Вблизи абсолютного нуля [Борис Иванович Смагин] (fb2) читать онлайн
[Настройки текста] [Cбросить фильтры]
[Оглавление]
Борис Смагин ВБЛИЗИ АБСОЛЮТНОГО НУЛЯ

Термометры и абсолютный нуль (Вступительная беседа)
 аждый вечер радио объявляет нам погоду, что ждет нас на следующий день. Холод, тепло, дожди, снег, вьюга. И какая будет температура.
Температура. Слово известно каждому: «Плюс двадцать», «минус десять», «тридцать градусов жары», «сорок градусов холода», «пятьдесят — ниже нуля». Так говорят о температуре.
Мы меряем температуру по Цельсию. Термометр так и называют термометром Цельсия. Когда пишут о температуре, ставят знак «С». Это означает: шкала Цельсия. Мы говорим: сегодня на улице девятнадцать градусов тепла. Что это значит? Девятнадцать градусов выше нуля по шкале Цельсия — так нужно ответить на этот вопрос. Или написать 19 °C.
Еще недавно висели в наших домах термометры Реомюра. И Реомюр и Цельсий за нуль взяли одну и ту же точку — таяние льда. Вода замерзает и тает при строго определенной температуре. Пока вся не замерзнет или не растает, температура не изменится. Ведь нелегко найти неизменную температуру. Обычно температура все время изменяется. Даже в теле человека она «гуляет» из стороны в сторону на десятые доли градуса.
А точка таяния льда — основная для термометров — незыблема.
Второй опорной точкой оба создателя шкалы термометров сделали кипение воды. Здесь тоже температура постоянна.
Пока вся вода не вскипит, температура не меняется. И вот тут-то пути создателей термометров разошлись. Точку кипения воды Цельсий обозначил как 100 градусов, а Реомюру больше по сердцу пришлось число 80. Значит, один градус шкалы Реомюра составляет 5/4 градуса шкалы Цельсия.
Есть еще одна, третья шкала температур. Ею пользуются в Англии и США. У одного из американских писателей есть небольшой рассказ про больного мальчика. Он знал, что температура у человека повышается при сильных заболеваниях до сорока с небольшим градусов.
И вдруг услышал слова отца, который измерял ему температуру. Мальчика охватил ужас — ведь температура оказалась около ста градусов. И он приготовился к неминуемой смерти от такого страшного жара.
аждый вечер радио объявляет нам погоду, что ждет нас на следующий день. Холод, тепло, дожди, снег, вьюга. И какая будет температура.
Температура. Слово известно каждому: «Плюс двадцать», «минус десять», «тридцать градусов жары», «сорок градусов холода», «пятьдесят — ниже нуля». Так говорят о температуре.
Мы меряем температуру по Цельсию. Термометр так и называют термометром Цельсия. Когда пишут о температуре, ставят знак «С». Это означает: шкала Цельсия. Мы говорим: сегодня на улице девятнадцать градусов тепла. Что это значит? Девятнадцать градусов выше нуля по шкале Цельсия — так нужно ответить на этот вопрос. Или написать 19 °C.
Еще недавно висели в наших домах термометры Реомюра. И Реомюр и Цельсий за нуль взяли одну и ту же точку — таяние льда. Вода замерзает и тает при строго определенной температуре. Пока вся не замерзнет или не растает, температура не изменится. Ведь нелегко найти неизменную температуру. Обычно температура все время изменяется. Даже в теле человека она «гуляет» из стороны в сторону на десятые доли градуса.
А точка таяния льда — основная для термометров — незыблема.
Второй опорной точкой оба создателя шкалы термометров сделали кипение воды. Здесь тоже температура постоянна.
Пока вся вода не вскипит, температура не меняется. И вот тут-то пути создателей термометров разошлись. Точку кипения воды Цельсий обозначил как 100 градусов, а Реомюру больше по сердцу пришлось число 80. Значит, один градус шкалы Реомюра составляет 5/4 градуса шкалы Цельсия.
Есть еще одна, третья шкала температур. Ею пользуются в Англии и США. У одного из американских писателей есть небольшой рассказ про больного мальчика. Он знал, что температура у человека повышается при сильных заболеваниях до сорока с небольшим градусов.
И вдруг услышал слова отца, который измерял ему температуру. Мальчика охватил ужас — ведь температура оказалась около ста градусов. И он приготовился к неминуемой смерти от такого страшного жара.

Между тем никакого жара и не было. Просто отец дал ему градусник с третьей шкалой — градусник Фаренгейта. Для этой шкалы девяносто шесть градусов — нормальная температура человека. Вы все, конечно, помните, как герои Джека Лондона великолепно себя чувствуют при холоде в шестьдесят и семьдесят градусов. Это опять-таки по Фаренгейту. А по Цельсию «ужасов» там нет. Обычные для Арктики морозы. Термометры бывают ртутные или спиртовые. Ртуть и спирт при нагревании расширяются, а при охлаждении сжимаются. Поэтому и перемещается столбик ртути или спирта вдоль шкалы термометра. На шкале, если мы делаем термометр сами, мы первым долгом отметим две основные точки. Опустим металлический шарик ртутного термометра в замерзшую воду и отметим нуль. Затем переведем его в воду кипящую. И появится вторая отметка — сто градусов. Значит, термометр будет со шкалой Цельсия. Расстояние между этими метками аккуратно разобьем на сто равных частей. И отложим их в обе стороны. И вверх от ста градусов и вниз от нуля. Вверх откладываем смело две тысячи, пять тысяч, десять тысяч градусов — пока шкалы хватит. А вот вниз от нуля так далеко путешествовать не придется. Там лежит таинственная температурная точка, носящая название — абсолютный нуль. Какие бы шкалы мы ни выдумывали, на сколько бы частей ни делили расстояния между основными точками температурной шкалы, ниже абсолютного нуля нам пойти не удастся. Эта температура предельная, практически недостижимая. Мы знаем в физике несколько таких величин. Скорость света, например, триста тысяч километров в секунду — большей не существует. И температур ниже, чем минус двести семьдесят три градуса по Цельсию, тоже не может быть. Это и есть абсолютный нуль —273 °C, точнее —273,16 °C. Нагревать тела можно сколько угодно. А вот охлаждать… Миллионы, десятки, сотни миллионов градусов выше нуля. И только двести семьдесят три — ниже! Заграждение, порог. За ним нет ничего. Зато при подходе к этому порогу происходят разные превращения веществ. И жидкости и газы замерзают, превращаются в тела твердые. И еще другие чудесные вещи происходят вблизи абсолютного нуля. Вот об этих чудесах, а также о том, как получают сверхнизкие температуры и для чего они нужны, мы и собираемся поговорить. Мы хотим совершить путешествие по шкале температур. Начать от самого обычного нуля Цельсия. А закончить путешествие где-то вблизи абсолютного нуля. У той самой температуры, куда уже добрались ученые. А отличается она от абсолютного нуля всего лишь на одну тысячную градуса. Таким образом, мы подойдем к абсолютному нулю вплотную, побываем в замке самой снежной из всех Снежных Королев!
Когда тепло, а когда холодно
Мир, окружающий нас, бесконечный и разнообразный. Чего только здесь нет: звезды, воздух, солнце, камни, вода, дома, машины, самолеты, всевозможные предметы нашего быта, одежды… Можно перечислять целыми часами, вспоминать тысячи названий. А вот физики разбили все, что нас окружает, на три категории: твердые тела, жидкости, газы. И все предметы разошлись, все оказались на своих местах. Правда, как мы сейчас увидим, тела часто перескакивают из одной такой категории в другую. И даже весьма успешно. Но это как раз связано с нашим путешествием по шкале температур. Чем отличаются эти три состояния веществ? Твердое тело сохраняет свой вид, свою форму. Куда бы мы ни перенесли кирпич, он кирпичом и останется. Разве только разбить его. Но и каждый осколок кирпича останется твердым телом. А вот жидкость займет любой сосуд. Форма ее будет в точности совпадать с формой этого пристанища. Если вылить ее, скажем, на пол, то жидкость растечется по полу, заползет в щели. И не соберешь ее. Что касается газов, то с ними дело обстоит еще хуже. Тут о форме уже говорить нельзя, жидкость легко перелить из одного сосуда в другой. Но объем свой жидкость сохраняет, что бы вы с ней ни делали. А вот газ мгновенно распространится в любом помещении. Твердые тела, жидкости и газы легко отличить друг от друга. Не спутаешь. Правда, есть вар, гудрон и еще кое-какие липучие, вязкие вещества, которые часто зовут переохлажденными жидкостями. Потому что, с одной стороны, они выглядят как твердые тела. А с другой стороны, понемногу растекаются, как очень густая жидкость. Но в большинстве случаев газ с жидкостью или твердым телом спутать трудно. Всегда ли газ остается газом, жидкость — жидкостью, а твердое тело — твердым телом? Оставили на ночь в блюдечке воду. А утром ее уже почти не осталось. Мы знаем, что вода не меняет своего объема. Куда же она делась? Испарилась, — отвечают вам. Еще быстрее исчезают духи из флакона, который мы забыли закрыть. Расходятся они по всей комнате, мы чувствуем их аромат: вместо жидкости появляется газ и смешивается с воздухом комнаты. И вода из блюдечка тоже начала новую жизнь. Теперь она уже не жидкость, а газ — водяной пар. Воду и духи мы видели. А газы обычно бесцветны. Разлетелись частички бывшей жидкости по комнате, превратились в невидимок. Хорошо, что некоторые невидимки пахнут. Так мы их и обнаружили. А водяные пары, пока их мало, никак о себе знать не дают. Часто из твердых тел получаются жидкости. По сути дела это чудесное превращение, а мы даже внимания не обращаем на подобные чудеса. Подумаешь, невидаль — снег растаял! А между тем произошло нечто необыкновенное. Вместо твердого снега или льда появилась жидкость — вода. Но никого это не удивляет. Мы просто привыкли к этому. А представьте себе, что подобные «переодевания» стали бы проделывать обычные предметы вашей комнаты — стол, стул, книги! Это было бы настоящим чудом. А тающий лед никого не удивляет! Зимой, наоборот, вода превращается в лед — твердое тело. Жидкости всегда испаряются, частички жидкости становятся невидимым газом. А могут ли они совершить обратный переход? Почему же нет! Утром на траве появляется роса, в воздухе туман — это водяной пар превращается в воду. То же самое происходит в бане. На стенах висят капельки воды. Откуда берется эта вода? Конечно, из воздуха. В банном воздухе много водяных паров. И они могут превращаться в воду — конденсироваться. Видите, сколько удивительных превращений все время происходит вокруг нас. Теперь нам надо остановиться и привести в порядок наши первые сведения о тепле и холоде. Ведь три, состояния вещества и переходы из одного состояния в другое тоже являются мерой тепла и холода. Твердое тело может стать жидкостью. Это называется плавлением. Жидкость превращается в твердое тело — затвердевает. Из жидкости появляется газ — жидкость испаряется. Или если все это происходит быстро и при определенной температуре, то говорят, что жидкость кипит. Обратное явление, когда из невидимого бесцветного газа появляются капельки жидкости, — конденсация. Почему же это происходит? Когда, например, вода остается водой, а когда становится льдом? На этот вопрос, без сомнения, ответит любой из наших читателей. Ниже нуля градусов вода твердая, между нулем и ста градусами Цельсия — жидкая. Сильней ее нагреют — нет ни льда, ни воды: сосуд наполняет бесцветный газ. Если мы понаблюдаем за другими веществами, то и там увидим то же самое. И сделаем вывод: для каждого вещества есть своя температура кипения и плавления. Правда, немного смешно говорить, скажем, о плавлении воздуха, который мы привыкли видеть газообразным, или о кипении железа. Но это происходит лишь потому, что мы живем при определенных температурах. И, конечно, привыкли видеть вещества, какими они при этих температурах выглядят. Но ведь в мире не везде так. Звездные температуры порой достигают миллионов градусов, в межпланетном пространстве свирепствует космический холод — двести с лишним градусов ниже нуля. Так что условия там будут разные. И вещества будут вести себя совсем по-разному. При температурах космических большинство газов станет твердыми телами. Что касается звезд, то там ни одно вещество не удержится в твердом состоянии. И железо станет газом, и самый крепкий камень, и алмаз, и сталь. Даже и не газом, а еще одним, четвертым состоянием вещества — плазмой. Но об этом мы поговорим несколько позже. Нас с вами интересует не космическая жара, а космический холод. Температуры космического пространства недалеки уже от абсолютного нуля, который мы собираемся обследовать. Только пространство это пустое — там почти нет вещества. А мы хотим узнать, как поведут себя в столь необычных условиях самые обычные, известные всем вещества. Но прежде чем познакомиться поближе с чудесами сверххолода, прежде чем на страницах книги приступить к охлаждению веществ, нам придется пристально посмотреть на них, выяснить, как они устроены, из чего состоят. Лишь когда мы это все узнаем, нам станет ясно, как подобраться как можно ближе к абсолютному нулю. В свое время науке понадобилось для этого много десятков лет. Некоторые загадки абсолютного нуля и сверхнизких температур не решены и до сих пор. Итак, несколько слов о строении вещества.О часах, винтиках и пружинках
Наверное, почти все когда-нибудь пытались починить или хотя бы разобрать часы. Сколько там различных винтиков, шестеренок, пружинок! Тьма-тьмущая! Разберешь часы — и вот на столе множество разных мелких частей. И собрать их воедино не так-то легко. У неопытного человека может получиться даже так: часы собраны, как будто идут. А на столе осталось несколько винтиков. Лишние они, что ли? — недоумеваете вы. Но вскоре часы остановятся, и вы поймете, что каждый винтик в часах на своем месте. Все части разные, каждая делает свое дело, каждая необходима. А вот если так же, «до винтика», разобрать какое-нибудь вещество, то окажется, что все эти «винтики» совершенно одинаковы. Только их очень много. Взяли мы как будто самую малость — крупинку. А частичек, из которых она состоит, набралось на удивление много. И все они для данного вещества одинаковы. Называются эти частички молекулами. Именно поведение молекул и диктует веществу, в каком состоянии оно должно находиться — быть ему газом, жидкостью или твердым телом. Но мы ведь говорили, что это зависит от температуры тела? Конечно. Только сейчас надо внести маленькую поправку — температура тела связана только с поведением его молекул тем, как они двигаются. Весь наш мир, все, что мы видим, чувствуем, состоит из различных молекул. И камень, и вода, и стены дома, и сахар, и воздух, и далекие звезды, и мельчайшие вирусы, и сами мы — все это скопище неисчислимого множества молекул. Без любой, самой завалящей пружинки часы правильно ходить не будут. А вещество, если даже потерять миллион молекул, все равно останется таким же. Молекулу глазом не увидишь, в руку не возьмешь, на язык не положишь. И расположены они в телах на изрядных расстояниях друг от друга. Вот, например, карандаш. На вид он твердый, гладкий, как будто никаких отверстий там нет. Но он состоит из множества молекул. И между ними — пустое пространство. В любом теле гораздо больше пустоты, чем молекул. Почему же мы эту пустоту не замечаем? Да потому, что и молекулы, и расстояния между ними настолько малы, что для нас все это сливается в единое целое. Так ведь и Луна издали кажется плоским блином с нарисованными на нем темными и светлыми пятнами. А между тем это круглая планета, где есть горы, впадины, холмы… И мы, разглядывая карандаш, не видим в нем ни молекул, ни пустых мест. У молекул есть свои законы — законы, по которым живут эти мельчайшие частички. Первый закон: молекулы находятся в беспрерывном движении. Остановиться молекула не может. Даже самый шаловливый мальчик, самый непоседливый все-таки лежит спокойно, когда спит. Молекулы же не спят и не отдыхают. Они вечно двигаются. Второй закон мира молекул еще интересней: они притягиваются друг к другу, а когда подойдут очень близко — отталкиваются. Поэтому и получается, что молекулы стремятся к другим молекулам, а подлетев, тотчас же разлетаются в разные стороны. Третий закон: молекулы данного тела одинаковы. Одинаковы все их свойства. И получается, что, собравшись вместе, молекулы соли образуют соленую соль, сахара — сладкий сахар, железа — твердое железо. Карик и Валя из известной детской повести совершили увлекательное путешествие. Они превратились в крошечных карликов и наблюдали за жизнью насекомых и растений вблизи. Они боялись муравьев, мух, стрекоз, так как сами были размерами гораздо меньше этих насекомых. Зато сколько интересного и необычайного открылось им, сколько чудес они увидели своими глазами! Но если бы Карик и Валя уменьшились до размеров молекул, то чудесного в их путешествии было бы гораздо больше. Ведь в том, что они видели в растительном и животном мире, ничего неожиданного нет. Стрекоза остается стрекозой, хоть и становится страшной для человека размером с муравья. И цветок тоже остается цветком, хотя путешествовать по нему приходится несколько часов. Но любое знакомое нам тело: кирпич, кусок железа, рубаха, вода — все, что мы видим вокруг себя, молниеносно преобразится, станет таинственным и непонятным, как только мы сможем наблюдать за поведением молекул. Многие фантасты любят посылать своих героев в далекие миры, заполненные дикими существами, странными растениями. А зачем ездить так далеко? Путешествие внутрь любого из привычных нам веществ не менее захватывающее. А то, что мы там увидим, не сравнится ни с какими фантастическими мирами. Молекулы, конечно, одни и те же. Но почему же тогда так различны лед и жидкая вода, составленные из тех же самых молекул? Может быть, молекулы ведут себя там по-разному? Или находятся в различных условиях? Путешествие внутрь веществ могло бы нам помочь объяснить это. Мы бы воочию убедились в том, как в разных телах расположены молекулы. Но, не имея пока возможности предпринять такое путешествие, хотя бы поговорим о том, что там происходит. Молекулы в веществе, обладающем тремя состояниями, одни и те же. Разница в том, как они двигаются. Именно из-за этого тела становятся твердыми, жидкими и газообразными. В твердых телах молекулы степенно путешествуют в разные стороны около одной точки. Далеко не уходят. В науке такие движения называются колебаниями. Твердое тело сохраняет свою форму. Ведь все молекулы в общем-то находятся на своих местах. А те небольшие движения, которые они совершают, мы и не замечаем. Даже Карик и Валя, ставшие такими маленькими, их бы тоже не заметили. Но вот перед нами жидкость. Ее можно легко переливать из одного сосуда в другой. Из миски в стакан, из стакана в кружку. И так далее. Как же поживают молекулы в жидкости? Довольно свободно. Внутри жидкости они путешествуют, как хотят. Но как только какая-нибудь свободолюбивая молекула подскочит к поверхности жидкости, захочет вырваться оттуда, так сразу же беглянку вернут на место. Молекулы, которые находятся около поверхности, вцепятся в нее мертвой хваткой. Ведь молекулы притягиваются друг к другу. И когда все молекулы потянут одну внутрь жидкости, с такими силами ей уже не справиться. Попытка к бегству сразу же ликвидируется. Вот молекулам газа жить гораздо легче. Их уже ничто не удерживает вместе. Куда бы мы ни выпустили газ, он мгновенно займет весь объем сосуда — все равно банка это, цистерна или комната. Можно сказать так: молекулы твердого тела привязаны к своим местам, жидкого — полусвободны. А молекулы газа свободны полностью. Но почему это происходит? Почему бы молекулам твердого тела не разбежаться, а молекулам газа не собраться вместе? Все дело в температуре. Мы ведь выяснили, что именно с температурой связан переход тела из одного состояния в другое. Из твердого в жидкое, из газа в жидкость. Остается одно — как-то совместить температуру и движение молекул. С одной стороны, состояние вещества зависит от его температуры. С другой — каждому такому состоянию соответствует своя особенная «жизнь» молекул. Существует и четвертое состояние вещества. Та самая плазма, о которой мы с вами уже говорили. Если газ нагревать дальше, то может случиться, что молекулы его, ударяясь друг о друга, сами начнут рассыпаться на составные части. Все равно что винтики разобранных часов разбить на маленькие кусочки. Когда все молекулы газа развалятся на части, газ превратится в плазму. В плазме можно найти самые разнообразные частицы: свободные электроны, положительные ионы, получившиеся из обыкновенных молекул, после того как те потеряли часть электронов. Немало в плазме и обычных электронейтральных молекул. Солнце — это громадное сборище плазмы, причем раскаленной. И звезды плазма. Самая обычная молния, которую каждый из вас много раз видел, северные сияния, электрическая дуга — тоже плазма. Но плазмой мы заниматься не будем, а посмотрим на поведение молекул в привычных для нас всех трех состояниях вещества — твердом, жидком и газообразном.Что такое температура
В учебниках на сей счет существует два ответа. Температура — мера нагретости тела, утверждают одни учебники. Температура — мера тепловой энергии молекул, добавляют другие. Действительно, температура показывает, как нагрето тело. Говорим же мы — на улице двадцать градусов. А что это значит, знает каждый. Температура воздуха, степень его нагретости и есть эти самые 20 градусов. И когда на пляжном щите написано «температура воды 23 °C», то все понимают, что вода нагрета до двадцати трех градусов и купаться хорошо. Даже, пожалуй, слишком теплая вода. С другой стороны, мы упомянули о тепловой энергии. Это тоже правильно. Чем температура тела выше, тем оно теплее, горячее, тем больше в нем тепловой энергии. Ее мы и называем теплом. Чтобы тело нагреть, надо ему откуда-то подать эту тепловую энергию. Чиркнули мы спичкой, зажгли газ. И на плиту поставили чайник. Газ горит, выделяется тепловая энергия, чайник нагревается, передает энергию воде. Потом закипит вода. Вот куда пошла энергия сожженного в горелке газа. Счетчик нам эту энергию подсчитывает в точности. Тепловая энергия тела, разумеется, сейчас же передается его частичкам — молекулам. Если тело твердое, то молекулы, получив причитающуюся им порцию энергии, начинают колебаться быстрее. И колеблются тем чаще, чем больше энергии поступает в их распоряжение. Если измерять температуру, то она все время будет увеличиваться. А потом застопорится, застынет на месте. Это сигнал — тело начало плавиться. И тепло теперь идет не на то, чтобы увеличивать температуру. Надо сорвать молекулы с насиженных мест, оторвать их друг от друга, увеличить внутреннюю энергию. Вот куда расходуется тепловая энергия. Изобретателям термометров это обстоятельство на руку. Пока все тело не расплавится или, наоборот, пока вся жидкость не застынет — температура его не изменится. Значит, можно использовать его для так называемой опорной — основной точки шкалы термометра. Мы ведь как раз это и делали, когда опускали ртутный шарик в замерзающую воду. Но вот все молекулы бывшего твердого тела сорвались со своих мест и путешествуют как хотят. Превращение совершилось. Перед нами жидкость. А мы продолжаем поставлять тепловую энергию. Теперь уже нагревается жидкость. Ни одна кроха тепла не пропадет, сразу же жидкость отзовется повышением температуры. Дойдет дело до точки кипения. И снова остановка — пока не выкипит вся жидкость, температура стоит на месте как вкопанная. Ни шагу дальше. Что касается газа, то его можно нагревать сколько угодно. Правда, там тоже появится нечто новое. Но это при очень больших температурах. Тут уж и от молекул «щепки полетят». Так получается новое, четвертое состояние вещества — плазма. Но вернемся к веществам обычным. Что мы с ними делали? Нагревали, повышали температуру. И увидели, что это тотчас же отражалось на поведении молекул. Остается добавить, что наиболее прыткие молекулы жидкости, у которых самая большая скорость, покидают поверхность жидкости задолго до кипения. Это и есть испарение. Мы уже говорили об этом. И вспомнили, что в бане на стенах появляются капельки воды. Там происходит конденсация. Часть водяных паров становится снова жидкостью. От чего зависит состояние тела? От температуры! С чем связана температура? С движением молекул. Чем температура больше, тем с большей скоростью они двигаются. Выходит, температура — мера движения молекул, мера их скорости. Строго говоря, температура определяет кинетическую энергию движения молекул. Кинетическая — как раз и означает энергию движения. На первый взгляд нагретое тело ведет себя спокойно. Какое уж там движение? Кинетической энергией обладает, например, падающая с плотины электростанции вода, летящий камень, движущийся поезд. Попробуйте их остановить! А тут энергия и… покой! Дело в том, что энергию движущихся тел мы, так сказать, видим своими глазами. А энергия движения молекул — скрытая, невидимая, внутренняя. Лежит, например, на земле камень. Лежит спокойно, тихо, никого не трогает. Но внутри его скрыто во много раз больше энергии, чем в другом, который с грохотом и пылью летит вдоль горного склона. И именно температура показывает, сколько тепловой энергии скрыто в данном теле. Больше ее стало или меньше. Тепловая энергия может легко переходить от одного тела к другому. При этом, конечно, тела обмениваются теплом, а не «горячими» молекулами. Тело горячее постепенно остывает, а холодное — нагревается. Только вот что интересно. Тепло переходит только от горячего тела к холодному. А наоборот — в обратном направлении — идти не хочет. Так ведет себя река, в которой вода течет лишь в одном направлении — по течению, туда, где уровень реки ниже. Когда-то давно люди думали, что переносит тепло особое вещество — теплород. И очень удивлялись, что этот теплород такой разборчивый. Никак нельзя отнять его от холодного тела и передать горячему. А теперь мы знаем, в чем дело. Никакого теплорода нет и в помине. Просто молекулы одного тела двигаются быстрее, чем другого. Если эти тела положить один возле другого, то молекулы горячего тела будут подталкивать молекулы тела холодного. Сами они при этом замедлятся. Так продолжается до тех пор, пока скорости обоих тел примерно не сравняются. И тепловая энергия распределится между всеми молекулами. Это общее свойство тепловой энергии. Сама собой она переходит только от тел более нагретых к телам менее нагретым. Вот мы с вами и выяснили, что же такое температура. Она, оказывается, показывает, сколько в теле тепловой энергии, как двигаются его молекулы. И чтобы понизить температуру, чтобы приблизиться к абсолютному нулю, надо эту энергию по возможности отнять у тела. Тогда оно начнет охлаждаться. Сейчас мы займемся этой операцией. Получить небольшой холод сравнительно нетрудно. Вот пойти дальше, приблизиться к самому абсолютному нулю — задача потяжелее. Но мы справимся и с ней. Мы — на бумаге. А ученые давно уже достигли самых низких температур. Правда, сразу же возникает недоуменный вопрос. Мы все время говорим, что тепловая энергия переходит только к холодным телам. Горячие лишь остывают. Да и то не сами по себе, а если их поместить рядом с телами похолодней. Выходит, чтобы охлаждать тела, мы всегда должны заранее иметь что-то вроде холодильника? Это все правильно, тепловая энергия сама по себе, самопроизвольно переходит лишь к телам менее нагретым, перемещается только в одном направлении. А вот специальными способами можно заставить ее путешествовать и в обратном направлении. Можно отнимать тепло и у холодных тел. Но для этого надо тратить энергию. Вот, например, стоит у нас дома холодильник. Он все время включен в электрическую сеть. Электричество работает в холодильнике. И в нем холодно. А попробуй-ка выключи его. Через несколько часов там будет тепло, как в комнате. Создать низкие температуры трудно, но возможно. Удержать их нелегко. Ведь кругом находятся теплые, горячие тела. Они рады передать кому-нибудь часть своей энергии. Приходится тщательно оберегать холод. Если заглянуть внутрь стенок холодильника, можно увидеть там много слоев теплоизоляции. А все для того, чтобы не допустить в холодильник тепла из комнаты, чтобы молекулы воздуха не смогли передать молекулам холодильника часть своей энергии. Горячие тела тоже очень трудно сохранять горячими. Даже если убрать воздух, и то тела остывают. Вы ведь знаете, что тепло от далекого Солнца идет к нам за миллионы километров пустого безвоздушного пространства. Тепло от печки передается молекулами воздуха. Воздух около печки прогревается, расширяется, уходит вверх. Его место занимает другая порция. И так идет перемешивание, пока все тепло печки не разойдется равномерно по всей комнате. Молекулы сильно нагретых тел отдают тепло в виде излучения. У них слишком много энергии. Температура велика, двигаются молекулы очень быстро. И отдают лишнюю энергию порциями излучения. Если поднести ладонь к сильно нагретому телу, то от него так и пышет жаром. Это летят невидимые тепловые лучи. Летят они и от звезд, и от нашего Солнца, летят за многие миллионы километров через межпланетное безвоздушное пространство. Именно таким способом Солнце «отапливает» нашу-Землю. Вся Вселенная заполнена этими «путешествующими» тепловыми лучами. Сейчас их научились находить, ловить даже, когда их совсем мало. Есть приборы, которые могут обнаружить даже спичку, зажженную на Луне. Но тела, нагретые не сильно, почти не излучают. Поэтому защитой низких температур служит вакуум — пространство, лишенное воздуха.Хлопотливая «жизнь» молекул газа
Про абсолютный нуль ученые узнали, когда стали изучать поведение газов. С другой стороны, газы, так сказать, объект всей техники сверхнизких температур. И все время, пока мы будем заниматься сверххолодом, нам придется общаться с газами. Правда, многие из них быстро меняют свой облик, становятся жидкостями. И наше продвижение к абсолютному нулю мы и будем отмечать тем, что газов останется все меньше и меньше. Вот, например, воздух. В нем есть углекислый газ, азот, кислород, пять инертных газов. Но стоит его охладить — и углекислый газ выпал твердым осадком. Потом ушел кислород, за ним азот, другие газы. Только морозоустойчивый гелий — один из инертных газов воздуха — держится до последнего. Лишь в самых близких покоях Владыки Сверххолода сдался и он. Ни одного газа в мире больше нет! Ледяное безмолвие! Давайте познакомимся с газами поближе. Пока что пусть они живут в наших обычных земных условиях. И ведут себя, как полагается газам, совсем не подозревая, какая участь им в дальнейшем уготована. У молекул есть свой свод законов. Мы с ним ознакомились. Но когда они составляют газ, появляются новые законы, действующие лишь для газа. Поскольку нас интересуют газы и мы собираемся с ними долго общаться, выясним, какие это законы. Это тем более интересно, что с помощью одного из них мы в точности определим значение абсолютного нуля — таинственное, на первый взгляд, ничего не выражающее число «минус двести семьдесят три». Молекулы газа свободны, как ветер. Это мы уже знаем. Их ничто не удерживает вместе. Они мчатся с громадными скоростями, сталкиваясь друг с другом, натыкаясь на стенки сосуда, в котором находится газ. Если сосуд раскрыть, то газ мгновенно покинет его, молекулы разлетятся во все стороны, осваивая новое помещение. Газ состоит из молекул. И хотя каждая молекула живет своей собственной отдельной жизнью, хотя все они «думают», что никакого отношения друг к другу не имеют, это неверно. Свойства газа как раз и зависят от того, как ведут себя все его молекулы, вместе взятые. Если у нас в руках твердое тело, то мы сначала смотрим, какое оно на вид, интересуемся формой тела. Затем судим о его весе — тяжелое оно или легкое. И, конечно, говорим о температуре. Затем можно определить твердость тела — упругое оно или нет, как проводит тепло и многое другое. Что касается газа, то говорят только о трех его характеристиках. Во-первых, у газа имеется определенная температура. Это мера тепловой энергии газа, мера энергии движения его молекул. Не надо, конечно, думать, что все молекулы двигаются точно с одними и теми же скоростями. Нет, у одних молекул скорость поменьше. Другие — порезвее, быстрее двигаются. Температуру определяет средняя скорость. Допустим, измерили мы скорости всех молекул. А потом сложили эти части и разделили на число молекул. Это и будет средняя скорость. Кроме того, газ находится в каком-то сосуде, значит, обладает определенным объемом. И, наконец, третья величина. Молекулы газа бомбардируют стенки сосуда, во время своих полетов ударяются в стенки. Чем больше таких ударов, чем больше скорость молекул, тем труднее приходится стенкам. Газ сильнее давит на них. Все эти удары, вместе взятые, создают давление газа. Итак, температура газа, объем и давление. Вот величины, с которыми связана жизнь газа. Их называют параметрами. Только они не существуют каждая сама по себе. Возьмем, например, кусок мела. Он может быть большим и маленьким, теплым и холодным. Но объем куска мела никакого отношения не имеет к его температуре. Вообще говоря, при нагревании твердые тела расширяются, но очень немного. Зато в газах объем, давление и температура связаны между собой. Это легко установить. Подобные опыты ученые проделали давно. Еще в средние века, когда физика только становилась наукой, люди, которых интересовали загадки природы, собирались. вместе, рассказывали о своих наблюдениях, спорили, объясняя то или иное интересное явление. Так рождалась наука — в беседах, спорах, так люди открывали законы природы, подтверждая их опытами, создавая первые формулы. В Англии в XVII веке образовался большой кружок таких исследователей. Сначала он носил название «Незримая коллегия», и ученые собирались почти подпольно. Они боялись, что королевские власти и вездесущая церковь сочтут их занятия греховными. Ученые недолго собирались втайне. Скоро английский король признал общество ученых, взял его под свое покровительство и повелел называть Лондонским королевским обществом. Так и теперь называется Английская академия наук, которая выросла из небольшого кружка ученых. Среди ученых, которые сразу же стали работать в этой академии, был и гениальный Исаак Ньютон, основавший современную физику, и Роберт Гук, который изучал упругость тел, колебания маятника, свойства звука. Было много других. В том числе очень богатый человек — Роберт Бойль. Роберт Бойль (1627–1691).
Роберт Бойль (1627–1691).
Роберта Бойля интересовало в науке лишь одно: он увлекался исследованием газов. Еще задолго до Бойля итальянские ученые выяснили много любопытного, узнали о некоторых свойствах газов. Торричелли доказал, что воздух давит на нас сверху с большой силой. Ученые уже знали, что воздух можно сжимать, что, нагреваясь, он расширяется. Но по-настоящему газами занялся Бойль. Он наблюдал много интересных явлений. Некоторые из них Бойль даже не старался объяснить. А это очень жалко. Например, в одном из своих опытов английский ученый по сути дела доказал, что воздух состоит из отдельных частичек — молекул. Но объяснили это лишь много лет спустя. Бойль проделал несколько опытов, благодаря которым остался навсегда в памяти потомков. Он открыл закон, носящий теперь имя закона Бойля — Мариотта. Бойль запаял небольшую изогнутую трубочку. В запаянном ее колене оказался воздух. Потом ученый стал поджимать этот воздух, добавляя в открытое колено ртуть. Воздух сжимался. И Бойль выяснил, что, чем меньший объем занимает попавший в ловушку воздух, тем большее количество ртути он уравновешивает. Ртуть давит на воздух. И воздух также давит на ртуть. Оба давления одинаковы, раз столбик ртути покоится на месте. Получается, что давление газа и его объем взаимосвязаны. Если не менять температуру, держать ее постоянной, то зависимость получается очень простая. Объем газа и его давление при постоянной температуре обратно пропорциональны друг другу. Так формулируется закон Бойля — Мариотта. Но при чем тут какой-то Мариотт? Ведь его сделал Бойль. Сделать-то он сделал, но окончательного конкретного вывода не дал. Он больше любил проводить интересные наблюдения, ставить диковинные опыты, а потом рассказывать о них на заседаниях Королевского общества. А создавать теории, делать выводы, предположения — скучно! В это же время появилась еще одна академия — французская. Одним из ее организаторов был замечательный ученый, исключительно пунктуальный и последовательный человек — Эрнст Мариотт. Бойль открыл свой закон в 1662 году. Доложил об опытах и забросил их. А Мариотт независимо от него пришел к тому же самому. Зато именно он дал новому закону четкую формулировку, которой мы пользуемся и сейчас. Произошло это в 1676 году. Но в то время наука развивалась не спеша. Сейчас мы считаем, что закон открыт одновременно и независимо друг от друга английским и французским учеными. Через сто лет после этих событий во Франции родился еще один ученый, который продолжил работы Бойля и Мариотта по изучению газов. Это был Жозеф Гей-Люссак. Именно ему мы обязаны рождением замечательного закона, с помощью которого сейчас без малейшего усилия докажем, что существует таинственная температура — абсолютный нуль. Гей-Люссак также изучил поведение газов при нагревании. Для этого он создал специальную установку. Она очень напоминала аппаратуру Бойля. И вообще надо сказать, что английский физик был прекрасным экспериментатором, великолепно умел проводить различные опыты. (Эксперимент — это и есть опыт. Экспериментатор — ученый, работающий практически. Есть ведь еще и теоретики. На их письменных столах не видно ничего, кроме бумаги и ручки. Однако они умеют так глубоко заглянуть в глубь вещества, что открывают в нем многие неожиданные свойства, объясняют сложнейшие результаты, полученные экспериментаторами. А такие замечательные ученые и теоретики, как Ньютон, Ломоносов, Галилей, были и экспериментаторами.) Но вернемся к экспериментам Гей-Люссака. Мы уже знаем, что он заинтересовался, как ведут себя газы при нагревании. Сначала Гей-Люссак, нагревая газ, давал ему возможность расширяться. Для опыта брал ту же порцию воздуха, которой пользовался Бойль. Помните трубку и пленника — воздух в запаянном ее колене? Воздух подогревается, и капелька ртути, которая закрывает ему путь к свободе, постепенно поднимается. Объем воздуха явно растет. В другом опыте Гей-Люссак решил оставить постоянный объем. Подогревая воздух, он все время добавлял ртуть во второе колено трубочки. Тогда объем воздуха действительно не менялся. Зато повышалось давление. Ведь теперь упругий воздух выдерживает давление все большего и большего количества ртути. Возрастает и давление газа. Ртуть стоит на месте. Значит, давление с той и другой стороны на нее одинаково. Гей-Люссак произвел подсчеты. И получилось, что и объем и давление газа при нагревании увеличиваются приблизительно на одну и ту же величину. Каждый лишний градус температуры изменяет объем или давление на 1/273 часть того, что было у газа при нуле. Увеличивают температуру, увеличивается давление. Уменьшают — давление уменьшается. Так Гей-Люссак подтвердил закон, открытый за несколько лет до этого французским ученым Шарлем. Но вот объемные соотношения он открыл сам. И доказал, что эти законы относятся ко всем газам без исключения. Водород, азот, кислород, смесь газов, называемая воздухом, — все равно. Нагрели на один градус — получайте 1/273 объема или давления! После того как Гей-Люссак численно сформулировал свой закон, настала очередь абсолютного нуля. Вы уже, конечно, заметили появление этого таинственного числа 273. Если газ охлаждать, то с каждым градусом давление его уменьшится на 1/273 часть. Оно будет все меньше и меньше, пока… Но по порядку!
На «сцене» появляется абсолютный нуль
Рассмотрим внимательно, как изменяется давление газа. На каждый градус понижения температуры приходится 1/273 часть давления. На десять градусов мороза отодвинулись мы от нуля Цельсия — на 10/273 упало давление. Ну что ж, пойдем дальше. На бумаге ведь понижать температуру легко. При — 200 °C от первоначального давления останется только 73/273. Это совсем немного. А что будет при температуре минус 273 °C? Арифметика показывает — давление обратится в нуль. Давление газа полностью пропадет. Но что это означает? Давление газа — удары его молекул о стенки сосуда. Выходит, при абсолютном нуле температуры молекулы должны замереть на месте. Покоящаяся молекула? Этого не может быть! Движение — неотъемлемое свойство молекул, свойство материи. Не могут молекулы остановиться. Выходит, невозможно достичь и такой температуры? Да, именно так! Минус 273 градуса Цельсия или, точнее, минус 273,16 — предел понижения температур, абсолютный нуль. Более низких температур просто не существует. Вот и добрались мы до абсолютного нуля. Эту величину ученые получили не сразу. Не сразу вслед за открытием газовых законов взялись они за арифметические подсчеты, которые мы сделали с такой легкостью. Интереснее другое. Задолго до работ французского ученого Михайло Васильевич Ломоносов утверждал, что температурная шкала должна быть ограничена снизу, что понижать температуру безгранично нельзя. Утверждал он это, исходя из того, что существуют молекулы, что они движутся и иными быть не могут. Ломоносов, по сути дела, предсказал появление большой области физики — кинетической теории материи. У него не было опытных данных — многие эксперименты появились сто лет спустя. Но гениальный ученый смотрел вперед, далеко обгоняя свое время. Ведь в конце концов действительно дело не в арифметике. Раз скорость движения молекул падает при охлаждении — должен быть предел, так как остановиться, замереть молекулы не могут. Кажется, простой вывод. Как будто все ясно и так. А между тем надо было быть гениальным Ломоносовым, чтобы утверждать это в конце XVIII века, когда наука только еще становилась на ноги, когда мрак средневековья сменился узенькой полоской неяркого света. И главное — то, что Ломоносов дал представление об абсолютном нуле не из арифметических подсчетов, а используя глубокие представления о строении мира. Гений выше других на много голов и видит он далеко вперед! Однако предвидения Ломоносова стали законами физики лишь сто лет спустя. Сразу же после Гей-Люссака за газы взялся английский ученый Уильям Томсон. Он, можно сказать, окончательно разделался с абсолютным нулем. Томсон известен больше под другой фамилией, так как за научные заслуги ему был пожалован титул лорда Кельвина. Английский ученый, в частности, предложил новую шкалу для измерения температур. Она так и называется теперь: абсолютная шкала температур, или шкала Кельвина. Обозначаются градусы Кельвина буквой «К». Например, 20° К — двадцать градусов по шкале Кельвина. Удобна эта шкала, между прочим, тем, что у нее нет отрицательных и положительных температур. Все температуры — положительные, так как отсчитываются они от абсолютного нуля. Абсолютный нуль — нуль термометра Кельвина. Что касается значения одного градуса шкалы Кельвина, то оно совпадает с привычной нам шкалой Цельсия. Там тоже две опорные точки: замерзание воды и кипение ее. Расстояние между ними Кельвин разбил на 100 частей. И отложил 273 такие части вниз от бывшего нуля Цельсия — точки замерзания воды. Тут он и поставил значок «0». Конечно, сделал он это мысленно, на бумаге. В действительности в стране сверххолода обычным термометром ничего не сделаешь. И ртуть и спирт замерзнут. Измерение сверхнизких температур — дело очень хитрое и тонкое. Сейчас во всех странах мира принята система единиц«СИ». Тут и знакомый нам метр, и секунды, и ампер, и ом. А вот температуру эта стройная система единиц разрешает измерять в двух шкалах. Шкала Кельвина основная. Но можно пользоваться и термометром Цельсия. Ведь разница между ними лишь в расположении нуля. От температуры Кельвина, от температуры абсолютной легко перейти к привычной нам шкале Цельсия, и наоборот. Вот, например, водород превращается в жидкость и кипит при — 252 °C. Сколько это будет по Кельвину? — 252 + 273 = 21° К. Можно произвести и обратный подсчет. 21° К = 21 — 273 = — 252 °C. Абсолютная шкала температур очень удобна. Но применяется она в основном, когда дело имеют с очень низкими температурами. А в наших обычных земных условиях немного смешно говорить, скажем, что температура 293 градуса. А на самом деле это наши 20 градусов Цельсия! Не так уж и жарко! Зато там, где пока что оперируют большими минусовыми температурами, конечно, удобнее вести более простой счет. Но дело не только в этой простоте. Существуют серьезные научные основания, для того чтобы считать шкалу Кельвина самой удобной и самой строгой с точки зрения науки. Так и будем знать. Вот теперь мы познакомились с абсолютным нулем. И можно начать главное, для чего мы и затеяли этот разговор. Можно начать путешествие к абсолютному нулю. Но наше путешествие будет необычным. Мы не просто собираемся познакомиться с чудесами сверххолода, побывать где-то рядом с абсолютным нулем. Нет, мы хотим еще научиться понижать температуру. Правда, организовать получение сверххолода «на дому» вряд ли удастся. Но как интересно узнать о работе фабрик жидкого воздуха, холодильных машин, необычных установок, с помощью которых можно совсем близко приблизиться к абсолютному нулю. Значит, решено. Едем вниз по шкале температур от нуля Цельсия к нулю абсолютному. На нашем пути будут остановки. Мы посмотрим, как работают всевозможные холодильные машины. Как различные вещества преобразуются в холоде. А потом снова вниз по шкале, к абсолютному нулю! Но сначала еще немного физики.Как отнять тепло у тела
Знаете ли вы, что такое работа? Странный вопрос, не правда ли? На первый взгляд с такими вопросами можно обращаться только к лодырям или тунеядцам, наставляя их на путь истинный. Любой человек с детских лет знает, что такое труд и работа. И это понятие «работа», в общем, совпадает с тем, что под «работой» понимают в физике. Работу совершает каждый из нас. Разница одна. Для обыденной жизни одна работа будет полезной, а другая нет. Для физики же и танцы, и физическая зарядка, и ходьба — все это работа. Только надо добавить, что и человек, и животное, и любое физическое тело, совершая работу, или тратит часть своей энергии, или все время получает эту энергию откуда-то со стороны. Чтобы камень полетел, надо его кинуть или поднять повыше, а потом опустить. Чтобы забить молотком гвоздь, надо сильно ударить его. Если приходится много работать, человеку необходимо хорошо поесть. На голодный желудок работать трудно. Человек питается, продукты питания превращаются в питательные вещества, увеличивают его внутреннюю энергию. А машины? Паровоз жжет уголь, автомобиль — бензин, электромоторы расходуют электричество, которое поставляет им электрическая сеть. Значит, всякое тело, работая, тратит часть своей энергии. Расходует то, что получает со стороны, или… В самом деле, а что будет, если энергии извне не поступит? Тело или не сможет совершить работу, или должно будет расходовать свою собственную внутреннюю энергию. А при этом тело должно остывать. Ведь именно внутренняя энергия связана с температурой тела. Это мы с вами уже знаем. Значит, чтобы понизить температуру тела, надо заставить его поработать. И, конечно, постараться сделать так, чтобы не помешал приток тепла со стороны. Ведь если оставить охлажденное тело в покое, к нему со всех сторон понесется тепло. Мы уже знаем об этом основном свойстве тепловой энергии — не оставлять никого в беде, согревать все кругом! Иногда кажется, что не всякое тело можно заставить работать. Что, например, сделаешь с тем самым лежачим камнем. Под него, как говорится, и вода не течет. А между тем работа кипит в этом тихом, безмятежно расположившемся камне. Молекулы двигаются, внутренняя энергия есть, и притом немалая. Как же до нее добраться? Для твердых тел это нелегко сделать. А вот жидкости и особенно газы гораздо покладистее. Газы, например, особенно охотно отдают энергию. Этим и пользуются ученые и инженеры-конструкторы различных холодильных установок. Вся техника сверххолода основана на охлаждении газов. У них, оказывается, нетрудно забрать тепло, отнять энергию, иногда даже большими порциями. Самое интересное, что газы в стране холода фигурируют как два лица. Во-первых, сверххолод получают, пользуясь различными свойствами газов, а во-вторых, используют его в технике чаще всего для сжижения газов. Ведь вблизи абсолютного нуля не остается «в живых» ни одного газа. Они превращаются в жидкости, даже в твердые тела… Газ может совершать два вида работ. Внешнюю, когда видно, что он, собственно, делает: скажем, двигает поршень, вращает турбину. И внутреннюю — когда только по тому, что падает температура газа, мы догадываемся о происходящем. Мы уже знаем твердо — чтобы понизить температуру газа, надо заставить его совершить работу! Внешнюю, чтобы он «работал» на наших глазах. Или внутреннюю, когда на вид газ бездействует. Но в том и другом случае температура газа понизится. А это нам и нужно! Теперь посмотрим, что надо сделать, чтобы быстро и как следует охладить жидкость. Хотя мы обязались говорить только о газах, вопрос этот не постороннего происхождения. Он имеет самое прямое отношение к путешествию в сверххолод. Ученые, которые изучают остатки далекого прошлого, называются археологами. Древние города, поселки, постройки, даже костры, вокруг которых сидели когда-то наши предки, и те интересны археологам. Роются они в земле, вытаскивают оттуда черепки, осколки, остатки оружия, всевозможную утварь и так далее. В числе всяческой посуды им иногда попадаются кувшины из очень пористого материала. Стоит такой кувшин весь в поту, как будто ему жарко. А может быть, ему и в самом деле жарко? Зато вода в таком кувшине всегда будет прохладной. Кувшин не случайно изготовляли из очень пористой глины. Древние народы были не менее сообразительны, чем мы. Раскопки происходили в жарких странах. Там очень важно, чтобы вода, налитая в кувшин, не нагревалась. Кому интересно пить теплую воду! Для этой цели и делали пористые кувшины. Вода постепенно испаряется через поры. Покидают жидкость самые активные молекулы, самые быстрые. Жидкость, естественно, остывает. Испарение — один из самых верных способов остудить жидкость. Каждый знает, что на горячий чай надо подуть, тогда он быстро остынет.
Так что, как видите, древние народы все это прекрасно учли, хотя и не знали физики. Вода в таких пористых кувшинах может стоять долго. И все время она будет прохладной, приятной на вкус. Летом любой из нас с удовольствием поливает себя холодной водой. Хорошо, прохладно! Что происходит? Вода испаряется, понижается температура тела. Ведь для испарения воды нужно тепло, вода забирает его и от нашего тела. Поэтому мы и ощущаем прохладу. Когда жидкость испаряется, ее внутренняя энергия тоже уменьшается. Ведь молекулы отрываются от жидкости. Для этого нужна работа. И теряет жидкость на эту работу часть своих запасов энергии. С холодильником теперь знакомы все. Работает там электрический ток, а «подсобным рабочим» является особая жидкость — фреон, циркулирующая по трубкам. Она замечательна тем, что очень легко и охотно испаряется, охлаждая все вокруг. Собственно говоря, фреон совершает внутри холодильника круговое путешествие, испытывая в каждом круге по два превращения. Сначала он существует в виде газа. Газ с помощью компрессора сжимают, и он превращается в жидкость. Жидкий фреон перегоняют в металлическую трубочку. Давление воздуха там маленькое. А температура кипения жидкости очень сильно зависит от давления воздуха. Чем оно меньше, тем легче молекулам покидать жидкость. Вот почему попавший в такие условия фреон начинает лихорадочно кипеть — испаряться. Температура сразу падает до минус 32 градусов. Испарившиеся молекулы фреона стремительно поднимаются вверх. Но тут же их вольной жизни приходит конец. Газ снова попадает в компрессор и опять становится жидкостью, чтобы повторить все тот же охладительный цикл много раз. Так электрический ток с помощью фреона совершает работу — беспрерывно охлаждает внутренность холодильного шкафа. Не будет тока — остановится компрессор, прекратятся круговые превращения фреона — холодильник станет неудобным шкафом для посуды. Температура минус 32 градуса, конечно, получается там, где испаряется фреон. Ближе к стенкам и двери она намного выше, ведь там теплее, в квартирном холодильнике — от минус 2 до плюс 6 градусов. Поэтому разные продукты кладут в различные места холодильника. Одним нужно место похолоднее, а другим — не очень холодное. В самый холод попадает мороженое. И оно получается твердое как камень.
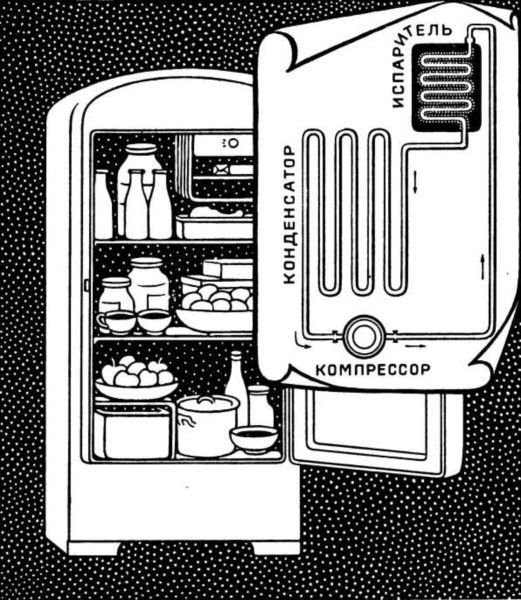
Холодильники промышленные, которые работают на больших мясокомбинатах, устроены примерно так же. Значит, жидкость, испаряясь, совершает внутреннюю работу. Поэтому она и остывает. А когда испарение идет сквозь пористый кувшин, то работа получается еще большей. Поэтому охлаждается вода в этом случае очень сильно. На этом мы простимся с жидкостями. Теперь уже наш путь в страну сверххолода будет связан только с газами.
Это пар или газ?
Жидкость испаряется. При любой температуре самые быстрые частички — молекулы — помаленьку покидают ее. Появляется пар. Из газообразного состояния вещество переходит в жидкое, и наоборот. Часто испаряется не вся жидкость целиком. В какое-то время процесс останавливается. Почему? Образуется насыщенный пар, говорят ученые. Ведь одновременно с испарением, когда молекулы жидкости покидают ее, чтобы начать вольную жизнь, другие молекулы конденсируются, попадают из газа в жидкость. Сначала молекул «свободолюбивых», конечно, больше. А потом их число может сравняться. Вот и получится насыщенный пар. Если температуру не изменять, то он таким и останется. Вот, скажем, в той же комнате распространился водяной пар. Заполнил комнату, стал насыщенным. Что это значит? А вот что. Одни молекулы испаряются, а другие, наоборот, попадают в жидкость. Если пар насыщенный, то в среднем тех и других столько же. Значит, число испарившихся молекул, тех, что ведут свободную жизнь в комнате, витают в воздухе, в каждом кубическом сантиметре теперь в среднем такое же. Вот если мы нагреем комнату, дело тотчас же изменится. Жидкость начнет испаряться сильнее. И пара в воздухе станет больше. Хватит воды в комнате — останется пар насыщенным. Только жидкости, то есть воды, станет меньше. Охладим воздух, температура в комнате упадет — часть пара превратится в жидкость, снова станет водой. Ну, а если вся жидкость обернется паром, то перед нами будет самый настоящий газ. В свое время ученые много спорили о том, что же такое пар — газ это или нет. Про воду все понимали, потому что, как говорится, секрет был известен. Каждый ведь видел, как вода обращается в лед или кипит, как лед тает. А вот газы воздуха никто еще тогда жидкими не видел. С водой все получилось гладко. Надо было изменить температуру, чтобы вода преобразовалась в лед или пар. Потом ученые сумели сконденсировать пар давлением. Увеличили давление — и заблестели капли воды там, где за минуту до этого и проживал бесцветный пар. А вот водород, кислород, азот никакими способами не удавалось обратить в жидкость. Может быть, этого нельзя сделать вообще? Многие так и думали. Великий английский физик Майкл Фарадей первый высказал мысль, что пары и газы — одно и то же. Он взял известный уже тогда тяжелый отравляющий газ хлор. Сначала Фарадей подверг газ большому давлению. Не помогло. Газ оставался газом. Тогда ученый одновременно стал замораживать сосуд, где все это происходило. И вот под напором высокого давления и низкой температуры хлор сдался. Так впервые ученые познакомились с жидкостью, которая при нормальных условиях не могла бы существовать. Появился жидкий хлор, и наконец-то стало ясно, что пары и газы — два названия одного и того же состояния вещества. Так и газ хлор можно было бы теперь назвать паром жидкого хлора. За хлором в ход пошли и другие вещества. Ученые начали по очереди сжимать все газы. Один за другим сдавались они, пока не осталось шесть самых упорных: водород, кислород, азот, болотный газ — метан, окись азота и окись углерода — угарный газ. Их сильно охлаждали, сжимали. Ничего не помогало. Может быть, эти газы вообще нельзя получить в жидком виде? Много споров возникло и по этому поводу. Решил проблему великий русский химик Дмитрий Иванович Менделеев. Для каждого вещества, заявил он, существует своя собственная критическая температура. Называется она так потому, что при температуре высшей никакими способами, никаким давлением жидкость из газа не получить. Опыты подтвердили это предположение Менделеева. Почему он так рассуждал, в чем тут дело? Можно сказать, что «каждый газ живет по-своему». Молекулы различных газов различны. И при одной и той же температуре у одного газа молекулы движутся быстрее, у другого — медленнее. И если эти скорости велики, как газ ни сжимай, все равно не заставишь молекулы присоединиться друг к другу, стать жидкостью.Облака в чистом небе
Сегодня с утра была прекрасная погода. А днем стали появляться облака. Одно за другим, где-то высоко в небе скапливались они, чтобы затем покрыть все небо густым слоем. К вечеру начался дождь. Почему образуются облака? Это явление интересовало еще ученых Древней Греции и Древнего Египта. Они научились хорошо разбираться в различных явлениях природы, даже предсказывать их. Но вот на вопрос, почему так происходит, ответить не могли. Только сейчас, когда науке известно, как ведут себя газы, ученые разобрались в процессе образования облаков. Основой этого процесса служат испарение и конденсация воды. Это понятно, так как облака состоят из капелек воды. Как эта вода попала туда, вверх, в верхние слои воздуха? Конечно, вместе с воздухом. В воздухе всегда имеется вода. С поверхности всех водоемов, все равно Тихий океан это или блюдечко, стоящее в вашей комнате, вода испаряется. Так появляются водяные пары. Это и есть водяной газ. Утром в летнее время на траве выступают блестящие капли. Вода-роса. Откуда? Из воздуха. Днем жарко, много воды испаряется. Ночью температура падает. Начинается конденсация водяного пара — на крышах, на траве, на деревьях появляются капли росы, капли сконденсировавшейся жидкости.
Но при образовании облаков происходят явления похитрее. И самое интересное, что именно эти явления приведут нас в страну сверххолода, страну бывших газов, ставших жидкостями. Тепловая энергия переходит от одного тела к другому. Мы знаем, что происходит это всегда и всюду. Очень трудно удержать тепло или, наоборот, не допустить приток тепла к какому-нибудь телу. Но представьте себе, что мы этого добились. Создали такой сосуд, который не обменивается тепловой энергией с окружающим миром. В сосуде находится газ. А наш сосуд обладает одной любопытной особенностью. Он как гармошка может сжиматься или расширяться. По нашему желанию. Вот мы и выскажем желание — пусть сосуд расширится. Газ должен занять новый, большой объем. Для этого его молекулам придется преодолеть силы притяжения со стороны других молекул. Раз объем газа станет большим, значит, молекулы должны быть на больших расстояниях друг от друга. Иными словами, газу надо совершить работу. Работа газа при этом будет невидимая, внутренняя, так как она направлена против внутренних сил — сил притяжения молекул. Для работы газу нужна энергия. Откуда ее взять? Никакого притока тепла со стороны не может быть. Значит, единственная возможность для газа — покопаться в собственных кладовых, отдать какую-то часть энергии из своих запасов. Эти запасы и есть внутренняя энергия газа. Естественно, что она должна уменьшиться. А газ, расширяясь таким образом, охладится. Процессы, которые происходят без обмена тепла с другими телами, физики называют адиабатными. Газ в нашем примере расширился именно адиабатно. Газы — плохие проводники тепла. И если какие-то изменения в газе происходят быстро, то приближенно можно считать и этот процесс адиабатным. Вот теперь можно вернуться к облакам. От земли поднимается большая масса воздуха. В этом воздухе имеются водяные пары. Поднимаясь вверх, воздух расширяется, так как над землей давление атмосферы меньше. А еще Бойль и Мариотт показали, что в этом случае газ должен расшириться. Расширение происходит быстро. Значит, можно сказать, что процесс приблизительно адиабатный. И температура газа падает. А раз упала температура, часть водяного пара перейдет в жидкое состояние. Ненасыщенный пар станет насыщенным. Вот и появились маленькие капельки воды, которые потом в конце концов сливаются в большое облако. Так охлаждается газ при адиабатном расширении. Мы убедимся дальше, насколько важен этот процесс. С адиабатным сжатием мы все хорошо знакомы. Не верите? Сейчас я это докажу. Каждый из вас, разумеется, играет в футбол и волейбол. Так ведь? Даже странно задавать подобные вопросы. И мячи не раз надували. Вспомните, что происходит, если проделать это достаточно быстро. Нагревается камера, не так ли? Вот он — адиабатный процесс. Ртом мы забираем порцию воздуха и загоняем ее внутрь мяча. При этом газ сжимается, молекулы сближаются. Их внутренняя энергия увеличивается. А поскольку все происходит быстро, воздух не успевает поделиться теплом с окружающим пространством и нагревается. Правда, в действительности полностью процессы адиабатными не бывают. Все-таки любая изоляция пропускает тепло. Как бы газ быстро ни нагревался, он кое-что из своего тепла успеет уделить или, наоборот, воспринять от окружающих тел. Итак, мы узнали, что, когда газ расширяется адиабатно, он охлаждается. Иногда даже очень сильно. Но все-таки этого охлаждения для очень низких температур не хватит. Тогда ученые нашли еще одну возможность охладить газ. Гораздо сильнее, чем при обычном адиабатном расширении. Натолкнули их на этот эффект все те же пористые материалы.
Опять двое ученых
В 1852 году два английских ученых — Джеймс Джоуль и Уильям Томсон — изучали поведение различных газов. Газы были очень популярны в лабораториях того времени. Пожалуй, как сейчас атомы. Но надо сказать, что вся атомная физика и теория строения вещества родились лишь после того, как ученые самым тщательным образом исследовали всевозможные явления, происходящие в газах. Это неудивительно. Ведь молекулам газа «дышится» свободнее, чем в жидкостях и твердых телах. Поэтому изучать жизнь молекул удобнее всего именно в газах. Но ученые еще не заглядывали так далеко в глубь вещества. Их интересовали газы как таковые. В числе других опытов, которые проделывали Джоуль и Томсон (тот самый, что позже стал Кельвином), был, на первый взгляд, странный эксперимент. Ученые перегоняли газы через пористую перегородку. Вернее, сначала они представляли газам возможность самим совершать это путешествие. А потом подгоняли их с помощью сильного давления. Ученые заметили, что с газами при этом происходят весьма существенные изменения. Чаще всего они охлаждаются. А некоторые нагреваются. Причем это зависит не только от вида газа, но и от его первоначальной температуры. Английские ученые весьма основательно исследовали это явление. И называется оно с тех пор в их честь эффектом Джоуля — Томсона. Разумеется, за него разом ухватились конструкторы различных холодильных аппаратов. В технике этот процесс именуется дросселированием. Слово «дроссель» означает регулятор. Дросселями регулируют потоки жидкости, давление в жидкостях. Течет, скажем, по трубе вода. А в середине трубы — заслонка. Она задерживает течение, пускает то больше воды, то меньше. Это и есть дроссель. Сначала ученые для охлаждения действительно просто перегоняли газы через пористую перегородку. Вроде того самого кувшина, о котором мы говорили, когда знакомились с археологами. Вообще говоря, эта перегородка удерживает газы. Но в ней есть поры. И через поры газ может понемногу просачиваться.
Сейчас используют специальные устройства — вентили. Это узкая щель, которую можно увеличивать или уменьшать. Газ сначала сильно сжимают, а потом пускают через вентиль. Он проскакивает вентиль и расширяется. Тут-то и происходит охлаждение. И опять-таки понятно почему. Обмена тепловой энергией с внешним миром нет. Происходит адиабатный процесс. Внутренняя работа, которую газ совершает здесь, гораздо больше, чем при обычном адиабатном расширении. Очень сильно падает давление газа. Газ расширяется резко. Его молекулы удаляются друг от друга на большие расстояния. Кроме того, часть внутренней энергии газа расходуется, чтобы пробраться через щель. И в результате температура падает. Чтобы дросселирование проходило хорошо, нужно одно условие. Чем ниже первоначальная температура газа, тем сильнее он охлаждается, а иногда, как вы знаете, это необходимо, чтобы он вообще начал охлаждаться. Для резкого охлаждения надо добиваться большой разности давлений. Скажем, газ продувают под давлением, в сто раз большим, чем давление газа на другой стороне вентиля. Вот тогда и температура понизится заметно. Дросселирование как будто совсем незнакомое явление. Но и с ним опять-таки каждый не раз встречался. Правда, небольшой это эффект, но все-таки заметить его можно. Если дунуть на руку через сильно сжатые губы, то рука почувствует холодок. Во-первых, это произойдет из-за того, что руку будет охлаждать сильная струя воздуха. А во-вторых, появится и дросселирование, так как воздух мы пропускаем через вентиль — наши сжатые губы. Давление воздуха во рту гораздо больше комнатного. Не зря же мы так сильно дуем. Если вдуматься, то нет ничего удивительного, что, проходя перегородку, газ охлаждается. Вспомните, сколько потов сойдет, пока проберешься сквозь густой кустарник. А, думаете, молекулам газа легче?
«Честный» труд газа
Дросселирование, адиабатный процесс — что-то вроде обходных путей. Мы старались заставить газ совершать внутреннюю работу, отнимали у него тепло необычным образом. Это все очень интересно. Однако способ дросселирования не такой уж удобный, как кажется. Повышать давление газа надо? Надо. А для этого приходится сооружать специальные громоздкие насосы — компрессоры. Потом, не все газы такие покладистые. Еще Джоуль и Томсон отметили, что они весьма капризны. Одному достаточно комнатной температуры, и можно посылать его к дросселю для охлаждения. А другой требует, чтобы его сначала сильно охладили. В противном случае, пройдя дроссель, капризуля-газ даже нагреется, сумеет забрать тепло со стороны. А почему бы не подействовать попросту? Дадим газу честно поработать. Пусть себе потрудится «в поте лица своего»! Скажем, пусть он двигает поршень. Самый обыкновенный поршень, какие встречаются во всех двигателях. И в автомобиле, и в мотоцикле, и во всех старых самолетах. Что там происходит? Взрывается смесь бензина с воздухом. Газ расширяется и резко двигает поршень в цилиндре. А там уже стоит передача, и каждый толчок газа передается колесам. Неплохо бы такую же работу предложить газу для охлаждения. Пусть поработает. Но здесь надо обязательно как-то изолировать газ, чтобы он не получил помощи извне. Пусть и внешняя работа происходит только за счет внутренней энергии газа. Короче говоря, опять надо постараться, чтобы процесс был адиабатным. Так и появились специальные установки для внешней работы газа. Конечно, в этом случае поработает газ на копейку. Но это проделывается лишь для того, чтобы понизить его температуру, охладить посильнее. В технике охлаждения, а называется она криогенной, у подобных поршней есть свое имя — детандеры. Общий вид их примерно одинаков. Во всяком случае, всегда можно догадаться, для чего такое устройство служит. Имеется цилиндр, а внутри его поршень. Поршень может перемещаться. Но не свободно. Его придерживают. Иногда таким тормозом служит вода. Это — гидравлический тормоз. Чтобы столкнуть поршень, газу надо преодолеть сопротивление воды, сдвинуть ее с места. «Это можно сделать — только соверши работу, охладись» — так говорит газу вода. Пожалуй, чаще встречаются тормоза электромагнитные. Противодействует работе газа обычный маленький электромагнит. А дальше все происходит так же, как и с тормозом гидравлическим. Газу ведь все равно, что там мешает работать, почему поршень сопротивляется его усилиям. Дело газа — давить на дно поршня, двигать его и… охлаждаться. Некоторые, конечно, удивятся. Зачем придерживать поршень? Пустить его свободно. Но ведь наша задача — заставить газ работать посильнее, чтобы он тратил побольше энергии. Поэтому мы и создаем всяческие неприятности, «ставим палки в колеса». В детандерах лучше, удобнее охлаждать газы. Правда, здесь приходится совершать лишнюю работу — «снабжать» энергией тормоз поршня. Но эта работа окупается хорошим охлаждением. Кроме того, у детандеров есть еще одно важное преимущество перед дроссельными установками. Не надо газ ни сильно охлаждать предварительно, ни загонять в мощные компрессоры для сжатия. А детандерам нужно лишь некоторое предварительное охлаждение. Немного увеличить давление газа тоже неплохо. Но это уже дело нехитрое. В технике существует много разных видов детандеров. Их описания занимают толстые книги. Но вот один из них нам особенно важен. Потому что сделал его впервые замечательный советский ученый академик Петр Леонидович Капица. И называется этот детандер турбодетандером. С Петром Леонидовичем Капицей мы познакомимся, когда посетим институт, который он организовал, институт, где академик Капица — бессменный директор.
Это основной мировой научный центр по сверххолоду — Институт физических проблем. Там работают экспериментаторы, замечательные отважные исследователи «странного мира» сверхнизких температур. И теоретики, объясняющие чудеса этого странного мира. Инженеры института создают прекрасные установки, с помощью которых можно получать сверхнизкие температуры. Именно здесь П. Л. Капица создал первый турбодетандер. Это устройство отличается от всех прочих детандеров одним — вместо поршня стоит там маленькая турбинка. Удобно ли это? Да, конечно! Турбинка занимает меньше места, установка компактнее. Кажется, выгода невелика. Что же, в лабораториях жилищный кризис, что ли? Но когда речь идет о температурах, уже совсем близких к абсолютному нулю, чем меньше установка, тем лучше. Ее легче изолировать от окружающего тепла. С турбинами удобнее работать, так считают ученые. Обычные детандеры гораздо капризнее. Наконец, у турбин больше коэффициент полезного действия. Они экономичнее и выгоднее. Петр Леонидович Капица высказал еще одну очень интересную мысль. Он сказал, что турбодетандеры надо в первую очередь использовать для сжижения воздуха. И вот почему. Воздух — газ. Но в холодильных машинах он попадает в особые условия. И в этих условиях воздух больше напоминает не газ, а… воду. Он ближе к воде по своим свойствам. Поэтому резонно использовать водяные турбины, строить детандеры вроде обычных турбин наших гидроэлектростанций, которые вырабатывают электрический ток. Работает турбодетандер примерно так. Сначала газ попадает на лопатки турбинного колеса, вращает колесо, отдает часть своей энергии, охлаждается. Но на этом путь очередной порции газа не кончается. Ее ждут специальные каналы. Газ врывается в каналы и расширяется там. Ему предоставлена такая возможность. Расширение адиабатное, газ, естественно, охлаждается еще сильнее. И окончательно обессилев, стекает каплями жидкости. Конечно, вы понимаете, что в холодильных установках встречаются и дроссели, и детандеры, и турбодетандеры. У всякого есть свои преимущества и недостатки. Часто даже в одной и той же машине дружно работают детандер и дроссельная установка. Они весьма мирно уживаются, даже помогают друг другу. Самые распространенные холодильные машины поставляют жидкий воздух. Потом уже из него готовят отдельно кислород, азот и другие «жидкости». Правда, странно называть жидкостью вещества, которые мы привыкли «видеть» газами. Но мы сейчас уже на подступах к абсолютному нулю. Поэтому надо привыкать к новому миру. Минус сто девяносто один градус по Цельсию — 82 градуса Кельвина. Вот где мы сейчас находимся. Это температура жидкого воздуха. Первая машина жидкого воздуха появилась около семидесяти лет назад. Сделал ее немецкий ученый Карл Линде.
Воздух капает из крана
1891 год. В стране сверххолода большой праздник. Из крана небольшой установки, носящей имя конструктора инженера Линде, падают первые капли новой жидкости— капли жидкого воздуха. Немецкий инженер в первой машине жидкого воздуха воспользовался эффектом Джоуля — Томсона. Кажется, что проще всего было создать детандер, где газ совершает внешнюю работу. Ведь двигатели внутреннего сгорания тогда уже работали вовсю. Но детандер появился позже. Мы помним недостатки дросселирования. Надо сильно сжимать газ и хорошо охлаждать предварительно. Иначе ничего не выйдет. Поэтому никто не удивится, если мы скажем, что самой важной частью машины Линде был теплообменник. Линде заставил воздух проходить по установке несколько раз. Каждый раз порция газа становилась все холоднее и холоднее и охлаждала следующую. Так машина готовила воздух для ответственного шага. В дроссель подходил воздух, вполне подготовленный к дальнейшему. Еще одна ступень, еще раз понизилась температура. И вот победа. Первые капли первого жидкого воздуха. Теплообменники до сих пор — самая хитрая часть конструкции любой холодильной машины. Машин множество. Конструкторы смело мешают детандеры и дроссели, заставляют газ путешествовать но замысловатым путям. Но неизменно стоит на этом пути теплообменник. Итак, в руках ученых появилась новая сверххолодная жидкость — воздух. Обычный газообразный воздух каждому знаком с первой минуты рождения. Правда, мы как будто не замечаем его. Просто привыкли. А вот воздух жидкий — новое незнакомое для нас вещество. Поэтому давайте познакомимся поближе с ним и его привычками. Вот он, там, в глубине этого блестящего сосуда. Сосуд Дьюара или, попросту, дьюар. Джеймс Дьюар — английский ученый. Он когда-то первым получил жидкий водород. Но об этом давно забыли. И так же забыто было бы имя Дьюара, если бы не изобрел он помещение — ловушку для жидких газов. Там два цилиндрических сосуда. Один вставлен в другой. А между ними безвоздушное пространство — вакуум. Или специальные прокладки, через которые не сможет пробраться тепло. Дьюар блестит, потому что его наружная стенка посеребренная. Помните, мы говорили, что один из способов передачи тепла — лучеиспускание. Так, например, Солнце издалека обогревает Землю. Блестящая поверхность дьюара хорошо отражает попавшие на нее световые и тепловые лучи. Поэтому дьюар не будет нагреваться снаружи. Дьюар находится в открытом ящике, заполненном ватой и сухим льдом. Это еще одна теплоизоляция, еще один слой отделяет жидкий воздух от теплой комнаты. Окружен дьюар сухим льдом с температурой —78°. Все-таки не +20°! Это уже лучше. Из дьюара вьется легкий дымок. Никакой крышки у сосуда нет. Она не нужна и даже опасна. Испаряющийся воздух может сорвать любую крышку. В виде жидкости много места он не занимает. А станет газом — потребует «жилплощади». И может наделать бед. Помните, что случилось с мистером Бэйли из романа А. Беляева «Продавец воздуха»? Он проглотил несколько бисеринок твердого воздуха. И гнусного негодяя немедленно раздуло так, что он лопнул с треском. Воздух снова стал газом, и — исчез мистер Бэйли! Поэтому сосуды для хранения жидких газов и их перевозки делают обязательно такими, чтобы газ мог при случае спокойно испаряться, покидая свое хранилище. Но больших потерь при этом не происходит. Итак, мы заглянули внутрь сосуда, в котором дымит жидкий воздух. Минус 190 градусов! Даже с лишком. Внушительная температура! Испытываешь желание сунуть в жидкий воздух палец. Но этого делать не следует. Вот плеснуть на руку его можно. Чуть обожжет руку — и нет жидкого воздуха. Весь испарился. Только легкий пар поднялся. Можно вылить немного жидкого воздуха, скажем, на блюдце. Он быстро-быстро испаряется. Ртуть жидкая. Это знают все — если разобьешь термометр, потом долго приходится собирать быструю, юркую жидкость. Но стоит только опустить ртуть в жидкий воздух, как она моментально замерзает.
Обычно на популярных лекциях из ртути изготовляют молоточек, и лектор торжественно забивает им гвоздь. Но вот в жидкий воздух попала резинка. Самая обыкновенная резинка, которую мы называем ластиком. И погиб ластик. Резина, побывав в жидком воздухе, перестает быть эластичной, она крошится, ломается. Особые структурные связи между молекулами нарушились, пропали. Резина перестала быть резиной. И при нормальной температуре осталась такой же хрупкой, ломкой. Даже самая крепкая сталь, встретившись с жидким воздухом, становится такой же хрупкой, как графит наших карандашей. Одним словом, с материалом творятся истинные чудеса. Жидкий воздух добывают сейчас в больших количествах в основном для того, чтобы разделить газы воздуха, чтобы получить отдельно кислород и азот. С первого взгляда это кажется очень странным. Посудите сами: чтобы разделить два основных газа, смесь которых и называется воздухом, их сначала надо сложным образом охладить, чтобы сделались они жидкими, отделить один от другого, а потом уже использовать, чаще всего снова в виде газа. Но, оказывается, разделять газы дешевле именно таким, на первый взгляд достаточно сложным, способом.
Кислород — газ жизни
Кислород — газ жизни, газ живой природы. Это знают все. Любой лектор, рассказывая о жизни на других планетах, начинает с кислорода. Действительно, без кислорода человек существовать не может. Альпинисты, уходя в горы, берут с собой кислородные аппараты. Кислородом дышит летчик в высотном полете. Больные используют кислородные подушки. После операций сердца больных держат но нескольку дней в особых кислородных палатках. Правда, если употреблять очень много кислорода, то может наступить и опьянение. Помните, как в романе Жюля Верна «Вокруг Луны» веселились опьяневшие Николь Барбикен и Ардан. Они забыли закрыть кран кислородного аппарата. И стали очень веселыми, пели, кричали, шумели. Однако кислород нужен не только живым существам. Без кислорода в технике сейчас буквально и шагу ступить нельзя. Прежде всего кислород очень нужен в металлургии. Металлургия занимается выплавкой металлов. Черная металлургия интересуется чугуном и сталью. Это и есть «черные» металлы. Получают чугун в доменных печах. Закладывают туда железную руду, поджигают топливо. От тепла руда плавится, и появляется чугун. Его разливают в специальные отливки. Так получаются различные чугунные изделия. Зачем здесь нужен кислород? А вот зачем. Чтобы топливо лучше, полнее сгорало, в него вдувают струю кислорода. Это очень хорошо действует. Для плавки в этом случае требуется меньше топлива, значит, и чугун обходится дешевле. Из чугуна в мартеновских печах добывают сталь. Там тоже вовсю используют кислород. Кислород добавляют в воздух, который идет к топливу. Жидкий металл также продувают чистым кислородом. Значит, топлива опять тратится меньше. И выходит, это выгодно. Сейчас сталь получают новым, конверторным способом. Конвертор напоминает большую грушу. В нее заливают жидкий чугун. Потом сверху, через горловину, вдувают кислород. Так из чугуна образуется сталь. Конверторный способ очень удобный. Сталь получается дешевле, заводы будут дешевыми. Да и строить их, оказывается, можно быстрее, чем обычные. Кислородной струей можно резать стальные слитки и очищать их поверхность. Если сталь сильно нагреть, а потом пустить струю кислорода, то знаете что получится? Кислород, как ножом, разрежет прочный металл. Примеси с поверхности слитков кислород тоже снимает. Они просто сгорают в струе кислорода. Этот процесс называется огневой чисткой. А вот кислород в цветной металлургии. Цветные металлы — цинк, медь, никель, свинец — выплавляют с помощью кислорода. И чистят кислородной струей. Конечно, кислород используют и в химии. Прежде всего на заводах искусственных удобрений. С помощью кислорода сейчас обрабатывают топливо. Давно известно, что гораздо лучше топить газом: он хорошо сгорает, всяких отбросов после газа нет. И дыма почти нет. В общем, удобно. Ученые нашли способ, как уголь или торф переделывать в горючий газ. Образуется он в газогенераторах. Сначала туда загружают твердое топливо, а потом вдувают кислород и водяной пар. Происходят различные химические реакции, и образуется горючий газ. Можно использовать его и для других целей. Например, изготовлять аммиак. Подземные залежи угля тоже можно газифицировать. И тоже с помощью вездесущего кислорода. Поистине он — газ жизни!Как разлучить неразлучных?
«Близок локоть, да не укусишь», — говорит старая пословица. Пословица вещая и мудрая. Вот, например, кислород. Казалось бы, чего проще — достать этот газ. Одна пятая часть воздуха, 18/9 частей воды. Кругом кислород. Но из воды взять его не просто. Надо сооружать электролизные ванны, разбивать молекулы воды электрическим током. А из воздуха? Как разделить газы воздуха, отделить их один от другого? Ответить на этот вопрос несложно. Сначала сделаем из воздуха жидкость. А потом пусть один газ испаряется, уходит, а другой — конденсируется. За этими двумя физическими явлениями и скрывается сложный технологический процесс — разделение газов — ректификация. Собственно говоря, ректификацией называется происходящее много раз испарение жидкости и ее конденсация. Испарение и конденсация — процессы взаимообратные. Переходит вещество в газообразное состояние — испаряется. Собираются капли жидкости из бывшего газа — конденсация. Когда жидкость испаряется, она охлаждается. Помните пористые кувшины, фреон — основу работы наших домашних холодильников? При конденсации это тепло возвращается жидкости. Таков великий закон природы — закон сохранения энергии. Тепловая энергия, как и всякая другая, не может возникнуть ниоткуда и не может пропасть. Она переходит от одного тела к другому или становится энергией другого вида. На тепловых электростанциях превращается в электрическую, в автомобиле — в механическую. Жидкий воздух содержит в основном два сконденсировавшихся газа — азот и кислород. Давайте пока что говорить только о них. Ведь остальных газов в воздухе около процента. И мы ими пренебрежем на некоторое время. Воздух становится жидким при —191,8 °C. А по другим данным его температура кипения даже —193,7 °C. Выходит, воздух сжижается не сразу. Почему это так? А потому, что газы воздуха кипят при разных температурах. Азот при —195,8 °C. Кислород сжижается гораздо раньше. Ему хватает —183 °C. Как раз поэтому и можно отделять сжиженные газы один от другого. Если бы они кипели при одинаковых температурах, дело обстояло бы гораздо хуже. Представьте себе такую операцию. Получили мы в холодильной машине жидкий воздух. И в эту холодную жидкость направили струю газообразного кислорода. Что произойдет в этом случае? Температура кипения кислорода гораздо выше, чем у жидкого воздуха. Значит, кислород немедленно сконденсируется. И сразу же на сцене появится тепловая энергия. Ее называют скрытой теплотой конденсации. Эта энергия скрыта в веществе. Только в момент конденсации, когда газ охлаждается, скрытое тепло становится явным. Куда денется эта энергия? Ее воспримет жидкость — жидкий воздух. У азота температура кипения ниже, чем у кислорода. Значит, часть азота вскипит и превратится в газ. Вместо газа кислорода появится газ азот. Зато в жидкости будет больше кислорода, чем вначале.
Понимаете теперь, в чем дело? Таким способом мы можем постепенно разделять газы. Вначале в жидком воздухе — на четыре части азота приходится одна часть кислорода. Так же, как и в природном воздухе, из которого мы получали жидкий. После каждой такой операции, после того как кислород газообразный посетит жидкость, в ней будет накапливаться жидкий кислород. А азота там станет все меньше и меньше. Вот и основа ректификации. Это в самом деле испарение и конденсация. Только испаряется одно вещество — азот, а конденсируется другое — кислород.
Фабрика кислорода
Завод, с которым мы хотим познакомиться, — кислородный. На нем получают жидкий кислород. Одним производствам нужен кислород в виде жидкости, других интересует газ. Но из жидкости газ получить уже легко. Она ведь быстро испаряется. На кислородных заводах ректификация идет в длинных колоннах, которые так и называются ректификационными. Внутри колонн — тарелки! Они и в самом деле напоминают обычную столовую посуду. В каждой из них — воздух, смесь жидкого кислорода и азота. Жидкость стекает из одной тарелкив другую, стекает сверху вниз. Навстречу поднимается струя газа. Там тоже смесь кислорода и азота. В верхней тарелке — обычный жидкий воздух, полученный тут же, в холодильной машине. А снизу идет не менее обычный воздух — газообразный. На каждой тарелке происходит своя доля конденсации и испарения. Конденсируется кислород, испаряется азот. После посещения тарелки жидкость обогащается кислородом. С другой стороны, поднимающийся вверх газ захватывает с собой все больше и больше азота. В результате всех этих операций газы разделяются. Из крана в нижней части колонны вытекает почти чистый кислород, а вверху специальные устройства отводят газообразный азот. Так расходятся пути газов в разделительных ректификационных колоннах. Большая кислородная установка — действительно целый завод! Прежде чем приступить к охлаждению воздуха, его надо очистить. Во-первых, там есть разные примеси — пыль, сажа, всяческие частички. Их не так уж мало — одна сотая грамма на каждый кубометр воздуха. Освободиться от этих примесей нетрудно. Для этого стоят фильтры. Скажем, пористые материалы. Воздух легко проходит через фильтр, а твердые частички застревают в нем. Во-вторых, в любом сухом воздухе есть немного водяных паров. Они вредны для холодильных установок. Вода будет вымерзать, забивать аппаратуру — в общем, мешать работе установки. Следовательно, прежде всего надо расправиться с ней, чтобы воздух, попадающий в установку, был абсолютно сухим. Воду вымораживают или поглощают специальными химическими веществами. Остается еще один враг, пожалуй более страшный, — углекислый газ. Замерзая, он сразу обращается в твердое вещество и может моментально забить все трубопроводы установки. Поэтому от углекислого газа освобождаются особенно тщательно. Его и вымораживают, и удаляют химически. Но вот воздух очищен. Можно производить с ним дальнейшие манипуляции. Прежде всего его сжимают. Для этого имеются мощные компрессоры. Это машины, напоминающие обычные насосы — те самые, с помощью которых накачивают автомобильные и велосипедные камеры. Только компрессор посильнее, а принцип работы один и тот же. При каждом рабочем ходе компрессор захватывает очередную порцию воздуха и вталкивает в сосуд. Чем больше воздуха он добавит туда, тем большим станет и давление. Зачем повышают давление, вы тоже, конечно, помните? Для дросселирования да и для хорошей работы детандера надо использовать газы повышенного давления. Причем при дросселировании чем больше это давление, тем лучше, тем сильнее будет охлаждение. Из компрессора сжатый воздух попадает прямо в холодильную машину. Мы знаем машину Линде, уже знакомились с ней. Посмотрим теперь на более современную установку, которую когда-то в лаборатории создал Петр Леонидович Капица. Ее холодильный цикл так и называется циклом Капицы. Охлаждение воздуха происходит сразу в двух частях установки. Тут есть и дроссель, есть и турбодетандер. Турбодетандер — небольшая турбина, которую должен вращать охлаждаемый газ. А дроссель — узкая щель. Газ под большим давлением прорывается сквозь эту щель, охлаждаясь на ходу. Многим кажется странным, зачем в одной установке иметь и детандер и дроссель. Оказалось, что получать жидкий газ в детандере не очень удобно. Там стоит поршень или турбина. Жидкость будет мешать им работать. Значит, охладить газ в детандере хорошо, а вот доводить до жидкого состояния лучше где-нибудь в другом месте. Другое дело — дроссельная установка. После дроссельного вентиля жидкий воздух никому уже не мешает. Итак, цикл Капицы. Воздух под небольшим давлением попадает в установку. Это тоже преимущество установки Капицы — не надо сильно повышать давление газа.
На пути воздуха из компрессора в холодильную установку стоит… холодильник! Да, да, именно холодильник. Как уже отмечалось, и при дросселировании и в детандере газ лучше отдает тепло, если он предварительно охлажден. Поэтому там стоят холодильные установки, в которых циркулирует жидкий аммиак — он сжижается при температуре минус 33,4 °C. Предварительно охлажденный воздух не сразу попадает в детандер или на дроссельную установку. На его пути стоит теплообменник. Здесь воздух охлаждается встречным потоком холодного воздуха, который появляется после турбодетандера. Охладили порцию воздуха. И тут ее разделяют на две части. Одна, основная, мчится к турбодетандеру. Другая — на дроссельную установку. По пути воздух проходит еще один теплообменник и охлаждается очень сильно. Теперь уже после дроссельного вентиля появляются капельки жидкости. В турбодетандере жидкость не образуется. Там только сильно охлаждают воздух, чтобы затем пустить его в оба теплообменника. И он делает свое дело. Дальше жидкий воздух начинает свое неторопливое путешествие по разделительным тарелкам. Одна тарелка за другой — так и спускается газ, пока не обернется голубоватым кислородом. А где его используют, вы уже знаете. Вот азот пока что для нас фигура темная. А между тем сосуды с жидким азотом можно встретить довольно часто.
Встреча в операционной
Температура минус 195,8 градуса. Жидкий азот. Кислород — газ жизни. Но и значение азота не меньшее. Без азота нет нищи растениям, нет жизни на Земле. Сельское хозяйство не может существовать без удобрений, без аммиака, основной частью которого является азот. Жидкий азот — постоянный гость и работник лабораторий и заводов. Инженеры и ученые пользуются им для охлаждения. Часто можно встретить большие сосуды, наполненные безопасной, слегка дымящейся жидкостью. Это азот. Холода от него вполне достаточно и обращаться с ним легко. Азот не взрывается, как кислород или тем более водород. Он почти не реагирует на различные окружающие его вещества. Химики говорят, что азот малоактивен, химически не ядовит. Это мы знаем сами — каждый день вполне безопасно для себя вдыхаем изрядные порции азота. Только на больших глубинах у пловцов может наступить азотное отравление. Но в обычных условиях этого никогда не произойдет. Азот поистине незаменим в некоторых лабораториях и на заводах. Сейчас очень много различных опытов приходится проделывать в вакууме. Так в науке называют пустоту. Откачали мощные насосы из какого-нибудь сосуда весь воздух — тогда оставшееся пустое пространство можно назвать вакуумом. Но все молекулы оттуда отсосать невозможно. Никакой насос с этим не справится. Хоть и немного их, но все же останется. Но о себе в этом случае молекулы почти не дают знать. Вакуум — пустота. Установки, с помощью которых получают такую пустоту, называются вакуумными. Сколько их на одних только ламповых заводах! Ведь из электрической лампочки сначала откачивают воздух, а потом наполняют каким-нибудь спокойным, не склонным к реакциям газом, например криптоном или тем же азотом. Иногда лампочки оставляют пустыми. А сейчас в вакууме сваривают металлы, изготовляют полупроводники, наносят тончайшие слои разных материалов. Везде вакуум. И везде жидкий азот. Он выполняет здесь роль бдительного сторожа. Есть много веществ, пары которых «гуляют» по вакуумным установкам, и тогда нет глубокого вакуума. Вот для таких вредных «гуляк» и устраивают холодные ловушки с жидким азотом. Через изогнутую трубочку насос качает воздух. Пока вредные пары путешествуют вместе с воздухом. Но вот трубочку окунули в жидкий азот. Мертвой хваткой своих минус ста девяноста шести градусов вцепляется он в трубочку. И пары падают на лету, замерзают, легким инеем оседают на дне трубочки. А сейчас у нас будет еще одно очень интересное свидание с жидким азотом. Мы увидим жидкий азот в роли доктора. Он помогает людям, возвращает больных к жизни, как и полагается медику. Человек устроен очень сложно. Никакая самая хитрая машина не сравнится с человеческим организмом. Ясно, что и различных дефектов — болезней у человека тоже хватает. Все может заболеть — и руки, и ноги, и живот, и голова. В голове находится командный пункт мышления, действий и поступков — большие полушария головного мозга. Оттуда получают распоряжения наши руки, ноги, глаза, уши — весь сложный организм человека. А если на командном пункте что-нибудь испортится? Тогда и команды понесутся или не по адресу, или какие-нибудь несуразные. Начал, например, человек как-то странно ходить, передергиваться, руки у него дрожат. Что случилось? Дело тут не в руках или ногах, говорит врач. Надо обратиться по адресу — в мозг. Рука послушно выполняет команду своего начальника — мозга. По длинной цепочке нервов поступает эта команда. Начинают действовать мышцы, рука сгибается, вот заработали кисти рук, пальцы. Если они делают что-то не то, то и винить надо мозг. Не ту команду послал! У нервных больных часто дрожат руки. Это бывает и когда человек сильно устал. Но встречается тяжелая болезнь, ее называют болезнью Паркинсона: руки и ноги дрожат так сильно, что такие больные не могут работать, ходить, не в состоянии написать самые обычные буквы. Головным мозгом занимаются нейрохирурги. Хирург, как вы знаете, — врач, который лечит с помощью «ножа». Хирурги выполняют смелые операции, удаляют поврежденные или заболевшие органы, сшивают ткани. Работы у них много. Сколько любой из них сделал хотя бы операций аппендицита? Сотни, тысячи! А ведь каждому такому больному врач спас жизнь. Нейрохирургам особенно трудно. Их поле деятельности — человеческий мозг. Головной и спинной. Одно неосторожное движение ножа — и повреждены важнейшие центры дыхания, пищеварения, зрения. Оперировать трудно, опасно. Но нейрохирурги смело занимаются своим нелегким делом. Возвращают больным зрение, слух, память, способность двигаться. Люди, годами прикованные к постели, становятся на ноги. Слепые прозревают. Много чудес на счету у этих замечательных врачей. Небольшая, совсем незаметная операция, скальпель хирурга только затронул уголочек мозга, и вдруг сразу у человека все меняется! Заинтересовались хирурги и болезнью Паркинсона. Открытие пришло случайно. Как-то при операции хирург случайно задел скальпелем один из участков мозга. И рука больного, дрожавшая до этого добрых десять лет, разом остановилась. Паркинсонизм побежден, сообщили журналисты. Но до полной победы пока еще очень далеко. Сотни операций сделали врачи лишь одной замечательной советской клиники — Московского института нейрохирургии, сотни безнадежно больных людей получили новую путевку в жизнь. Однако нож хирурга не такой уж тонкий инструмент. Врачи стали искать что-нибудь поизящнее. Начал работать ультразвук, пошло в ход электричество. Вместо скальпеля пораженный участок мозга выжигают электрическим разрядом. И вот самая последняя удача ученых, самый точный и тонкий метод. В трубочке жидкий азот. Температура минус 198 градусов. Хирург знает, где таится враг, знает очаг неизлечимой прежде болезни. И жидкий газ идет туда. Эта струя еще тоньше ножа, еще точнее. Ее можно включать на одно мгновение. Сначала мозг «выжигали» углекислотой — сухим льдом. Думали, что семидесяти градусов мороза хватит. Но оказалось, надо еще больше. Вот тогда в дело пошел жидкий азот. Тонкая, как волосок, струя. На вид ничего не изменилось там, куда так пристально смотрит хирург. Но больной сразу чувствует чудодейственное вмешательство. Все происходит почти мгновенно. В тот самый миг, когда хирург поразил больной участок ткани мозга капелькой сверххолода, когда воцарилась там температура минус сто девяносто градусов, неверные команды перестали поступать из мозга. И рука, дрожавшая до этого все время не переставая, успокоилась. Потом очаг холода в мозгу исчез. Ведь сам по себе холод долго не держится. Но вместе с холодом от человека ушла и болезнь.Газы, открытые на Солнце
Много различных веществ есть на Земле. Химия знает десятки тысяч различных соединений — сложных веществ, знает тысячи разнообразных реакций, когда вещества соединяются друг с другом, простые становятся сложными, а сложные разлагаются на простые. Но есть одна небольшая группа особенно упорных веществ. Они не хотят ни с чем соединяться. Живут обособленно. Могут существовать только в чистом виде. Назвали эти газы инертными — безразличными. Они действительно безразличны ко всем веществам на Земле. Правда, за последние годы ученые сумели заставить некоторые вещества соединяться с инертными газами. Но эти соединения непрочны. Они быстро разваливаются. Инертные газы разыскивали долго. Это были очень интересные поиски. Один из них — гелий нашли сначала на Солнце. Поэтому и имя ему дали гелий — солнечный. Рассказал историю открытия инертных газов советский ученый Бронштейн. У него и книга написана — «Солнечное вещество». Тем, кто не читал ее, советуем прочесть. В эту книгу инертные газы попали не случайно. Никаким другим способом, кроме сжижения и ректификации, выделить инертные газы из воздуха нельзя. Ведь и азот, и кислород, и водород можно получать не только ректификацией. Есть много и других способов. Правда, они дороже. А вот для инертных газов такой возможности нет совсем. И пока ученые не научились сжижать газы, разделить их было невозможно. Прежде всего давайте познакомимся с ними. Инертных газов пять: аргон, неон, криптон, ксенон и гелий. Инертные газы часто встречаются в нашей жизни. Они буквально везде вокруг нас. Не только потому, что входят в состав воздуха. Посмотрите внимательно. Криптон и ксенон висят прямо над вами, в комнате. Не удивляйтесь и поищите их получше. Не смогли найти? Электрическая лампочка. Что у нее внутри? Раньше из лампочки откачивали воздух, так как тонкий волосок нити в воздухе может сгореть. Но пустотная лампочка не очень выгодна в работе. Как говорят инженеры, у нее небольшой коэффициент полезного действия. И температура нити может быть выше. Надо наполнить лампу газом. Таким, который был бы безопасен для нити. Сначала употребляли азот. А потом вспомнили об инертных газах. Инертный газ ни с чем не соединяется. И нить в атмосфере инертного газа будет гореть в полной безопасности. Вот и первое применение — наполнение электрических осветительных ламп. Неон мы встречаем вечером. В городе зажигаются огни. И рекламы. Именно неон горит во многих рекламных надписях. Для промышленности важнее всего, пожалуй, аргон. Вернее сказать, что роль аргона могли бы выполнить и другие инертные газы. Но просто аргона в воздухе больше, чем других инертных газов. И добывать его оттуда легче. Поэтому аргон — весьма важное вещество для промышленности. Конечно, пользуются его основным драгоценным качеством — нежеланием вступать в реакции, соединяться с различными веществами. В металлургии часто нужно обрабатывать металлы, сваривать их в таких условиях, чтобы не появлялось никаких примесей. Металлы боятся кислорода, следовательно и воздуха: моментально возникнут окислы. Но и азот, который, вообще говоря, не очень склонен к реакциям, тоже может повредить. А вот аргону можно доверять полностью! Цветные металлы, например, очень часто обрабатывают в аргоне. Безопасно и удобно. Можно, конечно, откачать воздух, работать в вакууме, но в аргоновой среде все происходит гораздо удобнее. Есть один очень важный металл, который буквально не может жить без аргона. Титан — замечательное вещество, его сплавы не боятся высоких температур, они очень твердые, крепкие. И главное, титановые сплавы могут работать при больших температурах. Вы, конечно, догадались, где материалам приходится жарко — в соплах ракетных двигателей. Далеко не всякие вещества могут выдержать такую страшную жару. А ведь «чем дальше в лес, тем больше дров». Появляются ракеты еще мощнее, скоро они понесут отважных путешественников к далеким планетам. Им нужны еще более жароустойчивые сплавы. Чистый титан получают и потом обрабатывают только с помощью аргона. Иначе титан будет грязным, с разными примесями. А это уже никак не годится! Значит, аргон, который получается на установках сверххолода, служит для обработки материала, предназначенного для высоких температур. Вот как бывает в технике! Сейчас встречаются и не такие чудеса. Вот, например, термическая обработка. Термическая — значит тепловая. А между тем за последнее время инженеры разработали новый метод. Обработка по-прежнему называется термической, а производят ее с помощью… жидкого азота. Металл после ванны из жидкого азота закаляется так же, как будто побывал в жерле огнедышащей печи. Высокие температуры и низкие переплетаются в технике сплошь да рядом. Сталь на сталеплавильных заводах теперь стали чистить аргоном. Ведь к жидкой стали часто примешиваются пузырьки газов. Газы реагируют со сталью, появляются примеси. Как от них избавиться? Продуть сталь аргоном! Аргон быстро вытеснит все газы, которые «окопались» внутри стали, и займет их место. Но ведь для металла аргон безвреден. Он не способен окислить металл, дать какие-то примеси. Поэтому с ним можно мириться. Таков аргон — подсобный материал металлургии. Металлурги мечтают создать целые цеха, где атмосфера была бы аргоновой. Вместо воздуха — аргон. А людям можно дать специальные кислородные баллоны. Или еще лучше — создать безлюдные цехи. Пусть все делают автоматы. Автоматам аргон не страшен. Даже полезен. Есть такая мрачная болезнь металлов — коррозия. У железа она называется ржавчиной. Если кругом один аргон, никакой коррозии не будет и в помине. Ведь при коррозии металл соединяется с газами воздуха. А с аргоном никому еще не удалось соединиться. Но наиболее интересный из инертных газов, без сомнения, гелий. Ведь из него можно получить самую холодную жидкость. «Живет» жидкий гелий в самой непосредственной близости от абсолютного нуля. Как раз там, где разыгрываются весьма странные события, там, где привычный нам мир меняется до неузнаваемости. И во всех случаях, когда надо исследовать или использовать самые низкие температуры, на «сцене» появляется гелий. Мы пока что находимся на уровне минус 180 — минус 190 градусов Цельсия. До жидкого гелия еще добрых шестьдесят градусов с лишком. Но мы их скоро пройдем. И тогда начнутся настоящие чудеса. Но мы, по-моему, что-то очень много времени тратим на довольно скучные описания. Только издали посмотрели, как получают жидкий кислород. Поближе с ним не познакомились. А надо бы. Вот, скажем, куда отправилась эта цистерна с жидким кислородом? Очень интересно проследить. Тем более, что известно заранее — будут взрывы!
На Северном руднике
Далеко на Севере расположен Норильский горный комбинат. Его создали за Полярным кругом советские люди. Город большой, со всеми удобствами настоящего европейского города. А между тем Норильск находится там, где еще недавно и нога человека не ступала, где лишь изредка попадались охотники. Почему же людей потянуло в такую даль? Норильск сказочно богатый край. Чего тут только нет! Черные руды почти на поверхности земли. Нагибайся и собирай! Кроме того, там есть масса драгоценнейших веществ, которые ценятся, как говорится, на вес золота. Поэтому и появился здесь большой красивый город. Полезные ископаемые добывают самым простым способом. Гордые породы взрывают, благо далеко углубляться не нужно. Потом взорванное сырье собирают, чистят, выплавляют металлы. Но главное для нас, главное, для чего мы вспомнили о Норильске, — это, конечно, взрывы, потому что во взрывчатку, особенно часто используемую в Норильске, входит жидкий кислород. В сотнях приключенческих книг и кинокартин рассказывают, как под покровом ночи наши храбрые партизаны подрывали эшелоны с фашистскими солдатами, грузами, оружием. Кусок взрывчатки лежит под рельсами, от него в сторону тянется шнур. Шнур поджигают, пламя устремляется к взрывчатке. И вот страшный взрыв поднял вверх и рельсы и шпалы, сбросил под откос вагоны фашистского эшелона. Громовой удар, сопровождаемый тучей пыли, — вот что такое взрыв. Иногда вместо горящего шнура действует электрическая искра. Но и в этом случае взрыв происходит от детонации. Детонатор — начальная затравка взрывчатого вещества. От высокой температуры рвется сначала детонатор. А за ним уже взлетает на воздух основная масса взрывчатки. Взрывчатку обычно готовят на специальных химических заводах и привозят к местам взрыва в готовом виде. Там ее снабжают детонатором. И — взрыв! Но взрывчатку с жидким кислородом — оксиликвит — изготовить удивительно просто. Как раз из-за этого оксиликвитами так удобно пользоваться. Посудите сами. Положили мы в бумажный патрон кусок торфа. А потом осторожно нальем в торф жидкий кислород. Налили? Ну, все в порядке. Взрывчатка создана. Надо поместить ее на место взрыва, прикрепить детонирующий шнур, поджечь и спрятаться в укрытии. Через несколько минут грянет взрыв. И незачем возить на далекий комбинат изготовленные где-то взрывчатые вещества, когда их можно дешево соорудить прямо на месте! В Норильске оксиликвиты готовят из торфа. Но можно делать взрывчатку из дерева, стружек, соломы, сажи…
Эти материалы называются поглотителями, так как поглощают жидкий кислород. Что там происходит? Пористое вещество заполнилось жидким кислородом. Много его туда ушло. Кислород с веществами органическими, то есть образованными естественно природой, соединяется легко. В этом и состоит смысл взрыва оксиликвитов. Детонация как бы подстегивает жидкий кислород — окисляй, организуй, действуй! И начинается бурная реакция. При реакции выделяется тепло. Быстрое выделение тепла в небольшом пространстве и есть взрыв. И знаете, чем еще хороши заряды оксиликвита? До сих пор в разных местах, в городах и селах нашей страны находят неразорвавшиеся снаряды, старые мины, авиационные бомбы. Их обезвреживать очень опасно. Саперы рискуют жизнью, чтобы ликвидировать какую-нибудь бомбу, пролежавшую в земле пятнадцать — двадцать лет. А если бы взрывчатка в бомбе была оксиликвитом, то и бояться было бы нечего. Потому что оксиликвит через несколько часов становится абсолютно безвредным. Кислород постепенно испарится, снова станет газом. И останется кусок торфа, который так же способен взорваться, как, например, вспорхнуть в воздух. Так жидкий кислород производит полезные взрывы!
До цели остается двадцать градусов
Настала пора проститься с жидким воздухом и всеми газами, его «потомками». Правда, остается еще интересная встреча с гелием. Но его добывают не из воздуха. Гелий поступает к нам в смеси с природными газами, с тем самым газом, который горит у нас на кухне. Минус 252,8 °C. Всего лишь двадцать градусов отделяет нас от абсолютного нуля! Стал жидким самый легкий газ на свете — водород. Долгое время держался неон. Но за шесть градусов до сжижения водорода сдался и он. Жидкий водород получить нелегко. И еще труднее удержать. Ведь температура упала почти до абсолютного нуля. Со всех сторон стремится к жидкому водороду тепловая энергия. Как будто раздается клич: «Здесь очень холодно, помогите!» Нужна хорошая защита! Жидкий водород, как и другие бывшие газы, уже прошел путь от лабораторий к заводам. Он теперь нужен не только ученым, исследователям сверхнизких температур. Многим вообще кажется, что сверхнизкие температуры встречаются только в лабораториях, только в научных работах. Между тем даже жидкий гелий и тот уже стал веществом, с которым имеют дело инженеры на производстве. А другие газы — тем более. Водород как газ известен уже давно. Когда-то первые смельчаки, оторвавшиеся от Земли на воздушных шарах, заполняли их водородом. Водород — самое легкое вещество из всех известных на земле. Поэтому подъемная сила водородных шаров большая. Но есть у водорода и одна неприятная особенность. Водород легко загорается. Поджечь его — пара пустяков. Даже маленькая искра сразу вызовет пожар. Поэтому воздушные шары с водородом опасны. И в свое время отважные путешественники не раз гибли из-за того, что загоралась оболочка воздушного шара. Так погиб в XVIII веке отважный ученый Пилатр де Розье. Именно водородом наполнил свой воздушный шар герой романа Жюля Верна «Пять недель на воздушном шаре» доктор Фергюсон. Вы помните, конечно, как боялись отважные путешественники, что шар взорвется. Почему же водород ведет себя так воинственно? Дело в том, что вместе с кислородом этот газ образует особую горючую смесь. Ее название само говорит за себя — гремучий газ. Чуть только попадает в такой газ едва заметная искра, как уже не миновать страшного взрыва. А после взрыва на стенках сосуда, если он, конечно, остался в целости, можно увидеть капельки воды. Водород, соединяясь с кислородом, образует воду. Добывают его также из воды с помощью электролиза. В воду опускают две металлические пластинки — электроды. И к ним подключают электрическую батарею. Идет электрический ток. В воде появляются пузырьки газа. Один из этих газов и есть водород. Его можно собрать в какой-нибудь закрытый сосуд. Из открытого сосуда водород быстро вытечет. А так как он самый легкий, то поднимется высоко, уйдет в верхние слои атмосферы. Газообразный водород нужен химикам. Например, чтобы изготовить перекись водорода или другие соединения. Нас с вами гораздо больше интересует водород жидкий. Ведь мы занимаемся сверххолодом. Это одна из самых холодных жидкостей на земле. Получить жидкий водород гораздо труднее, чем сжимать воздух и разделять его на составные части. Можно использовать детандеры. А можно сжимать водород и в дроссельных установках. Только надо учесть, что «жары» это вещество не любит и на подходе к дросселю должно быть не теплее —69 °C! Куда идет эта «холодная» жидкость? Где она нужнее? Ведь не зря сооружают большие установки, чтобы получить жидким самый легкий газ на свете. Вероятно, жидкому водороду обеспечено славное будущее в ракетных кораблях. Но он нужен и сейчас. Используют водород и в лабораториях. Но, видимо, очень скоро жидкий водород ожидает всемирная слава. С одной из разновидностей его — дейтерием — люди будут так же хорошо знакомы, как сейчас с углем или нефтью. История эта длинная и начинается она с тяжелой воды.«Мертвая» вода
Мы много говорили о молекулах. Молекулы — мельчайшие частички вещества. Они сохраняют все свойства этого вещества. В самом маленьком кусочке тела, в капле жидкости содержится громадное количество молекул. Все они в точности одинаковы. И по виду, и по массе, и по свойствам. Молекулы непрерывно двигаются, обладают внутренней энергией. Если эту энергию отнять, то тела охлаждаются. Это все мы уже хорошо знаем. Но молекулы еще не самые маленькие частички вещества. Все молекулы состоят из атомов. Если молекула — карлик, лилипут, то атом — совсем малютка. Правда, у некоторых молекул всего лишь один-два атома. Зато в составе других — тысячи и десятки тысяч атомов. В нашем теле есть белковые молекулы. Они сложнее любой машины. Даже не верится. Вы видите, художник нарисовал нам макет одной такой молекулы. Даже не самой молекулы, а ее составной части. Спираль вроде лестницы с восемнадцатью витками тянется вверх. А от нее во все стороны — отростки. И это все атомы. Сотни, тысячи атомов. Стоит только один из них переменить, как сразу же изменится и молекула.
Молекул в мире огромное количество. А вот атомов значительно меньше. Отдельных разновидностей атомов — их называют элементами — немногим больше сотни. Конечно, складываются атомы по-разному, можно набрать сколько угодно различных молекул. Даже если взять пять атомов и только переставлять местами по-всякому, то сколько будет таких пятиатомных молекул? Сто двадцать! Понятно, что таким образом можно получить бесчисленное множество всевозможных молекул. Химики чуть ли не каждый день готовят их. Атомы одного элемента похожи друг на друга, как близнецы. Но и тут имеется разница. Опять-таки встречается несколько сортов этих близнецов. Называются они изотопами. Для химика все они одинаковы, в химических реакциях их не различить никаким способом. А вот физики говорят — близнецы, да не совсем. Вес у них различный. Возьмем водород. У него есть целых три изотопа. Называются они — обычным или легким водородом, тяжелым и сверхтяжелым. Тяжелый водород — дейтерий — в два раза тяжелее легкого, а сверхтяжелый — в три. Что такое вода? Два атома водорода и один кислорода — вот и получается молекула воды. Если вместо водорода в молекуле поселится дейтерий, тогда вода станет тяжелой. Правда, не такая уж тяжелая. Если дать вам в руки стакан простой и тяжелой воды, то вы не отличите их по весу. Молекула тяжелой воды в 10/9 раза тяжелее обычной молекулы. Зато по многим свойствам тяжелая вода отличается от обычной — от той, которую мы пьем, которой умываемся. Говорят иногда, что тяжелая вода вроде мертвой воды наших сказок. В любом водоеме вместе с обычной водой есть и тяжелая. Всего лишь 0,02 %. 0,2 грамма в каждом литре. А спрос на нее очень велик. Тяжелая вода нужна атомной физике, атомной технике. В чем разница? Атомная физика — наука, которая занимается исследованиями самых тонких свойств вещества, проникает в глубь молекул и атомов, изучает их строение. Вы думаете, меньше атома ничего нет? Ошибаетесь. Атом совсем не такой простой и неделимый. В нем есть частички еще меньших размеров. Бывает даже много этих частичек. До двух-трех сотен! Исследовать все частички, изучить их, проникнуть в глубь атома — нелегкая задача. И тяжелая вода помогает ученым в этой работе. Но еще чаще тяжелую воду мы встретим в атомных котлах. Их называют ядерными реакторами. При обычных взрывах, скажем, пороха или динамита, выделяется мгновенно тепловая энергия. Она хранилась до этих пор внутри молекул. И запас этой скрытой энергии в момент взрыва стремительно вырывается наружу. Гораздо больший запас энергии хранится внутри атомов. Но зато до него и труднее добраться. Лишь двадцать лет назад ученые добились этого. Человек начал осваивать энергию атомных ядер — атомную энергию. Сначала она появилась тоже при взрыве — атомном взрыве. Атом напоминает нашу солнечную систему. Внутри — солнце, а вокруг него вращаются планеты. В атоме подобием солнца служит ядро. Это и есть самая сокровенная кладовая природы. Здесь скрываются бессчетные запасы энергии. Надо только уметь ее оттуда изъять. Первыми «раскошелились» ядра тяжелого темного металла урана. Ученые нашли способ освобождать энергию ядер урана. Происходит это в атомном котле. Кроме «топлива» — длинных урановых стержней урана, в таком котле есть одна весьма существенная часть — замедлитель. Жители японских городов Хиросимы и Нагасаки хорошо запомнили августовские дни 1945 года. Они узнали, что получается, когда атомная энергия вырывается наружу мгновенным взрывом. Но человеку не нужна атомная бомба. Надо обуздать взрыв, чтобы атомная энергия выделялась постепенно, определенными порциями. Вот, например, электрическая энергия непрерывно вырабатывается электростанцией. И по проводам ее доставляют всюду. Работают станки, идут электропоезда, горят лампочки в квартирах, экраны кинотеатров. И все это благодаря тому, что электростанции исправно поставляют городу электричество. Вот таким способом надо поступать и с энергией атома. Надо заставить атомы урана выделять ее не спеша. Эту работу выполняет замедлитель. Он успокаивает, замедляет реакцию. И вместо мгновенного взрыва атомы урана работают долго и равномерно. Одним из лучших замедлителей является тяжелая вода. Вот наконец-то мы добрались до дела. Тяжелая вода нужна атомным реакторам. А их становится все больше и больше. Казалось бы, легче всего получать тяжелую воду из обычной воды. Выделить каким-нибудь образом эти 0,02 процента. Раньше так и поступали. И вдруг совсем недавно ученые доказали, что гораздо выгоднее окольный путь. Сначала из воды с помощью электричества получают водород. Разумеется, в этом случае водород появится на свет вместе со своим двойником — изотопом дейтерием. Химически они неразлучны, как настоящие двойники. Затем водород надо превратить в жидкость и тогда развести «близнецов» в разные стороны: дейтерию предложить для реакции атомы кислорода, чтобы он превратился в тяжелую воду, а водород отпустить на волю или передать химикам. Так в атомную технику пришли температуры, лишь на двадцать градусов отличающиеся от абсолютного нуля. Сейчас к ним уже привыкли. Газы удобно разделять в жидком виде из-за того, что они кипят при различных температурах. Азоту надо — 195,8 °C, а для кислорода хватит —183 °C. Дейтерий и легкий водород ведут себя точно так же. Но точки кипения азота и кислорода различаются на целых двенадцать градусов. А для дейтерия и легкого водорода разница всего около трех градусов. Но и это уже хорошо. Ведь обычно изотопы почти не отличаются друг от друга. Поэтому и разделять их чрезвычайно трудно. Значит, для разделения изотопов водорода нужно построить такие же разделительные колонны, заставить водород путешествовать по тарелкам, как это проделывают с жидким воздухом. Но сначала придется добывать обычный водород. Это ведь не воздух, который окружает нас. Поэтому первая ступень «дейтериевого» завода — электролизная ванна. Электрический ток разлагает воду. Затем водород очищают. Вымораживают воду, углекислый газ, кислород, азот, Особенно опасен кислород. Если в машину для сжатия водорода попадает хоть немного кислорода, ожидай взрыва. Дальше начинается знакомая нам работа. Жидкая смесь легкого и тяжелого водорода понемногу переходит с одной тарелки на другую, тянется в низ колонны. Навстречу — струя газа. Жидкость по дороге приобретает все больше и больше дейтерия, а газ, поднимающийся наверх, становится более чистым водородом. Полностью отделить изотопы с одного раза не удается. Для того чтобы получить дейтерий, почаще приходится повторять эту операцию. Когда дейтерий почти очищен от своего двойника — легкого водорода, можно приглашать кислород. Небольшой взрыв — это хлопнул гремучий газ, и вот она, желанная тяжелая вода. Теперь дейтерий крепко связан с кислородом и уже никуда не может улетучиться. Скоро дейтерий будет ценнейшим веществом сам по себе, а не только как составная часть тяжелой воды.
Еще одно «укрощение»
Запомните хорошенько слово «дейтерий». Он скоро сможет заменить уголь, нефть, горючие газы. И «загорится» в топках новых электростанций, самых удобных, самых лучших в мире. Слово «загорится» стоит в кавычках. Это не зря. Гореть пламенем дейтерий не будет. Он ведь такой же горючий газ, как и обычный водород, его легко поджечь. Но ученые хотят зажечь особенный костер. Он называется термоядерным. Для костра термоядерного и предназначается дейтерий. Атомная реакция урановых ядер — уже близкий друг и помощник человека. Есть чудовище пострашнее атомной бомбы — водородная бомба. Миллионы, десятки, сотни миллионов градусов. Атомная бомба уже укрощена учеными. Появились атомные котлы — источники энергии. Работают атомные электростанции, в том числе и первая в мире наша советская электростанция на ядерном горючем. Теперь ученые хотят заставить мирно работать водородную бомбу. Какую замечательную победу одержали бы в этом случае люди! Электростанцию, где работают ядра дейтерия, называют термоядерной. Таких электростанций еще нет. Но ученые надеются, что не за горами тот день, когда впервые родится ток самой удивительной фабрики электричества, работающей… на воде! Знаете, сколько полезных веществ сжигают ежедневно наши тепловые электростанции? Химики могут изготовить из них миллионы ботинок, пальто, галош, соорудить великолепные дома, построить автомобили, пароходы, самолеты. Вот что можно поучить из угля и нефти, которые так бесследно исчезают в прожорливых топках. Кстати, обычного топлива на земле не так уж много: хватит еще лет на двести… А что потом? Вот вода есть кругом. Вода и будет служить источником энергии. В каждой капле воды — дейтерий. Малюсенькая доля дейтерия таит большие силы. Там, где сейчас тратятся тонны угля, хватит грамма дейтерия. В атомных урановых котлах крошечные частички — ядра атомов урана разделяются на две половинки. Каждая несет энергию. Работают дружно, выделяют тепло. Это тепло можно забрать и использовать. Так и поступают на атомных электростанциях. Греют на «урановых топках» воду. Вскипятят ее, и пар летит крутить турбину. А турбина берет в работу генератор. Появляется электрический ток. Для термоядерных реакций нужны особые условия. Тут ядра уже не делятся, а, наоборот, соединяются. Из двух получается одно. Проще всего заставить соединиться ядра дейтерия. Когда они сливаются, образуется новое вещество — гелий и выделяется тепло — энергия. На электростанции каждую секунду будут «сгорать» миллиарды миллиардов ядер. Вот и получится Днепрогэс в маленькой коробочке! Зажечь такой термоядерный костер, приручить, замедлить реакцию — трудно. Нужна своеобразная топка для ядер. Сто миллионов градусов — никак не меньше. Иначе капризные ядра не желают соединяться. Можно даже догадаться почему. Атомы и атомные ядра, так же как и молекулы, вечно движутся. И на близких расстояниях отталкиваются друг от друга. Помните законы молекул: издалека — братья, вблизи — враги! Чтобы ядра соединить, надо разогнать их до огромной скорости. Чем выше температура, тем больше скорость. Вот и миллионы градусов! Такая жара царит, например, в недрах звезд и нашего Солнца. Энергия, которую несут нам солнечные лучи, — термоядерная. Конечно, получить такую температуру на земле страшно трудно. Пока что ученые только нащупывают пути, по которым им предстоит идти. Еще труднее задержать реакцию, чтобы шла она не доли секунды, как в водородной бомбе, а долго, сколько нужно. Но уже появились в лабораториях температуры в миллионы градусов, уже созданы «сосуды», в которых можно долгое время удерживать сверхвысокую температуру. А ведь и низкие и высокие температуры требуют особой защиты. Наука стоит на пороге великих открытий, великих решений. Дейтерий — сколько надежд возлагают на него! Вот тогда появятся тысячи установок жидкого водорода. Около водоемов, озер, рек, морей поднимутся башни ректификационных колонн, а само слово «дейтерий» станет таким же привычным, как дрова, уголь, нефть… И никто не удивится, что рядом мирно уживаются температуры космоса и звездные температуры. Никого не будет удивлять такое странное соседство — установка, где рождается дейтерий, и термоядерный котел, куда его посылают «работать». Минус 252 градуса и плюс сто миллионов — температуры космоса и Солнца рядом, ближайшие соседи. Ведь не удивляемся мы сейчас тому, что такими же соседями являются само Солнце и пространство, окружающее его.Чудеса жидкого гелия
Ну вот, мы почти у цели. Появился жидкий гелий. От абсолютного нуля нас отделяют каких-то четыре с небольшим градуса. Чтобы преодолеть их, науке пришлось потратить столько же времени и сил, как и на весь предыдущий путь. Последний газ стал жидкостью. А все остальные жидкости затвердели. Сначала сдались азот, кислород, аргон, неон. Вот уже замерз и водород. Страшный это мир, где нет ни одного газа, где все мертво. Говорят: «ледяные просторы Антарктики». Вот где они — ледяные просторы. Только льды эти из кислорода, азота, водорода, воздуха. Наверное, нечто подобное найдут космические путешественники будущего на далеких планетах. Жидкий гелий отделяют от жидкого водорода всего лишь 16 градусов. Небольшое пространство! Но как раз здесь и сосредоточены все чудеса мира сверххолода. На ближайших подступах к абсолютному нулю происходят самые чудесные превращения веществ, самые необычайные истории. Ученым понадобилось немало времени, чтобы обнаружить эти чудеса. Но еще больше сил они потратили, пока их объяснили. Сжижается гелий теми же способами, что и другие газы. Наверное, не стоит лишний раз упоминать их. Гелий охлаждают жидким воздухом, азотом и водородом. Для сжижения обычно берут его не из воздуха. В природном горючем газе гелия больше, и добывать его оттуда легко. «Чудеса» мира сверхнизких температур начинаются с самого гелия. У этой жидкости столько неожиданного, она так отличается от других жидкостей, что ученые посвятили гелию сотни, тысячи различных научных работ. Кто-то подсчитал, что по количеству этих исследований гелий даже обогнал воду, а, казалось бы, о воде написано очень много. Сначала гелий не производит впечатления необыкновенной жидкости. Что особенного? Нелегко получить, быстро вскипает. Как будто бы и все. Но стоит лишь немного охладить эту прозрачную жидкость, как начинаются форменные чудеса. Когда до абсолютного нуля остается лишь два градуса, гелий вдруг переходит в особое состояние. Он и тот и не тот. Ученые дали этой разновидности название — гелий-2 (читается «гелий два») в отличие от обычного гелий-1.
Что такое трение, без сомнения, знают все. Колеса автомобиля трутся о шоссе, наши ботинки — о тротуар. Из-за трения трудно ходить по песку. Когда одно тело движется по поверхности другого, появляется трение. По гладкой дороге автомобилю легче ехать, чем по плохой, проселочной. На проселке трение больше. С другой стороны, трение и помогает нам двигаться. На скользком льду трудновато ходить. Трение там мало, ноги скользят, можно упасть. Многие писатели описывали выдуманный «мир без трения». Там просто жить невозможно. Не только ходить нельзя. Ничего нельзя делать. Люди сидят голые. Ведь наше платье держится потому, что сшито нитками. А нитки не выскакивают благодаря трению. Столы и стулья, здания и машины лишь из-за трения не разваливаются. А то разлетелись бы на все свои составные части. В жидкостях тоже есть трение. Когда течет вода, то одни ее слои перемещаются вдоль других. И при этом трутся друг о друга. Поэтому в середине реки течение быстрее, чем у берегов.Каждый следующий слой, считая от середины, движется немного медленнее. Трение существует внутри всякой жидкости — всякой, кроме гелия-2. Для него трение отсутствует. Удивленные ученые назвали это явление, открытое в 1938 году П. Л. Капицей, сверхтекучестью. Эта жидкость может проникать в тончайшие трубочки — капилляры. И течет быстро, как будто ничто ей не препятствует. Да и в самом деле гелию-2 ничто не мешает. Еще интереснее «ползучесть» жидкого гелия. Ученые соорудили небольшой приборчик. Он называется «бочонок Капицы». Это действительно маленький бочонок. Наливают в него жидкий гелий-2. И жидкость храбро начинает взбираться наверх. Ползет, как будто и сила тяжести на нее не действует и законы физики не для нее писаны. Пленка жидкого гелия может пропутешествовать таким образом очень далеко. Но это еще не все. Гелий — просто фантастическая жидкость. Когда из самовара или водопровода течет вода, мы ничего особенного не замечаем. А если гелий вытекает по очень узкой трубке из большого сосуда, то в трубке он охладится. Зато гелий, оставшийся в сосуде, почему-то нагревается.

Обычные жидкости плохо передают тепло. Зато гелий в этом отношении может поспорить с любым металлом. Невозможно добиться того, чтобы в одном углу сосуда с жидким гелием была одна температура, а в другом — другая. Тепло мгновенно уравновесится. Очевидно, жидкий гелий любит единство в своих рядах и тщательно следит за этим. В каждом веществе — в воздухе, воде, дереве — звук распространяется по-разному. В воздухе звуковые волны проходят 330 метров в секунду. Если от вспышки молнии до удара грома прошло, скажем, три секунды, то каждый может подсчитать, где была молния. 330 метров в секунду — километр в три секунды. А у нас звук путешествовал ровно три секунды. Значит, молния сверкнула где-то на расстоянии одного километра от нас. В воде звук распространяется быстрее почти в четыре раза. В твердых телах ему надо еще меньше времени. Получили ученые жидкий гелий и стали его всячески обследовать. Дошла очередь и до звука. Тут-то и ждал ученых очередной сюрприз. Опять-таки гелий продемонстрировал свои чудесные свойства. У него оказалось две скорости звука. Обычная — она называется первым звуком. И второй звук, это как раз и будет скорость, с которой в гелии распространяется тепло. Думаете, чудеса на этом кончаются? Не тут-то было! Вот, пожалуйста, еще одно из чудес.
Фонтан в криостате
Все опыты с жидкими газами сверхнизкой температуры производят в особых установках — криостатах. Криостат — сосуд, в котором физики поддерживают нужную температуру. Зорко следят, чтобы тепло не попало туда со стороны. А если появится внутри сосуда лишняя тепловая энергия, тотчас же отводят ее, изгоняют! В общем, задача криостата ясна — температура должна быть строго постоянной. Чтобы достичь этой цели, ученые пускаются на всякие хитрости. Очень тяжело работать вблизи абсолютного нуля. Тут, как нигде, требуются очень умные руки. Даже для конструирования криостатов существует целая наука. А ведь по сути дела — это даже не аппаратура, а просто подготовка рабочего места. Но рабочее место особенное. Слишком уж низка его температура, слишком трудно ее достичь и сберечь. В одном из таких криостатов можно увидеть, как работает необычайный фонтан. Участник этого трюка, конечно, гелий. Фонтан интересен еще и тем, что возникает он совершенно неожиданно. В дьюаре покоится жидкий гелий. Внутри жидкости V-образная трубка. Такие трубки часто используются в лабораториях: различные газовые термометры, измерители давления — манометры — все это трубки, колена которых заполнены ртутью или другими жидкостями. Там, где трубка выступает из гелия, на нее надевают пористую пробку, через которую жидкость просачиваться может. Второе, короткое колено трубки погружено в жидкий гелий. Художник нарисовал нам эту картину. Вот она, трубка, внутри нее — пористая пробка, а тонкое жало тянется вверх из жидкости.
У верхнего края, там, где начинается жалообразное сопло, пробку немного нагревают. Нагревание, конечно, небольшое, чтобы гелий не закипел. И вот неожиданно из сопла вырывается форменный фонтан — струя жидкого гелия. На несколько сантиметров вверх брызжет этот необычайный фонтан. Почему он появляется? Тоже загадка! И таков весь жидкий гелий. Что бы с ним ни случилось, все чудеса, все фантастика. Только не подумайте, пожалуйста, что ученые, изучающие жидкий гелий, только и делают, что ахают и разводят руками, когда вдруг встречаются с такими фантастическими явлениями. Они научились объяснять эти чудеса. Так что для тех, кто часто сталкивается с самой холодной на земле жидкостью, она уже стала обычной. Точно так же, как и сама температура в четыре градуса Кельвина, как само близкое соседство с абсолютным нулем. Ученые не остановились на температурах сжиженного гелия. Они пошли еще дальше. Сейчас до абсолютного нуля остались сотые доли градуса. Но твердый гелий при обычных условиях не образуется. Только при давлении в несколько атмосфер удалось заставить упрямое вещество затвердеть. Можно считать, что на земле нет ни одного вещества, которое вблизи абсолютного нуля остается газом или жидкостью. Любое вещество ученые могут получить и в жидком, и в газообразном, и в твердом видах. А так же и в плазменном.
Пятьдесят лет поисков
Пятьдесят лет назад, когда ученые уже подобрались к абсолютному нулю, они натолкнулись на одно загадочное явление. Вы видите, какой это необычайный мир — Мир Сверххолода. Кругом подстерегает путешественника Необычайное, Невероятное! В отличие от чудес жидкого гелия, это явление уже нашло практическое применение. Но ученые сначала научились им пользоваться, а потом уже объяснили. Существуют два раздела физики, необычайно тесно связанные друг с другом. Это — электричество и магнетизм. И связь явлений электрических магнитных особенно поразительна как раз вблизи абсолютного нуля. Уже более ста лет пользуются люди чудесной электрической энергией. Вот тут уж действительно перед нами самый мощный, самый мудрый, самый нужный помощник человека. Без электрической энергии мы бы ничего не смогли делать. В любых делах человека — дома, на работе, на отдыхе — помогает электричество. Даже на космических ракетах, на спутниках Земли стоят маленькие электрические батареи и аккумуляторы, которые питают межпланетные корабли и искусственные спутники электрической энергией. Пока что энергия электрическая самая удобная, самая распространенная. Ее можно передавать на любые расстояния, делить на части, соединять и даже заготовлять впрок, правда, в небольших количествах. Когда мы включаем свет, в нашу лампу попадает электрический ток. Ток прекратится, когда станция перестанет подавать электрическую энергию или когда мы снова щелкнем выключателем и разомкнем электрическую цепь. Батарея карманного фонаря питает маленькую лампочку. Если фонарь перестает работать, вы говорите: «Скисла батарея» и идете покупать новую. Электрический ток сразу же прекращается, если разрядится батарея, перестанет работать электростанция, произойдет разрыв в линии электропередач. Почему же так получается? В каждом проводнике имеются носители электричества — электроны. Это тоже атомные частицы. В атомах они обычно тесным роем окружают ядра, вращаются вокруг него. Но в проводниках часть электронов — свободная. Ведут они себя, как молекулы в газе. Их так часто и называют — «электронный газ». Это название точное. Ведь внутри проводника электроны свободно носятся во все стороны, не связанные ничем. Им не удается лишь выбраться наружу, выскочить из провода. Так же чувствуют себя и молекулы обычного газа, подлетая к стенкам сосуда, в котором расположился газ. Когда мы включаем на электростанции рубильник или подсоединяем к лампочке карманного фонаря батарею, мы создаем электронам особые условия. В проводнике появляется электрическое поле. Вокруг Земли есть поле тяготения. Все предметы поэтому приближаются к Земле, падают вниз, если это можно. Электрическое поле действует на электрические частички — электроны, гонит их вперед. При токе переменном электроны бросаются то в одну сторону, то в другую. А при токе постоянном перемещаются с одного конца проводника к другому. Но путешествовать электронам не так-то просто. На пути встречаются другие электроны и атомы металла, и электронам приходится преодолевать их сопротивление. Чем сопротивление меньше, тем меньше потери электрической энергии в проводах. Когда издалека ведут линию передачи электроэнергии, провода делают очень толстыми, чтобы сопротивление уменьшить. Тогда в пути от электростанции к потребителям электрическая энергия не растратится зря. У всякого проводника определенное сопротивление. Правда, оно зависит от температуры. Но не очень сильно. Заметим еще одно. Чем сопротивление меньше, тем больший ток потечет по проводнику. Вот теперь перейдем к магнетизму. Магнитную стрелку знает каждый. И электромагнит тоже каждый видел. Ничего таинственного в этих предметах нет. Компас указывает нам страны света. А почему? Почему магнитная стрелка упорно становится в одном направлении? Потому, что она попадает в магнитное поле Земли. Так отвечает вам учебник. Земля — магнит. Это свойственно далеко не всякой планете. Вот, например, у Луны нет магнитных свойств. Это установила наша лунная ракета. Нет сильного магнитного поля и у нашей соседки — Венеры, определил недавно американский космический корабль «Маринер-2». Вокруг всякого магнита имеется магнитное поле. По этому полю и узнают, является ли планета магнитом. Видите, сколько разных полей может существовать в природе. Поля тяготения, электрическое, магнитное. Компас нам указывает, как на Земле расположено магнитное поле, где Северный полюс, а где — Южный. Вот на Луне путешественникам придется потруднее. Вынимаем компас. Но не тут-то было! Стрелка компаса «гуляет» в разные стороны, как хочет. Магнитного поля у Луны нет. Придется находить путь другими способами. В магнитном поле некоторые металлы, например железо, сами становятся магнитами. Магнитная стрелка — тоже маленький магнит. Ее магнитное поле сталкивается с магнитным полем Земли. И стрелка становится в такое положение, чтобы эти поля друг другу не мешали. Кроме магнитов природных, существуют магниты искусственные. Например, электромагниты. В электромагните есть обмотка — провод, по которому течет электрический ток, и железный сердечник. Вокруг всякого проводника с током появляется магнитное поле, а железо его усиливает. Электричество и магнетизм вообще очень дружат. С помощью магнитного поля получают электрический ток. А там, где течет электричество, сразу же появляется магнетизм. Электромагниты используются буквально везде. Можно встретить громадные установки, с помощью которых перетаскивают тяжелые железные предметы. И малюсенькие электромагнитики, вроде тормоза детандера, машины для охлаждения газов. Инженеры давно мечтали, как бы сделать сопротивление обмотки электромагнита поменьше. Тогда можно было бы изготовить особенно мощные электромагниты. Ток течет, а сопротивление ничтожно мало. Значит, ток будет очень большим. Раз ток большой, то и магнитное поле велико. А по размерам такой мощнейший магнит — фитюлька! Вообще говоря, можно и сейчас сделать сопротивление обмоток электромагнитов маленьким. Но для этого придется сооружать их очень толстыми. Провода толстые, значит, велики размеры магнита. А инженеры хотят собрать все магнитное поле на очень маленьком участке. Чуть ли не в точке.
Вот это будет магнит! Но как его сделать? И вдруг неожиданно у них появились надежды, что соорудить такой магнит можно. Пятьдесят лет назад голландский ученый Камерлинг-Оннес заметил, что вблизи абсолютного нуля при температуре жидкого гелия вдруг полностью пропало электрическое сопротивление ртути, с которой он экспериментировал. Пропало начисто, как будто его и не было. Заинтересованный ученый немного повысил температуру в своем криостате. Так же мгновенно появилось сопротивление. Так была открыта сверхпроводимость — чудесный физический процесс. С ним теперь связано много разных технических проектов, еще недавно казавшихся чистой фантастикой. Ученые начали исследовать различные проводники, искать у них это замечательное свойство. Оказалось, что сверхпроводимость наступает у многих металлов. Только при разных температурах. Редкому металлу рутению подавай 0,46° К, то есть почти абсолютный нуль. А другие более податливы. Ученые создали специальные сплавы, для которых температуры перехода в сверхпроводимость сравнительно большие. Одно сложное соединение сурьмы с ниобием становится сверхпроводящим уже при 18° К. Это немного ниже точки кипения водорода. Даже гелия получать не надо. Достаточно чуть охладить жидкий водород — и вот тебе сверхпроводимость! Что же это такое — сверхпроводимость? Электрический ток в таком проводнике может идти сколько угодно, ведь никаких затрат энергии не происходит, сопротивления нет. Все равно что дать возможность автомобилю ехать по дороге без трения. Подтолкнуть его разок, а дальше можно и не беспокоиться. Сам поедет, трения нет, ничто его не остановит, только на гору не лезь! Ученые взяли и проделали подобный опыт. Только не с автомобилем, конечно, а со сверхпроводимостью. Сделали из сверхпроводника маленькое колечко. Затем его надежно укрыли в криостате при температуре, когда должна наступить сверхпроводимость. В колечко пустили электрический ток. Подсоединили на минутку к батарейке, а потом ее отключили. В обычных условиях ток тотчас же исчезнет. А тут он шел несколько месяцев как ни в чем не бывало. И не пропадал, пока хватило терпения ученых. Вот когда настала пора радоваться инженерам, сооружившим электромагниты. Прямо в руки им шло открытие, которого они ждали. Теперь можно соорудить электромагнит со сверхпроводящими обмотками — мощнейший электромагнит. Так подумали инженеры. Ничего, что придется создавать теплоизоляцию, оберегать обмотки от внешнего тепла. Все окупится! «Вечный» ток, вечный электромагнит без всяких затрат энергии! Но природу обмануть не так-то легко. Создали инженеры первую модель электромагнита со сверхпроводящими обмотками. Сначала все шло хорошо. А потом вдруг сверхпроводимость пропала. Уменьшили ток, она появилась снова. Увеличили — и нет сверхпроводимости! Собственное магнитное поле, поле электрического тока — если оно сильное — ликвидирует сверхпроводимость! Конструкторам электромагнитов как раз нужно большое магнитное поле. За него они и бились, хотели получить мощный магнит. Пришлось им отступиться от сверхпроводящих обмоток. А все это было так заманчиво! Так написано в книгах, изданных до 1962 года. Совсем недавно физики все-таки совладали с коварным явлением. Нашли сплав, который сохраняет сверхпроводимость даже при очень сильных магнитных полях. А само это явление, когда сверхпроводимость то появляется, то пропадает, следуя за изменением магнитного поля, ученые научились использовать, да притом еще с большой пользой. Так что нет худа без добра! Ученые очень подробно исследовали интересные явления. Сверхпроводимость появляется в металле или сплаве сразу, почти мгновенно. Только наступила требуемая температура — и эффект налицо. Так же скачком сверхпроводимость и пропадает, когда тело немного нагреется, когда температура снова станет выше температуры перехода из проводящего состояния в сверхпроводящее. Ликвидировать сверхпроводимость можно с помощью магнитного поля. Для каждого проводника поле свое собственное. Для одних хватит небольшого, другим — подавай мощное. Магнитное поле может быть и внешнее, не обязательно свое собственное. Скажем, поднесем к криостату сильный магнит и ликвидируем сверхпроводимость… Однако и здесь не все просто. Сверхпроводящие металлы не пускают внешнее магнитное поле, не может оно пройти внутри проводника, пока не станет таким, что может ликвидировать сверхпроводимость. До тех пор сверхпроводящий материал отбрасывает это магнитное поле, не допускает его к себе! Что касается магнитных свойств, то у некоторых сверхпроводников они оказываются необычайными — антиферромагнитными. Железо и несколько других веществ — ферромагнетики. Они очень сильно увеличивают магнитные поля. Недаром у всех электромагнитов железные сердечники. А антиферромагнитные вещества ведут себя наоборот. Что значит — наоборот? Железо в магнитном поле усиливает это поле. Во внешнем поле антиферромагнетик тоже намагничивается, только противоположным образом, и уменьшает действие основного магнита. А в обычных условиях антиферромагнетик никаких магнитных свойств не обнаруживает. Их у него нет. У арабов существует легенда о гробе Магомета. Основатель магометанской религии будто бы похоронен в гробу, который висит в воздухе. Вообще говоря, подобную модель можно сделать. Намагнитить какую-нибудь железную коробку и положить на стол. И сделать надо так, чтобы, скажем, северный полюс магнита попал против северного полюса коробки. Вот тогда коробка может повиснуть в воздухе. С одной стороны, под действием силы тяжести она будет стремиться упасть на землю, а с другой стороны, магнит ее отталкивает. Игрушку поинтереснее создали ученые в криостате с помощью сверхнизких температур и явления сверхпроводимости. Вот это чудо на нашем рисунке. В сосуде сверхпроводящая жидкость. Сверху к ней поднесли магнит. В жидкости тотчас же появляются электрические токи из-за того, что рядом находится магнит. Только пошевельнем магнитом, и токи появятся. Поскольку материал — сверхпроводящий, токи будут там все время. И они создадут свое собственное магнитное поле. Это поле противоположно полю нашего основного магнита. И оно будет отталкивать магнит. Чем вам не «гроб Магомета» — магнит, свободно парящий в пространстве. Ничто его не держит, а магнит висит себе в воздухе.

Это, правда, игрушка. Но ученые уже научились ее использовать. Ведь получается очень удобная система. Предмет висит в воздухе без всякой опоры. Для многих физических установок это просто находка. Очень часто бывает необходимо, чтобы предметы не прислонялись друг к другу. Например, нужна хорошая теплоизоляция или требуется подставка. Сверхпроводящий магнит — подставка, не связанная ни с чем, а в то же время на нее можно опереться. Мне кажется, что мы слишком долго засиделись в лаборатории. Давайте совершим небольшое путешествие к… звездам. И сопровождать нас будут сверхнизкие температуры. Нет, не только за бортом корабля. Вместе с нами, в соседней кабине.
Путешествие к далеким мирам
Кругом мрак, холод, пустота и тишина. Мы в космосе. Но космический холод царствует не только там, в ледяном безмолвии далекого Мира, который мы обследуем. Командует нашим путешествием могучий электронный мозг, который также погружен в безмолвие сверххолода. Там ему лучше думается! И в баках нашего горючего температура близкая к абсолютному нулю, температура космоса. За окнами пустота. Мы говорим, что там температура абсолютного нуля. Но правильно ли так говорить? Температура связана с движением молекул. А в этом мертвом пространстве ничего нет. Почти ничего. Вещества межзвездного так мало, что можно считать его пустотой. Корабль кажется неподвижным. Скорость велика. Но среди далеких звезд, окружающих нас, незаметно, что мы передвигаемся, стремительно мчимся в пространство. Нашу траекторию «знает» точно только электронный мозг. Он ведет ежедневные подсчеты, подправляет ход корабля, если мы сбиваемся с курса. «Мозг» упрятан в тройной ящик. Для того чтобы он хорошо действовал, надо все время удерживать низкую температуру. Только тогда «мозг» работает как следует. Что же это за особый электронный мозг, которому обязательно надо создать такие странные условия? Наш электронный кормчий занимает очень мало места. И питается от маленькой электрической батарейки. Зато приходится считаться с его слабостями к сверхнизкой температуре. Но мы надежно укрыли его от возможных посягательств тепла. Вычислительная машина — устройство сказочное. Иначе не назовешь аппарат, который умеет считать, переводить с одного языка на другой, управлять работой заводов и фабрик. А наш электронный мозг спокойно ведет космический корабль к далекой цели. Как он устроен? Есть детская игра: тебе задают вопросы, и ты можешь отвечать только «да» и «нет». По этим ответам играющие должны угадать, что ты задумал. Работа вычислительно-электронной машины немного напоминает такую игру. Только в машину заранее вводят кое-какие знания. Это называется «памятью». Потом создают программу, по которой машина будет работать, — своего рода свод законов. А дальше машина начинает «думать» самостоятельно. Машина, которая расположена внутри космического корабля, собирает данные приборов, подсчитывает координаты места, где мы находимся. Если корабль вдруг начал отклоняться от курса, который хранится в «памяти» машины, она сразу же дает команду двигателям исправить курс. «Да» и «нет» «говорят» в вычислительной машине особые элементы. Нечто подобное представляет собой водопроводный кран. Он может пропускать воду, когда кран открыт («да»), или не пропускать ее, когда кран закрыт («нет»). Это называется системой с двумя положениями. А вот еще пример: электрическая лампочка. Она горит или бездействует, когда выключена. Тоже система с двумя положениями. В радиоприемниках имеются электронные лампы — тоже приборы с двумя возможными положениями. Если через лампу идет ток, то говорят, что она открыта. Лампа не пропускает тока — закрыта. Вот и два ответа. Открыта — значит «да». Закрыта — значит «нет». Сначала электронно-вычислительные машины делали на электронных лампах. Потом стали использовать полупроводники — транзисторы. Но вот ученые натолкнулись на сверхпроводимость. Очень интересное явление. Пока в проволочке небольшой ток, она может быть сверхпроводящей. А потом ток усилился, и магнитное поле убрало сверхпроводимость. Вот вам «да» и «нет». Так появились криотроны — сверхпроводящие элементы вычислительных машин — «думающие» ячейки. Слово «сверхпроводящие» указывает на то, как они работают. Когда надо говорить «да», криотрон — сверхпроводник, а когда «нет», он перестает быть сверхпроводником. Криотроны появились, когда ученые только еще начали нащупывать возможности сверхпроводимости. Самый первый криотрон был устроен так. Вокруг маленькой проволочки из редкого металла — тантала намотали вторую из еще более редкого — ниобия. Все это находилось в жидком гелии. Температура 4° К. Не жарко! В той и другой проволочке появляется сверхпроводимость. Только в тантале она как бы слабее. Ее легче разрушить магнитным полем. Поэтому, когда ток в проволочке из ниобия станет большим, танталовая проволочка перестанет быть сверхпроводящей из-за магнитного поля ниобия. Так и получается нечто вроде электронной лампы. Ток ниобия управляет током в тантале. То тантал сверхпроводник, то сверхпроводимости уже нет, в зависимости от того, сильный или слабый ток идет в ниобии. В нашей машине вместо криотронов действуют тончайшие пленки из полупроводников. В одном кубометре их больше миллиона. Получается маленький по размерам «электронный мозг». Работает он быстро, хорошо, энергии потребляет совсем немного. А это нам в корабле очень важно.
Но он тоже «сверхпроводящий». И требуется нашему «лоцману» сверххолодная каюта. Электронная машина охраняет нас от метеоритов и всяких неприятностей по дороге. Чуткие приборы-локаторы издалека замечают приближающийся метеорит. Сразу же об этом «узнает» электронный мозг. Он искусно маневрирует, за кратчайшее время успевает повернуть корабль — сторону, чтобы избежать столкновения. Потом следует самое главное. Надо восстановить правильное движение, снова попасть на трассу. Мозг справляется и с этой задачей. В машинной «памяти» тоже стоят сверхпроводящие пленки. Они быстро работают, места занимают мало. В общем, электронный мозг — замечательное существо. Так и хочется сказать — живое. Столько он умеет, столько делает и как быстро «думает»! Человек не успел бы даже пошевельнуться, а машина уже изменила движение космического корабля, он извернулся, обошел стремительный метеорит и снова лег на прежний курс! Летать нам также помогают сверхнизкие температуры. Наш корабль двигается с помощью жидкого водорода и жидкого гелия. Сначала обычная ракета выносит его за пределы земного притяжения. Ракета сделала свое дело и сгорела. Настала очередь наших собственных двигателей. Это двигатели атомные. Ракетный двигатель работает, как обитатель морей — каракатица или осьминог, иначе именуемый кракеном. Он выбрасывает струю воды и движется в противоположном направлении. Из сопла ракеты летит раскаленная струя газа, а сама ракета стремительно удаляется ввысь. Чем больше скорость выбрасываемой струи, тем большую скорость дополнительно получит ракета. Ракета может двигаться где угодно. В воздухе, без воздуха, около Венеры, Марса, в далеких звездных мирах. Ей это в высшей степени безразлично! В атомной ракете главное действующее лицо — атомный котел. Он и есть источник энергии. Урановое горючее расположено в замедлителе. В котле постоянно выделяется энергия. Ее нужно забрать и передать топливу ракетному. Для этого мы и взяли с собой жидкий водород и гелий. Жидкие газы занимают меньше места. Топливо пускают в атомный котел, жидкость моментально становится газом, сильно нагревается, и горячий газ пестрым веером вылетает из сопел. Так действует наш ракетный двигатель. Мы постепенно разгоняемся все больше и больше.
Ракеты сегодня
Наше путешествие закончилось. Мы прибыли на… Землю. Земля 1965 года. Но это уже не привычная планета, которую обживают люди. Нет, с первых полетов советских искусственных спутников Земля — стартовая площадка для путешествий в космос. И корабль предыдущих страниц этой книги, может быть, уже строится. Может быть, его контуры начерчены у конструкторов на плотных листах ватманской бумаги. Мы с вами летали с помощью сверххолода. Действительно ли будет так — угадать трудно. Но для низких температур хватает дела и сегодня. Без жидких газов не обходится почти ни один полет ракеты и запуск спутника или могучего космического корабля. Это великолепное, фантастическое зрелище. Ничего подобного нигде не увидишь. На платформе — грандиозная сигара. Она устремилась вверх — туда, куда ринется через несколько минут. Раздается команда, а за ней страшный взрыв. Из-под сигары летят клубы пламени и дыма. Плавно, словно нехотя, ракета отделяется от Земли и величественно поднимается. Через несколько секунд она уже несется стремглав, нам виден только огромный «хвост» — путь ракеты в атмосфере Земли. Пока что все ракеты термохимические. Как они работают, мы уже говорили. С громадной скоростью вылетают из сопел ракеты частички газов. Стремительным веером разносятся в пространстве, пылая ярким пламенем. Они и создают тягу, они и увлекают ракету вперед, ввысь. При виде этого «загоревшегося» неба невольно думаешь: «Где уж тут искать низкие температуры!» Но, между прочим, температура некоторых частей водородной бомбы за секунду до взрыва тоже немногим отличается от абсолютного нуля. Топливо часто состоит из двух частей: горючее и окислитель. Роль горючего ясна — сгорая, оно и образует газы, которые так стремительно вырываются из ракеты. Чтобы лучше использовать горючее, его смешивают с окислителем. Помните, в доменную печь вдувают кислород. Чтобы уголь сгорел там лучше, чтобы поменьше его тратить. Но там можно просто сжечь побольше топлива. А вот для ракеты важны первые секунды, когда она набирает скорость. Надо сжечь топливо побыстрее и получше. Поэтому обязательно нужен окислитель. Что же из них жидкий газ? Иногда и то и другое. Конечно, понятно, почему берут именно жидкие газы. Меньше занимают места — вот в чем дело. Прекрасное горючее — жидкий водород. Правда, работать с ним надо осторожно. Уж больно он капризен. Чуть что — грозит взрывом. А потом еще одна неприятность. Водород любит очень низкую температуру. Чуть мы зашли выше 21 градуса Кельвина — прощай жидкость. Водород быстро вскипает. А это уже не годится. Газ может буквально в щепки разнести баллон, в котором до сей поры он благополучно существовал. Надо следить за температурой, не допускать тепло к газу, изолировать баллон. Значит, нужна сильная теплоизоляция. И ракета станет тяжелее. Поэтому поступают когда как. У одних ракет горючее — газ, у других — твердый порошок. Но окислитель — обязательно сжиженный газ. Чаще всего кислород. Например, в Америке почти вся продукция «фабрик жидкого кислорода» идет прямо на ракетодромы. Есть еще один прекрасный окислитель. Но вот беда — связываться с ним очень неприятно. Мы уже встречались с инертными газами. Не правда ли — удобные вещества? Можно за них не беспокоиться. Поместить в любой сосуд, оставить по соседству с любым веществом. Ничего не случится. Но существует очень деятельный элемент, пожалуй, самый ехидный элемент на свете. Имя ему — фтор. Это — все разъедающий газ. Он вступает в реакцию с чем угодно и когда угодно. Чтобы хранить фтор, придумывают специальные сосуды из парафина или покрывают стенки сосудов особыми оболочками из соединений фтора. С ними он уже не может соединяться. Одним словом, хлопот этот газ доставляет очень много. От фтора могут пострадать не только уголь или дерево, стекло, бетон, несгораемый асбест. Даже вода и та иногда загорается, если поблизости появится фтор. Ко всем прочим прелестям фтор еще очень ядовит. Вот почему жидкий фтор используется не так уж часто.«Мозг» страны сверххолода
Низкими температурами занимаются давно. Даже сверхпроводимости уже стукнуло пятьдесят лет. Вполне солидный возраст. Ученые всего мира изучают эту таинственную область, следят за поведением веществ, попавших в опасную близость абсолютного нуля, ищут новые способы понижать, измерять и удерживать температуру. Самый главный научный центр, где занимаются сверххолодом, находится в нашей стране. На одной из улиц Москвы в тени деревьев стоит небольшое здание. Физики всего мира, занимающиеся сверхнизкими температурами, хорошо знают этот дом. Здесь находится Институт физических проблем Академии наук СССР, здесь работают замечательные ученые, пионеры физики сверхнизких температур. В институте много рабочих помещений. Входишь в комнату, в каждой — разнообразные приборы, различное оборудование — как будто ничего общего. Кроме одного: везде стоят дьюары, дымится жидкий газ — азот, водород, гелий. Чаще ученые работают с жидким гелием: ведь их интересуют самые низкие температуры. Но вот мы увидели совершенно пустую комнату. Ни одного прибора. Сидят люди за столами, пишут что-то на бумаге. Никаких опытов, никаких установок. Вроде ничего интересного. А между тем именно здесь физики-теоретики изучают чудеса сверххолода. Изучают и объясняют. В Институте физических проблем работает замечательный советский физик академик Д. А. Ландау. Можно сказать, что он самый видный советский физик-теоретик. В 1963 году академику Ландау вручили сразу две крупнейшие премии: Ленинскую — высшую премию в нашей стране и Нобелевскую — высшую мировую премию по физике за 1962 год. Нобелевский комитет заявил, что Ландау получает премию за работы по сверхтекучести гелия.
Вот об этих работах мы и поговорим. Но разговор придется начать издалека. Примерно с того места, где мы вообще начали рассуждения о веществе и температуре. При сверхнизких температурах происходят различные чудесные превращения. Но случайно ли это? Конечно, нет. Ученые давно предвидели, что вблизи абсолютного нуля должно начаться нечто необычайное. Предвидеть предвидели, а вот объяснили не сразу. Любое вещество состоит из множества атомов и молекул. В том, как оно себя ведет, виноваты именно молекулы. Ведь от движения молекул зависят и температура и выбор, чем быть веществу — твердым телом, жидкостью, газом, плазмой. При высоких температурах молекулы движутся очень быстро, взаимодействие между ними невелико, им можно пренебречь. Но чем температура тела меньше, тем большее значение приобретает именно взаимодействие частиц. Тут-то и проявляются некоторые тонкие свойства вещества. Когда молекулы движутся быстро, эти свойства остаются незамеченными. Но когда температура приближается к абсолютному нулю, нужно вспомнить, что любое вещество состоит из отдельных молекул и что молекулы и атомы живут своеобразной жизнью. Причем многое из того, что с ними происходит, случается как раз из-за взаимодействия, из-за сложной связи друг с другом. Советский писатель Даниил Данин написал замечательную книгу о современной физике. Называется она — «Неизбежность странного мира». Данин рассказывает в своей книге о «странном мире» атомов, о каких-то, на первый взгляд, несообразных законах, которым они подчиняются. «Свод законов» для атомов называется квантовой механикой. Это уже третий в нашем рассказе. Первому подчинялись все молекулы, второму — газы. А теперь настала очередь атомов. Мир атомов, оказывается, тоже особенный мир. Скажем, частица, вырываясь из недр атома, совершает «туннельный переход». Это что-то вроде лыжника, который, вместо того чтобы перевалить через гору, странным неведомым путем оказывается на другой стороне ее, минуя вершину. Мы с вами такого чуда совершить не сможем. А для частицы это вполне доступное путешествие. Или, например, такой запрет — измерил скорость частицы, но не можешь определить, где она находится. Для обычной классической механики, к которой люди привыкли на протяжении столетий, квантовая механика кажется наукой наоборот. Но что поделаешь, такова природа микромира — «странного мира» мельчайших частиц вещества. Чем больше энергия частиц, чем выше температура тела, тем ближе законы, определяющие их совместное поведение к обычным законам механики — науки, изучающей движение тел. А самый главный закон — основа квантовой механики и вообще квантовой теории — состоит вот в чем. Энергия, о которой мы много говорили, передается от одного тела к другому только определенными порциями — квантами. Это напоминает наши денежные расчеты. Нельзя заплатить за карандаш 3,5 копейки. Или 7 1/4 копейки. Меньше, чем копейка, меры денег у нас нет. Так и в обращении между молекулами и атомами. Они могут передавать энергию только определенными порциями. Самая маленькая порция называется квантом. Можно отдать или получить три кванта, десять квантов, тринадцать квантов. Но нельзя отдать, скажем, два с половиной Кванта. Квантовая теория замечательно объяснила многие совершенно непонятные факты. Она изучает не только поведение отдельных частиц, но и вещества в целом. Когда атомов или молекул много, да еще температура высокая, мы не чувствуем многих тонких квантовых эффектов. Зато, когда температура понижается, их становится все больше. Вот почему при сверхнизких температурах и оказалось столько чудесного. Движутся частицы медленно, почти замерли. Уже нельзя пренебрегать их взаимодействием. Тут-то квантовые законы сильны, как нигде. Частицы объединяются, двигаются вместе. Ученые образно назвали эти объединения ансамблями. Это не молекулы и не сборища одинаковых молекул — вещество, а просто временные объединения частиц. Много таинственного в области сверххолода разъяснилось, когда стали рассматривать поведение таких объединений. Ведь частицы объединяются не для того, чтобы просто побыть вместе. Они и так недалеко друг от друга. Ансамбль музыкантов занимается одним общим делом. Это оркестр. Так и ансамбль частиц — своеобразный «оркестр частиц». Но исполняют они самую различную «музыку». Сверхпроводимость и сверхтекучесть — свойства таких ансамблей. Но какие же частички входят туда? Молекулы? Атомы? Или частицы помельче — части разбитых атомов? В науке существует слово «квази». Квази — это вроде, что-то напоминающее. Академик Ландау предположил, что кванты энергии, которыми обмениваются различные тела, напоминают частицы. И назвал их квази-частицами. Затем он сделал еще более интересное предположение. В каждом веществе есть свои квази-частицы. И они образуют там свое собственное объединение. Называется оно — квази-газом. Молекулы кислорода составляют вещество — кислород. Молекулы водорода — водород. В этом самом кислороде есть и квази-частицы. Только свои, кислородные. Чем выше температура тела, тем больше в нем квази-частиц. Значит, когда вещество нагревается, у него прибывает количество квази-частиц. А когда остывает, их становится меньше. Только не подумайте, что тело при нагревании станет больше весить! Квази-частицы массой не обладают, они невесомы. Мы заметим, что их стало больше только по одному признаку: поднялась температура. Вот и все! Между прочим, это чем-то напоминает теплород. Помните, как представляли передачу тепла средневековые ученые? От теплого тела к холодному переходит особая жидкость — теплород. Чем ее больше, тем теплее тело, тем выше его температура. А здесь роль теплорода играют квази-частицы. Но, конечно, это не значит, что наука вернулась к старой, отвергнутой теории. Квази-частицы— это развитие квантовой теории, новой передовой теории микромира. Теплород считали определенным веществом. А квази-частицы для каждого тела свои собственные. При переходе квази-частиц от тела к телу они как-то изменяются. Когда температура тела невелика, число квази-частиц также невелико. Невелика и их энергия. Поэтому можно выяснить, как они себя будут вести, даже сделать некоторые точные подсчеты. Вот, например, как объяснили сверхтекучесть. Что такое трение жидкости о стенки сосуда? Передача энергии. Мы ведь говорили, что без трения автомобиль ездил бы по дорогам бесконечно долго. Можно выключить мотор и путешествовать в свое удовольствие. Трения нет, нет потерь энергии, значит, и бензин не надо сжигать. Когда жидкость течет по трубкам, она отдает энергию стенкам этой трубки. Значит, с точки зрения нашей теории часть квази-частиц газа уходит в стенки. Если трубка очень узкая, газ квази-частиц будет испытывать трение о стенки. В трубку он не пойдет, туда просочатся только молекулы жидкого гелия. Гелий отбросит прочь все свои квази-частицы. Тогда и трения никакого не будет, нечем передавать энергию. Но освободившись от свиты квази-частиц, гелий охладится еще больше. Не правда ли — простое объяснение! Но это все до поры до времени, как утверждает академик Ландау. Стоит только повысить температуру, скорость частиц гелия увеличится. И сразу же появятся новые квази-частицы. Тогда, конечно, вернется и трение. Так объясняют советские ученые сложное явление сверхтекучести. Но сверхпроводимость долгое время оставалась загадкой. Вспомним, почему металлы проводники? А, скажем, дерево не проводит электрический ток. Внутри металла существует электронный газ. Иногда говорят и об электронной жидкости. Сначала ученые предположили, что сверхпроводимость просто сверхтекучесть этой самой электронной жидкости. Но это объяснение оказалось не очень убедительным. Физики произвели сложные подсчеты и выяснили, что жидкость электронная сильно отличается от других. Как бы она ни двигалась, как бы мы ее ни охлаждали, квази-частицы электронной жидкости никогда не исчезнут. Ясно, что никакой сверхтекучести тут и быть не может. Долго ломали головы над этим тупиком. Потом вдруг появилось решение: что, если квази-частицы электронной жидкости иногда соединятся парами? Может, им так удобнее будет? Тогда они очень напомнят квази-частицы жидкого гелия, которые, оказывается, предпочитают именно парное движение. И таким образом можно объединить сверхтекучесть и сверхпроводимость. Так и оказалось. Все идет, как обычно, пока температура сравнительно велика. (Это, конечно, с точки зрения абсолютного нуля. Какие-нибудь —250 градусов Цельсия!) Что значит обычно? Температура падает, и сопротивление немного понижается. Но вот мы перешли границу. Повинуясь каким-то своим законам, квази-частицы электронной жидкости дружно объединились парами. Электронная жидкость мгновенно стала сверхтекучей. Теперь путь для нее в проводнике полностью свободен. Сопротивления нет. Ничто больше не мешает электрическому току. Он может идти вечно, на радость конструкторам мощных электромагнитов! Точную теорию сверхпроводимости развил советский математик и физик — академик Николай Николаевич Боголюбов. Мы не зря сказали, что он физик и математик. Академик. Боголюбов работает, как теперь говорят, на стыке наук. Тут математика так тесно смыкается с физикой, что трудно порой определить, к какому же разделу науки относятся эти вопросы и их решения. Теория сверхпроводимости не простая: она сложна математически. Но в двух словах можно сказать о ней так. Когда электронам металла становится «очень холодно», они начинают двигаться парами. А чтобы такие пары затормозить, надо их разорвать, разъединить, то есть совершить работу. Сделать это в таких условиях нельзя, слишком мала температура электронной жидкости. Так и гуляют электроны парами без сопротивления. Новая теория сверхпроводимости не только хорошо объяснила все, что до сих пор казалось непонятным и неясным. Ученые предсказали новые явления. И вскоре экспериментаторы их обнаружили. Это было блестящей победой теории. Ведь любая теория должна не только объяснять эффекты уже обнаруженные, но и предсказывать новые. Тогда она особенно ценна.
Экспериментальные заботы
Настала пора посмотреть, как же практически ученые работаютпри сверхнизких температурах, как они действуют в этих необычных условиях, что изучают, что измеряют. Это будет встреча с абсолютным нулем «лицом к лицу». Пройдемся по лабораториям института физических проблем. Это передовой фронт большой науки — физики низких температур. Ученые изучают тут поведение различных веществ в необычных условиях сверххолода. Ведь еще не все изучено, еще не все ученые поняли. Вот, например, металлы. Раньше считали, что сверхпроводимость наступает отнюдь не у всех, что это удел избранных. А вдруг оказалось, что очень чистые металлы, раньше никакими странностями не отличавшиеся, тоже становятся сверхпроводниками. Надо только как следует очистить их от примесей. В криостатах залит жидкий гелий. Но температуры, при которой он появляется — конденсируется, исследователям мало. Поэтому с жидким гелием производят различные манипуляции, чтобы температура упала еще ниже. Один градус, десятые, даже сотые доли градуса Кельвина — вот с каким «холодом» имеют дело ученые. Жидкий гелий производят тут же, на месте. И жидкий азот в институте также готовят сами. Две фабрики жидких газов расположены рядом. Азот появляется, как обычно, в ректификационной колонне. А жидкий гелий получают из привозного газа. Большие газовые баллоны, затем компрессоры, и газ под давлением попадает в турбодетандер. Сорок литров жидкого гелия в час — продукция этого «завода». Жидкого азота нужно, конечно, больше. Чтобы сохранить подольше температуру гелия, надо оградить его жидким газом. Вообще говоря, можно использовать водород. Но мы знаем про коварство этого вещества. Водород легко взрывается. Работа с жидким водородом требует различных предосторожностей. Другое дело — жидкий азот. Вот он покоится в большом металлическом дьюаре. Правда, с виду и азот ведет себя беспокойно: кипит на воздухе. Небольшие струйки пара вырываются наружу. Но это никого не пугает. Выплеснем из дьюара немного жидкости. Смешные шарики покатились по полу. И через секунду испарились. Жидким азотом брызнем на руку. Ничего страшного не произойдет! Мимолетный небольшой ожог, как будто легонько прошлись по руке крапивой. От тепла человеческого тела жидкий азот мгновенно вскипает. И серьезных неприятностей причинить не может. Правда, особенно зевать не надо. Все-таки температура почти что минус 200 градусов! Криостаты, в которых ученые добиваются встречи с абсолютным нулем, на вид довольно простые. В большом дьюаре — жидкий азот. Внутри его дьюар меньшего размера. В нем — жидкий гелий. От этого дьюара тянутся трубы насосов. Если откачивать жидкий гелий, можно еще сильнее понизить температуру. Ведь и в этом случае самые быстрые молекулы улетучатся. Значит, жидкость станет еще холоднее. Так и добираются ученые до десятых долей градуса. То есть к самому-самому абсолютному нулю. На одной из установок нас встретил твердый гелий. У атомов гелия также есть две разновидности — два изотопа. Они называются гелий-3 и гелий-4 (Не-3 и Не-4). Цифры 3 и 4 означают, что атом гелия в три или четыре раза тяжелее атома самого легкого элемента — водорода. Гелий-3 начали изучать совсем недавно. Толком узнали его лишь за последние десять лет. Он оказался куда «покладистее» обычного изотопа — гелия-4. Например, легко замерзает, превращается в твердое тело. Сверхтекучести в нем нет. Кроме того, этот редкий изотоп отличается еще рядом особенных свойств. Вот почему ученые рьяно взялись за изучение именно гелия-3. В окуляры зрительной трубы видна небольшая трубочка. Там две линии перехода. Две потому, что внизу расположен гелий-4, а сверху него немного жидкого гелия-3. Они замерзают при разных температурах. Температура понижается. И вот жидкость мутнеет. Это кристаллики твердого гелия заполнили трубку. Температура поднялась, снова перед глазами жидкость. Как-то странно себя чувствуешь, когда вот тут, рядом с тобой, расположены такие сказочно низкие температуры. А представьте себе, что этот холод вдруг выскочит из своего помещения, из криостата, и ринется в комнату. Даже страшно подумать! Мигом все бы обледенело. Ни одного живого существа не осталось бы вокруг! Когда-то давно ученые стремились получить очень низкие температуры, добраться до них. Теперь это не проблема. Теперь они хорошо умеют это делать. И уже используют сверххолод для того, чтобы получше изучить строение вещества. Ведь в сверххолоде и разыгрываются странные процессы и некоторые свойства веществ проявляются особенно ярко. Скорости движения молекул малы, и самые сокровенные действия их становятся открытиями. Тут изучают и электрические свойства вещества, и магнитные. Добираются даже до атомных ядер. С ними тоже происходят различные интересные превращения, когда вещество попадает в непосредственную близость к абсолютному нулю. И каждый раз ученые обнаруживают еще что-то интересное, что-то полезное. Сверххолод уже принес людям очень много добра. В его присутствии осуществляются порой самые смелые фантазии. Взять хотя бы эту.Сверххолод и тепловой луч
Сверххолод и сверхжара. Температура, при которой замерзает все живое и почти все неживое. И вдруг из этих чертогов Снежной Королевы летит тонкий луч, для которого нет никаких преград, луч, сжигающий все на своем пути. Помните, в замечательной повести Алексея Толстого два человека рассматривают металлическую доску, на которой прожжены слова: «Инженер Гарин… проба»… Гиперболоид инженера Гарина? Да, это сделал инженер Гарин — изобретатель, решивший стать Владыкой Мира. Прибор, о котором мы расскажем, в принципе другой. Но внешне они похожи. Гиперболоид, придуманный писателем Алексеем Толстым, и лазер, рожденный советскими учеными Басовым и Прохоровым, получившими недавно за эту работу звание лауреатов Ленинской премии. Скоро подобные «гиперболоиды» пойдут на заводы, займут место на космических кораблях и далеких маяках межпланетных и межзвездных трасс. Многие из них наденут на себя чехол из сверххолода.

Десять лет тому назад ученым стало ясно, что этот аппарат совсем не выдумка досужего ума. Его можно и нужно сделать. Только, разумеется, совсем не для того, чтобы уничтожать, сжигать, душить. Созидательный труд — вот чем займутся световые лучи. Луч лазера уже сейчас обрабатывает металлы и самые твердые материалы: режет, сваривает, сверлит тончайшие отверстия. В будущем световой луч, собранный в тонкий пучок, полетит на миллиарды километров не ослабевая, придет к месту назначения таким же, каким и вышел. Космическая связь, связь на Земле, может быть, передача на расстоянии энергии — без проводов, без потерь! Как же это все происходит? И при чем здесь абсолютный нуль? С первых страниц этой книги мы уже не раз говорили, что Природа наполнила все тела энергией. Но сделала это весьма осторожно. Запасов энергии у тела хоть отбавляй. А вот отдать ее оно может далеко не всегда. Кладовых вокруг нас много. Но вот попробуйте открыть их. Замки — невероятно хитрые, ключи потеряны, у дверей поставлены могучие часовые. Но человек и умнее и сильнее этих стражей. Так постепенно открываются заветные двери, освобождается веками скрытая энергия. Сначала люди научились получать энергию, сжигая горючие вещества. При этом мы пользуемся лишь крошечной частицей энергии, скрытой в них. Затем добрались до энергии атомной, термоядерной. А на очереди еще много других «отсеков» кладовой энергии, заполненных еще богаче, еще больше. И молекулы и атомы обмениваются энергией, передают ее только определенными порциями — квантами. Мы помним, что это один из главных законов «странного» микромира — мира мельчайших частичек. Молекулы как бы напоминают сосуд с черточками на стенках. Можно доливать сосуд только до определенной черты. Мало нальешь — он запросит еще, много нальешь — как только представится возможность, сосуд избавится от лишнего. «Содержимое» сосуда — это энергия. Ученые говорят так: каждой черточке соответствует определенный запас энергии молекулы. Молекула может переходить из одного состояния в другое. В этом случае она или отдает энергию или получает ее. Иногда эта энергия может излучаться в виде квантов, например, всем известного тепла. Именно так Солнце обогревает Землю. А иногда молекулы могут отдавать энергию радиоволнами. Это все было известно давно. Но советские ученые Басов и Прохоров и американец Таунс доказали, что можно собрать всю энергию, которую излучают миллиарды молекул какого-нибудь тела, в один узкий пучок. Каждая молекула выдает совсем крошечную порцию энергии. Какая-нибудь мельчайшая букашка и то наработает больше. Но когда все эти лучи сольются в один тонкий луч, то такому лучу позавидовал бы инженер Гарин! Помните зажигательное стекло? Поймали мы солнечные лучи и направили их в одну точку. Температура в этой точке разом подскочит. Дерево можно прожечь насквозь. Но собираются лучи только в точку. Устройство советских физиков преобразует излучение молекул в тончайший луч. Его можно забросить как угодно далеко. Хоть за сто километров, хоть за миллиард! И заполнить энергией до отказа. С помощью зажигательного стекла мы собираем световую энергию, которая падает на него. Если все эти лучи соберутся в одну точку, температура там поднимется очень сильно. То же самое происходит и с лучом, который несет излучение молекул. Разница заключается еще в одном. Сами по себе молекулы не хотят излучать. Им надо все время подбрасывать энергию. Лишь тогда излучение будет непрерывным. Стоит только перестать «кормить» молекулярный излучатель, и разом потухнет чудесный луч. Так и зажигательное стекло перестанет действовать, стоит лишь солнцу зайти за тучу. Вот при этом и не обойтись без сверххолода. В современных «гиперболоидах» работают газы. Для холода не нужно. А вот для кристаллов и особенно полупроводников подавай самые низкие температуры, какие только возможны. Чем ближе к абсолютному нулю, тем лучше работают такие установки. Конечно, не любое твердое тело можно выбрать излучателем. Годятся кристаллы, у которых есть слабые магнитные свойства. Железо, например, очень активно реагирует на магнитное поле. Стоит только затронуть кусок железа магнитным полем, сразу же он сам становится сильным магнитом. А вот кристаллы красивого изумруда или рубина во много раз слабее железа. Но все-таки магнитное поле усиливают. И чем больше энергии сумели мы передать молекулам, тем больше ее будет в пучке. Он может стать страшным, прорезать толщу стали, пробивать самую крепкую броню, какая и не снилась инженеру Гарину. Но не стоит думать об этом. Лазеры должны служить делу мира. Так это и будет!
Вот мы и у цели
Спускались мы к абсолютному нулю довольно долго. Зато пробыли в гостях у него порядочно. Но это только экскурсия. Мы узнали лишь небольшую долю тех чудес, что все время происходят в этом оригинальном, не похожем ни на что мире. Правда, за последние годы со сверххолода слетела пелена таинственности. Уже не только ученые, а рабочие на заводах уверенно и спокойно пользуются температурами, о которых еще недавно с таким почтением писали научные журналы. Не только жидкий воздух, кислород и азот, к которым все уже давно привыкли, но и жидкий гелий становится постоянным и трудолюбивым помощником человека. Когда настанет ваша очередь сменить отцов и старших братьев, вы в этом убедитесь. Поэтому стоит не прощаться с абсолютным нулем, а сказать ему — до свидания!


Последние комментарии
12 часов 42 минут назад
21 часов 34 минут назад
21 часов 37 минут назад
3 дней 4 часов назад
3 дней 8 часов назад
3 дней 10 часов назад