Гинекология [Сергей Николаевич Занько] (fb2) читать онлайн
[Настройки текста] [Cбросить фильтры]
[Оглавление]
Предисловие
Углубление научных представлений о физиологии и патологии репродуктивной системы женщин в различные возрастные периоды, особенности современного течения гинекологических заболеваний, внедрение новых методов обследования и лечения в гинекологии требуют усовершенствования учебной литературы. Структура гинекологической патологии в последние десятилетия характеризуется высокой частотой инфекций, передающихся половым путем, ростом эндометриоза и нарушений гормональной функции яичников.К сожалению, патология, которая в прошлые годы расценивалась специалистами как вторичное осложнение, сегодня становится причиной визита к гинекологу. Нередко основной жалобой при обращении к гинекологу является нарушение репродуктивной функции. При обследовании гинекологических больных рутинными стали методы ультразвуковой и эндоскопической диагностики. Значительно расширились возможности микробиологического обследования и идентификации возбудителей инфекционных заболеваний и определение их чувствительности к антиинфекционным препаратам. В гинекологическую практику вошли новые методы визуальной диагностики – компьютерная томография, магнитноядерная резонансная томография, денситометрия.
Сегодня работающему врачу необходимо знание современных методов обследования для постановки диагноза с использованием доступных методов лабораторной и инструментальной диагностики.
Изменился спектр лечебных средств, применяемых для терапии гинекологических заболеваний. В первую очередь это относится к новым гормональным препаратам, позволяющим проводить патогенетическое воздействие при патологических процессах репродуктивной системы женщин. Для лечения бесплодия широко используются высокоэффективные методы вспомогательных репродуктивных технологий. Значительное число пациенток нуждается в выборе метода контрацепции, а в период пери– и постменопаузы – метода заместительной гормональной терапии.
В книге обобщены данные литературы последних лет и собственный опыт авторов по диагностике и лечению гинекологической патологии, сделан акцент на особенности ведения женщин различных возрастных групп. Авторы надеются, что эта книга будет полезна акушерам–гинекологам, студентам медицинских вузов и врачам смежных специальностей.
Авторы стремились к наиболее полному изложению новых и важных в практическом отношении вопросов диагностики и лечения гинекологической патологии, в ряде случаев опуская вопросы этиологии, патогенеза и клинической картины заболеваний, подробно описанные в других руководствах. В списке литературы приведены основные источники, использованные при подготовке руководства.
В авторский коллектив вошли специалисты кафедр акушерства и гинекологии Витебского государственного медицинского университета, имеющие большой практический, педагогический и научно–исследовательский опыт в различных областях гинекологии.
В процессе работы над рукописью материал распределился следующим образом: предисловие, введение и глава «Организация гинекологической помощи населению» (профессор С.Н. Занько), «Анатомо–физиологические особенности половых органов женщины в различные возрастные периоды» (доцент Е. Д. Кожар), «Методы обследования в гинекологии» (профессор Т. С. Дивакова, доцент Л.Д. Ржеусская), «Детская и подростковая гинекология» (профессор Н.П. Жукова), «Гинекологическая эндокринология (доцент Т.Н. Мацуганова), «Воспалительные заболевания женских половых органов (профессор И.М. Арестова), «Вопросы планирования семьи» (профессор Л.Е. Радецкая), «Доброкачественные и пограничные заболевания женских половых органов» (доцент В.И. Харленок, доцент Н.С. Дейкало), «Эндометриоз» (профессор Л.Я. Супрун), «Бесплодный брак» (доцент Л.Д. Ржеусская), «Аномалии положения половых органов» (профессор Н.И. Кисилева), «Неотложные состояния в гинекологии» (доцент Е.Д. Кожар, доцент А.К. Семенюк), «Оперативная гинекология», «Некоторые вопросы урогинекологии» (доцент А.Г. Бресский), «Принципы реабилитации и врачебно–трудовой экспертизы» (доцент И.Г. Рандаренко).
Авторы выражают благодарность рецензентам, а также коллегам за предложения, направленные на усовершенствование книги. Все возможные критические замечания и предложения по содержанию учебника будут внимательно рассмотрены.
Профессор С.Н. Занько
Список сокращений
АГС – арреногенитальный синдром АКТГ – адренокортикотропный гормон АТ–ТПО – антитела к тиреоидной пероксидазе ВЗНЭ – воспалительные заболевания неспецифической этиологии ВЗПО – воспалительные заболевания половых органов ВКК – врачебно–консультативная комиссия ВМС – внутриматочное противозачаточное средство ВПР – врожденные пороки развития ВТЭК – врачебно–трудовая экспертная комиссия ГВЗ – гнойно–воспалительные заболевания ГВЗПМ – гнойные воспалительные заболевания придатков матки ГРЛ – гнойно–резорбционная лихорадка ГСГ – гистеросальпингография ГТ – гонадотропины ДА – дофамин ДВС – диссеминированное внутрисосудистое свертывание ДИН – динорфины ДМК – дисфукциональные маточные кровотечения ДЭА – дегидроэпиандростерон Е1 – эстрон Е2 – 17р–эстрадиол Е3 – эстриол ЗГТ – заместительная гормональная терапия ЗПР – задержка полового созревания ИБС – ишемическая болезнь сердца ИМТ – индекс массы тела ИР – индекс резистентности ИС – индекс зрелости ИЦН – истмико–цервикальная недостаточность КПИ – кариопикнотический индекс КС – климактерический синдром КТ – компьютерная томография КТР – копчико–теменной размер КУФ–облучение – коротковолновое ультрафиолетовое облучение КЭ – катехол–эстрогены ЛГ – лютеинизирующий гормон ЛПОНП – липопротеины очень низкой плотности МИС – мюллерова субстанция МКБ – международная классификация болезней МРТ – магниторезонансная томография МСГ – метросальпингография НА – норадреналин НВ – неспецифический вагинит НОЭС – нейрообменно–эндокринный синдром НПВС – нестероидные противовоспалительные средства НТ – нейротрансмиттеры ОДН – острая дыхательная недостаточность ОК – оральные контрацептивы ОПН – острая почечная недостаточность ОЦК – объем циркулирующей крови ПВИ – папилломавирусная инфекция ПИ – пульсационный индекс ПИФ – пролактинингибирующий фактор ПГФ2а – простагландины 2а ПКЯ – поликистозные яичники ПМП – переменное магнитное поле ППР – преждевременное половое развитие ПРЛ – пролактин ПСГ – половые стероидные гормоны Р – релаксин РГ–ЛГ – рилизинг–гормон лютеинизирующего гормона РЭГ – реоэнцефалография СОЭ – скорость оседания эритроцитов СПКЯ – синдром поликистозных яичников СРЯ – синдром резистентных яичников СТГ – соматотропный гормон СЭФР – сосудистый эндотелиальный фактор роста Т3 – трийодтиронин Т4 – тироксин ТСГ – тироксинсвязывающий глобулин ТСПА – тироксинсвязывающий преальбулин ТТГ – тиреотропный гормон ТФР – трансформирующий фактор роста УЗИ – ультразвуковое исследование ФАП – фельдшерско–акушерский пункт ФСГ – фолликулостимулирующий гормон ХВЗГ – хронические воспалительные заболевания гениталий ХГТ – хорионический гонадотропин ЦРБ – центральная районная больница ЧМГ – человеческий менопаузальный гонадотропин Э – эстрогены ЭИ – эозинофильный индекс ЭКГ – электрокардиография ЭНД – эндорфины ЭНК – энкефалин ЭОП – эндогенные опиоидные пептиды ЭФР – дермальный фактор роста ЭЭГ – электроэнцефалография ЮК – ювенильные кровотечения 17–КС – 17–кетостероидыВведение
В современном представлении гинекологию следует рассматривать как науку о женщине (от лат. gyne – женщина, logos – наука). В таком широком понимании гинекология является клинико–биологической дисциплиной, изучающей анатомо–физиологические особенности женской половой системы и весь комплекс специфичных для женщины физиологических и патологических процессов. Это позволяет разрабатывать методы профилактики, диагностики, терапии и реабилитационного лечения. Наиболее древняя отрасль этой дисциплины посвящена изучению детородной функции и составляет ее раздел – акушерство. Современная гинекология и акушерство составляют единую клиническую дисциплину.Гинекология – это наука о физиологии и патологии женской половой системы, состоянии и деятельности женских половых органов в нормальных и патологических условиях, присущих женщине биологических функциях, исключая деторождение.
Важной частью гинекологии как клинической дисциплины является общая гинекология. В ее задачу входит освещение симптоматологии и диагностики гинекологических заболеваний, их профилактика, а также методы терапии гинекологических больных. Общая гинекология включает описание важнейших симптомов гинекологических заболеваний генитального и экстрагенитального происхождения. Отсутствие в половых органах больной женщины отчетливо определяемых морфологических изменений не всегда исключает генитальную природу патологического процесса. Обширные патологические процессы могут иногда не вызывать значительных нарушений их деятельности, и, напротив, маловыраженные анатомотопографические изменения нередко сопровождаются значительными функциональными расстройствами.
В историческом плане гинекология является одной из древнейших медицинских наук. Первыми известными историческими литературными источниками являются египетские папирусы («гинекологический папирус») из Кахуна, датированные III в. до н.э.
Известны труды основоположника медицины Гиппократа (460–377 гг. до н. э.): «О природе женщины», «О женских болезнях», «О бесплодии». Многие ученые внесли вклад в развитие гинекологической науки: Филумен (I в. до н.э.), Авл Корнелий Цельс (I в. н.э.), Соран Эффеский (I в. н.э.), Авиценна (980–1037), Парацельс (1493–1541), Фаллопий (1532–1562), Амбруаз Паре (1517–1590).
Первым крупным русским ученым акушером–гинекологом был «медицины доктор повивального искусства» профессор Н.М. Максимович–Амбодик (1744–1812). Им написано оригинальное руководство «Искусство повивания, или наука о бабичьем деле», в котором освещены вопросы гинекологии, связанные с анатомией, физиологией, патологией и гигиеной женских половых органов.
В России долгое время гинекология являлась частью хирургии и только с XIX в. стала выделяться в самостоятельную клиническую дисциплину. Первое в России гинекологическое отделение было открыто при акушерской клинике Петербургской медико–хирургической академии. Наиболее яркими представителями Петербургской школы явились А.Я. Крассовский (1821–1898) – заведующий кафедрой акушерства и женских болезней Петербургской медико–хирургической академии, автор ряда фундаментальных трудов по оперативной гинекологии, основатель первого в России Петербургского общества акушеров–гинекологов и «Журнала акушерства и женских болезней»; Д.О. Отт (1855–1929) – директор Повивального института в Петербурге (ныне Институт акушерства и гинекологии имени Д.О. Отта), создатель нового направления в оперативной гинекологии. Последователями традиций петербургской школы являются такие известные в России и за рубежом ученые, как Э.К. Айламазян, Ю.В. Цвелев, Е.Ф. Кира, В.В. Абрамченко, В. П. Баскаков и др.
Огромный вклад в развитие гинекологии в России внесли представители московской школы. Одним из основоположников российской научной оперативной гинекологии является В.Ф. Снегирев (1847–1916) – основатель кафедры гинекологии Московского университета, специального гинекологического института усовершенствования врачей и Московского общества акушеров–гинекологов. Представители московской школы акушеров–гинекологов России и Советского Союза пользовались мировой известностью: А.П. Губарев (1855–1931), В.С. Груздев (1866–1938), Н.М. Побединский (1861–1923), М. С. Малиновский (1880–1976), Л.С. Персианинов (1908–1979). В настоящее время большой вклад в развитие гинекологии вносят такие российский ученые, как В.И. Кулаков, Г.М. Савельева, В.Н. Серов, В.П. Сметник, М.А. Репина, Е.А. Чернуха, В.И. Краснопольский, А.Н. Стрижаков, А.И. Давыдов и др.
Основоположником белорусской школы акушеров–гинекологов по праву считается воспитанник Гродненской медицинской академии первый профессор акушерства и женских болезней А. Матусевич (1760–1816). Первая кафедра акушерства и гинекологии в нашей стране была создана в 1923 г. на базе медицинского факультета Белорусского государственного университета, заведовал кафедрой профессор М.Л. Выдрин – автор ряда научных разработок и методик, получивших широкое распространение. В 1929 г. состоялся I съезд акушеров–гинекологов Белоруссии.
В Республике Беларусь подготовка акушеров–гинекологов в настоящее время ведется на кафедрах медицинских университетов и Гомельского медицинского института.
Огромный вклад в развитие белорусской школы акушеров–гинекологов и кафедры акушерства и гинекологии Белорусского государственного медицинского университета внесли академик Л.С. Персианинов и профессор И.М. Старовойтов. Под их руководством подготовлены многие известные ученые акушеры–гинекологи Беларуси: Г.И. Герасимович, И.В. Дуда, И.А. Макаренко, В.Т. Каминская. Продолжительное время кафедрой акушерства и гинекологии Минского медицинского института руководил профессор, академик Белорусской академии медицинских наук Г.И. Герасимович. Им подготовлены профессора Г.А. Лукашевич, Ю.К. Малевич, О.А. Пересада, Л.Ф. Можейко и более 30 кандидатов медицинских наук.
В настоящее время кафедрой руководит профессор Л.Ф. Можейко. Основные направления научных исследований кафедры акушерства и гинекологии Белоруссского государственного медицинского университета: герпетическая инфекция в акушерстве и гинекологии, гестозы, внутриутробная инфекция плода и новорожденного, миома матки, патология сократительной деятельности матки, патология послеродового периода, эндометриоз, детская гинекология, воспалительные процессы малого таза.
Основоположниками кафедры акушерства и гинекологии Витебского государственного медицинского университета являются профессора Г.Е. Гофман и Н.Ф. Лызиков. Под руководством профессора Н.Ф. Лызикова подготовлены профессора О.В. Осадчая и Л.Я. Супрун. Долгое время кафедрой акушерства и гинекологии Витебского медицинского университета руководила заслуженный деятель науки Беларуси профессор Л.Я. Супрун. Ею подготовлены профессора С.Н. Занько, Т.С. Дивакова, Л.Е. Радецкая, Е.И. Барановская, О.Н. Харкевич и около 20 кандидатов медицинских наук.
С 1999 г. кафедру возглавил профессор С.Н. Занько. Основные направления научных исследований кафедры акушерства и гинекологии Витебского государственного медицинского университета: эндометриоз, воспалительные заболевания половых органов, малоинвазивная реконструктивная хирургия малого таза, перинатальные инфекции, детская гинекология, разработка новых методов контрацепции. В университете издается Республиканский научно–практический журнал «Охрана материнства и детства», посвященный актуальным вопросам акушерства, гинекологии и педиатрии.
Кафедрой акушерства и гинекологии Гродненского государственного медицинского университета с момента основания руководил профессор М.В. Могилев. На кафедре подготовлены профессора В.С. Ракуть, К.И. Малевич, С. Л. Ващилко, З.А. Озерная, Н.А. Усоева.
С 1967 по 2003 г. кафедрой акушерства и гинекологии Гродненского медицинского университета заведовал профессор В.С. Ракуть. Основные направления научных исследований кафедры акушерства и гинекологии Гродненского государственного медицинского университета: гипотоническая болезнь у беременных, перинатология, гестозы, воспалительные заболевания половых органов. В настоящее время кафедрой руководит доцент Т.Ю. Егорова.
В 1993 г. в Гомельском медицинском институте открылась кафедра акушерства и гинекологии (ныне кафедра охраны материнства и детства), которую организовал и возглавлял до 2002 г. доцент Д.В. Введенский. Им подготовлено несколько кандидатов медицинских наук. Основное направление научных исследований кафедры акушерства и гинекологии Гомельского государственного медицинского университета – влияние радиации на репродуктивную систему у женщин. С 2002 г. заведует кафедрой профессор Е.И. Барановская.
Последипломная переподготовка врачей акушеров–гинекологов в Республике Беларусь проводится на кафедрах акушерства и гинекологии Белорусской медицинской академии последипломной образования и кафедре акушерства и гинекологии Витебского медицинского университета.
Кафедра акушерства и гинекологии Белорусской медицинской академии последипломного образования проводит подготовку врачей с 1945 г. Этот коллектив в разное время возглавляли известные отечественные ученые: И.С. Легенченко, Н.А. Шилко, В.Р. Линкевич, И.В. Дуда. С 1998 г. руководит кафедрой профессор С.Л. Воскресенский. Научными направлениями работы кафедры являются вопросы функциональной диагностики, реабилитации, патологии шейки матки и использование физиотерапевтических методов лечения в гинекологии.
Важная роль в развитии акушерства и гинекологии в Беларуси принадлежит Белорусскому научно–исследовательскому институту охраны материнства и детства, который был организован в 1931 г. В настоящее время институт возглавляет профессор Г.А. Шишко. В институте подготовлены доктора медицинских наук В.К. Зубович, С.Л. Воскресенский, О.Н. Харкевич. Основными направлениями научно–исследовательской работы акушерского отдела института являются: физиология сократительной деятельности матки, гестозы, детская реанимация и др.
Руководит акушерско–гинекологической работой в стране Главное управление лечебно–профилактической помощи детям и матерям Министерства здравоохранения Республики Беларусь, в состав которого входят два отдела: акушерско–гинекологической помощи и лечебно–профилактической помощи детям. Отдел акушерско–гинекологической помощи осуществляет организационно–методическое руководство акушерско–гинекологической работой путем издания приказов, рекомендаций, методических писем; планирует и осуществляет выезды для комплексной проверки деятельности учреждений и оказания практической помощи на местах; контролирует работу учреждений путем анализа годовых отчетов; планирует сеть акушерских и гинекологических коек, разрабатывает штатные нормативы лечебно–профилактических учреждений. Совместно с Управлением кадров разрабатывает программы подготовки врачебных и средних медицинских кадров учреждений родовспоможения; принимает активное участие в проектировании современных родильных домов и акушерско–гинекологических учреждений. Главное управление лечебно–профилактической помощи детям и матерям Министерства здравоохранения Республики Беларусь активно участвует в определении тематики научных исследований институтов и кафедр, а также во внедрении в практику новых методов обследования и лечения больных. Основные проблемы организации акушерско–гинекологической помощи обсуждаются на заседаниях коллегии Министерства здравоохранения Республики Беларусь.
Органы управления и учреждения родовспоможения работают совместно с кафедрами акушерства и гинекологии медицинских институтов. Научно–методические отделы научноисследовательских институтов анализируют деятельность акушерско–гинекологических учреждений, готовят методические указания и инструкции по различным вопросам акушерско–гинекологической практики.
Непосредственное руководство акушерско–гинекологическими учреждениями осуществляют соответствующие районные, городские, областные отделы здравоохранения. Подготовкой специалистов (врачи, акушерки) и внедрением достижений современной науки в практику занимаются главные специалисты – акушеры–гинекологи городских и областных отделов здравоохранения Министерства здравоохранения Республики Беларусь.
Глава 1. Организация гинекологической помощи населению
Амбулаторная и стационарная гинекологическая помощь
Организация гинекологической помощи в нашей стране базируется на основных принципах государственного здравоохранения и сводится к оказанию квалифицированной общедоступной и бесплатной медицинской помощи всем женщинам и профилактике гинекологической заболеваемости. Основными задачами охраны здоровья женского населения в области гинекологии являются: активное внедрение этапности в оказании стационарной помощи, развертывание сети стационаров для дневного пребывания больных, организация единых с терапевтами и педиатрами территориальных участков, расширение ассортимента платных услуг, развитие детской и подростковой гинекологии, повышение профилактической деятельности женских консультаций и др.Реализация всех этих мероприятий наряду с намечаемым ростом материально–технической базы, несомненно, будет способствовать дальнейшему повышению качества медицинской помощи гинекологическим больным.
Современный этап развития отечественной гинекологии характеризуется ее возрастающим медико–социальным значением.
Амбулаторная гинекологическая помощь оказывается пациенткам в женских консультациях, гинекологических кабинетах поликлиник и медико–санитарных частей на промышленных предприятиях, в ряде участковых больниц и на фельдшерско–акушерских пунктах (ФАП). Стационарную помощь женщины получают в гинекологических отделениях родильных домов, многопрофильных городских больниц, центральных и номерных районных больниц и медико–санитарных частей.
Женские консультации входят в состав родильных домов, городских поликлиник, медико–санитарных частей промышленных предприятий. Небольшое число консультаций существует на правах самостоятельных учреждений. Районные женские консультации обслуживают не только жительниц районного центра, но и всего района. Они оказывают лечебную помощь женщинам, непосредственно обращающимся по собственной инициативе за помощью в женскую консультацию, а также тем, которые направляются акушерками ФАП или врачами участковых больниц.
Женская консультация находится в отдельном типовом или приспособленном здании либо занимает часть здания, принадлежащего акушерскому стационару, поликлинике или медсанчасти. Помещения должны быть изолированными, чтобы исключить контакт беременных с больными женщинами.
Основными задачами женской консультации являются: ■ оказание квалифицированной акушерско–гинекологической помощи жителям прикрепленной территории ■ проведение работы по контрацепции ■ проведение мероприятий для предупреждения осложнений беременности, родов, послеродового периода, гинекологических заболеваний ■ внедрение в практику работы врачей современных методов диагностики и лечения патологической беременности, передовых форм и методов амбулаторной акушерско–гинекологической помощи ■ проведение санитарно–просветительной работы ■ обеспечение женщин правовой зашитой в соответствии с законодательством Республики Беларусь об охране материнства и детства ■ сохранение преемственности в обследовании и лечении беременных, родильниц и гинекологических больных; поддерживание систематической связи с родильным домом (отделением), станцией (отделением) скорой и неотложной медицинской помощи, поликлиникой и детской поликлиникой, а также с другими лечебно–профилактическими учреждениями (противотуберкулезным, кожно–венерологическим, онкологическим диспансерами и др.).
Мощность женской консультации определяется числом врачебных участков, которые создаются в соответствии с численностью жителей, количеством посещений врача женщинами и врачом женщин для оказания помощи на дому в течение дня.
Результаты специальных исследований свидетельствуют о том, что эффективность лечебно–профилактической работы выше в крупных женских консультациях, насчитывающих 10 и более врачебных участков, а также в женских консультациях, входящих в состав крупных многопрофильных поликлиник.
Для дальнейшего развития и совершенствования акушерско–гинекологической службы, в том числе поликлинической, целесообразно создавать лечебные комплексы, состоящие из многопрофильной больницы с акушерско–гинекологическим стационаром и мощной поликлиники с крупной женской консультацией.
Работа женской консультации строится по территориальноучастковому принципу. Один акушерский участок территориально включает приблизительно два терапевтических участка с числом жителей женского пола 4000–4500, в том числе старше 15 лет – 3000–3500, а детородного возраста (15–49 лет) – 2100. Обслуживают акушерский участок акушер–гинеколог и акушерка, которые принимают в год 7000–8000 девочек и женщин.
Благодаря территориально–участковому принципу работы участковый акушер–гинеколог может поддерживать постоянную связь с участковым терапевтом, терапевтом женской консультации и другими специалистами. Это способствует своевременному выявлению заболеваний у женщин, всестороннему их обследованию и установлению соответствующего режима и лечения, а за некоторыми из них – совместному диспансерному наблюдению.
Основная задача акушера–гинеколога женской консультации – оказание квалифицированной амбулаторной акушерско–гинекологической помощи жителям участка в женской консультации и на дому.
В соответствии с этим врач должен: ■ проводить лечебно–профилактические мероприятия для предупреждения осложнений беременности и гинекологических заболеваний на основе современных достижений науки и практики ■ осуществлять раннее выявление беременных женщин (до 12 недель беременности) и обеспечивать их диспансерное наблюдение ■ проводить профилактические гинекологические осмотры женщин с использованием современных методов исследования (кольпоскопического, цитологического и др.) для ранней диагностики и лечения гинекологических заболеваний ■ выявлять гинекологических больных, нуждающихся в стационарном лечении, и подготовку их к госпитализации; диспансеризацию гинекологических больных (своевременно брать на учет подлежащих диспансеризации, осуществлять лечебные и оздоровительные мероприятия) ■ проводить профилактику абортов (использование современных противозачаточных средств с целью предупреждения нежелательной беременности и др.) ■ оказывать акушерско–гинекологическую помощь преимущественно женщинам, работающим на промышленных предприятиях, в совхозах, в районе обслуживания участка ■ выявлять и отбирать гинекологических больных для направления на санаторно–курортное лечение ■ предоставлять своевременный отпуск по беременности и родам согласно действующему законодательству, больничный лист временной нетрудоспособности, направление на ВКК и ВТЭК в установленном порядке ■ проводить санитарно–просветительную работу среди жителей и организацию санитарного актива на своем участке.
Прием в женской консультации должен проводиться в удобное для жителей время (оптимально – с 8 до 20 ч). Распределение утренних и вечерних приемов между врачами и акушерками фиксируют в месячных графиках, которые утверждает руководитель учреждения. Обычно каждый врач имеет одинаковое число утренних и вечерних приемов, чередующихся через день, чтобы женщина могла обратиться к врачу в удобное для нее время. В течение одного часа амбулаторного приема врач принимает 5 пациенток, или в среднем одну пациентку в течение 10–15 мин. За 5 ч работы в женской консультации врач принимает 25 человек, или в течение года (при 283 (среднем числе) рабочих днях в году) – 6500. Этим числом и выражается значение термина «функции врачебной должности».
Вызов врача на дом оформляют по телефону либо при непосредственном обращении больной или ее родственников в регистратуру женской консультации. Каждый вызов врача на дом записывают в специальной книге. Врач наносит визит по вызову в тот же день, а при срочных показаниях – немедленно. Если необходимо, врач повторно «активно посещает» больную на дому.
Патронажную работу в женской консультации выполняет преимущественно акушерка самостоятельно или по указанию врача. Беременных, родильниц и гинекологических больных она посещает для того, чтобы ознакомиться с их жилищнобытовыми условиями, проконтролировать правильность выполнения ими назначений врача и соблюдения рекомендованного режима. При патронаже необходимо установить состояние здоровья женщин, не явившихся на прием к врачу или не госпитализированных по направлению врача в стационар, обучить женщин правилам личной гигиены и по другим причинам. Время, затраченное акушеркой на патронажную работу, входит в часы ее работы в женской консультации.
Привлечение врачей женской консультации к дежурствам в акушерско–гинекологическом стационаре в установленном порядке, участию в утренних, теоретических и клинико–анатомических конференциях родильного дома, несомненно, способствует их профессиональному совершенствованию. Не реже одного раза в 5 лет врач должен повышать свою квалификацию на факультетах, в институтах усовершенствования врачей в соответствии с действующим положением.
Стационарную гинекологическую помощь городскому населению оказывают в гинекологических отделениях в составе родильных домов и многопрофильных больниц. Если родильный дом и гинекологическое отделение больницы служат клинической базой медицинского института или университета, научно–исследовательского института, а также базой производственной практики студентов медицинского вуза и учащихся медицинского училища, они работают в соответствии с Положением о клиническом лечебно–профилактическом учреждении здравоохранения.
Родильное и гинекологическое отделения в составе родильного дома или многопрофильной больницы рекомендуется размещать в разных корпусах. Для приема гинекологических больных функционирует отдельное приемное помещение.
Для определения потребности населения в стационарной гинекологической помощи необходимы данные об уровне и структуре гинекологической заболеваемости, размере госпитализации, среднем числе дней пребывания больных в стационаре и среднем числе дней занятости койки в году.
Наиболее часто лечебно–профилактическую помощь рабочим промышленных предприятий оказывают в медико–санитарных частях, в состав которых входят поликлиника, стационар, цеховые здравпункты, а в некоторые – также профилактории, ясли, столовые.
Современные медсанчасти – это комплексные амбулаторнополиклинические лечебно–профилактические учреждения. Во многих из них есть женская консультация и акушерско–гинекологическое отделение в стационаре. Поэтому в таких медсанчастях можно обеспечить акушерско–гинекологическую помощь работницам в полном объеме.
Типовой цеховой врачебный участок организуют из расчета обслуживания 2000 работающих, а на предприятиях химической, угольной, горнорудной и нефтеперерабатывающей промышленности – 1500 работающих.
В обязанности акушера–гинеколога на промышленном предприятии также входят: изучение условий труда женщин; разработка лечебно–оздоровительных мероприятий для профилактики и снижения временной нетрудоспособности женщин; трудоустройство работниц, перенесших гинекологические болезни или операции, часто и длительно болеющих; участие в обязательных предварительных (при поступлении на работу) и периодических медицинских осмотрах работниц, сбор санитарного актива на своем участке; активное участие в разработке и проведении мероприятий на промышленном предприятии, которые организуют администрация и общественные организации по охране труда и здоровья женщин.
Акушер–гинеколог должен работать в тесном контакте с санитарно–промышленным врачом, который информирует его о введении новых технологических процессов с применением энергий новых видов, различных химических веществ и о других производственных факторах, опасных для здоровья работающих женщин, особенно для беременных.
Диспансеризация гинекологических больных
Главная цель диспансеризации – создать единую систему оценки и динамического контроля за состоянием здоровья человека и общества в целом, чтобы, опираясь на достижения научно–технического прогресса, обеспечить условия для нанесения «упреждающего удара» по всему, что может стать причиной развития болезни.Под диспансеризацией понимается активное выявление женщин с заболеваниями на ранних стадиях, динамическое наблюдение за ними и проведение комплексного лечения, осуществление мероприятий по оздоровлению условий их труда и быта, предупреждению развития и распространения болезней, укреплению трудоспособности.
В основу всеобщей диспансеризации населения положено профилактическое направление, которое закреплено законодательством, неуклонно проводится в жизнь путем широких санитарно–гигиенических, противоэпидемических мер, улучшения гигиенического воспитания населения, дальнейшего внедрения здорового образа жизни, физической культуры и спорта.
Для успешной диспансеризации необходима мобилизация всех кадровых и материальных ресурсов органов здравоохранения, их рациональное использование, усиление санитарногигиенического воспитания населения, повышение пропаганды здорового образа жизни, чтобы каждый гражданин осознал, что охрана здоровья – не только его личное дело, но и общественная необходимость.
Основная цель ежегодной диспансеризации – проведение комплекса мероприятий для сохранения и укрепления здоровья, предупреждения развития болезней, снижения заболеваемости, увеличения активного творческого долголетия на основе динамического наблюдения за здоровьем населения. Для диспансеризации во всех лечебно–профилактических учреждениях необходимы активные меры по профилактике заболеваний, выявлению больных и проведению лечебно–оздоровительных мероприятий.
В качестве подготовки к ежегодной диспансеризации женщин органы и учреждения здравоохранения проводят персональный учет женщин, проживающих в районе обслуживания поликлиники, амбулатории и фельдшерско–акушерских пунктов; врачи и средние медицинские работники разъясняют им цели и задачи ежегодной диспансеризации, выполняют расчеты для рационального использования сил и средств, а также текущей и перспективной дополнительной потребности учреждений здравоохранения и населения в лекарственных средствах, реактивах, инструментах, медицинской технике и приборах, санитарном и медицинском транспорте.
После персонального учета всех женщин, подлежащих диспансеризации, проводят их ежегодные осмотры терапевт, стоматолог, гинеколог, хирург и другие специалисты по показаниям.
Во время осмотра женщины осуществляют: сбор анамнестических сведений по специально разработанной анкете; антропометрические измерения; измерения артериального давления; гинекологический осмотр со взятием мазка для цитологического исследования (с 18 лет); исследование остроты зрения; измерение внутриглазного давления (после 40 лет); определение остроты слуха; туберкулиновые пробы подросткам (15–17 лет); анализ крови (определение СОЭ, уровня гемоглобина, лейкоцитов); исследование мочи на глюкозу (кровь на глюкозу по показаниям); исследование мочи на белок; ЭКГ (в 40 лет и старше); флюорографию (рентгенографию) органов грудной клетки ежегодно; маммографию (флюоромаммографию) с 35 лет 1 раз в 2 года; кольпоскопию по показаниям; пальцевое исследование через прямую кишку – с 30 лет.
Диспансеризация населения ведется в строгом соответствии с обязательными исследованиями, определенными «Временным положением о порядке проведения ежегодной диспансеризации всего населения», сетью базовых учреждений здравоохранения, в первую очередь амбулаторно–поликлиническими учреждениями. Установленный объем обследования населения на отдельных территориях можно расширять, если есть возможность.
Для ежегодной диспансеризации населения от органов здравоохранения требуется улучшение организации амбулаторнополиклинической помощи населению, в том числе: разукрупнение терапевтических, педиатрических и цеховых участков; совершенствование режима деятельности учреждений здравоохранения с целью обеспечения проведения диспансерных осмотров трудящихся преимущественно в их свободное от работы время; создание новых и совершенствование деятельности существующих отделений (кабинетов) профилактики в амбулаторнополиклинических учреждениях; дальнейшее развитие сети отделений и кабинетов восстановительного лечения; создание сети консультативно–диагностических поликлиник при медицинских научно–исследовательских институтах, высших учебных заведениях, крупных многопрофильных больницах; расширение консультативных приемов профессоров и преподавателей вузов непосредственно в поликлиниках, медико–санитарных частях, учреждениях здравоохранения сельской местности и др.; развитие и внедрение новых организационных форм амбулаторно–поликлинической помощи населению.
В подготовительном периоде органы здравоохранения базовых территорий разрабатывают общий план и конкретные графики проведения диспансерных мер среди населения, рассчитывают потребность и обеспечивают кадрами, дополнительно оснащают техникой, реактивами, подготавливают необходимое количество бланков учетной медицинской документации, создают условия для участия сотрудников всех лечебно–профилактических учреждений, клиник и кафедр медицинских вузов в ежегодной диспансеризации, дообследовании нуждающихся и диспансерном наблюдении за больными и лицами с факторами риска; формируют бригады специалистов из республиканских, областных больниц, медицинских вузов и научно–исследовательских институтов, а если необходимо – из городских учреждений здравоохранения для диспансерного обследования взрослых и детей сельских районов с недостающим числом врачей–специалистов, оснащают бригады необходимым оборудованием и средствами передвижения.
Сотрудники женских консультаций и профильных диспансеров участвуют в ежегодных осмотрах жителей, ведут диспансерное наблюдение за всеми выявленными больными, выполняют необходимые лечебно–оздоровительные мероприятия, оценивают эффективность диспансерного наблюдения, проводят санитарно–гигиеническую и воспитательную работу среди населения, обеспечивают преемственность в работе (с территориальными лечебно–профилактическими учреждениями).
В целях пропаганды здорового образа жизни в поликлиниках, медико–санитарных частях, женских консультациях, фельдшерско–акушерских пунктах, здравпунктах и других учреждениях здравоохранения посетителям разъясняют, в чем заключается вред гиподинамии, курения, употребления алкогольных напитков, почему необходимо рациональное питание, соблюдение режима труда и отдыха, обращают внимание на роль физкультуры в предупреждении болезней и укреплении здоровья и др. Руководители учреждений здравоохранения вместе с руководителями предприятий, учреждений и организаций способствуют распространению здорового образа жизни среди своих работников.
На всех больных заполняют «Медицинскую карту амбулаторного больного» и «Контрольную карту диспансерного наблюдения». Для правильной организации диспансерного наблюдения на каждом участке следует создать сигнальную картотеку. После окончания лечения карту женщины перекладывают в ячейку месяца, на который назначено очередное посещение. Частоту и сроки посещения больными консультаций врач определяет индивидуально для каждой больной в зависимости от клинических проявлений болезни. Длительность и частота наблюдения зависят от характера болезни, ее клинических проявлений, возраста больных и других факторов. Диспансерное наблюдение прекращают после выздоровления женщины и в связи со сменой местожительства.
Остальные женщины считаются практически здоровыми. У некоторых практически здоровых женщин бывают отклонения в состоянии половых органов, но они не предъявляют жалоб, не нуждаются в лечении и систематическом наблюдении, трудоспособность их не нарушена и угрозы для здоровья нет. Необходимы лишь профилактические осмотры этих женщин и некоторые рекомендации. Специальные документы на них не заводят и диагнозы им не выставляют. К практически здоровым относят женщин, у которых отмечаются опущение стенок влагалища и матки I степени, нефиксированные отклонения в положении матки, так называемая фиброзная матка в возрасте старше 40 лет, неосложненный климактерический период, некоторое нарушение менструального цикла в течение 1–2 месяцев после аборта, бесплодный брак при неустановленном бесплодии женщины. К ним следует также относить многих женщин, которые перенесли воспаление придатков матки и у которых отмечаются лишь остаточные явления признаков обострения и нарушения функции.
Профилактические осмотры женского населения
Профилактическим гинекологическим осмотрам подлежат все женщины старше 18 лет, работающие, учащиеся или постоянно проживающие в районе деятельности женской консультации, а также женщины, снятые с диспансерного наблюдения. Целесообразны гинекологические профилактические осмотры девочек – учащихся старших классов, так как выявление заболеваний и своевременное оздоровление девочек–подростков служат залогом их успешной подготовки к здоровому материнству.План проведения профилактических осмотров составляет руководитель женской консультации и согласовывает его с администрацией того предприятия или учреждения, в котором онибудут организованы. Если комплексные осмотры проводят гинекологи вместе с другими специалистами, то план утверждает городской или районный отдел здравоохранения.
При подготовке к осмотру необходимо иметь «Список лиц, подлежащих целевому медицинскому осмотру», а на пациенток, прошедших обследование, нужно оформить «Карту профилактически осмотренного».
Для проведения профилактических осмотров нужно подготовить гинекологические и вспомогательные кабинеты, лабораторию. Подготовке должна предшествовать большая санитарно–просветительная работа. Женщинам разъясняют цели и задачи профилактических осмотров, необходимость своевременного и регулярного их проведения. Во время обследования девочек–подростков санитарно–просветительную работу проводят не только с учащимися, но и с родителями и педагогами. Желательно перед профилактическими осмотрами организовать семинары для врачей.
Каждую женщину гинеколог должен обследовать 1 раз в год. Во время профилактического осмотра он обращает внимание на особенности менструальной и детородной функции, болевой синдром, осматривает наружные половые органы, промежность, область заднего прохода, влагалище и шейку матки, используя влагалищные зеркала, берет мазки для цитологического исследования, проводит пробу Шиллера и кольпоскопию, двуручное или ректальное (девушкам и по показаниям) исследование, обследует молочные железы.
В случае выявления какой–либо гинекологической болезни или подозрения на нее женщину направляют к участковому акушеру–гинекологу по месту жительства для уточнения диагноза, лечения и диспансерного наблюдения.
Большую роль в проведении профилактических осмотров женщин, особенно неработающих, играют смотровые кабинеты, которые создают при поликлиниках и оснащают всем необходимым для гинекологического осмотра. В смотровые кабинеты направляют всех женщин, обращающихся в поликлинику, независимо от возраста и особенности болезни, кроме больных, нуждающихся в экстренной помощи или находящихся на диспансерном учете у гинеколога. Регистратор или медицинская сестра соответствующего врачебного кабинета выдают направление в смотровой кабинет, акушерка которого после обследования женщины ставит штамп с отметкой о дате осмотра. Больная возвращает направление в регистратуру, где его наклеивают на амбулаторную карту.
В смотровом кабинете работают акушерки, которых главный врач поликлиники выделяет из имеющихся у него в штате средних медицинских работников. Подготовку акушерок и методическое руководство их работой осуществляют акушер–гинеколог и онколог поликлиники: в отсутствие гинеколога методическое руководство возлагают на заведующего одной из женских консультаций. Главный врач, заведующие отделениями и все сотрудники поликлиники должны постоянно разъяснять больным важность и необходимость посещения смотровых кабинетов. Акушерки смотрового кабинета, как правило, работают в две смены, начинают свою работу за полчаса до приема женщин специалистами поликлиники.
В смотровом кабинете у женщины выясняют состояние менструальной функции, осматривают и пальпируют молочные железы, осматривают шейку матки, используя зеркала, проводят бимануальное и ректальное исследование, берут мазки для цитологического исследования. При малейших отклонениях от нормы со стороны молочных желез или половых органов женщине выдают направление к хирургу или гинекологу, сделав соответствующую запись в журнале смотрового кабинета. Диагнозы, установленные акушеркой, ориентировочные, их окончательно уточняет врач соответствующего профиля. Сведения о выявлении больных акушерка регулярно передает в женскую консультацию.
Гинекологическая помощь сельскому населению
Гинекологическая помощь сельскому населению организуется на тех же принципах, что и помощь горожанам. Однако из–за особенностей расселения людей, большого радиуса обслуживания, специфики сельскохозяйственного производства (на больших территориях, сезонности), состояния путей сообщения и транспорта в деревне необходима несколько особая, отличающаяся от городской, система организации медицинской помощи.В целях совершенствования акушерско–гинекологической помощи сельскому населению разработана система оказания амбулаторно–поликлинической помощи жительницам села, состоящая из 5 этапов.
На 1–м этапе амбулаторную и стационарную акушерско–гинекологическую помощь жительницам села оказывают акушерки ФАП и участковых больниц, в которых нет акушера–гинеколога. Амбулаторная работа акушерки в основном профилактическая, т. е. направлена на предупреждение гинекологических заболеваний.
На 2–м этапе амбулаторную помощь гинекологическим больным оказывают медработники участковой больницы, в которой работает акушер–гинеколог, районной центральной и районной больниц с фондом 300 коек и менее. Беременных и гинекологических больных – жительниц сельского участка также периодически обследуют в женской консультации районной или центральной больницы данного района (по направлению из амбулатории или участковой больницы) и врачи выездной бригады центральной районной больницы (ЦРБ): акушер–гинеколог, терапевт и стоматолог. Лаборант из состава выездной бригады на месте выполняет необходимые анализы. Постоянно медработники участковой больницы или амбулатории, в которой работает акушер–гинеколог, наблюдают только здоровых женщин с нормально протекающей беременностью.
На 3–м этапе амбулаторно–поликлиническую помощь оказывают работники женских консультаций районной и центральной районной больниц, а стационарную помощь – сотрудники центральной районной больницы с фондом 300 коек и более.
Центральная районная больница (ЦРБ) – учреждение, в котором оказывают квалифицированную акушерско–гинекологическую помощь сельчанам.
В ЦРБ работают акушеры–гинекологи, хирурги, анестезиологи и другие специалисты, благодаря которым централизуется гинекологическая помощь в стационарах и женских консультациях. Только в единичных случаях, когда в условиях районной больницы невозможно оказать необходимую помощь, больных заблаговременно госпитализируют в акушерско–гинекологическое отделение областной или городской больницы.
На 4–м этапе амбулаторно–поликлиническую акушерско–гинекологическую помощь оказывают сотрудники женских консультаций городского родильного дома, отделений больницы, медико–санитарных частей, а стационарную помощь – работники городских и областных родильных домов или акушерско–гинекологических отделений областных и городских больниц.
Областная больница является центром оказания высококвалифицированной помощи специалистами всех областей медицины, руководства деятельностью районных медицинских учреждений, предоставляющих акушерско–гинекологическую помощь, и контроля за ними. Областные больницы обеспечены квалифицированными кадрами, оснащены современным оборудованием, имеют клинико–диагностические лаборатории, анестезиолого–реанимационную службу. На базе этих больниц повышают квалификацию врачи сельских районов.
В областных больницах в основном оказывают консультативную помощь беременным группы высокого риска и гинекологическим больным, нуждающимся в специальном обследовании. Беременным в зависимости от возникших патологических изменений выполняют специальные диагностические исследования. При этом определяют не только состояние женщины и целесообразность сохранения беременности, но и состояние плода.
На 5–м этапе консультативную амбулаторно–поликлиническую помощь оказывают высококвалифицированные акушеры–гинекологи специализированных акушерско–гинекологических учреждений, научно–исследовательских институтов и баз кафедр акушерства и гинекологии медицинских вузов. К ним направляют обследованных беременных женщин и гинекологических больных, которым невозможно провести специальные исследования на предыдущих этапах оказания помощи.
Специализированная гинекологическая помощь
В настоящее время одной из форм специализированной акушерско–гинекологической помощи в амбулаторно–поликлинических условиях является организация специализированных консультативных приемов (кабинетов) женщин с экстрагенитальными заболеваниями, невынашиванием беременности, иммуноконфликтной беременностью, неправильным положением и тазовым предлежанием плода, бесплодием, эндокринными расстройствами, патологией шейки матки, туберкулезом половых органов, детей с гинекологическими заболеваниями и др.Более современная форма специализированной акушерско–гинекологической помощи – специализированные приемы в базовых женских консультациях, которые стали центрами специализированной консультативно–диагностической помощи, подготовки и усовершенствования врачей женских консультаций.
В функцию специализированных консультативно–диагностических центров (базовых женских консультаций) входит оказание медицинской помощи женщинам, проведение организационно–методической работы, решение задач по подготовке кадров и обобщение рекомендаций по передовому опыту. Выполнение этих обязанностей возможно лишь в тех случаях, когда базовые учреждения оснащены современными эндокринологическими, иммунологическими, биохимическими и медико–генетическими лабораториями, кабинетами функциональных методов исследования. Не менее важную роль в современной диагностике заболеваний и правильном лечении в этих учреждениях играет консультативно–лечебная помощь врачей других специальностей (эндокринолога, онколога, фтизиатра, хирурга, гематолога, педиатра и др.).
Кроме того, специализированную акушерско–гинекологическую помощь могут оказывать специалисты консультативных центров, организованных при специализированных стационарах, кафедрах вузов или отделах научно–исследовательских институтов. Чем выше по своей квалификации учреждение, тем шире объем применяемых в нем диагностических приемов и тем многостороннее лечебная помощь.
Есть и другие формы амбулаторно–поликлинического обслуживания – консультации «Брак и семья» и специализированные консультативно–диагностические центры по дородовой диагностике заболеваний плода. При них организованы пансионаты на хозрасчетной основе для временного проживания больных и сопровождающих их лиц.
В консультациях «Брак и семья» решают как медицинские, так и социальные вопросы. Эти консультации обслуживают не только женщин, но и мужчин. Основные их задачи – работа по гигиене брака, внедрению контрацепции, медико–генетическое консультирование, проблемы сексопатологии, половое воспитание подрастающего поколения. Они оказывают специализированную консультативную и лечебно–профилактическую помощь, содействуют оздоровлению и укреплению семейнобрачных отношений.
Для раннего выявления наследственных заболеваний и прогноза потомства, а также разработки мер ранней антенатальной профилактики врожденной патологии нужно создавать новые и укреплять уже существующие медико–генетические консультации.
Одновременное развитие специализированных родильных домов или акушерско–гинекологических отделений в больницах с организацией консультативных амбулаторных приемов обусловливает единство специализированной поликлинической и стационарной помощи беременным женщинам, роженицам, родильницам и гинекологическим пациенткам.
Глава 2. Анатомо–физиологические особенности половых органов женщины в различные возрастные периоды
В жизни женщины выделяют следующие периоды: ■ период антенатального, или внутриутробного, развития ■ период новорожденности ■ период детства ■ препубертатный период ■ пубертатный период, или период полового созревания ■ репродуктивный период ■ климактерический период (пременопауза, постменопауза).Внутриутробный период
Половые железы закладываются одними из первых в процессе эмбрионального развития. Уже на 30–й день у зародыша может быть обнаружен зачаток первичной почки, который формируется из урогенитальной пластинки.Эмбриональная закладка половых органов идет параллельно с развитием мочевыводящей системы. В эмбриогенезе мочевыводящей системы различают 3 последовательных, сменяющих друг друга образования – предпочка (pronephros), первичная почка (mezonephros), или вольфовы тела, окончательная почка (metanephros).
Развитие внутренних половых органов начинается в стадии появления первичной почки (mezonephros) к концу 1–го месяца беременности. На внутренней поверхности первичной почки возникают гребневидные утолщения–валики, которые являются началом в развитии половых желез: яичников у женщин и яичек у мужчин. Первоначально они состоят из целомического эпителия и мезенхимы, к которым добавляются первичные половые клетки (гоноциты), образующиеся в стенке желточного мешка. Параллельно этому процессу идет закладка парамезонефральных (мюллеровых) каналов, из которых развиваются маточные (фаллопиевы) трубы, матка и верхняя треть влагалища. В процессе эмбриогенеза с мюллеровыми каналами происходит ряд изменений. Располагаясь первоначально рядом с мезонефральными (вольфовыми) протоками, они растут в каудальном направлении, переходят к средней линии, соприкасаются между собой. На 8–й неделе перегородки между мюллеровыми каналами начинают рассасываться и парамезонефральные протоки сливаются. Слияние обоих каналов происходит поочередно на различных уровнях, заканчиваясь к концу 9–й недели. Краниальные участки мюллеровых каналов остаются разделенными, представляя собой будущие маточные трубы. В средней части парамезонефральных каналов перед слиянием образуется просвет – маточно–влагалищный канал. К 20–24–й неделе происходит окончательная дифференцировка мюллеровых каналов на матку, трубы и влагалище.
Сохранение внутримюллеровой перегородки или ее частичная резорбция ведет к появлению влагалищно–маточных пороков развития. От первичной почки в половой системе взрослой женщины сохраняются рудиментарные образования: придаток яичника (epoophron), околояичник (paraophron), гартнеров ход.
Закладка наружных половых органов начинается с 6–7–й недели эмбриональной жизни в виде полового бугорка, уретральной щели. Дифференцировка наружных половых органов по мужскому типу начинается с 8–й недели внутриутробного развития и заканчивается к 18–20 неделям. Наружные половые органы по женскому типу начинают развиваться позже, чем по мужскому типу, так как в яичках плода синтез половых стероидов начинается с 8–й недели. Яичники не играют определяющей роли в развитии внутренних и наружных половых органов.
До 17 недель у плодов женского пола наружные половые органы индифферентны.
Развитие наружных половых органов по женскому типу начинается с 17–й недели и к 23–й неделе формируются половые губы, которые представляют собой тонкие кожные складки. Клитор образуется из полового бугорка. Окончательное разделение на матку, трубы и влагалище происходит к 20–24–й неделе.
В процессе формирования яичника первичные половые клетки дифференцируются в овогонии. Вступая в стадию размножения, овогонии образуют овоциты 1–го порядка. На 20–й неделе внутриутробного развития в результате мейотического деления овоциты 1–го порядка окружает оболочка из фолликулярных клеток. Таким образом формируется примордиальный фолликул. В 6–7 месяцев беременности в ретальном яичнике увеличивается число примордиальных фолликулов, при рождении их количество уменьшается. После 8 месяцев беременности образуется белочная оболочка, тем самым эмбриогенез яичника заканчивается.
К моменту рождения яичник морфологически сформирован. В корковом слое яичника имеются множественные примордиальные фолликулы, зреющие, атрезирующиеся фолликулы. Во внутриутробном периоде происходит морфологическое развитие репродуктивной системы и формирование ее гормональной функции. В антенатальном периоде в яичниках происходит стероидогенез, но на половую дифференцировку гормоны яичников не оказывают особого влияния.
Период новорожденности
С момента рождения организм новорожденного подвергается радикальным изменениям. Переход от внутриутробной жизни с ее характерными биологическими условиями дыхания, кровообращения и питания к внематочной жизни, где совершенно иные условия, требует определенной адаптации. При рождении вульва имеет несколько отечный вид. Влагалище представляет гиперплазию влагалищного эпителия, клетки которого богаты гликогеном. В первые 24 ч влагалище стерильно, его рН = 5.При рождении длина матки составляет 3 см. Шейка занимает 2/3 длины матки. Яичник при рождении имеет размеры 0,5*0,3*0,3 см, большое количество примордиальных и атрезирующихся фолликулов. В этот период возможно появление «половых кризов», связанных с критическим уменьшением уровня циркулирующих материнских половых гормонов. «Половой криз» проявляется в виде нагрубания молочных желез и появления незначительных кровянистых выделений из половых путей.Яичник плода продуцирует эстрогены и андрогены под влиянием ЛГ и ФСГ и в меньшей степени ХГТ. ФСГ и ЛГ продуцируются аденогипофизом начиная с 12 недель внутриутробного развития. Их синтез увеличивается до тех пор, пока не достигнет своего максимального уровня в начале 20–26–й недели. Продукция этих гормонов заканчивается на 32–й неделе. Внезапное падение уровня эстрогенов провоцирует увеличение уровня ФСГ ХГ исчезает в течение 1–й недели после рождения. Эти гормональные сдвиги объясняют изменения органов–мишеней: молочных желез, наружных половых органов, эндометрия.
Большие половые губы утолщены, малые половые губы хорошо развиты. Гимен просматривается. Обычно наблюдаются вязкие выделения, объясняющие клеточную активность шеечного и влагалищного эпителия. Могут появиться кровянистые выделения, связанные с десквамацией эндометрия в ответ на падение уровня гормонов. Нагрубание молочных желез, часто асимметричное, связаное с высвобождением ФСГ и пролактина, возникает в конце 1–й недели и исчезает через 10–15 дней.
Период детства
Период детства продолжается до 7–8 лет и заканчивается к периоду полового созревания. Этот период называют «периодом покоя». В этом возрасте рост органов половой системы происходит постепенно. Влагалище девочки до полового созревания в среднем имеет длину 4–5 см. Соотношение между шейкой матки и телом – 3: 1, между тем как у женщины фертильного периода оно составляет 1:3. Маточные трубы длинные и извитые. Ввиду уменьшения уровня эстрогенов происходят изменения во влагалище. Слущивание эпителиальных клеток превышает темпы их регенерации, что ведет к истончению влагалищного эпителия и уплотнению коллагеновых волокон. Благодаря низкому уровню половых гормонов гистологическая картина остается стабильной в течение последующих нескольких лет. Слизистая влагалища истонченная, с невыраженными промежуточными слоями, слабо заметными складками, хорошо развитой соединительной тканью и переплетенными эластичными волокнами. Уменьшение уровня эстрогенов провоцирует снижение количества внутриклеточного гликогена и pH увеличивается до 6–8, что способствует развитию анаэробной флоры. Микрофлора детского влагалища характеризуется отсутствием доминирующего типа бактерий, она смешанная (грамположительные кокки и грамотрицательные палочки). В этом периоде чаще развиваются вульвовагиниты из–за отсутствия анатомического барьера, близости вульвы и анального отверстия, неправильного ухода за наружными половыми органами.Количество фолликулов в яичниках в детстве растет, за счет чего яичник увеличивается, но также происходит и интенсивный процесс атрезии фолликулов, а зрелые фолликулы в яичниках отсутствуют.
Гипоталамо–гипофизарная система в детстве характеризуется незрелостью, что обусловливает отсутствие вторичных половых признаков.
Препубертатный период (7–9 лет)
В этом периоде отмечается диспропорция между ростом и массой тела ребенка. Увеличение массы тела отстает от его роста. В препубертатном периоде происходит дальнейшее развитие половых желез. появляются первые половые признаки, жировая ткань в области больших половых губ становится более обильной.Кожный покров на этом уровне пигментируется и покрывается волосами, молочные железы развиваются, выделяется околососковый кружок. В гипоталамусе в незначительных количествах образуется РГ–ЛГ, периодически выделяются гонадотропины, под их влиянием увеличивается секреция гормонов яичников.
Пубертатный период (10–17 лет)
В этот период женский организм заканчивает развиваться физически. Он характеризуется усилением созревания гипоталамических структур. Увеличивается выделение РГ–ЛГ, усиливается синтез гонадотропинов, выброс их имеет циклический характер. Выработка ЛГ и ФСГ стимулирует синтез эстрогенов в яичниках. Увеличивается число рецепторов к половым гормонам в клетках всех органов репродуктивной системы. Высокий уровень эстрогенов стимулирует выброс гонадотропинов, созревание фолликула и яйцеклетки. В этот период увеличиваются молочные железы, изменяется флора влагалища, появляются лактобациллы, матка растет в объеме. Увеличение матки происходит неравномерно и в основном за счет миометрия. Матка занимает физиологическое положение в малом тазу. Увеличивается размер яичников. Развитие вторичных половых признаков начинается с оволосения лобка, затем подмышечных впадин, появляется первая менструация (менархе). Становление менструальной функции происходит под влиянием циклической секреции рилизинг–факторов гипоталамуса, гонадотропных гормонов гипофиза и стероидных гормонов яичников.Увеличивающийся выброс гонадотропинов носит циклический характер. В этот период завершается полное морфологическое и функциональное развитие полового тракта до способности к воспроизведению.
Репродуктивный период
Репродуктивный период, или период половой зрелости, (18–45 лет), – наиболее продолжительный период в жизни женщины. В это время активизируются все функции полового аппарата, связанные с деторождением. В этом периоде у женщин наступают беременность и роды.Репродуктивная система в этот период характеризуется определенными морфологическими данными. Женские половые органы делят на наружные и внутренние. К наружным половым органам относят лобок, большие и малые половые губы, клитор преддверия влагалища и промежность (рис. 2.1).
Лобок, лонный бугор (mons pubis, mous veneris) представляет собой треугольную площадку на нижней части передней брюшной стенки со значительно развитой жировой клетчаткой. С наступлением половой зрелости вся область лобка покрывается волосами. У женщин верхняя граница волосяного покрова представляет почти горизонтальную линию.
Большие половые губы (labia majora pudendi) – это две складки кожи, покрытые волосами, ограничивающие с боков половую щель (rima pudendi). В толще больших половых губ располагается богатая жиром клетчатка, в которой проходят сосуды, нервы, а также большие (бартолиновы) железы преддверия (glandulae vestibulares majores, glandulae vestibulares Bartholini). Они находятся на границе передней и средней трети губ. Спереди большие половые губы образуют переднюю спайку (comissura labiorum anterior). Сзади, соединяясь по средней линии, они образуют заднюю спайку (comissura labiorum posterior).
 Рис. 2.1. Наружные половые органы женщины: 1 – лобок; 2 – крайняя плоть клитора; 3 – клитор; 4 – малая половая губа; 5 – девственная плева; 6 – задняя спайка; 7 – промежность; 8 – заднепроходное отверстие; 9 – большая половая губа; 10 – наружное отверстие мочеиспускательного канала; 11 – уздечка клитора
Рис. 2.1. Наружные половые органы женщины: 1 – лобок; 2 – крайняя плоть клитора; 3 – клитор; 4 – малая половая губа; 5 – девственная плева; 6 – задняя спайка; 7 – промежность; 8 – заднепроходное отверстие; 9 – большая половая губа; 10 – наружное отверстие мочеиспускательного канала; 11 – уздечка клитора
Малые половые губы (labia minora pudendi) расположены кнутри от больших половых губ. Кожа, покрывающая их, бледно–розового цвета, без волосяного покрова, богата сальными железами, венозными сосудами и нервными окончаниями. Спереди малые половые губы раздваиваются и образуют две пары ножек. Верхняя пара ножек обеих губ, соединяясь над клитором, образует крайнюю плоть клитора (preputium clitoridis), нижняя пара, соединяясь под клитором, образует его уздечку (frenulum clitoridis).
Клитор (clitor) – аналог мужского полового члена. Состоит из двух слившихся пещеристых тел, ножки клитора прикрепляются к надкостнице лобковых костей. В нем различают головку и тело. Клитор обильно снабжен сосудами и нервами, он является органом полового чувства. Ниже клитора располагается наружное отверстие мочеиспускательного канала.
Преддверие влагалища (vestubulum vaginae) – это пространство, ограниченное спереди клитором, сзади – задней спайкой половых губ, с боков – внутренней поверхностью малых половых губ. Границей преддверия является девственная плева или ее остатки. В преддверии влагалища открывается наружное отверстие мочеиспускательного канала и выводные протоки больших желез преддверия.
Девственная плева (pymen) является границей между внутренними и наружными половыми органами. Это соединительнотканная перепонка, покрытая многослойным плоским эпителием снаружи и изнутри. В ее соединительнотканной основе имеются мышечные пучки и эластичные волокна, кровеносные сосуды, нервы. В девственной плеве есть отверстие. При первом половом сношении происходит разрыв девственной плевы, обычно сопровождающийся кровотечением из поврежденных сосудов. После разрыва от плевы остаются образования, похожие на сосочки (carunculae hymenales).
Промежность (perinemu) – кожно–ленточная фасциальная пластинка, расположенная между задней спайкой больших половых губ и копчиком.
К внутренним половым органам относят влагалище, матку и придатки (маточные трубы и яичники) (рис. 2.2, 2.3).
Влагалище (vagina) – это мышечно–эластичная трубка, расположенная в малом тазу, участвующая в процессе оплодотворения, в родах составляет часть родового канала. Влагалище располагается под углом к вертикальной линии. Оно охватывает шейку матки и заканчивается в области преддверия. Длина влагалища в среднем составляет 7–8 см. Передняя и задняя его стенки обычно соприкасаются. Сверху в просвет влагалища выступает влагалищная часть шейки матки, вокруг которой оно образует своды. Различают четыре свода влагалища: передний, задний и два боковых. Самый глубокий – задний свод. Передняя стенка влагалища соприкасается с дном мочевого пузыря в верхней части, а ниже – с мочеиспускательным каналом, задняя стенка влагалища прилегает к прямой кишке. Стенка влагалища состоит из трех оболочек: слизистой, мышечной и соединительнотканной. Слизистая оболочка собрана в многочисленные поперечные складки. Влагалище выстлано многослойным плоским эпителием, слизистая влагалища лишена желез. Состояние эпителия зависит от уровня эстрогенов, циркулирующих в крови женщины. Мышечный слой состоит из наружного продольного и внутреннего циркулярного, более развитого, который содержит большое количество эластичных волокон. Соединительнотканная оболочка образована рыхлой волокнистой соединительной тканью, связывающей его с соседними органами.
 Рис. 2.2. Внутренние половые органы: 1 – мочевой пузырь; 2 – яичник; 3 – труба; 4 – наружные подвздошные сосуды; 5 – яичниковые сосуды; 6 – уретра; 7 – прямая кишка, 8 – дугласово пространство; 9 – маточнокрестцовая связка; 10 – матка; 11 – круглая связка
Рис. 2.2. Внутренние половые органы: 1 – мочевой пузырь; 2 – яичник; 3 – труба; 4 – наружные подвздошные сосуды; 5 – яичниковые сосуды; 6 – уретра; 7 – прямая кишка, 8 – дугласово пространство; 9 – маточнокрестцовая связка; 10 – матка; 11 – круглая связка
 Рис. 2.3. Внутренние половые органы и их взаимоотношение: 1 – матка; 2 – интрамуральная часть трубы; 3 – истмическая часть трубы; 4 – мезосальпингс; 5 – мезоовариум; 6 – ампулярная часть трубы; 7 – воронко–тазовая; 8 – труба; 9 – воронка; 10 – гидатида морганьи; 11 – яичник; 12 – маточно–яичниковая связка; 13 – свод влагалища; 14 – влагалище
Рис. 2.3. Внутренние половые органы и их взаимоотношение: 1 – матка; 2 – интрамуральная часть трубы; 3 – истмическая часть трубы; 4 – мезосальпингс; 5 – мезоовариум; 6 – ампулярная часть трубы; 7 – воронко–тазовая; 8 – труба; 9 – воронка; 10 – гидатида морганьи; 11 – яичник; 12 – маточно–яичниковая связка; 13 – свод влагалища; 14 – влагалище
Кровоснабжение влагалища осуществляется маточной артерией, а также ветвями нижней мочепузырной, средней прямокишечной и внутренней половой артерий. В адвентиции (соединительнотканной части) имеются многочисленные вены, формирующие влагалищное венозное сплетение. Оттекает венозная кровь в систему внутренней подвздошной вены.
Лимфатические сосуды идут от верхней и средней трети влагалища во внутренние подвздошные и крестцовые лимфатические узлы, а от нижней трети – в глубокие и поверхностные паховые лимфатические узлы. Иннервируется влагалище симпатической и парасимпатической нервной системой.
В просвете влагалища содержится 0,5–1,5 мл жидкости, образующейся за счет транссудата из кровеносных и лимфатических сосудов и слизи, которая вырабатывается эпителиальными клетками желез эндометрия и слизистой оболочки цервикального канала. Реакция влагалищного содержимого кислая за счет молочной кислоты, образующейся из гликогена под действием палочек Дедерлейна. Молочная кислота уничтожает патогенные микробы, способствуя процессу самоочищения влагалища. В соответствии с характером клеточного содержимого и микрофлоры влагалища различают четыре степени его чистоты. При 1–й степени чистоты в нем присутствуют только клетки эпителия и палочки Дедерлейна, реакция содержимого кислая (рН 4,0–4,5). При 2–й степени чистоты палочек Дедерлейна во влагалище содержится меньше, появляются лейкоциты в небольшом количестве, клетки эпителия, грамположительные диплококки, реакция кислая (рН 5,0–5,5). При 3–й степени чистоты отмечается мало палочек Дедерлейна, значительное количество лейкоцитов и разнообразная микрофлора, реакция слабокислая или слабощелочная (рН 6,0–7,2). При 4–й степени чистоты палочки Дедерлейна отсутствуют, обнаруживаются различные микробы: стрептококки, стафилококки, нередко встречаются трихомонады, много лейкоцитов, реакция щелочная (рН выше 7,2).
Первая и вторая степени чистоты – признак здорового состояния, а 3–я и 4–я свидетельствуют о воспалительном процессе.
Матка (uterus) – полый мышечный орган (рис. 2.4), имеющий грушевидную форму. Располагается она в малом тазу между мочевым пузырем и прямой кишкой. Вес матки – около 50 г, длина – 7–8 см, толщина стенок – 1–2 см. В матке различают дно, тело и шейку. Участок между телом матки и шейкой называется перешейком. Верхняя выпуклая часть матки, располагающаяся выше места отхождения маточных труб, – дно матки. Тело матки имеет треугольную форму. В верхнем отделе и сбоку от тела матки отходят маточные трубы, а спереди – круглые связки.
 Рис. 2.4. Структура матки: 1 – интерстициальная часть трубы; 2 – дно; 3 – периметрии (сероза); 4 – трубные углы; 5 – тело; 6 – эндометрий; 7 – миометрий; 8 – истмическая часть и внутренний зев; 9 – цервикальныи канал и надвлагалищная часть шейки матки; 10 – влагалищная часть шейки матки; 11 – влагалище; 12 – наружный зев; 13 – влагалищный свод; 14 – маточные сосуды
Рис. 2.4. Структура матки: 1 – интерстициальная часть трубы; 2 – дно; 3 – периметрии (сероза); 4 – трубные углы; 5 – тело; 6 – эндометрий; 7 – миометрий; 8 – истмическая часть и внутренний зев; 9 – цервикальныи канал и надвлагалищная часть шейки матки; 10 – влагалищная часть шейки матки; 11 – влагалище; 12 – наружный зев; 13 – влагалищный свод; 14 – маточные сосуды
Передняя и задняя стенки матки соприкасаются друг с другом, поэтому полость тела матки имеет вид узкой щели. Матка расположена в малом тазу несколько ближе к его передней стенке и наклонена вперед (andeversio). Тело матки находится под углом по отношению к шейке матки (anteflexio).
Канал шейки матки соединяет полость матки и влагалища. В шейке матки различают две части. Надвлагалищная часть располагается над влагалищем в брюшной полости. Влагалищная часть вдается в полость влагалища и покрыта так же, как и влагалище, многослойным плоским эпителием. Слизистая оболочка шеечного канала выстлана цилиндрическим эпителием и имеет складчатый характер. В толще слизистой оболочки расположены железы с широким просветом, заполненным слизистым секретом.
Стенка матки состоит из трех слоев. Слизистая оболочка (эндометрий) выстилает полость матки, толщина ее до 1 мм. У женщин репродуктивного возраста она состоит из двух слоев: базального и функционального. Базальный слой граничит с мышечным и имеет большое количество желез с узким просветом, выстланным цилиндрическим эпителием. В функциональном слое эндометрия под действием гормонов на протяжении менструального цикла происходят структурные и морфофункциональные изменения.
Мышечный слой тела матки (миометрий) хорошо развит и представляет собой густые сплетения. Мускулатура матки соответственно ходу мышечных пучков подразделяется на три слоя: наружный серозный – продольный, средний – круговой, или циркулярный, внутренний – подслизистый, состоящий из продольных и циркулярных пучков мышц. В шейке матки и в области перешейка мышечный слой тоньше, а больше соединительнотканных элементов.
Серозная оболочка состоит из тонкого слоя соединительной ткани и покрывающего ее мезотелия. Брюшина с внутренней поверхности передней брюшной стенки переходит на мочевой пузырь, затем на матку, образуя на уровне перешейка пузырно–маточное углубление. Покрывая тело матки, брюшина в месте перехода с задней стенки на прямую кишку образует прямокишечно–маточное углубление – дугласов карман. Кровоснабжается матка (рис. 2.5) из маточной артерии (a. uberina) и яичниковой артерии (a. ovarica). Дно матки кровоснабжается также за счет артерий круглых связок. Маточная артерия отходит от a. iliaca inferna, идет по боковой стенке таза. Не доходя до шейки матки 1–2 см, она образует перекрест с мочеточником, затем делится на 2 шеечно–влагалищные ветви – нисходящую и восходящую, идущую к верхнему углу матки. В области дна она дает 2 ветви, идущие к трубе и яичнику. Лимфоотток – лимфатические сосуды тела матки идут в верхнем отделе широких связок, отводя лимфу в поясничные и крестцовые узлы, лимфа от дна матки отводится в паховые лимфоузлы. Иннервируется матка симпатической и парасимпатической нервной системой.
 Рис. 2.5. Артерии внутренних половых органов: 1 – мочеточник; 2 – яичниковая артерия (a. ovarica); 3 – a. utenna; 4 – внутренняя половая артерия; 5 – артерия круглой связки
Рис. 2.5. Артерии внутренних половых органов: 1 – мочеточник; 2 – яичниковая артерия (a. ovarica); 3 – a. utenna; 4 – внутренняя половая артерия; 5 – артерия круглой связки
Симпатическая осуществляет свое влияние через plexus hypogastricus inferior (тазового) сплетения, парасимпатическая – через nn. splanchnici pelvim (тазовыми нервами).
Маточные трубы (tubae uterinae, salpinges) начинаются от углов матки и идут между метками широких связок (рис. 2.6). Длина труб – 10–12 см, просвет трубы сообщается с полостью матки, где диаметр трубы – 0,5–1,0 мм. Это интерстициальная часть трубы – отдел, проходящий в толще миометрия. Далее просвет трубы шире – это перешеечная, или истмическая часть. Самая широкая часть трубы – ампулярная, которая заканчивается воронкой диаметром 6–8 мм. Края воронки имеют вид бахромок – фимбрий.
Стенка трубы состоит из 3 слоев: слизистого, мышечного и серозного.
Слизистая оболочка трубы образует продольные складки, покрыта однослойным цилиндрическим мерцательным эпителием, реснички которого мерцают в сторону матки. Между клетками эпителия располагаются секреторные клетки, они выделяют секрет в полость трубы.
 Рис. 2.6. Фаллопиева труба: 1 – воронка, абдоминальное отверстие и фимбрия; 2 – фимбрия; 3 – складки слизистой;4 – интерстициальный; 5 – истмический; 6 – мезосальпинкс; 7 – ампулярный
Рис. 2.6. Фаллопиева труба: 1 – воронка, абдоминальное отверстие и фимбрия; 2 – фимбрия; 3 – складки слизистой;4 – интерстициальный; 5 – истмический; 6 – мезосальпинкс; 7 – ампулярный
Мышечный слой трубы состоит из гладкой мускулатуры. Наружный пласт – продольный, средний – циркулярный, внутренний – подслизистый. Серозный покров трубы – это самый верхний отдел широкой связки. Брюшина покрывает трубу сверху и с боков. К нижнему ее отделу прилегает параметральная клетчатка, в которой проходят сосуды и нервы. Труба выполняет важные функции. В ее ампулярном отделе происходит оплодотворение, а также по трубе осуществляется перемещение яйцеклетки в полость матки.
Яичники (рис. 2.7) – это парная женская половая железа. Яичники являются органом, где образуются и созревают яйцеклетки и вырабатываются половые гормоны. Яичник имеет овальную форму длиной 3–4 см, шириной 2–2,5 см, толщиной 1–1,5 см. Вес его 6–8 г. Яичник имеет два полюса (маточный и трубный). Внутренний свободный край яичника обращен в брюшную полость, брыжеечный – фиксируется к заднему листку широкой связки. В брыжеечном крае проходят артерии, вены, лимфатические сосуды, нервы.
В свободном подвешенном состоянии яичник удерживается связками: широкой связкой, собственной связкой яичника и воронко–тазовой связкой. В яичнике различают: эпителий, белочную оболочку, корковый и мозговой слои.
Под поверхностным эпителием, который покрывает яичники, находится белочная оболочка, состоящая из плотной соединительной ткани. Под белочной оболочкой располагается корковый слой с многочисленными примордиальными фолликулами, а также фолликулы и желтые тела на разных стадиях развития. Мозговой слой яичника состоит из соединительнотканной стромы и мышечных волокон. В строме проходят многочисленные сосуды и нервы.
 Рис. 2.7. Яичник в разрезе (фолликулы и желтое тело в различные фазысвоего развития): 1 – сосуды; 2 – сероза; 3 – развивающийся фолликул; 4 – поверхностный эпителий; 5 – белочная оболочка; 6 – желтое тело; 7 – кортикальный слой яичника; 8 – первичный (примордиальный) фолликул; 9 – фолликул после овуляции; 10 – доминантный фолликул;11 – мозговой слой яичника
Рис. 2.7. Яичник в разрезе (фолликулы и желтое тело в различные фазысвоего развития): 1 – сосуды; 2 – сероза; 3 – развивающийся фолликул; 4 – поверхностный эпителий; 5 – белочная оболочка; 6 – желтое тело; 7 – кортикальный слой яичника; 8 – первичный (примордиальный) фолликул; 9 – фолликул после овуляции; 10 – доминантный фолликул;11 – мозговой слой яичника
Кровоснабжение яичника осуществляется за счет яичниковой артерии (a. ovarica), которая отходит от брюшной части аорты и ветви маточной артерии, идет по верхнему краю широкой связки. Лимфоотток осуществляется в поясничные и крестцовые лимфоузлы.
Иннервируются яичники в основном афферентными волокнами из спинномозговых узлов, а также симпатическими волокнами из узлов чревного и пояснично–крестцового отделов симпатического ствола. Из подчревного сплетения осуществляется парасимпатическая иннервация яичника.
Климактерический период
Физиологический период в жизни женщины, в течение которого происходит постепенное угасание функции яичников и постепенное старение организма, называется климактерическим.В этом периоде выделяют следующие этапы: ■ пременопауза – от 45 лет и до наступления менопаузы ■ менопауза – последняя менструация ■ постменопауза – период после менопаузы.
Раньше пременопауза и постменопауза (переходный период от репродуктивного к пострепродуктивному периоду) назывался климактерическим периодом. В последнее время выделяют перименопаузу – период около менопаузы, он захватывает и пре– и постменопаузу.
Угасание активности репродуктивной системы в этом периоде связано с изменением функции гонад. Секреция прогестерона и эстрогенов постепенно снижается. Уменьшается чувствительность яичников к гонадотропным гормонам, что вызывает увеличение их уровня, в особенности ФСГ. Овуляторные циклы сменяются ановуляторными. Менструации становятся нерегулярными. В постменопаузе наблюдается выраженное снижение уровня эстрогенов. Секреция прогестерона с прекращением овуляции снижается в два раза. Исчезает часть гормонопродуцирующих структур яичника, что сопровождается прогрессирующим фиброзом стромы яичника. Размеры яичников уменьшаются. Уменьшаются размеры матки, постепенно происходит ее атрофия. Слизистая тела матки истончается, суживается просвет желез. Строма матки сморщивается, стенки кровеносных сосудов склерозируются. Эпителий влагалища в пременопаузе многослойный, утолщенный в соответствии с циклическими изменениями еще не угасшей функции яичников, в постменопаузе он – низкий многослойный. Гликогена в эпителиальных клетках очень мало. В менопаузе в соединительной ткани преобладают коллагеновые волокна над элластичными. Снижение, а затем и прекращение продукции эстрогенов вызывает анатомические изменения влагалища и его содержимого. Основные изменения в связи с этим: атрофия слизистой, исчезновение цервикальной слизи. Слизистая истончается, становится легкоранимой, изменяются кровеносные сосуды, уменьшается кровоснабжение влагалища, что ведет к уменьшению влагалищной секреции. Снижение количества гликогена сопровождается замедленным развитием молочно–кислых бактерий, изменением влагалищной микрофлоры и повышенной чувствительностью к инфекциям. Вульва атрофируется, кожа наружных половых органов истончается, постепенно выпадают волосы на лобке, исчезают малые половые губы и уменьшаются большие половые губы.
С различными возрастными периодами жизни женщины и анатомо–физиологическими особенностями женского организма связана многочисленная гинекологическая патология.
Глава 3. Методы исследования в гинекологии
Анамнез и жалобы
Основой постановки предварительного диагноза является сбор жалоб и анамнеза. Схема сбора информации: ■ основная жалоба ■ сопутствующие жалобы ■ перенесенные соматические и другие заболевания ■ семейный анамнез ■ менструальная и репродуктивная функции, характер контрацепции ■ гинекологические заболевания, секреторная и половая функции, заболевания полового партнера ■ характер предшествующего лечения ■ история настоящего заболевания ■ образ жизни, питания, условия труда и быта, вредные привычки. Специальные методы исследования, изложенные ниже, позволяют сформулировать окончательный диагноз.Осмотр больных и гинекологическое исследование
Типобиологическая оценка. При осмотре женщины обращают внимание на длину и массу тела, телосложение, развитие жировой ткани и ее распределение. Различают мужской и евнухоидный типы телосложения. Мужской тип имеет две стадии омужествления: ■ мужской тип: увеличение межакромиального расстояния, увеличение окружности грудной клетки, уменьшение межвертельного размера, увеличение длины тела (высокий рост, широкие плечи, узкий таз) ■ вирильный тип: увеличениемежакромиального размера, уменьшение длины ног, уменьшение межвертельного размера (средний рост, короткие ноги, длинное туловище, широкие плечи, узкий таз).Евнухоидный тип: увеличение длины тела, увеличение длины ног, равные межакромиальные и межвертельные размеры.
Оценка телосложения позволяет ретроспективно определить особенности течения периода полового созревания, когда происходит формирование скелета и его окостенение. При гиперандрогении в пубертатном периоде в зависимости от степени ее выраженности формируется мужской или вирильный тип телосложения. При недостаточности гормональной функции яичников телосложение приобретает евнухоидные черты.
Обязательным является определение длины и массы тела. Эти два показателя позволяют оценить степень превышения массы тела по так называемому индексу массы тела (ИМТ), предложенному G. Brey в 1978 г. ИМТ определяется как отношение массы тела в килограммах к длине тела в метрах, возведенной в квадрат.
ИМТ = масса тела, кг / длина тела, м2.
Например, при массе тела 70 кг, длине 160 см (или 1,6 м) ИМТ = 70/1,62 = 70/2,56 = 27,3.
Исследованиями установлена четкая положительная корреляция между ИМТ и частотой метаболических нарушений (гипергликемия, гиперхолестеринемия, гиперлипидемия, гипертензия, атеросклероз и др.). В норме ИМТ женщин репродуктивного возраста равен 20–26; ИМТ, равный 26–30, свидетельствует о малой вероятности возникновения метаболических нарушений, свыше 30 – о средней степени риска их развития, свыше 40 – о высокой степени риска развития метаболических нарушений. Значения индекса от 30 до 40 соответствуют III степени ожирения (превышение массы тела на 50%), а значение индекса свыше 40 – IV степени ожирения (превышение массы тела на 100%).
При избыточной массе тела необходимо выяснить, когда началось ожирение: с детства, в пубертатном возрасте, после начала половой жизни, после абортов или родов.
В случае необходимости проводят оценку фенотипических особенностей в целях выявления у больных дисплазий и дисморфий, характерных для разных клинических форм нарушения развития половых желез (дисгенезия гонад).
Важное диагностическое значение имеют микро– и ретрогнатия, арковидное нёбо, широкое плоское переносье, низко расположенные ушные раковины, низкий рост, короткая шея с кожным складками, идущими от сосцевидных отростков к плечам (крыловидные складки), бочкообразная грудная клетка с вдавлением тела грудины, вальгусная девиация локтевых суставов, гипоплазия ногтей, обилие родимых пятен.
Состояние кожи и кожных покровов. Необходимо обращать внимание на характер оволосения, особенно избыточного, время его появления (до или после менархе), состояние кожи (повышенная сальность, наличие акне, фолликулитов, повышенной пористости), хорошо заметное на лице и спине. Следует отметить наличие полос растяжения на коже, их цвет, количество и расположение, время их появления, особенно у нерожавших женщин.
Констатирование гирсутизма производится по шкале и диаграмме D. Ferriman, G. Galvey (1961) в табл. 3.1. и на рис. 3.1.
Таблица 3.1. Шкала количественной характеристики гирсутизма (по D. Ferriman, G. Galvey, 1961)
| Зона | Баллы | Описание |
|---|---|---|
| Верхняя губа | 1 | Отдельные волосы на наружном крае |
| 2 | Небольшие усики на наружном крае | |
| 3 | Усы, распространяющиеся на половину расстояния до средней линии верхней губы | |
| 4 | Усы, достигающие средней линии | |
| Подбородок | 1 | Отдельные волосы |
| 2 | Отдельные волосы и небольшие скопления | |
| 3, 4 | Сплошное покрытие волосами, редкое или густое | |
| Грудь | 1 | Волосы вокруг сосков |
| 2 | Волосы вокруг сосков и на грудине | |
| 3 | Слияние этих зон с покрытием до 3/4 поверхности | |
| 4 | Сплошное покрытие | |
| Спина | 1 | Разрозненные волосы |
| 2 | Много разрозненных волос | |
| 3, 4 | Сплошное покрытие волосами, густое или редкое | |
| Поясница | 1 | Пучок волос на крестце |
| 2 | Пучок волос на крестце, расширяющийся в стороны | |
| 3 | Волосы покрывают 3/4 поверхности | |
| 4 | Сплошное покрытие волосами | |
| Верхняя часть живота | 1 | Отдельные волосы вдоль средней линии |
| 2 | Много волос по средней линии | |
| 3, 4 | Покрытие волосами половины или всей поверхности | |
| Нижняя часть живота | 1 | Отдельные волосы вдоль средней линии |
| 2 | Полоса волос вдоль средней линии | |
| 3 | Широкая лента волос вдоль средней линии | |
| 4 | Рост волос в виде римской цифры V | |
| Плечо | 1 | Редкие волосы, покрывающие не более 1/4 поверхности |
| 2 | Более обширное, но неполное покрытие | |
| 3, 4 | Сплошное покрытие волосами, редкое или густое | |
| Бедро | 1, 2, 3, 4 | Значения те же, что на плече |
| Предплечье | 1, 2, 3, 4 | Сплошное покрытие волосами дорсальной поверхности: 2 балла – для редкого и 2 – для густого покрытия |
| Голень | 1, 2, 3, 4 | Значения те же, что на плече |
 Рис. 3.1. Диаграмма Ферримана и Галвея. Цифрами обозначены зоны гипертрихоза на поверхности тела. Зоны 8, 9 и И охватывают переднюю и заднюю поверхности тела. Оволосение каждой из зон оценивается по 4–балльной шкале количественной характеристики
Рис. 3.1. Диаграмма Ферримана и Галвея. Цифрами обозначены зоны гипертрихоза на поверхности тела. Зоны 8, 9 и И охватывают переднюю и заднюю поверхности тела. Оволосение каждой из зон оценивается по 4–балльной шкале количественной характеристики
Оволосение определяется на каждой из 7 зон передней части тела и 2 зонах задней части (зоны 8 и 9 охватывают переднюю и заднюю части). Степень оволосения оценивается по 4–балльной шкале. Показатель гормонального статуса больной определяется исходя из общего количества баллов, которое равняется 36.
Осмотр и пальпация молочных желез. Осмотр молочных желез осуществляют в положении стоя, затем лежа в первую фазу менструального цикла (с 6–го по 12–й день) при поднятых и опущенных руках. Обращают внимание на степень формирования молочных желез, их форму, размеры, состояние кожных покровов и соска, наличие кожных рубцов, втяжений, выбуханий, пигментации. Последовательно пальпируют наружные и внутренние квадранты молочной железы, регионарные зоны лимфооттока. Вначале пальпацию осуществляют поверхностно путем легкого поглаживания обеих желез от периферии к центру, затем глубоко так, чтобы ощутить наличие узловых образований, оценить их размер, количество, плотность, однородность, подвижность, связь с подлежащими тканями, кожей. Определяют отсутствие или наличие отделяемого из сосков, его цвет, консистенцию и характер при надавливании на околососковое поле.
Оценка степени развития молочных желез (по Marshall, Tanner, 1969): ■ I степень – возвышение соска ■ II степень – сосок и ареола слегка приподняты (набухание молочных желез) ■ III степень – ареола и железа слегка приподняты (дальнейшее увеличение молочных желез) ■ IV степень – ареола и сосок возвышаются над всей железой ■ V степень – ареола сливается с контурами железы, сосок возвышается над общим контуром железы и ареолы.
I степень развития молочных желез в норме соответствует препубертатному периоду, II, III и IV – пубертатному периоду, V – репродуктивному возрасту. При общем и половом инфантилизме имеют место I или II степени развития молочных желез.
Цитологическое исследование отделяемого из сосков. При получении отделяемого его посылают на цитологическое исследование. Легко надавливают на основание соска. К выступившей капле прикладывают чистое предметное стекло. Осторожно размазывают каплю другим предметным стеклом. Таким образом готовят не менее 3 мазков, чтобы получить максимум информации о различных отделах системы млечных ходов. Мазки в лабораторных условиях окрашивают по Романовскому – Гимзе.
Исследование наружных половых органов. Исследование начинают с осмотра лобка. Отмечают его форму, состояние подкожного жирового слоя, характер волосистости (женский, мужской или смешанный тип). Затем осматривают внутренние поверхности бедер (гиперемия, пигментация, экзема, кондиломы, варикозное расширение вен), большие и малые половые губы (величина, наличие отека, язв, опухолей, кондиломатозных разрастаний, степень смыкания половой щели, промежность), область заднего прохода (геморроидальные узлы, трещины, кондиломы, язвы, выпадение слизистой оболочки). Для осмотра преддверия влагалища половые губы разводят большим и указательным пальцами левой руки. Обращают внимание на цвет, состояние слизистой оболочки, пигментацию, изъязвления. Осматривают клитор (форма, величина, аномалия развития), наружное отверстие мочеиспускательного канала (состояние слизистой оболочки, наличие полипов, характер выделений), парауретральные ходы (наличие воспаления, гнойных пробок), внутреннюю поверхность больших и малых половых губ (состояние слизистой оболочки, пигментация, наличие язв), девственную плеву (целость, форма разрывов, состояние рубцов). Параллельно выявляют наличие признаков инфантилизма (узкая половая щель, большие половые губы не прикрывают малые, высокая промежность). В преддверии влагалища осматривают выводные протоки больших вестибулярных желез. Обращают внимание на характер выделений, наличие пятен, отека, гиперемии.
Цианоз слизистой оболочки преддверия влагалища может указывать на наличие беременности, застойных явлений в тазу, обусловленных опухолью, неправильным положением матки и др.
Чтобы определить наличие опущения или выпадения стенок влагалища и матки, нужно предложить больной потужиться или покашлять.
После осмотра входа во влагалище исследуют кожу наружных половых органов: определяют ее окраску (бледность, депигментация, гиперемия, изъязвление, кондиломы, варикозно расширенные вены).
При выявлении той или иной патологии наружных половых органов врач производит забор материала для бактериоскопического, цитологического, гистологического исследований (после кольпоскопического, цервикоскопического исследований).
Исследование внутренних половых органов. Влагалище и шейку матки осматривают с помощью влагалищных зеркал. Определяют состояние стенок влагалища (характер складчатости и цвет слизистой оболочки, наличие изъязвлений, разрастаний, опухоли и др.), свода и шейки матки (величина, форма, разрывы, эрозии, эпителиальная дисплазия, эндометриоз, выворот слизистой оболочки, опухоли и др.), а также характер влагалищных выделений.
Влагалищное исследование должно быть комбинированным (бимануальным). Раздвигая большим и указательным пальцами левой руки половые губы, врач вводит указательный, а затем и средний палец во влагалище, обращая внимание на чувствительность, ширину входа во влагалище, упругость его стенок. Другой рукой он фиксирует через брюшную стенку исследуемый орган (матку, придатки), старается прощупать ту или иную область малого таза. Исследование можно производить одним указательным пальцем.
Если введение пальцев во влагалище затруднено, необходимо отвести промежность книзу, предварительно смазав пальцы индифферентным жиром (вазелином). Вводя пальцы глубоко во влагалище, определяют состояние его слизистой оболочки (степень влажности, наличие разрастаний, шероховатости, рубцов, смещаемость), наличие опухолей, перегородки (двойное влагалище); исключают бартолинит (рис. 3.2). Через переднюю стенку влагалища может на значительном протяжении прощупываться мочеиспускательный канал при его инфильтрации. Затем пальцем находят влагалищную часть шейки матки и определяют ее форму (коническая, цилиндрическая), величину, форму наружного маточного зева, его раскрытие (при истмикоцервикальной недостаточности), наличие на шейке разрывов и рубцов после родов, опухолей. При дисплазии шейки матки поверхность ее иногда кажется бархатистой; ovula Nabothi прощупываются в виде небольших бугорков. По расположению шейки матки иногда можно судить о смещении матки.
Исследуют матку. Для того чтобы определить ее положение, форму, величину и консистенцию, пальцами, введенными во влагалище, фиксируют влагалищную часть шейки матки, приподняв ее немного кверху и кпереди и приблизив тем самым дно матки к передней брюшной стенке (рис. 3.3). В норме матка расположена в малом тазу по средней линии, на одинаковом расстоянии от лонного сочленения и крестца. Дно матки обращено кверху и кпереди и не выходит за пределы плоскости входа в малый таз, а шейка матки обращена кзади. Между шейкой и телом матки имеется угол, открытый кпереди. В норме матка взрослой женщины имеет форму груши, сплющенной спереди назад; поверхность ее ровная. При ощупывании матка безболезненна и смещается во всех направлениях. Физиологическое уменьшение матки наблюдается в постменопаузе. Консистенция матки в норме тугоэластичная, при беременности – мягкая, при миоме – плотная.
 Рис. 3.2. Схема пальпации больших вестибулярных желез (по В.И. Бодяжиной, К.Н. Жмакину, 1977)
Рис. 3.2. Схема пальпации больших вестибулярных желез (по В.И. Бодяжиной, К.Н. Жмакину, 1977)
 Рис. 3.3. Схема двуручного (влагалищно–брюшностеночного) исследования (по В.И. Бодяжиной, К.Н. Жмакину, 1977)
Рис. 3.3. Схема двуручного (влагалищно–брюшностеночного) исследования (по В.И. Бодяжиной, К.Н. Жмакину, 1977)
Неизмененные маточные трубы тонкие и мягкие, обычно не прощупываются. Связки, клетчатка и придатки матки в норме настолько мягки и податливы, что прощупыванию не поддаются.
Яичники хорошо прощупываются у худощавых женщин в виде тела миндалевидной формы размером 3*4 см; они достаточно подвижны и чувствительны. Увеличиваются яичники обычно перед овуляцией и при беременности. Правый яичник в большей мере доступен пальпации, чем левый. Околоматочная клетчатка (параметрий) и серозная оболочка матки (периметрий) пальпируются только при наличии в них инфильтрата (ракового или воспалительного), спаек или экссудата. Когда исследование через влагалище невозможно (у девственниц, при артезии влагалища, а также при опухолевых образованиях), показано ректальное комбинированное исследование. Исследование женщины проводят на гинекологическом кресле, надев на руку резиновую перчатку или напальчник, смазанные вазелином. Предварительно пациентке необходимо назначить очистительную клизму.
 Рис. 3.4. Схема ректально–абдоминального исследования (по В.И. Бодяжиной, К.Н. Жмакину, 1977).
Рис. 3.4. Схема ректально–абдоминального исследования (по В.И. Бодяжиной, К.Н. Жмакину, 1977).
Комбинированное прямокишечно–влагалищно–брюшностеночное (рис. 3.4) исследование показано при подозрении на наличие патологических процессов в стенке влагалища, прямой кишке или в прямокишечно–влагалищной перегородке. При наличии того или иного образования, определяемого в малом тазу, следует обратить внимание на его форму, величину, поверхность, консистенцию, подвижность, болезненность и локализацию. Форма образования может быт круглой, продолговатоовальной (миоматозный узел, кистома, фолликулярная киста, дермоидная киста), продолговатой (трубная беременность, сактосальпинкс, опухоль трубы и др.), причудливой (множественная подсерозная миома); поверхность – гладкой (фолликулярная киста, серозная кистома, узел миомы матки, гидросальпинкс), бугристой (интерстициальная множественная миома матки, внутренний очаговый эндометриоз, папиллярная кистома с прорастанием капсулы яичника, эндометриоидная киста яичника, рак яичника и др.); консистенция – мягкой (беременная матка, трубная беременность – перитубарная гематома, по–задиматочная гематома, начальная стадия параметрита, экссудативный пельвиоперитонит, хорионэпителиома и др.), плотной (организованный параметрит, раковый инфильтрат, петрифицированные узлы миомы матки, костные включения в дермоидной кисте и др.), средней плотности (миоматозные узлы, участки внутреннего эндометриоза, текома яичника, фибромиома яичника, опухоль Бренера, рак яичника и др.), ложнофлюктуирующей (пузырный занос); консистенция – мягкоэластической (гидросальпинкс, фолликулярная киста и др.), тугоэластической (кистома яичника), неравномерно–эластической (муцинозная многокамерная кистома).
Образование может быть подвижным (кистомы на «ножке») и неподвижным – интралигаментарные узлы миомы, кистомы, шеечная миома, воспалительный конгломерат, кистома в сочетании со спаечным процессом, злокачественная опухоль яичника, наружный эндометриоз и др.
Болезненность проявляется при воспалительных процессах в придатках матки, эндомиометрите, перекруте «ножки» опухоли, некрозе миоматозного узла; нарушении целости капсулы пиосальпинкса, кисты, кистомы, эндометриозе яичников.
Локализация образования определяется с учетом всех данных исследования, описанных выше.
Определение степени чистоты влагалища
Забор материала для исследования производится браншей пинцета из заднего свода влагалища, тонким слоем наносится на предметное стекло, высушивается, окрашивается метиленовым синим, микроскопия – 10*70.Различают 4 степени чистоты влагалища (рис. 3.5): ■ 1–я степень чистоты – в содержимом влагалища бациллы (влагалищные) в чистой культуре и клетки плоского эпителия, реакция кислая ■ 2–я степень чистоты – кроме влагалищных бацилл (число их меньше, чем при 1–й степени), в содержимом влагалища встречаются единичные лейкоциты, comma variabile, отдельные кокки, много эпителиальных клеток; реакция кислая; 1–я и 2–я степени чистоты считаются нормальными ■ 3–я степень чистоты – влагалищных бацилл мало, преобладают другие виды бактерий, главным образом кокки и comma variabile, много лейкоцитов; реакция слабощелочная ■ 4–я степень чистоты – влагалищных бацилл нет, очень много патогенных микробов (кокки, бациллы, сарцины, встречаются трихомонады) и лейкоцитов, эпителиальных клеток мало; реакция слабощелочная.
Микроскопическая характеристика биоценоза влагалища (Е.Ф. Кира, 1995) представлена в табл. 3.2.
Таблица 3.2. Микроскопическая характеристика биоценоза влагалища
| Тип биоценоза | Признаки | Нозологические формы |
|---|---|---|
| Нормоценоз | Доминирование лактобактерий, отсутствие грамотрицательной микрофлоры, спор, мицелия, псевдогифов, лейкоцитов, единичные чистые клетки эпителия | Нормальный биотоп влагалища |
| Промежуточный тип | Умеренное или сниженное количество лактобактерий, наличие грамположительных кокков, грамотрицательных палочек. Обнаруживаются лейкоциты, моноциты, макрофаги, эпителиальные клетки | Часто наблюдается у здоровых женщин, редко сопровождается субъективными жалобами и клиническими проявлениями |
| Дисбиоз влагалища | Незначительное количество или полное отсутствие лактобактерий, обильная полиморфная грамотрицательная и грамположительная палочковая и кокковая микрофлора: наличие ключевых клеток. Количество лейкоцитов вариабельно, отсутствие или незавершенность фагоцитоза. Полимикробная картина мазка | Бактериальный вагиноз |
| Вагинит | Большое количество лейкоцитов, макрагов, эпителиальных клеток, выраженный фаготоцитоз | Неспецифический вагинит |
| При обнаружении: | ||
| гонококков; | Гонорея | |
| трихомонад; | Трихомоноз | |
| мицелия, псевдогифов, спор | Микотический вагинит |

 Рис. 3.5. Оценка степени чистоты влагалища по микроскопии мазков:I – 1–я степень чистоты; эпителиальные клетки слизистой влагалища и влагалищные палочки; II – 2–я степень чистоты; эпителиальные клетки и влагалищные палочки, comma variabile, несколько лейкоцитов; III – 3–я степень; меньше влагалищных палочек, многочисленные comma variabile, грамположительные и грамотрицательные кокки, много лейкоцитов; IV – 4–я степень; влагалищные палочки отсутствуют, грамположительные и грамотрицательные кокки, стрептококки, справа внизу Trichomonas vaginalis, много лейкоцитов (по Т.Н. Колгушкиной и др., 1999)
Рис. 3.5. Оценка степени чистоты влагалища по микроскопии мазков:I – 1–я степень чистоты; эпителиальные клетки слизистой влагалища и влагалищные палочки; II – 2–я степень чистоты; эпителиальные клетки и влагалищные палочки, comma variabile, несколько лейкоцитов; III – 3–я степень; меньше влагалищных палочек, многочисленные comma variabile, грамположительные и грамотрицательные кокки, много лейкоцитов; IV – 4–я степень; влагалищные палочки отсутствуют, грамположительные и грамотрицательные кокки, стрептококки, справа внизу Trichomonas vaginalis, много лейкоцитов (по Т.Н. Колгушкиной и др., 1999)
Методы исследования, основанные на биологическом эффекте половых гормонов
Базальная температура. Тест основан на гипертермическом воздействии прогестерона на центр терморегуляции, расположенный в гипоталамусе. Температуру измеряют одним и тем же термометром утром натощак, не поднимаясь с постели в течение 10 мин. Полученные данные изображают графически.При повышении секреции прогестерона базальная (ректальная) температура повышается на 0,4–0,8 °С. Стойкий двухфазный цикл свидетельствует о произошедшей овуляции и наличии функционально активного желтого тела (рис. 3.6, а). Отсутствие подъема температуры во вторую половину цикла или значительные размахи температуры как в первую, так и во вторую половину цикла с отсутствием стабильного подъема свидетельствует об ановуляции (рис. 3.6, б). Запаздывание подъема и кратковременность его (гипертермическая фаза в течение 2–7 дней) наблюдается при укорочении лютеиновой фазы, недостаточный подъем (0,2–0,3 °С) – при недостаточной функции желтого тела (рис. 3.6, в).
Исследование шеечной слизи. Метод основан на том, что в течение нормального менструального цикла физико–химические свойства слизи подвержены характерным изменениям. Количество секрета колеблется в пределах от 60–90 мг/сут в раннюю фолликулиновую фазу и 600–700 мг/сут в период овуляции. К этому периоду увеличивается активность некоторых ферментов слизи и появляется ее текучесть, что связано с уменьшением вязкости. Количество слизистого секрета зависит в основном от эстрогенной насыщенности организма. Наибольшее его количество обнаруживают при овуляции, наименьшее – перед началом менструации. «Феномен зрачка» связан с изменениями количества слизи в зависимости от гормональной насыщенности организма и тонуса шейки матки.


 Рис. 3.6. Кривые базальных температур (по З.Ш. Гилязутдиновой, 1982): а – при двухфазном цикле; б – при ановуляторном цикле; в – при недостаточности лютеиновой фазы цикла
Рис. 3.6. Кривые базальных температур (по З.Ш. Гилязутдиновой, 1982): а – при двухфазном цикле; б – при ановуляторном цикле; в – при недостаточности лютеиновой фазы цикла
Шейка матки осматривается в зеркалах с дополнительным освещением несколько раз в течение цикла. В лучах света наружный зев с выступающей каплей слизи кажется темным и напоминает зрачок.
Оценку производят по 3–балльной системе: ■ небольшая точка или полоса – 1 балл (+) ■ 0,2–0,25 см – 2 балла (++) ■ 0,3–0,35 см – 3 балла (+++).
При овуляции с уменьшением секреции эстрогенов «феномен зрачка» постепенно ослабевает и исчезает к 20–23–му дню менструального цикла. Наличие слабо выраженного «феномена зрачка» в течение менструального цикла свидетельствует о гипоэстрогении, сохранение его в течение цикла на высоком уровне (3 балла) – о гиперэстрогении, на уровне 2 баллов – о недостаточности функции желтого тела. При эрозии, эндоцервиците, старых разрывах шейки матки тест бывает нехарактерным.
Натяжение шеечной слизи также зависит от эстрогенной стимуляции, влияющей на уменьшение вязкости слизи и появление текучести.
Слизь набирают корнцангом, который вводят в канал шейки матки. Натяжение определяется при осторожном разведении браншей корнцанга после его извлечения. Длину слизистой нити измеряют в сантиметрах и оценивают по 3–балльной системе: до 6 см – 1 балл (+); 8–10 см – 2 балла (++); более 12 см – 3 балла (+++). Максимальная длина нити бывает в период овуляции.
«Феномен папоротника» основан на способности шеечной слизи при высушивании подвергаться кристаллизации, интенсивность которой изменяется во время менструального цикла и зависит от гормональной активности яичников. Материал забирают анатомическим пинцетом, который вводят в канал шейки матки на глубину 0,5 см. Полученную каплю слизи переносят на предметное стекло и высушивают. Оценку производят под микроскопом при увеличении 10·10 по 3–балльной системе: мелкие кристаллы с нечетким рисунком в виде отдельных стеблей – 1 балл (+), четко выраженный лист с ясным рисунком – 2 балла (++), грубые кристаллы, складывающиеся в «листья папоротника», где ветви отходят под углом 90°, – 3 балла (+++) (рис. 3.7). Выраженный «феномен папоротника» связан с максимальной продукцией эстрогенов в фазу овуляции. В лютеиновую фазу цикла этот феномен постепенно исчезает, перед менструацией кристаллизация слизи отсутствует – 0 баллов (–).
 Рис. 3.7. Микроскопия шеечной слизи (по В.И. Бодяжиной, К.Н. Жмакину, 1977): а – феномен папоротника «+++», б – феномен папоротника «+»
Рис. 3.7. Микроскопия шеечной слизи (по В.И. Бодяжиной, К.Н. Жмакину, 1977): а – феномен папоротника «+++», б – феномен папоротника «+»
Оценка шеечного индекса представлена в табл. 3.3, динамика тестов шеечной слизи – в табл. 3.4.
Кольпоцитология. Метод основан на влиянии стероидных гормонов яичников на органы–мишени, к которым относится и эпителий влагалища (рис. 3.8). Материал получают путем аспирации или осторожного прикосновения инструментом к боковой стенке влагалища, затем его переносят на предметное стекло, фиксируют в смеси Никифорова и окрашивают. Методы окрашивания делятся на монохромные, при которых все клетки мазка окрашиваются в один цвет, и полихромные, окрашивающие клетки в сине–зеленый или оранжево–красный цвет. Вначале клеточный состав изучают при малом увеличении (10·10), оценивая расположение клеток и количество материала, затем – при большом (10·20 или 10x40). Для интерпретации кольпоцитограмм подсчитывают 200–300 клеток.
Таблица 3.3. Оценка шеечного индекса
| Диагностический тест | Баллы | |||
|---|---|---|---|---|
| 0 | 1 | 2 | 3 | |
| «Феномен зрачка» | Отсутствует | Темная точка | 0,2–0,25 см | 0,3–0,35 см |
| «Феномен папоротника» | Кристаллизация отсутствует | Мелкие кристаллы в виде тонких стеблей | Четкий рисунок листа | Грубые кристаллы, лист крупный, с толстым стеблем |
| Количество слизи | Немного | Незначительное | Умеренное | Большое |
| Натяжение слизи | Отсутствует | До 6 см | 8–10 см | 15–20 см |
Таблица 3.4. Норма тестов шеечной слизи при 28–дневном менструальном цикле
| Фазы менструального цикла | «Феномен папоротника» | «Феномен зрачка» | Натяжение слизи | Количество слизи | Шеечный индекс (цервикальное число) | ||||
|---|---|---|---|---|---|---|---|---|---|
| Оценка | Баллы | Диаметр, см | Баллы | Диаметр, см | Баллы | Оценка | Баллы | Баллы | |
| Ранняя фолликулиновая, 4–9–й день | + | 1 | 0,2 (+) | 1 | 6 | 1 | Мало | 1 | 4–6 |
| Поздняя фолликулиновая, 10–13–й день | ++ | 2 | 0,2–0,25 (++) | 2 | 8–10 | 2 | Умеренное количество | 2 | 8–9 |
| Овуляция, 14–15–й день | +++ | 3 | 0,3–0,35 (+++) | 3 | 15–20 | 3 | Большое количество | 3 | 10–12 |
| Ранняя лютеиновая, 16–20–й день | – | 1 | 0,2 (+) | 1 | 6–10 | 1–2 | Умеренное количество или мало | 1–2 | 5–8 |
| Поздняя лютеиновая, 21–27–й день | – | 0 | 0,2 или полоса (+) | 0–1 | 6 | 1–2 | Мало | 1 | 4–6 |
 Рис. 3.8. Схема изменения влагалищного эпителия под влиянием гормонов (по Miklaw, 1961)
Рис. 3.8. Схема изменения влагалищного эпителия под влиянием гормонов (по Miklaw, 1961)
ИС (индекс зрелости) – это процентное отношение парабазальных, промежуточных и поверхностных клеток. Записывается в виде трех чисел слева направо. Сдвиг влево означает появление парабазальных клеток, свидетельствующих о недостаточной функции яичников. Увеличение числа поверхностных клеток свидетельствует о высокой эстрогенной насыщенности организма.
КИ (кариопикнотический индекс) – процентное отношение поверхностных клеток с пикнотичными ядрами к общему числу клеток в мазке. Чем больше значение этого индекса, тем выше эстрогенная насыщенность организма.
ЭИ (эозинофильный индекс) – процентное отношение эозинофильно–окрашенных поверхностных клеток к общему числу клеток мазка. Так же как КИ, служит показателем эстрогенного воздействия. В норме ЭИ < КИ.
Идекс складчатости (загибания) представляет отношение всех складчатых зрелых поверхностных клеток к числу плоских зрелых поверхностных клеток.
Индекс скученности определяется по отношению клеток, находящихся в скоплениях по 5 и более, к клеткам, расположенным раздельно. Оценивается по 3–балльной системе.
Последние два показателя характеризуют прогестероновое воздействие.
Кольпоцитограмма при овуляторном менструальном цикле представлена в табл. 3.5, в конце беременности (по Zidousky) – в табл. 3.6.
Кариопикнотический индекс (КИ) у беременных женщин в норме не превышает 10%, в 13–16 недель он в пределах 3–9%, в 17–39 недель – 5%. Цитологические исследования вагинальных мазков проводятся 1–2 раза в неделю.
У женщин с угрозой прерывания беременности наблюдается повышение КИ от 20 до 50%, что зависит от снижения уровня эстрогенов и прогестерона.
Цитологическая картина влагалищных мазков при осложненном течении беременности.
Эстрогенный тип мазка. В мазке отмечается значительное уменьшение клеточных элементов. Выражена тенденция к изолированному их расположению. Наблюдается сдвиг в сторону увеличения числа поверхностных клеток, повышение кариопикнотического индекса до 30–40% и выше. Ладьевидные клетки определяются в незначительном количестве или их нет. Эстрогенный тип мазка чаще наблюдается при наличии плацентарной недостаточности у беременных с поздним токсикозом, угрожающем прерывании беременности, при резусизоиммунизации.
Тип мазка с преобладанием глубоких промежуточных клеток с крупными ядрами. Они располагаются большими и малыми группами. Ладьевидные клетки значительно уменьшаются в числе или не определяются. Этот тип мазка чаще встречается при тяжелых формах позднего токсикоза и реже характеризует недостаточность плаценты у женщин с угрозой позднего выкидыша, перенашиванием беременности.
Таблица 3.5. Данные кольпоцитограммы при двухфазном менструальном цикле
| Наименование показателя | Фолликулиновая фаза | Овуляция | Лютеиновая фаза | ||||
|---|---|---|---|---|---|---|---|
| Дни менструального цикла | |||||||
| 5–7 | 8–11 | 12–13 | 14 | 15–18 | 19–24 | 25–28 | |
| Реакция влагалищного мазка (по Гейст и Сальмону) | III | III | III–IV4 | IV | IV–III | III | III |
| Кариопикнотический индекс, % | 10–30 | 20–40 | 40–70 | 70–90 | 30–50 | 30 | 15–0 |
| Эозинофильный индекс, % | 5–20 | 20–40 | 50 | 70 | 20–40 | 20 | 10–0 |
| Индекс созревания | 0/80/20 | 0/60/40 | 0/30/70 | 0/10/90 | 0/70/40 | 0/70/30 | 0/95/5 |
| Индекс загибания, % | 0 | 0 | 10–20 | 20–30 | 30–40 | 20–40 | 30–50 |
| Индекс скученности, % | 0–3 | 0–5 | 0–2 | 0–3 | 10–20 | 20–30 | 30 |
Таблица 3.6. Цитология влагалищного мазка в конце беременности
| Тип мазка | Цитологическая картина | Срок беременности |
|---|---|---|
| I тип, «прогрессирующая беременность» | Преобладают ладьевидные и промежуточные клетки в соотношении 3: 1. Характерны скопления клеток. Клетки базофильны, хорошо окрашиваются, имеют четкие границы. Эозинофильный индекс не превышает 1%, кариопикнотический – 3%. Лейкоцитов нет или единичные | II и III триместр беременности, до родов более 10 дней |
| II тип «близко к родам» | Преобладают клетки промежуточного слоя, ладьевидные встречаются реже. Соотношение промежуточных и ладьевидных клеток 1: 1. Больше клеток изолированных. Встречаются поверхностные и эозинофильные клетки с пикнотическим ядром. Контуры клеток резкие. Картина мазка ясная, четкая. Эозинофильный индекс до 2%, кариопикнотический – до 6%. Единичные лейкоциты и немного слизи | За 4–8 дней до родов |
| III тип, «срок родов» | Преобладают промежуточные клетки, соотношение их с ладьевидными равно 3: 1. Поверхностных клеток – до 25–35%. Характерна изолированность клеток. Эозинофильный индекс – до 8%, кариопикнотический – до 20%. Границы клеток стертые, общая картина мазка «смытая», количество лейкоцитов и слизи заметно увеличивается | За 1–3 дня до родов |
| IV тип,«несомненный срок родов» | Преобладают поверхностные клетки, промежуточных мало, ладьевидные отсутствуют. Границы клеток нечеткие. Эозинофильный индекс – до 20%, кариопикнотический – 20–40%. Лейкоциты и слизь образуют скопления, встречаются эритроциты. Мазок имеет вид «грязного» | За 2–3 дня до родов и в день родов |
Цитолитический тип мазка. Характеризуется нарушением морфологической структуры клеток. Отмечается много свободно лежащих ядер, обрывки цитоплазмы. Лейкоциты в небольшом количестве. Много палочек Дедерлейна. Мазок имеет вид тусклого.
Взятие мазков на онкоцитологию
Мазки на онкоцитологию с поверхности шейки матки.Цитологическому исследованию подвергают мазок с поверхности влагалищной части шейки матки, на границе плоского многослойного эпителия с цилиндрическим эпителием слизистой оболочки цервикального канала шейки матки, из нижней трети цервикального канала. Для получения мазка с поверхности шейки матки используют шпатель Эйра или его модификации.
Методика: после введения влагалищных зеркал при помощи шпателя Эйра берут соскоб вокруг входа в цервикальный канал (рис. 3.9). Полученный материал наносят бережно на предметное стекло и фиксируют. Мазок не требует тщательного растирания, так как клетки будут разрушаться. Мазок с поверхности области стыка многослойного плоского и цилиндрического эпителия осуществляют металлическим шпателем. Мазок с поверхности канала шейки матки можно получить с помощью пинцета, его обратной стороной. Нежно надавливая на слизистую оболочку так, чтобы не травмировать ее, получают содержимое, которое наносят на предметное стекло в виде тонкого мазка. Обозначают мазки: «ш» – шейка матки, «с» – стык цилиндрического и плоского эпителия, «к» – канал шейки матки. Прицельные соскобы берут при выявлении патологических состояний после кольпоскопического исследования.
 Рис. 3.9. Схема забора соскоба шпателем Эйра с поверхности шейки матки для цитологического исследования (по Л.Н. Василевской, 1986)
Рис. 3.9. Схема забора соскоба шпателем Эйра с поверхности шейки матки для цитологического исследования (по Л.Н. Василевской, 1986)
Гормональные пробы
Гормональные пробы применяют для уточнения функционального состояния различных отделов репродуктивной системы. Принцип исследования основан на том, что введенные в организм гормоны обладают такими же свойствами, как эндогенные.Проба с гестагенами. Показания: выяснить степень дефицита эстрогенов и реактивность эндометрия. Назначается при аменорее любой этиологии.
Прогестерон назначается по 10–20 мг/сут в течение 7–10 дней (дюфастон 10 мг, утрожестан 400 мг, норколут 10 мг ежедневно в течение 7–10 дней).
Появление кровотечения через 3–5 дней после окончания пробы оценивается как положительный результат, отсутствие – как отрицательный.
Положительная проба указывает на умеренную эстрогенную недостаточность, так как прогестерон вызывает секреторную трансформацию эндометрия и отторжение его только в том случае, если эндометрий достаточно подготовлен эстрогенами. Отрицательная проба может быть при маточной форме аменореи или при эстрогенной недостаточности.
Проба может проводиться как дифференциально–диагностическая при синдроме поликистозных яичников. До и после нее исследуют экскрецию 17–КС (17–кетостероидов). Если после пробы экскреция 17–КС снижается на 50% и более, то проба оценивается как положительная и свидетельствует о гипоталамо–гипофизарном генезе заболевания. Отсутствие или незначительные изменения уровня 17–КС – отрицательная проба, указывающая на яичниковый генез.
Проба с эстрогенами и гестагенами. Показания: исключить заболевания или повреждения эндометрия (маточную форму аменореи) и выяснить степень дефицита эстрогенов. Проводится при аменорее.
Прогинова назначают по 1–2 таблетке в течение 8–10 дней, затем – гестагены в течение 7–10 дней. Отсутствие менструальноподобной реакции через 2–4 дня после окончания пробы оценивается как отрицательная реакция и свидетельствует о маточной форме аменореи. Положительная проба указывает на гипофункцию яичников.
Проба с гонадотропином. Показания: подозрение на первичную яичниковую недостаточность. Применяют для установления причины ановуляции.
Пергонал в дозе 150 МЕ вводят внутримышечно в течение 5–7 дней или назначают гонадотропин хорионический (профази) по 1500–3000 ЕД в течение 3 дней. Контролем является определение содержания эстрадиола в крови до и после введения препарата. При положительной пробе происходит увеличение уровня эстрадиола в 3–5 раз. Отрицательная проба указывает на первичную неполноценность яичников. Снижение КИ (менее 50%), повышение базальной температуры, ультразвуковое исследование яичников, при котором регистрируется наличие фолликулов диаметром более 18 мм свидетельствуют о первичной недостаточности гипоталамо–гипофизарной системы.
Проба с кломифеном. Показания: заболевания, сопровождающиеся хронической ановуляцией на фоне аменореи или гипоменструального синдрома.
Перед проведением пробы вызывают менструальноподобную реакцию (гестагенами или оральными контрацептивами). С 5–го по 9–й день от начала реакции назначают кломифен по 100 мг в день (2 таблетки). Кломифен как антиэстроген вызывает временную блокаду эстрогеновых рецепторов и усиление секреции гонадотропного рилизинг–гормона. Это приводит к выбросу гипофизом ФСГ (фолликулостимулирующего гормона) и ЛГ (лютеинизирующего гормона) и созреванию фолликулов в яичнике с синтезом стероидных гормонов.
Положительная проба указывает на сохраненную активность гипоталамуса, гипофиза и яичников.
Контролируется проба с кломифеном по базальной температуре и появлению менструальноподобной реакции через 25–30 дней после приема кломифена. При этом возможны ановуляторные циклы (менструальная реакция наступила, базальная температура монофазная), овуляторные циклы (базальная температура двухфазная, менструация в срок) и циклы с недостаточностью лютеиновой фазы (базальная температура двухфазная с укороченной менее 8 дней 2–й фазой, менструация в срок).
Отрицательная проба (отсутствие увеличения эстрадиола, гонадотропинов в крови, монофазная температура, отсутствие менструальноподобной реакции) указывает на нарушение функциональной способности гипоталамуса и гипофиза.
Проба с гормональными контрацептивами. Показания: уточнение генеза гиперандрогении. Препарат из группы оральных контрацептивов (ОК) назначают по 2 таблетки в день в течение 10 дней. До и после пробы определяют экскрецию 17–КС. Положительная проба (снижение экскреции 17–КС на 50% и более) свидетельствует о яичниковом генезе заболевания, отрицательная – о надпочечниковом.
Проба с дексаметазоном. Показания: для установления источника гиперандрогении у женщин с клиническими проявлениями вирилизации. Проба основана на тормозящем действии высоких концентраций глюкокортикоидов на выделение АКТГ передней долей гипофиза, вследствие чего снижается образование и выделение андрогенов надпочечниками.
Повышенная секреция андрогенов яичниками возможна при эндокринных заболеваниях и вирилизующих опухолях. Источником андрогенов могут быть надпочечники. В связи с этим перед проведением пробы необходимо исключить опухоль яичников с помощью ультразвуковой диагностики или лапароскопии.
Имеются две разновидности пробы – малая и большая. Малый тест заключается в назначении внутрь по 0,5 мг дексаметазона 4 раза в сутки в течение 3 дней. До и после проведения пробы определяют содержание 17–КС. Большой тест состоит в назначении 2 мг дексаметазона каждые 6 ч в течение 3 дней с последующим определением содержания 17–КС.
Проба положительная, если снижение содержания 17–КС имеет место на 50–75% по сравнению с исходным и указывает на надпочечниковый генез заболевания (гиперплазия коркового вещества). Отрицательная проба (отсутствие снижения 17–КС) свидетельствует о наличии вирилизующей опухоли надпочечников, так как в ней секреция андрогенов имеет автономный характер и не снижается при блокаде АКТГ гипофиза дексаметазоном.
Проба с дифенином. Показания: выявление центральной формы синдрома ПКЯ и оценка возможности регуляции гипоталамо–гипофизарныхнарушений с помощью нейромедиаторов.
Дифенин назначается по 1 таблетке 3 раза в день 3 дня после предварительного определения исходных уровней ЛГ, ФСГ, Т.
Положительная проба (снижение ЛГ, Т) означает нарушение выработки нейромедиаторов. Отрицательная проба свидетельствует об отсутствии центрального генеза нарушений при ПКЯ.
Инструментальные методы исследования
Биопсия эндометрия
Материал для исследования рекомендуется брать на 21–24–й день цикла (при 28–дневном) путем вакуум–аспирации или методом выскабливания. Полученный соскоб фиксируют, окраску препаратов производят гематоксилином и эозином или по Ван–Гизону. При оценке препаратов учитывают морфологические особенности фукционального слоя эндометрия, характер строения стромы и желез, особенности желез (рис. 3.10). В норме в лютеиновую фазу цикла железы расширены, пиловидной формы, цитоплазма клеток железистого эпителия светлая, ядра бледные, в просвете желез виден секрет (рис. 3.11, а).При ановуляторном менструальном цикле железы эндометрия узкие или несколько расширенные, прямые или извитые. Железистый эпителий цилиндрический, высокий, ядра крупные, расположены базально или находятся на различных уровнях.
Атрофический эндометрий характеризуется преобладанием стромы, иногда видны единичные железы (рис. 3.11, б). Соскоб скудный.
Железисто–кистозная гиперплазия эндометрия характеризуется кистозно расширенными железами, усиленной пролиферацией эпителия, часто он многоядерный, с утолщенными или кубическими клетками, ядра находятся на различных уровнях (рис. 3.11, в).
 Рис. 3.10. Схема изменения эндометрия в динамике менструального цикла (железы трансформируются от прямых к извитым, возрастает толщина и васкуляризация слизистой. Часть базального эндометрия не подвергается циклическим изменениям и не отторгается во время менструации) (по F.H. Netter, 1965)
Рис. 3.10. Схема изменения эндометрия в динамике менструального цикла (железы трансформируются от прямых к извитым, возрастает толщина и васкуляризация слизистой. Часть базального эндометрия не подвергается циклическим изменениям и не отторгается во время менструации) (по F.H. Netter, 1965)


 Рис. 3.11. Микрофотографии эндометрия: а – секреторная трансформация эндометрия на 23–й день овуляторного менструального цикла; б – атрофия эндометрия; в – гиперплазия эндометрия (по Т.С. Диваковой, 2000)
Рис. 3.11. Микрофотографии эндометрия: а – секреторная трансформация эндометрия на 23–й день овуляторного менструального цикла; б – атрофия эндометрия; в – гиперплазия эндометрия (по Т.С. Диваковой, 2000)
Зондирование полости матки
Зондирование выполняют для определения положения и направления полости матки, ее длины и состояния рельефа стенок матки. Зондирование производится маточным зондом, изготовленным из мягкого металла, длиной 25 см, диаметром 3 мм. На конце зонда имеется пуговка и утолщение на расстоянии 7 см от пуговки, соответствующее нормальной длине полости матки. На поверхности зонда нанесены сантиметровые деления. Зондирование матки производят обязательно перед диагностическим выскабливанием полости матки, при искусственном аборте, для определения аномалий развития матки, субмукозного узла в матке (рис. 3.12) и др.Противопоказанием для зондирования матки являются острые и подострые воспалительные процессы половых органов, подозрение на маточную или внематочную беременность. Зондирование матки производят только в условиях стационара с соблюдением правил асептики и антисептики.
Техника зондирования полости матки: левой рукой пулевыми щипцами фиксируют и низводят шейку матки, а правой – берут зонд так, чтобы рукоятка его лежала свободно между большим и указательным пальцами. Вводят зонд в канал шейки матки без применения силы, осторожно продвигая до дна матки. В случае препятствий при продвижении зонда меняют его направление. По окончании зондирования извлекают зонд, снимают пулевые щипцы и влагалищную часть шейки матки смазывают йодом. По шкале маточного зонда определяют длину полости матки. Направлением движения зонда определяется положение матки: в положении anteversio зонд направляется кпереди, в retroversio – кзади. Рельеф стенок полости матки в норме гладкий, ровный. Плотная неровная поверхность, выдающаяся в полость, свидетельствует о наличии субмукозной миомы. Участки мягкой консистенции подозрительны на злокачественный рост. При аномалиях развития матки определяется перегородка в матке или двойная матка. Кровяные выделения во время зондирования или после него могут появиться ввиду легкого ранения тканей при полипозе, эндометрите или раке матки. При зондировании матки можно образовать ложный ход или перфорировать стенку матки. Это может произойти, если перед зондированием не определено положение матки или если введение зонда осуществлялось с усилием.
 Рис. 3.12. Схема зондирования матки при субмукозной миоме (по В.И. Бодяжиной, К.Н. Жмакину, 1977)
Рис. 3.12. Схема зондирования матки при субмукозной миоме (по В.И. Бодяжиной, К.Н. Жмакину, 1977)
Диагностическое выскабливание матки
Выскабливание стенок полости матки представляет собой инструментальное удаление функционального слоя слизистой оболочки матки вместе с патологическими образованиями, которые могут из нее исходить. Диагностическое выскабливание производится в условиях стационара при соблюдении принципов асептики и антисептики, под общим обезболиванием.Показания: маточные кровотечения, дисфункциональные нарушения менструального цикла, подозрение на злокачественные опухоли матки, плацентарный и децидуальный полипы, гиперплазию и полипоз слизистой матки, неполный выкидыш и др. При полипах, гиперплазии, неполных выкидышах выскабливание производят не только с диагностической, но и с терапевтической целью.
Противопоказаниями для выскабливания стенок полости матки являются острые воспалительные процессы половых органов.
Техника диагностического выскабливания: после дезинфекции наружных половых органов и влагалища шейку матки обнажают при помощи зеркал, обрабатывают спиртом и за переднюю губу захватывают пулевыми щипцами. Если матка в положении ретрофлексии, то лучше захватить шейку за заднюю губу. Производят зондирование полости матки и расширение канала шейки расширителями Гегара до № 9–10. Расширители вводят, начиная с малых номеров, только силой пальцев, а не всей руки. Расширитель не доводят до дна матки, достаточно провести его за внутренний зев. Каждый расширитель надо оставить в канале на несколько секунд; если последующий расширитель входит с большим трудом, то следует еще раз ввести предыдущий расширитель. Кюретку держат свободно, без упора на рукоятку. Вводят до дна матки, а затем нажимают на рукоятку, чтобы петля кюретки скользила по стенке матки, и смещают ее сверху вниз к внутреннему зеву. Для выскабливания задней стенки, не извлекая кюретки из полости матки, поворачивают ее осторожно на 180°. Выскабливание производят в определенном порядке: сначала выскабливают переднюю стенку, затем левую боковую, заднюю, правую боковую и углы матки. Соскоб тщательно собирают в баночку с 10% раствором формалина и отправляют на гистологическое исследование.
Особенности выскабливания матки зависят от характера патологичекого процесса. Неровная, бугристая поверхность полости матки может быть при интерстициальной или субмукозной миоме. В этих случаях выскабливание надо производить осторожно, чтобы не повредить капсулу миоматозного узла. Повреждение капсулы миоматозного узла может вызвать кровотечение, некроз узла и его инфицирование. Соскоб может иметь вид крошковатых масс, характерных для распадающихся злокачественных опухолей. В таких случаях не следует производить полное выскабливание, чтобы не перфорировать стенку матки. Во всех случаях подозрения на злокачественную опухоль следует производить раздельное диагностическое выскабливание матки. Сначала производят выскабливание слизистой оболочки цервикального канала, не заходя за внутренний зев. Соскоб собирают в отдельную пробирку. Затем выскабливают слизистую матки и этот соскоб помещают в другую пробирку. В направлениях на гистологическое исследование отмечают, из какой части матки получен соскоб.
Биопсия шейки матки
Биопсия – это иссечение кусочка патологически измененных тканей с целью гистологического исследования. Биопсия может быть произведена скальпелем, конхотомом или петлей электрода от аппарата для электрокоагуляции.Перед проведением биопсии шейки матки проводят реакцию Вассермана, исследуют мазки из уретры, канала шейки и влагалища на инфекцию. После расширенного кольпоскопического исследования осуществляют прицельную биопсию.
Техника ножевой биопсии шейки матки: после дезинфекции вульвы, кожи промежности и влагалища раствором йода обнажают шейку матки при помощи зеркал, обрабатывают спиртом, захватывают пулевыми щипцами и низводят. Скальпелем производят клиновидное иссечение ткани размером не менее 1 см таким образом, чтобы в него входила патологически измененная и здоровая ткань. Нельзя захватывать пинцетом эпителиальный покров вырезаемого кусочка, чтобы его не повредить (рис. 3.13). Кровотечение из раны останавливают тампонадой влагалища или наложением на рану 1–2 кетгутовых швов.
 Рис. 3.13. Схема биопсии шейки матки (по Л.С. Персианинову, 1961)
Рис. 3.13. Схема биопсии шейки матки (по Л.С. Персианинову, 1961)
Пункция брюшной полости через задний свод влагалища. Задняя кольпотомия
Пункция делается при подозрении на наличие свободной жидкости в полости малого таза, подозрении на внематочную беременность при нечетко выраженной клинической картине; в случаях трудной дифференциальной диагностики, с целью определения места разреза при кольпотомии, при подозрении на наличие рака яичника. Пункцию через задний свод производят в условиях стационара при соблюдении всех правил асептики и антисептики. Перед операцией необходимо опорожнить мочевой пузырь и кишечник. Пункцию производят толстой иглой длиной 10–12 см, надетой на шприц объемом 10 мл.Техника пункции: больную укладывают на гинекологическое кресло. Наружные половые органы, влагалище и шейку матки дезинфицируют спиртом и 5% спиртовым раствором йода. При помощи заднего зеркала и подъемника обнажают влагалищную часть шейки матки, заднюю губу ее захватывают пулевыми щипцами, подъемник удаляют, заднее зеркало передают ассистенту. Шейку матки за пулевые щипцы подтягивают на себя и кпереди, одновременно зеркалом надавливают на заднюю стенку влагалища и таким образом максимально растягивают задний свод. Под шейкой матки строго по средней линии, отступая на 1 см от места перехода свода во влагалищную часть шейки матки, вводят иглу через задний свод на глубину 2–3 см (рис. 3.14). При проколе свода получается ощущение проваливания иглы в пустоту. После этого нужно потянуть поршень шприца на себя. Если жидкость не идет в шприц, то можно осторожно продвинуть иглу вглубь или, наоборот, медленно ее извлекать и одновременно потягивать поршень шприца на себя. Полученный пунктат осматривают, определяют его характер, цвет, запах. По показаниям проводят бактериологическое, цитологическое, онкоцитологическое или биохимическое исследование. При прервавшейся внематочной беременности в пунктате имеет место жидкая кровь темного цвета с мелкими сгустками.
 Рис. 3.14. Схема пункции брюшной полости через задний свод влагалища
Рис. 3.14. Схема пункции брюшной полости через задний свод влагалища
Заднюю кольпотомию выполняют для эвакуации гноя из абсцесса позадиматочного пространства. Вначале проводят пункцию брюшной полости через задний свод влагалища. По игле скальпелем рассекают задний свод (рис. 3.15, а). Отверстие расширяют зажимом тупо (рис. 3.15, б). Выполняют пальцевое исследование полости абсцесса, вскрывая при этом все карманы. Стараются избежать проникновения в брюшную полость. Устанавливают дренажную трубку, фиксируя ее швом к малой половой губе или стенке влагалища.
Диагностика проходимости маточных труб
Проходимость маточных труб определяют с помощью кимографических методов исследования – пертубации и гидротубации.Пертубация заключается во введении в маточные трубы воздуха с помощью специального аппарата. Давление воздуха повышают постепенно в течение 30 мин, оно не должно превышать 24 кПа (180 мм рт. ст.). Результаты пертубации оценивают по показателям пертубационного давления, количеству введенного воздуха, данным двусторонней аускультации и наличию френикус–симптома. Различают следующие типичные кимографические кривые: 1–й вариант – трубы хорошо проходимы, максимальное давление не превышает 12 кПа (90 мм рт. ст.); 2–й вариант –трубы стенозированы, максимальное давление 150 мм рт. ст, снижение кривой пологое; 3–й вариант – трубы непроходимы, максимальное давление 21,3–24 кПа (160–180 мм рт. ст.), снижение кривой практически отсутствует (рис. 3.16).
 Рис. 3.15. Схема задней кольпотомии: а – натяжение заднего свода влагалища; б – вскрытие позадиматочного пространства
Рис. 3.15. Схема задней кольпотомии: а – натяжение заднего свода влагалища; б – вскрытие позадиматочного пространства

 Рис. 3.16. Оценка результатов пертубации: а – маточные трубы хорошо проходимы; б – спазм трубы; в – стеноз трубы; г – трубы непроходимы (по Т.Д. Травянко, Я.П. Сольскому, 1989)
Рис. 3.16. Оценка результатов пертубации: а – маточные трубы хорошо проходимы; б – спазм трубы; в – стеноз трубы; г – трубы непроходимы (по Т.Д. Травянко, Я.П. Сольскому, 1989)
Гидротубация заключается во введении в маточные трубы жидкости. Условия проведения те же, что и для пертубации. Используют стерильный раствор натрия хлорида, 0,25% раствор новокаина и др. Проведение гидротубации при давлении свыше 24 кПа (180 мм рт. ст.) противопоказано.
Эхографическое исследование
Ультразвуковое исследование (УЗИ) – безопасный, высокоинформативный метод. Может использоваться для выявления заболеваний органов репродуктивной системы.Показания: подозрение на гинекологическую патологию, ургентные состояния, контроль лечения, скрининговые исследования в акушерстве и гинекологии.
Противопоказания для проведения исследования нет.
Методика: используют трансабдоминальную, влагалищную, ректальную методику.
Трансабдоминальный секторальный датчик имеет частоту 3,5–5 МГц, влагалищный – 5–7,5 МГц.
При применении трансабдоминальных датчиков исследование проводят в условиях наполненного мочевого пузыря. Перед использованием влагалищного датчика его подвергают специальной обработке, затем на его сканирующую поверхность наносят звукопроводящий гель и надевают презерватив.
При допплерографии определяют количество зон васкуляризации, наличие или отсутствие мозаичности кровотока, а также показатели скорости кровотока: пульсационный индекс (ПИ), индекс резистентности (ИР) и максимальную систолическую скорость кровотока (Vc).
Чувствительность и специфичность метода варьируют в широких пределах и колеблются от 50 до 90%. Чувствительность и специфичность метода зависят от характера образования, его размеров, опыта исследователя и качества используемой ультразвуковой аппаратуры.
Использование трансвагинальных датчиков позволяет в более ранние сроки установить факт беременности, с большей точностью изучить развитие плодного яйца (эмбриона и экстраэмбриональных структур), уже с I триместра диагностировать большинство грубых аномалий развития эмбриона/плода. Интерпретацию эхограмм осуществляют на основании анализа внутренней структуры образования, его эхогенности, звукопроводимости и оценки контура. После завершения исследования дают заключение о структуре образования (кистозное, солиднокистозное, солидное) и по возможности делают заключение о его нозологической принадлежности.
Допплерография имеет большое клиническое значение в дифференциальной диагностике доброкачественных и злокачественных опухолей яичников. Наиболее характерными допплерографическими признаками злокачественного процесса являются наличие большого числа зон васкуляризации, мозаичность кровотока, низкие значения ПИ (<0,6) и ИР (<0,45) и высокая Vc.
По данным сонографии установлено, что в норме матка имеет грушевидную форму. Ее длина у женщин детородного возраста составляет в среднем 5,0 см (4,5–6,7 см), толщина – 3,5 см (3,0–4,0 см) и ширина – 5,4 см (4,6–6,4 см). В постменопаузальном периоде величина матки существенно уменьшается и через 20 лет после окончания менструаций ее длина составляет в среднем 4,2 см, толщина – 3,0 см и ширина – 4,4 см (рис. 3.17).
При вычислении толщины эндометрия (М–эхо) отмечены изменения этого параметра в зависимости от фазы менструального цикла. В первые дни менструального цикла полость матки может быть расширена до 0,1–0,4 см, на 3–4–й день цикла толщина эндометрия составляет 0,1–0,4 см, на 5–6–й день – 0,3–0,6 см, на 8–10–й день – 0,6–1,0 см, на 11–14–й день – 0,8–1,5 см, на 15–18–й день – 1,0–1,6 см, на 19–23–й день – 1,0–2,0 см и на 24–28–й день – 1,0–1,7 см. В норме на протяжении всего менструального цикла эндометрий должен быть однородным, в I фазу цикла анэхогенным и к концу II фазы гиперэхогенным.
Размеры яичников у женщин детородного возраста составляют в среднем в длину 3,6 см (3,0–4,1 см), в ширину – 2,6 см (2,0–3,1 см), в толщину – 1,9 см (1,4–2,2 см). В паренхиме яичников при трансвагинальном сканировании выявляют множественные элементы фолликулярного аппарата диаметром 0,3–0,6 см, а в середине цикла – доминантный фолликул диаметром 1,8–2,4 см. После наступления овуляции в паренхиме яичника появляется желтое тело – образование круглой формы, анэхогенной или гетерогенной структуры с толстыми стенками диаметром около 2,0 см, которое постепенно уменьшается в размерах к началу следующего цикла. После менопаузы происходит исчезновение фолликулярного аппарата и постепенное уменьшение размеров яичников.
 Рис. 3.17. Сонограмма трансабдоминальная органов малого таза:а – интерстициальный узел миомы; б – двухкамерная эндометриоидная киста яичника (по ТС. Диваковой, 2000)
Рис. 3.17. Сонограмма трансабдоминальная органов малого таза:а – интерстициальный узел миомы; б – двухкамерная эндометриоидная киста яичника (по ТС. Диваковой, 2000)
Ультразвуковой скрининг беременных проводится в сроки 10–13, 20–24 и 30–34 недели.
Ультразвуковое исследование в I триместре беременности позволяет: ■ установить маточную беременность на основании визуализации плодного яйца в полости матки ■ исключить внематочную беременность ■ диагностировать многоплодную беременность, тип плацентации (бихориальная, монохориальная) ■ оценить рост плодного яйца (средний внутренний диаметр плодного яйца, копчико–теменной размер эмбриона/плода) ■ оценить жизнедеятельность эмбриона (сердечная деятельность, двигательная активность) ■ исследовать анатомию эмбриона/плода, выявить эхомаркеры хромосомной патологии ■ изучить экстраэмбриональные структуры (желточный мешок, амнион, хорион, пуповину) ■ диагностировать осложнения беременности (угрожающий аборт, начавшийся аборт, полный аборт, пузырный занос) ■ диагностировать патологию гениталий (миома матки, аномалии строения матки, внутриматочная патология, образования яичников) на фоне беременности.
Диагностика маточной беременности при УЗИ возможна с самых ранних сроков. С 3–й недели от зачатия в полости матки начинает визуализироваться плодное яйцо в виде эхонегативного образования округлой или овоидной формы диаметром 5–6 мм. В 4–5 недель возможна визуализация эмбриона – эхопозитивной полоски размером 6–7 мм. Головка эмбриона идентифицируется с 8–9 недель в виде отдельного анатомического образования округлой формы средним диаметром 10–11 мм.
Наиболее точный показатель срока беременности в I триместре – КТР эмбриона. Средняя ошибка в определении срока беременности при измерении плодного яйца составляет ±5 дней, КТР – ±2 дня.
Оценка жизнедеятельности эмбриона в ранние сроки беременности основывается на регистрации его сердечной деятельности и двигательной активности. При УЗИ регистрировать сердечную деятельность эмбриона можно с 4–5 недель ЧСС постепенно увеличивается с 150–160 уд/мин в 5–6 недель до 175–185 уд/мин в 7–8 недель с последующим снижением до 150–160 уд/мин к 12–й неделе. Двигательную активность оценивают с 7–8 недель.
С 4–5 недель беременности определяется желточный мешок, величина которого варьирует от 6 до 8 мм. К 12–й неделе происходит физиологическая редукция желточного мешка. Отсутствие желточного мешка и его преждевременная редукция – прогностически неблагоприятные признаки.
С помощью трансвагинальной эхографии в I триместре беременности диагностируют грубые ВПР – анэнцефалию, грыжу спинного мозга, скелетные аномалии, мегацистис и др. В 11–14 недель крайне важно выявление эхомаркеров хромосомной патологии – воротникового отека, гипоплазии/отсутствия носовой кости, неиммунной водянки плода, несоответствия КТР эмбриона сроку беременности. Осложнения отсутствуют.
Рентгенологические методы
Рентгенологическое исследование черепа
Состояние костей свода черепа и области турецкого седла оценивается по боковой рентгенограмме черепа. Снимок выполняется при следующих технических условиях: расстояние от трубки до стола –80 см, напряжение – 63 кВ, сила тока – 60 мА, экспозиция – 0,8 с при боковой проекции и 1 с – при прямой. Должна быть правильная укладка больных, особенно тучных, чтобы сагиттальная плоскость черепа была параллельна плоскости стола, можно использовать ватно–марлевый валик (диаметр 25–30 см, толщина 4–5 см). Укладка считается правильной, если плоскость дна передней черепной ямки представлена одной линией, а изображения тел скуловых костей («тени падающих капель») максимально совпадают. Тогда тени передних отростков клиновидной кости и гипофизарной ямки будут видны четко, без раздвоения.При оценке состояния турецкого седла учитывают его размеры, конфигурацию и контуры: сагиттальный размер (в норме 9–4 мм) определяется по линии, соединяющей две наиболее отдаленные точки гипофизарной ямки и параллельной плоскости клиновидной кости. Вертикальный размер в норме равен 8–12 мм.
Для определения строят проекцию диафрагмы турецкого седла, другую линию проводят касательно дну и параллельно плоскости клиновидной кости. Из точки касания ставят перпендикуляр до пересечения с проекцией диафрагмы турецкого седла, этот отрезок и является вертикальным размером гипофизарной ямки. Соотношение вертикального и сагиттального размеров турецкого седла (индекс седла) в норме меньше 1; индекс больше 1 свидетельствует об инфантильности.
При чтении и оценке краниограммы обращают внимание на состояние костей свода черепа, придаточных пазух носа, на наличие рисунка «пальцевых вдавлений», истончение диплоического слоя костей, усиление и деформацию рисунка каналов диплоических вен, диффузный или очаговый остеопороз, в том числе верхнего отдела спинки турецкого седла и передних клиновидных отростков, развитие и степень пневматизации ячеек сосцевидной кости, появление крупнопетлистого рисунка кости, истончение и подчеркнутость краев кортикального слоя.
Гистеросальпингография
Представляет собой контрастное изображение полости матки и маточных труб с помощью рентгенографии. Показаниями к применению данного метода исследования являются различные патологические процессы, вызывающие изменение формы и величины матки. Сальпингографию применяют для диагностики проходимости маточных труб. Цервикография дает возможность выяснить состояние рельефа слизистой оболочки канала шейки матки, обнаружить полипоз, деформацию, эктропион шейки матки.Метросальпингографию (МСГ) проводят через 7–10 дней после окончания менструаций и не позже чем за 7–10 дней до начала ее. Применяют водные йодсодержащие неионные рентгеноконтрастные вещества.
Методика: накануне вечером и утром в день исследования рекомендуется сделать очистительную клизму. Перед началом метросальпингографии необходимо опорожнить мочевой пузырь. Больную укладывают на край рентгеновского стола так же, как для влагалищной операции. Наружные половые органы, влагалище и шейку матки обрабатывают спиртовым раствором йода или спиртом. Накладывают пулевые щипцы на переднюю губу шейки матки при положении тела матки кпереди или на заднюю губу при положении тела матки кзади. В полость матки медленно в течение 15–20 с при помощи шприца Брауна или приспособления для МСГ вводят 4–5 мл контрастной жидкости, подогретой до температуры тела. Наконечник вводят так, чтобы он не достигал дна матки, а узкая его часть заходила за внутренний зев. После медленного введения контрастного вещества в полость матки наконечник удаляют и на шейку, закрывая наружный зев, накладывают пулевые щипцы. Из влагалища тампоном удаляют контрастное вещество (во избежание наложения тени на изображение половых органов). Сразу после введения контрастного вещества производят первый снимок (рис. 3.18). Если контрастное вещество не попало в маточные трубы, то через 15–20 мин делают второй снимок. Если контрастное вещество заполнило маточные трубы на всем протяжении, а в свободную брюшную полость не попало, через 1 сутки выполняют контрольный снимок.
Маммография.
Маммография – рентгенография молочных желез без применения контрастных веществ. Этот метод позволяет исключить анатомические изменения в них, наличие опухоли, а также оценить состояние железистой и фиброзной ткани. Маммография является лучшим и недорогим методом визуализации молочных желез (информативность – 95–97%).Рентгенографию молочных желез выполняют на предназначенном для этой цели рентгеновском аппарате («Senograph», Франция; «Isis», Бельгия; «Mammomat», Германия; «TURD240», Германия и др.) с использованием специальных усиливающих экранов типа ЭУИ5, Min R (США), Lo Dose (Франция), позволяющих снизить дозовые нагрузки до минимума.
Показания: подозрение на опухоль молочной железы по данным физикального обследования и клинической картины, скрининговое обследование женщин один раз в 2 года в возрасте после 35 лет и один раз в год после 50 лет, рак молочной железы.
 Рис. 3.18. Гистеросальпингограмма: полость матки обычная, левая маточная труба проходима с перитубарными спайками, правая маточная труба окклюзирована с гидросальпинксом (по Дж. В. Рейньяка и др., 1982)
Рис. 3.18. Гистеросальпингограмма: полость матки обычная, левая маточная труба проходима с перитубарными спайками, правая маточная труба окклюзирована с гидросальпинксом (по Дж. В. Рейньяка и др., 1982)
Противопоказаний нет. При беременности необходимо использовать свинцовый фартук.
Методика: рентгеновский снимок при скрининге выполняется в косой проекции, при подозрении на опухоль – в краниокаудальной, косой и боковой с направлением пучка излучения под углом 45° для 1–й и 2–й проекций. Имеет важное значение компрессия железы во время укладки (рис. 3.19). Для пациенток с силиконовыми имплантатами, кроме обычных проекций, используют укладку, когда ткань, располагающаяся впереди имплантата, подвергается сдавливанию отдельно. Тогда имплантат смещается в сторону грудной стенки. Чтобы уточнить состояние отдельных участков опухолевого узла, его структуру, характер контуров, визуализировать мельчайшие включения, производят прицельную рентгенографию с помощью специальных тубусов различной площади. При подозрении на рак молочной железы для оценки степени и распространения процесса выполняют рентгенографию мягких тканей подмышечных областей. Средняя доза, поглощенная грудной железой, на одну маммографическую пленку небольшая, составляет 0,1 рад, соответствуя 30% фоновой радиации за год. При наличии патологии по данным маммографии выполняют прицельное УЗИ молочной железы датчиком частотой 7,5 МГц, тонкоигольную аспирационную биопсию под контролем УЗИ или рентгенографии. Из пункционного материала готовят мазки для цитологического исследования. Для дифференциальной диагностики ряда заболеваний молочных желез применяют также искусственное контрастирование: пневмокистографию, дуктографию. Принцип пневмокистографии следующий: пунктируют пальпируемое образование и аспирируют содержимое. В полость вводят воздух в объеме, равном объему удаленной жидкости. Затем выполняют рентгенографию в двух взаимно перпендикулярных проекциях. При дуктографии проводят рентгенологическое исследование млечных протоков с контрастированием. Молочную железу массируют, чтобы удалить секрет. В наружное отверстие протока вводят стерильную тонкую затупленную медицинскую иглу, через которую в протоки вводят не более 0,5 мл йодсодержащего водорастворимого контраста. Затем выполняют рентгенографию молочной железы в двух проекциях. Компрессия способствует более полному распределению контрастного вещества.
 Рис. 3.19. Схема стандартных проекций для маммографии: 1 – косая проекция; 2 – краниокаудальная; 3 – боковая; стрелка – направление луча (по I. Andersson, B.F. Sigfusson, 1996)
Рис. 3.19. Схема стандартных проекций для маммографии: 1 – косая проекция; 2 – краниокаудальная; 3 – боковая; стрелка – направление луча (по I. Andersson, B.F. Sigfusson, 1996)
Эндоскопическая диагностика
Кольпоскопия
Представляет собой осмотр влагалищной части шейки матки, стыка эпителиев многослойного плоского и цилиндрического, поверхности эндоцервикса, влагалища и наружных половых органов оптическим прибором (кольпоскопом) с осветителем при увеличении в 4–30 раз. Различают кольпоскопию простую и расширенную. При простой кольпоскопии осмотр осуществляют без обработки шейки каким–либо веществом, при расширенной – после обработки 3% раствором уксусной кислоты, растворомЛюголя. Среднюю и верхнюю треть цервикального канала можно осмотреть лишь с помощью цервикоскопа или при гистероскопии. Кольпомикроскопия – гистологическое исследование слизистой шейки в падающем свете при увеличении в 160–280 раз. Кольпоскопия выполняется без обезболивания, до бимануального исследования.Техника кольпоскопии: женщину укладывают в гинекологическое кресло. Шейку матки обнажают в зеркалах. Тампоном с поверхности шейки снимают избыток слизи так, чтобы не травмировать ткани. Кольпоскоп устанавливают на расстоянии 25 см от поверхности шейки матки. Пучок света направляют на шейку и получают четкое изображение путем передвижения головки и микровинта кольпоскопа. Дают обзорную кольпоскопическую оценку состояния шейки матки. Осмотр шейки проводят по часовой стрелке либо вначале осматривают переднюю, а затем заднюю губу. Оценивают размер шейки матки, ее поверхность, наличие старых разрывов и их характер, особенность наружного зева, стыка двух видов эпителия (зона трансформации), цвет и рельеф слизистой оболочки, особенность сосудистого рисунка.
Для выявления более четкой кольпоскопической картины на влагалищную часть шейки матки наносят 3°%раствор уксусной кислоты. Действие раствора проявляется через 30–60 с и продолжается 3–4 мин. В результате временной коагуляции белков и межклеточной дегидратации происходит набухание клеток, сокращение подэпителиальных сосудов, анемизация тканей, изменяется цвет. Проба позволяет получить максимум информации о состоянии эпителия, четко отдифференцировать многослойный плоский эпителий от цилиндрического. В участках дисплазии отмечаются зоны значительного побеления. Чем белее ткань и дольше сохраняется эффект, тем глубже повреждение эпителия. Далее шейку матки осушают тампоном и смазывают раствором Люголя (йод – 1 г, калия йодид – 2–4 г, дистиллированная вода – 300 г). Под действием раствора (проба Шиллера) окрашиваются клетки поверхностного слоя слизистой. Клетки богаты гликогеном. При соединении гликогена с йодом слизистая приобретает темно–коричневый цвет. Измененная ткань окрашивается раствором Люголя разнообразно в зависимости от вида повреждения и степени кератинизации тканей. Так, при предраковых и раковых заболеваниях клетки бедны гликогеном и не окрашиваются. Не окрашиваются также участки истонченного плоского эпителия вследствие резкого уменьшения толщины промежуточного слоя или воспаленная слизистая оболочка. Проба Шиллера позволяет четко отграничить нормальный плоский многослойный эпителий от патологически измененного, выявить наружные границы поражения.
Для выявления контуров кровеносных сосудов могут использоваться при кольпоскопии зеленые и желтые фильтры, осмотр в ультрафиолетовых лучах.
Документирование данных кольпоскопического исследования проводится с помощью общепринятой символики и зарисовывается в виде схемы (рис. 3.20). Для описания патологических изменений учитывают их место расположения. Шейку матки условно делят на зоны с указанием точек, соответствующих циферблату часов: I зона – вокруг наружного зева, II – между I и III зонами, III – по лимбу шейки матки, 6 ч – середина задней губы, 12 ч – середина передней губы.
 Рис. 3.20. Обозначения участков шейки матки при описании кольпоскопической картины
Рис. 3.20. Обозначения участков шейки матки при описании кольпоскопической картины
Международная терминология кольпоскопических терминов (7–й Всемирный конгресс по патологии шейки матки, 1990) ■ Нормальные кольпоскопические картины: ■ оригинальный сквамозный эпителий (многослойный плоский эпителий, МПЭ) ■ цилиндрический эпителий (ЦЭ) ■ нормальная зона трансформации (стык зоны ЦЭ с плоским, ЗТ). ■ Ненормальные кольпоскопические картины: • На зоне трансформации: ♦ ацетобелый эпителий (зоны побеления после аппликации уксусом): ▼ плоский ▼ микропапиллярный. ♦ пунктация нежная или грубая (точечность, атипическая васкуляризация эпителия) ♦ мозаика нежная и грубая (поля, разветвленные в эпителии стромальные папиллы с сосудами внутри) ♦ лейкоплакия (тонкая и толстая) ♦ йоднегативная зона (не окрашенная раствором Люголя) ♦ атипические сосуды (в виде шпильки, штопора, запятой; разной толщины, не исчезают после обработки уксусом). • За пределами зоны трансформации (вагина, экзоцервикс): ♦ ацетобелый эпителий: ▼ плоский ▼ микропапиллярный ♦ пунктация (нежная и грубая) ♦ мозаика (нежная и грубая) ♦ лейкоплакия (тонкая и толстая) ♦ йоднегативная зона ♦ атипические сосуды. ■ Кольпоскопическая картина, подозрительная на инвазивную карциному (атипическая зона трансформации с плюс–тканью, язвами и др.). ■ Неудовлетворительная кольпоскопия: • Граница эпителиев разного вида не визуализируется. • Сильное воспаление или атрофия. • Цервикс не визуализируется. ■ Другие картины (смешанные): • Не белая микропапиллярная поверхность. • Экзофитная кондилома. • Воспаление. • Атрофия. • Язва (истинная эрозия. • Другие (эндометриоз, полипы шейки матки, аденоз – участки ЦЭ на эпителии влагалища).
Гистероскопия
Гистероскопия – это метод визуального осмотра внутренней поверхности матки с помощью эндоскопа.Показания: маточные кровотечения; невынашивание; аменорея неясного генеза; подозрение на синдром Ашермана; пороки развития; внутренний эндометриоз; рак эндометрия; полипы цервикального канала и полости матки; удаление фрагментов ВМС; оперативное удаление влагалищным доступом субмукозных миом матки, полипов (рис. 3.21), разрушение синехий; контроль за диагностическим выскабливанием матки; контроль за эффективностью лечения гиперпластических процессов эндометрия.
Противопоказания: инфекционные заболевания, тяжелые болезни сердечно–сосудистой системы, печени, почек, органов дыхания, эндокринной системы в стадиях декомпенсации, острые воспалительные заболевания гениталий, трихомониаз, молочница, III и IV степень чистоты влагалища.
Обезболивание: для диагностической гистероскопии достаточным является сомбревиновый внутривенный наркоз (калипсол), допустима парацервикальная блокада раствором новокаина. Если предполагается внутриматочная манипуляция, то применяют нейролептанальгезию, барбитуратовый кратковременный или кетаминовый наркоз.
Техника гистероскопии: исследование выполняют в гинекологическом кресле после соответствующей подготовки (туалет наружных половых органов, опорожнение кишечника и мочевого пузыря, санация влагалища).
Шейку матки фиксируют пулевыми щипцами после зондирования, канал шейки матки расширяют расширителями Гегара до № 11, после чего вводят гистероскоп с подключенным световодом и промывной системой (заполняют ее 0,9% раствором натрия хлорида или 0,05% водным раствором хлоргексидина). Регулируя систему, необходимо добиться струйного поступления жидкости в корпус гистероскопа, а затем – в матку. Продвижение гистероскопа в цервикальном канале и затем в полости матки должно проходить при обязательном визуальном контроле. Начиная с цервикального канала, производят поэтапный контроль полости матки. При этом обращают внимание на рельеф слизистой оболочки, состояние эндометрия, осматривают устья маточных труб. При наличии показаний под визуальным контролем производят биопсию, осуществляют катетеризацию и бужирование маточных труб.
 Рис. 3.21. Схема удаления полипа эндометрия путем электрокоагуляции его ножки при гистероскопии
Рис. 3.21. Схема удаления полипа эндометрия путем электрокоагуляции его ножки при гистероскопии
Подготовка больных для проведения гистероскопии с использованием газа такая же, как и при применении жидких сред. Производят зондирование и расширение канала шейки матки расширителями Гегара до № 7, подбирают колпачок–адаптер соответствующего размера, в котором создается отрицательное давление с помощью специального шприца или вакуумного отсоса. После извлечения расширителя из канюли адаптера в полость матки вводят корпус гистероскопа без оптической трубки. Через канал корпуса вводят 40–50 мл изотонического раствора натрия хлорида (для удаления крови из полости матки), который затем с помощью отсоса удаляют. К оптической трубке гистероскопа подключают световод, оптический прибор фиксируют в корпусе гистероскопа. К одному из вентелей присоединяют трубку, по которой поступает оксид углерода из гистерофлатера со скоростью 60–80 мл/мин. В течение 20 с в полости матки создается давление 21,3–24 кПа, или 160– 180 мм рт.ст., необходимое для достаточной дилатации полости матки. Осматривают полость матки.
Лапароскопия
Представляет собой эндоскопическое исследование брюшной полости при абдоминальном доступе через проколы маленького диаметра. Врач осуществляет осмотр и вмешательства специальными инструментами, наблюдая за своими действиями на экране монитора, на который через лапароскоп видеокамера передает увеличенное в несколько раз изображение.Показания: подозрение на трубно–перитонеальный фактор бесплодия, внематочную беременность, апоплексию яичника, разрыв пиосальпинкса, острую хирургическую патологию, опухоль или опухолевидное образование яичников и матки, перекрут ножки опухоли яичника или субсерозной миомы, наружный генитальный эндометриоз, стойкий болевой синдром неясного генеза, выявление характера порока развития внутренних половых органов, уточнение местонахождения внутриматочного контрацептива (если предполагается нахождение его в брюшной полости), оценка степени повреждения матки при подозрении на ее перфорацию, обследование при злокачественных заболеваниях гениталий (как метод установления стадии болезни или контроля предшествующего лечения), выбор доступа для выполнения лапаротомии при неясных опухолях малого таза.
Противопоказания к лапароскопии редки и определяются степенью тяжести состояния больного. Лапароскопия не показана там, где необходимость лапаротомии не вызывает сомнений. Эту процедуру не проводят при тяжелой сердечной и циркуляторной недостаточности, разлитом перитоните, выраженном ожирении, больших размерах опухолей гениталий, беременности после 24 недель и выраженном спаечном процессе. Оптимальным методом обезболивания при выполнении лапароскопии является эндотрахеальный наркоз (полное обезболивание, релаксация мышц передней брюшной стенки, предотвращение аспирации содержимым желудка, возможность продолжительной анестезии). При диагностической лапароскопии чаще используют общий внутривенный наркоз (кеталар, калипсол, сомбревин), иногда местное обезболивание новокаином или лидокаином.
Техника диагностической лапароскопии: хирург располагается слева от операционного стола, ассистент – справа таким образом, чтобы оба равнозначно видели изображение на мониторе, рабочие показатели приборов для инсуффляции. Операционная должна быть затемнена для получения оптимального качества изображения на мониторе.
Этапы выполнения диагностической лапароскопии состоят из наложения пневмоперитонеума СО2 (закисью азота, воздухом) и маточного манипулятора (канюли), введения троакара для оптики, панорамного осмотра органов брюшной полости, введения троакаров–манипуляторов, осмотра органов малого таза, сальпингоскопии и контрольной хромогидротубации, извлечении троакаров и маточного манипулятора, ушивании тканей передней брюшной стенки.
Пациентку укладывают в горизонтальное положение на спине с разведенными ногами, частично согнутыми в тазобедренных и коленных суставах (как при влагалищных операциях). После наложения пневмоперитонеума и введения троакара для оптики пациентку переводят в положение Тренделенбурга с углом 10–30°.
Мочевой пузырь должен быть опорожнен. После обработки дезинфицирующим раствором наружных половых органов и влагалища вводят зеркала, обнажают шейку матки, фиксируют ее за переднюю губу. После зондирования полости матки накладывают маточную канюлю.
После дезинфекции передней брюшной стенки скальпелем рассекают кожу от нижнего края пупка по средней линии вниз или дугообразно на протяжении 1 см. Левой рукой захватывают кожу и подкожную клетчатку продольно или поперечно на середине расстояния от лона до пупка. Складку приподнимают максимально вверх, создавая условия для наложения пневмоперитонеума. Вертикально через разрез в брюшную полость вводят иглу Вереша доощущения проваливания ее и щелчка подвижного мандрена (рис. 3.22). Кончик иглы должен сохранять подвижность во всех направлениях. При попадании ее в свободное пространство брюшной полости слышится шипение всасываемого воздуха.
Для подтвержения правильности введения иглы при наличии сомнений используют следующие приемы. Аспирационная проба: 5 мл физиологического раствора вводят в иглу Вереша, при правильном ее расположении раствор не поступает обратно в шприц. При получении аспирата инсуффляцию начинать нельзя. Необходимо вновь повторить введение иглы от начала до конца. При очередной неудаче возможно выполнение «открытой» лапароскопии или пункции брюшной полости через задний свод влагалища с последующей инсуффляцией. Еще один признак: после подсоединения шланга к игле и начале инсуффляции со скоростью 1 л/мин газ входит в брюшную полость легко; после введения первых 1,0–1,5 л СО2 внутрибрюшное давление не превышает 1–4 мм рт.ст. Отмечается симметричный подъем передней брюшной стенки, равномерный тимпанит при перкуссии. После достижения внутрибрюшного давления 12–14 мм рт. ст. прекращают инсуффляцию и извлекают иглу. Как правило, для достижения такого давления необходимо введение 2,5–3 л газа.
 Рис. 3.22. Схема введения иглы Вереша в брюшную полость (по Т.С. Диваковой, 2001)
Рис. 3.22. Схема введения иглы Вереша в брюшную полость (по Т.С. Диваковой, 2001)
Введение 1–го троакара является одним из наиболее ответственных моментов, так как данный этап лапароскопии осуществляют вслепую, что может повлечь за собой ранение кишечника, сосудов. После фиксации передней брюшной стенки левой рукой, как описано выше, правой рукой вводят троакар (для оптики 11,0 мм) через разрез у нижнего края пупка со средней силой под углом 30–45° сверху вниз (по направлению к проекции дна матки). Причем шляпка стилета троакара должна упираться в ладонь, а указательный палец располагаться на гильзе.
У тучных больных при введении троакара можно не достигнуть брюшной полости. У худощавых больных профилактикой ранения сосудов и кишечника является ограничение проваливания троакара за счет опоры правого мизинца и локтевого края ладони о переднюю брюшную стенку, введение троакара лишь усилием кисти руки. При правильном расположении троакара в брюшной полости ощущается звук выходящего газа. Извлекают стилет троакара, подключают шланг инсуффлятора к гильзе, вставляют лапароскоп со световодом. В случае неудачной попытки введения троакара необходим переход к «открытой» лапароскопии. Осмотр брюшной полости осуществляют последовательно. Вначале необходим осмотр органов брюшной полости непосредственно под местом введения троакара и в месте прокола передней брюшной стенки. Далее оценивают свободное пространство брюшной полости, печень, желчный пузырь, желудок, диафрагму, кишечник, сальник, слепую кишку и червеобразный отросток, внутренние грыжевые отверстия, наличие выпота, спаек, состояние париетальной брюшины.
Для манипуляций в брюшной полости используют 1–2 троакара меньшего диаметра (5,5 мм) или инструмент рабочего канала лапароскопа (методика одного прокола). Манипуляционные троакары вводят в подвздошных областях на 3–4 см выше лона и на 5–6 см в стороны от средней линии живота. При использовании одного манипулятора троакар вводят по средней линии чуть выше границы роста волос. С целью профилактики ранения подчревных и подвздошных сосудов освещают брюшную стенку изнутри лапароскопом, рассекают кожу на 0,5 см. Только после этого под визуальным контролем вводят троакары в направлении позадиматочного пространства. Извлекают стилеты и через гильзы вводят манипуляторы (зонд, травматические щипцы и т.д.). Для диагностической лапароскопии оптимальным является внутрибрюшное давление 13–14 мм рт. ст., но не более 15 мм рт. ст. Осмотр органов малого таза начинают с матки, переднематочного кармана, далее – по часовой стрелке правого яичника и маточной трубы, позадиматочного пространства, левых придатков. Для исключения ошибки в диагнозе осмотр осуществляется вначале без использования манипуляторов (касание или фиксация тканей вызывают появление на поверхности точечных прозрачных или ярко–красных очагов, повышение экссудации жидкости и микрокровотечение), а затем с манипуляторами путем смещения органов. Адекватная оценка состояния внутренних половых органов возможна при смещении тела матки с помощью маточного манипулятора (рис. 3.23). Оценивают также объем и цвет перитонеальной жидкости, состояние висцеральной брюшины, расположение органов малого таза по отношению друг к другу, величину и форму матки, длину и форму маточных труб, состояние фимбрий, наличие спаек, величину и форму яичников, наличие доминантного фолликула, стигмы или желтого тела, плотность коркового слоя, состояние круглых, широких, воронкотазовых и крестцово–маточных связок. Производят забор перитонеальной жидкости для цитологического или бактериологического исследований.

 Рис. 3.23. Схема применения маточного манипулятора при лапароскопии: а – осмотр перднематочного пространства; б – осмотр позадиматочного пространства (по Т.С. Диваковой, 2000)
Рис. 3.23. Схема применения маточного манипулятора при лапароскопии: а – осмотр перднематочного пространства; б – осмотр позадиматочного пространства (по Т.С. Диваковой, 2000)
Генетические методы исследования
Генетические методы исследования включают оценку дерматоглифики, полового хроматина, кариотипирование и проводятся специалистами–генетиками.Дерматоглифика
Представляет собой оценку совокупности эпидермальных узоров гребней пальцев, ладоней и подошв человека. Основу этого простого и информативного метода исследования составляют представления об анатомии, эмбриогенезе и генетике кожных узоров. При ряде хромосомных аномалий выявлены нарушения дерматоглифики, что позволяет ее использовать для диагностики некоторых хромосомных болезней, например болезни Дауна, при дисплазии конечностей, пороках развития различных органов, сахарном диабете, карциноме грудной железы, лейкозе и других заболеваниях. Дерматоглифика может быть изменена не только у больных, но и их родственников, что указывает на семейно–наследственный характер некоторых заболеваний. Поражение плода вирусом краснухи приводит к аномалии дерматоглифики. Данные дерматоглифики оказывают определенную помощь для установления этиологии, патогенеза и диагностики наследственных аномалий.Определение полового хроматина
Важную роль в диагностике врожденных дефектов половых желез играет определение полового хроматина. Определение Х– и Y–хроматина производят в ядрах клеток поверхностного эпителия из соскоба слизистой оболочки внутренней поверхности щеки шпателем. При определении Х–хроматина используют краситель орсеин, Y–хроматина – акридин оранжевый. Мазок и в том, и в другом случае равномерно распределяют по предметному стеклу и помещают на 10 мин в метанол для фиксации (или высушивают на воздухе), затем окрашивают вышеуказанным красителем. Для анализа берут клетки с хорошо контурированным гомогенным ядром.При определении Х–хроматина подсчитывают 100 клеток и по количеству ядер, содержащих тельце полового хроматина, высчитывают его процент. Для исследования берут 200–300 ядер при сниженном проценте Х–хроматина и выводят средний процент.
Для определения Y–хроматина анализ окрашенных препаратов производят немедленно под люминисцентным микроскопом и подсчитывают процент ядер, содержащих Y–хроматин, который выглядит ярко флюоресцирующим тельцем.
При мозаицизме с присутствием клона клеток 45Х процент полового Х–хроматина снижается и полностью зависит от величины аномального клона клеток. Половой хроматин используется как скрининг–тест.
Анализ кариотипа
Строго по показаниям проводят анализ кариотипа ввиду высокой стоимости и трудоемкости. Основными показаниями к исследованию кариотипа являются отклонения в количестве полового хроматина, низкий рост пациенток, уродства в анамнезе, пороки развития, особенно множественные семейного характера, самопроизвольные выкидыши в ранние сроки, дисгенезия гонад.Исследование кариотипа производится на препаратах метафизных хромосом, которые получают из культуры лимфоцитов периферической крови по специальным методикам. У больных с дисгенезией гонад обязательно определяется кариотип, так как выявление у них Y–хромосомы или ее участка указывает на присутствие элементов тестикулярной ткани в дисгенетической гонаде и высокий риск (до 30%) возможности злокачественного роста.
Глава 4. Детская и подростковая гинекология
Гинекология детей и подростков – раздел гинекологии, изучающий нормальную функцию половой сферы и заболевания организма девочки, связанные с преимущественным поражением органов половой системы в детском и подростковом периодах жизни, а также меры профилактики и лечения этих заболеваний. Данный раздел медицины охватывает возрастные границы от рождения до 18 лет включительно (Н.В. Кобозева, М.Н. Кузнецова, Ю.А. Гуркин, 1981).Физиологические особенности развития детского организма
Формирование женской половой системы – сложный многоступенчатый, генетически детерминированный процесс, в результате которого организм достигает биологической зрелости, способности к репродукции.Возрастные периоды. В 1965 г. на Международном симпозиуме по возрастной периодизации была принята следующая классификация периодов развития девочки: новорожденности (1–10 дней), грудного возраста (10 дней – 1 год), раннего детства (1–3 года), первого детства (4–7 лет), второго детства (8–11 лет), подростковый 12–15 лет, юношеский (16–20 лет).
В гинекологической практике наиболее часто используется несколько упрощенная классификация полового развития девочек: ■ период внутриутробного развития ■ период новорожденности (1–21–й день жизни) ■ «нейтральный» период, или период «относительного гормонального покоя» (от 3 недель до 7 лет) ■ препубертатный период (от 7 лет до менархе) ■ пубертатный период (от менархе до 15 лет) ■ подростковый период (от 15 до 18 лет).
Эмбриогенез половой системы девочки
Формирование половой системы в эмбриогенезе определяется взаимодействием трех групп факторов: генетического механизма, внутренних эпигенетических факторов (ферментные системы, гормоны) и внешних эпигенетических факторов, отражающих влияние внешней среды.Генетический пол будущего ребенка обусловлен, с одной стороны, набором половых хромосом, образующихся в зиготе при соединении материнской и отцовской гамет (ХХ – женский, ХУ – мужской), и, с другой стороны, набором особых генов, определяющих тип гонад, уровнем активности ферментных систем, реактивностью тканей к половым гормонам, синтезом половых гормонов.
Мужские и женские половые железы развиваются из одного недифференцированного зачатка. До 6–7 недель эмбриональной жизни он морфологически одинаков как для женского, так и для мужского пола и состоит из коркового и мозгового слоев. В последующем из коркового слоя образуется яичник, а из мозгового – яичко (М.А. Жуковкий, Н.Б. Лебедев, Т.В. Семичева 1989; В.П. Сметник, Л.Г. Тумилович, 1997).
Установлено, что ген, детерминирующий развитие зачатка гонады по мужскому типу, локализуется в коротком плече У–хромосомы и определяет биосинтез специфического мембранного белка, Н–У–антигена. В настоящее время известно, что Н–У–антиген образуется только при наличие Н–У–гена, локализующегося вокруг центромеры У–хромосомы. В клетках эмбриона, в том числе в клетках, покрывающих поверхность примордиальной гонады, содержатся рецепторы к Н–У–антигену. Захват Н–У–антигена этими клетками индуцирует развитие из первичной гонады яичка. Существует мнение, что морфогенез гонады регулируется не одним, а несколькими генами и одного Н–У–антигена недостаточно для полноценного развития яичка. Предполагают, что по крайней мере 18 генов необходимы для пренатального развития мужского фенотипа (U. Wblf, 1986).
Превращение первичной гонады в яичник индуцируется специфическими молекулами, соответствующими Н–У–антигену у мужской особи. В дифференцировке яичников определенную роль играют локусы Х–хромосомы, расположенные в области ее центромеры, ближе к коротким плечам хромосомы.
Развитие женской гонады, так же как и мужской, начинается на медиальной стороне первичной почки половых валиков – будущих гонад. Элементами развивающихся гонад являются гоноциты, дающие начало овогониям, производные целомического эпителия – будущие соединительнотканные и мышечные элементы половых желез. Интерстициальная ткань гонады, происходящая из клеток мезенхимы, образует у эмбрионов мужского пола клетки Лейдига, а у эмбрионов женского пола – тека–ткань (М.А. Жуковкий, Н.Б. Лебедев, Т.В. Семичева, 1989). Яичники в период внутриутробной жизни в гормональном отношении малоактивны. Таким образом, дифференцировка гонад обусловлена генами, находящимися в половых хромосомах.
Изучение развития яичников в антенатальный период позволяет выделить 5 основных этапов: ■ индифферентных гонад (5–7 неделя) ■ начало половой дифференциации гонад (7–8 неделя) ■ размножение овогоний (8–10–я неделя) ■ неразъединенных овоцитов (10–20–я недели) ■ период первичных фолликулов.
Уже у 5–месячного плода в яичнике можно выделить три различных, морфологически гетерогенных компонента: ■ внутренний – ворота (в месте прикрепления яичника к мезоварию) ■ средний – мозговой слой ■ наружный – корковый слой.
Ворота содержат нервы, кровеносные сосуды, поддерживающую соединительную ткань, и непостоянное число клеток, секретирующих стероидные гормоны (R.J. Harrison, 1962). Мозговой слой состоит из гетерогенных клеток, остающихся после удаления овоцита из созревшего фолликулярного комплекса. Корковый слой представлен незрелыми герминальными клетками (овоцитами), заключенными в клеточный комплекс и строму (фолликулы); снаружи он покрыт целомическим эпителием, названным герминативным (С. С.К. Йен, РБ. Джаффе, 1998). К 28–й неделе в яичниках иногда появляются полостные фолликулы. Гормональная активность фетальных яичников максимально повышается на 32–34–й неделе беременности и не снижается до рождения ребенка. По мнению большинства авторов, один из критических периодов становления функции женской половой системы наблюдается с 24–й по 34–ю неделю внутриутробного развития плода, когда воздействие повреждающих факторов наиболее пагубно и может приводить в последующем к развитию ряда гинекологических заболеваний (Ю.А. Крупко–Большова, А.И. Корнилова, 1990).
Следующим этапом половой дифференциации является развитие внутренних и наружных гениталий (рис. 4.1, 4.2). На ранних этапах внутриутробного развития половая система имеет бисексуальные закладки внутренних и наружных половых органов. Внутренние половые органы (маточные трубы, матка и верхняя треть влагалища) начинают дифференцироваться с 5–6–й недели и заканчивают дифференцировку к 18–й неделе внутриутробного развития. При развитии плода женского пола мезонефральные (вольфовы) протоки регрессируют, а парамезонефральные (мюллеровы) – превращаются в матку, маточные трубы и свод влагалища. Этому способствует автономная тенденция любого плода к развитию по женскому типу.
 Рис. 4.1. Развитие мужских и женских внутренних половых органов (по P.B. Jaffe, 1998)
Рис. 4.1. Развитие мужских и женских внутренних половых органов (по P.B. Jaffe, 1998)
 Рис. 4.2. Развитие наружных половых органов (по P.B. Jaffe, 1998)
Рис. 4.2. Развитие наружных половых органов (по P.B. Jaffe, 1998)
Маточные трубы развиваются из верхних отделов мюллеровых протоков. С 17–18–й недели в маточных трубах определяются циркулярные мышечные волокна, на 20–21–й – мерцательный и секреторный эпителий, с 30–й недели прогрессивно увеличивается складчатость (В.П. Сметник, Л.Г. Тумилович, 1997).
Матка и верхняя треть влагалища образуются в результате слияния парамезонефральных протоков, которое начинается с каудального конца на 9–й неделе эмбриогенеза. Формирование матки как органа происходит на 11–14–й неделе, шейка матки начинает выделяться на 16–20 неделе развития плода. Мышечный слой матки развивается к 27–й неделе, а эндометрий к 24–й неделе эмбриогенеза.
Нижний отдел слившихся мюллеровых протоков образует верхнюю треть влагалища, а урогенитальный синус – нижние две трети влагалища, формирование которого начинается с 12–й и заканчивается к 21–22–й неделе внутриутробной жизни. Наружные половые органы начинают дифференцироваться с 7–й недели внутриутробного периода, однако до 16–й недели их вид мало отличается от индифферентной стадии развития. У плода женского пола формирование наружных половых органов происходит из полового бугорка, лабиоскротальных валиков и урогенитального синуса независимо от состояния гонад. С 17–й недели эмбриогенеза образуются большие (из лабиоскротальных валиков) и малые (из уретральных складок) половые губы; из полового бугорка – клитор; из урогенитального синуса – преддверие влагалища и его нижние две трети. К 20–23–й неделе внутриутробного развития формирование наружных половых органов заканчивается.
Гипоталамо–гипофизарная система – 3–й и 4–й уровни репродуктивной системы человека. Основные звенья этой сложной системы начинают функционировать еще в антенатальный период онтогенеза. Закладка ядер гипоталамуса (супраоптического и паравентрикулярного) происходит у 8–недельного эмбриона человека. К сроку 16 недель внутриутробного развития ядра начинают приобретать такую же форму и расположение, как у взрослой женщины, появляются признаки нейросекрета. К 28–й неделе внутриутробного развития топографическая дифференциация ядер гипоталамуса в основном заканчивается.
Независимо от половой принадлежности плода гипоталамус способен стимулировать как тоническое, так и циклическое выделение гонадотропинов. Ответственным этапом становления функции гипоталамуса является его половая дифференциация, программирующая определенный тип функционирования у взрослой особи – циклический (женский) или тонический (мужской). Половая дифференциация у человека происходит на 4–7–м месяце внутриутробной жизни. В физиологических условиях благодаря высокой чувствительности нейронов циклического центра (расположенного в преоптической области) к андрогенам у самцов этот центр выключается, маскулинизируется. Следовательно, хотя пол ребенка закодирован в хромосомном аппарате оплодотворенной яйцеклетки, хромосомные детерминации не имеют абсолютного значения для развития и функционирования половой системы. Решающую роль играют гормоны. Данные о высокой чувствительности развивающегося гипоталамуса к воздействию половых стероидов необходимо учитывать в клинической практике.
В эмбриональный период половая система интенсивно развивается. Центральное место в эндокринной системе плода занимает гипофиз, который выделяется как анатомическое образование уже к 5–й неделе эмбрионального развития. На 8–й неделе в гипофизе плода определяются гонадотропины. В течение 19– 24–й недели количество фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ) в гипофизе прогрессивно увеличивается. Очевидно, на ранних этапах эмбрионального развития гипофиз, так же как и половые железы, надпочечники и щитовидная железа, находится под влиянием плацентарных гормонов. Существует высокая степень согласованности функционирования эндокринной системы плода с экзогенным гормональным (материнским) ритмом. После 27–й недели внутриутробного развития, когда сформирована гипофизарная воротная система, начинают устанавливаться коррелятивные взаимоотношения в системе гипоталамус – гипофиз – надпочечники – яичники. Однако до настоящего времени вопрос о существовании связи между развитием половых желез и функцией гипофиза в антенатальный период окончательно не решен. Не выяснено, какова роль в этом процессе влияния гонадотропинов плода и каково участие хорионического гонадотропина.
В антенатальном периоде онтогенеза постепенно формируются все органы и системы, которые позволяют плоду приспосабливаться к изменяющимся условиям внутриутробной среды, а затем к нагрузкам, сопряженным с периодом адаптации к внеутробному существованию. В последние годы с успехом изучались процессы эмбриогенеза, начиная с оплодотворения и ранних стадий развития, формирования отдельных органов и систем плода на различных этапах антенатального онтогенеза с учетом особенностей окружающей среды (течения беременности). Основные звенья эндокринной и половой систем начинают функционировать еще в антенатальном периоде онтогенеза.
Период новорожденности и детства
В постнатальном периоде развитие женской половой системы происходит волнообразно. При этом половая система девочки испытывает транзиторное напряжение, связанное с резким изменением гомеостаза (в частности, гормонального статуса). В половых органах и молочных железах отмечается очевидное влияние эстрогенов, которое визуально проявляется в виде менструальноподобных выделений из половых путей и нагрубания молочных желез. К окончанию периода новорожденности все проявления эстрогенного влияния исчезают.При рождении у здоровой девочки наружные половые органы четко дифференцированы по женскому типу и имеют некоторые характерные особенности. Клитор относительно велик. Малые половые губы лишь частично прикрываются большими половыми губами до 6–7–летнего возраста. Они, как правило, несколько выступают вперед; преддверие влагалища, имеющее воронкообразную форму, расположено глубже, чем у подростков и взрослых женщин. При осмотре создается впечатление, что вульва находится в состоянии набухания, отечна и гиперемирована. Большие вестибулярные железы не функционируют до окончания «нейтрального» периода. Малые вестибулярные железы появляются в 3 года на наружной поверхности половых губ, а к 4 годам – и на внутренней. Покровный эпителий вульвы у девочек очень нежный и легкоранимый.
Девственная плева расположена глубоко в преддверии влагалища, имеет центральное отверстие различной формы (круглой, овальной, щелевидной, сердцевидной, треугольной) и величины (от едва заметного точечного отверстия до 10 мм). У девочек в период «гормонального покоя» соединительной ткани в девственной плеве мало, а сосудистая сеть хорошо развита, поэтому девственная плева тонкая, мягкая, нежная, эластичная и легко кровоточит.
Влагалище новорожденной девочки имеет почти вертикальное расположение, длина его – от 3 до 5 см; своды, особенно задний, достаточно выражены. Сзади к влагалищу примыкает прямая кишка, расположенная, так же как и влагалище, вертикально. Спереди влагалищная стенка не соприкасается с мочевым пузырем, как у взрослых женщин. Примерно к 3 годам жизни девочки мочевой пузырь и прямая кишка опускаются в малый таз, занимая свое обычное положение, при этом изменяется направление оси влагалища, которая устанавливается под острым углом к вертикальной оси таза. Своды влагалища уплощаются, а передняя стенка приходит в соприкосновение с дном мочевого пузыря.
Слизистая влагалища у новорожденной имеет незначительную поперечную складчатость, хорошо заметную в нижней трети, окраска ее в этом возрастном периоде ярко–розовая, затем она становится более бледной, с желтоватым налетом. По мере развития сосудистой сети и эластических волокон в подэпителиальном слое и мышцах (к 5–7 годам жизни) складчатость влагалища становится выраженной, а цвет слизистой становится ярко–розовым. Реакция влагалищного секрета кислая (рН = 4–5), при бактериоскопии выявляются палочки Дедерлейна. Однако к концу 1–го месяца жизни количество слоев в эпителии влагалища значительно уменьшается с 30–40 до 2–4, основные типы клеток – базальный и парабазальный. Реакция влагалищного содержимого становится нейтральной или щелочной (рН = 7–8), палочки Дедерлейна исчезают, влагалищная флора представлена разнообразными микроорганизмами с преобладанием кокков. Приведенные особенности влагалища и наружных половых органов способствуют более частоту возникновению вульвовагинитов у девочек именно в периоде «гормонального покоя».
Матка в период новорожденности расположена в брюшной полости и имеет характерный вид в связи с преобладанием величины шейки над телом (3/1), угол между ними не выражен. Длина матки равна в среднем 30 мм, масса – около 4 г, тело ее имеет чечевицеобразную форму, дно может быть слегка вогнутым. Миометрий хорошо развит, эндометрий образует большое количество складок, в нем определяются пролиферативные и секреторные изменения, возможна десквамация, сопровождающаяся менструальноподобными выделениями. Внутренний зев шейки матки не сформирован, наружный зев – щелевидный и расположен на уровне диагональной конъюгаты. Цервикальный канал заполнен густой слизью, складки его слизистой выражены. Граница между многослойным плоским эпителием, покрывающим влагалищную часть шейки матки, и цилиндрическим эпителием цервикального канала устанавливается к моменту рождения внутри от наружного зева, хотя иногда наблюдается эктопия. Слизистая влагалищной части шейки матки у новорожденной бывает покрыта сосочками, из наружного зева возможно выделение слизистых или слизисто–кровянистых выделений.
В 1–й год жизни размеры матки уменьшаются, подвергаясь обратному развитию. К концу 2–го года жизни она достигает размеров, соответствующих размерам матки плода примерно на 7–м месяце внутриутробного развития. Динамика изменения соотношения тела матки и шейки следующая: к концу 1–го года жизни оно составляет 2/1; в 4 года –1,7/1; в 7–8 лет – 1,4/1. Темпы роста матки заметно возрастают лишь с 9–10–летнего возраста. Форма матки также меняется с возрастом. Так, к концу «нейтрального» периода матка округляется, шейка матки постепенно укорачивается и принимает конусообразную форму, наружный зев становится точечным. К 3–летнему возрасту дно матки находится ниже плоскости входа в малый таз. До 10 лет маточная артерия не извилиста и располагается не у самого ребра матки, а на расстоянии 1,0–1,2 см латеральнее. Характерной особенностью детской матки является складчатость ее слизистой оболочки, которая уменьшается с 6–7–летнего возраста, когда начинает расти миометрий. Изменения размеров матки в процессе развития девочки представлены на рис. 4.3.
Маточные трубы длинные (около 35 мм) и извитые из–за относительно коротких широких связок, проходимы на всем протяжении. Правая маточная труба, как правило, длиннее левой. Перистальтика труб у новорожденных отсутствует. С 5–7–летнего возраста относительная длина маточных труб начинает уменьшаться, они выпрямляются и утолщаются, просвет их увеличивается.
 Рис. 4.3. Сравнительные размеры матки (по А.И. Петченко, 1964): 1 – новорожденной; 2 – девочки 1 года; 3 – девочки 4 лет; 4 – девочки 8 лет; 5 – девушки 16 лет
Рис. 4.3. Сравнительные размеры матки (по А.И. Петченко, 1964): 1 – новорожденной; 2 – девочки 1 года; 3 – девочки 4 лет; 4 – девочки 8 лет; 5 – девушки 16 лет
Яичники новорожденной девочки расположены в брюшной полости, форма их вытянутая цилиндрическая или призматическая с закругленными краями и гладкой поверхностью. Размеры яичника следующие: длина – 1,5–2 см, ширина – 0,5 см, толщина 0,1–0,35 см (В.П. Сметник, Л.Г. Тумилович, 1997). Величина и масса правого яичника больше размеров левого. Корковый слой яичников толстый, мозговой – тонкий, много примордиальных фолликулов (500.000–700.000 в каждом). Овуляция отсутствует, хотя встречаются и зреющие фолликулы (антральные), что свидетельствует о возможности синтеза эстрогенов в яичниках новорожденной девочки. С возрастом яичник девочки постепенно увеличивается во всех направлениях, но значительно больше в ширину и толщину. Начиная с 2 лет яичники опускаются в малый таз и в 5–7 лет занимают свое обычное положение. У девочек в «нейтральном» периоде развития имеется небольшое число зреющих и зрелых фолликулов, а также отмечается выраженный процесс атрезии на всех стадиях фолликулярного развития. В этот период уменьшается количество примордиальных фолликулов до 250.000– 350.000.Созревание фолликулов не носит циклического характера, уровень половых гормонов невысок.
Гипоталамо–гипофизарно–яичниковая система в «нейтральный» период практически заканчивает свое морфологическое развитие, однако функциональная активность ее обусловлена только механизмом обратной связи. Так, выделение эстрадиола очень мало, созревание фолликулов бессистемно и редко, выделение РГ–ЛГ носит эпизодический характер, синаптические связи между адренергическими и дофаминергическими нейронами неразвиты, секреция нейротрансмиттеров скудная (В.П. Сметник, Л.Г. Тумилович,1997).
Период полового созревания
Половое созревание представляет собой переход от ювенильного состояния к взрослому, по времени данный период занимает около 10 лет (от 7 до 18 лет). В широком смысле половое созревание – это период, когда организм достигает биологической зрелости. С учетом сроков соматического, психологического и социального созревания экспертами ВОЗ (1977) было предложено считать подростками лиц в возрасте от 10 до 20 лет. В это время происходит быстрое соматическое и половое развитие девочки, достигается фертильность, возникают глубокие психологические изменения личности.Большинство исследователей в процессе полового созревания выделяют 2–3 фазы (препубертатная, пубертатная и юношеская). Однако до сих пор нет согласованности авторов по данному вопросу. Е.А. Богданова, Р.Г. Саркисян (1972), М.Н. Кузнецова (1973), Л.А. Лазарева (1977) выделили две фазы полового созревания. Первая фаза (препубертатная) начинается в 8–9 лет и заканчивается в 13–14 лет. Она характеризуется ускоренным ростом тела в длину, появлением вторичных половых признаков, дальнейшим развитием половых органов и заканчивается появлением менархе. Вторая фаза (пубертатная) начинается в 13–14 лет и заканчивается к 17–18 годам. Она характеризуется завершением развития вторичных половых признаков, установлением менструальной функции, замедлением роста.
В.Ф. Коколина (1990) выделила следующие периоды полового созревания: препубертатный, с выделением ранней стадии (4–7 лет) и поздней стадии (с 7 лет до возраста менархе); пубертатный – с возраста менархе до 14 лет; юношеский – с 14 до 17 лет.
В 1971–1973 гг. В.И. Бодяжина, Л.Г. Тумилович и Н.М. Ткаченко на основании степени зрелости гипоталамо–гипофизарно–яичниковой системы выделили три периода полового созревания: I период – препубертатный (7–9 лет); II – 1–я фаза пубертатного периода (10–13 лет); III – 2–я фаза пубертатного периода (14–17 лет). Данная классификация получила наибольшее признание в практическом здравоохранении (В.П. Сметник, Л.Г. Тумилович, 1997).
Препубертатный период
Это время гормональных изменений, предшествующих появлению признаков полового созревания. Качественные гормональные изменения у девочек наступают после 6 лет, когда созревает адреналовая система с быстрым подъемом надпочечниковых андрогенов. В этот период усиливается ациклический эпизодический выброс гонадотропинов под влиянием нейросекреции гипоталамических структур, достигших некоторой степени зрелости (М.А. Жуковский и соавт., 1989).Пубертатный период
Этот период характеризуется сложной многоэтапной перестройкой гипоталамо–гипофизарно–яичниковой системы, когда качественно изменяются взаимоотношения в системе отрицательных и положительных обратных связей. В этот период снижается порог чувствительности гипоталамуса к половым стероидам, что приводит к увеличению секреции гонадотропных гормонов, под влиянием которых возрастает выработка гормонов яичников. На этом этапе появляется менархе.По мере развития девочки происходит дальнейшее повышение уровня гонадотропных гормонов с постепенным увеличением их амплитуды колебаний. Стимулирующее воздействие ГТ–РГ способствует пульсирующему выбросу гонадотропинов (ночной импульс ЛГ, а чуть позже и дневной импульс ЛГ), формируя зрелый базовый или так называемый, цирхоральный тип секреции ЛГ с частотой импульсов 60–90 в 1 мин. Циклический характер приобретает нейросекреция гипоталамуса, гипофиза, яичников, устанавливается овуляторный менструальный цикл.
Соматические изменения, сопровождающие половое созревание, происходят под влиянием половых стероидов, выделяемых яичниками и в меньшей степени надпочечниками.
В препубертатном периоде (7–9 лет) отмечается «момент старта» или «скачок» роста, появляются признаки феминизации фигуры (за счет увеличения и перераспределения жировой ткани), начинается формирование женского таза. Наружные половые органы как бы зрительно увеличиваются также за счет увеличения жировой клетчатки, девственная плева располагается поверхностно, начинают функционировать большие вестибулярные железы. Влагалище удлиняется до 6 см, его стенки становятся складчатыми, задний свод углубляется, увеличивается толщина эпителия, реакция влагалищного содержимого сдвигается в кислую сторону, появляются палочки Дедерлейна.
Матка начинает постепенно увеличиваться и к 10 годам достигает размеров, соответствующих таковым ее у новорожденной девочки. Яичники увеличиваются (длина до 3,5 см, масса до 5 г), созревание фолликулов становится более интенсивным, иногда происходит овуляция. Количество примордиальных фолликулов – от 100.000 до 300.000.
На пубертатный период приходится пик скорости роста. Фигура продолжает феминизироваться, появляются и прогрессивно развиваются вторичные половые признаки. К 16–17 годам формирование молочных желез и половое оволосение завершаются, менструальный цикл приобретает овуляторный характер, замедляется и прекращается рост трубчатых костей за счет заращения эпифизарных щелей, окончательно формируется женский таз.
Наружные половые органы в пубертатном периоде постепенно приобретают полное сходство с органами взрослой женщины. Вульва сочная, большие половые губы хорошо прикрывают малые половые губы и клитор, функционируют большие вестибулярные железы. Влагалище удлиняется до 8–10 см, своды его сформированы, эпителий содержит все слои, реакция содержимого кислая, определяются палочки Дедерлейна.
Матка постепенно увеличивается и к 17 годам достигает размеров и соотношения с шейкой взрослой женщины (3/1). Появляется перистальтика маточных труб. Нарастание размеров и массы яичников происходит за счет увеличения объема фолликулов.
Половая зрелость наступает к 18 годам, когда молодая женщина приобретает способность не только зачать, но также выносить, родить, выкормить и воспитать свое потомство.
 Рис. 4.4. Стадии развития молочных желез. Описание в тексте (по J.C. Van Wieringer, 1971)
Рис. 4.4. Стадии развития молочных желез. Описание в тексте (по J.C. Van Wieringer, 1971)
Возрастная последовательность пубертатных изменений у девочек (по Р. Тейлору, 1969). Последовательность развития вторичных половых признаков представлена на рис. 4.4, где указаны стадии развития молочных желез, и на рис. 4.5, где представлены стадии лобкового оволосения.
Стадия 1 (до 7–8 лет). У девочек отсутствуют молочные железы, оволосение на лобке и под мышками. Половая щель незрелая, большие и малые половые губы недифференцированы.
Стадия 2 (8–10 лет). Начинается развитие молочных желез. Они появляются в виде маленьких узелков под ареолой (пигментация отсутствует) и составляют около 2 см в диаметре. Начинают дифференцироваться малые и большие половые губы, на половых губах отмечается нежный пушок, но лобковые волосы отсутствуют. Запах пота не заметен.
Стадия 3 (10–12 лет). Отмечается дальнейшее развитие молочных желез. Они расширяются за края ареолы, пигментация которой пока еще отсутствует.
Размер молочных желез уже составляет 3–8 см в диаметре, они приподнимаются над уровнем грудной стенки на 2–4 см. Появляются первые нежные волоски под мышками и на лобке. Волосы в области промежности становятся гуще, появляется запах пота.
Стадия 4 (12–14лет). Половое созревание сопровождается появлением менструаций, которые вначале нерегулярны, но циклы могут быть овуляторными. Молочные железы составляют 8–12 см в диаметре и приподнимаются над грудной стенкой на 3–6 см и более. Ареолы слабо пигментированы. Появляются волосы под мышками и оволосение на лобке по женскому типу.
 Рис. 4.5. Стадии развития лобкового оволосения. Описание в тексте (по J.C. Van Weringer, 1971)
Рис. 4.5. Стадии развития лобкового оволосения. Описание в тексте (по J.C. Van Weringer, 1971)
Стадия 5 (14–16 лет и старше). На этой стадии формируются молочные железы взрослой женщины. Оволосение по женскому типу характеризуется появлением достаточно густых волос на лобке, усилением роста волос в области промежности, выделением слизи из влагалища, появлением отчетливого запаха тела. Менструации проходят с регулярными или нерегулярными интервалами, иногда возникают дисменорея и предменструальные симптомы.
Оценка развития вторичных половых признаков проводится отечественными и зарубежными авторами по–разному. В большинстве источников отечественной литературы отсчет полового развития принят с нулевой стадии, с использованием следующих градаций.
Ма – молочные железы: ■ Ма0 – молочная железа не увеличена, сосок маленький не пигментирован ■ Ма1 – набухание околососкового кружка, увеличение его диаметра, пигментация соска не выражены ■ Ма2 – молочная железа конической формы, околососковый кружок не пигментирован, сосок не возвышается ■ Ма3 – «юношеская грудь» округлой формы, околососковый кружок пигментирован, сосок возвышается ■ Ма4 – «зрелая грудь» округлой формы.
Р – оволосение; Ах – подмышечное оволосение: ■ Р0 Ах0 – волосы на лобке и в подмышечных впадинах отсутствуют ■ Р1 Ах1 – единичные прямые волосы ■ Р2 Ах2 – волосы более густые и длинные, располагаются на центральной части лобка и подмышечных впадин ■ Р3 Ах3 – волосы густые, вьющиеся на всем треугольнике лобка, половых губах и в подмышечных впадинах.
Ме – менструации: ■ Ме0 – отсутствие менструаций ■ Ме1 – менархе в период обследования (±1 месяц) ■ Ме2 – нерегулярные менструации ■ Ме3 – регулярные менструации.
Каждый символ имеет свой коэффициент: Ма (молочные железы) – 1,2 балла, Р (оволосение лобка) – 0,3 балла, Ах (подмышечное оволосение) – 0,4 балла, Ме (менструации) 2,1 балла. Половая формула вычисляется следующим образом: Ма+Р+Ах+Ме = балл полового развития.
В зарубежной литературе, как правило, принята система условных обозначений стадии пубертата, рекомендованная W. Marschall, J. Tanner в 1969 г., где отсчет начинается не с 0, а с 1 – Pb1Ах1Ма1.
Среди отечественных исследований последних лет, посвященных половому развитию девочек, большой интерес в практической гинекологии представляют стандарты В. М. Максимовой (1994), приведенные в табл. 4.1.
Таблица 4.1. Стандарты полового развития по М.В. Максимовой (1994)
| Возраст, лет | Формула нормального развития | Баллы нормального развития | Отставание | Опережение |
|---|---|---|---|---|
| 10 | От Ма0 Pb0 Ахд Ме0 до Ма2 Pb1 Ах0 Ме0 | От 0 до 2,7 | – | Более 2,7 |
| 11 | От Ма1 Pb0 Ахц Ме0 до Ма2 Pb1 Ах0 Ме0 | От 1,2 до 2,7 | Менее 1,2 | Более 2,7 |
| 12 | От Ма1 Pb0 Ахц Ме0 до Ма3 Pb3 Ах1 Ме1 | От 1,2 до 7,0 | Менее 1,2 | Более 7,0 |
| 13 | От Ма3 Pb2 Ах0 Ме0 до Ма3 Pb3 Ах2 Ме3 | От 3,0 до 11,6 | Менее 3,0 | Более 11,6 |
| 14 | От Ма3 Pb2 Ах2 Ме0 до Ма3 Pb3 Ах3 Ме3 | От 5,0 до 12,0 | Менее 5,0 | – |
| 15 | От Ма3 Pb3 Ах3 Ме3 до Ма3 Pb3 Ах3 Ме3 | От 11,6 и выше | Менее 11,6 | – |
Нарушения полового развития
Нарушения полового развития наблюдаются у девочек довольно часто – 30: 1000 человек.Ю.А. Гуркин (2000) выделяет следующие нарушения полового созревания: ■ преждевременное половое развитие ■ неправильный пубертат ■ гетеросексуальное половое развитие ■ отсутствие и задержка полового созревания.
Основные факторы, влияющие на физическое и половое развитие, следующие: генотип, перинатальные факторы, гормональная регуляция, состояние вегетативной нервной системы, питание, режим труда и отдыха, психоэмоциональные, климатогеографические, экологические составляющие, хронические заболевания и интоксикации (В.П. Медведев и др., 1996).
Преждевременное половое развитие
Преждевременным половым развитием (ППР, pybertas ргаесох) у девочек принято считать появление каких–либо вторичных половых признаков в возрасте, который более чем на 2,5 стандартных отклонения ниже среднего возраста полового созревания. По общепринятым данным, у девочек такой границей является 8–летний возраст. Расстройства, вызывающие преждевременное половое развитие, можно разделить на те, при которых повышенная секреция половых стероидов зависит от стимуляции гипофизарными гонадотропинами, и те, при которых избыток половых стероидов не связан с секрецией этих гормонов. Эта редкая патология составляет до 2,5% гинекологических заболеваний у девочек. Преждевременное половое развитие может протекать по женскому (изосексуальное ППР) и по мужскому (гетеросексуальное ППР) типу.В клинической практикепринята следующая классификация (А.Н. Окороков, 1998): ■ истинное преждевременное половое развитие: • конституциональная или идиопатическая форма • преждевременное половое развитие церебрального генеза. ■ ложное преждевременное половое развитие: • преждевременное половое развитие яичникового генеза • преждевременное половое развитие надпочечникового генеза • преждевременное половое развитие экзогенно–медикаментозного характера. ■ неполная форма: • изолированное увеличение молочных желез (телархе) • изолированное развитие полового оволосения (адренархе).
Истинное преждевременное изосексуальное половое развитие ППР (ЛРГ–зависимое ППР)
К истинному преждевременному половому развитию относятся все формы, в основе которых лежит повышенная продукция гонадотропных гормонов, возникшая в результате преждевременной реактивации гипоталамического импульсного генератора ЛРГ.Конституциональная, или идиопатическая, форма ППР (рис. 4.6) встречается довольно редко, у 0,6% здоровых девочек признаки полового созревания появляются до 8–летнего возраста. Сюда относятся девочки с конституциональным преждевременным половым развитием, которые занимают самую нижнюю точку кривой нормального распределения возраста полового созревания.
Причины и патогенез
Эту форму ППР иногда связывают с семейным фактором (раннее половое созревание у родителей), возможно, в редких случаях, истинное преждевременное половое созревание передается по наследству как аутосомно–рецессивный или доминантный признак.Однако у большинства девочек ППР не связано с семейным анамнезом. Встречается идиопатическая форма ППР у девочек в 7,5 раз чаще, чем у мальчиков, может проявляться в младенческом возрасте. В основе патогенеза – преждевременная секреция гонадотропных гормонов. При этом не удается выявить неврологической, церебральной или другой патологии. Последовательность и темпы физического и полового развития не нарушены и как бы сдвинуты на более ранний возраст.
 Рис. 4.6. Преждевременное половое созревание: конституциональная форма (по И.И. Богорову, 1960)
Рис. 4.6. Преждевременное половое созревание: конституциональная форма (по И.И. Богорову, 1960)
Клиническая картина
Ранним симптомом является выраженное ускорение роста и дифференцировка скелета. Вначале имеет место значительное превышение роста по сравнению с одногодками. Однако в связи с преждевременным закрытием эпифизарных щелей под воздействием эстрогенов рост заканчивается раньше. Во время ускорения роста эти девочки обгоняют сверстников, но, став взрослыми, они ниже их на 14–20 см со специфическим телосложением: относительно короткие руки и ноги при длинном туловище (В.П. Сметник, Л.Г. Тумилович, 1997). Характерно также ускоренное физическое развитие этих детей, значительная мышечная сила, более выраженное развитие мышц по сравнению со сверстниками, ранняя феминизация фигуры. При этом психическое развитие соответствует хронологическому возрасту.Вторичные половые признаки прогрессируют быстрее, чем при нормальном половом развитии, тем не менее последовательность появления их аналогична нормально протекающему периоду. Сначала отмечается увеличение молочных желез, затем появляется лобковое оволосение. Менархе совпадает с появлением аксиллярного оволосения. Менструации могут быть регулярными и быстро устанавливаться. Уровень гонадотропных гормонов и эстрогенов у девочек соответствует степени их полового развития. Изменения наружных половых органов напоминают таковые при нормальном половом созревании, но происходят раньше и быстрее. Нередко у девочек в этом возрасте возможна овуляция и даже не исключена фертильность. ППР не приводит к более ранней менопаузе, однако возрастает риск развития рака молочных желез в детстве.
Преждевременное половое развитие церебрального генеза (истинное полное ППР)
Возникает при нарушениях и повреждениях ЦНС. При этом в процесс вовлекаются гипофизарные структуры гипоталамуса, которые, секретируя РГ–ЛГ, стимулируют образование и выделение гонадотропных гормонов гипофизом, что в свою очередь способствует росту и созреванию фолликулов, усилению секреции эстрогенов в яичниках, вызывая функционирование, таким образом, всех уровней репродуктивной системы.Причины и патогенез
Церебральная форма ППР может быть обусловлена патологией ЦНС двух типов: органического и функционального характера.К основным причинами органических повреждений ЦНС относят следующие: перенесенные воспалительные заболевания ЦНС (абсцессы мозга, менингит, энцефалит, арахноидит); гидроцефалия различного генеза; черепно–мозговые травмы; опухоли ЦНС (эпендиомы, астроцитомы, глиомы зрительных путей, тератомы гипоталамуса, гамартомы в области серого бугра). Такие опухоли обычно вклиниваются в область гипоталамуса, прерывая нормальные нейрохимические связи его с гипофизом. Опухоли эпифиза; краниофарингиомы; гранулематозное поражение головного мозга при туберкулезе и саркоидозе чаще встречаются у мужчин. Гранулемы могут вызвать сдавливание гипоталамуса и преждевременное половое созревание. При нейрофиброматозе (болезнь Реклингхаузена) нейрофибромы, развивающиеся в ЦНС, могут нарушать функцию гипоталамуса (А.Н. Окороков, 1998).
Среди причин нарушений ЦНС функционального характера наиболее часто встречаются следующие: инфекционные заболевания и интоксикации, перенесенные как матерью девочки при вынашивании данной беременности, так и самим ребенком в первые годы жизни (2–4 года); гестозы беременных, осложненные роды, тяжелая соматическая патология у матери. Церебральную форму ППР иногда обусловливают арахноидальные кисты, образующиеся после инфекционного процесса или хирургической операции, а также саркоидальные или туберкулезные гранулемы гипоталамуса независимо от наличия туберкулезного менингита.
Патогенез преждевременного полового созревания церебрального генеза связан либо с непосредственным увеличением секреции гонадолиберина (опухоли гипоталамуса, опухоли серого бугра – гамартома) и гонадотропинов (опухоли гипофиза), либо с уменьшением влияния тормозящих центров на гипоталамо–гипофизарную активность (опухоль эпифиза, краниофарингиомы, воспалительные, гранулематозные и травматические повреждения мозга). Опухоли эпифиза могут вызывать преждевременное половое развитие не только за счет гипопродукции антигонадотропных веществ, но и за счет повышения секреции гонадотропинподобного полипептида.
Клиническая картина
Половое созревание идет по изосексуальному типу (рис. 4.7), клиническая картина соответствует идиопатической форме, однако в отличие от нее при церебральной форме четко выражены признаки поражения ЦНС в зависимости от этиологии. У больных определяются следующие нарушения: изменение функций Ill, VIII, XII пар черепно–мозговых нервов; снижение мышечного тонуса; изменения в двигательной (малые судороги) и чувствительной сферах, а также расстройство регуляторной функции гипоталамо–гипофизарной зоны (полидипсия, полиурия, булимия, ожирение, расстройство терморегуляции); снижение остроты зрения; ограничение полей зрения; застойные явления в области зрительных нервов; интеллектуальная неполноценность; головная боль. Из эмоциональных нарушений у этих детей Рис. 4.7. Преждевременное половое развитие центрального генеза: а – больная С., 7 лет (по И.И. Богорову, 1960); б – больная К., 8 лет (по Н.В. Кобозевойи соавт., 1981)
Рис. 4.7. Преждевременное половое развитие центрального генеза: а – больная С., 7 лет (по И.И. Богорову, 1960); б – больная К., 8 лет (по Н.В. Кобозевойи соавт., 1981)
Появление вторичных половых признаков уже с рождения ребенка (при внутриутробном поражении ЦНС) или в более поздние сроки (постнатальное поражение ЦНС) на фоне выраженной неврологической симптоматики является ранним клиническим признаком истинного ППР церебрального генеза.
При органическом поражении ЦНС вторичные половые признаки всегда появляются позже неврологической симптоматики или (реже) на ее фоне. Одним из характерных симптомов при этом является внутричерепная гипертензия, причем у ряда больных она проявляется гидроцефалией со значительным увеличением окружности головы; у большинства больных на рентгенограмме черепа выявляется усиленный рисунок пальцевых вдавлений в костях свода и основания черепа (Ф.И. Нарина,1966).
При функциональном характере церебральной патологии признаки ППР появляются первыми, а иногда и единственными проявлениями нарушения функции гипоталамуса. При этом часто выявляются обменно–вегетативные нарушения: гипергидроз, акроцианоз, субфебрилитет, незначительное ожирение. У детей с функциональным характером поражения ЦНС при анализе биоэлектрической активности головного мозга обнаружены патологические знаки типа спайк–волн, комплексов «острая волна – медленная волна» с высокоамплитудными веретенообразными колебаниями β–активности, что указывает на нарушение функции диэнцефальных структур.
Для полной формы ППР церебрального генеза характерно быстрое развитие вторичных половых признаков, ускоренное созревание костей, при этом темпы окостенения опережают скорость развития костей. Костный возраст обычно опережает паспортный, и ежегодная его прибавка может соответствовать 2–4 годам. Без лечения зоны роста закрываются в 9–14 лет, рост девочек достигает 133–150 см.
У больных девочек отмечается низкий рост и диспропорциональное строение туловища (короткие конечности, длинное туловище, широкий таз, узкие плечи).
Содержание в крови половых гормонов и экскреция их с мочой соответствуют выраженности полового развития.
Синдром Мак–Кьюна – Олбрайта – Арайцева
Редкая форма ППР церебрального генеза. Возникает почти исключительно у девочек.Причины и патогенез
Механизм преждевременного полового созревания неизвестен. Длительное время его связывали с гипоталамической дисфункцией и гиперпродукцией гонадотропинов, в последние годы предполагается автономная гиперфункция половых желез. При этом реакция ЛГ на ЛРГ остается на пубертатном уровне, а характер импульсов ЛГ не соответствует половому созреванию. У таких больных появление автономно функционирующих кист в яичниках может определяться предшествующей гонадотропной стимуляцией. Позже в ходе преждевременного полового созревания начинает работать импульсный генератор ЛРГ и возникают овуляторные циклы. Описана узелковая гиперплазия надпочечников и щитовидной железы с синдромом Кушинга, тиреотоксикозом и гигантизмом вследствие секреции гормонов роста аденомами гипофиза, и постулируется связь всех этих изменений с множественным эндокринным аденоматозом.Клиническая картина
Характеризуется следующей триадой симптомов: распространенная фиброзная дисплазия черепа и длинных костей, преждевременное половое развитие и пигментные пятна цвета кофе с молоком с неправильными краями. В длинных трубчатых костях (как правило, в бедренной кости, особенно в ее головке) наблюдается прогрессирующее образование кист и истончение коркового слоя со склонностью к спонтанным переломам. Могут наблюдаться также изменения тел позвонков и выраженный сколиоз. Основание черепа часто утолщено из–за фиброза. Преждевременное половое развитие начинается в возрасте 3–5 лет. Обращает на себя внимание раннее появление менструаций на фоне еще слабо выраженных других признаков полового созревания. Характерно наличие на коже пигментных пятен цвета кофе с молоком, по форме напоминающих гирлянды; по мере развития болезни распространенность их увеличивается.Нейрофиброматоз (болезнь Реклингхаузена)
Представляет собой аутосомное заболевание, наследуемое по доминантному типу, но с различной пенетрантностью. Заболевание характеризуется светлокоричневыми пятнами на коже туловища и конечностей, нейрофибромами по ходу периферических нервов, на конъюнктиве и радужной оболочке глаз, железах внутренней секреции, костях черепа. Осложнения нейрофиброматоза связаны с внутренними нейрофибромами, у 20% больных выявляются кисты костей и псевдоартроз, односторонняя гипертрофия и искривления, а также дефекты черепа и лицевых костей. Гантелеобразные опухоли корешков спинномозговых нервов могут вызывать боли, нарушения чувствительности и движений, а также эрозию костей. Глиомы и нейрофибромиомы обнаруживаются в любых отделах ЦНС, включая зрительные нервы и гипоталамус, они могут кальцинироваться. У 5–15% больных развиваются саркомы, и это наиболее серьезное осложнение синдрома.Клиническая картина
Отмечаются судороги, нарушения зрения, психическая отсталость и либо задержка полового развития, либо, наоборот, преждевременное половое развитие. У большинства больных девочек отдельные симптомы заболевания проявляются уже в годовалом возрасте, хотя четкая клиническая картина заболевания появляется лишь в последующие годы. У взрослых больных иногда возникают феохромоцитомы.Синдром Рассела – Сильвера
Обусловлен генетическими нарушениями. Дети с данной патологией имеют малую длину и массу тела при рождении при доношенной беременности. В дальнейшем рост остается карликовым, лицевой череп мал, а мозговой череп относительно большой, что придает лицу треугольную форму. Углы рта опущены – «рот карпа». Бывают множественные скелетные аномалии: синдактилия, клинодактилия, готическое нёбо, укорочение проксимального отдела конечностей. У большинства больных интеллект развит нормально. На фоне указанных признаков появляется преждевременное половое развитие. Уровень гонадотропных гормонов в крови при этом увеличен. Описанный синдром относится к группе примордиального нанизма (А.Н. Окороков, 1998).Существуют и другие нарушения ЦНС, при которых развивается ППР, – эпилепсия, психическая отсталость, посттравматическое состояние.
Ложное преждевременное половое развитие (ЛРГ–независимое ППР)
Причинами могут быть гормонально–активные опухоли яичников, надпочечников, адреногенитальный синдром на фоне врожденной гиперплазии коры надпочечников, злокачественные заболевания печени, применение медикаментозных средств, ускоряющих половое созревание (препараты андрогенов, анаболических стероидов, гонадотропных гормонов). В основе ложного преждевременного полового созревания обычно лежит автономная продукция половых гормонов.Ложное изосексуальное ППР обусловлено такими состояниями, при которых эстрогены секретируются автономно. Приблизительно у 10% больных с опухолями, развивающимися из половых клеток яичника, имеются признаки неполного изосексуального преждевременного созревания в виде менструаций, развития молочных желез, пигментации ареол.
Причины и патогенез
Причинами ложного ППР могут быть гормоноактивные опухоли (гранулезоклеточные и тека–клеточные опухоли яичников, тератобластомы и хорионэпителиомы с элементами тератобластом, фолликулярные кисты). При этом опухоли яичников секретируют эстрогены автономно и в большом количестве, что обусловливает появление вторичных половых признаков. Концентрация эстрадиола в плазме может быть очень высока, тем не менее содержание ФСГ и ЛГ, как правило, снижено, что связано с незрелостью гипоталамических структур и гипофиза. При опухолях, секретирующих только ХГЧ, признаки полового созревания отсутствуют. Однако при наличии тератобластомы или хорионэпителиомы с элементами тератобластомы, секретирующих ХГЧ, возможно появление преждевременного полового развития. Это связано с одновременной секрецией опухолью и эстрогенов. Среди этих опухолей в детском возрасте наиболее часто обнаруживается доброкачественная кистозная тератома. Следующие по частоте встречаемости – злокачественная тератома, смешанная опухоль из половых клеток, опухоль внутридермального синуса.Клиническая картина
Первым симптомом преждевременного полового созревания у девочек с гормонопродуцирующими опухолями яичника и с фолликулярными кистами являются кровянистые выделения из половых путей при незначительном увеличении грудных желез. Затем появляется скудное оволосение в области лобка и подмышечных впадин. Ускорения соматического развития при этом не наблюдается. Костный возраст, рост и масса тела соответствуют календарному возрасту (рис. 4.8).При гинекологическом исследовании у большинства девочек отмечается не соответствующая возрасту «сочность» вульвы; выраженная складчатость влагалища; положительный симптом «зрачка»; незначительное увеличение матки, однако наличие угла между телом и шейкой матки, открытого впереди (характерного для пубертатного периода), не наблюдается; возможно выявление опухоли или увеличения одного яичника, что подтверждается данными рентгенографии и ультразвуковой сонографии.
 Рис. 4.8. Преждевременное половое развитие яичникового генеза (фолликулома). Больная С., 8 лет (по И.И. Богорову, 1960)
Рис. 4.8. Преждевременное половое развитие яичникового генеза (фолликулома). Больная С., 8 лет (по И.И. Богорову, 1960)
Кольпоцитология характеризуется наличием промежуточных клеток и клеток с пикнотическим ядром. Секреция эстрогенов повышена. Для больных с фолликулярной кистой характерно транзиторное преждевременное половое созревание, когда признаки преждевременного полового созревания в течение 2–3 месяцев наблюдения подвергаются обратному развитию.
Ложное гетеросексуальное ППР
Обусловлено автономной продукцией андрогенов.Причины и патогенез
Причинами гетеросексуального ППР являются, как правило, врожденная гиперплазия коры надпочечников и андрогенпродуцирующие опухоли яичников и надпочечников.Врожденная гиперплазия коры надпочечников (врожденный адреногенитальный синдром – АГС) является аутосомным врожденным заболеванием, обусловленным дефицитом одного из четырех стероидгидролизирующих ферментов: 21–гидроксилазы, 3р–ол–дегидрогенизы, 11 β–гидроксилазы или 17а–гидроксилазы, 18–гидроксилазы, прегненолонсинтетазы (десмолазы).
Наиболее распространенной формой врожденного АГС является простая вирилизирующая форма с дефицитом 21–гидроксилазы, которая встречается у 1 из 5000–7000 новорожденных. В результате дефицита фермента возникает недостаток кортизола и увеличивается секреция АКТГ, что вызывает двустороннюю гиперплазию коры надпочечников и увеличение синтеза стероидных гормонов. Эти биохимические нарушения проявляются сразу после рождения девочки вирилизацией наружных половых органов (женский псевдогермафродитизм).
Вирилизирующие опухоли яичников – андробластомы (арренобластома, тубулярная аденома, опухоль из сустентоцитов и гландулоцитов, маскулиномы и др.) являются редкой формой патологии у детей. Андробластомы встречаются в 0,09% случаев из 2309 опухолей яичников. Основным источником андрогенов в этих опухолях являются клетки Лейдига и в меньшей степени – клетки Сертоли (А. А. Пищулин, 1996).
Клиническая картина
Характеризуется вирилизацией наружных половых органов у девочек (пенисообразный клитор, персистенция урогенитального синуса, мошонообразные большие половые губы, углубление преддверия влагалища, высокая промежность – рис. 4.9), преждевременным физическим и половым развитием по гетеросексуальному типу. Нарушение функции надпочечников начинается внутриутробно, избыток андрогенов коры надпочечников приводит к вирилизации inutero и развитию наружных половых органов неясной половой принадлежности, включая увеличение клитора у девочек, у которых вирилизация продолжается и после рождения.На дифференцировку внутренних гениталий андрогены не влияют, их маскулинизация возможна только в присутствии яичек, выделяющих особую «антимюллерову» субстанцию. Развитие матки и яичников происходит нормально. При рождении у всех девочек отмечается неправильное строение наружных половых органов. Внутриутробная степень вирилизации наружных гениталий может быть очень выраженной. Нередки случаи, когда генотипически женским особям ошибочно присваивался мужской пол при рождении.
Вследствие анаболического действия андрогенов в первые годы жизни больные растут, обгоняя сверстников; рано появляется оволосение как вторичный половой признак; происходит раннее закрытие эпифизарных зон роста костей (иногда уже к 12–14 годам). Физическое развитие девочек характеризуется резко выраженным ускорением темпа роста в первое десятилетие жизни. К 12 годам скорость роста замедляется. Быстрый темп роста связан со значительным ускорением процессов роста и окостенения. Костный возраст 3–6–летних девочек превосходит календарный на 5 лет, а к 12 годам процессы окостенения почти завершаются, рост прекращается, не достигая среднего.
 Рис. 4.9. Половые органы девочки с АГС (по Р.Б. Джаффе, 1998)
Рис. 4.9. Половые органы девочки с АГС (по Р.Б. Джаффе, 1998)
Телосложение девочек весьма характерно: широкие плечи, узкий таз, короткие конечности, трубчатые кости довольно массивные.
Период полового созревания начинается рано (6–7 лет) и протекает по гетеросексуальному типу: развиваются мужские вторичные половые признаки (оволосение по мужскому типу, увеличивается клитор, понижается тембр голоса, возрастает мышечная сила). Больные остаются низкорослыми, непропорционально сложенными: с широким плечевым поясом и узким тазом, хорошо развитой мускулатурой. У девочек при достижении пубертатного возраста не происходит развития молочных желез, матка резко отстает в размерах от возрастной нормы, менструаций не наступает. В то же время усиливается вирилизация наружных половых органов, голос становится низким, половое оволосение развивается по мужскому типу (рис. 4.10).
 Рис. 4.10. Врожденный АГС у девочек (по А.И. Петченко, 1964): а – 12 лет; б – 3 года
Рис. 4.10. Врожденный АГС у девочек (по А.И. Петченко, 1964): а – 12 лет; б – 3 года
Вирилизирующие опухоли надпочечников
Кортикоандростеромы относятся к редкой патологии (1–3% всех опухолей). Болеют преимущественно девочки и женщины до 35 лет. Опухоли могут достигать больших размеров–до 1000–1200 г (А. А. Пищулин, 1996). Опухоль автономно секретирует андрогены.Клиническая картина
Клинические проявления вирилизирующей опухоли надпочечников – кортикоандростеромы характеризуются развитием ложного преждевременного полового развития по гетеросексуальному типу и обусловлены избыточной продукцией андрогенов. Степень вирилизации зависит от гормональной активности опухоли, длительности заболевания. У девочек заболевание проявляется вирилизацией разной степени: уменьшается подкожно–жировой слой, увеличивается мышечная масса, отмечается рост волос на лобке, а нередко и на лице, туловище, конечностях, происходит ускорение физического развития, огрубение голоса, гипертрофия клитора, костный возраст опережает фактический, преждевременно закрываются зоны роста. В то же время яичники и матка обычно соответствуют возрасту ребенка. У девочек пубертатного возраста (II и III периодов) молочные железы начинают подвергаться более и менее выраженной атрофии, менструации (при их наличии) начинают «путаться» и вскоре прекращаются. Происходит характерное изменение наружных гениталий – увеличение и вирилизация клитора. В поздних стадиях заболевания ухудшается самочувствие, наступают истощение, слабость, могут возникнуть боли, обусловленные большими размерами опухоли. Количество андрогенов, определяемых в крови и моче, может увеличиваться в десятки раз.Пубертатная форма АГС характеризуется избыточным образованием андрогенов, которое начинается с наступлением периода полового созревания и совпадает с физиологической активацией гормональной функции надпочечников. Девочки с данной патологией обычно выше своих сверстниц и имеют характерное телосложение: широкие плечи, узкий таз, отсутствие жировых отложений на бедрах и ягодицах, гипопластичные молочные железы. Девушки, как правило, достигают хороших результатов в спорте.
Гипертрихоз – основной постоянный симптом пубертатной формы АГС. Проявляется наличием единичных стержневых волос над верхней губой, щеках («бакенбарды»), в области ареол; отмечается оволосение по белой линии живота, промежности, бедер, голеней. Гирсутизм появляется до или сразу после менархе. У девочек с данной патологией отмечаются множественные acne vulgaris, себорея, пористая жирная кожа лица и спины. Половые органы развиты по женскому типу, иногда наблюдается умеренная гипоплазия малых и больших половых губ, некоторая гипертрофия клитора, увеличенное расстояние от основания клитора до наружного отверстия уретры, умеренно выраженная гипоплазия матки (Н.В. Кобозева, М.Н. Кузнецова, Ю.А. Гуркин, 1981).
Менархе у большинства девушек может быть своевременной или запаздывать (14–16 лет). В дальнейшем менструации носят нерегулярный характер или отсутствуют. Характер менструального цикла и гипертрихоз четко коррелируют с гиперандрогенией: чем выше уровень андрогенов, тем реже менструации (вплоть до аменореи), более выражены гипертрихоз и гипоплазия молочных желез (В.П. Сметник, Л.Г. Тумилович, 1997). У данных больных выделение 17–кетостероидов (17–КС) с мочой превышает норму в 1,5–2 раза.
Для дифференциальной диагностики между вирилизирующей опухолью коры надпочечников и их гиперплазией проводится проба с нагрузкой дексаметазоном и исследованием кортизола сыворотки. При врожденной вирилизирующей гиперплазии коры надпочечников наблюдается значительное снижение кортизола сыворотки крови после блокады адренокортикотропной функции гипофиза дексаметазоном. При кортикоандростероме уменьшение содержания кортизола в сыворотке крови на фоне приема дексаметазона не наблюдается.
Преждевременное половое развитие может быть обусловлено медикаментозными средствами, такими как эстрогены и анаболические стероиды, а также примесью половых гормонов в продуктах, применяемых для интенсификации животноводства.
Использование кремов и мазей, содержащих половые гормоны, может привести к возникновению у ребенка симптомов преждевременного полового развития.
В диагностике ППР, обусловленного медикаментозными средствами помогает изучение анамнеза, отсутствие других причин преждевременного полового развития, исчезновение симптомов заболевания с прекращением введения экзогенных гормонов.
Преждевременное половое развитие, обусловленное опухолями, секретирующими гонадотропины. Хорио– и тератокарцинома, или тератома, секретирующие хорионический гонадотропин, могут спровоцировать ППР. Опухоли могут локализоваться в средостении или половых железах. У девочек данная патология встречается очень редко. Опухоли сопровождаются высоким содержанием в крови хорионического гонадотропина α–фетопротеина, уровень фоллитропина снижен, а лютропина повышен вследствие перекрестного реагирования с хорионическим гонадотропином (А.Н. Окороков, 1998).
Неполные формы преждевременного полового развития (варианты полового созревания) – заболевания, при которых преждевременно появляется лишь один признак полового созревания (менархе, телархе, адренархе, пубархе). Эти состояния, как правило, рассматривают как условно патологические. Неполные формы ППР обусловлены повышенной чувствительностью органов–мишеней к нормальному уровню гормонов (М. А. Жуковский и соавт., 1989).
Преждевременное телархе (изолированное развитие молочных желез) – формирование у девочек молочных желез в возрасте до 8 лет без других признаков преждевременного полового созревания. Чаще всего развитие желез начинается в первые 2 года жизни (рис. 4.11), и редко – после 4 лет. Иногда наблюдается увеличение только одной железы. Обычно через несколько месяцев молочные железы регрессируют, но иногда это увеличение сохраняется годами. При этом, как правило, отсутствует развитие сосков.
Преждевременное развитие молочных желез представляет собой доброкачественный самоизлечивающийся процесс, в некоторых случаях – это семейный признак. Рост и окостенение скелета не нарушены, менструации появляются в обычное время, уровни фоллитропина и лютропина в плазме крови нормальные, реакция на введение люлиберина усилена, содержание эстрогенов в крови нормальное. При ультразвуковом исследовании яичников иногда выявляется одна или несколько кист яичников.
 Рис. 4.11. Изолированное преждевременное развитие молочных желез у 2–летней больной (по Н.В. Кобозевой и соавт., 1981)
Рис. 4.11. Изолированное преждевременное развитие молочных желез у 2–летней больной (по Н.В. Кобозевой и соавт., 1981)
Причины преждевременного появления менструаций неизвестны. Описаны случаи, когда у девочек 1–9 лет начинались циклические менструальноподобные кровотечения при отсутствии других вторичных половых признаков. Затем, через 1–6 лет, кровотечения прекращались и половое созревание начиналось своевременно. Уровень гонадотропинов в плазме крови данных больных был в пределах нормы, но концентрация эстрадиола может быть увеличена, у некоторых девочек при ультразвуковом исследовании выявляются фолликулярные кисты яичников.
Преждевременное адренархе (пубархе) – появление волос на лобке, в подмышечных впадинах без других признаков полового созревания или вирилизации. Это непрогрессирующее состояние, не оказывающее влияния на течение и сроки нормального полового созревания.
Данная патология чаще встречается у детей с повреждениями головного мозга. При обследовании девочек необходимо исключить врожденный АГС и андрогенпродуцирующие опухоли надпочечников и яичников.
Диагностика
В анамнезе необходимо отметить наличие перинатальной патологии или травмы, неонатальной инфекции, использование при лечении ребенка препаратов и мазей, содержащих половые гормоны; выяснить возраст начала ускорения полового созревания и его динамику. При объективном осмотре очень важно определить вторичные половые признаки и степень их развития; наличие угрей; полос растяжения; признаков гирсутизма; развитие мускулатуры; характер отложения жира. Гинекологическое исследование включает определение состояния вульвы; шейки матки; симптома «зрачка» матки и ее придатков; кольпоцитологию.При необходимости проводят дополнительное обследование: ■ ультразвуковое исследование (УЗИ) органов малого таза ■ диагностическую лапароскопию при сомнительных данных УЗИ ■ консультацию невропатолога (общая и очаговая симптоматика, электроэнцефалография и реэнцефалография) ■ консультацию окулиста (состояние полей зрения, глазного дна) ■ консультацию эндокринолога (УЗИ щитовидной железы и надпочечников, исследование гормонов щитовидной железы, гипофиза, яичников и надпочечников) ■ компьютерную томографию гипоталамо–гипофизарной зоны ■ определение костного возраста (рентгенография кистей рук, эпифизов лучевой и локтевой костей, черепа).
У девочек с истинным преждевременным половым развитием уровень гонадотропинов (ЛГ и ФСГ) повышен или соответствует таковому в пубертатном возрасте. При ложном ППР концентрация гонадотропинов крови будет низкой, соответствующей календарному возрасту. Для диагностики патологии надпочечников следует определить содержание в крови кортизола, дегидроэпиандростерона, тестостерона (уровни их будут значительно превышать норму, иногда в несколько раз), а также 17–КС в моче (высокая концентрация).
Лечение
Основные задачи наблюдения и лечения истинного ППР следующие: ■ обнаружение и лечение прогрессирующих внутричерепных нарушений ■ задержка преждевременного полового созревания до нормального возраста начала пубертата ■ регрессия уже имеющихся вторичных половых признаков ■ обеспечение нормального окончательного роста, снижение высокой скорости созревания скелета ■ профилактика эмоциональных расстройств у больных и родителей, облегчение социальной адаптации к возрастной среде ■ снижение риска раннего начала половой жизни ■ предотвращение беременности у девочек ■ сохранение фертильности в будущем ■ снижение повышенного риска развития рака молочных желез.Для лечения больных с ППР применяют средства, снижающие содержание гонадотропинов за счет влияния на гипоталамо–гипофизарную систему по механизму обратной связи.
В последнее время широко применяются препараты, лечебный эффект которых связан с их антигонадотропным действием: ■ медроксипрогестерона ацетат (депо–провера) назначают по 100–200 мг внутримышечно 1 раз в 10–14 дней или провера по 5–10 мг 2 раза сутки внутрь в течение 6 месяцев (подавляет рост молочных желез, менструации, но не влияет на рост и созревание костей) ■ 12,5% оксипрогестерона капронат, 1 мл 1 раз в 7–10 дней длительно внутримышечно в течение 1–2 лет (уменьшает рост матки и яичников) ■ ципротерона ацетат (андрокур) назначают внутрь от 25 до 100 мг/сут (дозу подбирают индивидуально, начиная с минимальной, затем постепенно снижают) 1 раз в день в течение 2–4 месяцев ■ даназол по 100 мг внутрь 2–3 раза в сутки в течение 6 месяцев (может вызывать вирилизацию).
Существенным прогрессом в лечении больных с истинным ППР явилось применение аналогов ЛРГ. Они не активны при приеме внутрь, их назначают интраназально (нафарелин, бусерелин), подкожно (золадекс), внутримышечно (декапетил). Данные препараты снижают чувствительность гипофизарных рецепторов ЛРГ и препятствуют действию эндогенного ЛРГ. Спустя неделю после применения аналогов ЛРГ заметно снижается секреция ЛГ и ФСГ, а через 2 недели – и секреция половых стероидов до уровня, характерного для препубертатного возраста (M.M. Grumbach, 1985).
Другим потенциальным средством лечения при ППР центрального генеза являются антагонисты ЛРГ, но их применение дает менее обнадеживающие результаты. Все вышеперечисленные методы лечения являются симптоматическими и не влияют на причину заболевания.
Лечение ППР церебрального генеза зависит от природы и локализации патологического процесса. Опухоли головного мозга удаляются хирургическим путем. Некоторые опухоли, например герминомы, высокочувствительны к лучевой терапии. При невозможности произвести операцию или при отсутствии опухоли проводят предложенное выше лечение.
Терапия ложной формы преждевременного полового развития заключается в хирургическом удалении опухоли надпочечников или яичников. При вирилизирующей гиперплазии коры надпочечников проводится лечение преднизолоном или кортизоном пожизненно, индивидуально подбирая дозу препарата. У детей до 1 года доза преднизолона обычно не превышает 2,5 мг/сут, у более старших девочек – от 5 до 10 мг/сут. Адекватность дозы оценивают по содержанию 17–КС в суточной моче или по уровню 17–гидроксипрогестерона в сыворотки крови. Данные показатели должны соответствовать биологическому возрасту девочки.
При первичной гиперплазии клеток Лейдига проводится лечение антиандрогенами. Если ложная форма преждевременного полового развития обусловлена приемом медикаментов, лечение заключается в их отмене.
Диспансерное наблюдение за девочками с ППР следует проводить не реже 1 раза в полгода, оценивая темпы физического и полового развития, рентгенологически контролируя зоны роста костей. После отмены антигонадотропной терапии необходимо наблюдение за восстановлением функции репродуктивной системы.
Задержка полового развития
Задержка полового развития (ЗПР) – отсутствие проявлений полового созревания у девочек, хронологический возраст которых на 2,5 стандартных отклонения превышает средний возраст начала полового созревания (13 лет – для телархе и 15 лет – для менархе). Данная патология встречается у 33% девочек–подростков с гинекологическими заболеваниями.Основные причины ЗПР: ■ семейные (конституциональные) ■ хромосомные заболевания и генная патология ■ врожденные или приобретенные повреждения ЦНС ■ гипогонадизм или удаление яичников ■ хронические соматические заболевания, приводящие к нарушению белкового обмена или к хронической гипоксии (заболевания печени, почек, сердца, анемии, эндоинтоксикации) ■ острые тяжело протекающие инфекционные заболевания (паротит, корь, краснуха, герпетический менингоэнцефалит) ■ нервно–психические расстройства ■ психические и физические перегрузки ■ недостаточное, несбалансированное питание.
Классификация
Выделяют: ■ конституциональную задержку роста и полового созревания (задержка активации гипоталамического импульса генератора ЛРГ) ■ задержку полового развития центрального генеза (гипогонадотропный, или вторичный, гипогонадизм) ■ задержку полового развития яичникового генеза (гипергонадотропный, или первичный, гипогонадизм): ■ синдром дисгенезии гонад и его варианты (синдром Шерешевского – Тернера) ■ ХХ– и ХУ–дисгенезии гонад ■ другие формы первичной недостаточности яичников.Идиопатическая (конституциональная) физиологическая задержка роста и полового созревания. По данным Dennis M. Styne, Melvin M. Grumbach (1998), у 0,6% подростков половое созревание начинается позже 13 лет. Как правило, причины задержки физического и полового развития конституциональные. В семейном анамнезе таких больных имеются указания на задержку полового и физического развития у матерей, отцов, братьев и сестер (до 14–18–летнего возраста).
Основным клиническим признаком данного состояния является конституциональная задержка всех стадий физического развития. Дифференцировка костного скелета задерживается незначительно, костный возраст отстает от хронологического на 1–2 года. Телосложение у таких девочек астеническое, характерна высокорослость, иногда ожирение. Вторичные половые признаки недоразвиты. Так, молочные железы к 13 годам не превышают II степени по Таннеру, ареолы бледные, лобковое и подмышечное оволосение выражено скудно. Менархе отсутствуют до 15–16 лет. При гинекологическом исследовании выявляется гипоплазия наружных и внутренних половых органов, что подтверждается данными УЗИ.
Уровни гонадотропных гормонов (ЛГ и ФСГ) и эстрадиола в сыворотке крови соответствуют нормам для начала пубертата или допубертатным значениям. Экскреция ЛГ и ФСГ в динамике носит ациклический характер.
Задержка полового развития центрального генеза (гипогонадотропный, или вторичный, гипогонадизм) является по своей сути лишь симптомом патологических состояний различной этиологии и патогенеза. Первичное звено поражения может находиться в ЦНС, гипоталамусе, гипофизе. Нарушения могут быть тяжелыми, органическими и вызывать стойкий гипогонадизм или незначительными, функциональными и ликвидироваться при соответствующей терапии (М. А. Жуковский и соавт., 1989).
Причины и патогенез. Наиболее частыми причинами нарушения функции ЦНС, приводящими к задержке полового развития, являются следующие: ■ болезни ЦНС (опухоли, врожденные уродства, лучевая терапия) ■ травматические и постинфекционные поражения ЦНС ■ наследственная патология (синдром Прадера – Вилли и синдром Лоренса – Муна – Бидля, болезнь Хенда – Шюллера – Крисчена) ■ функциональная недостаточность гонадотропинов (тяжелые системные и хронические заболевания, нарушения питания, гипотиреоз, гиперпролактинемия, психогенная травма, нервная анорексия, чрезмерные психические и физические нагрузки, употребление наркотиков).
Патогенетические проявления ЗПР могут быть результатом: ■ абсолютной или относительной недостаточности импульсной секреции ЛРГ или же нарушения амплитуды и частоты импульсов секреции ЛРГ ■ недостаточного образования и выделения нейространсмиттеров ■ нарушения образования рилизинг–гормонов (недостаток соматолиберина пролактинингибирующего фактора или избыток тиролиберина) ■ изолированной недостаточности ФСГ и ЛГ ■ изолированной гиперпродукцией пролактина.
Клиническая картина
Клинические проявления ЗПР зависят от основного заболевания и весьма вариабельны.Наиболее частыми клиническими признаками являются следующие: отсутствие вторичных половых признаков или их недостаточное развитие в соответствующем возрасте, отсутствие менструации или выраженный гипоменструальный синдром. У большинства девочек с функциональным поражением ЦНС отмечается высокий рост, евнухоидное телосложение (длинные конечности при относительно коротком туловище), недоразвития внутренних половых органов.
У больных с органическими поражениями ЦНС часто, хотя и не всегда, превалируют жалобы, указывающие на поражение структур головного мозга (головная боль, нарушение зрения, экзофтальм и др.). Вторичные половые признаки в период пубертата практически отсутствуют. Наружные и внутренние половые органы недоразвиты. Рост невысокий, подкожная жировая клетчатка распределяется по женскому типу с максимальным отложением на животе (жировой «фартук»), груди, бедрах. На коже ягодиц, бедер, груди выявляются полосы растяжения.
Задержка полового развития яичникового генеза (гипергонадотропный, или первичный, гипогонадизм) обусловлена недостаточной функцией яичников,связанной с непосредственным их поражением.
В основе данной патологии могут быть врожденные нарушения половой дифференцировки; дисгенезия гонад (синдром Шерешевского – Тернера); повреждение яичников инфекционным процессом (туберкулез, сифилис, эпидемический паротит); врожденная гипоплазия яичника; действие ионизирующего излучения; аутоиммунный оофорит; оперативное удаление яичников. В результате поражения яичников происходит уменьшение биосинтеза эстрогенов. По механизму отрицательной обратной связи повышается секреция гонадотропинов.
Клиническая картина весьма вариабельна и зависит от причинного фактора и времени воздействия. Врожденный первичный гипогонадизм (синдром дисгенезии гонад и его варианты) описан в гл. 5, мы приводим лишь данные собственных наблюдений (рис. 4.12).
При повреждении яичников в детском возрасте вторичные половые признаки не формируются или выражены недостаточно. Так, молочные железы рудиментарны, оволосение на лобке и в подмышечных впадинах скудное – обусловлено действием андрогенов надпочечникового происхождения (рис. 4.13).
Девочки в большинстве случаев высокого роста, астенического телосложения, с удлиненными конечностями. Хотя встречаются больные с явными признаками физического недоразвития. Довольно часто на бедрах, животе и груди отмечается избыточное отложение жира. Кожа больных тонкая, сухая («старческая»), на лице бывают преждевременные морщины.
При гинекологическом исследовании отмечается недоразвитие наружных и внутренних половых органов. При развитии гипогонадизма в постпубертатном периоде недоразвития половых органов может не быть, но менструации прекращаются и постепенно присоединяются признаки гипотрофии половых и молочных желез (А.Н. Окороков, 1998).
 Рис. 4.12. Больная М., 17 лет 3 месяца с хромосомным дисбалансом (собственное наблюдение)
Рис. 4.13. Больная К., 17 лет 8 месяцев с первичным гипогонадизмом. Кариотип 46ХХ (собственное наблюдение)
Рис. 4.12. Больная М., 17 лет 3 месяца с хромосомным дисбалансом (собственное наблюдение)
Рис. 4.13. Больная К., 17 лет 8 месяцев с первичным гипогонадизмом. Кариотип 46ХХ (собственное наблюдение)
Диагностика
Диагноз ЗПР ставят на основании отсутствия появления вторичных половых признаков в возрасте 13 лет и менархе в возрасте 15 лет. Из жалоб особое внимание обращают на головные боли, повышение артериального давления, нарушение зрения, нарушение обоняния, слабость в одной или нескольких конечностях.При изучении развития девочки отмечают следующие данные: наследственную патологию у близких родственников; наличие патологии у матери при вынашивании данной беременности, в родах и послеродовом периоде; инфекции и соматические заболевания, перенесенные и имеющиеся у ребенка от рождения до момента обследования; перенесенные травмы и операции; медикаментозные препараты и другие методы терапии, которые применялись для лечения девочки; наличие психических травм, физических перегрузок; нерациональность питания.
Осмотр больных позволяет выявить отсутствие или недоразвитие вторичных половых признаков; несоответствие показателей роста и массы тела хронологическому возрасту или диспропорции в развитии скелета; неправильное отложение жировой клетчатки; наличие гипоталамических знаков на коже; такие типичные симптомы дисгенезии гонад, как микрогнатия, рыбий рот, готическое нёбо, деформация зубов, эпикантус, птоз, низко расположенные и деформированные уши, широкая щитоподобная грудная клетка, короткая шея с крыловидными складками и низкой границей оволосения затылка, переразгибание в локтевых суставах, гипоплазия ногтей и склонность к образованию келлоида, возможна патология левых отделов сердца. При гинекологическом исследовании обращают внимание на недоразвитие наружных и внутренних половых органов.
Из дополнительных методов исследования используют следующие: ■ регистрацию роста и массы тела и определение величины стандартных отклонений ■ ультразвуковое сканирование органов малого таза для уточнения размеров матки и яичников ■ лапароскопия с биопсией гонад при наличии показаний ■ консультация невропатолога с исследованием общей и очаговой неврологической симптоматики и анализом результатов ЭЭГ и РЭГ ■ компьютерная томография головного мозга ■ консультация окулиста с исследованием глазного дна и полей зрения ■ рентгенологическое исследование кистей рук, эпифизов лучевой и локтевой костей, черепа ■ исследование гормонов крови (ФСГ, ЛГ, АКТГ, ТТГ, СТГ, пролактина) ■ функциональные пробы для дифференцирования уровня и тяжести поражения (гипоталамус, гипофиз, яичники), исследование гормонов крови ■ у всех низкорослых девочек даже при отсутствии специфических признаков дисгенезии гонад проводят определение кариотипа и полового хроматина.
Использование дополнительных методов исследования должно проводиться по показаниям. Так, например, при специфической внешности, известной под названием «фенотип Шерешевского – Тернера», нет необходимости в компьютерной томографии головного мозга, изучении гормонального профиля, консультациях невропатолога и окулиста, исследовании костного возраста и т.д. Для диагностики данного заболевания достаточно изучения клинической картины, УЗИ органов малого таза, определения полового хроматина и кариотипа.
Лечение. Лечение больных с ЗПР зависит от диагноза и характера патологии. Терапия должна быть комплексной и проводиться совместно с невропатологом, эндокринологом, педиатром, онкологом.
Конституциональная задержка полового развития, как правило, не требует медикаментозного лечения. Однако большинство девочек, страдающих данной патологией, нуждаются в коррекции питания, нормализации режима труда и отдыха, снижении или устранении психических и физических перегрузок, санации очагов хронической инфекции, витаминотерапии. По психологическим причинам девочкам 13 лет и старше можно провести курс этинилэстрадиола по 10 мкг в день внутрь или конъюгированных эстрогенов (премарин) по 0,3 мг в день внутрь в течение 3 месяцев. Если в течение последующих 3–6 месяцев не появятся признаки полового созревания, лечебный курс следует повторить. Когда костный возраст девочки достигает 13–14 лет, лечение отменяют и половое созревание продолжается спонтанно.
При ЗПР центрального генеза лечение сложное: ■ ликвидация очагов хронической инфекции ■ общеукрепляющее лечение (рациональное питание, режим труда и отдыха, исключение физических и психических перегрузок) ■ лечение экстрагенитальной патологии (гипотиреоза, сахарного диабета и т.д. ) ■ специальное лечение опухолей ЦНС ■ нормализация состояния ЦНС.
Медикаментозное лечение включает следующие препараты. ■ Циклическая витаминотерапия с микроэлементами в обычных суточных дозировках по следующей схеме (Ю.А. Гуркин, 2000): • 1–я неделя – витамины В1, Н, РР, кальций, магний • 2–я неделя – витамины С, В2, В5 и глютаминовая кислота; • 3–я неделя – витамины В6, А, Е и верошпирон; • 4–я неделя – витамин Е, верошпирон и янтарная кислота. Курс лечения начинают с любого дня у неменструирующих девочек и с 1–го дня менструаций у менструирующих. Требуется 3–6 курсов без перерыва. ■ При отставании в физическом развитии необходимо назначать терапию соматотропином, гонадотропинами (префизоном или пергоналом) в сочетании с нестероидными анаболическими средствами (калия оротатом, кальция глицерофосфатом, инозимом), микроэлементами (цинка сульфат), ферментами (фестал, абомин, панзинорм). ■ Заместительную гормональную терапию начинают с назначения эстрогенных препаратов. Девочкам 12–13 лет назначают синэстрол по 0,001 г/сут ежедневно в течение 6–12 месяцев. В дальнейшем переходят на препараты большей эстрогенной активности. Микрофоллин – по 0,05 мг/сут ежедневно в течение 6–12 месяцев. При появлении менструальноподобного кровотечения или не позднее чем через 6 месяцев после начала циклической терапии, с 12–го по 21–й день каждого месяца добавляют прегнин по 10–30 мг в день или медроксипрогестерона ацетат по 2,5–5 мг в день. Лечение проводят в течение 6–12 месяцев или до достижения костного возраста 14 лет. ■ В последние годы при лечении гипоталамических форм ЗПР используют гонадолиберин, вводимый в пульсирующем режиме, каждые 90 мин подкожно или внутривенно. Однако в качестве рутинного метода индукции полового созревания у подростков эта терапия, так же как и применение менопаузального и хорионического гонадотропина, не практикуется. ■ Для улучшения микроциркуляции в ЦНС возможно применение солкосерила или актовегина в течение 2–3 месяцев.
Немедикаментозное лечение включает: ■ эндоназальный электрофорез кальция, витамина Вх, 1%о раствора новокаина ■ гальванизация воротниковой зоны 2%раствором натрия бромида ■ гомеопатические препараты (barium carbonicum, calcium carbonicum, pulsatilla, graphites, sepia).
При задержке полового развития, связанной с потерей массы тела в результате нервной анорексии или косметического похудания, терапия гормонами противопоказана!
Лечение нервной анорексии проводится только в специализированном психоневрологическом стационаре (психотерапия, восстанавление адекватного питания).
Лечение ЗПР яичникового генеза основано на заместительной гормональной терапии, направленной на развитие вторичных половых признаков и регуляцию процессов роста скелета.
Если диагноз первичного гонадизма не вызывает сомнения, то лечение начинают в возрасте 10–11 лет. Терапия не должна прерываться до окончания пубертатного периода. С окончанием формирования вторичных половых признаков и прекращением роста эстрогены можно заменить на препараты растительного происхождения с эстрогенопободным действием (тефэстрол).
Лечение при дисгенезиях гонад описано в гл. 5.
Аномалии развития половых органов
Аномалии развития женских половых органов занимают, по данным разных авторов, от 0,23 до 4% от всех пороков развития (О.А. Толмачевская, 1976; I. Sakuntala–Devi, 1976). К данной патологии относятся врожденные нарушения анатомического строения гениталий в виде незавершенного органогенеза; отклонения формы, величины, пропорций, симметрии, топографии; наличие образований, не свойственных женскому организму в постнатальном периоде (И.В. Кобозева, М.Н. Кузнецова, Ю.А. Гуркин, 1981). Наиболее часто аномалии выявляют в следующие возрастные периоды: при рождении, при половом созревании, с началом половой жизни и, наконец, во время беременности.Причины
Порочная дифференциация половых органов может быть обусловлена генетическими причинами, однако чаще является следствием воздействия неблагоприятных факторов на плод, особенно в критические периоды. Как правило, пороки развития различных органов, в том числе и гениталий, возникают у девочек, матери которых имели такие осложнения течения беременности, как ранние и поздние токсикозы; тяжелую экстрагенитальную патологию; острые инфекции и ЗППП; а также подвергались воздействию лекарственных, токсических, радиационных, наркотических и других вредных факторов в критические сроки органогенеза (Н.В. Кобозева, М.Н. Кузнецова, Ю.А. Гуркин, 1981).Классификация основных типов нарушений органогенеза.
Агенезия – отсутствие органа и даже его зачатка.Аплазия – отсутствие части органа.
Атрезия – недоразвитие органа.
Гетеротопия – наличие клеток или тканей в тех органах и тканях, где они в норме не встречаются.
Гиперплазия – увеличение органа за счет увеличения количества и объема клеток.
Гипоплазия – недоразвитие органа, размеры которого значительно меньше средних величин.
Мультипликация – умножение (обычно удвоение) частей или числа органов.
Неразделение (слияние) – отсутствие разъединения органов или их частей.
Персистирование – сохранение рудиментарных структур.
Стеноз – сужение канала или отверстия.
Эктопия – смещение органов или развитие их в тех местах, где они не должны находиться.
Аномалии развития девственной плевы и влагалища
Атрезия девственной плевы и влагалища (atresia hymenis et vaginae)
Наиболее часто встречающаяся паталогия.Классификация
Выделяют: ■ врожденные атрезии девственной плевы и влагалища: возникают вследствие внутриутробного воспалительного процесса. ■ приобретенные атрезии девственной плевы и влагалища представляют собой синехии малых половых губ или стенок влагалища, возникающие после перенесенных вульвовагинитов неспецифической и специфической этиологии (скарлатина, дифтерия, тяжело протекающая корь, гонорея).Клиническая картина
Как правило, атрезии девственной плевы и влагалища обнаруживают с наступлением менструаций.Менструальная кровь (рис. 4.14), скапливаясь во влагалище, растягивает его, образуя гематокольпос (haematocolpos), затем заполняет матку – гематометра (haematometra) и, наконец, маточные трубы – гематосальпинкс (hae ma tosalpinx). Ведущий симптом – первичная, ложная аменорея. Основные жалобы – на периодические (ежемесячные) боли в низу живота ноющего характера. Со временем боли становятся более интенсивными, нередко постоянными, могут принимать характер кишечных колик с нарушением акта дефекации и с тошнотой, а иногда с дизурией. Довольно часто наблюдается повышение температуры тела до 37,5–38,0 °С, что может быть следствием пирогенной реакции на всасывание продуктов распада крови и ее нагноение.
 Рис. 4.14. Атрезия девственное плевы (гематоколпос, гематоматра, гематосальпинкс, по Н.В. Кобозевой и соавт., 1981)
Рис. 4.14. Атрезия девственное плевы (гематоколпос, гематоматра, гематосальпинкс, по Н.В. Кобозевой и соавт., 1981)
При наличии гематометры пальпаторно над лоном определяется опухолевидное образование с четкими контурами (размеры весьма вариабельны), как правило, безболезненное, хорошо смещаемое. При нагноении могут появляться болезненность и симптомы пельвиоперитонита.
Диагностика
Осмотр наружных половых органов имеет основное значение в диагностике атрезии девственной плевы. Девственная плева лишена отверстия, куполообразно выпячена кнаружи, через нее просвечивается темная кровь и ощущается флюктуация.Атрезия влагалища для диагностики более сложна; при осмотре наружных половых органов можно не выявить «заращение» отверстия влагалища. При ректальном исследовании определяется шаровидная, тугоэластическая, чувствительная опухоль, величина которой колеблется от размеров куриного яйца до головки новорожденного ребенка и больше. Ультразвуковое сканирование органов малого таза позволяет выявить наличие гематокольпоса, гематометры и гематосальпинкса. Можно провести диагностическую пункцию влагалища (только как этап начавшегося хирургического лечения!), при которой получают значительное количество дегтевидной вязкой от примеси слизи крови.
Дифференциальную диагностику проводят при ярко выраженной клинической картине (чаще при атрезии влагалища) с перекрутом ножки кисты или кистомы яичника, с аппендицитом. При изучении анамнеза обращают внимание на следующие симптомы: отсутствие менструаций при достаточной степени полового созревания; периодичность болей. При осмотре области преддверия влагалища отмечают отсутствие отверстия в девственной плеве. При наличии отверстия в девственной плеве проводят зондирование или вагиноскопию (короткий слепой мешок, отсутствие шейки матки).
Лечение
Проводят только хирургическое лечение.При атрезии девственной плевы в центре куполообразного выпячивания производят крестообразный разрез (2*2 см), после выделения основной части крови одиночными узловыми кетгутовыми швами формируют края искусственного отверстия. В течение 3–5 дней после операции назначают средства, сокращающие матку, при необходимости проводят антибактериальную терапию.
Лечение атрезии нижней трети влагалища производится следующим образом – через небольшой разрез в области девственной плевы тупым путем при помощи расширителей Гегара осуществляют доступ к нижнему полюсу влагалища. Затем рассекают слизистую влагалища, эвакуируют кровь, низводят края слизистой оболочки влагалища и подшивают их к эпидермису вульварного кольца.
В случаях полной атрезии влагалища возможно создание искусственного влагалища по одному из многочисленных методов, описанных в специальных руководствах (А. А. Вербенко, М.П. Шахматова, 1982; С.Н. Давыдов, Б.М. Хромов, В.З. Шейко, 1982).
Агенезия влагалища (agenesia vaginae)
Первичное полное отсутствие влагалища, в основе которого лежит утрата зародышем проксимальных отделов мюллеровых ходов. Поскольку нижняя треть влагалища формируется не из этих ходов, а из урогенитального синуса, то при агенезии сохраняется незначительное углубление между большими половыми губами, не превышающее 2–3 см.Аплазия влагалища (aplasi vaginae)
Первичное отсутствие части влагалища, является следствием неправильного формирования зачатков мюллерова протока и, как правило, сочетается с аплазией матки (синдром Майера – Рокитанского–Кюстера – Хаузера).Все пороки развития матки и верхней трети влагалища являются отклонениями от правильного развития парамезонефральных (мюллеровых) протоков в эмбриональном периоде. Выделение и клонирование гена мюллеровой субстанции (МИС) позволило понять механизм возникновения аномалий. У эмбрионов женского пола МИС отсутствует, поэтому мюллеровы протоки беспрепятственно развиваются в матку, маточные трубы и верхнюю треть влагалища. Вольфовы протоки самопроизвольно регрессируют.
Дифференциация мюллеровых протоков начинается у эмбриона в возрасте 5 недель и заканчивается к 20–й неделе.
При этом наблюдается три этапа: ■ слияние протоков друг с другом в области будущей матки и влагалища (8–11 недель) ■ рост протоков в каудальном направлении и формирование мюллерова бугорка, слияние их с урогенитальным синусом (до 11–12 недель) ■ рассасывание срединной перегородки в месте слияния протоков с образованием единой матки, шейки матки и влагалища (12–16 недель).
Отсутствие слияния мюллеровых протоков с урогенитальным синусом формирует аплазию влагалища, протяженность которой зависит от степени задержки роста протоков. При отсутствии роста протоков возникают полные формы аплазии (аплазия матки и влагалища). Отсутствие рассасывания общей стенки протоков приводит к удвоению матки и влагалища (Ю.А. Гуркин, 2000).
Учитывая, что развитие мюллеровых каналов может изменяться на разных стадиях в зависимости от влияния повреждающих факторов, аплазия влагалища может быть полной и частичной.
Частичная аплазия встречается редко. Как правило, аплазия влагалища сочетается с характерным удвоением матки: рога матки располагаются непосредственно около яичников, они округлые, с латеральными краями, колбообразной формы. Матка определяется в виде рудимента с двумя рогами, от которых отходят ответвления – связки к яичникам. В каждой связке установлено трубоподобное строение мышечной структуры. За мочевым пузырем эти ответвления соединяются дубликатурой брюшины. Часто расположение яичников асимметрично или один из них отсутствует.
Клиническая картина.
Жалобы на головную боль, аменорею, периодические набухания молочных желез, викарные кровотечения.Все больные имеют типично женскую внешность. Даже при инфантильной внешности молочные железы хорошо развиты, оволосение на лобке и в подмышечных впадинах нормальное.
Лечение
Проводят только хирургическое лечение. Существует множество способов и разнообразных методик кольпопоэза, предложенных различными авторами (М.С. Александров 1955, 1963; Д.П. Чухриенко, А.В. Люлько, 1972; А.М. Мажбиц, 1969; I. Krenar, 1968). Основные из них, применяемые в настоящее время, подразделяются на два вида: способы, связанные с перемещением отрезка кишечника в прямокишечно–пузырное пространство, и способы, основанные на выстилании канала, образуемого в ретровезикальной клетчатке кожей, брюшиной малого таза или алопластическими материалами.Наибольшее распространение в современной гинекологии получила операция кольпопоэза с применением брюшины в воде аутотрансплантата. Преимущества использования брюшины по сравнению с другими тканями (отрезками кишечника, кожей, плодными оболочками) следующие: легкое перемещение брюшины в канал, создаваемый в ректовезикальной клетчатке, быстрое прорастание трансплантата сосудами и, как следствие этого, быстрое приживление, редкость осложнений, одноэтапность операции и хороший косметический результат. Техника операции прекрасно изложена в специальной литературе (С.Н. Давыдов, Б.М. Хромов, В.З. Шейко, 1982; А.А. Вербенко, М.П. Шахматова, 1982).
Перегородка влагалища (vagina septa – полная, et subsepta – неполная)
Одно из наиболее частых пороков развития влагалища.Врожденная влагалищная перегородка – это результат неполного слияния зародышевых мюллеровых каналов, она обычно располагается в продольном направлении и может иметь различную толщину и протяженность.
Различают полную перегородку, которая простирается от сводов влагалища до девственной плевы, и неполную, при которой влагалище делится на две части только в определенном его отделе (нижнем, среднем, верхнем, в области сводов). Чаще всего перегородка встречается в нижней трети влагалища.
При наличии перегородки по всей длине влагалищной трубки или только в верхнем отделе, как правило, бывает и удвоение матки – двурогая, двушеечная, двойная матка или другие пороки развития. Редко встречается перегородка, расположенная в поперечном направлении, которая делит влагалищный канал как бы на два этажа.
Клинически такой порок практически не проявляется, обнаруживается обычно при 1–м половом акте, при гинекологическом или акушерском обследовании.
Диагностика
Основана на выявлении перегородки при осмотре влагалища в зеркалах или бимануальном исследовании. У девочек перегородка может быть обнаружена при вагиноскопии.Лечение
Проводят хирургическое лечение. Тонкие перегородки могут быть иссечены электродом, толстые – скальпелем с последующим тщательным гемостазом. В послеоперационном периоде такие больные требуют наблюдения в течение 10 дней с целью предупреждения развития воспаления и последующего образования синехий.Пороки развития матки
Наиболее частые пороки развития матки представлены на рис. 4.15. Как правило, эти аномалии развития являются следствием частичного или полного неслияния мюллеровых ходов.

 Рис. 4.15. Аномалии развития матки (по С.Н. Давыдову, 1982): а – uterus didelphis; б – uterus duplex et vagina duplex; в – uterus bicornis bicollis; г – uterus bicornis unicollis; д – uterus arcuatus; е – uterus septus duplex; ж – uterus subseptus; з, и, к, л – uterus bicornis rudimentarius; м – uterus unicornis
Рис. 4.15. Аномалии развития матки (по С.Н. Давыдову, 1982): а – uterus didelphis; б – uterus duplex et vagina duplex; в – uterus bicornis bicollis; г – uterus bicornis unicollis; д – uterus arcuatus; е – uterus septus duplex; ж – uterus subseptus; з, и, к, л – uterus bicornis rudimentarius; м – uterus unicornis
Существуют различные классификации пороков развития матки. Наиболее приемлемой для практической гинекологии является классификация И.Л. Брауде (1960), согласно которой все аномалии развития матки делятся на две группы: нарушение анатомического строения и задержка развития правильно сформированной матки.
Двойная матка в сочетании с двойным влагалищем (uterus duplex et vagina duplex)
Является следствием сохранения мюллеровых ходов в результате неслияния их на всем протяжении в период органогенеза. При таком пороке развития каждый мюллеров канал образует самостоятельную половую трубку (влагалище – матка – маточная труба). Обе матки не соприкасаются между собой, каждая имеет отдельную маточную трубу, наблюдается два отдельных влагалища, каждое из которых соединено с соответствующей маткой. Этот порок развития чаще всего встречается у нежизнеспособных плодов в сочетании с рядом других аномалий развития. У женщин этот порок развития наблюдается крайне редко.В других случаях может встречаться наличие двух маток и двух влагалищ, соприкасающихся друг с другом на том или ином участке. При таком пороке одна из маток (вернее, «полуматок») и одно из влагалищ выражены лучше. Однако каждая матка, если она достаточно развита, может функционировать самостоятельно («менструировать и беременеть»). Двойная матка может сочетаться с односторонней гинатрезией и другими пороками развития, в первую очередь с аномалиями почек и мочеточников.
Двурогая матка (uterus bicornis)
Является следствием неслияния тех частей мюллеровых каналов, за счет которых обычно образуется единая матка, причем влагалище развивается одно, общее. Двурогая матка может иметь различную степень выраженности.В связи с этим различают следующие основные ее виды: ■ седловидная, или дугообразная, матка (uterus arcuatus) относится к наименее выраженному варианту двурогой матки; в этом случае разделенным оказывается лишь дно матки ■ матка с полной или неполной перегородкой (uterus septus, subseptus) – форма матки более или менее нормальная, в то время как ее полость разделена полной или частичной перегородкой. При наличии полной перегородки последняя простирается от дна матки до области внутреннего или наружного зева. Частичная перегородка разгораживает только часть матки – в области ее дна или шейки ■ раздельное тело матки при общей шейке (uterus bicornis unicollis) образуется вследствие слияния мюллеровых ходов в области шейки матки. Этот вид двурогой матки является наиболее частым ■ раздельные тела и шейки матки (uterus bicornis bicollis) – наиболее резко выраженный вариант двурогой матки, при котором раздельными оказываются не только тела, но и шейки маток.
В тех редких случаях, когда оба мюллеровых канала не слились и не имеют просвета, обе матки представляют собой два рудиментарных рога солидного строения без просвета (uterus bicornis rudimentarius solidus). Эта аномалия известна под названием «синдром Майера – Рокитанского – Кюстера – Мюллера – Хаузера». Влагалище при этом варианте развития может иметь различное строение (быть нормальным, иметь перегородку) или отсутствовать. Нередко встречаются переходные формы упомянутых видов пороков развития матки и влагалища.
Могут встречаться и менее понятные с точки зрения эмбриогенеза аномалии, как, например, атрезия шейки матки (atresia colli uteri), при которой тело матки оказывается соединенным с влагалищем лишь тонким тканевым тяжем, полностью лишенным просвета.
Однорогая матка (uterus unicornis)
Редкая патология, следствие неполного развития одного из мюллеровых каналов.В зависимости от состояния рудиментарного рога различают следующие ее варианты: ■ однорогая матка с нефункционирующим рудиментом второго рога. Рудиментарный рог представляет собой тонкий тяж без какой–либо полости. Такая однорогая матка формируется только из одного мюллерова канала при полной атрезии другого ■ однорогая матка с функционирующим вторым рогом. В этом случае в рудиментарном роге имеется полость, выстланная функционирующим эндометрием. Если функционирующая полость не сообщается с полостью матки, то в рудиментарном роге обычно скапливается содержимое (кровь, гной).
Атрезия полости матки
Чаще всего представляет собой заращение канала шейки матки на уровне внутреннего зева. Сращение обычно является следствием грубого выскабливания полости матки или возникает в результате прижигания тканей цервикального канала. Как исключение, атрезия может носить врожденный характер.Задержка развития правильно сформированной матки
К этой группе относятся пороки развития, формирующиеся прижизненно. Матка, развиваясь правильно, отстает в своем развитии. В нейтральный период у нормально развитой девочки соотношение тела матки к шейке матки 1: 3, в препубертатный период этот соотношение составляет 1: 1, в пубертатный, как и в период половой зрелости, 3: 1.Различают три степени гипоплазии матки: ■ рудиментарная, или зародышевая, матка (uterus foetal is) длиной 1–3 см, причем величина шейки составляет 50% и более общей величины органа. Этот вариант отмечается редко и характеризуется гипоэстрогенией, стойкой аменореей. Прогноз для восстановления функции неблагоприятный ■ инфантильная матка (uterus infantilis) – длина больше 3 см, соотношение величины шейки и тела 3: 1, т.е. как в нейтральном периоде, или 1: 1, как в препубертатном периоде. При бимануальном исследовании выявляется маленькая матка плотной консистенции, шейка ее длинная, конической формы. По длине тело матки отстает от шейки. Чем резче выражено это отставание, тем значительнее недоразвитие. Эта форма встречается чаще предыдущей и характеризуется редкими болезненными менструациями. Для восстановления функции требуется длительная терапия ■ гипопластическая матка (uterus hipoplasticus) сохраняет нормальное соотношение величины шейки и тела – 1:3, т.е. тело матки составляет две трети, шейка – одну треть всей длины. Однако величина всего органа меньше физиологической нормы (до 6–7 см). Чаще эту форму недоразвития обнаруживают у девочек невысокого роста, астенического телосложения. Эта степень гипоплазии встречается наиболее часто, менструальная, а в последующем и детородная функции не нарушены.
Клиническая картина
Клинически пороки развития матки в детстве, как правило, не проявляются. В период полового созревания могут появляться симптомы, связанные с нарушением менструальной функции (аменорея, гипоменструальный синдром, альгоменорея), а также с присоединением осложнений, связанных с образованием гематометры и гематосальпинкса при нарушении оттока менструальной крови из рудиментарной маточной трубы или одной из маток. Нагноение гематометры или гематосальпинкса может привести к пельвиоперитониту и перитониту. При беременности в одном из рогов матки может произойти его разрыв.Диагностика
Диагнострировать пороки развития матки у девочек затруднительно.Диагностика основана на следующих данных: ■ анализ течения беременности у матери, влияние вредных факторов на плод в период органогенеза; перенесенная экстрагенитальная и гинекологическая патология у девочки в детстве и препубертатном возрасте ■ жалобы на нарушение менструальной функции в период полового созревания, позднее менархе, аменорея, гипоменструальный синдром, альгодисменорея. Возможно также появление жалоб, связанных с присоединением осложнений (боли в животе, повышение температуры тела, симптомы перитонита) ■ при общем осмотре учитывают физическое развитие и степень полового созревания ■ при гинекологическом осмотре обращают внимание на наличие недоразвития или аномалий развития наружных половых органов; бимануальное ректальное или вагинальное (у живущих половой жизнью девушек) исследование позволяет обнаружить недоразвитие матки (как правило, в период полового созревания), а также такие аномалии, как удвоение матки, наличие рудиментарного рога, можно пропальпировать гематометру и гематосальпинкс. На наличие двурогой матки указывает обнаружение при бимануальном исследовании «петушиных гребней» – выраженных поперечных складок на передней и задней стенках влагалища ■ дополнительные методы исследования.
Наиболее информативными оказываются такие методы исследования, как ультразвуковое сканирование органов малого таза, лапароскопия, рентгенологические методы исследования. Вагиноскопия нередко позволяет выявить перегородку влагалища и удвоение шейки матки.
Однако у детей иногда решающее значение имеет диагностическое чревосечение, которое может завершиться гонадэктомией, пластической операцией, резекцией яичника, иссечением рудиментарных образований.
Лечение
При некоторых видах пороков (седловидная, одногорогая матка) лечения не требуется. Диагностировав данную патологию у девочки, врач должен поставить в известность больную или ее мать о наличии у нее аномалии развития матки, чтобы в дальнейшем правильно провести беременность, роды и производить внутриматочные манипуляции.При присоединении осложнений, а также для восстановления нормальной менструальной и детородной функции показано оперативное вмешательство. Появление осложнений требует, как правило, немедленной лапаротомии, а объем операции зависит от характера осложнения.
При различных формах удвоения матки применяют метропластику (лапаротомия, рассечение матки, иссечение перегородки, ушивание матки). Оперативных методик метропластики существует несколько, наибольшее признание получили следующие методы: по Штрассману (поперечное рассечение дна матки, иссечение перегородки, наложение двухрядных швов в переднезаднем направлении), по Матье – Дюпарку (поперечное рассечение матки между местами прикрепления круглых связок, иссечение перегородки и последующее восстановление матки в продольной плоскости путем наложения двухрядных швов). При наличии неполной перегородки матки по передней и задней поверхности матки производят V–образный разрез, включающий в себя перегородку, иссекают весь участок матки с перегородкой и восстанавливают матку отдельными кетгутовыми швами – операция Джонса. (С.Н. Давыдов, Б.М. Хромов, В.З. Шейко, 1982). Иногда при сложных пороках развития матки, шейки матки и влагалища оперативное вмешательство проводят в два этапа или формируют две хирургические бригады: одну – для операции на влагалище, другую – для доступа через брюшную полость.
Лечение недоразвития матки заключается в терапии общего и генитального инфантилизма, а также, по возможности, в устранении причины.
Пороки развития придатков матки
Аномалии развития маточных труб
Являются следствием недоразвития, нарушения реканализации и неполного слияния мюллеровых ходов.Из числа аномалий развития придатков матки следует иметь в виду возможность полного одностороннего отсутствия маточной трубы и яичника.
Различают следующие пороки развития маточных труб, имеющие практическое значение: ■ чрезвычайно длинные трубы, которые могут перекручиваться или вовлекаться в грыжевой мешок при паховых грыжах ■ спиралеобразная форма труб, перекруту которых способствуют воспалительные процессы придатков, спайки, опухоли и нарушения перистальтики труб ■ врожденные облитерации труб или их маточных отверстий, а также их атрезия, клинически проявляющиеся бесплодием ■ удвоение труб, обычно сопровождающееся удвоением яичников ■ добавочные слепые ходы; добавочные отверстия, чаще располагающиеся вблизи от брюшного отверстия трубы ■ врожденные дивертикулы труб. Атрезии маточных труб, как единственный врожденный порок, практически не встречаются.
Клиническая картина
Клинические проявления отсутствуют и появляются только при присоединении осложнений данной патологии (перекруты гидро– и сактосальпинксов, вовлечение трубы в грыжевой мешок, гематосальпинкс, пиосальпинкс, внематочная беременность и т.д.).Диагностика
Основана на появлении жалоб при присоединении осложнений, пальпации образований (сактосальпинсы) при бимануальном исследовании, данных УЗИ, рентгенологических методов исследования, лапароскопии и диагностической или лечебной лапаротомии.Лечение.
Аномалии развития маточных труб лечат оперативно, что зависит от вида патологии и цели, которую ставит перед собой хирург. У детей и подростков оперативные вмешательства по поводу данной патологии приходится выполнять в случаях осложнений (перекруты и нагноение маточных труб). При этом хирург должен максимально щадить придатки матки и использовать при возможности пластические операции.Аномалии развития яичников
Многочисленные аномалии развития яичников (врожденные и приобретенные) по классификации Stange (1963) подразделяют на следующие виды: агонадизм истинный (аплазия желез) и ложный (регрессивная форма); гипергонадизм истинный (гиперплазия) и ложный (фиброкистозный и поликистозный яичники); гипогонадизм первичный (гипоплазия яичников) и вторичный (атрофия); амбиогонадизм (односторонний и двусторонний). Причиной первичного гипогонадизма являются аномалии в хромосомах половых желез, вторичного – гонадотропная недостаточность гипофиза. Полное отсутствие одного или обоих яичников (aplasia ovariorum) обычно сопровождается различными расстройствами менструальной функции.Подробно аномалии развития яичников описаны в гл. 5.
Воспалительные заболевания половых органов у девочек
Во все периоды развития девочки (даже после наступления половой зрелости) воспалительные заболевания гениталий являются наиболее частой причиной обращения девочек к гинекологу. Частота воспалительных процессов полового аппарата у детей и подростков возросла вдвое после 1985 г. и составляет в настоящее время 60–80% от всех гинекологических заболеваний у этого контингента. При этом большое значение имеют социальные факторы, жизненный уровень семьи, общие гигиенические условия.В структуре гинекологических заболеваний детского возраста (до пубертата) воспалительные поражения половых органов занимают 1–е место. Клиническое значение названных заболеваний определяется не только их частотой, но и тем, что они могут быть причиной серьезных нарушений половых функций в зрелом возрасте.
Классификация
Неспецифические воспалительные заболевания, явившиеся результатом воздействия на половые органы физических, химических и инфекционных факторов, называются первичными.К вторичным неспецифическим воспалениям гениталий относят воспалительные процессы, явившиеся следствием экстрагенитальной патологии общего (сахарный диабет, инфекционноаллергические заболевания, гельминтозы, хронический пиелонефрит и др.) или местного (аппендицит, цистит, проктит и др.) характера.
К специфическим воспалительным заболеваниям относятся гонорея, трихомониаз, туберкулез, кандидозы, кондиломатоз и др.
По локализации воспалительного процесса выделяют вестибулит, вульвит, кольпит, эндоцервицит, эндометрит, сальпингит, оофорит, периметрит, параметрит, пельвиоперитонит.
По продолжительности течения воспалительные заболевания гениталий подразделяют на острые (до 2 недель), подострые (до 2 месяцев) и хронические (более 2 месяцев).
Воспаление наружных половых органов
Вульвовагиниты
Представляют собой наиболее распространенную форму гинекологической патологии среди девочек. Это клинически определенное понятие охватывает изолированные поражения вульвы и влагалища. По отношению к различным гинекологическим заболеваниям детского возраста они составляют 63% (Н.В. Кобозева, М.Н. Кузнецова, Ю.А. Гуркин, 1981). Влагалище, подобно другим полостям человеческого тела, имеющим контакт с окружающей средой, колонизировано различными, в норме безвредными микроорганизмами. Большинство бактерий влагалищной микрофлоры является условно–патогенным. Инфекционное поражение влагалища, а затем и вульвы начинается при нарушении равновесия между микрофлорой и региональными или системными защитными механизмами.Вульвит как таковой у девочек встречается очень редко и, как правило, связан с вагинитом, т.е. является вторичным. Наиболее часто вульвовагинитом болеют дети в «нейтральном» возрасте и чуть старше (от 1 месяца до 9 лет), что объясняется несовершенством иммунитета и анатомо–физиологическими особенностями половых органов, присущих возрастному периоду.
Вульва у девочек покрыта нежной, легко ранимой кожей с многочисленными криптами и очень восприимчива к инфекции. Во влагалище до 8–9 лет много складок, углублений, оно выстлано нежной, тонкой слизистой оболочкой, клетки которой содержат малое количество гликогена. Реакция влагалищного секрета после 1–го месяца жизни девочки – амфотерная или щелочная (рН около 7,0), отсутствуют лактобактерии (палочки Дедерлейна), преобладает кокковая флора, местный иммунитет влагалища слабый. В препубертатный период под влиянием эстрогенов изменяется микрофлора влагалища. Она из кокковой переходит в бациллярную (появляются палочки Дедерлейна), образуется молочная кислота, благодаря чему устанавливается кислая реакция влагалищного секрета. В пубертатном возрасте частота воспалительных заболеваний вульвы значительно снижается.
Неспецифическиевульвовагиниты
Этиология весьма разнообразна, по данным Hammerschlag и соавторов (1978) у девочек в возрасте от 2 месяцев до 15 лет, страдающих неспецифическими вульвовагинитами, выявляется более 41 вида бактерий, наиболее часто встречаются следующие: Staphilococcus epidermidis (84%), Diphtheroid bacilli (80%), Bacteroides (76%), Peptococcus (76%), Peptostreptococcus (56%).Факторы, способствующие развитию неспецифического воспаления гениталий: ■ механические – мастурбация, грубые швы нижнего белья, инородные тела, травмы половых органов, нарушение личной гигиены ■ термические – горячие ванны, спринцевания, ожоги гениталий ■ химические – подмывание неприемлемыми в практике или концентрированными растворами ■ эндогенные причины – иммунодефициты, диатезы, сахарный диабет, энтеробиоз, анемия, заболевания почек и мочевого пузыря, алиментарная дистрофия или ожирение, наличие хронических очагов инфекции и др.
Клиническая картина
Клиническое течение неспецифических вульвовагинитов редко бывает острым, только в случае, если оно спровоцировано тяжелым первичным повреждающим фактором (ожоги, травмы наружных половых органов). Чаще воспаления вульвы у детей протекают в виде подострого или хронического процесса.Больные предъявляют жалобы на жжение, зуд, боль в области наружных половых органов, частое и болезненное мочеиспускание. Поведение девочек становится беспокойным, нарушается сон, хотя общее состояние детей страдает незначительно.
В острых случаях при объективном осмотре наружных половых органов обращают внимание на гиперемию больших и малых половых губ, преддверия влагалища и их отек. Иногда, при запущенных случаях воспаления, отмечают гиперкератоз и пигментацию внутренней поверхности бедер, промежности, перианального пространства.
Особое место в клинической картине воспалительных заболеваний гениталий имеют бели.
Классификаций выделений из половых путей у детей достаточно много (И.И Богоров, 1960, В.А. Макаренко, 1973; R. Peter, 1950, P. Morin, D. Sersiron et G. Plantureux, 1957). Однако в современной литературе наиболее часто приводится классификация, предложенная А.И. Петченко в 1960 г.: ■ бели физиологические: у новорожденных, в период полового созревания (гиперсекреция): ■ бели от общих причин: • инфантилизм, астения • анемия, хлороз • хронические инфекции (туберкулез легких) • интоксикации, расстройства обмена • заболевания сердца, легких • лабильность нервной системы (эмоции положительные и отрицательные) ■ бели при инфекционных (вне гениталий) заболеваниях: • скарлатина, дифтерия, грипп • отиты, тонзиллиты ■ бели от специфической инфекции: • гонорея • туберкулез гениталий • местные поражения при скарлатине и дифтерии ■ бели от неспецифических инфекций: • стрептококками, стафилококками • пневмококками, энтерококками, колибациллами. ■ бели от инвазии: • трихомонадами • грибками • глистами. ■ бели от механического раздражения: • скопления смегмы • инородные тела • онанизм • травма.
Основные признаки патологической секреции – динамическая гиперсекреция, изменение консистенции и цвета (желтые от примеси гноя или красноватые от примеси крови), изменение степени чистоты влагалища до III и IV с понижением кислотности и повышением количества лейкоцитов.
Бели могут вызывать сильное раздражение наружных половых органов, их мацерацию, имеют часто неприятный запах (ихорозный) и соответственно являются причиной перечисленных выше жалоб.
Диагностика
Диагностика вульвовагинитов у девочек представлена в табл. 4.2.Таблица 4.2. Программа обследования при вульвовагинитах
| Исследование | Результаты |
|---|---|
| Вагиноскопия | Определение степени поражения влагалища и шейки матки |
| Влагалищная рН–метрия | Бактериальный вагиноз, при других заболеваниях имеет относительное значение |
| Аминотест | Бактериальный вагиноз |
| Микроскопия нативного мазка | Наличие трихомонад, грибковой флоры, энтеробиоз, ключевые клетки, лейкоцитоз |
| Мазок, окрашенный по Граму | Диагностика гонореи, трихомониаза, кандидоза, лейкоцитоз, степень функциональной активности лейкоцитов |
| Анализ кала на яйца глист, соскоб на энтеробиоз | Подтверждение глистной инвазии |
| Посев на аэробную флору и чувствительность к антибиотикам | Неспецифический бактериальный вульвовагинит |
| Определение возбудителя методом полимеразной цепной реакции | Подтверждение специфической природы возбудителя |
После подробного выяснения жалоб, истории жизни и заболевания ребенка приступают к осмотру. Оценивают степень физического развития, наличие вторичных половых признаков (если таковые появились) и их соответствие возрасту, конституцию, поведение, состояние кожи и слизистых оболочек, лимфатической системы и других органов.
При осмотре наружных половых органов обращают внимание на наличие гиперемии, отека и патологических выделений или налета в области наружных половых органов и преддверия влагалища. Для осмотра преддверия, задней стенки влагалища и девственной плевы используют прием, описанный М.Г. Сердюковым (рис. 4.16): большим и указательным пальцами обеих рук захватывают кусочками ваты большие половые губы у их основания и натягивают их кпереди, книзу и несколько в стороны. Затем осматривают область наружного отверстия уретры, перианальное пространство и внутреннюю поверхность бедер.
С целью изучения состояния внутренних половых органов применяют ректо–абдоминальное исследование (до 7–летнего возраста мизинцем). При необходимости осматривают влагалище при помощи вагиноскопа или детских зеркал. Вагиноскопия производится при рецидивирующих вульвовагинитах, при подозрении на наличие опухоли или инородного тела во влагалище. При невозможности выполнить вагиноскопию очень осторожно производят исследование влагалища зондом.
 Рис. 4.16. Осмотр наружных половых органов. Половые органы натянуты кпереди, книзу и несколько в стороны (по И.И. Богорову, 1960)
Рис. 4.16. Осмотр наружных половых органов. Половые органы натянуты кпереди, книзу и несколько в стороны (по И.И. Богорову, 1960)
После осмотра половых органов производят взятие материала для бактериоскопического и бактериологического исследования отделяемого влагалища (при необходимости – мочеиспускательного канала и прямой кишки), одновременно необходимо выяснить чувствительность микрофлоры к антибиотикам. При подозрении на герпетическую или микоплазменную инфекцию исследуют соскоб слизистой из влагалища или мазок–отпечаток с места поражения методом иммунофлюоресценции. Биоценоз влагалища у девочек представлен в табл. 4.3.
Дополнительные методы исследования: общий анализ крови, мочи, кала на яйца глист и исследование с помощью липкой ленты или соскоба с перианальной области для выявления яиц остриц, определение глюкозы в моче и крови, мазки на онкоцитологию. При необходимости больную следует проконсультировать у педиатра, эндокринолога, невропатолога, психиатра, отоларинголога и других специалистов.
Лечение
Вульвовагиниты у детей лечат, учитывая индивидуальные (шаблоны не приемлемы), патогенетические, комплексные подходы.На 1–м месте в лечении вульвовагинитов стоит удаление причины заболевания, если ее удалось установить (лечение глистных инвазий, коррекция глюкозы, соблюдение гигиены, устранение аллергических агентов, удаление инородных тел и т.д.).
Рекомендуется строгое соблюдение правил личной гигиены, ежедневная смена нижнего белья. Трусики у девочки должны быть свободными, из мягкой хлопчатобумажной ткани без грубых внутренних швов. Важно соблюдать правильный режим дня и проводить полноценное питание с учетом росто–весового коэффициента, исключить острые пищевые добавки.
Проводится санация хронических очагов инфекции, лечение сопутствующей экстрагенитальной патологии.
При длительной сенсибилизации организма детям с отягощенным аллергоанамнезом, инфекционно–аллергическими заболеваниями назначают десенсибилизирующую терапию следующими препаратами: кальция глюконатом, кальция хлоридом, тавегилом, димедролом, пипольфеном, супрастином.
В лечении необходимо применение витаминов С, А, Е, Р с соблюдением возрастных дозировок или комплексов витаминов типа «Витус», «Теравит», «Юникапс» и др.
Общая антибактериальная терапия назначается в тех редких случаях, когда вульвовагинит обусловлен распространенным инфекционным процессом или вызван патогенной флорой типа гемолитического стрептококка. Она должна проводиться с учетом чувствительности микрофлоры и с профилактикой кандидоза.
Таблица 4.3. Биоценоз влагалища в детском возрасте (М.Л. Корсиунов, 1996)
| Тип мазка | Показатели | 1–3 года | 4–6 лет | 7–9 лет | 10–12 лет | 13–15 лет | Нозология |
|---|---|---|---|---|---|---|---|
| Нормоценоз | Лейкоциты | 0–2 | 1–3 | 1–3 | 1–4 | 1–4 | Нормальное состояние биоценоза влагалища |
| Слизь | 1–2 | 1 | 1 | 1–2 | 1–2 | ||
| Эпителий | 1–2 | 2–3 | 4–5 | 6–8 | 10–12 | ||
| Лактобацила | – | – | – | – | + | ||
| Фагоцитоз | – | – | – | – | – | ||
| Дегенеративно– и реактивно–измененные клетки | Незначительное количество Грамположительные коккобактерии в незначительном количестве | ||||||
| Флора | |||||||
| Переходный | Лейкоциты | 0–2 | 1–3 | 1–3 | 1–4 | 1–4 | Переходное состояние редко сопровождается жалобами и клиническими проявлениями, часто заканчивается вагинитом |
| Слизь | 2 | 2 | 2 | 2 | 2 | ||
| Эпителий | 1–2 | 3–4 | 4–5 | 4–5 | 10–12 | ||
| Лактобацилла | – | – | – | – | – | ||
| Фагоцитоз | – | – | – | – | – | ||
| Дегенеративно– и реактивно–измененные клетки | Незначительное количество Смешанная, кокковая и палочковая флора в большом количестве | ||||||
| Флора | |||||||
| Вульвовагинит | Лейкоциты | >15 | >15 | >15 | >15 | >15 | Клинический неспецифический вульвовагинит |
| СлизьЭпителий | 34–5 | 37–8 | 39–10 | 310–15 | 310–20 | ||
| Лактобацилла | – | – | – | – | – | ||
| Фагоцитоз | +++ | +++ | +++ | +++ | +++ | ||
| Дегенеративно– и реактивно–измененные клетки | Значительное количество | ||||||
| Смешанная, кокковая и палочковая флора в большом количестве | |||||||
| Флора | |||||||
| При обнаружении: | |||||||
| ■ гонококков; | Гонорея | ||||||
| ■ трихомонад; | Трихомониаз | ||||||
| ■ мицелия, псевдогифов и спор | Микотический вульвовагинит | ||||||
Промывание влагалища при помощи тонкого резинового катетера можно проводить растворами натрия хлорида (2%), а также вышеуказанными растворами не более 3–5 дней.
При наличии отека, гиперемии, расчесов, изъязвлений в области вульвы назначают обработку наружных половых органов мазями прополиса, каланхоэ, маслом облепихи или шиповника в течение 7–10 дней.
При отсутствии эффекта от лечения назначают местную антибактериальную терапию, которую проводят с учетом выделенной микрофлоры и ее чувствительности к антибиотикам. Антибактериальные препараты применяют в виде мазей, эмульсий, кремов или влагалищных палочек. Палочки и мазевые компоненты вводятся во влагалище на ночь после предварительной обработки наружных половых органов вышеуказанными способами. Хороший терапевтический эффект дает введение антибактериальных средств после промывания влагалища с помощью катетера 2% раствором натрия гидрокарбоната. Лечение применяют не более 5–7 дней, затем при необходимости производят смену антибактериального компонента.
При рецидивирующих, хронических вульвовагинитах возможно местное применение синтетических эстрогенов в виде присыпок, мазей, влагалищных палочек (сигетин, овестин) в течение 7–10 дней. Использование данных препаратов особенно показано девочкам, у которых в результате тяжелых вульвовагинитов развился слипчивый процесс в области малых половых губ или преддверия влагалища.
Вульвовагиниты специфической этиологии
Этиология
К развитию заболевания приводят гонококки, трихомонады, кандиды, вирусы (герпес, ВПЧ), хламидии, микоплазмы, гарднереллы.Факторы, способствующие заражению специфическими инфекциями: нечистоплотность, пользование общими предметами гигиенического ухода, близкий контакт с больными детьми или родителями, погрешности в асептике и антисептике со стороны ухаживающего персонала, изнасилование и/или извращенные действия со стороны больного взрослого.
Гонорейный вульвовагинит
У девочек значительно отличается от такового у взрослых по способу заражения, локализации и особенностям клинического течения, что обусловлено анатомо–физиологическими особенностями детского организма. Наиболее часто, по данным большинства авторов (К. А. Карышева, 1954; М.М. Райц, 1958; И.И. Богоров, 1960, Н.В. Кобозева и соавт., 1981) гонорея у девочек встречается в возрасте от 3 до 7 лет, т.е. в «нейтральном периоде».Путь заражения чаще всего бытовой (90%). Заражение в основном происходит от больной матери или других больных членов семьи, которые осуществляют уход за девочкой, при пользовании общими предметами гигиены, общей постелью, общей ванной, полотенцами, мочалками и т.д. Иногда инфицирование возможно еще во внутриутробном периоде или во время родов от больной матери. В препубертатном и пубертатном возрасте основное значение приобретает половой путь заражения, что весьма актуально в современном обществе.
Классификация
Выделяют гонорею свежую (острую, по–дострую, торпидную) и хроническую. Свежей называется гонорея, если длительность заболевания не превышает 2 месяцев, хронической – если заболевание протекает более двух месяцев.Клиническая картина
У девочек в отличие от взрослых женщин воспалительный процесс гонорейной этиологии локализуется в слизистой влагалища и вестибулярной части вульвы. При этом также поражается уретра, прямая кишка и шейка матки, т.е. для гонореи характерна многоочаговость.Клиническое течение зависит от характера и активности штамма возбудителя, реактивности организма и возраста девочки, локализации процесса и длительности заболевания.
В 60% случаев (К. А. Карышева, 1954) у девочек встречается острое течение заболевания, которое проявляется отеком и гиперемией наружных половых органов, гнойными выделениями из влагалища.
Основными жалобами являются зуд, а иногда и боли в области наружных половых органов, болезненное мочеиспускание, обильные гнойные выделения из половых путей.
При осмотре наружных половых органов выявляются отек и гиперемия в области малых половых губ, преддверия влагалища, клитора. Иногда отек и гиперемия распространяются на большие половые губы, промежность, внутреннюю поверхность бедер и перианальную область. Влагалищные бели представляют собой густое гнойное зеленовато–желтое отделяемое, которое, раздражая слизистую, способствует развитию фолликулярного вестибулита, локализуемому наиболее часто в области наружного отверстия мочеиспускательного канала.
При вагиноскопии наблюдается отечная и резко гиперемированная слизистая, иногда с поверхностными эрозиями, особенно в области сводов и влагалищной части шейки матки, возможно истечение гнойного отделяемого из цервикального канала, хотя данные литературы о частоте выявления эндоцервицита у девочек весьма разноречивы. По нашим данным, эндоцервицит встречается в «нейтральном» и препубертатном периодах редко, частота его значительно возрастает после появления менархе.
Бартолинит у девочек в «нейтральном возрасте» встречается редко.
При остром поражении мочеиспускательного канала мочеиспускание становится учащенным и болезненным, наблюдаются отек и гиперемия наружного отверстия уретры, выделение гноя.
Иногда гонорейный вульвовагинит сопровождается воспалением прямой кишки, при этом характерна болезненность при акте дефекации, тенезмы, отек, гиперемия и появление трещин и мацерации в перианальной области.
Торпидные формы гонореи у девочек встречаются в 40% случаев, хронические рецидивирующие – в 10% (К.А. Карышева, 1954).
Торпидные, вялотекущие и хронические гонорейные вульвовагиниты чаще встречаются у ослабленных девочек, часто и длительно болеющих острыми респираторными заболеваниями, страдающих анемией и истощением. Обострения заболевания провоцируются острыми инфекционными заболеваниями, переутомлением, переохлаждением и другими стрессовыми факторами. Клиническая картина скудная. Диагностика затруднена.
Диагностика
Диагноз гонореи ставится на основании опроса матери больной девочки, данных осмотра, результатов лабораторного исследования.При опросе матери больной девочки следует обратить внимание на начало заболевания и клиническую симптоматику: наличие белей и их характер, расстройство мочеиспускания и дефекации, зуд, беспокойное поведение ребенка, плохой сон, раздражительность. Необходимо выяснить также гинекологический анамнез матери, наличие у нее воспалительных заболеваний гениталий и их характер; бытовые и гигиенические условия дома и в детском коллективе, контакты с возможными источниками инфекции.
Объективное исследование включает общий осмотр, при этом особое внимание уделяют наличию конъюнктивита, ринита, стоматита. Очень редко у девочек бывают гонорейные полиартриты, описаны случаи эндокардитов, миокардитов и периоститов. При осмотре наружных половых органов обращают внимание на состояние слизистой малых половых губ, преддверия влагалища и наружного отверстия мочеиспускательного канала, характер отделяемого из влагалища и уретры; наличие гиперемии, отека, расчесов, трещин, изъязвлений в области больших половых губ, клитора, промежности, перианальной области и внутренней поверхности бедер. Обязательно проводится ректоабдоминальное исследование больной.
Для лабораторного выявления возбудителя берутся мазки и посев из уретры, влагалища и прямой кишки.
Мазки из каждого места берутся на 2 стекла для окраски метиленовым синим и по Граму. Посев проводится на асцитагар или другую питательную среду на 24–48 ч, после чего производится бактериоскопическое исследование полученных колоний с окраской по Граму. Обязательно исследуется чувствительность флоры к антибактериальным средствам.
При отрицательных результатах исследования, особенно в случаях подозрения на вялотекущую или хроническую формы гонореи, необходимо проведение провокационной пробы. В детской практике наиболее часто применяют комбинированный метод провокации: внутримышечно вводится 50–100 млн микробных тел (в зависимости от возраста) гоновакцины; во влагалище вводят раствор Люголя или 1% раствор серебра нитрата; в уретру глазной пипеткой вспрыскивают 0,25% раствор серебра нитрата; слизистую прямой кишки смазывают 2% раствором протаргола или делают микроклизму (2–5 мл) с 1–2% раствором серебра нитрата. Мазки берут из вышеуказанных источников через 24–48–72 ч после провокации. Посев с исследованием чувствительности микрофлоры к антибактериальным препаратам делают, как правило, через 48 ч. При проведении провокации следует очень тщательно изучить аллергоанамнез ребенка и учесть все противопоказания для введения гоновакцины. Для выявления источника заражения гонореей обязательно обследуются мать или другие близкие лица, осуществляющие уход за девочкой.
Лечение
Общие принципы этиопатогенетической терапии гонореи у детей такие же, как у взрослых (антибиотикотерапия и вакцинотерапия, местное лечение, витаминотерапия, десенсибилизирующая и общеукрепляющая терапия).В острой стадии свежей гонореи лечение начинают с применения антибактериальной терапии с учетом чувствительности гонококка. Наиболее часто назначают бензилпенициллин в дозе 2–3 млн ЕД на курс. Препарат вводится разовыми дозами по 50–200 ЕД (в зависимости от возраста) с интервалом в 4 ч круглосуточно. Для лечения гонореи у девочек–подростков курсовая доза бензилпенициллина увеличивается до 4,2–6,8 млн ЕД. Также возможно применение таких антибиотиков, как ампициллин, ампиокс, оксациллин, цефтриаксон, цефиксим или цефотаксим. Доказана эффективность применения прокаинпенициллина G, пробенецида, амоксициллина и спектиномицина, их дозы необходимо подбирать индивидуально с учетом возраста ребенка, лучше в расчете на площадь поверхности тела (Дж.Д. Нельсон, 1997). При непереносимости антибиотиков применяют сульфаниламиды пролонгированного действия.
Местное лечение в остром периоде включает: гигиенические процедуры, сидячие ванночки по 15–20 мин 2 раза в день с отварами трав (ромашки, шалфея, чистотела, череды). Влагалищные орошения применяют только после стихания острого процесса.
При подострой, торпидной и хронической формах гонореи лечение начинают с вакцинотерапии поливалентной гоновакциной, которую вводят внутримышечно или внутрикожно, начиная с 50–100 млн микробных тел (в зависимости от возраста и состояния здоровья ребенка). Каждая последующая доза повышается в 1,5–2 раза. Количество инъекций – 6–8–10 с интервалами в 2–3–4 дня (в зависимости от реакции организма девочки). Противопоказания для специфической иммунотерапии – возраст девочки до 3 лет, туберкулез, органические заболевания сердечно–сосудистой системы, заболевания печени, отягощенный аллергический анамнез, анемия.
После окончания иммунотерапии назначают антибиотики в комбинации с сульфаниламидами, причем их доза, как правило, в 1,5–2 раза выше, чем при лечении острой стадии гонореи. Часто лечение дополняется местным применением антибактериальной терапии в виде свечей с антибиотиками, мазей и орошений влагалища. Антибактериальная терапия обязательно дополняется общеукрепляющей, включающей полноценное питание, витамины В1 и В6, антиоксидантный комплекс, биогенные стимуляторы; десенсибилизирующую терапию.
При правильном комплексном лечении гонореи, адекватно подобранной антибактериальной терапии прогноз, как правило, благоприятный.
Критерии излеченности
В течение 3 месяцев устанавливается динамическое наблюдение за ребенком, проводятся анализ наличия жалоб, клиническое и лабораторное обследования.Бактериоскопическое и бактериологическое исследования проводят после комбинированной провокации дважды в течение 1–го месяца после завершения лечения и по одному разу в последующие два месяца. Критериями стойкой излеченности гонореи являются следующие: исчезновение клинических проявлений заболевания, отсутствие гонококков в отделяемом из влагалища, уретры и прямой кишки. В случае упорно рецидивирующей гонореи, а также при невыявленном источнике заражения девочка подлежит диспансерному наблюдению в течение 6 месяцев. Посещение детских коллективов (ясли, сад, школа) возобновляется после первого контрольного обследования.
Профилактика
Проводится индивидуальное и коллективное санитарное просвещение.Соблюдение санитарно–гигиенического режима в семье. Девочке необходимо иметь отдельную кровать, постельное белье, полотенца и предметы гигиенического ухода.
Все беременные женщины должны обследоваться для выявления гонореи.
Первичный туалет новорожденных детей должен включать профилактику гонобленнореи и вульвовагинита в виде обработки глаз и половой щели (у девочек) 30%раствором натрия сульфацила.
Все женщины с любыми проявлениями воспалительных процессов гениталий должны быть обследованы для выявления гонореи.
Ребенка следует обучить правилам гигиенического ухода за половыми органами.
Обязателен осмотр гинеколога при поступлении девочки в дошкольное учреждение или школу.
Обследование персонала детских учреждений на наличие гонореи проводится перед поступлением на работу и затем ежемесячно с занесением данных обследования в санитарную книжку.
В детских учреждениях должны быть индивидуальные предметы для туалета и гигиенических мероприятий.
Девочки, у которых выявлена гонорея, должны быть изолированы до полного излечения и допускаются в коллектив только после получения стойких критериев излеченности после первого контрольного обследования.
Трихомониаз
Является одним из наиболее распространенных заболеваний, передаваемых половым путем. Возбудитель – подвижное простейшее Trichomonas vaginalis. У девочек заболевание встречается относительно редко – в 4% случаев (Н.В. Кобозева, М.Н. Кузнецова, Ю.А. Гуркин, 1981).Заражение девочек, не живущих половой жизнью, происходит бытовым путем, при тесных контактах неполового характера от больных женщин при совместном пользовании загрязненными предметами гигиенического ухода, нижним бельем и при других грубых нарушениях гигиены. Новорожденные девочки могут инфицироваться от больной матери во время родов. У девушек старшего возраста возможно заражение половым путем и при манипуляциях membri ante portas, причем такой способ заражения возможет и у детей младшего возраста.
Клиническая картина
Заболевание носит многоочаговый характер (уретрит, вагинит, вестибулит, цистит).Характерные симптомы трихомонадного вульвовагинита у девочек – обильные, гноевидные, пенистые выделения зеленоватого цвета, с неприятным запахом; зуд и боли в области наружных половых органов; дизурия; беспокойное поведение больного ребенка, плаксивость, нарушение сна. При осмотре наружных половых органов и вагиноскопии отмечаются отек и гиперемия вульвы, преддверия влагалища, наружного отверстия мочеиспускательного канала, перианальной области; расчесы; специфические выделения из влагалища; явления вагинита. У девушек после наступления менархе наблюдается симптом «земляничной шейки матки».
Диагностика
В распознавании трихомониаза важную роль играет выяснение истории заболевания, его начала, длительности, частоты рецидивов, условий проживания девочки; соблюдения правил гигиены; а также гинекологического анамнеза матери. Осмотр наружных половых органов и вагиноскопия позволяют выявить явления вульвовагинита, характерные для данной инфекции.Основа диагностики – выявление подвижных трихомонад при микроскопии в нативном препарате влагалищных выделений, приготовленном на изотоническом растворе натрия хлорида, а также культуральные исследования и микроскопия мазков, окрашенных по Граму и Романовскому – Гимзе.
Лечение
Основные принципы лечения такие же, как и при неспецифических вульвовагинитах.Специфическое лечение проводится метронидазолом, ти–нидазолом, трихомонацидом, нитазолом, фуразолидоном, фурагином, фурадонином, тетрациклином, метациклином, доксициклином. Эффективность лечения повышается при применении местного лечения (мази, суппозитории, таблетки): клотримазол, «Клеон–Д», грамицидин, октилин.
Ребенок допускается в детский коллектив после 3–кратного (через день) бактериоскопического исследования.
Критерии излеченности: отсутствие трихомонад в исследуемом материале из разных очагов в течение трех месяцев.
Прогноз при адекватном лечении трихомониаза благоприятный.
Профилактика – санитарно–гигиеническое просвещение родителей, персонала детских учреждений, обучение правилам личной гигиены девочек.
Кандидамикоз – грибковое заболевание половых органов. Данная инфекция встречается до 25% случаев среди всех воспалительных процессов у детей и подростков. Наиболее часто поражается слизистая оболочка влагалища, вульвы и шейки матки. Возбудители заболевания – грибы рода Candida albicans.
Развитию кандидозной инфекции способствуют следующие факторы:
■ первичные и вторичные иммунодефициты ■ длительное применение антибиотиков, кортикостероидов, цитостатиков ■ кишечный дисбактериоз ■ эндокринные заболевания (сахарный диабет, гипотиреоз, гипопаратиреоз) ■ обменные нарушения (ожирение, дефицит микроэлементов, анемия).
Пути инфицирования различные, возможно попадание грибов из кишечника, экзогенных источников (больные, носители, предметы гигиены, белье), реже от полового партнера.
Классификация
Кандидоз у детей можно классифицировать следующим образом (Е.В. Пронина, 1996): ■ кандидозоносительство (поверхностное и глубокое) ■ поверхностный кандидоз (кожи и придатков, видимых слизистых оболочек, в частности вульвовагинит) ■ висцеральный кандидоз и системный кандидоз (ЦНС, сердечно–сосудистой системы, желудочно–кишечного тракта, костно–суставной системы, иммунной системы, мочевыделительной системы) ■ острый диссеминированный кандидоз ■ генерализованный кандидоз.Патогенез
Грибы рода Candida прикрепляются к слизистой оболочке, внедряются в эпителий, вызывая развитие воспалительной реакции. При проникновении кандид сквозь базальную мембрану развивается гематогенная диссеминация, которая способствует поражению органов и систем.Клиническая картина
Основные жалобы – сильный зуд в области вульвы, жжение, обильные бели. Дети ведут себя очень беспокойно, капризничают, плохо спят.При осмотре отмечаются гиперемия с четкими границами (часто малинового цвета) и отек вульвы. Пораженная слизистая оболочка блестяща, легкоранима, с налетами сероватобелого цвета, которые трудно снимаются. Выделения из половых путей жидкие, мутные с примесью «творожистых» включений и кислым запахом. При мист–инфекции поражается кожа промежности, бедер, перианальная область.
Хроническое течение инфекции носит рецидивирующий характер. Обострению способствуют интеркуррентные заболевания, менструации.
Диагностика
При типичной клинической картине диагностика кандидоза не представляет трудности. Однако стертые, хронические формы заболевания иногда довольно трудно распознаются.Учитывая, что кандидамикоз является, как правило, вторичным заболеванием, важно установить наличие у ребенка основной патологии: иммунодефицита, сахарного диабета, гипотиреоза и т.д.
Точный диагноз возможен только при обнаружении грибов с помощью бактериоскопических или бактериологических методов исследования. Микроскопически диагностируются только 1/3 всех случаев кандидамикоза. Материал для бактериоскопии берется металлической петлей с пораженных слизистых оболочек и наносится на предметное стекло. Исследуют препараты, неокрашенные и окрашенные по Граму, Романовскому – Гимзе или метиленовым синим. Применяют также культуральные исследования, путем посева материала на питательные среды (Сабуро, Гисса и др.) с последующей идентификацией грибов. Применяются также люминесцентная микроскопия и иммунодиагностика (серологические методы – ИФА с антигеном Candida и определение сывороточных иммуноглобулинов).
Лечение. Лечение состоит из общих и местных мероприятий, оно должно быть комплексным и основываться на принципах курсовой терапии. Для проведения адекватного лечения определяют степень тяжести и распространенности патологического процесса у больной. Девочкам назначают местное лечение при поверхностном поражении слизистой влагалища и вульвы. Местная терапия направлена на ощелачивание влагалищной среды с помощью спринцеваний через резиновый катетер 2–3%раствором натрия гидрокарбоната в течение 3–5 дней с последующим введением вагинального крема с бутоконазолом, клотримазолом, миконазолом, терконазолом, тиоконазолом или же применение влагалищных палочек с данными препаратами. Курс лечения – не менее 7 дней. Общая противогрибковая терапия проводится у детей при длительно текущих, рецидивирующих кандидамикозах с поражением других органов и систем. Эффективно применение амфотерицина В, амфоглюкамина, флуконазола. При этом разовая и курсовая дозы должны рассчитываться индивидуально для каждого ребенка (на 1 кг массы тела или 1 кв. м поверхности площади тела). Нистатин является препаратом выбора при кандидозоносительстве и поверхностном кандидозе.
Лечение проводят на фоне общеукрепляющей терапии (витаминнные, десенсибилизирующие и иммунокорригирующие препараты, адаптогены) и коррекции биоценоза как вагинального, так и общего (лактобактерин, бифидумбактерин, бификол, фемилак).
Клиническое течение, диагностика и лечение таких специфических инфекций, как герпетическая, хламидийная, урео– и микоплазменная, описаны в гл. 6.
Воспалительные заболевания внутренних половых органов
Воспалительные заболевания внутренних половых органов у детей допубертатного возраста встречаются крайне редко (до 2%). С появлением менструаций и особенно с началом половой жизни частота поражения внутренних гениталий значительно возрастает – от 10 до 27% соответственно.У девочек воспаление придатков матки в 23–30% случаях провоцируется перенесенным аппендицитом. По данным Н.В. Кобозевой и соавторов (1981), возрастные пики аппендицита и аднексита совпадают, они приходятся на 2–5–летний и 10–14–летний возрастные периоды.
Диагностика и лечение воспалительных заболеваний внутренних гениталий описаны в гл. 6.
Ювенильные маточные кровотечения
Ювенильные маточные кровотечения (ЮК) – дисфункциональные маточные кровотечения, связанные с нарушением гормонального гомеостаза в период становления менструальной функции.В структуре гинекологической заболеваемости девочек ювенильные кровотечения составляют от 2,5 до 38,2% (В.Ф. Коколина, 1997; Ю.А. Гуркин, 2000; И.Н. Гоготадзе, 2003; Ю.Ю. Чеботарева, Т. А. Яценко, 2003).
Высокая частота дисфункциональных маточных кровотечений в период полового созревания связана с особой чувствительностью всех звеньев регуляции функции репродуктивной системы (экстрагипоталамические церебральные структуры, гипоталамус, гипофиз, надпочечники, щитовидная железа, яичники) к различным неблагоприятным воздействиям вследствие ее незрелости.
Этиология и патогенез
К развитию патологии приводят следующие факторы. ■ Неблагоприятное течение перинатального периода (гестоз, фетоплацентарная недостаточность, хроническая гипоксия плода, угроза прерывания беременности эндокринного генеза, черепно–мозговая травма в родах и др.). ■ Наследственность со стороны матери (эндокринные, гинекологические и соматические заболевания). ■ Хронические и острые инфекционные заболевания в детстве (инфекционный паротит, вирусный гепатит, менингит, острая и хроническая тонзиллогенная инфекция, острые и хронические гнойно–воспалительные заболевания ЛОР–органов и т.д.). ■ Хронические соматические заболевания (хронические заболевания печени, желудка и кишечника, почек, системы крови, заболевания сердечно–сосудистой системы, вторичные иммунодефициты). ■ Нарушения функции эндокринных желез (сахарный диабет, гипер– и гипофункция щитовидной железы, нарушение питания, гиперпаратиреоз, гиперфункция коры надпочечников и др.), вторичное нарушение синтеза тропных гормонов. ■ Детские и актуальные психогении (неблагоприятный психологический климат в школе, плохая оценка, конфликт с близкими людьми, смерть родственника, переезд, физические и психогенные переутомления). ■ Алиментарные факторы (гиповитаминозы и дефицит микроэлементов, нерациональное питание, глистные инвазии, дисбактериозы и др.). ■ Экологические факторы (техногенное воздействие, радиация). ■ Дисфункции иммунной системы, в том числе сопровождающиеся развитием аутоиммунных заболеваний (поливалентная аллергия, бронхиальная астма, псориаз и др.).10. Врожденные соединительнотканные дисплазии (нефроптоз, пролапс митрального клапана, нарушение зрения, дискинезии желчевыводящих путей, ювенильный остеохондроз, гипермобильность суставов, повышенная растяжимость кожи, варикозное расширение вен, дополнительная хорда левого желудочка и др.).
В основе патогенеза ювенильных кровотечений, как указывают Ю.А. Гуркин и И.Н. Гоготадзе (2003), лежат нарушения нормального ритма секреции гипоталамических, гипофизарных и яичниковых гормонов на фоне несостоятельности нервнорецепторного аппарата различных звеньев репродуктивной системы в период ее возрастной функциональной незрелости.
Патогенетически дисфункциональные маточные кровотечения, согласно классификации К.Н. Жмакина (1976), подразделяются следующим образом. ■ Ановуляторные маточные кровотечения, обусловленные: • кратковременной персистенцией фолликула • длительной персистенцией зрелого фолликула • атрезией или персистенцией незрелого фолликула. ■ Овуляторные маточные кровотечения: • двухфазный укороченный цикл • гиполютеинизм • гиперлютеинизм.
Ювенильные кровотечения в большинстве случаев являются следствием ановуляции и возникают чаще на фоне нарушения созревания и персистенции или атрезии незрелых фолликулов и реже – на фоне персистенции зрелых фолликулов.
При персистенции или атрезии незрелых фолликулов возникает относительная длительная монотонная секреция эстрогенов, которая вызывает неравномерную гиперплазию эндометрия на фоне очаговой гипоплазии.
При персистенции зрелых фолликулов развивается состояние абсолютной гиперэстрогении, что способствует формированию выраженной гиперплазии эндометрия.
Кровотечение является следствием колебания уровня половых гормонов, приводящим к нарушению кровоснабжения слизистой матки, появлению очагов застойного полнокровия, ишемии, гипоксии, некроза и в результате – отторжению эндометрия (неравномерному). Эти явления усугубляются неадекватной реакцией нервно–рецепторного аппарата матки в силу его незрелости, низкой контрактильной активностью миометрия.
Клиническая картина
Ювенильными следует считать дисфункциональные маточные кровотечения, которые возникают у девушек: ■ не старше 18 лет ■ с гинекологическим возрастом не более 3 лет ■ не страдающих специфическими гинекологическими воспалительными заболеваниями (гонорея, туберкулез идр.) ■ не имевших абортов или родов.Истинные ЮК реже всего начинаются с первой менструации, чаще всего они проявляются через 6–18 месяцев после менархе.
Клиническая картина ЮК характеризуется длительными (более 7 дней), ациклическими (метроррагия) или циклическими (меноррагия) кровотечениями, которые могут быть обильными или скудными («кровомазание»), продолжительными кровотечениями с периодическими усилениями.
При циклических кровотечениях по типу меноррагии ювенильные кровотечения от нерегулярных менструаций отличаются хотя бы по одному из нижеперечисленных признаков: ■ ЮК продолжаются более 7 дней ■ повторяются чаще, чем через 24 дня ■ сопровождаются кровопотерей, превышающей объем нормальной менструации (80–120 мл).
Ювенильные кровотечения, возникающие на фоне длительной персистенции или атрезии незрелых фолликулов, появляются в основном после длительной (от 1,5 до 6 месяцев) задержки менструаций, в виде умеренных (реже – обильных или скудных) кровянистых выделений из половых путей, которые периодически уменьшаются вплоть до кровомазания и вновь усиливаются.
Для кровотечения на фоне персистенции зрелого фолликула характерна незначительная (до 2–8 недель) задержка менструаций и обильное кровотечение, быстро приводящее к анемизации.
Классификация
Для клиницистов наиболее приемлема классификация ювенильных кровотечений, предложенная Ю.А. Гуркиным и И.Н. Гоготадзе (2000), которые выделяют следующие клинические формы ЮК. ■ Неосложненная форма – кровотечение является основным клиническим симптомом (обычно продолжительность менее 10 дней). ■ Осложненная форма (продолжительность более 10 дней) сопровождается: • развитием постгеморрагической анемии, гипоксемии • развитием вторичного бактериального воспалительного процесса в матке • появлением вторичных нарушений в системе гемостаза: • тромбоцитопения потребления • изменение гемокоагуляции, фибринолиза, нарушение внутриматочного гемостаза • латентные и затяжные формы ДВС–синдрома. ■ Сочетанная форма – дисфункциональные маточные кровотечения: • при наличии исходных нарушений в системе гемостаза • при синдроме склерокистозных яичников • ятрогенный вариант ЮК как следствие неадекватной гормональной терапии.При неосложненном течении кровотечения безболезненны, общее состояние удовлетворительное, показатели гемодинамики (артериальное давление, пульс, цвет кожных покровов), а также общего, биохимических анализов крови и гемостазиограммы – в пределах нормы.
Диагностика
При осмотре необходимо обращать внимание на особенности морфотипа девочки (табл. 4.4), который у 83% больных отличается от нормативного стандарта (Ю.А. Гуркин, 2003; В.Ф. Коколина, 1997).У девочек младшего возраста (1–я фаза пубертата), страдающих ЮК, чаще бывает гиперэстрогенный морфотип, у девушек старших возрастных групп – гипоэстрогенный морфотип.
Оценка степени выраженности вторичных половых признаков и подсчет суммарного «балла полового развития» позволяет определить соответствие полового развития девушки возрастному периоду.
При гинекологическом осмотре обращают внимание на развитие наружных и внутренних половых органов, которое в большинстве случаев совпадает с морфотипом. Так, при гиперэстрогенном морфотипе наружные и внутренние половые органы развиты хорошо, а иногда даже опережают возрастную норму. При инфантилизме (гипоэстрогенный морфотип) отмечают наличие недоразвития больших и малых половых губ, гипоплазию матки.
На фоне обильного или длительного рецидивирующего кровотечения, как правило, развиваются осложнения, наиболее частыми из которых являются эндомиометрит и постгеморрагическая анемия.
Таблица 4.4. Женские фенотипы на основании физикальных и анамнестических данных (по Д. Шерегей, 1981; в модификации Ю.А. Гуркина, 2003)
| Перечень данных | Перевес эстрогенов | Уравновешенный тип | Перевес гестагенов и андрогенов | Недостаток эстрогенов |
|---|---|---|---|---|
| Внешний вид | Очень женственный | Женственный | Мальчишеский | Инфантильный |
| Рост | Низкий, средний | Средний | Средний, высокий | Низкий, высокий |
| Молочные железы | Большие | Средние, округлые | Маленькие, плоские | Неразвившиеся |
| Оволосение | По женскому типу | По женскому типу | По мужскому типу | Скудное, по женскому типу или отсутствует |
| Волосы | Сухие | Нормальные | Жирные | Истонченные |
| Кожа | Сухая | Бархатистая | Жирная (угри) | Тонкая, иногда «пергаментная» |
| Предменструальное настроение | Нервное, напряженное | Уравновешенное | Склонность к депрессии | Неустойчивое |
| Длительность менструального цикла | 28 дней и более | 28 дней | Менее 28 дней | Менее 28 дней или более 1–3 месяцев |
| Длительность менструации | 5 дней и более | 5 дней | 4 дня и менее | 2 дня и менее |
| Альгодисменорея | Есть | Нет | Нет | Может быть |
| Межменструальные кровянистые выделения | Нет | Редко | Нет | Есть |
| Выделения из влагалища | Усиленные | Умеренные | Минимальные | Минимальные, но могут быть патологические |
| Размеры матки | Увеличены | Нормальные, соответствуют возрасту | Уменьшены | Резко уменьшены |
| Либидо | Нормальное или усилено | Нормальное | Может быть усилено | Отсутствует или снижено |
| Голос | Глубокий, женственный | Женственный | Низкий, мутация | Высокий, бедный обертонами |
Анемия сопровождается ухудшением самочувствия девочки (головокружение, слабость, быстрая утомляемость) и показателей гемодинамики (бледность кожных покровов и видимых слизистых, снижение артериального давления, тахикардия). Общий анализ крови подтверждает наличие анемии и позволяет определить ее степень (гемоглобин – ниже 110 г/л, эритроциты – менее 3,0·1012/л, гематокрит – ниже 30%).
Исследование биохимических показателей крови и гемостазиограммы позволяет своевременно выявить вторичные нарушения в системе гемостаза, определить наиболее оптимальный метод остановки ювенильного кровотечения и профилактики ДВС–синдрома.
Изучение тестов функциональной диагностики (измерение базальной температуры, гормональная кольпоцитология) и определение уровней пептидных и стероидных гормонов в плазме периферической крови позволяют определить гормональный тип ЮК (гипоэстрогенный, нормоэстрогенный или гиперэстрогенный) и назначить наиболее адекватную гемостатическую терапию.
Диагностика ювенильных кровотечений основана на изучении жалоб, истории жизни и развития.
Общий осмотр обязательно включает определение состояние гемодинамики, оценку морфотипа и оценку степени полового и физического развития.
При гинекологическом осмотре определяют состояние и степень развития наружных и внутренних половых органов. Из вспомогательных инструментальных методов используют вагиноскопию и ультразвуковое исследование органов малого таза.
Обязательными лабораторными методами исследования являются клинический и биохимический анализы крови, коагулограмма.
Дополнительные методы исследования: ■ определение в плазме крови (при возможности и по показаниям) уровня фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), пролактина, прогестерона, эстрадиола, кортизола, тестостерона, трийодтиронина (Т3), тироксина (Т4), свободного Т4, тиреотропного гормона (ТТГ); антител к тиреопероксидазе (АТ–ТПО), 17–оксипрогестерона (17–ОНП), дегидроэпиандростерон (ДЭА) ■ УЗИ печени, надпочечников, щитовидной железы ■ рентгенография черепа с проекцией турецкого седла ■ ЭЭГ и РЭГ с консультацией невропатолога (определение общей и очаговой неврологической симптоматики) ■ КТ гипоталамо–гипофизарной области ■ консультация окулиста (глазное дно, цветные поля зрения) ■ консультация гематолога (развернутая гемостазиограмма) ■ консультация эндокринолога ■ определение костного возраста (рентгенография кистей рук).
Дифференциальный диагноз ЮК проводят с кровотечениями из матки и влагалища, обусловленными такими причинами, как: ■ первичные дефекты в системе гемостаза (тромбоцитопения, тромбастения, апластическая анемия, гемофилия–С, болезнь Виллебранда, геморрагические васкулиты) ■ органическая патология половых органов (аномалии развития, генитальный инфантилизм, генитальный эндометриоз, гормонопродуцирующие опухоли яичников, неоплазмы влагалища, шейки и тела матки) ■ специфические воспалительные заболевания гениталий (генитальный туберкулез, гонорея, кольпит вирусного или смешанного генеза) ■ травмы половой системы, в том числе при коитусе и мастурбации ■ прервавшаяся беременность ■ органические поражения ЦНС (опухоли гипофиза или гипоталамуса) ■ патология сочетанного генеза (функциональные нарушения гормонального гомеостаза при первичных дефектах гемостаза, специфические воспалительные заболевания половой системы).
Лечение
Лечение ювенильных маточных кровотечений должно быть комплексным и состоять из двух основных этапов: ■ остановки кровотечения ■ профилактики рецидивов кровотечения (нормализация функции гипоталамо–гипофизарно–яичниковой системы).В табл. 4.5 представлены основные принципы подбора терапии больным ювенильными кровотечениями и ее последовательность для каждой клинической формы (Ю.А. Гуркин, 2000).
Таблица 4.5. Основные принципы подбора терапии для больных ЮК и ее последовательность при каждой клинической форме
| Течение ЮК | Первый этап | Второй этап |
|---|---|---|
| Неосложненная форма | Негормональный гемостаз | Негормональная корригирующая терапия |
| Профилактика постгеморрагических коагулопатий | Гормональная корригирующая терапия | |
| При отсутствии эффекта | ||
| Гормональный гемостаз | ||
| Хирургический гемостаз | ||
| Осложненная форма: постгеморрагическая анемия | Гормональный гемостаз | Гормональная корригирующая терапия |
| Антианемическая терапия | Антианемическая терапия | |
| Профилактика постгеморрагических коагулопатий | ||
| При отсутствии эффекта | ||
| Хирургический гемостаз | ||
| Эндометрит | Негормональный гемостаз | Негормональная корригирующая терапия |
| Антибактериальная терапия, противовоспалительная, дезинтоксикационная терапия | Противовоспалительная терапия | |
| Профилактика вторичных приобретенных коагулопатий | Иммуномодулирующая терапия | |
| Иммунокорригирующая терапия | Гормональная корригирующая терапия | |
| При отсутствии эффекта | ||
| Гормональный гемостаз | ||
| Хирургический гемостаз (осторожно – под прикрытием антибактериальной терапии) | ||
| ДВС–синдром | Негормональный гемостаз | Негормональная корригирующая терапия |
| Лечение ДВС–синдрома | Антианемическая терапия | |
| При отсутствии эффекта | Гормональная корригирующая терапия | |
| Гормональный гемостаз | ||
| Хирургический гемостаз | ||
| Сочетанные формы | Гормональный гемостаз, лечение первичных нарушений в системе гемостаза | Гормональная корригирующая терапия |
| Антианемическая терапия | Лечение первичных заболеваний крови | |
| При отсутствии эффекта. Хирургический гемостаз | Антианемическая терапия |
Расчет предполагаемого дня менструального цикла проводится по формуле О.В. Осадчей и О.В. Лысенко (2003):
365·n+П1+П2
где 365 – число дней в году; n – возраст больной (в годах); П1 – дополнительные дни, прожитые в високосные годы; П2 – количество дней, прожитых после последнего дня рождения; С – продолжительность менструального цикла.
I этап – стационарное лечение.
Лечение необходимо всегда начинать с создания лечебноохранительного режима – устранение физических и психических нагрузок, полноценное, сбалансированное питание, 8–10–часовой сон. Психотерапия, назначение седативных препаратов (настойка или настой корня валерианы, пустырника, пиона, препараты брома), при выраженных психоэмоциональных нарушениях назначают небольшие дозы транквилизаторов (реланиум, тазепам и другие препараты по 1 таблетке 1–2 раза в день).Негормональная гемостатическая терапия. Негормональный гемостаз как самостоятельная терапия показан больным с ЮК при длительности кровотечения не более 10 дней, отсутствии анемии, эхографической толщине эндометрия не более 8–10 мм, величине индекса ЛГ/ФСГ 0,6–1, концентрации про–лактина не более 400 ммЕ/л.
При положительном эффекте проводится в течение 3–7 дней и включает: ■ утеротонические препараты (эрготал, эрготамин, эргометрина малеат, котарнина хлорид по 1 таблетке 3 раза в сутки внутрь или окситоцин, гифотоцин, питуитрин по 0,5–1 мл 4 раза в сутки внутримышечно) ■ препараты, повышающие контрактильную активность миометрия (10% раствор кальция хлорида по 10 мл внутривенно медленно или по 1 столовой ложке 3 раза в сутки; 1% раствор АТФ по 1 мл 1 раз в день внутримышечно; кокарбоксилазу по 50–100 мг 1 раз в день внутримышечно; мексамин – по 50 мг 3 раза в день внутрь) ■ физиотерапевтическое лечение (электрофорез кальция эндоназальный или на воротниковую зону, электростимуляция шейки матки, электро–, вибромассаж сосков, диатермия солнечного сплетения) ■ рефлексотерапия (электро–, лазеро–, магнитопунктура, иглотерапия) ■ препараты, стимулирующие коагуляционный потенциал крови (дицинон или натрия этамзилат по 2,0 мл внутримышечно 1–2 раза в день или по 1–2 таблетке 2–3 раза в день внутрь; 0,025% раствор андроксона по 1 мл внутримышечно или внутривенно 1–2 раза в сутки; 5%раствор аминокапроновой кислоты по 20 мл внутрь 3–5–раз в сутки, ПАМБА по 1 таблетке 3 раза в сутки, диклофенак по 1 свече ректально 1–2 раза в сутки или по 50 мг 2–3 раза в сутки внутрь) ■ витаминотерапия (аскорбиновая кислота по 0,1 г 3 раза в сутки внутрь или 5% раствор по 3–5 мл внутримышечно или внутривенно 1 раз в сутки; рутин либо аскорутин по 1 таблетке 3 раза в сутки, витамин Е по 100–200 мг/сут; витамин В1 по 2–5 мг/сут, витамин В6 по 2 мг/сут, витамин В12 по 100 мг внутримышечно в сутки не более 5–7 дней, витамин К – викасол по 1,0 внутримышечно или по 1 таблетке 3 раза в сутки не более 3 дней) ■ фитотерапия (лагохилус, крапива, арника горная, пастушья сумка, тысячелистник, кровохлебка, полевой хвощ, змеиный горец, земляника лесная, лапчатка прямостоячая, кора калины, водяной перец, кошачьи лапки, кукурузные рыльца и др.). Существуют готовые кровоостанавливающие сборы.
Негормональная гемостатическая терапия проводится в течение 3–5 дней при наличии эффекта (уменьшение кровотечения) и продолжается до 7 дней при хорошем гемостатическом эффекте (остановка кровотечения). При отсутствии клинического эффекта в течение 3 дней или продолжающихся даже в виде кровомазания кровянистых выделениях в течение 7 дней показаны другие виды гемостаза.
Гормональная гемостатическая терапия. Показания для гормонального гемостаза: ■ профузное кровотечение, угрожающее жизни и здоровью девочки ■ отсутствие клинического эффекта от симптоматической терапии: в течение 12 ч при обильном кровотечении и наличии анемии (снижение гемоглобина до 100–90 г/л, гематокрита до 30–25%) ■ в течение 2–3 дней умеренные и длительные кровотечения и наличие анемии (снижение гемоглобина до 100–90 г/л, гематокрита – до 30–25%) ■ в течение 6–7 дней скудное кровотечение и наличие легкой анемии или даже ее отсутствие ■ наличие бактериального эндометрита ■ сочетанные формы ЮК (при заболеваниях системы гемостаза) ■ подозрение на достаточно выраженную гиперплазию эндометрия (по данным УЗИ более 10 мм) ■ наличие в яичниках жидкостных включений диаметром больше 15 мм (по данным УЗИ) ■ наличие выраженных поликистозных изменений яичников ■ УЗИ (размеры яичников больше 35*20 мм с множеством фолликулов диаметром 7–8 мм и больше) ■ неблагоприятный прогностический индекс ЛГ/ФСГ (менее 0,5 и более 1).
Препаратами выбора гормональной гемостатической терапии являются комбинированные эстроген–гестагенные монофазные низкодозированные контрацептивы.
Гемостаз комбинированными эстроген–гестагенными препаратами: ■ ригевидон, регулон, марвелон, минизистон, микрогинон, нордетте по 1 таблетке через 1–1,5–2–3 ч под язык до остановки кровотечения, но не более 6 таблеток назначаются девушкам всех фенотипов ■ при обильном кровотечении и нарастающей анемизации, особенно у девушек гипоэстрогенного фенотипа, могут быть использованы высокодозированные препараты – овидон, овулен, линдинол или ноновлон по 1 таблетке через 1–1,5–2–3 ч под язык до остановки кровотечения, но не более 4 таблеток.
После достижения гемостаза доза всех гормональных препаратов снижается не более чем на 1/3 в сутки, т.е. в последующие дни дозу снижают на 1 таблетку ежедневно, доведя до 1 таблетки, сохраняя ее до окончания курса лечения. Общая продолжительность терапии – 21 день (считать с 1–го дня гемостаза).
Эстрогеный гемостаз может быть рекомендован только при выраженной гипоэстрогении и отсутствии гиперпластических изменений в эндометрии (по данным УЗИ эндометрий – не более 6 мм).
Наиболее распространенная схема эстрогенного гемостаза: микрофоллин форте по 1/2 таблетки (0,025 мг) через 1 ч до гемостаза, но не более 2 таблеток (суточная доза 0,1 мг), снижая дозу по 1/2 таблетки в день. Продолжительность приема микрофоллина по 1/2 таблетки (0,025 мг) в течение 10–15 дней, за 3 дня до отмены эстрогенов назначают дюфастон по 20 мг (2 таблетки) в сутки в течение 10 дней.
Гестагенный гемостаз не рекомендуется для остановки ювенильных кровотечений. В редких случаях возможно его применение при выраженных гиперпластических процессах в эндометрии (по данным УЗИ эндометрий – более 10 мм) и скудных кровянистых выделениях. При обильных и даже умеренных кровотечениях гестагены противопоказаны. Назначают дюфастон по 10 мг/сут или норколут по 5–10 мг/сут. Продолжительность курса лечения – 6–10 дней. Курсовая доза – 50–100 мг.
Противопоказания для гормонального гемостаза: ■ наличие гиперкоагуляции по данным коагулограммы ■ тяжелые заболевания печени – острый или хронический персистирующий гепатит или цирроз печени.
При болезни Жильбера, идиопатической гиперхолестеринемии, дискинезии желчевыводящих путей гормональный гемостаз назначается с осторожностью (следует еще раз проанализировать все показания и противопоказания для его назначения) в сочетании с гепатопротекторами (эссенциале, гепатил), желчегонными средствами и препаратами, снижающими уровень холестерина (липостабил, мевакор, лескол и др.).
Хирургический гемостаз. Иногда при ювенильных кровотечениях приходится прибегать к хирургическому гемостазу – выскабливанию эндометрия. Решение о необходимости данного метода лечения принимает консилиум врачей с письменного согласия близких родственников девочки.
Показания к раздельному лечебно–диагностическому выскабливанию слизистой матки и цервикального канала: ■ профузные ювенильные кровотечения, угрожающие жизни и здоровью, с выраженной анемизацией (снижение гемоглобина до 70 г/л, гематокрита до 25% и ниже) ■ рецидивирующие кровотечения при отсутствии эффекта от симптоматической и гормональной терапии ■ подозрение на наличие органической патологии эндометрия или матки (эхографическая толщина эндометрия – более 16 мм, неоднородность структуры эндометрия – подозрение на полипы, аденоматоз эндометрия).
Лечебно–диагностическое выскабливание производят только в условиях стационара под внутривенным обезболиванием, в асептических условиях, маленькой кюреткой, под контролем (по возможности) гистероксопа. Во избежание дефлорации предварительно обкалывают девственную плеву лидазой и новокаином (64 ед. лидазы и 5 мл 0,25% раствора новокаина). Производится раздельное бережное выскабливание слизистой матки и цервикального канала с последующим гистологическим исследованием соскоба.
Вакуум–аспирацию не использовать!
Контрольное диагностическое выскабливание после корригирующей гормональной терапии в течение 3 курсов на 24– 26–й день цикла производится только при наличии аденоматоза, аденоматозных полипов или атипической гиперплазии.
Лечение осложнений ювенильных кровотечений. Антианемическая терапия зависит от степени анемизации больных с ЮК.
При легкой анемии (гемоглобин не менее 100 г/л, количество эритроцитов – не менее 3 млн): тотема по 1 ампуле 1–4 раза в день, мальтофер по 1 таблетке 1 раз в день, сорбифер по 1 таблетке 1 раз в день, феррум–лек по 1 таблетке 2–3 раза в день и др.), витаминотерапия.
При анемии средней степени тяжести (кровопотеря до 15%, гемоглобин – 90–70 г/л) гемотрансфузия не проводится, переливается криоплазма в дозе 5 мл/кг массы тела в сутки, 5–20% растворы альбумина в дозе 100–400 мл/сутки, для полного восстановления ОЦК переливают коллоидные и кристаллоидные растворы (реополиглюкин, реоглюсоль, ронферрин, желатиноль, полиоксидин, мафусол, раствор Рингера – Локка, лактосол, 5%раствор глюкозы).
При анемии тяжелой степени (кровопотеря 15% и более, гемоглобин ниже 70 г/л, гематокрит менее 38%) производится гемотрансфузия эритроцитарной массы, эритровзвеси в сочетании с препаратами крови (криоплазма, альбумин, протеин).
Противовоспалительная терапия назначается при осложнении ювенильного кровотечения воспалительными изменениями в половой системе: ■ антибактериальная (метронидазол по 0,25 г 3–4 раза в сутки в течение 7–10 дней или метрогил по 100 мл внутривенно 1–2 раза в сутки в течение 3–5 дней и доксициклин по 1 капсуле 2 раза в сутки в течение 5–7 дней или макролиды внутримышечно или внутривенно в зависимости от состояния больной и степени распространенности воспалительного процесса) ■ дезинтоксикационная и противовоспалительная терапия (30% раствор натрия тиосульфата по 10 мл 1 раз в сутки внутривенно, реополиглюкин – по 200–400 мл внутривенно капельно, 5–10% раствора глюкозы по 200–400 мл внутривенно капельно с инсулином 1 ЕД на 5 г сухой глюкозы, 5–20% растворы альбумина в дозе 100–400 мл/сут и др.).
Профилактика вторичных (постгеморрагических) коагулопатий: назначаются только при отсутствии кровотечения антиагреганты – витамин Е по 100 мг/сут, ацетилсалициловая кислота по 0,2–0,35 г/сут, индометацин – по 0,25 мг/сут и препараты, улучшающие микроциркуляцию, – трентал по 100 мг 1–2 раза в сутки.
При ЮК в сочетании с болезнью Виллебранда назначают антигемофильную плазму или криопреципитат в дозе 15 ЕД/ кг массы тела 1 раз в 1–2 дня, аминокапроновую кислоту в дозе 0,2 г/кг массы тела в сутки. Данные препараты не рекомендуется применять с комбинированными эстроген–гестагенными препаратами.
При ЮК в сочетании с тромбастенией назначают аминокапроновую кислоту по 0,2 г/кг массы тела в сутки – до 6 приемов, витамины С, А, Р (противопоказан витамин В6), фитотерапию, 1% раствор АТФ по 2,0 мл внутримышечно в сочетании с магния тиосульфатом по 0,5 г 3 раза в день, дицинон – по 2,0 внутримышечно 1–2 раза в сутки или по 1–2 таблетке 2–3 раза в сутки. Гемотрансфузии и переливания плазмы неэффективны.
Факторы, обусловливающие развитие ДВС–синдрома у больных ЮК: ■ обильное кровотечение и геморрагический шок ■ массивные гемотрансфузии ■ инфекционные воспалительные изменения в половых органах ■ иммунные нарушения ■ лечение препаратами, вызывающими агрегацию тромбоцитов, повышающими свертываемость крови и снижающими ее противосвертывающий и фибринолитический потенциал, особенно при их комбинированном применении.
Крайне редко, когда все известные методы гемостаза оказываются безрезультатны, с целью сохранения жизни больной приходится прибегать к гистерэктомии. Абсолютные показания к этому методу хирургического лечения определяют только на консилиуме высококвалифицированных специалистов.
II этап – амбулаторное лечение
Нормализацию функции гипоталамо–гипофизарно–яичниковой системы проводят негормональными средствами: ■ соблюдение режима труда и отдыха, ликвидация отрицательных эмоций, сбалансированное питание, создание физического и психического покоя ■ седативная терапия (настой или настойка корня валерианы, пиона, препараты брома), курс лечения 1–1,5 месяца ■ витаминотерапия в циклическом режиме: ■ с 5–го по 14–й день цикла: фолиевая кислота по 0,001 г 3 раза в день, глютаминовая кислота по 0,25 г 3 раза в день, 5%раствор витамина В6 1,0 мг внутрь натощак 1 раз в день ■ с 16–го по 25–й день цикла: аскорбиновая кислота по 0,5 г 3 раза в день, витамин Е по 0,1 г 1 раз в день 5% раствор витамина В1 1,0 мг внутрь 1 раз в день ■ ноотропные препараты принимают в течение 1,5–2 месяцев (ноотропил по 0,2–0,4 г 2–3 раза в сутки, пикамилон по 0,02–0,05 г 3 раза в сутки, пантогам по 0,25–0,5 г 3 раза в сутки, глицин по 1 таблетке 2–3 раза в сутки) ■ препараты, улучшающие микроциркуляцию, принимают в течение 1–1,5 месяца (кавинтон по 5 мг 3 раза в сутки, стугерон по 25 мг 2 раза) ■ физиотерапия (электрофорез на область шейных симпатических ганглиев с бромом и новокаином № 10 или электрофорез интраназально с кальцием или витамином В1 № 10) ■ рефлексотерапия 2–3 курса по 10 сеансов (игло–, лазеро–, магнито–, электротерапия на точки акупунктуры) ■ дегидратационная терапия ■ иммуномодулирующая терапия ■ антианемическая терапия.Корригирующая гормональная терапия. Препараты выбора – комбинированные эстроген–гестагенные низкодозированные монофазные или трехфазные оральные контрацептивы (ОК) или комбинированные эстроген–гестагенные препараты для заместительной гормональной терапии (ЗГТ): ■ низкодозированные монофазные ОК: ригевидон, регулон микрогинон, марвелон, минизистон, минулет, нордетте, фемоден, жанин; ■ трехфазные ОК: три–регол, триквилар, тризистон, тримерси; ■ комбинированные эстроген–гестагенные препараты: фемостон, климонорм.
Гормональные контрацептивы и препараты для ЗГТ назначаются на II этапе лечения ювенильных кровотечений по контрацептивной схеме. Проводится 2–4 курса терапии. Только при аденоматозе, аденоматозных полипах назначаются 6 курсов корригирующей гормональной терапии.
Микродозированные монофазные ОК (новинет, линдинет 20, логест и др.) назначают редко, только девушкам, живущим половой жизнью, «гиперэстрогенного» фенотипа, с избыточным питанием, «менструальный» возраст которых не менее 2 лет.
При абсолютной гиперэстрогении (эхографическая толщина эндометрия после псевдоменструации более 10 мм) назначают только чистые гестагены во 2–ю фазу менструального цикла. Используют норколут по 1–2 таблетке (5–10 мг) или дюфастон (10 мг) 1 раз в день с 16–го по 25–й день от начала менструальноподобной реакции или утрожестан по 1 капсуле (100 мг) 2 раза в день. Проводится 2–3 курса терапии.
Больным с выраженной гипоэстрогенией, особенно при «менструальном» возрасте менее 2 лет, на фоне гипоэстрогенной атрезии на ранних стадиях созревания фолликулов назначают циклическую гормональную терапию, так как применение у них 2–4 курсов гормональной коррекции комбинированными эстроген–гестагенными препаратами может вызвать развитие синдрома гиперторможения.
Циклическая терапия начинается с чистых эстрогенов в 1–ю фазу создаваемого цикла. Назначают: микрофоллин форте по 1/2–1 таблетке (0,025–0,05 мг) в сутки внутрь или фолликулин по 5000–10.000 ЕД в сутки внутримышечно с 5 по 15–18–й день цикла.
Для создания 2–й фазы цикла назначают чистые гестагены: дюфастон по 1 таблетке (10 мг) 1 раз в сутки внутрь с 16–го по 25–й день цикла, норколут по 1 таблетке (5 мг) 1 раз в сутки внутрь с 16–го по 25–й день цикла, 1%раствор прогестерона по 1 мл внутримышечно 1 раз в день с 18–го по 25–й день цикла.
По данным В.Ф. Коколиной (1997), ранняя и своевременная патогенетически обоснованная терапия ювенильных маточных кровотечений у девочек–подростков способствует сохранению репродуктивной функции в дальнейшем у 93% пациенток.
Глава 5. Гинекологическая эндокринология
Нейрогуморальная регуляция репродуктивной системы
Репродукция, или воспроизводство, является важнейшей функцией женского организма. Репродуктивная система представлена внерепродуктивными органами (структуры ЦНС: аркуатные ядра гипоталамуса, гонадотрофы гипофиза) и репродуктивными органами (яичники и органы–мишени: матка, маточные трубы, влагалище). Эти структурные элементы системы связаны между собой информационными сигналами, позволяющими ей функционировать как единое целое. Система начинает активно функционировать в период половой зрелости, или репродуктивный период, который длится с 16–17 лет до 45 лет. В репродуктивной системе выделяют 5 уровней: I уровень – ткани–мишени, II – яичники, III – аденогипофиз, IV – гипоталамус и V –экстрагипоталамические церебральные структуры и кора головного мозга (рис. 5.1). Первый уровень репродуктивной системы – ткани–мишени – точки приложения действия половых стероидных гормонов. К ним относятся половые органы, молочные железы, волосяные фолликулы, кожа, кости, жировая ткань. Свободная молекула стероидного гормона проникает через клеточную мембрану, затем в ядро клетки и соединяется с белковым рецептором. Далее происходит взаимодействие комплекса гормон–рецептор с ядерной ДНК, синтез мРНК, транспорт мРНК в рибосомы и синтез специфического белка в цитоплазме клетки (рис. 5.2). Рецепторы обладают специфичностью к эстрадиолу, прогестерону, тестостерону. При действии стероидных гормонов на клетки–мишени происходит снижение числа рецепторов. Уменьшение содержания рецепторов стимулирует их новый синтез. Стероиды регулируют не только концентрацию своих собственных рецепторов: эстрогены стимулируют рецепторы прогестерона, а прогестерон, как правило, понижает концентрацию рецепторов эстрогенов в репродуктивном тракте.Основной тканью–мишенью для половых стероидов является эндометрий. Содержание рецепторов эстрогенов и прогестерона в нем изменяется в зависимости от фазы цикла. Концентрация рецепторов эстрадиола (Е2) достигает пика в предовуляторном периоде и соответствует выбросу Е2 в периферический кровоток, что ведет к усилению клеточного деления и увеличению массы эндометрия. Одновременно под влиянием Е2 возрастает концентрация рецепторов прогестерона. После овуляции происходит снижение уровня Е2–рецепторов в цитоплазме в ответ на повышение концентрации прогестерона. В лютеиновую фазу прогестерон, концентрация которого увеличивается, тормозит синтез своих собственных рецепторов.
 Рис. 5.1. Уровни регуляции (I–V) репродуктивной системы. Нейтротрансмиттеры (дофамин, норадреналин, серотонин; опиоидные пептиды; β–эндорфины, энкефалин); Ок – окситоцин; П – прогестерон; Э – эстрогены; А – андрогены; Р – релаксин; И – ингбин
Рис. 5.1. Уровни регуляции (I–V) репродуктивной системы. Нейтротрансмиттеры (дофамин, норадреналин, серотонин; опиоидные пептиды; β–эндорфины, энкефалин); Ок – окситоцин; П – прогестерон; Э – эстрогены; А – андрогены; Р – релаксин; И – ингбин
 Рис. 5.2. Механизм взаимодействия стероидного гормона и клетки–мишени
Рис. 5.2. Механизм взаимодействия стероидного гормона и клетки–мишени
Рецепторы половых стероидных гормонов имеются в ЦНС. Они локализуются в перивентрикулярной области гипоталамуса, включая аркуатное ядро, и в передней доле гипофиза. Взаимодействуя с этими рецепторами, эстрадиол оказывает модулирующее действие на секрецию гонадолиберина и гонадотропных гормонов, осуществляя обратную связь.
Второй уровень репродуктивной системы – яичники. Здесь происходят процессы фолликулогенеза и синтеза стероидных гормонов.
Основная морфофункциональная единица яичника – фолликулярный комплекс. Ключевым элементом комплекса является овоцит. Предшественники овоцитов – овогонии, возникают из примордиальных герминативных клеток. Между 8–й и 13–й неделями внутриутробного развития овогонии превращаются в первичные овоциты.
У плода первичный овоцит окружен одним слоем веретенообразных клеток, являющихся предшественниками гранулезных. Они отделены от окружающей стромы базальной мембраной. Этот комплекс овоцита, окруженного клетками и базальной мембраной, называется примордиальным фолликулом (рис. 5.3). На 5–6–м месяце беременности веретенообразные клетки превращаются в кубовидные, которые начинают делиться и превращаются в гранулезные. Гранулезные клетки продуцируют мукополисахариды, окружающие овоцит прозрачной оболочкой (zona pellucida). Через нее проникают отростки гранулезных клеток к плазматической мембране овоцита, обеспечивая его информацией и питательными веществами (первичный фолликул). Когда слой фолликулярного эпителия, окружающего овоцит, утолщается до 8–10 рядов клеток, формируется вторичный (преантральный) фолликул. Веретенообразные клетки стромы, окружающие фолликул, превращаются в тека–клетки.
Когда размер первичного фолликула достигает 100–200 мкм, среди гранулезных клеток появляются скопления жидкости и образуется третичный фолликул. Постепенно скопления жидкости сливаются и образуют полость фолликула (antrum), после формирования которой фолликул превращается в зрелый (полостной, или граафов фолликул). В полостном (антральном) фолликуле происходит дальнейшее нарастание числа рядов фолликулярного эпителия, образующего гранулезную оболочку. Текальная оболочка делится на наружную и внутреннюю. Овоцит, окруженный 2–3 слоями гранулезных клеток в виде лучистого венца, отодвигается к периферии фолликула, образуя яйценосный бугорок. Клетки бугорка контактируют с гранулезными клетками, окружающими полость фолликула.
 Рис. 5.3 Этапы развития фолликула: а – примордиальный фолликул; б – преантральный фолликул; в – антральный фолликул; г – преовуляторный фолликул; 1 – ооцит; 2 – клетки гранулезы; 3 – тека–клетки; 4 – базальная мембрана
Рис. 5.3 Этапы развития фолликула: а – примордиальный фолликул; б – преантральный фолликул; в – антральный фолликул; г – преовуляторный фолликул; 1 – ооцит; 2 – клетки гранулезы; 3 – тека–клетки; 4 – базальная мембрана
Рост неактивных примордиальных фолликулов до ранней предполостной стадии не зависит от действия гонадотропинов, но дальнейший их рост и развитие контролируются ФСГ и ЛГ. До менархе не происходит полного созревания фолликулов: не достигнув предовуляторной стадии, они подвергаются атрезии. Если при рождении девочки в яичниках имеется 2–4 млн примордиальных фолликулов, то к менархе остается около 200– 400 тысяч, а за весь репродуктивный период женщины овулирует только 400–500 фолликулов. С наступлением менархе в яичниках начинаются циклические изменения (яичниковый цикл).
Фолликулогенез (развитие фолликулов) условно включает рост и дифференцировку примордиальных фолликулов до преантральных (около 120 дней), базальный рост преантральных фолликулов до стадии малых антральных диаметром 1–2 мм (около 65 дней), выбор когорты (группы) малых антральных фолликулов, их рост, селекцию и созревание доминантного фолликула (около 20 дней). Таким образом, фолликулогенез не ограничивается одним яичниковым циклом и в среднем занимает от 85 до 200 дней.
Яичниковый цикл состоит из трех фаз: фолликулярной, овуляции и лютеиновой.
В фолликулярную фазу рост фолликулов и синтез в них гормонов происходят при координированном действии гонадотропинов и местных яичниковых факторов (рис. 5.4). На фоне регресса желтого тела, примерно за 1 день до менструации, в ответ на спад гормонов повышается уровень ФСГ. Это является стимулом для рекрутирования группы растущих фолликулов. В раннюю фолликулярную фазу (1–4–й день цикла) ФСГ стимулирует рост группы малых антральных фолликулов, повышает активность ароматаз в гранулезных клетках, что ведет к увеличению продукции эстрогенов и ингибина. Эстрогены повышают чувствительность клеток гранулезы к ФСГ. К середине фолликулярной фазы (5–7–й дни) из группы растущих фолликулов происходит отбор доминантного фолликула, предназначенного к овуляции. Доминантным становится фолликул наибольшего диаметра, с наибольшим числом клеток гранулезы и рецепторов ФСГ.
В позднюю фолликулярную фазу (8–12–й дни) подъем уровня эстрогенов, образующихся в доминантном фолликуле, приводит к подавлению секреции ФСГ по механизму обратной связи. Это ведет к торможению роста и атрезии остальных фолликулов. Механизм атрезии, по–видимому, связан с апоптозом.
 Рис. 5.4. Развитие овулирующего (доминантного) фолликула
Рис. 5.4. Развитие овулирующего (доминантного) фолликула
Рост доминантного фолликула и способность его синтезировать эстрогены в условиях снижения уровня ФСГ сохраняются благодаря переходу с ФСГ–зависимого на ЛГ– и ФСГ–зависимый рост и включению местных яичниковых регуляторных механизмов: аутокринного (стимуляция эстрогенами синтеза собственных рецепторов) и паракринного (увеличение количества гранулезных клеток и, тем самым, числа рецепторов ФСГ вследствие прямого митогенного действия эстрогенов). Таким образом, ФСГ и эстрогены, действуя синергично, стимулируют рост доминантного фолликула.
В доминантном фолликуле к 9–му дню цикла резко увеличивается васкуляризация тека–клеток. Это обеспечивает усиленное поступление в доминантный фолликул гонадотропинов и липопротеинов низкой плотности (ЛПНП), необходимых для синтеза половых стероидов. Кроме того, в предовуляторный период ФСГ и эстрогены стимулируют образование рецепторов ЛГ в гранулезных клетках. С этого момента начинается процесс их лютеинизации и переключение стероидогенеза с эстрогенов на прогестины. Эти процессы происходят в предовуляторном фолликуле непосредственно до и в течение всего периода (48 ч) овуляторного выброса гонадотропинов. Овуляторный пик секреции ЛГ и ФСГ по времени связан с пиком секреции эстрогенов и быстрым увеличением уровня прогестерона.
Когда диаметр предовуляторного фолликула достигает 20– 21 мм, в фолликулярной жидкости, объем которой увеличивается в 100 раз, нарастает осмотическое давление за счет деполимеризации полисахаридов. Клетки в области лучистого венца разрыхляются, увеличиваются межклеточные пространства. На вершине предовуляторного фолликула формируется небольшая бессосудистая зона–стигма. Стенка в этой зоне представлена одним рядом клеток гранулезы, которые прилежатнепосредственно к поверхностному эпителию яичника. Здесь происходит разрыв фолликула во время овуляции. В предовуляторном фолликуле возобновляется мейоз, необходимый для созревания овоцита.
Под влиянием окситоцина, простагландинов, стимуляции α–адренорецепторов и холинергических рецепторов, а также коллагеназы и плазмина увеличивается растяжимость оболочки яичника. Вслед за разрывом стигмы происходит овуляция – выход овоцита вместе с клетками яйценосного бугорка и фолликулярной жидкостью в брюшную полость. Овуляция происходит через 12 ч после пика ЛГ или через 24–36 ч после пика эстрадиола (Е2). После овуляции на месте фолликула образуется желтое тело, которое в своем развитии проходит стадии пролиферации, васкуляризации, расцвета и регресса. На стадии пролиферации продолжается размножение и лютеинизация клеток гранулезы, происходит лютеинизация клеток внутренней теки. На стадии васкуляризации в гранулезолютеиновую ткань врастают тонкостенные кровеносные сосуды из внутренней теки и продвигаются в направлении центральной полости желтого тела, обычно содержащей сгусток крови (центральное ядро желтого тела). Клетки гранулезы становятся крупными, полигональными. На стадии расцвета желтое тело окончательно сформировано, достигает величины 1–1,5 см; клетки его богаты цитоплазмой, содержащей капельки липидов и липохромный пигмент. Наибольшая активность желтого тела приходится на 7–8–й день после пика секреции ЛГ. В нем происходит максимальная секреция прогестерона и, в меньшей степени, эстрогенов. Параллельно нарастанию уровня половых стероидов в крови снижается содержание ЛГ и ФСГ. Желтое тело доминирует в лютеиновую фазу цикла, подавляя рост других фолликулов в обоих яичниках. Период его существования постоянен и составляет 10–12 дней. Регресс желтого тела (лютеолиз) начинается за 2–3 дня до наступления менструации и обусловлен дистрофическими процессами в лютеиновых клетках. Лютеолиз, по–видимому, связан с действием ПГФ2а, окситоцина и вазопрессина. Лютеолиз сопровождается быстрым падением уровней прогестерона и эстрогенов.
Устранение механизма обратной связи со стороны половых стероидов вызывает реактивацию гипоталамо–гипофизарной системы, что дает начало отбору новой когорты фолликулов, которые продолжат развитие в следующем цикле.
Секреторная функция яичников заключается в синтезе половых стероидных гормонов: эстрогенов, андрогенов, прогестерона. Стероидпродуцирующими тканями яичников являются клетки гранулезы, выстилающие полость фолликула, клетки внутренней теки и строма.
В синтезе эстрогенов синергично участвуют клетки гранулезы и теки, имеющие на своей поверхности рецепторы ФСГ и ЛГ (рис. 5.5). Клетки внутренней теки и в значительно меньшей степени строма являются источниками андрогенов. Прогестерон синтезируется в тека–клетках и клетках гранулезы фолликула. В желтом теле прогестерон продуцируют гранулезолютеиновые клетки, а эстрогены – тека–лютеиновые.
 Рис. 5.5. Клетки фолликула, участвующие в стероидогенезе: 1 – яичниковая артерия; 2 – тека–клетки; 3 – клетки гранулезы; 4 – базальная мембрана; 5 – яичниковая вена, А+Т – андростендион и тестостерон, образующиеся в клетках теки; Е2 – эстрадиол, ароматизирующийся из андрогенов в гранулезе фолликула
Рис. 5.5. Клетки фолликула, участвующие в стероидогенезе: 1 – яичниковая артерия; 2 – тека–клетки; 3 – клетки гранулезы; 4 – базальная мембрана; 5 – яичниковая вена, А+Т – андростендион и тестостерон, образующиеся в клетках теки; Е2 – эстрадиол, ароматизирующийся из андрогенов в гранулезе фолликула
Источником синтеза всех стероидных гормонов является холестерин, поступающий в яичник в составе ЛПНП с током крови. В тека–клетках под влиянием ЛГ из него синтезируются прегненолон и андрогены – андростендион и тестостерон, которые затем попадают в фолликулярную жидкость и гранулезные клетки, где ароматизируются в эстрогены – эстрадиол и эстрон (рис. 5.6). Активность ароматазы (фермент цитохром Р450) и ароматизация андрогенов в эстрогены контролируется ФСГ.
Основными классическими фракциями эстрогенов являются эстрон (Е1), 17р–эстрадиол (Е2) и эстриол (Е3). Наиболее активным эстрогеном является Е2: 95% его от общего пула стероидов синтезируется доминантным фолликулом. Около 10% Е2 ароматизируется из тестостерона вне яичника. В раннюю фолликулярную фазу секретируется 60–100 мкг Е2, к моменту овуляции – 400–900 мкг, в лютеиновую фазу – 270 мкг в сутки. Только половина образующегося Е1 секретируется яичником, вторая его половина ароматизируется в Е2. Кроме того, Е1 может образовываться из андростендиона путем ароматизации вне яичника, Е3 в отсутствие беременности рассматривают как метаболит Е1 и Е2.
 Рис. 5.6. Схема синтеза половых стероидных гормонов в яичнике
Рис. 5.6. Схема синтеза половых стероидных гормонов в яичнике
В фолликулярную фазу в яичнике образуется около 2 мг/сут прогестерона, в предовуляторный период – 4 мг/сут и в лютеиновую фазу – 25 мг/сут.
Андрогены представлены в яичнике, главным образом, андростендионом и тестостероном. В яичнике образуется около 1,5 мг/сут андростендиона, из него образуется 0,15 мг тестостерона. Около 15% тестостерона ароматизируется в дегидротестостерон (75 мкг/сут), который является наиболее активным внутриклеточным андрогеном сальных желез и волосяных фолликулов у женщин. Предшественники тестостерона – дегидроэпиандростерон (ДЭА) и дегидроэпиандростерон–сульфат (ДЭА–С) образуются преимущественно в коре надпочечников.
Основная масса стероидных гормонов (80%) находится в крови и транспортируется в связанном состоянии со специфическими белками – стероидсвязывающими глобулинами и неспецифическими транспортными системами – альбумином, эритроцитами. Связанные стероиды биологически неактивны. Эстрадиол и тестостерон соединяются с β–глобулином, связывающим половые стероидные гормоны. Он синтезируется в печени под контролем Е2, тестостерона и инсулина. Его сродство к Е2 в 5 раз ниже, чем к тестостерону, и еще ниже к прогестерону. Известно два прогестеронсвязывающих глобулина. Около 10% стероидов связывается с альбумином. Сродство стероидов к альбумину снижается на фоне приема нестероидных противовоспалительных препаратов. Почти 20% стероидных гормонов связывается с эритроцитами, причем они могут взаимодействовать как с мембраной, так и с участками, находящимися внутри эритроцита. Метаболизм половых стероидных гормонов происходит в печени. Обмен эстрогенов протекает по схеме: эстрадиол – эстрон – эстриол – нестероидные продукты. Все три фракции эстрогенов с помощью печеночных ферментов присоединяют глюкуроновую или сульфатную группу и становятся водорастворимыми. Образовавшиеся глюкурониды и сульфаты поступают в желчь, а с ней в кишечник. В нем часть эстрогенов реабсорбируется, а часть выделяется с калом. Основное количество эстрогенов (около 50–70%) выделяется с мочой. Главный метаболит прогестерона – прегнандиол, после соединения с глюкуроновой кислотой выделяется из организма с мочой. Продуктами обмена андрогенов являются 17–кетостероиды (17–КС). Фракции 17–КС яичникового происхождения представлены андростероном, эпиандростероном и этиохоланолоном. Основная их часть (65–70%) выделяется с мочой.
Кроме основных стероидных гормонов в гранулезных клетках фолликулов образуется белковый гормон ингибин, тормозящий выделение ФСГ гипофизом. Из венозной крови яичников женщин выделен фолликулярный протеин, ингибирующий ароматазу. Он предупреждает увеличение яичников в ответ на стимуляцию гонадотропинами. Количество его увеличивается по мере роста фолликула. В фолликулярной жидкости обнаружен ингибитор созревания овоцита, который, по–видимому, синтезируется гранулезными клетками яйценосного холмика. Его действию на овоцит препятствует ЛГ. Имеются данные о присутствии в малый фолликулах ингибитора, а в больших – стимулятора лютеинизации гранулезных и тека–клеток. В фолликулярной жидкости, желтом теле, матке и маточных трубах обнаружен окситоцин. В яичнике он оказывает лютеолитическое действие, способствуя регрессу желтого тела, блокирует секрецию прогестерона, вызывает высвобождение ПГФ2а. Важная роль в стимуляции синтеза простагландинов в предовуляторном фолликуле принадлежит ЛГ. ПГФ2а вместе с окситоцином участвует в овуляции путем усиления сократительной активности контрактильных элементов внутренней теки и в регрессе желтого тела. В желтом теле в небольших количествах образуется релаксин. Концентрация его велика в желтом теле при беременности. Релаксин способствует овуляции и оказывает токолитическое действие на миометрий, вызывает релаксацию связочного аппарата межлобкового сочленения. В желтом теле из прогестерона под влиянием фермента 21–гидроксилазы почечного происхождения может образовываться дезоксикортикостерон. Этот сильный минералокортикоид может играть значительную роль в регуляции водно–минерального баланса и сосудистого тонуса во время лютеиновой фазы цикла.
Получены данные, что на процесс фолликулогенеза и синтеза стероидных гормонов влияют некоторые факторы роста: инсулиноподобные факторы роста–1 и 2 (ИПФР–1 и ИПФР–2), эпидермальный фактор роста (ЭФР), трансформирующие факторы роста–а и –Р (ТФР–а и –Р), сосудистый эндотелиальный фактор роста (СЭФР). ИПФР синтезируются в печени и в гранулезных клетках растущего фолликула под влиянием соматотропного гормона (СТГ). ИПФР–1 участвует в синтезе эстрадиола, но под влиянием инсулина ИПФР–1 может усиливать синтез андрогенов в тека–клетках и интерстициальной ткани яичника. ЭФР активно влияет на клеточную пролиферацию, способен тормозить синтез стероидов в яичнике. ТФР–а и –Р оказывают непосредственное влияние на процессы, происходящие в гранулезных клетках, связанные с ростом и созреванием фолликулов. СЭФР усиливает проницаемость сосудов, обладает мощным митогенным эффектом и обеспечивает функциональную активность гранулезных клеток предовуляторного фолликула. Протеины с активностью факторов роста модулируют как амплитуду, так и скорость ответа фолликула на действие ЛГ и ФСГ. Изучается роль цитокинов (интерлейкинов –1 и –6) в стероидогенезе, пролиферации и лютеинизации гранулезных клеток, неоваскуляризации развивающихся фолликулов. Они действуют пара– и аутокринно, влияя на внутрияичниковые процессы.
Третий уровень регуляции представлен передней долей гипофиза – аденогипофизом, секретирующим гонадотропные гормоны (ГТ): фолликулостимулирующий гормон (ФСГ, или фоллитропин), лютеинизирующий гормон (ЛГ, или лютропин) и пролактин (ПРЛ). ФСГ и ЛГ являются гликопротеинами и секретируются базофильными клетками – гонадотрофами. Гонадотрофы человека гетерогенны: одни содержат ЛГ, другие – ФСГ, третьи – оба ГТ.
Пролактин является полипептидом и секретируется ацидофильными клетками – лактотрофами. По химическому строению и биологическим свойствам ПРЛ наиболее близок к СТГ и плацентарному лактогену. Основную роль в регуляции репродуктивной функции отводят низкомолекулярной форме ПРЛ.
Секреция ГТ контролируется ЦНС посредством гипоталамических нейропептидов и трансмиттеров, поступающих по портальной системе в переднюю долю гипофиза, и механизмом обратной связи со стороны стероидных гормонов и ингибина яичников. В ответ на каждый импульс выброса ГТ гипоталамусом идет пульсирующий выброс ФСГ и ЛГ. Частота и амплитуда импульсов ГТ изменяется в соответствии с фазой менструального цикла. В фолликулярную фазу пульсация ЛГ высокочастотная (периодичность импульсов – 60–120 мин) и низкоамплитудная. Она сохраняется на таком уровне до предовуляторного периода, когда выброс ЛГ становится высокоамплитудным. После овуляции и образования желтого тела частота импульсов ЛГ снижается до 4–часовых и более интервалов, а их амплитуда увеличивается в 2 раза по сравнению с ранней фолликулярной фазой. Пульсация ФСГ менее выражена, чем ЛГ.
Циклическое выделение гонадотропинов в репродуктивном периоде жизни женщины определяется действием гормонов яичника на гипофиз и/или гипоталамус (рис. 5.7). По мере увеличения секреции Е2 доминантным фолликулом усиливается торможение секреторной функции аденогипофиза по механизму отрицательной обратной связи. При достижении критического уровня Е2 (около 300 нг/мл) проявляется его кратковременный стимулирующий эффект на секрецию ГТ, обусловливающий пиковый выброс ЛГ и в меньшей степени ФСГ по механизму положительной обратной связи и последующую овуляцию. После образования желтого тела проявляется совместный угнетающий эффект Е2 и прогестерона на секрецию ГТ. По мере снижения секреторной функции желтого тела в поздней лютеиновой фазе возобновляется высокочастотная импульсная секреция ГТ и уровень их постепенно возрастает вплоть до наступления следующего цикла.
 Рис. 5.7. Динамика секреции гонадотропинов и гормонов яичника в менструальном цикле:ПГ – прогестерон, Е2 – эстрадиол, ФСГ – фолликулостимулирующий гормон, ЛГ – лютеинизирующий гормон
Рис. 5.7. Динамика секреции гонадотропинов и гормонов яичника в менструальном цикле:ПГ – прогестерон, Е2 – эстрадиол, ФСГ – фолликулостимулирующий гормон, ЛГ – лютеинизирующий гормон
Местом приложения тормозящего обратного эффекта Е2 является аденогипофиз, а прогестерона – аркуатные ядра гипоталамуса. Малые количества прогестерона (предовуляторная секреция) стимулируют высвобождение гонадотропинов на уровне гипофиза (механизм положительной обратной связи). Е2 снижает амплитуду импульсов ГТ, а прогестерон – их частоту.
Ритм секреции ПРЛ также меняется в течение менструального цикла. Его уровень имеет тенденцию к увеличению в середине цикла и в лютеиновой фазе. Это связано с возрастанием не частоты, а амплитуды импульсов. Механизмы, индуцирующие пульсирующую секрецию ПРЛ, пока неясны. Они исходят не из гипоталамуса, а из гипофиза.
Между гонадотрофами и пролактотрофами имеются межклеточные связи. Поэтому возможен вариант обратного влияния, т.е. изменение активности гонадотрофов при изменении секреции ПРЛ (например, снижение секреции ГТ при гиперпролактинемии).
Основными регуляторами секреции ПРЛ являются пролактолиберин и пролактостатин.
Синтез и секреция ПРЛ возможны в эндометрии, плаценте, эпителиальных клетках тонкой кишки, раковых клетках легких и почек.
Органами–мишенями для ГТ являются яичники. Рецепторы ФСГ и ЛГ локализуются на клеточной мембране. После связывания гормона с мембранным рецептором в клетке–мишени происходит активация аденилатциклазы (1–й посредник), что приводит к образованию из АТФ цАМФ (внутриклеточный переносчик сигнала – 2–й посредник), а цАМФ активирует протеинкиназу, катализирующую фосфорилирование регуляторных клеточных белков.
Пролактин после связывания с рецептором не активирует аденилатциклазу, его внутриклеточный посредник пока неизвестен.
Четвертый уровень репродуктивной системы представлен гипофизотропной зоной гипоталамуса, представляющей собой скопление нейронов в виде ядер вентро–, дорсомедиального и аркуатного. В гипоталамусе присутствуют два типа нейронов – крупноклеточные и мелкоклеточные. Тела крупноклеточных нейронов находятся в супраоптическом и паравентрикулярных ядрах, а их аксоны идут к срединному возвышению, вниз по ножке гипофиза к терминалям в задний доле гипофиза. Эти нейроны синтезируют и секретируют окситоцин и вазопрессин. Тела мелкоклеточных нейронов образуют скопления во многих гипоталамических ядрах. Они синтезируют нейрогормоны, которые стимулируют (либерины) или ингибируют (статины) выделение соответствующих тропных гормонов аденогипофиза. Либерины и статины по аксонам этих клеток поступают в терминали, находящиеся в срединном возвышении. Срединное возвышение является составной частью нейрогипофиза и представляет собой переход основания гипоталамуса в ножку гипофиза. Здесь содержится значительное количество терминалей гипоталамических и экстрагипоталамических нейронов, происходит перекрест нервных и гуморальных сигналов. Трансформация сигналов осуществляется благодаря связи терминалей секретирующих нейронов с капиллярами гипоталамо–гипофизарной портальной системы, а также через специфические клетки танициты, выстилающие дно 3–го желудочка.
Либерины и статины проникают в капилляры гипоталамо–гипофизарной портальной системы и переносятся в переднюю долю гипофиза. Кроме основного направления кровотока вниз по ножке гипофиза небольшой объем крови может поступать вверх по ножке, что важно для осуществления механизма обратной связи между гипофизом и гипоталамусом.
Выделен и хорошо изучен ЛГ–рилизинг–гормон (ЛГ–РГ, или люлиберин). Он представляет собой декапептид. Поскольку ЛГ–РГ способен стимулировать образование и выделение ЛГ и ФСГ, он получил название гонадолиберина (ГЛ). ЛГ–РГ у приматов и человека образуется в аркуатных ядрах медиобазального гипоталамуса, получивших название аркуатного осциллятора, так как секреция ЛГ–РГ генетически запрограммирована в определенном пульсирующем ритме с частотой примерно один раз в час. Этот ритм получил название цирхорального. Цирхоральный ритм выделения ЛГ–РГ формируется в пубертатном возрасте и является показателем зрелости нейросекреторных структур гипоталамуса. Считают, что в функции репродуктивной системы восстановление пульсирующего ритма ЛГ–РГ играет только пермиссивную (запускающую) роль, т.е. пульсирующая секреция ГЛ необходима лишь для индукции секреции ЛГ и ФСГ, а циклические изменения содержания ГТ в течение менструального цикла обеспечиваются механизмом обратной связи со стороны гормонов яичника.
Гонадолиберин стимулирует синтез и высвобождение гонадотропинов из депо в аденогипофизе после связывания со специфическими рецепторами на клеточной мембране гонадотрофов, что приводит к активации аденилатциклазы, образованию цАМФ и последующей стимуляции внутриклеточной системы Са2+ – кальмодулин.
Секреция ГЛ контролируется нейромедиаторами (нейротрансмиттерами) и простагландинами. Последнее подтверждается отсутствием пика секреции ЛГ и овуляции при использовании индометацина, подавляющего синтез простагландинов.
Регуляция секреции пролактина осуществляется, главным образом, пролактинингибирующим фактором (ПИФ), роль которого выполняет дофамин (ДА). Он вырабатывается дофаминергическими структурами в области срединного возвышения и по нейронам тубероинфундибулярной системы поступает в портальную сосудистую сеть. Дофамин тормозит выделение ПРЛ из лактотрофов гипофиза, а его антагонисты (резерпин, аминазин, метилдофа и др.) вызывают усиление выделения ПРЛ.
Выделить и установить структуру пролактолиберина не удалось. Однако известно, что при определенных условиях стимулировать выделение ПРЛ могут эстрогены, серотонин, гистамин, γ–аминомасляная кислота (ГАМК), тиреотропный гормон (ТТГ), β–эндорфин, энкефалин (ЭНК), вазоинтестинальный полипептид. Физиологическими стимулами секреции ПРЛ являются сон, физическая активность, стресс, гипогликемия, раздражение соска молочной железы, половой акт, эстрогены.
Пятый уровень регуляции репродуктивной системы осуществляется на уровне коры головного мозга и экстрагипоталамических церебральных структур, воспринимающих импульсы из внешней среды, и интерорецепторов. Они передают импульсы через систему нейротрансмиттеров (НТ) в нейросекреторные ядра гипоталамуса по афферентным путям, которые подразделяются на восходящие и нисходящие. Восходящие пути к гипоталамусу идут из групп норадреналиновых, серотониновых и дофаминовых нейронов, рассеянных в акведуктном и перивентрикулярном сером веществе. Нисходящие пути идут от миндального ядра, гиппокампа, лимбической системы, сетчатки глаза. НТ являются основным связующим звеном между ЦНС и эндокринной системой и обеспечивают их единство в организме.
Классическими НТ являются катехоламины норадреналин (НА) и дофамин (ДА), ацетилхолин, ГАМК, серотонин, гистамин, морфиноподобные опиоидные нейропептиды. В качестве нейромедиаторов могут выступать γ–аминомасляная кислота (ГАМК) и катехолэстрогены.
Дофамину, норадреналину и серотонину принадлежит ведущая роль в контроле секреции гонадолиберина (ГЛ). Норадреналин стимулирует овуляторный выброс ГЛ, дофамин понижает цирхоральную секрецию ЛГ, серотонин опосредует тормозящее влияние на циклический выброс ГЛ.
Эндогенные опиоидные пептиды (ЭОП) образуются в результате расщепления предшественников, дающих начало 3 группам ЭОП: эндорфинам (ЭНД), энкефалинам (ЭНК) и динорфинам (ДИН). β–ЭНД образуется при расщеплении проопиомеланокортина, в молекуле которого еще содержатся β–липотропин, α–, β– и γ–меланоцитостимулирующий гормон и АКТГ. Предшественником ЭНК является препроэнкефалин, ДИН – препродинорфин.
Эндогенные опиоиды снижают частоту и амплитуду выброса ГЛ, что сопровождается снижением тонической секреции гонадотропинов, а также блокируют овуляторный выброс ФСГ и ЛГ; β–ЭНД, ЭНК и их аналоги могут усиливать выброс ПРЛ путем стимуляции выделения серотонина и торможения освобождения ДА.
Имеются сведения об участии в регуляции гипоталамо–гипофизарной активности катехолэстрогенов (КЭ) – естественных производных эстрогенов. Они имеют структурное сходство как с эстрогенами, так и с катехоламинами и могут взаимодействовать с рецепторами катехоламинов и эстрогенов. Это позволяет рассматривать их в качестве модуляторов функциональной активности гипоталамуса.
Таким образом, регуляция репродуктивной системы представляет собой сложный процесс, включающий 5 уровней, каждый из которых регулируется вышележащими структурами и механизмом обратной связи. Выделяют длинную петлю обратной связи между гормонами яичника и ядрами гипоталамуса, между гормонами яичника и гипофизом; короткую петлю – между передней долей гипофиза и гипоталамусом и ультракороткую – между ГЛ и нейроцитами гипоталамуса. Обратная связь может быть положительной или отрицательной. Примером положительной обратной связи является овуляторный пик выброса ЛГ и ФСГ в ответ на максимальное содержание эстрадиола в крови, примером отрицательной – усиление выделения ЛГ в ответ на низкий уровень эстрадиола или увеличение образования ГЛ при снижении уровня ЛГ в клетках аденогипофиза. В течение фолликулярной фазы по мере увеличения концентрации Е2 усиливается его отрицательный обратный эффект на высвобождение ГТ.
В регуляции функции репродуктивной системы основными являются пульсирующая секреция ГЛ в нейронах гипоталамуса и регуляция выброса ЛГ и ФСГ эстрадиолом по механизму отрицательной и положительной обратной связи. На фоне фиксированных (цирхоральных) импульсов ГЛ у приматов и человека именно яичник играет роль биологических часов, а эстрадиол является основным гормоном, участвующим в обеспечении функциональных связей между звеньями репродуктивной системы.
Менструальный цикл
В процессе эволюции в соответствии с ритмическими изменениями явлений природы в организме животных и человека сформировался определенный ритм физиологических функций. Наиболее четким и наглядным проявлением ритмических изменений, происходящих в женском организме, является менструальный цикл.Менструальный цикл – это повторяющаяся циклическая деятельность системы гипоталамус – гипофиз – яичники и обусловленные ею структурные и функциональные изменения репродуктивного тракта: матки, эндометрия, маточных труб, влагалища. Каждый менструальный цикл заканчивается менструальными кровянистыми выделениями. Он охватывает период от 1–го дня последней менструации до начала следующей.
Первые месячные (менархе) появляются обычно в возрасте 12–14 лет (возможны физиологические колебания от 9 до 15 лет) и продолжаются в детородном возрасте до 45–46 лет. Длительность менструального цикла колеблется от 21 до 35 дней, составляя у большинства женщин 28 дней.
Нормальный менструальный цикл включает 3 основных компонента: циклические изменения в системе гипоталамус–гипофиз – яичники (яичниковый цикл), циклические изменения в матке, преимущественно в эндометрии (маточный цикл) и разнообразные физиологические сдвиги во всем организме женщины (менструальная волна).
Информация о циклических процессах, происходящих в гипоталамо–гипофизарно–яичниковой системе была рассмотрена выше.
Маточный цикл
Представляет собой циклические изменения в матке в ответ на действие стероидных гормонов яичника (эстрогенов и прогестерона). Они продуцируются на протяжении всего менструального цикла клетками зреющего фолликула и желтого тела, но уровень их в крови различен и определяется фазой яичникового цикла: фолликулярная, овуляция, лютеиновая.Секреция эстрадиола (Е2) характеризуется двухфазным увеличением: прогрессирующее нарастание его уровня в фолликулярной фазе длится в среднем 5 дней и достигает максимума за день до предовуляторного пика ЛГ; второй подъем отмечается в лютеиновой фазе, но он вдвое меньше предовуляторного. Секреция прогестерона достоверно увеличивается в день пика ЛГ и непрерывно возрастает до 21–22–го дня цикла.
Взаимодействие стероидных гормонов со специфическими рецепторами приводит к структурным и морфофункциональным изменениям в эндометрии.
У женщин репродуктивного возраста слизистая оболочка дна и тела матки состоит из двух слоев: базального и функционального. Состояние базального слоя на протяжении менструального цикла существенно не меняется, тогда как функциональный слой подвергается структурным и функциональным изменениям, в которых выделяют фазы пролиферации и секреции с последующим кровотечением (десквамация и регенерация эндометрия).
Фаза пролиферации при 28–дневном цикле продолжается в среднем 10–12 дней, но длительность ее может колебаться в связи с вариабельностью фолликулярной фазы. Рост эндометрия (пролиферация) и изменения в нем в 1–й половине менструального цикла происходят в результате действия эстрогенных гормонов. В фазе пролиферации выделяют раннюю (4–7–й дни), среднюю (8–10–й дни) и позднюю (11–14–й дни) стадии.
Фаза секреции наступает после овуляции. В эту фазу морфофункциональные изменения в эндометрии связаны с процессом развития желтого тела и продукцией прогестерона. Продолжительность лютеиновой фазы цикла стабильна и составляет 14±2 дня. Морфологически выделяют раннюю стадию секреции, к которой относятся первые 4 дня после овуляции (15–18–й дни при 28–дневном цикле), среднюю (19–23–й дни) и позднюю (24–28–й дни).
Изменения морфологической картины эндометрия на протяжении овуляторного менструального цикла представлены в табл. 5.1.
Основными причинами возникновения маточного кровотечения при менструации являются: ■ спад уровня эстрогенов и прогестерона в периферической крови ■ сосудистые изменения: спазм спиральных артерий и артерий эндометрия, повышение их проницаемости ■ нарушение кровообращения с деструкцией эндометрия ■ лейкоцитарная инфильтрация стромы компактного слоя с появлением эндометриальных гранулоцитов, выделяющих релаксин ■ тромбоз, ишемия и некрозы ■ повышение содержания протеолитических (кислая фосфатаза) и фибринолитических ферментов в эндометрии. Последние, выделяясь при распаде слизистой оболочки, препятствуют свертыванию менструальной крови в процессе десквамации. После отторжения эндометрия кровь начинает свертываться.
Таблица 5.1. Морфологическая картина эндометрия на протяжении овуляторного менструального цикла
| Фаза цикла | День | Эндометрий | |
|---|---|---|---|
| железы | строма | ||
| Пролиферация: | |||
| ранняя | 5–7–й | Прямые с маленьким круглым поперечным сечением. Ядра расположены базально. Отдельные митозы | Веретенообразные клетки с относительно большим ядром. Митозы редкие |
| средняя | 8–10–й | Удлиненные с легкой извитостью. Ядра псевдостратифицированы. Многочисленные митозы | Преходящий отек. Многочисленные митозы |
| поздняя | 11–14–й | Значительная извитость, широкий просвет, максимальная псевдостратификация ядер | Меньше отек, ядра клеток более крупные. Мало митозов |
| Секреция: | |||
| ранняя | 15–18–й | Широкий просвет, на 16–й день ядра расположены базально. Субнуклеарные вакуоли проникают в ядра на 18–й день. Исчезают митозы | Относительно компактна. Редкие митозы |
| средняя | 19–23–й | Пилообразно–зубчатой формы. Ядра расположены у основания клеток. Максимальная секреция в просвет желез. Митотические фигуры отсутствуют | Максимальный отек на 22–й день, первое появление псевдодецидуальных скоплений клеток вокруг небольших артерий на 23–й день |
| поздняя | 24–28–й | Регрессия с освобождением поверхности эпителия желез, усиление складчатости стенок. Ядра некоторых клеток пикнотичные | Максимальная предецидуальная реакция, инфильтрация лейкоцитами и, позднее, эритроцитами |
| Менструация | 1–4–й | Отслойка эпителия | Кровоизлияния в строму и отслойка эндометрия |
Отторжение функционального слоя эндометрия во время менструации происходит не полностью, отторгаются лишь отдельные его участки. Эпителизация раневой поверхности эндометрия начинается со 2–го дня от начала менструации, продолжается около 5 дней и происходит путем разрастания эпителия из каждой железы базального слоя и, возможно, за счет разрастания железистого эпителия функционального слоя, сохранившегося от предыдущего менструального цикла.
В норме менструация длится от 2 до 7 дней (в среднем 3–4 дня). Кровопотеря небольшая и составляет 50–100 мл за все дни. Выделяемая кровь не образует сгустков. Самочувствие не нарушено, болевых ощущений нет.
Шеечный цикл
Эпителий цервикального канала представлен двумя типами клеток (не считая резервных): секреторными и реснитчатыми. Бокаловидные клетки выполняют ту же функцию, что и секреторные, и являются их разновидностью. Реснитчатые клетки способствуют транспорту секрета благодаря постоянным движениям ресничек в дистальном (к наружному маточному зеву) направлении. Секреторные клетки продуцируют слизь (муцин) в просвет цервикального канала. Слизь представляет собой гидрогель, богатый карбогидратами и состоящий из гликопротеинов муцинового типа. Вязкость слизи и диаметр пор в геле зависят от уровня гормонов и изменяются циклически.В фолликулярную фазу цикла под влиянием эстрогенов происходит рост клеток эндоцервикса и увеличение секреции муцина от 60 мг/сут в раннюю фолликулярную фазу, до 700 мг/сут – к периоду овуляции. Накапливаясь в просвете цервикального канала, слизь растягивает область наружного маточного зева (симптом «зрачка»). К моменту овуляции, по мере увеличения уровня эстрогенов, слизь становится жидкой, вязкость и клеточный состав ее уменьшаются. В слизи содержится много солей, муцина, гликопротеинов. Под влиянием эстрогенов натрия хлорид в присутствии муцина и при рН слизи 7,5–8 образует кристаллы в виде листа папоротника (симптом кристаллизации). Миофибриллы цервикальной слизи располагаются параллельно, образуя поры (микроканалы), облегчающие проникновение сперматозоидов в полость матки. После овуляции в лютеиновую фазу, когда уровень эстрогенов снижается, размер клеток эндоцервикса уменьшается, строма становится отечной. Продукция слизи снижается, она становится более вязкой, ее рН снижается до 6–6,5; миофибриллы располагаются в виде мелкой сетки; наружный зев закрывается, «симптом зрачка» и симптом кристаллизации становятся отрицательными.
Циклические изменения в маточных трубах
Слизистая оболочка маточных труб представлена следующими типами эпителиальных клеток: мерцательными (реснитчатыми), секреторными, базальными (индифферентными, интраэпителиальными, пузырчатыми) и вставочными (штифтообразными). Основными из них являются мерцательные и секреторные. Распределение этих клеток в различных частях трубы обратно пропорционально: наибольшее число мерцательных клеток (85%) находится в фимбриях и уменьшается по направлению к маточному концу трубы, а количество секреторных клеток, наоборот, увеличивается.В 1–й половине менструального цикла поверхность эпителиального покрова маточных труб ровная. Высота секреторных и мерцательных клеток в начале фолликулярной фазы –20 мкм, а к моменту овуляции достигает 30–35 мкм. Эстрогены способствуют увеличению высоты мерцательных клеток, образованию и росту ресничек.
На протяжении 2–й половины менструального цикла высота эпителиальных клеток, главным образом мерцательных, снижается до 18–20 мкм. Секреторные клетки приобретают разнообразную форму, апикальная их часть выступает над поверхностью мерцательных клеток.
Функция секреторных клеток сводится к выработке веществ, необходимых для обеспечения жизнеспособности оплодотворенной яйцеклетки: гликопротеинов, кислых гликозаминогликанов, электролитов и различных ферментов, а также ПГБ2а. Максимальная их активность наблюдается в лютеиновую фазу под влиянием прогестерона.
Мерцательным клеткам отводится важная роль в обеспечении продвижения яйцеклетки по трубе в матку.
В продвижении яйцеклетки важное значение имеет перистальтика трубы, которая наиболее выражена в период овуляции. Сократительная деятельность маточных труб контролируется простагландинами. В овуляторный период менструального цикла отверстие в истмическом отделе маточной трубы закрывается под действием ПГЕ2а на циркулярные волокна, во 2–ю фазу истмический отдел расслабляется. Проникновению яйцеклетки в полость матки способствует усиление сократительной активности всех отделов трубы под влиянием ПГФ2а. Захват яйцеклетки после овуляции обеспечивается соприкосновением воронки трубы с яичником.
Определенная роль в транспорте овулировавшей яйцеклетки к фимбриальному концу маточной трубы отводится сократительной активности трубно–яичниковой связки, которая возрастает в период овуляции под влиянием ПГФ2а и ацетилхолина.
Влагалищный цикл
Слизистая оболочка влагалища представлена многослойным плоским (сквамозным) эпителием, в котором различают четыре типа клеток: базальные, парабазальные, промежуточные и поверхностные.Базальные клетки отличаются небольшими размерами, но сравнительно крупными ядрами, занимающими более 50% клетки. Форма клеток округлая, цитоплазма базофильная.
Парабазальные клетки несколько больше базальных, округлые, ядро занимает 50% клетки, цитоплазма обычно базофильная, хотя могут встречаться и ацидофильные парабазальные клетки.
Промежуточные клетки образуют несколько слоев, они неправильной вытянутой формы с интенсивно окрашенным ядром средних размеров. Цитоплазма их частью базофильна, в отдельных случаях ацидофильна.
Поверхностные клетки наиболее крупные, полигональной формы с мелкими интенсивно окрашенными ядрами. Среди них различают базофильные кариопикнотические клетки, происходящие из внутреннего отдела поверхностного слоя, и ацидофильные кариопикнотические клетки – из наружного поверхностного слоя плоского эпителия.
Клеточный состав влагалищного содержимого и толщина эпителия изменяются на протяжении менструального цикла. В раннюю фолликулярную фазу под влиянием эстрогенов происходит разрастание эпителия влагалища за счет клеток базального слоя. По мере приближения овуляции и нарастания уровня эстрогенов клетки дифференцируются, увеличивается количество слоев эпителия за счет промежуточных клеток. К овуляции эпителий достигает максимальной толщины – 150–300 мкм за счет клеток поверхностного слоя, главным образом ацидофильных с пикнотичными ядрами. Происходит разрыхление всей толщи эпителия. В лютеиновую фазу прекращается разрастание эпителия, усиливаются процессы слущивания клеток, при этом толщина эпителия уменьшается до 120–150 мкм. В мазке преобладают промежуточные клетки. В период менструации отторгаются поверхностный и частично промежуточный слои влагалищного эпителия.
Строма слизистой оболочки влагалища также изменяется в течение менструального цикла: она набухает в предменструальный период вследствие крове– и лимфонаполнения и спадается во время менструации.
Молочные железы, так же как и внутренние половые органы претерпевают циклические изменения под влиянием гормонов гипофиза и яичников. Установлено, что эстрогены стимулируют развитие выводных протоков молочных желез, а прогестерон – альвеолярного аппарата, причем прогестерон оказывает действие на альвеолы только после предварительного воздействия эстрогенов. ПРЛ стимулирует развитие системы молочных ходов и секреторную функцию молочной железы. Кроме того, имеются данные относительно влияния гормона роста на развитие молочных ходов и тироксина, глюкокортикоидов и дезоксикортикостерона на развитие альвеолярного аппарата железы.
В течение менструального цикла происходит усиление пролиферативных процессов эпителия молочных ходов и покровного эпителия соска под влиянием эстрогенов. Максимальное количество митозов и наибольшее количество ороговевающих клеток обнаруживается в момент овуляции. Гибель избыточных эпителиальных клеток осуществляется путем слущивания их в просвет выводных протоков и альвеол или путем набухания и последующего лизиса. В лютеиновой фазе может проявляться слабая секреция эпителия, в результате чего в период менструации в просвете железистых ходов появляются жировые капли и слущившийся эпителий. Увеличение молочных желез перед менструацией объясняется набуханием их вследствие отека стромы между дольками молочной железы, что иногда сопровождается болевыми ощущениями. Явления масталгии сопровождаются повышением уровня ПРЛ во 2–й фазе цикла.
Репродуктивная система и другие железы внутренней секреции
Эпифиз
Эпифиз (шишковидная железа) – непарная железа, располагающаяся в среднем мозге над мозжечком, на задней поверхности мозговых полушарий. Шишковидное тело является нейроэндокринным трансдуктором, в нем происходит преобразование нервных импульсов, сигнализирующих о соответствующих уровнях освещенности, в гуморальный ответ в виде продукции биологически активных веществ. Эпифиз является метаболически активным органом. Здесь происходит интенсивный обмен липидов, белков, фосфора и нуклеиновых кислот. В шишковидной железе обнаружены гормоны нейрогипофиза (аргинин–вазопрессин, окситоцин, нейрофизин), накапливаются гормоны аденогипофиза (ЛГ, ФСГ, ПРЛ, сомато– и меланостимулирующий гормоны), образуются мелатонин и нейротрансмиттеры (норадреналин и серотонин).Эпифиз активно влияет на образование и секрецию большинства тропных гормонов гипофиза, в первую очередь гонадотропинов, АКТГ, а также окситоцина. Он находится в реципрокных отношениях с гипоталамо–гипофизарным комплексом, модулирует механизм обратной связи между этим комплексом и половыми железами. Мелатонин и ряд пептидных веществ (включая аргинин–вазотоцин), вырабатываемых эпифизом, обладают антигонадотропным свойством. Мелатонин блокирует в гипоталамусе образование гонадолиберина и ограничивает синтез в гипофизе ФСГ и ЛГ, что клинически проявляется гипоэстрогенией и инфантилизмом. Гипофункция эпифиза, напротив, сопровождается повышением секреции ФСГ, персистенцией фолликулов, гиперэстрогенией. Адреногломерулотропин (продукт восстановления мелатонина) обладает альдостеронстимулирующей активностью.
В шишковидном теле плода обнаруживается вазотоцин, имеющий сходство с окситоцином и вазопрессином. Он участвует в регуляции осмотического давления. Прослеживается роль эпифиза в обеспечении согласованности и сопряженности между соматическим развитием и степенью полового созревания. В детстве продукция серотонина шишковидной железой неуклонно возрастает, что сдерживает гонадотропную активность гипофиза. Персистенция такого типа секреции серотонина может быть одной из причин инфантилизма или первичного гипогонадизма. Повышенная секреция мелатонина обнаружена при перенашивании беременности, слабой родовой деятельности, дисфункциональных маточных кровотечениях.
Надпочечники
Особое значение в патологии и физиологии женского организма имеют гормоны коры надпочечников, главным образом сетчатой зоны, где вырабатываются андрогены (дегидроэпиандростерон, андростендион, тестостерон), гестагены и некоторое количество эстрогенов (эстрадиол, эстрон).Полагают, что во внутриутробном периоде тестостерон оказывает маскулинизирующее действие на регуляцию синтеза и выделения ФСГ и ЛГ передней долей гипофиза. В препубертатном периоде гормоны яичников и андрогены надпочечников обеспечивают развитие вторичных половых признаков, скачок роста вследствие анаболического действия: андрогены ускоряют рост скелета, эстрогены вызывают созревание костной ткани и окостенение ростковых зон трубчатых костей. В постменопаузе с увеличением возраста основным источником продукции эстрона является андростендион, секретируемый корой надпочечников.
Избыточная секреция андрогенов надпочечниками тормозит выделение гонадолиберина и гонадотропинов аденогипофизом по механизму отрицательной обратной связи, что вызывает нарушение функции яичников различной степени тяжести: подавление роста и созревания фолликулов на ранних стадиях фолликулогенеза ведет к аменорее; торможение роста, созревания фолликулов и яйцеклетки проявляется ановуляцией и олигоменореей, а неполноценность развития желтого тела при наличии овуляции и регулярных менструаций –недостаточностью лютеиновой фазы цикла. В условиях гиперандрогении отмечается неблагоприятное течение беременности. Это связано с неполноценностью желтого тела, склерозированием сосудов эндометрия, миометрия и хориона.
Щитовидная железа
Щитовидная железа является важнейшим звеном нейроэндокринной системы и оказывает существенное влияние на функцию репродуктивной системы. Только при нормальной функции щитовидной железы происходит правильное формирование репродуктивной системы. О взаимосвязи тиреоидной и репродуктивной систем свидетельствуют изменение активности функции щитовидной железы в различные фазы менструального цикла, в период полового созревания, беременности, лактации. С другой стороны, при заболеваниях щитовидной железы отмечаются нарушения менструальной и репродуктивной функции: при тиреотоксикозе чаще встречаются дисфункциональные маточные кровотечения, при гипотиреозе – олигоменорея, вторичная аменорея, бесплодие, невынашивание беременности.Гипоталамо–гипофизарно–тиреоидная система является саморегулирующейся и подчиняющейся механизму обратной связи. Регуляция функции щитовидной железы осуществляется на 3 уровнях: гипоталамическом, гипофизарном, тиреоидном. Под влиянием метаболических, эндокринных, термических и психических раздражителей в гипоталамусе выделяется тиролиберин, который попадает в гипофиз через портальную систему, где стимулирует синтез и выделение тиреотропного гормона (ТТГ) из тиротрофов, а также высвобождение пролактина и соматотропина. Соматостатин (его уровень повышается при увеличении в плазме ИПФР–1) ингибирует тиреотропную функцию, а эстрогены, возможно, повышают чувствительность тиротрофов к тиролиберину. ТТГ, в свою очередь, стимулирует размножение тиреоцитов, синтез и секрецию гормонов щитовидной железы. Гормоны щитовидной железы тироксин (Т4) и трийодтиронин (Т3) циркулируют в связанной форме с белками – тироксинсвязывающим глобулином (ТСГ) и преальбумином (ТСПА), однако сродство Т3 и Т4 к ТСГ в 100 раз выше. Эстрогены, усиливая синтез ТСГ в печени, могут ослаблять биологическое действие гормонов щитовидной железы, а андрогены и глюкокортикоиды, снижая продукцию ТСГ, напротив, усиливать.
Различные неблагоприятные факторы внешней среды, инфекционные заболевания, стрессовые ситуации, иммунные факторы, структурные и функциональные нарушения в гипоталамо–гипофизарной системе могут приводить к изменению биосинтеза тиреоидных гормонов, возникновению гипер– и гипотиреоза.
Избыток тиреоидных гормонов приводит к возрастанию базального уровня ЛГ, подавлению овуляторного пика гормона, изменению чувствительности гонад к тропной стимуляции, что может вызвать недостаточность лютеиновой фазы цикла, ановуляцию, нарушение менструальной функции по типу ДМК. При гипофункции щитовидной железы избыточное выделение тиролиберина приводит к развитию гиперпролактинемии и нарушению гонадотропной функции гипофиза, снижению чувствительности яичников к тропной стимуляции, развитию аменореи и бесплодию.
В заключение следует отметить, что репродуктивная система, являясь самостоятельной физиологической единицей, взаимосвязана с другими системами организма. Наличие широких межнейронных внутригипоталамических контактов определяет возможность взаимовлияния гипоталамических центров регуляции тропных функций аденогипофиза. Существует реципрокная зависимость между адренокортикотропной и гонадотропной, тиреотропной и гонадотропной, гонадотропной и соматотропной функциями. Нарушение функции одних элементов эндокринной системы может оказать влияние на функционирование других и быть причиной возникновения в них патологических изменений.
Нарушения менструального цикла
Дисфункциональные маточные кровотечения
Дисфункциональные маточные кровотечения (ДМК) – это кровотечения, обусловленные функциональными нарушениями в системе гипоталамус – гипофиз – яичники при отсутствии органических заболеваний половых органов или системных заболеваний организма.Дисфункциональные маточные кровотечения в структуре общей гинекологической заболеваемости составляют 4–19%, однако частота их нарастает в переходные возрастные периоды жизни женщины, когда наблюдается наибольшая уязвимость гипоталамо–гипофизарно–яичниковой системы. Частота ДМК в период становления менструальной функции составляет 10–20%, в период угасания – 50–60% всех ДМК.
Классификация
По морфофункциональным изменениям в яичниках и характеру нарушений менструального цикла ДМК бывают ановуляторными и овуляторными.Ановуляторные ДМК – это кровотечения, при которых отсутствует овуляция.
Они подразделяются на ДМК: ■ с кратковременной персистенцией фолликула ■ с длительной персистенцией зрелого фолликула или нескольких фолликулов ■ с атрезией нескольких фолликулов.
Овуляторные ДМК – это кровотечения, при которых овуляция сохранена, но отмечается неполноценность фаз цикла.
Среди них выделяются кровотечения, обусловленные: ■ недостаточностью фолликулярной фазы ■ нарушениями функции желтого тела ■ кратковременным снижением эстрогенов в середине цикла ■ повышенным содержанием простагландинов в матке.
По возрастным периодам ДМК подразделяют: ■ на ювенильные (10–18 лет) ■ репродуктивного периода (18–45 лет) ■ предменопаузального периода (45–55 лет) ■ постменопаузального периода (56 лет и старше).
Этиология
Этиологические факторы ДМК весьма многообразны. К ним можно отнести неблагоприятные материально–бытовые условия, умственное и физическое перенапряжение, психические потрясения, стрессы, перемену климата, гиповитаминозы (дефицит витаминов С, Е, К), интоксикации, острые и хронические инфекции, особенно частые ангины, грипп, хронический тонзиллит, ОРЗ, ветряную оспу, краснуху, паротит, ревматизм.ДМК могут быть начальными проявлениями нейроэндокринных и экстрагенитальных заболеваний (заболевания крови, ожирение, сахарный диабет, гипертиреоз, болезнь Иценко–Кушинга, акромегалия, некоторые формы адреногенитального синдрома и синдрома поликистозных яичников), а также хронических воспалительных заболеваний гениталий.
Патогенез
В основе ДМК лежит нарушение амплитуды и ритма выделения гонадотропинов, что ведет к нарушению процесса созревания фолликулов и их гормональной функции. Секреция ГТ может носить беспорядочный характер с повышением или понижением секреции ФСГ и ЛГ.В большинстве случаев ювенильных ДМК имеется функциональная незрелость центров гипоталамуса, что выражается в отсутствии формирования цирхорального ритма выделения гонадолиберина и, как следствие этого, циклического выделения ГТ. При гипоэстрогенной форме ДМК секреция ФСГ и ЛГ понижена, при гиперэстрогенной форме уровень ФСГ повышен, а ЛГ снижен. В патогенезе ановуляторных ДМК у девочек с хорошей эстрогенизацией может играть роль неспособность гипоталамо–гипофизарной системы реагировать на действие эстрогенов по механизму положительной обратной связи, вследствие чего отсутствует овуляторный выброс ЛГ.
Нарушение ритма выделения ГТ приводит либо к атретическим процессам в яичнике со снижением продукции эстрогенов, либо к персистенции зрелого фолликула, секретирующего большие количества эстрогенов. Длительное волнообразное выделение небольших количеств эстрогенов при атрезии или больших при персистенции приводит в конечном итоге к одинаковому результату – пролиферации эндометрия без секреторной трансформации или гиперплазии.
В репродуктивном периоде вероятными причинами ДМК могут быть дисфункция гипоталамо–гипофизарной системы с выпадением механизма положительной обратной связи; нарушение периферической конверсии андрогенов в эстрогены; резкое падение концентрации эстрогенов в эндометрии, приводящее к «кровотечению прорыва»; увеличение продукции простагландинов эндометрия, которые вызывают спазм сосудов, ишемию и кровотечение. В яичниках чаще происходит кратковременная (в течение 7–8 дней) или длительная персистенция фолликула (фолликулов) с секрецией повышенного уровня эстрогенов. Гиперэстрогения сопровождается избыточным ростом эндометрия и развитием гиперпластических процессов.
В период угасания менструальной функции в центрах регуляции репродуктивной системы снижается количество рецепторов эстрогенов. Это приводит к нарушению механизма отрицательной обратной связи и увеличению выделения ГТ, особенно ФСГ. В яичниках уменьшается число слоев гранулезных клеток и тека–клеток с уменьшением синтеза эстрадиола и нарушением механизма положительной обратной связи. В результате не происходит овуляторного выброса ЛГ и ФСГ, отсутствует овуляция. Избыток эстрогенов приводит к гиперплазии эндометрия.
Механизм кровотечения обусловлен выраженными сосудистыми изменениями. В результате действия эстрогенов происходит застойное полнокровие эндометрия с резким расширением капилляров, повышением их проницаемости, стазами крови. Нарушение кровообращения приводит к тканевой гипоксии, метаболическим сдвигам, дистрофии и некрозу, что вызывает длительное и неравномерное отторжение эндометрия. Повышение фибринолитической активности и уменьшение агрегации тромбоцитов поддерживают кровотечение, тормозя процессы тромбообразования на локальном уровне.
Ановуляторные ДМК
Кратковременная ритмическая персистенция фолликула (ановуляторной цикл) характеризуется циклическими менструальноподобными выделениями при отсутствии овуляции. Этот вариант ДМК чаще встречается в период полового созревания, у кормящих женщин, в климактерическом периоде. Клиническая картина может не отличаться от нормального менструального цикла. Поводом для обращения к врачу является бесплодие у женщин детородного возраста.Диагноз основывается на клинических симптомах (сохраненный ритм менструаций, бесплодие) и дополнительных методах исследования.
Тесты функциональной диагностики констатируют монофазный тип базальной температуры, положительные во 2–й половине цикла симптомы «зрачка» и «папоротника», однотипную картину цитологии влагалищного мазка, чаще свидетельствующую об умеренной гипоэстрогении.
По данным ультразвуковой фолликулометрии можно установить отсутствие овуляции.
При гормональном исследовании определяются монотонные уровни эстрогенов, низкая секреция прогестерона.
Окончательный диагноз ставится на основании гистологического исследования соскоба эндометрия, произведенного за 2–3 дня до предполагаемого срока менструации. Постоянным характерным признаком является отсутствие секреторной трансформации эндометрия.
Лечение ановуляторных циклов в период пубертации, лактации и климактерия, протекающих без клинических проявлений и нарушения общего состояния, не требуется.
Выбор метода гормонального лечения в репродуктивном периоде зависит от эстрогенной насыщенности организма. При умеренной и сниженной эстрогенной насыщенности (шеечный индекс до 7 баллов, КПИ – не более 30%) назначают циклическую терапию эстрогенами (этинилэстрадиол, прогинова) и гестагенами (норколут, оргаметрил, утрожестан, дюфастон).
При достаточном и повышенном уровне эстрогенизации (шеечный индекс 8 баллов, КПИ 35–70%) проводят лечение гестагенами во 2–ю половину цикла: норколут – 5–10 мг с 16–го по 25–й день, дюфастон – 10–20 мг с 11–го по 25–й день цикла, 17–ОПК – 125–250 мг на 16–й и/или 18–й день цикла или комбинированными эстроген–гестагенными препаратами с преобладанием гестагенного компонента (марвелон, ригевидон, новинет, жанин) по контрацептивной схеме в течение 3–4 месяцев.
Для восстановления репродуктивной функции используются стимуляторы овуляции (антиэстрогены, рекомбинантные гонадотропины).
Длительная персистенция или атрезия фолликулов
Этот вариант ановуляторных ДМК клинически характеризуется нарушением ритма менструаций со склонностью к задержкам, которые сменяются вначале скудными, а затем обильными и длительными кровянистыми выделениями. Период аменореи при персистенции фолликула длится 4–8 недель, при атрезии фолликулов – 3–4 месяца и более. Длительность кровотечения также может быть различной: от 2–4 недель до 1,5–2 месяцев и более, а количество теряемой крови – от обильных, опасных для жизни кровотечений до умеренных, незначительных. Как правило, кровотечение безболезненно.Обильное и длительное кровотечение приводит к развитию анемии, которая сопровождается слабостью, головокружением, обмороками, бледностью кожных покровов. Возможны вторичные нарушения в системе гемостаза.
Диагноз ставится на основании клинической картины (кровотечение после задержки менструации при отсутствии органических заболеваний гениталий), подтверждается тестами функциональной диагностики и данными гистологического исследования соскоба эндометрия. Базальная температура при ановуляторных ДМК всегда монофазная. При персистенции фолликула тесты функциональной диагностики свидетельствуют о повышенном уровне эстрогенов, при атрезии – о гипоэстрогении. Морфологическая картина эндометрия разнообразна: ранняя и поздняя пролиферация, железистая и железисто–кистозная гиперплазия, полипоз, атипическая гиперплазия. Атрофия слизистой может наблюдаться при ДМК в пред– и постменопаузе.
Поскольку ДМК – это «диагноз исключения», объем обследования должен быть расширен для выявления других возможных причин кровотечения.
В юношеском возрасте необходимо исключить первичные нарушения в системе гемостаза (тромбоцитопатии, идиопатическую тромбоцитопеническую пурпуру, синдром Виллебранда), туберкулез гениталий, фолликулому и дисгерминому яичников, миому матки, внутренний эндометриоз, инородное тело влагалища, патологию печени, рак шейки и тела матки.
В детородном возрасте ДМК необходимо дифференцировать с нарушенной беременностью (маточной или внематочной), плацентарным полипом, пузырным заносом, хорионкарциномой, острыми и подострыми воспалительными заболеваниями придатков и матки, миомой, эндометриозом, раком шейки и тела матки, поликистозом яичников, полипами и эрозией шейки матки.
В предменопаузальном периоде в первую очередь следует исключить рак тела матки, эстрогенпродуцирующую опухоль и рак яичников с метастазами в матку, миому матки и эндометриоз, эрозию и полипы шейки матки, редко – воспалительные процессы. При кровотечении в постменопаузе необходимо исключить рак шейки и тела матки, рак маточной трубы, гормонопродуцирующие опухоли яичников, сенильный кольпит.
Для выявления или исключения перечисленной выше патологии необходимо провести исследование времени свертывания крови и длительности кровотечения, количества и функциональной активности тромбоцитов, коагулограммы, функции печени, ультразвуковое сканирование матки и придатков, применить эндоскопические методы (гистероскопию, кольпоскопию, у девочек – вагиноскопию, лапароскопию).
Однако ведущим в диагностике является морфологическое исследование эндометрия, полученного при выскабливании матки.
Лечение ДМК начинают с мероприятий по остановке кровотечения, т.е. гемостаза. С этой целью используют симптоматические средства, рефлексотерапию, гормоны и выскабливание матки.
В качестве симптоматических средств для уменьшения кровопотери назначают препараты, усиливающие сокращение матки (окситоцин, метилэргометрин – по 0,5 мл внутримышечно 2–3 раза в сутки, отвар крапивы, пастушьей сумки); влияющие на процессы свертывания крови (10% раствор кальция глюконата – 10 мл внутривенно или по 0,5 г 3 раза в день внутрь, 1% раствор викасола – 3–5 мл внутримышечно или по 0,1–3 г в день внутрь, 1% раствор памба – 5–10 мл внутривенно, транексам 1–3 г в сутки); ангиопротекторы (12,5% раствор дицинона – 2 мл в вену или в мышцу 3 раза в день или по 0,5 г внутрь каждые 4–6 ч). Лечение продолжают до 7 дней. С симптоматического гемостаза начинают лечение ювенильных ДМК у девочек до 12 лет. Во всех остальных случаях он используется как вспомогательный метод.
В качестве рефлекторных методов остановки кровотечения применяется электро– или лазеростимуляция шейки матки, электро– или лазеропунктура.
Наиболее эффективным методом остановки кровотечения является выскабливание матки, которое должно проводиться под контролем гистероскопии. С него следует начинать оказание помощи при ДМК в репродуктивном, пред– и постменопаузальном периодах. У девочек к выскабливанию матки прибегают при отсутствии эффекта от медикаментозного гемостаза и по жизненным показаниям при интенсивном кровотечении с тяжелой анемией (гемоглобин 70 г/л, гематокрит 0,20 л/л). Лечебно–диагностическое выскабливание у девочек рекомендуют также производить при рецидивирующих скудных длительных выделениях, продолжительности заболевания более двух лет, а также при обильных кровотечениях на фоне гипоталамических нарушений.
Гормональный гемостаз достигается использованием эстрогенов, монофазных комбинированных эстроген–гестагенных препаратов или сочетанием эстрогенов и андрогенов.
В юношеском возрасте гормональный гемостаз показан при обильном кровотечении с умеренной анемией у девочек старше 12–13 лет, отсутствии эффекта от симптоматической терапии при умеренных и длительных кровянистых выделениях. Противопоказанием могут быть болезни печени, гиперкоагуляция и ревматизм в стадии обострения. Для остановки кровотечения используют эстрогены и комбинированные эстроген–гестагенные препараты. В качестве эстрогенного гемостаза применяют фолликулин по 10.000–20.000 ед внутримышечно, микрофоллин – по 0,05 мг, эстрофем – по 2 мг, эстрадиола валерат – по 2 мг внутрь каждые 3–4 ч до остановки кровотечения. Гемостаз наступает обычно в пределах 24 ч. Затем эстрогены вводят в течение 2–3 недель с постепенным снижением дозы на 30–50% (микрофоллин – на 1 таблетку в день). По окончании приема эстрогенов назначают гестагены в течение 6–8 дней.
Комбинированные эстроген–гестагенные препараты (овидон, микрогинон, минизистон, ригевидон, марвелон) с целью гемостаза назначают по 1/2 таблетки каждые 2–3 ч до 2–3 таблеток в день в возрасте до 14–15 лет и до 4–6 таблеток в день девочкам старше 16 лет. По достижении гемостаза доза постепенно снижается до 1 таблетки в день, и прием продолжается до 21 дня. После отмены препаратов через 2–4 дня наступает менструальноподобная реакция.
В репродуктивном и предменопаузальном возрасте для гемостаза используют чаще всего монофазные комбинированные эстроген–гестагенные препараты (овидон, ановлар, марвелон, ригевидон) до 6 таблеток в день до остановки кровотечения, после чего дозу постепенно снижают до 1–2 таблеток в день и продолжают лечение до 21 дня, считая от 1–го дня гемостаза.
В позднем репродуктивном возрасте можно использовать внутримышечное введение эстрадиола дипропионата – 1 мг (0,1% раствор – 1 мл) и тестостерона пропионата – 50 мг (5% раствор – 1 мл): в 1–й день – 3 инъекции с интервалами 1–3 ч, на 2–й день – 2, на 3–й – 1. Гемостаз наступает через
24–32 ч, а через 6–8 дней – менструальноподобное кровотечение с полным отторжением эндометрия. Гормональный гемостаз в этих возрастных группах может быть использован при отсутствии полного эффекта от выскабливания матки или, по крайней мере, в тех случаях, когда информация о состоянии эндометрия была получена в пределах 6–8 месяцев, предшествующих рецидиву ДМК.
Параллельно с остановкой кровотечения проводится общая терапия, включающая седативные средства, противоанемические препараты (конферон, ферлатум, ферковен), витамины (В6, В12, Р, фолиевая кислота).
Переливание эритроцитарной массы и плазмы производится только при наличии показаний (тяжелая анемия, гематокрит ниже 0,20 л/л). При гиповолемии проводится инфузионная терапия препаратами декстрана (реополиглюкин), кристаллоидами (ацесоль, дисоль). У девочек при необходимости гемотрансфузии лучше переливать кровь близких родственников, совместимую по группе и резус–принадлежности, или отмытые донорские эритроциты.
Следующим важным этапом лечения больных ДМК является проведение реабилитационных мероприятий, направленных на предупреждение рецидивов кровотечения. Объем этих мероприятий и выбор медикаментозных средств должны определяться индивидуально в зависимости от возраста больной, уровня эстрогенизации, морфологической картины эндометрия, наличия экстрагенитальной патологии и противопоказаний к назначению тех или иных гормональных препаратов.
К общим реабилитационным мероприятиям следует отнести устранение отрицательных эмоций, физического и умственного переутомления; борьбу с инфекциями и интоксикациями, хронической анемией; выявление и лечении экстрагенитальной патологии.
Гормональная коррекция менструальной функции преследует определенные цели в различных возрастных группах больных ДМК. В юношеском и репродуктивном возрасте основные усилия должны быть направлены на регуляцию функции яичников с восстановлением нормальных овуляторных циклов и репродуктивной функции (в период половой зрелости), в перименопаузальном периоде – на профилактику предрака и рака эндометрия, подавление функции яичников и прекращение менструаций.
При ювенильных ДМК у девушек с низким уровнем эстрогенизации для регуляции менструальной функции рекомендуется циклическая гормональная терапия: назначают со 2–3–го дня цикла эстрогены {микрофоллин – по 0,05 мг, прогинова – по 2 мг, эстрофем – по 2 мг) с последующим переходом на гестагены с 15–го по 25–й день цикла (1%раствор прогестерона – 1 мл внутримышечно, норколут – по 5 мг, дюфастон – по 20 мг, утрожестан – по 200 мг, лютенил – по 5 мг) в течение 2–3 месяцев.
При умеренной и повышенной эстрогенной насыщенности используются гестагены за 8–10 дней до предполагаемого срока менструации (норколут – 5 мг, прогестерон – 10 мг в день в течение 6–8 дней, 17–ОПК – 125 мг внутримышечно однократно и др.) или комбинированные эстроген–гестагенные препараты моно– (ригевидон, микрогинон, регулон) или трехфазные (трирегол, милване, триквилар) в контрацептивном режиме в течение 3 месяцев. Если после проведенного в течение 3 месяцев гормонального лечения спонтанные овуляторные циклы не восстанавливаются, что подтверждается данными обследования, тестами функциональной диагностики в циклах отмены, то лечение продолжают до 6 месяцев.
В период половой зрелости целью гормональной терапии является регуляция нормального ритма менструаций, профилактика гиперпластических процессов эндометрия и восстановление репродуктивной функции. При ДМК на фоне атрезии фолликулов и сниженного уровня эстрогенов для регуляции менструального цикла чаще всего используют комбинированные эстроген–гестагенные препараты (овидон, ригевидон, белара, жанин, ярина и др.) в контрацептивном режиме в течение 3–4 месяцев; при персистенции фолликула, наряду с комбинированными эстроген–гестагенными препаратами, используют чистые гестагены с 16–го по 25–й день цикла (норколут, оргаметрил, прималутнор – по 5 мг, дюфастон – по 10–20 мг, 17–ОПК – по 125–250 мг, депо–провера – по 250 мг внутримышечно на 16–й и/или 18–й день цикла).
Для восстановления репродуктивной функции у женщин в возрасте до 35 лет применяют кломифен, при снижении функции гипофиза – гонадотропины, назначая последовательно аналоги ФСГ (антрогон, пурегон, фоллистиман, меногон, менопур) с 5–го дня цикла по 75–100 ЕД с постепенным увеличением дозы через каждые 3–4 дня под контролем тестов функциональной диагностики (шеечный индекс не более 9 баллов) и фолликулометрии (диаметр фолликула 18–20 мм) с последующим введением овуляторной дозы аналога ЛГ (хорагон, прегнил, профази, луверис, овитрел) на 14–15–й день цикла.
В предменопаузальном периоде основная цель гормональной коррекции – профилактика и лечение гиперпластических процессов эндометрия и выключение менструальной функции (после 48–50 лет).
До 45 лет при отсутствии противопоказаний допустима гормонотерапия, регулирующая ритм менструаций и обеспечивающая профилактику гиперплазии эндометрия. С этой целью назначают комбинированные эстроген–гестагенные препараты с повышенным содержанием гестагенного компонента (ановлар, овулен, демулен–35) с 5–го дня условного цикла, аналоги норэтистерона (норколут, примолутнор) – по 5–10 мг с 16–го по 25–й день после выскабливания, 17–ОПК – по 125 мг 2–3 раза во 2–й половине цикла или депо–провера по 250 мг на 16–й и/или
18–й день цикла. В возрасте 48–55 лет для выключения менструальной функции гестагены назначают в непрерывном режиме в течение 6–9 месяцев. Женщинам старше 50 лет, особенно при гипопластическом или атрофическом состоянии эндометрия, предпочтительнее назначать андрогены: омнадрен–250 или сустанон–250 – по 1 мл внутримышечно раз в месяц, 10%раствор тестэната – по 1 мл 2 раза в месяц в течение 3–4 месяцев. Затем можно перейти на прием метилтестостерона по 5–10 мг в день под язык в течение 1–2 месяцев.
Для лечения климактерических кровотечений и гиперплазии эндометрия используют производное 19–норстероида нового поколения – гестринон по 2,5 мг 2 раза в неделю, антигонадотропин даназол по 400 мг ежедневно в непрерывном режиме в течение 4–6 месяцев, агонист гонадолиберина золадекс (гозерелин) по 3,6 мг под кожу передней брюшной стенки 1 раз в 28 дней (на курс 3–6 инъекций).
Хирургическое лечение по относительным показаниям может быть рекомендовано больным с рецидивирующей железисто–кистозной гиперплазией эндометрия на фоне эндокринно–обменных нарушений (сахарный диабет, ожирение), гипертонической болезни, заболеваний печени, вен.
Абсолютными показаниями к радикальному хирургическому лечению больных с ДМК являются: предрак эндометрия (атипическая гиперплазия эндометрия, аденоматоз, аденоматозные полипы) в сочетании с аденомиозом, миомой любой локализации, патологическими процессами в яичниках (увеличение одного или двух яичников), аденокарцинома, подслизистое расположение узлов миомы, узловатая форма аденомиоза, сочетание аденомиоза и миомы матки.
При наличии противопоказаний для гормонального и хирургического лечения альтернативой могут быть аблация (электрическая, лазерная, термальная, микроволновая), гистерорезектоскопия, криодеструкция эндометрия жидким азотом или введение внутриматочной системы с левоноргестрелом «Мирена».
В постменопаузальном периоде после остановки кровотечения лечение должно быть направлено на подавление менструальной функции. При железистой и железисто–кистозной гиперплазии эндометрия назначают 17–ОПК по 125 мг 2 раза в неделю в течение 6–8 месяцев с последующим гистологическим исследованием соскоба эндометрия. Предрак эндометрия предпочтительнее лечить хирургическим методом. При наличии противопоказаний назначают 17–ОПК по 125–250 мг 2 раза в неделю до 12 месяцев или препараты провера по 400– 600 мг 1 раз в неделю в течение 3 месяцев.
Диспансерное наблюдение больных с ДМК осуществляется в условиях женской консультации в течение года после восстановления нормальных менструальных циклов или наступления стойкой менопаузы.
Овуляторные ДМК
Овуляторные ДМК, обусловленные нарушением функции желтого тела, встречаются у большинства больных. В отечественной литературе выделяют в основном два варианта таких нарушений: укорочение лютеиновой фазы (гиполютеинизм) и удлинение лютеиновой фазы (гиперлютеинизм или персистенция желтого тела). С.Л Pauerstein выделяет 6 вариантов ДМК с нарушениями функции желтого тела.1–й вариант. У некоторых женщин отмечаются редкие (3–4 раза в год), но обильные месячные. Для такого типа нарушений характерно замедленное развитие фолликула и неполноценная короткая лютеиновая фаза, что подтверждается морфологическими изменениями эндометрия: секреторная трансформации запаздывает на 2 дня от начала лютеиновой фазы, установленной по базальной температуре.
2–й вариант. Созревание фолликула и продолжительность фолликулярной фазы нормальные, но желтое тело оказывается короткоживущим, в результате клинически отмечается укорочение общей продолжительности менструального цикла менее 21 дня. Этот вариант нарушений функции желтого тела подтверждается тестами функциональной диагностики: нарастание симптома «зрачка», «папоротника», шеечного индекса к 13–14 дню цикла, происходит подъем базальной температуры на 0,4–0,6 °С, но длится он всего 3–7 дней.
3–й вариант. Характеризуется мажущими выделениями перед менструацией. При этом отмечается нормальная продолжительность функционирования желтого тела, но неадекватная секреция прогестерона. Подъем базальной температуры происходит всего на 0,2–0,3 °С. При биопсии эндометрия выявляются неполноценная периваскулярная децидуальная реакция стромы, большое содержание лейкоцитов, слабая извитость желез, нарушение разделения эндометрия на компактный и спонгиозный слои.
4–й вариант. Обусловлен персистенцией желтого тела, которое продуцирует прогестерон в количестве, недостаточном для нормального отторжения эндометрия (синдром неполного отторжения эндометрия). Менструации при таком типе нарушения регулярные, но обильные и длительные. Диагноз ставится на основании результатов биопсии эндометрия, произведенной на 5–й день кровотечения: характерно сочетание участков желез в стадии секреции, с участками желез в стадии регенерации.
При персистенции желтого тела с нормальной секрецией прогестерона продолжительность менструального цикла нормальная или несколько больше обычной. Полагают, что это связано с длительным выделением ЛГ и пролактина. Продолжительность фолликулярной фазы нормальная, лютеиновой – увеличена. Длительное действие прогестерона на матку приводит к снижению ее тонуса и увеличению размеров, разрастанию секреторного эндометрия и нарушению его отторжения. Вследствие того что прогестерон действует как антиэстроген, замедляется процесс регенерации слизистой. Снижение сократительной способности матки и нарушение регенерации слизистой приводят к увеличению длительности и величины менструальной кровопотери. Данный вид нарушений менструальной функции необходимо дифференцировать с прерывающейся маточной беременностью. Персистенцию желтого тела можно заподозрить, если при затянувшемся менструальном кровотечении на 5–8–й день после его начала не происходит снижения базальной температуры и остается высоким уровень прогестерона. При морфологическом исследовании соскоба выявляются участки слизистой, секреторно преобразованной, не отличающейся от прегравидарной, и участки в стадии очень ранней регенерации, строма сморщена.
5–й вариант. Клинически проявляется задержкой менструации на несколько недель с последующей гиперменореей и обусловлен персистенцией кисты желтого тела, которая секретирует эстрогены и прогестерон в количествах, достаточных для предотвращения отторжения эндометрия. Это состояние следует дифференцировать с внематочной беременностью, так как имеется задержка менструации, образование в области придатков и боли, связанные с наличием кисты желтого тела. Морфологическое исследование соскоба эндометрия, произведенного с целью остановки кровотечения, дает картину десквамации на фоне децидуальных изменений стромы.
6–й вариант. Кровотечения в середине цикла, по–видимому, связаны с дисфункцией гипофиза и изменением секреции ЛГ, что приводит к нарушению соотношения эстрогенов и прогестерона. После овуляции секреция эстрогенов резко снижается, тогда как продукция прогестерона тормозится незначительно. Клинически это приводит к появлению кровянистых выделений: от незначительных в течение суток до обильных в течение нескольких дней у 20% больных. В этом случае женщины жалуются на частые менструации – каждые 2 недели (псевдополименорея), появляющиеся без каких–либо предвестников. Иногда выделения сопровождаются болью в животе, слабостью, диспептическими и диэнцефальными нарушениями. Диагноз ставится на основании появления кровянистых выделений в середине цикла и тестов функциональной диагностики: симптомы «зрачка» и «папоротника» нарастают к 14–му дню цикла, но резко уменьшаются после овуляции; базальная температура после овуляторного падения медленно повышается.
ДМК по типу укорочения фолликулярной фазы цикла может быть следствием послеродовой, послеабортной инфекции, наблюдается при вегетоневрозе, тиреотоксикозе, в юношеском и предменопаузальном периодах. При этом варианте овуляторного ДМК ритм менструаций правильный, но продолжительность цикла укорачивается до 14–21 дня, менструации более обильные (особенно в первые 2–3 дня) и затяжные. Это связано с нарушением процессов регенерации и пролиферации на фоне пониженной секреции эстрадиола. Диагноз подтверждается тестами функциональной диагностики: по данным базальной термометрии овуляция сдвинута к 7–10–му дню цикла, когда отмечается подъем базальной температуры, КПИ. Лютеиновая фаза длится 10–12 дней. При гистологическом исследовании соскоба эндометрия накануне месячных выявляется его секреторная трансформация.
ДМК по типу меноррагий может наблюдаться при нормальном уровне гормонов. Увеличение менструальной кровопотери объясняют повышенной внутриматочной концентрацией простагландинов у таких больных, так как некоторые из них реагируют на ингибиторы синтеза простагландинов.
Для лечения больных овуляторными ДМК, независимо от характера нарушений, широко применяются комбинированные эстроген–гестагенные препараты, которые временно подавляют овуляцию и тем самым предупреждают рецидивы ДМК. Их назначают в контрацептивном режиме в течение 3 циклов.
При кровотечениях, обусловленных неполноценностью лютеиновой фазы (укорочение, недостаточная секреция прогестерона), показано лечение гестагенами, которые назначают за 6–7 дней до начала менструации или через 5–6 дней после подъема базальной температуры: прогестерон – 10 мг (1% раствор – 1 мл) внутримышечно, норколут – по 5–10 мг, медроксипрогестеронацетат 10 мг внутрь и др. Гестагены пролонгированного действия вводятся за 10–12 дней до начала менструации: 17–ОПК – 125 мг (12,5% раствор – 1 мл) внутримышечно. Для стимуляции функции желтого тела можно вводить аналоги ЛГ после овуляции.
При гиперфункции (персистенции) желтого тела выскабливание матки с целью остановки кровотечения уже может привести к выздоровлению. При обильных кровотечениях дополнительно назначают эстрогены в постоянно убывающей дозе с 1–го по 25–й день цикла для усиления процесса регенерации эндометрия.
Большинство больных с укорочением фолликулярной фазы в лечении не нуждаются, но при сочетании коротких интервалов между менструациями (14 дней) с обильными кровотечениями кроме комбинированных эстроген–гестагенных препаратов можно использовать средние дозы эстрогенов со 2–го по 6–й день цикла. В предменопаузальном периоде назначают метилтестостерон по 0,005 г 2 раза в день под язык на 2, 4–й и 6–й дни цикла. При сочетании патологии с гипоплазией матки за 4–5 дней до менструации назначают 0,02 мг микрофоллина ежедневно в сочетании с сокращающими матку средствами.
При межменструальных кровотечениях дополнительно назначают небольшие дозы эстрогенов на 11–14–й день цикла (накануне овуляции) и в течение 2–3 последующих дней. У больных позднего репродуктивного возраста вместо эстрогенов назначают андрогены (метилтестостерон по 0,005 г 2–3 раза в день под язык) за 4–5 дней до срока овуляции.
Если причиной овуляторных ДМК является повышенное содержание простагландинов, то назначают ингибиторы циклооксигеназы (индометацин, метиндол, напросин) за 3–4 дня до менструации и продолжают прием препаратов до прекращения выделений.
Профилактика ДМК заключается в нормализации режима труда и отдыха, строгом соблюдении уровней психической и физической нагрузки, устранении стрессовых ситуаций, закаливании организма с рождения для повышения устойчивости к инфекционным заболеваниям, своевременном выявлении и рациональном лечении очагов инфекции, экстрагенитальных заболеваний, рациональном ведении беременности и родов.
Аменорея
Аменорея – это отсутствие менструаций в периоде полового созревания или их исчезновение на 6 и более месяцев.Аменорея может быть симптомом различных поражений репродуктивной системы, а также психических, соматических, эндокринных заболеваний и опухолей. В структуре нарушений менструальной функции аменореи составляют 10–15%.
Классификация
Классификация аменореи представлена на рис. 5.8.Аменорея может быть истинной и ложной. Истинная аменорея является следствием нарушения циклических процессов в системе гипоталамус – гипофиз – яичники – матка. При ложной аменорее (криптоменорее) циклические процессы в репродуктивной оси сохранены, но нарушено наружное выделение менструальной крови вследствие имеющегося препятствия на уровне шейки матки, влагалища или девственной плевы (атрезии или аплазии).
Истинная аменорея подразделяется на физиологическую и патологическую.
Физиологическая аменорея наблюдается у девочек в препубертатном периоде, у женщин репродуктивного возраста в период беременности и лактации; у пожилых женщин в постменопаузе.
Патологическая истинная аменорея по времени возникновения подразделяется на первичную и вторичную. Под первичной аменореей понимают отсутствие менструаций у девушек без вторичных половых признаков в 14 лет или у девушек с хорошо развитыми вторичными половыми признаками в 16 лет.
 Рис. 5.8. Классификация аменореи
Рис. 5.8. Классификация аменореи
Вторичная аменорея – это отсутствие менструаций в течение 6 месяцев и более у женщин репродуктивного возраста с предшествующей нормальной менструальной функцией при отсутствии беременности.
По уровню поражения выделяют маточную, яичниковую, гипофизарную, гипоталамическую и супрагипоталамическую патологическую истинную аменорею.
Согласно классификации ВОЗ (1973), аменореи подразделяются по уровню гонадотропных гормонов на гипергонадотропные (гипергонадотропный гипогонадизм), гипогонадотропные (гипогонадотропный гипогонадизм гипофизарный или гипоталамический) и нормогонадотропные (нормогонадотропный гипогонадизм).
С практической точки зрения наиболее приемлемы клинико–этиологические классификации, которые учитывают причины развития и/или особенности клинической картины первичной и вторичной аменореи (Dewhurst, 1974; S.S.K. Yen, 1998; И.Б. Манухин и соавт., 2001; Вл.И. Дуда и соавт., 2002). Данные представлены в виде схемы на рис. 5.9. Так, среди аменорей (первичных) выделяют аменорею с задержкой и без задержки полового развития; низким, нормальным или высоким ростом; с явлениями гирсутизма; высоким или низким уровнем гонадотропинов и гиперпролактинемией.
Общие принципы обследования и лечения. При первичной аменорее в первую очередь исключается ложная аменорея. Для нее характерно развитие вторичных половых признаков (общий осмотр). При гинекологическом осмотре выявляется препятствие для оттока менструальной крови (сплошная девственная плева, перегородка во влагалище, атрезия цервикального канала), скопление крови выше препятствия с образованием гематокольпоса, гематометры, гематосальпинксов (ректальное исследование, УЗИ–сканирование, лапароскопия), нормальное анатомическое строение яичников (УЗИ).
Для диагностики истинной первичной аменореи проводятся следующие обследования. ■ Общее клиническое обследование для исключения экстрагенитальных заболеваний, нарушения питания, патологии щитовидной железы. ■ Оценка роста и типа телосложения (женский, мужской, интерсексуальный, евнухоидный, диспластичный). Низкий или карликовый рост может быть следствием низкой секреции гормона роста (гипофизарный гипопитуитаризм), метаболических нарушений при болезни почек, синдроме мальабсорбции, при типичной форме дисгенезии гонад (синдром Шерешевского – Тернера). В последнем случае имеются характерные соматические аномалии. Низкий рост в сочетании с признаками маскулинизации характерен для врожденной формы адреногенитального синдрома. Высокий рост может быть при усилении продукции гормона роста (аденома гипофиза), чистой форме дисгенезии гонад, гипогонадотропом гипогонадизме. ■ Степень и последовательность развития вторичных половых признаков (молочные железы – половое оволосение – менархе) и гениталий. Отсутствие или слабое развитие молочных желез и полового оволосения, недоразвитие половых органов чаще являются следствием дисгенезии гонад, но могут быть и при гипоталамическом и гипофизарном гипогонадизме. Хорошо развитые молочные железы, отсутствие полового оволосения и матки, слепое влагалище характерны для тестикулярной феминизации. Нормальное соматическое и половое развитие,отсутствие матки, слепое влагалище являются признаками синдрома Рокитанского. ■ Ультразвуковое сканирование малого таза позволяет выявить наличие или отсутствие яичников, матки; оценить их строение (размеры и наличие фолликулярного аппарата в яичниках, размеры матки, состояние эндометрия). ■ Генетическое обследование проводится при первичной аменорее, когда имеются аномалии развития полового аппарата и/или соматические отклонения. Исследуются половой хроматин и кариотип. Половой хроматин очень низкий при кариотипе, содержащем У–хромосому. ■ Гормональное исследование заключается в определении уровня ФСГ, ЛГ и пролактина: высокий уровень ФСГ наблюдается при первичном поражении яичников, низкий – при первичной недостаточности гипофиза, нормальный чаще бывает при функциональных гипоталамических нарушениях. Нарушение соотношения ЛГ и ФСГ характерно для синдрома поликистозных яичников (СПКЯ). При высоком уровне пролактина показано определение уровня Т3, Т4, ТТГ для исключения первичного гипотиреоза. При гирсутизме исследуется уровень тестостерона в плазме крови или экскреция с мочой 17–КС. ■ Рентгенологическое обследование, компьютерная (КТ) или магнитно–резонансная томография (МРТ) проводятся для исключения опухолей, расположенных в области турецкого седла или супраселлярно. Его обязательно проводят при повышении уровня пролактина или при клиническом подозрении на опухоль. Внутривенную урографию следует произвести при всех случаях врожденных пороков развития матки и влагалища, так как они часто сочетаются с аномалиями мочеточников и почек. ■ Лапароскопия с биопсией гонад проводится в тех случаях, когда неинвазивные методы не позволяют точно установить их природу (яичник или яичко) или когда необходимо определить, есть ли примордиальные фолликулы и овоциты в яичнике. Реже к лапароскопии прибегают для установления наличия матки при атрезии влагалища. Возможно лапароскопическое удаление дисгенетичных гонад, особенно у больных, имеющих в кариотипе У–хромосому, или яичек при тестикулярной феминизации после формирования вторичных половых признаков в связи с высоким риском роста дисгерминомы.
 Рис. 5.9. Клинико–этиологическая классификация и алгоритм обследования больных с первичной аменореей:
ФСГ – фолликулостимулирующий гормон; ЛГ – лютеинизирующий гормон; КТ – компьютерная томография; МРТ – магнитно–резонансная томография; ПРЛ – пролатин; Т3 – трийодтиронин; Т4 – тироксин; ТТГ – тиреотропный гормон; СПКЯ – синдром поликистозных яичников; АГС – адреногенитальный синдром
Рис. 5.9. Клинико–этиологическая классификация и алгоритм обследования больных с первичной аменореей:
ФСГ – фолликулостимулирующий гормон; ЛГ – лютеинизирующий гормон; КТ – компьютерная томография; МРТ – магнитно–резонансная томография; ПРЛ – пролатин; Т3 – трийодтиронин; Т4 – тироксин; ТТГ – тиреотропный гормон; СПКЯ – синдром поликистозных яичников; АГС – адреногенитальный синдром
Алгоритм обследования больных с первичной аменореей представлен на рис. 5.9.
Обычно больные с вторичной аменореей имеют матку, влагалище, эндометрий, который отвечает на введение половых стероидных гормонов, и яичники, реагирующие на введение гонадотропинов. Во всех случаях вторичной аменореи в первую очередь следует исключить беременность.
Порядок обследования больных с вторичной аменореей включает проведение следующих мероприятий. ■ Оценка особенностей предшествующей менструальной функции; информация о перенесенных ранее операциях на органах малого таза и приеме лекарств. ■ Выявление обстоятельств, касающихся изменений в социальном и эмоциональном окружении больной, воздействия каких–либо стрессовых факторов, в том числе тяжелой физической нагрузки и ограничений диеты. ■ Проведение общего медицинского обследования с целью выявления хронических заболеваний. ■ Оценка телосложения, массы тела, характера роста волос, состояния молочных желез и органов малого таза, функции щитовидной железы. ■ Исследование содержания гормонов и оценка уровня поражения гипоталамо–гипофизарно–яичниковой системы: уровни ФСГ, ЛГ и яичниковых гормонов низкие при гипоталамической или гипофизарной недостаточности; при яичниковой недостаточности уровни гонадотропинов, особенно ФСГ, высокие; нарушение соотношения ФСГ и ЛГ в сторону увеличения последнего (1:3) и увеличение уровня тестостерона подтверждают наличие болезни или синдрома ПКЯ. ■ Проведение проб: с прогестероном и циклической с эстрогенами и прогестероном. ■ Для подтверждения маточной аменореи – проба с гонадотропинами; для подтверждения гипоталамо–гипофизарного уровня поражения – проба с гонадолиберином. ■ Ультразвуковое сканирование для уточнения состояния эндометрия и фолликулярного аппарата яичников. ■ Компьютерная или магнитно–резонансная томография с целью визуализации гипофизарной ямки и исключения селлярных и супраселлярных опухолей. ■ Гистероскопия для уточнения природы маточной аменореи (синдром Ашермана, туберкулезный эндометрит) и оценки состояния эндометрия. ■ Лапароскопия с биопсией яичников с целью дифференциальной диагностики синдромов преждевременного истощения яичников (отсутствуют примордиальные фолликулы) и резистентных яичников. ■ Консультация специалистов (невропатолога, психиатра, эндокринолога, терапевта). Алгоритм определения уровня поражения при аменорее представлен на рис. 5.10.
 Рис. 5.10. Алгоритм определения уровня поражения выбора метода терапии при аменорее: N – норма; J. – пониженный уровень; f – повышенный уровень
Рис. 5.10. Алгоритм определения уровня поражения выбора метода терапии при аменорее: N – норма; J. – пониженный уровень; f – повышенный уровень
Лечение больных аменореей должно проводиться с учетом причины и уровня поражения репродуктивной системы гипоталамус – гипофиз – яичники – матка.
При центральной аменорее, обусловленной опухолью, расположенной в области турецкого седла или супраселлярно, показано хирургическое лечение (чаще транссфеноидальная аденомэктомия) и/или лучевая терапия; при пролактиноме иногда проводится лечение парлоделом. Если причиной аменореи являются последствия перенесенной нейроинфекции, травмы, то назначается противовоспалительное и рассасывающее (алоэ, ФиБС, гумизоль) лечение; проводят эндоназальную гальванизацию с витамином В1 или ионами кальция; назаначают препараты, улучшающие интракраниальный кровоток и метаболические процессы в мозге и снижающие внутричерепную гипертензию (циннаризин, танакан, ноотропил, актовегин, верошпирон).
При гипофункции щитовидной железы проводится лечение тироксином по 0,05–0,1 мг; при гиперплазии надпочечников, связанной с дефицитом фермента 21–гидроксилазы, – дексаметазоном по 0,5 мг под контролем уровня 17–ОН–прогестерона, при функциональной гиперпролактинемии – агонистами ДА (парлодел, норпролак, достинекс).
Для лечения психогенно–стрессовых аменорей необходимо устранение стрессорного фактора (в том числе повышенных физических нагрузок), нормализация массы тела; показана психотерапия. Эти мероприятия сами по себе могут привести к восстановлению менструальной функции.
Гормональное лечение включает назначение половых стероидных гормонов (эстрогенов и прогестерона), кломифена, гонадотропинов и аналогов гонадолиберина (см. рис. 5.10).
Циклическая заместительная гормональная терапия эстрогенами и гестагенами показана, в первую очередь, больным с яичниковой аменореей. При первичной аменорее сначала назначают эстрогены (микрофоллин, прогинова, эстрофем – по 1–2 таблетки в день в течение 21 дня) для стимуляции вторичных половых признаков, роста матки (если она есть) и эндометрия, закрытия зон роста костей, после чего переходят на циклический прием эстрогенов и гестагенов (дюфастон – 20 мг, утрожестан – 200 мг, провера – 20 мг, норколут – 5–10 мг) или комбинированных препаратов (циклопрогинова, дивина, фемостон, трирегол, триквилар), содержащих небольшие дозы этих гормонов. Гормональная терапия проводится практически пожизненно, поэтому через каждые 6 месяцев желательно делать перерыв на 1–2 месяца с назначением гепатопротекторов и витаминов. Циклическая терапия половыми стероидами назначается также при центральных формах аменореи (гипоталамической и гипофизарной) для восстановления менструальной функции.
Восстановление репродуктивной функции при агенезии и дисгенезии гонад, тестикулярной феминизации невозможно. В этих случаях при наличии матки восстановление фертильности достигается оплодотворением донорской яйцеклетки.
Гонадотропины (меногон, пурегон, метродин, хорагон) назначают при гипофизарной аменорее, главным образом для восстановления репродуктивной функции.
При гипоталамической или психогенной аменорее для восстановления репродуктивной функции методом выбора является использование аналогов гонадолиберина (бусерелин, лютрелеф), которые вводятся в импульсном режиме с помощью аппарата «Цикломат» внутривенно или подкожно каждые 60, 90 или 120 мин или в виде спрея интраназально каждые 2 ч.
Антиэстроген кломифен может применяться при функциональной психогенной аменорее для стимуляции овуляции по общепринятой методике. При отсутствии эффекта показано введение гонадолиберина в импульсном режиме.
Лечение маточной аменореи, не связанной с отсутствием матки, заключается в разрушении внутриматочных сращений, введении протектора для предупреждения повторного образования спаек и назначении эстрогенов для стимуляции роста оставшихся островков эндометрия. При аменорее, вызванной туберкулезным эндометритом, показано специфическое лечение. Прогноз в отношении восстановления менструальной и репродуктивной функции неблагоприятный.
Первичная аменорея без задержки полового развития. В основе ложной аменореи лежит нарушение оттока менструальной крови вследствие врожденных аномалий развития полового тракта (отсутствие отверстия в девственной плеве, загименальная перегородка, поперечная перегородка влагалища в нижней, средней или верхней трети, аплазия части или всего влагалища) или атрезии цервикального канала, влагалища, гимена в результате перенесенного воспалительного процесса. Менструальная кровь, не находя выхода, скапливается выше препятствия, и со временем развиваются гематокольпос, гематометра, гематосальпинкс.
При атрезии гимена больные жалуются на периодически ноющие боли, возникающие и усиливающиеся в определенные дни, совпадающие с менструацией, в области промежности, в низу живота. Скопление больших количеств крови во влагалище может привести к нарушению мочеиспускания и дефекации. При аплазии части влагалища боли носят схваткообразный характер, интенсивность их нарастает: сначала боли появляются периодически, а с течением времени становятся постоянными. Болевой синдром может быть обусловлен и развитием эндометриоза, который обнаруживается у 70% девочек с пороками развития гениталий.
Иногда наблюдается повышение температуры тела до 37–37,8 °С вследствие всасывания пирогенных веществ из мест скопления крови или при ее инфицировании.
Вторичные половые признаки появляются своевременно, хорошо выражены, наружные половые органы развиты нормально.
Диагноз ставится на основании осмотра наружных половых органов. При атрезии гимена можно увидеть отсутствие отверстия в нем, просвечивающуюся опухоль цианотичного цвета, выбухание всей промежности. При ректальном исследовании в случаях атрезии гимена и аплазии части влагалища в малом тазу или за его пределами определяется опухолевидное образование тугоэластической консистенции (гематокольпос) размерами с 6–7–месячную беременность. Над гематокольпосом можно пропальпировать матку.
При аплазии части влагалища размеры гематокольпоса меньше, определение матки затруднено из–за развития гематометры. При аплазии всего влагалища и функционирующей матке на месте влагалища пальпируется тяж, а в малом тазу определяется увеличенная плотная болезненная матка (гематометра). Сбоку от матки может пальпироваться гематосальпинкс.
Диагноз уточняется с помощью ультразвукового исследования органов малого таза, иногда лапароскопически.
Лечение атрезии гимена хирургическое: производится рассечение гимена крестообразным разрезом 2*2 см, удаляется скопившаяся во влагалище кровь, затем формируются края отверстия путем наложения одиночных или непрерывного обвивного шва.
При частичной аплазии влагалища перед хирургическим лечением проводится вытяжение тканей с помощью кольпоэлонгатора.
Аплазия всего влагалища является показанием для создания искусственного влагалища. Однако, если аплазия влагалища сочетается с отсутствием шейки матки или цервикального канала, рекомендуется удаление матки в период полового созревания и проведение операции по созданию искусственного влагалища перед замужеством.
Маточная аменорея может быть обусловлена патологией развития эндометрия, снижением чувствительности его рецепторов к половым стероидам или деструкцией всей слизистой оболочки, чаще всего вследствие туберкулезного процесса.
Недостаточность эндометрия («немой» цикл, «немая» менструация) проявляется отсутствием менструации при сохранении циклических процессов в гипоталамо–гипофизарно–яичниковой системе. Причина патологии точно не установлена. Для клинической картины этой формы аменореи характерно нормальное соматическое и половое развитие, правильное строение наружных и внутренних половых органов. Тесты функциональной диагностики подтверждают наличие циклических изменений гормонального фона и овуляции. Однако в ответ на спад гормонов слизистая оболочка матки не отторгается, а подвергается бессимптомной инволюции. Репродуктивная функция не нарушается, проведения лечения не требуется.
Деструкция эндометрия в большинстве случаев бывает связана с перенесенным туберкулезным эндометритом и образованием фиброзных внутриматочных сращений (синдром Ашермана).
Для подтверждения диагноза необходимо проведение туберкулиновых проб, биопсии эндометрия под контролем гистероскопа с последующим морфологическим исследованием соскоба (выявляются туберкуломы и казеозные очаги). Гистеросальпингография выявляет грубые дефекты наполнения, обусловленные внутриматочными синехиями, и изменения маточных труб, указывающие на сальпингит специфической этиологии. Больным проводится общее противотуберкулезное лечение.
Для дифференциальной диагностики с другими формами аменорей используется прогестероновая проба. При отсутствии менструальноподобной реакции в ответ на введение прогестерона проводится комбинированная проба с эстрогенами и прогестероном. Отрицательная проба подтверждает маточную форму аменореи.
Для синдрома Майер – Рокитанского – Кюстнера характерно врожденное отсутствие (аплазия) матки и влагалища.
Дефект мюллеровых ходов приводит к недоразвитию или отсутствию средней части маточных труб, матки и верхнего отдела влагалища. Возможен вариант сочетания аплазии влагалища с рудиментарной солидной двойной маткой в виде тонких соединительнотканных шнуров. От рогов матки часто отходят гипопластичные трубы. Яичники нормально развиты и расположены в типичном месте. Гипоталамо–гипофизарно–яичниковая система функционирует нормально.
Больные обращаются к врачу в связи с первичной аменореей, невозможностью или болями при попытке полового сношения. При осмотре отмечается нормальный женский фенотип, хорошо развитые вторичные половые признаки. Наружные половые органы сформированы правильно. Иногда сохраняется незначительное углубление (2–3 см) между большими половыми губами (нижняя треть влагалища формируется из урогенитального синуса). При ректальном исследовании матка не определяется.
Диагностика основывается на данных клинической картины и дополнительных методов обследования. УЗИ подтверждает отсутствие матки, нормальное расположение и строение яичников. Содержание ФСГ и ЛГ в сыворотке крови в пределах нормы. Отмечаются циклические колебания уровня гонадотропинов и половых стероидных гормонов. Кариотип женский (46ХХ), содержание полового хроматина в норме. При лапароскопии яичники и фимбриальные концы маточных труб выглядят нормально. Сами трубы постепенно уменьшаются в диаметре и смыкаются по средней линии в виде горизонтального тканевого тяжа, располагающегося между мочевым пузырем и прямой кишкой. У 30–50% больных могут быть аномалии развития почек и мочевыводящих путей, поэтому им показана экскреторная урография.
Лечение. Для обеспечения нормальной половой жизни проводится хирургическое лечение (кольпопоэз). Восстановление менструальной и репродуктивной функции у больных невозможно.
Первичная аменорея с задержкой полового развития – аменорея, обусловленная нарушением развития гонад (первичная яичниковая или гипергонадотропная аменорея или гипергонадотропный гипогонадизм).
В структуре первичной аменореи дисгенезия гонад, при которой отсутствует гормонопродуцирующая ткань яичников, составляет около 30%. В результате дефицита эстрогенов отсутствует отрицательная обратная связь, что сопровождается резким увеличением секреции гонадотропинов. В основе дисгенезии гонад лежат хромосомные аномалии: от изменения количества половых хромосом до их структурных дефектов (делеции, транслокации). При выпадении гена Х–хромосомы, детерминирующего рост тела в длину, отмечается низкорослость.
Синдром Шерешевского – Тернера (типичная форма дисгенезии гонад) развивается при отсутствии одной Х–хромосомы.
При данном синдроме в эмбриональном периоде герминативные клетки вначале мигрируют в гонадные валики, но затем гибнут, вследствие чего отсутствуют функционирующие половые железы. Формируются незрелые внутренние и наружные половые органы по женскому типу, так как их дифференцировка происходит автономно, независимо от состояния гонад.
Частота синдрома Шерешевского – Тернера составляет 1:2000–1:7000 рождений. По данным ВОЗ, заболевание встречается почти у 0,02% родившихся живыми и почти в 4% случаев самопроизвольных выкидышей. Наследование заболевания не доказано.
Для больных с хромосомным набором 45ХО характерными симптомами уже при рождении являются низкая масса тела (2000–2300) при доношенной беременности, короткая шея с крыловидными складками кожи, низкая граница роста волос на затылке. Иногда обнаруживается лимфатический отек тыльной поверхности кистей и стоп. В детском и школьном возрасте отмечаются замедленный рост, отсутствие полового созревания.
У взрослых больных низкий рост (120–140 см) и диспластичное телосложение: бочкообразная грудная клетка с широко расставленными сосками молочных желез, короткая шея с кожными складками (шея сфинкса), вальгусная девиация локтевых и коленных суставов, разболтанность суставов, полая стопа, могут быть пороки развития пальцев кистей и ногтевых выемок, остеодистрофия. При осмотре можно выявить птоз, эпикантус, антимонголоидный разрез глаз, косоглазие, низко посаженные уши, высокое нёбо. Рентгенологически выявляются остеодистрофия и остеопороз губчатых костей таза, позвоночника, черепа. Костный возраст может незначительно отставать от календарного.
Вторичные половые признаки у больных не появляются: молочные железы отсутствуют, соски мягкие, слабо пигментированы. Оволосение в подмышечных впадинах и на лобке скудное (Ах1_2, Р ). Большие и малые половые губы гипопластичны, клитор развит слабо. Влагалище и матка резко недоразвиты, слизистая их атрофична. Менструации отсутствуют (первичная аменорея).
У больных может наблюдаться патология щитовидной железы (аутоиммунный тиреоидит), пороки развития почек, мочевого пузыря, мочеточников, стеноз перешейка аорты.
Наряду с типичной клинической картиной синдрома Шерешевского – Тернера существуют другие варианты, что объясняется широким диапазоном хромосомных аномалий: наличием мозаицизма с кариотипами ХО/ХХ, ХО/ХУ, ХО/ХХХ, а также структурных аберраций Х–хромосомы (изохромосома по короткому или длинному плечу, делеция длинного или короткого плеча Х–хромосомы) при кариотипе 46ХХ.
Так, при мозаицизме ХО/ХУ развивается синдром Шерешевского – Тернера с маскулинизацией: у больных наблюдается увеличение клитора и рост волос по мужскому типу. Стертые формы синдрома без выраженных соматических аномалий и с умеренной задержкой полового развития возможны при мозаицизме 45ХО/46ХХ с высоким процентом нормального клона или при структурной аберрации Х–хромосомы. Описаны единичные случаи появления менструаций у таких больных и даже наступление беременности.
Диагностика заболевания строится на основании клинических признаков, перечисленных выше, и подтверждается дополнительными методами.
Важным в постановке диагноза является исследование кариотипа и полового хроматина. Последний отсутствует при кариотипе 45ХО или снижен до 4–10% при мозаицизме 45ХО/46ХХ.
Ультразвуковое исследование выявляет на месте внутренних гениталий резко гипопластичную матку, на месте яичников – тяжи, расположенные у входа в малый таз, либо зачатки гонад без фолликулярного аппарата.
Лапароскопически обнаруживается рудиментарная или резко гипопластичная матка и рудиментарные гонады в виде белых, тонких соединительнотканных тяжей или тонких пластинок.
Во влагалищных мазках отмечается картина атрофии (преобладают базальные и парабазальные клетки), шеечный индекс 1–2 балла, симптомы «зрачка» и «папоротника» отрицательные, что свидетельствует о резко выраженной гипоэстрогении. В крови определяются высокие уровни гонадотропинов, особенно ФСГ. Содержание эстрогенов резко снижено.
Чистая форма дисгенезии гонад возникает в более поздние сроки эмбриогенеза (6–12–я неделя внутриутробного развития). Ее причинами могут быть хромосомные аберрации, генные мутации или эмбриотоксические факторы. В случае формирования дисгенетического яичника (кариотип 46ХХ; половой хроматин в норме) фенотип остается женским. Неполноценность яичников проявляется лишь в период пубертата в виде гипогонадизма.
При дисгенезии яичек (кариотип 46ХУ, половой хроматин отсутствует) не обеспечивается регресс мюллеровых ходов и нормальная маскулинизация наружных половых органов. Это ведет к развитию матки, маточных труб, влагалища и бисексуальному строению наружных гениталий.
Первичная аменорея и инфантилизм сопровождаются нормальным или высоким ростом. У больных отмечается интерсексуальное или евнухоидное телосложение с увеличением окружности грудной клетки, фенотип женский. Соматические аномалии отсутствуют.
Вторичные половые признаки отсутствуют или недостаточно развиты: молочные железы гипопластичны, оволосение в подмышечных и лобковой областях скудное. Отмечается резко выраженное недоразвитие наружных половых органов и матки.
Диагностика учитывает уровни гормонов. Уровень ФСГ в 8–15 раз и ЛГ – в 4–5 раз превышает норму, содержание эстрогенов резко снижено. Кольпоцитологически определяется атрофический тип мазка. Экскреция 17–КС нормальная.
При ультразвуковом сканировании яичники не определяются, матка резко гипопластична или вместо нее визуализируется тяж.
Лапароскопически выявляется женский тип внутренних половых органов (гипопластичная матка и трубы), на месте яичников – тонкие белесоватые образования.
Кариотип у больных чаще всего 46ХХ и 46ХУ Половой хроматин при кариотипе 46ХУ отсутствует, при женском кариотипе (46ХХ) содержание его может быть нормальным.
Этиология и патогенез смешанной формы дисгенезии гонад окончательно не выяснены. Возможно, вследствие патологии половых хромосом нарушается дифференцировка яичек, развивается их функциональная недостаточность, проявляющаяся в эмбриогенезе.
При этой особой форме дисгенезии гонад на одной стороне обнаруживают рудиментарный тяж, не функционирующий как яичник, на другой – дисгенетическое яичко с различно выраженной гормональной активностью, что и определяет фенотип и строение половых органов. У больных выделяются различные варианты кариотипов: ХО /ХУ, ХУ, но чаще всего определяется мозаицизм типа ХО/ХУ
Клинические проявления зависят от процентного соотношения нормального и аберрантного клона клеток. Для больных характерен женский, реже мужской фенотип, интерсексуальное строение наружных половых органов с преобладанием женского типа, наличие гипопластичных влагалища и матки (не происходит рассасывание мюллеровых производных).
Рост больных нормальный, но может быть его задержка. Молочные железы отсутствуют. Имеется гипертрофия клитора, часто сохраняется урогенитальный синус. В некоторых случаях в пубертатном периоде проявляется маскулинизация: оволосение по мужскому типу, гипертрихоз, низкий тембр голоса.
Соматические аномалии отсутствуют.
Диагностика основывается на данных клинической картины, УЗИ (матка в виде тяжа), лапароскопии (обнаруживается недоразвитая матка, со стороны рудиментарного белесоватого тяжа – маточная труба, со стороны дисгенетичного яичка – семенной канатик или маточная труба). Яичко может находиться на месте яичника, в паховом канале, иногда – в рудиментарной мошонке. Отмечается склонность к малигнизации.
Половой хроматин резко снижен до 3–7% или отрицательный.
При гормональном исследовании отмечается повышение содержания андрогенов; уровень гонадотропинов резко повышен, а эстрогенов резко снижен.
Первичная яичниковая недостаточность, не связанная с патологией половых хромосом, может быть следствием длительного действия различных повреждающих факторов (интоксикация, инфекция, радиация и др.) в период эмбриогенеза, что ведет к замедлению структурной и функциональной дифференциации яичника вплоть до гибели герминативных элементов.
Чаще всего яичниковую недостаточность вызывают паротит (особенно в фетальном и пубертатном периодах) и коревая краснуха.
Первичная яичниковая недостаточность может быть обусловлена нечувствительностью морфологически полноценных яичников к эндогенной гонадотропной стимуляции (синдром резистентных яичников), а также врожденным дефектом фермента 17а–гидроксилазы, что ведет к нарушению продукции стероидов надпочечниками и яичниками, включая глюкокортикоиды, андрогены и эстрогены. Дефицит половых стероидов является причиной полового инфантилизма и первичной аменореи, а избыток продукции дезоксикортикостерона в надпочечниках приводит к развитию артериальной гипертензии.
Отсутствие или резкое снижение гормональной функции яичников приводит к увеличению секреции гонадотропинов. Уровень ФСГ в 5–6,5 раза, а ЛГ в 1,5–2 раза превышает предовуляторный пик в менструальном цикле женщины репродуктивного возраста. Может усиливаться секреция соматотропина, что отражается на соматическом развитии в пубертатном периоде: высокий рост с преобладанием продольных размеров тела, узкая грудная клетка, узкий таз, длинные конечности.
Для данной группы больных характерны отсутствие менструаций, резко выраженный половой инфантилизм. Молочные железы неразвиты, половое оволосение слабо выражено. При гинекологическом осмотре выявляются недоразвитие и слабая пигментация больших и малых половых губ, гимен тонкий, кольцевидный, отмечается сухость вульвы и слизистой входа во влагалище. Влагалище узкое, складчатость его стенок не выражена. Матка маленькая, круглая, шейка длинная. В редких случаях у больных при недостаточности фермента 17а–гидроксилазы в яичнике имеются примордиальные фолликулы, которые на определенном этапе синтезируют эстрогены, что обусловливает развитие молочных желез и появление нескольких менструальноподобных кровотечений, поэтому чаще всего таких пациенток относят к больным со вторичной аменореей.
Для диагностики применяют тесты. Тесты функциональной диагностики свидетельствуют о резко выраженной эстрогенной недостаточности: симптомы «зрачка» и «папоротника» отрицательные, шеечный индекс составляет 1–3 балла, в мазке парабазальные клетки составляют 70–80%.
Уровень гонадотропинов в крови высокий. Экскреция эстрогенов снижена, прегнандиол не определяется.
У больных с синдром недостаточности 17а–гидроксилазы отмечается повышение образования 17–ОН–прогестерона и дезоксикортикостерона надпочечниками.
При рентгенологическом исследовании выявляется отставание костного возраста от календарного.
УЗИ выявляет значительное уменьшение размеров матки и яичников вплоть до полного отсутствия последних. Расположение яичников более высокое – на уровне входа в малый таз. Кариотип женский – 46ХХ.
Лечение больных с первичной яичниковой аменореей проводится заместительной терапей половыми гормонами. Лечение следует начинать как можно раньше, с 10–12 лет. Это способствует устранению диспропорционального соматического развития, уменьшению проявлений полового инфантилизма, улучшению нервно–психического состояния больных, обеспечению накопления массы костной ткани, наиболее приближенному к физиологическому процессу.
На 1–м этапе в течение нескольких месяцев (от 2 до ■ назначают только эстрогены для стимуляции развития вторичных половых признаков, формирования фигуры по женскому типу, увеличения размеров матки и стимуляции пролиферации эндометрия. При нормальном росте используются небольшие, а при высоком росте – большие дозы эстрогенов (микрофоллин по 0,05 мг или 0,2–0,25 мг соответственно) для ускорения закрытия зон роста. Рекомендуется использовать препараты, содержащие природные (прогинова, эстрофем, дивигель) или конъюгированные (премарин) эстрогены в течение 21 дня каждого месяца. Высокорослым больным с низким костным возрастом для быстрого появления вторичных половых признаков и замедления роста предпочтение следует отдать дивитрену (содержит 70 таблеток эстрадиола валерата по 2 мг; 14 таблеток эстрадиола валерата в сочетании медроксипрогестерона ацетатом по 20 мг и 7 таблеток плацебо).
После развития вторичных половых признаков или при появлении менструальноподобной реакции переходят на циклическую гормональную терапию: в течение 21 дня назначают эстрогены, затем 7 дней гестагены (дюфастон – по 20 мг, утрожестан – по 200 мг, норколут – по 5–10 мг в день). После 25 лет допустимо назначение моно– или трехфазных комбинированных эстроген–гестагенных препаратов.
Лечение следует проводить в течение всего детородного периода под наблюдением врача с УЗИ–контролем.
У больных с низким ростом (синдром Шерешевского – Тернера) на 1–м этапе проводят терапию по стимуляции роста. С этой целью используют гормоны щитовидной железы (тиреоидин, тиреокомб по 50–100 мг), анаболические стероиды (нероболил по 1 мл 1 раз в месяц илиретаболил по 1 мл 1 раз в 3 месяца внутримышечно курсами по 4–5 месяцев с перерывами в 2–3 месяца), аналоги гормона роста (генотропин), инсулинотерапию. Имеются данные о том, что заместительная терапия натуральными эстрогенами, начатая в возрасте 14–18 лет, существенно не влияет на закрытие зон роста костей, поэтому может быть применена у низкорослых пациенток.
Хирургическое лечение (удаление рудиментарных тяжей гонад) показано при дисгенезии гонад, если в кариотипе больных имеется У–хромосома или ее фрагменты, а также при подозрении на развитие опухоли гонады (гонадобластомы или дисгерминомы) у больных с кариотипами 45ХО, 46ХХ или их мозаичными вариантами. При гистологическом подтверждении злокачественности процесса в удаленной гонаде гормонотерапия не проводится. Возможно применение фитоэстрогенов, которые не обладают пролиферативной активностью. Воспитание детей проводится с ориентацией на женский пол.
В случае смешанной дисгенезии гонад при мужской соматической и психической ориентации яичко, расположенное в мошонке, следует оставить. При женском типе строения наружных половых органов и соответствии психики соматическому виду яичко удаляется, проводится пластика молочных желез и влагалища.
Синдром тестикулярной феминизации (ложный мужской гермафродитизм) – это аутосомное заболевание с рецессивным наследованием, связанным с полом (передается по женской линии). Частота патологии составляет 1 случай на 20.000 всех живорожденных.
В основе заболевания лежит отсутствие или врожденный дефект рецепторов андрогенов в органах–мишенях, а также генетически обусловленный дефект фермента 5а–редуктазы, превращающей тестостерон в дигидротестостерон. Последний обеспечивает развитие полового оволосения и вирилизацию половых органов. В результате нечувствительности или отсутствия периферических рецепторов андрогенов в тканях–мишенях у лиц мужского пола с кариотипом 46ХУ, нормально развитыми и продуцирующими тестостерон яичками формируется женский фенотип.
Нарушения развития начинаются на 3–м месяце внутриутробного развития. Наличие У–хромосомы обеспечивает формирование тестикул. Стимуляция яичек хорионическим гонадотропином вызывает в них образование тестостерона и тормозящей мюллеровой субстанции (гормон эмбрионального тестикула), которая подавляет развитие мюллеровых протоков и формирование маточных труб и матки. Развития вольфовых протоков и мужских гениталий также не происходит, несмотря на присутствие тестостерона, так как его рецепторы либо отсутствуют, либо не функционируют. В результате происходит запрограммированное развитие плода с наружными женскими гениталиями. К моменту рождения яички могут оставаться в брюшной полости, вырабатывают тестостерон в концентрациях, соответствующих норме для мужчин, но действие его не проявляется из–за дефекта рецепторов. Часть тестостерона ароматизируется в печени и жировой ткани в эстрогены, количество которых достаточно для развития молочных желез и распределения жира по женскому типу.
Различают полную и неполную формы тестикулярной феминизации.
При полной форме во время полового созревания у внешне нормальных девочек начинают развиваться молочные железы, однако рост волос на лобке и в подмышечных впадинах отсутствует. Наблюдается первичная аменорея.
Наружные половые органы развиты по женскому типу. Влагалище укорочено, заканчивается слепо. Матка отсутствует, у 1/3 больных располагаются в брюшной полости, у 50–60% больных – в паховых каналах, являясь содержимым врожденной паховой грыжи, у остальных – в толще больших половых губ.
УЗИ подтверждает отсутствие матки. При лапароскопии в брюшной полости обнаруживаются яички в виде круглых образований, меньших, чем яичники размеров, с гладкой сероватой оболочкой, мягкой консистенции. Матка и трубы отсутствуют.
Уровни ФСГ и ЛГ в плазме крови могут быть нормальными или высокими (результат отсутствия отрицательной обратной связи), содержание тестостерона соответствует верхней границе нормы для мужчин. Кариотип нормальный мужской 46ХУ, половой хроматин резко снижен (меньше 6%).
При неполной форме синдрома тестикулярной феминизации частично сохранен рецепторный аппарат и его чувствительность к андрогенам в тканях–мишенях, поэтому у больных проявляются признаки вирилизации: морфограмма мужского типа; строение наружных половых органов неопределенное: клитор увеличен, происходит слияние больших половых губ, остается урогенитальный синус. Матка и маточные трубы отсутствуют. В период полового созревания развивается гипертрихоз. Молочные железы слабо развиты. Яички обычно находятся в брюшной полости.
Лечение комплексное. Больные растут и воспитываются как девочки. Их не следует информировать о том, что по хромосомному набору и гормональной характеристике они относятся к мужскому полу. Замужество и нормальная половая жизнь возможны, менструальная и репродуктивная функции исключаются.
В связи с высоким риском малигнизации яички следует удалять при полной форме после завершения роста и развития молочных желез в 16–18 лет, при неполной – до периода полового созревания с целью предотвращения вирилизации. При неполной форме проводится хирургическая коррекция наружных половых органов: удаление клитора, рассечение наружной стенки урогенитального синуса, при необходимости – пластика влагалища.
В дальнейшем проводится заместительная гормональная терапия эстрогенами для развития вторичной половых признаков, предупреждения посткастрационного синдрома, атрофии молочных желез, слизистой вульвы и влагалища, остеопороза, сердечно–сосудистых осложнений. В дальнейшем возможно применение низко– и микродозированных эстроген–гестагенных препаратов (регулон, фемоден, силест, логест, мерсилон).
Гипофизарный гипогонадотропный гипогонадизм, как правило, возникает при органическом поражении области турецкого седла, реже является следствием функциональных (биохимических) нарушений. При этом может наблюдаться избирательное нарушение синтеза β–цепей с изолированной недостаточностью ФСГ и ЛГ или α–цепей, что приводит к недостаточности продукции ФСГ, ЛГ и ТТГ.
Клиническая картина гипофизарного гипогонадотропного гипогонадизма при нарушении продукции только ФСГ и ЛГ (недостаточность β–цепей) не отличается от таковой при гипоталамическом гипогонадотропном гипогонадизме.
При нарушении синтеза α–цепей имеются клинические признаки вторичного гипотиреоза.
При гормональном обследовании выявляется недостаточность ФСГ и ЛГ почти до полного их отсутствия, гипоэстрогения. Проба с гонадотропными гормонами положительна.
Лечение обычно начинают с заместительной терапии половыми стероидами до полового развития. Для стимуляции овуляции и восстановления репродуктивной функции используются менопаузальные гонадотропины – меногон, менопур (содержат ФСГ и ЛГ по 75 МЕ) или рекомбинантные аналоги ФСГ (пурегон, гонал–Ф). Их вводят под контролем фолликулометрии и определения уровня эстрогенов в сыворотке крови. По достижении доминантным фолликулом диаметра 18–20 мм вводится овуляторная доза ЧХГ (профази, хорагон) или рекомбинантных аналогов ЛГ (луверис) или ХГ (овитрел). Длительное использование гонадотропинов нежелательно, так как может вызвать появление к ним антител.
Гипоталамический гипогонадотропный гипогонадизм (синдром Kallmann, ольфактогенитальная дисплазия, гипогонадотропный евнухоидизм) был описан в 1944 г. Kallmann. Синдром, включающий гипогонадотропный гипогонадизм и аносмию. В большинстве случаев этот синдром передается по наследству как аутосомно–доминантный признак, но описаны случаи и аутосомно–рецессивного наследования. Дефектный ген локализуется в Х–хромосоме.
В основе развития синдрома лежит изолированная гипоталамическая недостаточность гонадолиберина, которая приводит к избирательному нарушению секреции ФСГ и ЛГ в гипофизе и, тем самым, к гипогонадизму. При аутопсии у больных находят анатомические признаки частичной или полной агенезии обонятельной луковицы.
У больных с женским генотипом не наступает полового созревания, наблюдаются первичная аменорея, нарушение обоняния. Рост больных высокий, так как на фоне дефицита эстрогенов тормозится закрытие эпифизарных зон роста. Тип телосложения евнухоидный. Наружные и внутренние половые органы гипопластичны.
Обследование выявляет очень низкие, практически не поддающиеся определению уровни ФСГ и ЛГ в плазме крови. Содержание эстрогенов резко снижено. Проба с гонадолиберином положительная.
Яичники инфантильные по внешнему виду и морфологической картине: в основном выявляются примордиальные фолликулы; рост и развитие предполостных фолликулов замедлен.
Рентгенограмма черепа в пределах нормы.
Лечение проводится заместительной терапией эстрогенами для стимуляции развития вторичных половых признаков и торможения роста. Восстановление репродуктивной функции достигается прерывистым введением аналогов гонадолиберина (бусерелин) в средней дозе 5 мкг на импульс с интервалами 60–120 мин.
Гипоталамический гипопитуитаризм в последние годы встречается все чаще. Этиологическими факторами патологии могут быть опухоли (краниофарингиома, эктопическая пинеалома, глиома, рак желточного мешка, тератома), инфильтративные заболевания (эозинофильная гранулема или болезнь Хенда – Шюллера – Крисчена, саркоидоз), инфекции (менингит, туберкулез), травмы головы, в том числе родовые, перенесенная анте– или интранатально гипоксия.
В основе развития гипопитуитаризма в описанных выше случаях может лежать нарушение обмена нейротрансмиттеров, выработки или доставки гипоталамических рилизинг–гормонов или ингибинов в переднюю долю или вазопрессина в заднюю долю гипофиза.
Клиническими признаками гипоталамического гипопитуитаризма, наряду с симптомами, связанными с дефицитом гонадотропинов (нарушение развития вторичных половых признаков, генитальный инфантилизм), могут быть: несахарный диабет; умеренное повышение уровня пролактина на фоне снижения других гормонов гипофиза; зрительные нарушения; задержка роста при действии патологического фактора в детском возрасте; возможно ожирение; выраженная сонливость; головные боли; нарушение психики у некоторых больных.
При обследовании, в первую очередь, необходимо исключить опухоли (рентгенография, КТ или МРТ черепа). Положительная проба с гонадолиберином подтверждает гипоталамический генез заболевания.
Выбор лечения определяется причиной гипоталамического гипопитуитаризма. При опухолях показано оперативное лечение и/или лучевая терапия, при воспалении – противовоспалительное. Проводятся мероприятия, направленные на нормализацию функции диэнцефальной области(совместно с невропатологом, психоневрологом). Назначается общеукрепляющая терапия: диета с учетом исходной массы тела, циклический прием витаминов (фолиевой кислоты по 0,02 г и глутаминовой кислоты по 0,25 г 3 раза в день в условную 1–ю фазу цикла, витамина С по 1,0 г и витамина Е по 100 мг в день во 2–ю фазу). Показана эндоназальная гальванизация с ионами кальция, тиамином, воротниковой зоны – с 2% раствором новокаина; при выраженной гипоплазии матки – тепловые процедуры на низ живота для усиления кровоснабжения органов малого таза.
Для стимуляции полового развития, восстановления менструальной функции назначается циклическая гормональная терапия, которая проводится по общепринятым схемам с 12– 13 лет. Применение малых доз эстрогенов оказывает стимулирующее влияние на образование и выделение гонадолиберина и гонадотропинов. Для стимуляции овуляции назначают гонадолиберин в импульсном режиме. При недостаточности соматотропный функции назначают соматотропин, анаболики (инозин, оротат калия), при несахарном диабете – вазопрессин.
Вторичная аменорея. Вторичная аменорея составляет 75% в структуре аменорей. Она является частым симптомом нарушения функции не только гипоталамо–гипофизарно–яичниковой системы, но и надпочечников, щитовидной железы, при нарушении функции которых на долю вторичной аменореи приходится около 50%.
Ложная аменорея является следствием травматических манипуляций, выскабливаний, при которых происходит повреждение базальной мембраны эндоцервикса, атрезия цервикального канала и нарушение оттока менструальной крови.
Вторичная аменорея развивается после медицинского аборта, диагностического выскабливания, удаления полипов. Характерной жалобой являются циклические боли схваткообразного характера в дни ожидаемой менструации.
Диагноз строится на данных анамнеза, клинической картины, УЗИ, произведенного при болях, которое выявляет расширение полости матки и скопление в ней жидкости.
Лечение заключается в восстановлении проходимости цервикального канала при зондировании.
Причинами вторичной маточной аменореи являются повторные выскабливания или аблация слизистой оболочки матки, воздействие прижигающих веществ (йод, жидкий азот), послеродовые и послеоперационные осложнения, воспалительные процессы различной этиологии, которые могут привести к образованию синехий между передней и задней стенками и повлечь за собой частичную или реже полную облитерацию полости матки. Циклические процессы в яичнике сохраняются, эндокринные нарушения не наблюдаются.
У нормально эстрогенизированных больных появляется вторичная аменорея после воздействия факторов, перечисленных выше. Могут сохраняться субъективные ощущения циклических изменений в организме.
Диагностика базируется на данных гормонального исследования, свидетельствующих о сохранении функции яичников и тропной стимуляции гипофиза. Содержание ФСГ и ЛГ в плазме крови нормальное, отмечается их пик в середине цикла. Уровень пролактина в пределах нормы. Концентрации эстрадиола и прогестерона соответствуют фазам цикла. Гормональные пробы с прогестероном и циклическим назначением эстрогенов и прогестерона отрицательные.
При ультразвуковом исследовании эндометрий истончен. Метросальпингограмма выявляет внутриматочные синехии. Гистероскопия производится для оценки состояния эндометрия, уточнения характера и расположения внутриматочных сращений.
При подозрении на инфекционный, часто туберкулезный, генез внутриматочных синехий производится выскабливание с последующим морфологическим, бактериоскопическим и бактериологическим исследованием.
Лечение зависит от этиологического фактора. Внутриматочные синехии разрушают под контролем гистероскопа, после чего вводят ВМС на 2–3 месяца и назначают циклическую гормональную и антибактериальную терапию. Туберкулезный эндометрит является показанием для проведения специфической терапии в условиях противотуберкулезного диспансера.
Вторичная яичниковая аменорея может быть следствием нечувствительности яичников к гонадотропинам, преждевременного их истощения, болезни поликистозных яичников, андрогенпродуцирующих опухолей, гнойного расплавления яичников (двухсторонние пиовары, туберкулезный процесс), ятрогенных причин (хирургическое удаление яичников, облучение, лечение цитостатиками).
При синдроме резистентных яичников (СРЯ) у больных с яичниками нормального строения отсутствует реакция фолликулярного аппарата на гонадотропины. Частота патологии составляет от 3,4 до 10% среди всех форм аменореи. Развивается у женщин моложе 35 лет.
Этиология и патогенез СРЯ не установлены. Среди этиологических факторов, способствующих развитию СРЯ, упоминаются инфекции (туберкулез, паротит, саркоидоз, актиномикоз), операции на яичниках, использование иммунодепрессантов, цитостатиков, радио– и рентгенотерапии, аутоиммунные заболевания (болезнь Хашимото, миастения, алопеция, гипопаратиреоз, злокачественная анемия и др.).
В основе патологии лежит дефект рецепторного аппарата яичников, его рефрактерность к ФСГ. Нечувствительность рецепторов может быть связана с их блокадой антиовариальными антителами (при аутоиммунных заболеваниях) или с локальными яичниковыми регуляторами (полипептидным фактором, тормозящим связывание ФСГ с рецепторами; ингибитором лютеинизации гранулезных и тека–клеток; ингибитором созревания овоцита). Не исключается возможность аномальности самой молекулы ФСГ, при которой сохраняется ее иммунологическая активность, но отсутствует биологическая.
Для больных с СРЯ характерен отягощенный семейный анамнез (нарушение менструальной функции по типу аменореи и олигоменореи), низкая масса тела при рождении (у 85%), большое число (до ■ перенесенных инфекционных заболеваний в детстве.
Менархе обычно наступает своевременно, но через 5–10 лет возникает аменорея, развитие которой больные связывают со стрессом, тяжелыми вирусными инфекциями, приемом больших доз сульфаниламидов. На фоне аменореи эпизодически могут появляться менструации. Беременность и роды бывают редко (только у 5% больных).
При осмотре больные с СРЯ имеет правильное телосложение, с развитыми вторичными половыми признаками. Часто наблюдается железисто–кистозная мастопатия.
При гинекологическом осмотре отмечается истончение вульвы и слизистой влагалища. При ультразвуковом сканировании размеры матки нормальные или несколько уменьшены, эндометрий тонкий, яичники средней величины со множеством фолликулов диаметром до 5–6 мм.
Диагноз подтверждают лапароскопия, биопсия и морфологическое исследование ткани яичника (наличие в них примордиальных и преантральных фолликулов), высокие уровни ФСГ и ЛГ и низкие уровни эстрогенов в плазме крови.
Вспомогательное значение имеют гормональные пробы: проба с прогестероном сначала часто положительная, в последующем – отрицательная; циклическая проба с эстрогенами и прогестероном или микродозами (1/4 таблетки) эстроген–гестагенных препаратов положительная; проба с гонадотропинами и кломифеном отрицательная.
Кариотип женский (46ХХ), половой хроматин нормальный.
Лечение комплексное. Менструальная функция восстанавливается при назначении заместительной циклической терапии эстрогенами и гестагенами или комбинированными эстроген–гестагенными препаратами. На начальных этапах заболевания при положительной гестаген–кломифеновой пробе продолжают лечение кломифеном; при положительной пробе с гестагенами и отрицательной с кломифеном последний назначают в сочетании с хорионическим гонадотропином.
Данные о лечении бесплодия у больных СРЯ большими дозами гонадотропинов противоречивы. Отмечено увеличение размеров фолликулов и появление материальноподобных выделений. Однако рост фолликулов не сопровождается увеличением уровня эстрогенов в крови.
Имеется информация о положительных результатах лечения аналогами гонадолиберина, попытках восстановления репродуктивной функции путем экстракорпорального оплодотворения донорской яйцеклетки.
При выявлении аутоиммунного процесса проводят лечение кортикостероидами и циклоспорином.
Синдром истощения яичников (СИЯ) – это вариант вторичной яичниковой аменореи, развивающийся у женщин моложе 38 лет с нормальной менструальной и репродуктивной функцией в прошлом и сопровождающийся клиническими симптомами климактерического синдрома (приливы жара, сухость слизистой влагалища, диспареуния и др.). В структуре вторичных аменорей частота СИЯ составляет около 10%.
СИЯ рассматривается как мультифакторное заболевание, в основе которого могут лежать хромосомные аномалии и действие патологических средовых факторов, приводящих к формированию яичников с врожденным дефицитом фолликулярного аппарата или к его деструкции в пре– и постпубертатном периоде. Среди таких факторов упоминается радиация, лекарственные и химические вещества, неблагоприятное течение беременности, вирус гриппа, краснухи, паротита, гемолитический стрептококк, неполноценное питание, авитаминозы, тяжелые инфекционные и соматические заболевания. У больных отягощен семейный анамнез: у близких родственниц часто отмечаются нарушения менструальной функции, такие как аменорея, олигоменорея, позднее менархе, ранний климакс. СИЯ может развиваться после субтотальной резекции яичников, особенно при апоплексии.
Вследствие действия средовых факторов у больных с генетической предрасположенностью происходит истощение запаса фолликулов в яичниках и замещение их соединительной тканью, апоптоз гормонально–активных клеток. Яичники перестают функционировать, прекращаются менструации, наступает ранняя менопауза. На фоне низкого уровня эстрогенов отсутствует отрицательная обратная связь, что приводит к увеличению секреции гонадотропинов, особенно ФСГ.
Клиническая картина при СИЯ определяется дефицитом эстрогенов и напоминает климактерический синдром.
Менархе у больных с СИЯ, как правило, наступает своевременно, менструальная и репродуктивная функции сохраняются в течение 12–20 лет и прекращаются в возрасте до 38 лет. Через 1–2 месяца после наступления аменореи появляются приливы жара, нервно–психические расстройства, затем сухость во влагалище, диспареуния и другие симптомы, характерные для постменопаузального синдрома.
Фенотип у больных типичный женский, генотип 46ХХ, половой хроматин в пределах нормы. Отмечается гипоплазия матки, резкое уменьшение размеров яичников. Тесты функциональной диагностики свидетельствуют о выраженной гипоэстрогении: симптом «зрачка» отрицательный, КПИ 0–10%. При ультразвуковом сканировании размеры матки меньше нормы, эндометрий истончен, яичники маленькие, без фолликулов. Содержание эстрадиола в крови ниже нормы, уровень ФСГ в 15 раз, а ЛГ в 4 раза превышает их базальный уровень. Концентрация пролактина снижена. Пробы с прогестероном, гонадотропинами, кломифеном отрицательные, проба с эстрогенами и прогестероном положительная.
Окончательный диагноз ставится на основании лапароскопии и биопсии яичников: выявляются маленькие, морщинистые яичники желтого цвета; фолликулы в них отсутствуют.
Лечение гормональное. Больным с СИЯ показана заместительная гормональная терапия по меньшей мере до возраста естественной менопаузы. Предпочтительна циклическая терапия натуральными эстрогенами (прогинова, дивигель) и производными прогестерона (медроксипрогестерона ацетат, дюфастон) или использование комбинированных препаратов (дивина, фемостон, климен). Заместительная гормональная терапия не только ликвидирует вазомоторные и нервно–психические симптомы, но является профилактикой атрофических процессов в мочеполовом аппарате и коже, сердечно–сосудистых расстройств, остеопороза.
Прогноз относительно восстановления репродуктивной функции неблагоприятный. Беременность возможна при экстракорпоральном оплодотворении донорских яйцеклеток спермой мужа с последующим их переносом в предварительно подготовленную в течение 3–4 циклов матку. До 16–20 недель беременности назначаются препараты прогестерона (дюфастон, утрожестан).
Вторичная гипофизарная аменорея может быть следствием хирургического или лучевого разрушения гипофиза, развития крупных (обычно нефункционирующих) опухолей, инфарктов, инфильтрирующих и грануломатозных процессов. Клинические проявления возникают при повреждении 70% ткани гипофиза. Ранние проявления гипофункции гипофиза можно установить только при проведении проб с рилизинг–гормонами. Развитие гормональной недостаточности обычно происходит в определенной последовательности: сначала нарушается гонадотропная функция гипофиза, затем снижается уровень гормона роста, ТТГ, АКТГ и пролактина.
Наибольшее практическое значение имеют инфаркты гипофиза: идиопатические (встречаются в конце репродуктивного периода или в период менопаузы); у больных с диабетическим васкулитом или серповидно–клеточной анемией, но чаще связанные с послеродовыми кровотечениями и шоком (синдром Шихена).
Послеродовой гипопитуитаризм (синдром Шихена) описан в 1939 г. Sheehan (синдром гипопитуитаризма, развившегося вследствие острого некроза передней доли гипофиза, вызванного послеродовым кровотечением и шоком).
Некроз аденогипофиза развивается вследствие тромбоза сосудов гипофиза на фоне глубокой гипотензии и гиповолемии при тяжелых послеродовых кровотечениях.
В результате некроза передней доли гипофиза наблюдается нарушение продукции тропных гормонов. Степень гипопитуитаризма может быть различной: от полного прекращения до неадекватно низкой секреции гонадотропинов, АКТГ, ТТГ, гормона роста и пролактина.
В зависимости от степени нарушения функции аденогипофиза синдром Шихена может протекать в тяжелой и легкой, скрытой форме и проявляться при воздействии дополнительных стрессовых факторов (повторные роды, инфекция, травма). Симптомы определяются недостаточностью гормонов периферических желез: надпочечников, щитовидной железы, яичников.
При массивном некрозе гипофиза клинические проявления развиваются быстро. Первым признаком является инволюция молочных желез и отсутствие лактации в послеродовом периоде. Возникают астения, апатия, артериальная гипотензия, головная боль, головокружения, обмороки. Затем выпадают волосы на лобке и в подмышечных впадинах, отмечаются анорексия, тошнота, рвота, запоры, атрофия молочных желез, гипоплазия полового аппарата, аменорея; дистрофические изменения ногтей и зубов; выпадение волос. Может развиться гипопитуитарная кома: упорная астения, резкая гипотензия, брадикардия, сонливость, сильная зябкость, безразличие к окружающей обстановке, гипотермия, гипогликемия, микседема. Если своевременно не диагностировать это состояние и своевременно не лечить, может наступить смерть.
Тесты функциональной диагностики свидетельствуют о резко выраженной недостаточности эстрогенов (симптомы «зрачка» и «папоротника» отрицательные, во влагалищном мазке преобладают парабазальные клетки – 60–80%). Гормональные исследования выявляют снижение уровня тропных гормонов: ФСГ, ЛГ, АКТГ, ТТГ, гормона роста, пролактина и гормонов периферических желез: эстрадиола, Т3, Т4, кортизола, андрогенов. Проведение проб с рилизинг–гормонами важно для оценки степени повреждения гипофиза и прогнозирования состояния больных.
Для исключения опухоли гипофиза показана рентгенография черепа.
Лечение должно быть направлено, в первую очередь, на улучшение общего состояния больной. С этой целью назначается заместительная терапия гормонами щитовидной железы (тиреоидин по 0,05 г в день) и кортикостероидами (гидрокортизон по 25 мг, преднизолон по 5 мг в день). В качестве анаболического гормона можно назначать метилтестостерон или неробол (ретаболил) при выраженной астении. Показана высококалорийная пища, витамины (аскорбиновая кислота, тиамин, ретинол, токоферола ацетат, эргокальциферол).
Восстановление менструальной функции имеет психологическое значение и осуществляется назначением циклической терапии эстрогенами и прогестероном женщинам репродуктивного возраста.
При гипопитуитарной коме внутривенно вводят гидрокортизон по 100–300 мг/сут или кортизон по 25 мг каждые 4–6 ч, 20% растворы глюкозы – 200–300 мл, строфантин, кордиамин, дофамин.
В основе гипофизарной кахексии (болезни Симмондса) лежит атрофия или некроз гипофиза, которые могут быть следствием воспаления (туберкулез, сифилис, нейроинфекция), травмы или деструкции опухолью. В результате нарушается секреция тропных гормонов с выпадением функции периферических желез: щитовидной, надпочечников, яичников. Поражение вентромедиальных ядер гипоталамуса приводит к развитию кахексии.
Клиническая картина напоминает таковую при синдроме Шихена и связана с гипофункцией коры надпочечников, щитовидной железы и яичников. Кроме того, отмечается плохой аппетит вплоть до полной анорексии, потеря в весе до 3–6 кг в месяц, резко выраженная анемия и кахексия: отсутствие подкожной клетчатки и атрофия мышц сначала на лице, верхней половине туловища, затем на нижней.
Результаты гормонального исследования такие же, как при синдроме Шихена.
Лечение при опухоли хирургическое и/или лучевое, при инфекционном процессе – специфическое противовоспалительное. Гормональная коррекция проводится гормонами периферических желез (см. синдром Шихена). Общеукрепляющая терапия включает назначение витаминов А, С, D, Е и группы В.
Аменорея при опухолях гипофиза встречается редко. Аденомы гипофиза составляют 10% всех внутричерепных опухолей, но многие из них малы и не проявляются клинически, а выявляются только при КТ. Аденомы, секретирующие один или несколько полипептидных гормонов, составляют 85% гипофизарных опухолей. Они могут достигать больших размеров и располагаться интра–, супра– и параселлярно. Наиболее известны опухоли, секретирующие полипептидные гормоны: АКТГ, пролактин, гормон роста. С 1970 г. появляются публикации о существовании аденом из клеток, секретирующих избыток гликопротеидных гормонов – ТТГ, ЛГ, ФСГ и различные их субъединицы, а также β–эндорфин. ТТГ, ЛГ, ФСГ–секретирующие опухоли встречаются редко. Более распространены опухоли, образующие α–субъединицу этих гормонов, при которых клинические симптомы отсутствуют.
Снижение активности передней доли гипофиза часто сопутствует опухоли гипофиза, обычно доброкачественной, которая оказывает компрессионное действие на здоровые клетки или прерывает связи между гипофизом и портальной системой, доставляющей рилизинг–гормоны из гипоталамуса. Медленно растущая аденома приводит к эрозии клиновидной кости и расширению турецкого седла.
Наибольшее практическое значение имеют аденомы, секретирующие полипептидные гормоны.
Аменорея встречается и при болезни Иценко – Кушинга. Заболевание обусловлено избыточной продукцией АКТГ аденомой из кортикотрофов гипофиза и вторичной гиперфункцией коры надпочечников. Гиперпродукция глюкокортикоидных и андрогенных гормонов приводит к развитию характерных клинических симптомов. Аменорея при этом связана с избытком андрогенов, которые подавляют в яичнике рост фолликулов и вызывают их атрезию, а также с подавлением секреции ФСГ по механизму обратной связи.
Для больных с данной патологией характерно ожирение с избыточным отложением жира в области лица, шеи (жировой горб), верхней половины туловища и живота при относительно худых конечностях. Лицо лунообразное, багрово–красного цвета с синюшным оттенком. На коже молочных желез, живота, бедер видны синюшно–багровые стрии; на коже лица, грудной клетки – угревые высыпания. Отмечается умеренно выраженный рост волос на лице, туловище, конечностях. На голове волосы выпадают. У больных развиваются артериальная гипертензия, гипергликемия (стероидный диабет), остеопороз (чаще позвоночника, ребер), дисфункциональные кровотечения, затем аменорея. Из неврологических расстройств бывают головная боль, нарушение сна, иногда развивается депрессия.
Расстройства зрения наблюдаются при опухоли больших размеров, растущей супраселлярно.
При диагностике учитывают клинические проявления и результаты обследования. При гинекологическом осмотре выявляются гиперпигментация наружных половых органов, внутренней поверхности бедер, скудный рост волос на лобке. Матка обычного размера, иногда увеличена, реже уменьшена.
Тесты функциональной диагностики констатируют умеренную гипоэстрогению (слабоположительные симптомы «зрачка» и «папоротника», КПИ около 40%), отсутствие циклических изменений (монофазная базальная температура). При гормональном исследовании определяется значительное увеличение уровня АКТГ, кортизола, умеренное – тестостерона, ДЭА. Обязательно исследование полей зрения, сужение которых отмечается при супраселлярном росте опухоли из–за сдавления перекреста зрительного нерва. Проба с дексаметазоном отрицательная. Подтверждает диагноз опухоли КТ или МРТ во фронтальной проекции.
Лечение заключается в хирургическом (транссфеноидальном) удалении аденомы с сохранением, по возможности, непораженной части гипофиза. Допустимо проведение лучевой терапии, назначение ингибиторов синтеза глюкокортикоидов: метирапона, блокирующего 11–гидроксилирование кортизола; кетоконазола, хлодитана. При тяжелой форме заболевания прибегают к двухсторонней адреналэктомии с последующей заместительной терапией.
Аменорея отмечается при акромегалии и гигантизме. Наиболее частым этиологическим фактором является доброкачественная, медленно растущая опухоль из соматотрофов, продуцирующая гормон роста (ГР). При росте опухоли в детском и подростковом возрасте развивается гигантизм. У взрослых, когда зоны роста костей уже закрыты, ГР действует на хондроциты, стимулирует повышение инсулиноподобного фактора роста – 1 (ИПФР–1), что ведет к расширению костей, особенно черепа и дистальных отделов конечностей; утолщению кожи, гипертрофии и гиперфункции ее придатков (увеличению продукции кожного сала); кардиомегалии, функциональной и анатомической гипертрофии почек. Бывает гипертензия с развитием в нелеченых случаях застойной сердечной недостаточности. Изменения костей нарушают действие сил, поддерживающих тело, что способствует развитию остеоартроза, особенно коленного сустава. Противоинсулиновый эффект ГР вызывает развитие клинической картины сахарного диабета. Некоторые аденомы, секретирующие ГР, выратабатывают также пролактин. Увеличение уровня последнего также может быть следствием нарушения опухолью связи лактотрофов с портальной системой, через которую поступает дофамин.
Утрата гонадотропной функции гипофиза с развитием аменореи и атрофических процессов во влагалище на фоне низкого уровня ФСГ является частым и ранним признаком растущего в турецком седле образования. Кортикотропная и тиреотропная функции гипофиза, как правило, сохранены.
Для гигантизма характерен высокий рост (более 190 см) при нормальных пропорциях тела. В отличие от синдрома Марфана (заболевания с доминантным типом наследования, при котором отмечаются пороки развития сердечно–сосудистой системы, вывих хрусталика, слабое развитие мышц, паукообразные пальцы) соматические аномалии при гигантизме отсутствуют.
При акромегалии происходит постепенное изменение черт лица и появляется необходимость носить обувь, перчатки, шляпу большего размера. Черты лица становятся грубыми: увеличивается нос, нижняя челюсть и надбровные дуги выступают вперед. Кожа жирная, отмечаются макроглоссия, широкие промежутки между зубами. Из–за утолщения голосовых связок голос становится грубым. Увеличиваются дистальные отделы конечностей – кисти, стопы; утолщаются пальцы. Появляется ночная полиурия. Один из ранних симптомов – прекращение месячных и сухость влагалища.
Диагостику проводят с помощью лабораторных и инструментальных методов обследования.
Лабораторное обследование выявляет увеличение уровня глюкозы в крови, резкое увеличение содержания ГР, снижение ФСГ, умеренное увеличение ИПФР–1, иногда пролактина.
Диагноз подтверждается рентгенологически или с помощью МРТ: выявляются увеличение размеров, расширение входа, углубление дна турецкого седла с эрозией его стенок.
Лечение должно быть направлено на уменьшение размеров аденомы, снижение уровня ГР до нормы и замещение утраченных функций гипофиза. Первое достигается хирургическим лечением и проведением лучевой терапии. Некоторые больные реагируют на лечение агонистами дофамина (бромокриптином). Эффект от лечения наступает при снижении уровня ГР до 3 нг/мл и ниже: снижаются АД, уровень глюкозы, уменьшается припухлость рук, ног, но изменения костей сохраняются.
После хирургического или лучевого лечения, которое, как правило, приводит к развитию пангипопитуитаризма, назначается заместительная терапия гормонами щитовидной железы, кортикостероидами и половыми стероидами.
Аменорея наблюдается при пролактинсекретирующих аденомах гипофиза. Распространенность пролактинсекретирующих аденом гипофиза в последние годы возросла, что может быть связано как с действием неблагоприятных экологических факторов, так и с улучшением диагностики. Пролактин–секретирующие аденомы делятся на микро– (до 1 см в диаметре) и макропролактиномы (более 1 см в диаметре). Пролактиномы составляют около 40% всех опухолей гипофиза, размеры большинства – менее 1 см.
Избыточная секреция опухолью пролактина приводит к нарушению менструальной функции вплоть до развития аменореи. Имеются клинические и лабораторные доказательства того, что пролактин может действовать непосредственно на гонады, гипофиз или гипоталамус. На уровне яичника высокие концентрации пролактина тормозят синтез прогестерона и эстрогенов, нарушают нормальное созревание фолликулов, по–видимому, в результате конкурентного связывания с рецепторами гонадотропинов. На уровне гипофиза происходит торможение секреции гонадотропинов и блокада спонтанного пика секреции ЛГ. При гиперпролактинемии снижается чувствительность гипоталамуса к эстрогенам и ингибируется выделение гонадолиберина.
Основными клиническими симптомами являются аменорея и галакторея. Другие симптомы, такие как быстрое увеличение массы тела, ожирение, головная боль, не являются специфичными. При супраселлярном росте опухоли нарушаются острота и поля зрения. Крупные опухоли, распространяющиеся в стороны, сдавливают кавернозные синусы и проходящие здесь III, IV, V и VI пары черепных нервов, что ведет к параличу внеглазничных мышц, диплопии, потере зрения. У больных с пролактиномой возрастает риск остеопороза, так как пролактин, подавляя секрецию кальцитонина, способствует деминерализации костной ткани.
Для диагностики используют гормональные и рентгенологические методы исследования. Как правило, в плазме крови больных определяются высокие уровни пролактина (более 2500–3000 мМЕ/л или 100 нг/мл – 500 нг/мл). Однако следует помнить, что встречаются случаи, когда при наличии опухоли уровень пролактина не превышает 50 нг/мл. При пролактиномах отсутствуют суточные колебания уровня пролактина, нет подъема, связанного со сном. Пробы с тиролиберином, метоклопрамидом или бромокриптином отрицательные.
Диагноз пролактиномы подтверждают с помощью КТ и МРТ. Опухоль обычно локализуется в боковых отделах гипофиза, часто смещает дно турецкого седла кпереди и книзу, что сопровождается истончением кортикального слоя кости.
При выявлении гиперпролактинемии и увеличении размеров турецкого седла следует определить уровень ТТГ, Т3 и Т4 для исключения первичного гипотиреоза.
Основными методами лечения являются хирургический, медикаментозный и лучевой.
Хирургическое лечение заключается в удалении транссфеноидальным доступом опухоли интраселлярной или растущей в сторону основной кости.
При использовании лучевой терапии восстановления менструальной функции часто не происходит. Может развиться гипопитуитаризм, связанный, по–видимому, с повреждением гипоталамуса.
Медикаментозное лечение заключается в назначении агониста дофамина – бромокриптина, парлодела, абергина, достинекса, норпролака, обладающих выраженным антипролиферативным влиянием на лактотрофы. Больные с пролактиномой подлежат диспансерному наблюдению. Один раз в год им проводится КТ, осмотр у окулиста, два раза в год – определение уровня пролактина.
Гипоталамическая и супрагипоталамическая аменорея – формы истинной патологической аменореи могут развиваться вследствие психонейроэндокринных расстройств, нарушений в системе нейротрансмиттеров, осуществляющих нервные связи между гипоталамусом и супрагипоталамическими центрами, и простагландинов на фоне приема некоторых препаратов; нарушений внутри гипоталамо–гипофизарного комплекса (воспалительные, опухолевые, травматические повреждения гипоталамуса).
Супрагипоталамические влияния играют важную роль в формировании целостности гипоталамо–гипофизарной системы и в реализации процессов психологической, социальной и физиологической адаптации. Функциональное состояние гипоталамуса неразрывно связано с активностью нейронов супрагипоталамической лимбической системы, поэтому нарушения этих структур, имеющих прямое отношение к регуляции настроения, эмоций и поведения, при действии стрессовых факторов (физических, эмоциональных и психосоциальных) приводят к резкому снижению секреции гонадотропинов и усилению выделения стрессорных гормонов гипофиза: АКТГ, гормона роста и пролактина.
Аменорея часто встречается при нервной анорексии. Это психонейроэндокринное состояние известно более двух столетий. Особенно распространено в западных странах. Частота его возросла в последние годы (от 1: 150 до 1:550 среди девочек–подростков и 1:90 у девушек старше 16 лет).
Нервная анорексия представляет собой стресс–синдром, при котором отмечается неспособность индивидуума психологически адаптироваться к конкретной обстановке, что проявляется патологическим отношением к еде.
В основе заболевания лежит повышение эндогенной опиоидной активности ЦНС, последствиями чего является активация гипоталамо–гипофизарно–надпочечниковой системы, торможение секреции гонадолиберина гипоталамусом, ингибирование норадренергической системы.
Активация гипоталамо–гипофизарно–надпочечниковой системы выражается в увеличении активности кортиколиберина, секреции АКТГ и возрастании количества и длительности эпизодов секреции кортизола. Это ведет к увеличению его среднесуточного уровня в плазме крови. Метаболизм кортизола и тестостерона замедлен, что связано с дефицитом гормонов щитовидной железы, особенно Т3. Отсутствие клинических проявлений избытка кортизола у больных с нервной анорексией объясняют уменьшением числа клеточных рецепторов глюкокортикоидов. Активность фермента 5а–редуктазы снижена, поэтому не происходит превращения тестостерона в дигидротестостерон, который действует на волосяные фолликулы. У больных отсутствуют выраженные проявления гирсутизма. Избыток кортиколиберина и снижение уровня катехоламинов в гипоталамусе могут подавлять потребление пищи и воды. Роль такого мощного фактора, ингибирующего потребление пищи, как кальцитонин, в патогенезе нервной анорексии неизвестна.
Нарушения в гипоталамо–гипофизарно–яичниковой системе выражаются в снижении амплитуды и частоты секреции гонадолиберина гипоталамусом и ЛГ гипофизом; нарушении реакции ФСГ и ЛГ на экзогенное введение гонадолиберина; приросте импульсной секреции ЛГ во время сна, как в препубертатном состоянии, что не является нормой для постпубертатного и зрелого возраста.
Снижение гонадотропной функции гипофиза приводит к нарушению функции яичников (отсутствию роста и созревания фолликулов, снижению секреции эстрадиола) и развитию аменореи. Уровень тестостерона у больных в пределах нормы.
Наиболее яркие проявления патологии – это соблюдение больными строжайшей диеты с навязчивым стремлением к похуданию, часто приводящему к резкому истощению, патологическая боязнь потерять контроль над приемом пищи и массой тела, чередующаяся с эпизодами переедания и искусственным вызыванием рвоты. Больные обычно принадлежат к семьям материально обеспеченным, но с деспотическими или безразличными родителями. В анамнезе у них возможны сексуальные покушения или инцест. Характерны чрезмерное, навязчивое самоутверждение, приводящее к прекрасной успеваемости, неправильная самооценка, непереносимость холода и тепла. Они могут быть агрессивны, сосредоточены на самих себе, плохо адаптируются к окружающей обстановке.
При осмотре выявляются снижение массы тела вплоть до полного истощения, низкая температура тела, брадикардия и снижение АД. Тело покрыто пушком. Молочные железы атрофичны, половое оволосение сохранено. Постоянный клинический признак – аменорея.
Из метаболических изменений у больных нервной анорексией отмечается снижение уровней глюкозы и инсулина натощак до нижней границы нормы, повышение числа инсулиновых рецепторов на эритроцитах, базальные уровни гормона роста. Почти у половины больных выявляют частичный несахарный диабет, обусловленный нарушениями гипоталамической регуляции секреции АДГ. Нарушений в электролитном балансе при этом может не быть.
Нарушение терморегуляции выражается в непереносимости как тепла, так и холода. У больных, как правило, отсутствует дрожь – гипоталамическая реакция, не зависящая от количества жировой ткани.
В тяжелых случаях возможен летальный исход на фоне гипокалиемического алкалоза.
Основу лечения составляют психоанализ, психотерапия, направленные на прекращение голодания, принудительного вызывания рвоты, поноса; изменение отношения к питанию, инструктаж членов семьи.
При уменьшении массы тела на 40% и более требуется принудительное парентеральное кормление. В менее тяжелых случаях рекомендуется высококалорийное питание дробными дозами в жидком виде до 6 раз в день.
Показано назначение витаминов А, В, С, седативных средств.
Имеются сведения о значительном увеличении массы тела на фоне внутривенной инфузии налоксона (3,2–6,4 мг/сут) – антагониста эндогенных опиоидов. Уже в течение 1–й недели лечения отмечаются положительные результаты. Эффективны также регуляторы дофаминергических систем (L–дофа – предшественника ДА) и антисеротонинергический препарат ципрогептадин.
После нормализации массы тела менструальная функция восстанавливается. Если этого не происходит, то назначается 2–3 курса циклической гормональной терапии эстрогенами и гестагенами. Восстановление фертильности достигается при использовании кломифена, гонадотропинов или гонадолиберина в пульсирующем режиме.
Психогенная (функциональная) аменорея – исчезновение менструаций у молодых женщин при отсутствии явных клинических нарушений в системе гипофиз – яичники – матка или других эндокринных системах. В настоящее время это один из наиболее распространенных типов аменорей.
Гипоталамическая аменорея психогенного типа обычно развивается у женщин, занятых интеллектуальным трудом, с предшествующими нарушениями менструальной функции, недостаточной массой тела, подвергающихся длительному воздействию стрессорных факторов, при применении седативных и снотворных средств. Важным в развитии патологии является степень восприимчивости больной и индивидуальная способность к адаптации. Прекращение менструаций у таких больных «отражает стремление природы предотвратить неблагоприятные воздействия внешней среды на плод в условиях, когда в организме потенциальной матери развиваются хронические реакции, направленные на ее собственное выживание» (C.C.K. Yen, R.B. Jaffe, 1998).
Нейроэндокринные нарушения при этой форме аменореи заключаются: в активации гипоталамо–гипофизарно–надпочечниковой системы в дневные часы; снижении частоты и/или амплитуды импульсной секреции гонадолиберина и гонадотропинов, что ведет к прекращению циклических процессов в яичниках и к аменорее; вероятном усилении ингибиторных влияний на секрецию гонадолиберина опиоидных пептидов и ДА. Иногда отмечается усиление импульсной активности ЛГ, связанное со сном. Это свидетельствует о том, что система гипоталамус – гипофиз – яичники регрессирует к препубертатному состоянию.
Характерно прекращение менструаций без предварительного периода их урежения. На фоне аменореи отсутствуют вегетативно–сосудистые нарушения («приливы», потливость и др.), свойственные климактерическому синдрому или синдрому истощения яичников.
В плазме крови отмечается снижение уровня гонадотропинов и половых стероидов до базальных значений.
Лечение должно начинаться с выявления анамнестических данных об отношениях с родителями, реакциях на окружающую среду, социальных и межличностных отношениях. Большую помощь оказывает психологическая поддержка. Если через 6–8 месяцев после психологической помощи не наступает спонтанное выздоровление, проводят заместительную терапию эстрогенами и гестагенами или кломифеном с целью индукции овуляции. Для восстановления репродуктивной функции при отсутствии эффекта от кломифена показано импульсное введение аналогов гонадолиберина.
Аменорея при физической нагрузке и потере массы тела возникает при чрезмерных физических нагрузках при занятиях различными видами спорта и снижении массы тела, связанном с использованием различных диет и ограничением питания.
Тяжесть нарушений репродуктивной системы зависит от продолжительности и интенсивности физической нагрузки или степени выраженности дефицита жировой ткани и массы тела. Так, например, у спортсменок, занимающихся бегом, или у балерин аменорея встречается чаще (у 40–50%), чем у занимающихся плаванием (около 12%). Снижение массы тела на 10–15% (что отражает потерю 30% жира) может вызвать аменорею.
В основе аменореи, связанной с физическими нагрузками и ограничением питания, лежит нарушение нейромедиаторного обмена в ЦНС, гипоталамической секреции гонадолиберина (снижение амплитуды и частоты пульсаций) и снижение импульсной секреции ЛГ, что вначале ведет к недостаточности лютеиновой фазы, ановуляции, затем к аменорее.
Вторичная аменорея может появляться, когда выраженного истощения еще нет. Возникновение аменореи зависит от исходной массы тела, скорости ее потери и индивидуальной реакции организма. Так, потеря массы тела у больных может колебаться от 5 до 31 кг (3–10%).
Мотивом для соблюдения диеты может быть стремление к достижению идеальной фигуры, стресс, критические замечания окружающих по поводу фигуры и т.д. Конфликты в семье усугубляют нарушение психики вплоть до развития нервной анорексии.
При осмотре отмечаются дефицит массы тела и подкожной жировой клетчатки, телосложение женского типа (при чрезменых физических нагрузках интерсексуальное), вторичные половые признаки развиты нормально. Уровень ЛГ, ФСГ и эстрадиола снижен.
Проба с аналогом гонадолиберина положительная.
Лечение должно быть направлено на уменьшение интенсивности физических нагрузок и нормализацию массы тела, что само по себе ведет к восстановлению менструальной функции. Возможно также применение циклической терапии микродозами эстрогенов с гестагенами в течение 3–6 месяцев. Восстановление репродуктивной функции достигается введением гонадолиберина в импульсном режиме или назначением кломифена.
Аменорея возникает при гиперпролактинемии (гиперпро–лактинемическом гипогонадизме). Под гиперпролактинемией понимают стойкое повышение уровня пролактина в плазме крови, превышающее верхнюю границу нормы (20 нг/мл или 600 ммЕ/л), не связанное с беременностью и лактацией. Гиперпролактинемия выявляется у 15–30% женщин с вторичной аменореей и почти у 50–70% – с бесплодием. Гиперпролактинемия может быть физиологической и патологической. Физиологическая гиперпролактинемия наблюдается во время беременности и в период лактации. Подъем уровня пролактина отмечается во время сна, после приема пищи, при стрессе, физической нагрузке, во время полового акта, в предовуляторном периоде и в лютеиновой фазе менструального цикла. Патологическая гиперпролактинемия развивается в результате анатомических или функциональных нарушений в системе гипоталамус – гипофиз. Органическими причинами гиперпролактинемии могут быть микро– и макропролактиномы, интра– и супраселлярные гормонально неактивные опухоли, синдром «пустого турецкого седла», травма ножки гипофиза.
Функциональная патологическая гиперпролактинемия чаще всего бывает связана с нарушением образования, доставки или взаимодействия пролактинингибирующего фактора дофамина (ДА) с лактотрофами гипофиза.
Клинические нарушения продукции пролактина могут быть связаны: ■ с патологическим течением беременности, родов и послеродового периода (синдром Киари – Фроммеля) ■ с приемом лекарств: фенотиазинов,бутирофенонов, метоклопрамида, блокаторов ДА–рецепторов; резерпина, альдомета, истощающих запасы катехоламинов; имипрамина (тофранила) и амфетамина, препятствующих обратному захвату ДА нервными окончаниями; опиатов, ингибиторов моноаминооксидазы (МАО) ■ с использованием эстрогенов и комбинированных оральных контрацептивов, эстрогенный компонент которых, взаимодействуя с эстрогенчувствительным элементом гена пролактина, увеличивает его синтез и секрецию ■ с травмами и оперативным вмешательством на грудной клетке; опоясывающим герпесом грудной клетки ■ с некоторыми тяжелыми заболеваниями: почечной и печеночной недостаточностью, саркоидозом, гистиоцитозом Х, бронхогенным раком ■ с частыми выскабливаниями стенок матки.
Гиперпролактинемия наблюдается при гипотиреозе, некоторых формах климактерического, предменструального синдромов и синдрома поликистозных яичников (СПКЯ), хроническом психогенном стрессе, акромегалии, болезни Иценко – Кушинга, а также при миоме матки, эндометриозе, воспалительных процессах, которые можно расматривать как состояние хронического эндогенного стресса.
Устранение действия пролактинингибирующего фактора (ДА) либо действие стимулирующих факторов (эстрогены, тиролиберин, серотонин, ГАМК) ведут к усилению образования и секреции пролактина с последующим угнетением секреции гонадолиберина, гонадотропной функции гипофиза, фолликуло– и стероидогенеза в яичниках. Кроме того, у 1/3 женщин с гиперпролактинемией обнаруживается усиление синтеза андрогенов в надпочечниках (ДЭА и ДЭА–С).
Функциональная форма гиперпролактинемии может сопровождаться галактореей в 30% случаев. Частота ее увеличивается до 70–96% при аменорее, связанной с пролактиномой гипофиза. Галакторея может наблюдаться на фоне ановуляции, овуляторного цикла и нормопролактинемии. Последнее может объясняться высокой биологической активностью пролактина и повышенной чувствительностью к нему рецепторов молочных желез. Нормальный уровень пролактина в крови определяется в связи с его низкой иммуннореактивностью.
Нарушения функции яичников могут проявляться недостаточностью лютеиновой фазы, ановуляцией, нерегулярными менструациями, олигоменореей и аменореей. Среди других клинических симптомов встречаются бесплодие, снижение полового влечения, ожирение, головные боли типа мигрени и др.
При осмотре выявляется умеренная гиперплазия молочных желез на фоне гипоэстрогенного состояния гениталий. Уровень пролактина в крови при функциональной гиперпролактинемии не превышает 1500–2000 ммЕ/л, уровни ЛГ, ФСГ, эстрадиола и тестостерона снижаются. У 30–40% больных увеличивается содержание надпочечниковых андрогенов – ДЭА и ДЭА–С. При проведении проб с тиролиберином, метоклопрамидом, бромокриптином отмечается умеренно положительная реакция.
Клиническим примером аменореи, обусловленной гиперпролактинемией, может служить синдром Киари – Фроммеля, или послеродовая аменорея–галакторея, возникающая после патологически протекающих беременности и родов. Характерными клиническими признаками синдрома являются аменорея, галакторея, атрофия половых органов. Заболевание часто сопровождается нарушением углеводного и липидного обмена, ожирением, психическими и неврологическими расстройствами. При гормональном обследовании выявляются повышенное содержание пролактина в плазме крови, снижение уровня ФСГ, низкое содержание эстрогенов, соответствующее ранней фолликулярной фазе цикла, и очень низкая концентрация прогестерона. Тесты функциональной диагностики свидетельствуют о выраженной гипоэстрогении: симптомы «зрачка» и «папоротника» отрицательные, шеечный индекс 1–3 балла, во влагалищном мазке парабазальные клетки достигают 20–50%, видны мелкие промежуточные клетки, КПИ менее 5%.
Для исключения опухоли гипофиза показаны КТ или МРТ черепа, консультация офтальмолога (исследование цветных и периферических полей зрения). При подозрении на гипофункцию щитовидной железы в плазме крови исследуется уровень ТТГ, Т3 и Т4.
Лечение функциональной гиперпролактинемии заключается в терапии основного заболевания и назначении агонистов ДА: бромокриптина (парлодела), метерголина (достинекса), квинаголида (норпролака), оказывающих тормозящее влияние на секрецию пролактина. Доза препаратов подбирается индивидуально под контролем уровня пролактина: от 1,25 до 7,5 мг/сут для парлодела; от 20 до 75 мкг/сут для норпролака и от 0,3 мг (1/2 таблетки) до 1,0 мг в неделю для достинекса. Общая продолжительность лечения – до 6 месяцев. Оптимальным считается снижение концентрации пролактина в плазме крови до 10 нг/мл. Клиническими критериями эффективности лечения являются исчезновение галактореи, восстановление овуляторных циклов (по данным базальной термометрии), наступление беременности. Если при приеме бромокриптина беременность не наступает, то лечение дополняют назначением кломифена и гонадотропинов.
При гиперпролактинемии, развившийся на фоне первичного гипотиреоза, показано лечение препаратами щитовидной железы (тиреоидином по 0,1 г; трийодтиронином по 20 мкг или тиреокомбом).
Дисменорея
Дисменорея – это циклический патологический процесс, который проявляется в дни менструации выраженными болями в низу живота и различными вегетативными реакциями, что дает основание рассматривать эту патологию как менструальный синдром. Согласно МКБ–10, дисменорея – это нарушение менструального цикла, проявляющееся болезненными менструациями.Частота дисменореи составляет 10–35%, но среди некоторых социальных групп женщин может достигать 61–82%.
Дисменорея относится к тяжелой патологии, так как сильная боль, повторяющаяся при каждой менструации, истощает нервную систему, способствует развитию астенического состояния, снижает память и работоспособность.
Развитию дисменореи предшествует воздействие различных неблагоприятных факторов внешней среды на организм женщины: высокая частота инфекционных заболеваний, неудовлетворительные материально–бытовые условия, стрессы. Провоцирующими факторами могут быть переохлаждение, перегревание, психические и физические перегрузки, осложненные роды и аборты, воспалительные заболевания половых органов, общие инфекционные заболевания, неадекватная гормональная терапия.
В первые годы заболевания боли во время менструации бывают обычно терпимыми, кратковременными и не влияют на работоспособность. Но с течением времени отмечаются усиление болей, увеличение их продолжительности, появление новых патологических симптомов, что приводит к полной потере работоспособности во время менструации. При этом после повторного воздействия стрессовых ситуаций у подавляющего большинства женщин течение заболевания ухудшается.
В настоящее время основная роль в патогенезе функциональной (первичной) дисменореи отводится нарушениям в системе простагландиногенеза, в частности увеличению уровня ПГФ2а и/или увеличению соотношения ПГФ2а/ПГЕ2 в эндометрии.
Доказано, что во время лютеиновой фазы цикла эндометрий секретирует простагландины. Увеличение ПГФ2а маточного происхождения совпадает по времени с регрессом желтого тела. В этот период между высоким уровнем ПГФ2а и эстрадиолом существует положительная корреляция. Во время менструации нарушается целостность мембран клеток эндометрия, и простагландины из клеток попадают в межклеточное пространство. Отторжение эндометрия ведет к увеличению их содержания в менструальной крови. Это сопровождается усилением сокращений матки, спазмом сосудов, локальной ишемией, что вызывает болевые ощущения.
Нарушения гемодинамики малого таза на фоне спазма сосудов или длительной вазодилатации и венозного застоя вызывают гипоксию клеток, накопление аллогенных веществ, раздражение нервных окончаний и возникновение боли. Усилению боли способствует накопление в тканях солей калия, высвобождение свободного активного кальция.
Возникновение других симптомов, сопровождающих менструацию (диарея, тошнота, рвота, головная боль), также можно объяснить действием простагландинов.
В генезе первичной дисменореи существенную роль играют также функциональные нарушения гипоталамических центров и лимбико–ретикулярного комплекса.
При функциональной неустойчивости лимбико–ретикулярного комплекса реакция на стрессовые воздействия становится неадекватной. Происходит патологическое накопление биологически активных веществ (гистамина, ацетилхолина, катехоламинов, кининов), которые можно рассматривать как биохимические субстраты боли, так как они нарушают тонус и проницаемость сосудов, приводят к нарушению кровообращения, гипоксии тканей, оказывают раздражающее действие на нервные окончания. Неадекватный выброс кортиколиберина может привести к нарушению синтеза проопиомеланокортина – предшественника АКТГ и β–эндорфина с последующей дисфункцией коры надпочечников, нарушением обменных процессов и снижением порога болевой чувствительности, связанной с дефицитом опиоидных пептидов, выполняющих роль так называемой эндогенной анальгетической системы.
Классификация
Различают первичную и вторичную дисменорею. При первичной дисменорее у женщин, как правило, отсутствуют патологические изменения половых органов, при вторичной – появление боли в низу живота в дни менструации связано с гинекологическими заболеваниями: воспалительными процессами в придатках матки, инфантилизмом, неправильным положением, пороками развития матки, эндометриозом, миомой матки, кистами яичников, а также варикозным расширением вен малого таза и синдромом Алена – Мастерса, несоответствием размеров ВМС и объема полости матки или неправильным положением внутриматочного средства.Клиническая картина
Клиническое течение первичной и вторичной дисменореи одинаково. Она встречается у женщин любого возраста от менархе до менопаузы, однако первичная дисменорея наблюдается чаще в период появления первых менструаций (52,5%), а вторичная – у женщин после 30 лет. У подавляющего большинства женщин (85,7%) дисменорея проявляется болями в низу живота, у 10% – болями другой локализации (в области сердца, суставов, глаз, мочевом пузыре, эпигастрии) и у 4,3% – вегетативно–сосудистыми пароксизмами без боли.Болевой синдром в дни менструации носит приступообразный характер. Боли, как правило, начинаются в 1–й день цикла, продолжаются в течение 2–6 ч в первые 1–2 дня или все дни менструации, в остальные дни и в межменструальном периоде женщины чувствуют себя здоровыми. Боли в низу живота чаще (80,5%) бывают схваткообразного характера, реже – ноющего, дергающего, распирающего, могут иррадиировать в прямую кишку, область придатков матки, мочевой пузырь, ноги.
Сильные боли сопровождаются ухудшением общего состояния. Симптомы, сопутствующие дисменорее, можно разделить на эмоционально–психические (раздражительность, анорексия, депрессия, сонливость, бессонница, булимия, непереносимость запахов, извращение вкуса), вегетативные (тошнота, отрыжка, икота, познабливание, ощущение жара, потливость, гипертермия, субфебрилитет, сухость во рту, слюнотечение, диарея, дискинезия кишечника, частое мочеиспускание, тенезмы, метеоризм и др.), вегетативно–сосудистые (обмороки, головная боль, головокружение, тахикардия, брадикардия, экстрасистолия, боли в сердце, похолодание и чувство онемения рук и ног, отеки век, лица), обменно–эндокринные (рвота, ощущение «ватных ног», общая резкая слабость, зуд кожи, боли в суставах, отеки, полиурия). Менструации могут сопровождаться даже судорогами с потерей сознания, бронхоспазмом по типу бронхиальной астмы, явлениями нейродермита.
В клинической картине дисменореи можно выделить компенсированную и декомпенсированную формы заболевания. При компенсированной форме выраженность и характер патологического процесса в дни менструации с течением времени не изменяются. При декомпенсированной форме у больных с каждым годом интенсивность боли нарастает, увеличивается длительность болезненного состояния, появляются новые симптомы, резко ухудшающие состояние.
Диагностика
Диагностика дисменореи не представляет трудности, так как патологический симптомокомплекс появляется только в дни менструации. Однако необходимо дифференцировать первичную и вторичную дисменорею для выбора правильной тактики лечения.Обследование больных должно начинаться с тщательного сбора анамнеза для выявления возможных стрессовых факторов, лежащих в основе заболевания, экстрагенитальной и генитальной патологии.
Для оценки гормонального статуса больных необходимо использовать тесты функциональной диагностики, определение уровня половых гормонов (эстрогенов, прогестерона, тестостерона), кортизола.
Для установления возможных причин развития вторичной дисменореи в объем обследования больных следует включить ультрасонографию органов малого таза, гистеросальпингографию, которые позволяют выявить эндометриоз тела матки, миому, пороки развития матки, образования в области придатков (УЗИ). Гистероскопия помогает выявить внутренний эндометриоз, внутриматочные синехии, субмукозные миоматозные узелки. Лапароскопия дает возможность диагностировать эндометриоидные гетеротопии различной локализации (малые формы), спаечный процесс, варикозное расширение вен таза, разрывы листков широких маточных связок (синдром Алена–Мастерса).
Лечение
Основными средствами лечения дисменореи являются гестагены, гормональные контрацептивы и нестероидные противовоспалительные средства (НПВС).Гестагены снижают порог возбудимости миометрия, уменьшая сократительную активность матки. Снижая концентрацию эстрогенов, которые стимулируют выработку простагландинов во 2–й фазе цикла, гестагены приводят к ослаблению или исчезновению симптомов дисменореи. Из препаратов гестагенного действия можно рекомендовать дюфастон по 10–20 мг с 14–го по 25–й день цикла или утрожестан по 200–300 мг в течение 3–6 месяцев.
Комбинированные эстроген–гестагенные препараты и гестагенные контрацептивы (мини–пили) уменьшают объем менструальных выделений за счет торможения пролиферации эндометрия и подавления овуляции. При этом снижается секреция простагландинов эндометрием. Использование монофазных контрацептивов (регулон, новинет, логест, фемоден с 5–го по 25–й день цикла) или мини–пили (микролют, экслютон, мендинон, норплант по 1 таблетке в непрерывном режиме) способствует уменьшению выраженности симптомов дисменореи.
Для лечения дисменореи широко используются нестероидные противовоспалительные препараты – ингибиторы синтеза простагландинов. Они являются препаратами выбора для девушек и молодых женщин, не желающих применять гормональные средства или имеющих противопоказания к их использованию. Нестероидные противовоспалительные средства (аспирин, индометацин, ибупрофен, кетонал, раптен, рапид) назначают по следующей схеме: при появлении боли – 1 таблетку, каждые последующие 3–6 ч – по 1 таблетке до исчезновения боли или с момента появления боли – двойную дозу, затем по 1 таблетке 3–4 раза в день до купирования болевых ощущений. Эти препараты можно применять с профилактической целью за 1–3 дня до предполагаемой менструации по 1 таблетке 2–3 раза в день в течение 3 менструальных циклов.
Прием НПВС противопоказан при язвенной болезни желудка или двенадцатиперстной кишки, гастрите и других заболеваниях желудочно–кишечного тракта. Значительно меньше побочных явлений отмечается при использовании селективных ингибиторов циклооксигеназы–2 (мелоксикам, найз, нимесулид).
Тайленол применяют в свечах, содержащих 350 мг парацетамола, по 1–2 свечи в прямую кишку до 3–4 раз в день. Препарат повышает порог болевой чувствительности.
Витамин Е (α–токоферола ацетат), оказывающий антиоксидантное действие, назначают за 3–4 дня до менструации в дозе 150–200 мг и при болях во время менструации от 200 до 500 мг в сутки. При отсутствии продолжающегося действия стрессовых факторов боли исчезают через 3 цикла.
Для снятия судорожных сокращений матки и боли можно использовать агонисты β2–адренорецепторов (тербуталин, фенотерол 5 мг до 3–4 таблеток в день) или антагонисты ионов кальция (сензит по 50 мг 3 раза в день).
Одновременно с патогенетической терапией, назначают общеукрепляющее лечение: витаминотерапию (витамины А, В6, С, РР), седативные средства (валериана, реланиум, диазепам на ночь во 2–ю фазу цикла), спазмолитики (но–шпа 2 мл, галидор 100 мг, максиган 5 мл внутримышечно).
Из немедикаментозных средств можно рекомендовать электрофорез магния на низ живота, во 2–ю фазу цикла – электрофорез новокаина на область солнечного сплетения, гальванизацию эндоназальную или зоны «воротника», чрескожную электронейростимуляцию. В период становления менструальной функции при сниженной гормональной активности яичников следует назначать ультразвук в импульсном режиме, при выраженных психоэмоциональных реакциях – токи низкой частоты (диадинамические или синусоидальные модулирующие). Терапию начинают с 5–7–го дня цикла и заканчивают только после прекращения менструации. При достижении хотя бы частичного эффекта показаны 2–3 курса лечения. В случае неэффективности 1–го курса дальнейшее воздействие нецелесообразно.
Для лечения дисменореи может быть полезным использование магнитных полей, которые оказывают седативное, болеутоляющее действие и улучшают регионарное кровообращение. Источник ПМП индуктивностью 40 мТл помещают на надлобковую область на 10–15 мин. Лечение начинают за неделю до менструации и продолжают в дни менструации. Всего проводят 3 курса.
Иглорефлексотерапия проводится в виде трех курсов: 1–й – на протяжении всего менструального цикла, 2–й и 3–й – во 2–й половине цикла. Воздействие проводится на общие и местные транквилизирующие точки.
Для лечения вторичной дисменореи применяются ингибиторы циклооксигеназы в сочетании с лечением основного заболевания, которое является источником болевых нервных импульсов (противовоспалительное, гормональное, хирургическое, физиотерапевтическое).
Женщины, длительно страдающие дисменореей, особенно с менархе, составляют группу риска возникновения стойкого функционального бесплодия и гормональнозависимых пролиферативных процессов в органах–мишенях.
Профилактика дисменореи должна заключаться в ограждении женщин любого возраста от стрессов и других видов перегрузок. Особенно это важно в период становления менструальной функции. В этот период необходимы правильное физическое воспитание, организация режима труда и отдыха, закаливание организма, своевременное выявление и лечение экстрагенитальной патологии.
Нейроэндокринные синдромы
Климактерический синдром
Старение организма является генетически запрограммированным процессом. В жизненном цикле женщины вслед за фертильным (репродуктивным) наступает переходный, или климактерический (от греч. climacter – ступень лестницы), период, за которым следует старость.Климактерий – это физиологический период в жизни женщины, в течение которого на фоне возрастных изменений в организме преобладают инволюционные процессы в репродуктивной системе, приводящие сначала к прекращению детородной, а затем менструальной функции.
Последняя самостоятельная менструация в жизни женщины (менопауза) может быть в возрастном интервале 45–55 лет, поэтому у каждой конкретной женщины дата менопаузы устанавливается ретроспективно спустя 12 месяцев отсутствия менструации.
Хотя менопауза наступает в определенное время, однако изменения в организме женщины, приводящие к ней, проявляются гораздо раньше. В связи с этим в климактерическом периоде, согласно ВОЗ, принято выделять предменопаузу – период от 45 лет до менопаузы, менопаузу – последнюю менструацию естественную или хирургическую и постменопаузу – период жизни от менопаузы до старости. Перименопауза включает в себя период с момента появления первых клинических, эндокринных и биологических симптомов климактерия (предменопауза) и 1 (2) года после последней самостоятельной менструации.
Для перименопаузы характерна функциональная перестройка в репродуктивной системе. Установлено, что за несколько лет до менопаузы содержание ФСГ в крови возрастает, а эстрадиола и прогестерона уменьшается; чувствительность яичников к гонадотропинам снижается. Это связано с постепенным истощением первоначального запаса фолликулов в яичниках, ускорением процесса их атрезии, что ведет к снижению функции яичников, изменению в них стероидогенеза. В крови, оттекающей от яичников пожилых женщин, содержится больше тестостерона. Основным источником эстрогенов в постменопаузальном периоде являются андрогены надпочечников и яичников, подвергающиеся экстрагонадной ароматизации.
Ослабление, а затем прекращение активности фолликулов в яичниках снимает ингибирующее действие эстрогенов на гипоталамо–гипофизарную систему, что приводит к повышению уровня гонадотропинов: в течение 1–го года после менопаузы содержание ФСГ в периферической крови возрастает в 13 раз, ЛГ – в 3 раза.
Таким образом, для постменопаузального периода характерно повышение уровней гонадотропинов и дефицит эстрогенов в сыворотке крови. В связи с этим различные органы и ткани, имеющие эстрогенные рецепторы (матка, влагалище, молочные железы, уретра, мочевой пузырь, мышцы тазового дна, клетки сердца, артерии, кожа и слизистые оболочки, костная ткань, нейроны мозга), лишаются постоянного воздействия эстрогенов, что способствует возникновению в них патологических изменений и ведет к развитию симптомокомплекса, называемого менопаузальным синдромом. К нему относятся вазомоторные нарушения (климактерический синдром), эмоционально–вегетативные, урогенитальные расстройства, дистрофические изменения кожи, остеопороз, высокий риск атеросклероза и ишемической болезни сердца.
Частота патологических проявлений, свойственных климактерическому синдрому (КС), по данным разных авторов, колеблется от 39 до 84,2%.
Наибольшая частота и выраженность типичных проявлений климактерического синдрома отмечается в течение первых 2–3 лет постменопаузы. Однако в современных условиях он имеет склонность к длительному течению и почти у каждой 2–й женщины продолжается свыше 15 лет после наступления менопаузы.
Установлено, что существенную роль в патогенезе наиболее типичных вазомоторных проявлений КС (приливы жара, потливость, сердцебиение, головокружение и др.) играют изменения функционального состояния гипоталамических структур и вегетативная дисфункция вследствии нарушений выработки нейротрансмиттеров (норадреналина и дофамина), участвующих в процессе терморегуляции. Прогрессирующий дефицит эстрогенов и катехолэстрогенов приводит к накоплению катехоламинов в структурах, причастных к вегетативным реакциям. Повышение тонуса норадренергических и дофаминергических структур ЦНС обусловливает пароксизмальное расширение кожных сосудов и появление «прилива жара».
На фоне горячих приливов происходит увеличение выброса гонадолиберина, ЛГ, АКТГ, ТТГ, кортизола, дегидроэпиандростерона и андростендиона. Отмечена корреляция между импульсной секрецией ЛГ и возникновением «приливов жара».
Среди многообразных системных нарушений при КС важная роль принадлежит вегетативной неустойчивости: у 26,8% больных с КС выявляются умеренные или выраженные симпато–адреналовые реакции, у 36,8% – ваготропные, у 36,4% больных не наблюдается четкой симпатической или парасимпатической направленности вегетативных реакций.
Структурно–функциональная связь гипоталамуса и лимбико–ретикулярного комплекса обусловливает многообразие кардиоваскулярных, респираторных и психоэмоциональных нарушений у больных с КС. Развитие депрессивных состояний может быть связано с увеличением активности моноаминооксидазы и дефицитом катехоламинов.
Таким образом, КС можно рассматривать как процесс, связанный с нарушениями адаптационных механизмов и метаболического равновесия в период возрастной перестройки нейроэндокринной системы.
Наиболее вероятно развитие КС у женщин с неблагоприятным преморбидным фоном: с отягощенной наследственностью (гипертоническая болезнь у одного из родителей, КС у ближайших родственниц), различными пароксизмальными расстройствами (особенно с лабильным АД), с аллергическими проявлениями, тяжелыми соматическими заболеваниями (гипертоническая болезнь, ИБС, заболевания желудочно–кишечного тракта и печени), оперативными вмешательствами, черепно–мозговыми травмами, предменструальным синдромом в переходном возрасте, длительным воздействием психотравмирующих ситуаций в семье или на работе.
Первые клинические проявления климактерического синдрома возникают у женщин в возрасте 45–50 лет и обычно совпадают с изменениями менструальной функции (недостаточность лютеиновой фазы, ановуляция, ДМК, поли–, олигоменорея).
Многочисленные симптомы КС можно разделить на 3 группы: нейровегетативные, обменно–эндокринные и эмоциональновегетативные (психоэмоциональные).
Нейровегетативные нарушения (вазомоторные) наблюдаются у 35–40% больных. Наиболее типичным симптомом являются «приливы жара» к лицу, голове и верхней половине грудной клетки, которые встречаются у 90,7–98% больных.
Это состояние длится от 30 с до 1–2 мин и сопровождается интенсивным покраснением кожи, повышением кожной температуры, которые сменяются обильным потом на лбу, лице, спине или на всем теле.
«Приливы жара» могут сопровождаться другими симптомами, обусловленными дисфункцией вегетативной нервной системы. При активации симпатоадреналовой системы у больных отмечаются повышение АД, учащение пульса и дыхания в покое, боли в сердце, приступы пароксизмальной тахикардии, симпато–адреналовые кризы. Для активности парасимпатической системы характерны артериальная гипотензия, вагоинсулярные кризы, аллергические реакции, брадикардия и урежение дыхания в покое, чувство «замирания сердца» и нехватки воздуха, тошнота, головокружение, резкая слабость. При отсутствии четкой направленности вегетативных реакций клиническая картина КС может включать комбинацию вышеперечисленных симптомов.
Обменно–эндокринные нарушения связаны с возрастными изменениями обменных процессов и реакцией органов и тканей–мишеней на гипоэстрогению. К ним относятся урогенитальные проявления (дистрофические изменения вульвы, сенильные кольпиты, тригониты, цисталгии, стрессовое недержание мочи), экстрагенитальные эстрогендефицитные состояния (сухие конъюнктивиты, ларингиты, сухость во рту), рост волос на лице, снижение тембра голоса, связанные с усилением синтеза андрогенов в яичниках и надпочечниках, ожирение, изменение функции щитовидной железы, дисгормональная гиперплазия молочных желез, боли в мышцах и суставах, остеопороз, гиперлипидемия, прогрессирование атеросклероза и тромбоэмболических осложнений.
Эмоционально–вегетативные нарушения проявляются в снижении работоспособности, появлении раздражительности, утомляемости, рассеянности, нарушении аппетита, преобладании плохого настроения, нарушении полового влечения. У 13,1% больных может развиваться астеноневротический синдром, у 13% – депрессия.
Перечисленные выше симптомы по времени возникновения можно разделить на ранние, средневременные и поздние.
Ранние симптомы (вазомоторные, эмоционально–вегетативные) у 40% совпадают с менопаузой, у 21% возникают через 1–1,5 года после менопаузы и у 2% – спустя 3–5 лет после менопаузы. Частота ранних симптомов составляет 40–60%.
Средневременные расстройства возникают спустя 3–5 лет после менопаузы. К ним относятся атрофические процессы в коже (сухость, появление морщин, ломкость ногтей, выпадение волос) и урогенитальные нарушения: сухость и зуд во влагалище, дизурические явления и недержание мочи, диспареуния, рецидивирующие сенильные кольпиты. Частота симптомов, связанных с атрофическими процессами, составляет 30–40% и с возрастом увеличивается: у женщин старше 55–60 лет – до 50%, после 75 лет – до 80%.
Поздние обменные нарушения появляются спустя 5–10 лет после менопаузы. К ним относят сердечно–сосудистые заболевания (атеросклероз), остеопороз, болезнь Альцгеймера.
Классификация
По степени тяжести КС делят на легкий, средней тяжести и тяжелый (Е.М. Вихляева, 2002).К легкой форме КС относят заболевание с числом «приливов жара» в течение суток до 10 при отсутствии нарушений общего состояния и работоспособности.
При КС средней тяжести число «приливов жара» достигает 10–20 в сутки и имеются другие выраженные симптомы КС (головная боль, головокружение, боли в области сердца и др.), ухудшение общего состояния больных и снижение работоспособности.
При тяжелом течении КС частота «приливов жара» превышает 20 в сутки, другие симптомы резко выражены, работоспособность значительно снижена или полностью потеряна.
Тяжелое течение КС наблюдается у 51% женщин, средней тяжести – у 33%, легкое – у 16% больных. Более точное представление о тяжести КС дает менопаузальный индекс (табл. 5.2, 5.3). По клиническому течению (Е.М. Вихляева, 2002) выделяют три основные формы КС: типичную неосложненную, осложненную (сочетанную) и атипичную.
Таблица 5.2. Менопаузальный индекс
| Симптомы | Баллы | ||
|---|---|---|---|
| 1 | 2 | 3 | |
| Нейровегетативные | |||
| Повышенное АД, мм рт. ст. | 150/90 | 160/100 | Более 160/100 |
| Пониженное АД, мм рт. ст. | 100/70 | 100/70 | 90/60 |
| Головные боли | Редко | Часто | Постоянно |
| Вестибулопатии | + | ++ | +++ |
| Сердцебиение в покое | 1–2 | 1–2 | 1–2 |
| Непереносимость высокой температуры | + | ++ | +++ |
| Судороги/онемение | + | ++ | +++ |
| «Гусиная кожа» | Изредка | Ночью | Всегда |
| Дермографизм | Белый | Красный | Красный |
| Сухость кожи | Умеренная | Кератоз | Короста |
| Потливость | + | ++ | +++ |
| Отечность | Лица слабая | Век | Постоянно |
| Аллергия | Ринит | Крапивница | Отек Квинке |
| Экзофтальм, блеск глаз | + | ++ | +++ |
| Повышенная возбудимость | + | ++ | +++ |
| Сонливость | Утром | Вечером | Постоянно |
| Нарушение сна | При засыпании | Прерывисто | Бессонница |
| Приливы жара/день | Менее 10 | 10–20 | Более 20 |
| Приступы удушья/неделя | 1–2 | 1–2 | 1–2 |
| Симпатоадреналовые кризы | 1–2 | 1–2 | 1–2 |
| Метаболические/эндокринные | |||
| Ожирение, степень | 1 | 2 | 3 |
| Дисфункция щитовидной железы | + | ++ | +++ |
| Сахарный диабет | + | ++ | +++ |
| Гиперплазия молочных желез | Диффузная | Узловая | Фиброаденома |
| Мышечно–суставные боли | Редко | Периодически | Постоянно |
| Жажда | + | ++ | +++ |
| Атрофия гениталий | + | ++ | +++ |
| Психоэмоциональные | |||
| Утомляемость | + | ++ | +++ |
| Снижение памяти | + | ++ | +++ |
| Слезливость, возбудимость | + | ++ | +++ |
| Изменение аппетита | Повышение | Снижение | Потеря |
| Навязчивые идеи | Подозрительность | Страхи | Суицид |
| Настроение | Лабильное | Депрессия | Меланхолия |
| Либидо | Угнетение | Отсутствие | Повышение |
Таблица 5.3. Оценка стпени климактерического синдрома
| МПИ, баллы | Слабая степень | Умеренная степень | Тяжелая степень |
|---|---|---|---|
| Менопаузальный индекс (МПИ) | 12–34 | 35–58 | Более 58 |
Осложненная (сочетанная) форма КС развивается у женщин пожилого возраста, имеющих заболевания сердечнососудистой системы, желудочно–кишечного тракта, атеросклероз, неврологические расстройства, эндокринопатии, хронические инфекции. Эта форма КС протекает тяжело, снижает трудоспособность больных, плохо поддается лечению.
Атипичная форма КС протекает в виде симпатоадреналовых кризов, бронхиальной астмы, климактерической кардиопатии, циклических появлений симптомов по типу кризовой формы предменструального синдрома. При этой клинической форме КС типичные симптомы («приливы жара») встречаются редко или могут отсутствовать, в связи с чем больные часто обращаются за помощью к врачам терапевтического профиля.
Диагностика типичной формы КС основывается на появлении характерных симптомов у женщин переходного возраста.
Сочетанная форма КС требует более тщательного обследования.
При изучении анамнеза необходимо выяснить: ■ имелись ли у больной в прошлом заболевания, отягощающие течение КС (гипертоническая болезнь, атеросклероз, заболевания щитовидной железы, сахарный диабет, бронхиальная астма, заболевания нервной системы и др) ■ особенности менструальной и детородной функции ■ наличие или отсутствие гормональнозависимых заболеваний гениталий и молочных желез ■ перенесенные гинекологические операции и их объем ■ время появления симптомов КС типичных и атипичных, в том числе урогенитальных, кардиологических и связанных с развитием остеопороза ■ длительность, объем и эффективность проводимого ранее лечения.
При проведении общего осмотра необходимо оценить состояние кожи, вид дермографизма, наличие избыточного роста волос, характер распределения подкожной клетчатки, определить индекс массы тела, провести визуальную и пальпаторную оценку состояния молочных желез, щитовидной железы.
Гинекологический осмотр проводят с целью оценки возрастных изменений слизистой оболочки влагалища, матки и придатков, наличия симптома «зрачка», а также заболеваний гениталий.
Дополнительные обследования показаны в случае выявления экстрагенитальных или генитальных заболеваний.
Для исключения заболеваний ЦНС, в том числе опухолей, показана рентгенография черепа (КТ, МРТ), исследование глазного дна и полей зрения, эхо–, электро–, реоэнцефалография, гормональные исследования (пролактин, АКТГ).
При наличии симптомов, характерных для заболеваний щитовидной железы, показано ее ультразвуковое сканирование, исследование гормонов: ТТГ, Т3, Т4, ТСГ, ТГ, α–ПО (антитела к пероксидазе).
У женщин с признаками вирилизации необходимо проводить исследование содержания в крови уровня тестостерона, кортизола и 17–КС в суточной моче. При повышении их уровня проводится проба с глюкокортикоидами. Для исключения опухоли надпочечников проводят ультразвуковое сканирование, рентгенографию на фоне ретропневмоперитонеума.
Определение уровня глюкозы в крови необходимо для исключения сахарного диабета.
В диагностике атипичных форм КС помогает информация о связи возникновения патологических симптомов с наступлением перименопаузы и отсутствии эффекта от лечения традиционными методами. Так, при климактерической кардиопатии боли в области сердца носят постоянный характер, выраженный болевой синдром в отличие от ИБС не сопровождается значительными изменениями ЭКГ, проба с нитроглицерином отрицательная, с обзиданом и калием – положительная.
При подозрении на заболевания внутренних половых органов в объем обследования следует включить УЗИ, а при необходимости – гистероскопию, диагностическое выскабливание, гистеросальпингографию, лапароскопию.
Маммография показана при подозрении на опухоль молочных желез.
Диагностика атрофического вагинита, кроме жалоб больной (сухость и зуд во влагалище, патологические выделения, затруднения при половой жизни), должна заключаться в проведении кольпоскопии простой и расширенной (определяется истончение слизистой, кровоточивость, субэпителиальная сосудистая сеть), бактериоскопического и бактериологического исследования белей, кольпоцитологического исследования (КПИ<15–20%), в определении рН влагалищного содержимого (при умеренной атрофии эпителия рН 5,1–5,8, при выраженной – рН больше 6,1).
Наличие уродинамических и дизурических явлений предполагает необходимость проведения бактериологического исследования мочи и специальных урологических обследований (цистометрии, урофлоуметрии, профилометрии).
Для диагностики остеопороза применяются специальные рентгенологические методы (однофотонная и двухфотонная денситометрия), ультразвуковая денситометрия и определение биохимических маркеров резорбции кости (кальций/креатинин, гидроксипролин/креатинин, пиридолин и дезоксипиридолин мочи).
Дополнительные методы исследования для выявления риска развития атеросклероза и сердечно–сосудистых заболеваний в постменопаузе должны включать: измерение артериального давления, электрокардиографию, допплерометрию для оценки скорости кровотока в миокарде и сонных артериях, определение биохимических параметров крови (креатинин, холестерин, триглицериды, ЩФ, АЛТ, АСТ, глюкоза и тест на толерантность к глюкозе); оценку липидного спектра крови и гемостазиограммы (факторы свертывания крови, тромбоцитарное звено, определение простациклина, тромбоксана).
Лечение
Вопрос о тактике лечения больных следует решать индивидуально, исходя из особенностей клинических проявлений КС, тяжести и длительности течения, наличия или отсутствия сопутствующей экстрагенитальной патологии, эффективности проводимой ранее терапии.Исходя из этих критериев, В.П. Сметник предложила выделить 3 этапа в лечении больных КС: применение немедикаментозной терапии (1–й этап), медикаментозной негормональной терапии (2–й этап) и гормональной терапии (3–й этап).
Немедикаментозное лечение показано женщинам с легкой типичной формой КС, так как почти у 1/3 таких пациенток патологические симптомы исчезают в течение года.
К лечебным мероприятиям этого этапа относятся: ■ рациональное питание (ограничение приема углеводов, преобладание в пищевом рационе овощей, жиров растительного происхождения, продуктов, содержащих кальций) и контроль за массой тела ■ соблюдение режима труда и отдыха, прогулки перед сном, полноценный ночной сон не менее 9–10 ч ■ дозированная физическая нагрузка в виде утренней гимнастики по 15–20 мин, лечебной гимнастики 2–3 раза в неделю по 30–45 мин, общий массаж ■ водные процедуры и бальнеотерапия: в домашних (обливание, дождевой душ, ванны хвойные, шалфейные, контрастные ножные), поликлинических или санаторно–курортных условиях в привычной климатической зоне (веерный, циркулярный, струевой душ; минеральные, жемчужные, кислородные, радоновые, йодобромные ванны) ■ использование преформированных факторов (анодическая гальванизация головного мозга; гальванизация шейнолицевой области и электрофорез новокаина на область верхних шейных симпатических ганглиев в сочетании с массажем воротниковой зоны; центральная электроанальгезия) и иглорефлексотерапии не менее 2–3 курсов ■ психотерапия и аутотренинг.
Медикаментозная негормональная терапия проводится с учетом выраженности психосоматической картины заболевания, направленности вегетативно–сосудистых реакций и сопутствующей экстрагенитальной патологии.
Она показана женщинам с ограниченным кругом ранних симптомов КС и тем, кому противопоказана заместительная терапия эстрогенами.
На этом этапе назначаются препараты, способствующие нормализации функционального состояния центральной и вегетативной нервной системы.
Для устранения вазомоторных симптомов можно использовать клонидин по 0,1 мг 2 раза в день, который блокирует циклическое высвобождение норадреналина в гипоталамусе, т.еустраняет источник вазомоторных симптомов.
β–блокаторы (пропранолол 40 мг) предупреждают реактивную вазодилатацию в экстракраниальных сосудах и снижают частоту и интенсивность приливов жара. Их назначение может быть полезным у больных с сердцебиениями и состоянием тревоги.
Для устранения легких проявлений эмоционально–вегетативных расстройств рекомендуется прием отвара корня валерианы, травы пустырника и другие варианты фитотерапии. При более выраженных проявлениях психоэмоциональных нарушений широко используются малые транквилизаторы, снижающие возбудимость лимбических структур и гипоталамуса (диазепам, тазепам по 0,01 мг 1–3 раза в день), и пиперазиновые производные фенотиазинового ряда (френолон, этаперазин, терален по 0,5–1,0–2,5 мг) в течение 10–14 дней; грандаксин по 50 мг 2–3 раза в день курсами по 1–2 месяца.
При тревожно–депрессивных состояних, психовегетативных расстройствах (диэнцефильных кризах) хороший эффект дает транквилизатор нового поколения – ксанакс (алпразолам), который назначают по 0,25–0,5 мг 2–4 раза в день.
Симпатическая направленность вегетативно–сосудистых реакций у больных КС является показанием для назначения препаратов симпатолитического действия (резерпин, обзидан, стугерон), а при активации парасимпатического звена показано назначение препаратов холинолитического действия (настойка белладонны по 5–10 капель 2–3 раза в день) и антигистаминных средств (тавегил по 1 мг или супрастин по 0,25 мг 1–3 раза в день). При дисфункции обоих отделов вегетативной нервной системы рациональным является использование препаратов адрено– и холинолитического действия (беллоид, беллатаминал по 2–3 таблетки в день) в сочетании с антигистаминными препаратами.
Гормональная терапия КС показана больным с тяжелым и среднетяжелым течением КС, а также при отсутствии эффекта от 1–2 курсов комплексной негормональной терапии.
Для заместительной гормональной терапии (ЗГТ) используются преимущественно натуральные эстрогены (17в–эстрадиол, эстрадиола валерат, эстриол) и конъюгированные эстрогены (содержат преимущественно эстрона сульфат) и их комбинации с гестагенами или андрогенами.
Перед назначением ЗГТ обязательно проводятся УЗИ органов малого таза, маммография, онкоцитологическое исследование мазка с шейки матки, определение уровня глюкозы крови.
Контрольное обследование в процессе лечения включает маммографию, которая проводится через 1–2 года при использовании ЗГТ до 5 лет и ежегодно – при более длительном назначении ЗГТ; динамический УЗИ–контроль за состоянием эндометрия 1–2 раза в год.
Монотерапия эстрогенами проводится препаратами, содержащими эстрадиола валерат 2 мг (прогинова), 17 в–эстрадиол 1 мг или 2 мг (эстрофем), эстрон в виде конъюгированных эквилиновых эстрогенов (премарин 0,3–0,45–0,625 мг) и эстриол (овестин 1 мг или 2 мг).
Эстрогены могут назначаться прерывистыми курсами по 4 дня каждой недели, циклически в течение 21 дня каждого месяца или непрерывно с 1–го года постменопаузы.
Назначение чистых эстрогенов может быть методом выбора у женщин с удаленной маткой (эстрофем) и атрофическими урогенитальными процессами (овестин). При сохраненной матке в целях снижения риска развития гиперпластических процессов эндометрия прием эстрогенов дополняют гестагенами: медроксипрогестерона ацетатом по 5–10 мг, ципротерона ацетатом 1–2 мг, дюфастоном 10–20 мг, утрожестаном 200 мг, левоноргестрелом 0,125 мг, норгестрелом 0,15 мг и дезогестрелом 0,15 мг в течение 10–12 дней каждого месяца.
Эстрогены можно применять внутрь, сублингвально или парентерально.
Для парентерального введения эстрогенов используются трансдермальные пластыри (эстрадерм, дерместрил, климара–50), гели (дивигель, эстрожель), подкожные имплантаты, вагинальные мази, кольца, свечи (эвестин), эндоназальные спреи (аэродиол).
При использовании всех парентеральных препаратов эстрогенов необходимо назначать прогестагены в течение 10–13 дней в каждом цикле лечения для предупреждения гиперплазии эндометрия.
Терапия комбинированными эстроген–гестагенными двухфазными препаратами может проводиться в циклическом режиме (климен, циклопрогинова, дивина, климонорм), в непрерывном (фемостон 2/10–1/10–1/5) и пролонгированном (дивитрен), трехфазными (трисеквенс) и монофазными (анжелик, климодиен, клиогест) – в непрерывном. Эти препараты показаны для лечения климактерических расстройств в перименопаузальном периоде у женщин с интактной маткой. В постменопаузе проводится терапия монофазными препаратами в непрерывном режиме.
Гинодиан–депо – комбинированный препарат для внутримышечного введения, 1 мл которого содержит 4 мг эстрадиола валерата и 200 мг простерона энантата, являющегося андрогеном. Вводится 1 раз в 4 недели. По достижении лечебного эффекта интервалы между введениями могут быть увеличены на 10–12 дней. Назначение препарата предпочтительнее назначать женщинам с нарушениями со стороны мочевыводящей системы, инволюционными процессами в области половых органов, дистрофическими дерматологическими осложнениями, синдромом дефицита андрогенов (гипотония, астенизация, депрессия, потеря либидо, быстрое развитие остеопении и остеопороза).
Монотерапия гестагенами может быть использована для лечения КС у женщин с противопоказаниями к применению эстрогенов, при циклическом течении КС (по типу предменструального синдрома).
Для лечения урогенитальных расстройств наряду с оральным и трансдермальным показано местное применение эстрогенов в виде кремов, свечей (овестин), таблеток (вагифем).
Лечение остеопороза должно быть направлено на блокаду процессов резорбции костной ткани и одновременно на активацию процессов остеогенеза. С этой целью применяются эстрогены в сочетании с гестагенами в виде моно–, двух– и трехфазных препаратов (клиогест, трисеквенс) или комбинация эстрогенов и андрогенов (гинодиан–депо), миакальцик (кальцитонин), бисфосфонаты (ксидифон) и витамин D.
При климактерической кардиопатии предпочтение следует отдавать препаратам, содержащим преимущественно эстрогены, и их чрескожному введению.
Длительность курса гормональной терапии зависит от времени развития и характера клинических проявлений менопаузального симптомокомплекса.
Устранение вазомоторных, эмоционально–вегетативных, урогенитальных симптомов достигается при продолжительности лечения от 3–6 месяцев до 2–3 лет с постепенным выходом из лечебной программы.
При выраженных системных нарушениях и у женщин группы риска развития поздних менопаузальных осложнений непрерывное лечение должно продолжаться не более 5 лет. При необходимости более длительной терапии вопрос решается на основании ежегодной строгой оценки соотношения «риск/польза».
Абсолютными противопоказаниями для гормональной терапии являются: ■ рак молочной железы и эндометрия, менингиомы ■ тяжелые нарушения функции печени ■ коагулопатии (острый тромбоз глубоких вен, острое тромбоэмболическое заболевание) ■ тромбофлебит, в том числе связанный с приемом эстрогенов ■ маточное кровотечение неуточненного генеза.
При наличии противопоказаний или нежелании женщины применять гормоны можно рекомендовать прием препаратов растительного происхождения на основе цимицифуги, обладающей слабым эстрогенным действием (климадинон по 30 капель или по 1 таблетке 2 раза в сутки или климактоплант по 1–2 таблетки 3 раза в сутки за 30 мин до еды в течение 3–6 месяцев; ременс по 10–20 капель 3 раза в сутки в течение 3 месяцев). Сагенит (действующее вещество – сигетин) можно применять при вегетативно–сосудистых проявлениях
КС и дегенеративных изменениях кожи и слизистых оболочек (по 0,1 г 1–2 раза в сутки в течение 30–40 дней).
Профилактика перименопаузальных расстройств включает следующие мероприятия: ■ рациональный режим труда и отдыха, аэротерапию в виде прогулок на свежем воздухе, полноценный сон не менее 8–10 ч ■ физические упражнения (утренняя гимнастика, групповые занятия) и водные процедуры ■ рациональное питание с обязательным включением овощей, молочных продуктов, являющихся естественным источником кальция, или при непереносимости молока – препаратов кальция (кальций–Д3–Никомед, Cal–C–Vita); витаминов: А (3300 ед. 2–3 раза в день), Е (100–200 мг в день), С ( 0,3–0,5 г в день) курсами по 15–20 дней ■ исключение избыточного приема алкоголя, кофе (не более 5 чашек в день), курения ■ устранение стрессовых ситуаций, психотерапию и аутогенные тренировки ■ при отсутствии противопоказаний – заместительная гормональная терапия.
Основанием для длительной заместительной гормональной терапии после устранения патологических симптомов может быть желание пациентки или наличие риска развития остеопороза и сердечно–сосудистых заболеваний.
Риск развития нарушений со стороны сердечно–сосудистой системы на фоне приема гормонов снижается с 65 до 33%, инфаркта миокарда – на 50%, инсульта – на 40, переломов шейки бедра – на 50%.
Таким образом, заместительная гормональная терапия устраняет климактерические симптомы (вазомоторные, эмоционально–вегетативные), предупреждает развитие атрофических процессов в тканях и связанных с ними урогенитальных расстройств, дистрофических изменений кожи, сухих конъюнктивитов; снижает риск сердечно–сосудистых заболеваний и остеопороза у женщин в постменопаузе, что позволяет им улучшить качество жизни, сохранить здоровье, физическую, умственную и сексуальную активность.
Синдром поликистозных яичников
Синдром поликистозных яичников (СПКЯ) относится к числу довольно распространенных гинекологических заболеваний. Среди больных с нарушением менструального цикла и гирсутизмом частота СПКЯ достигает 68–85%.Заболевание известно с 1935 г., когда Stein и Leventhal опубликовали данные о синдроме, включающем олигоменорею, гирсутизм, ожирение и увеличение яичников поликистозного характера. В течение многих лет именно эти клинические симптомы были ведущими для постановки диагноза СПКЯ.
Согласно современным представлениям СПКЯ рассматривают как полиэтиологическую, полигландулярную, полисимптоматическую патологию, патогенез, которой может быть обусловлен нарушениями как в центральном, так и периферическом звене регуляции репродуктивной системы.
Многочисленные клинико–морфологические и гормональные исследования свидетельствуют о существовании различных клинико–патогенетических вариантов СПКЯ.
Классификация
М. Л. Крымская (1980) выделяет три формы СПКЯ: типичную, сопровождающуюся яичниковой гиперандрогенией; сочетанную – с надпочечниковой и овариальной гиперандрогенией и центральную – с выраженными проявлениями системных нарушений со стороны ЦНС.Б.И. Железнов (1982) предлагает выделять первичный по–ликистоз яичников (ПКЯ), или болезнь ПКЯ (к ней относится синдром Штейна – Левенталя), и вторичный ПКЯ, или синдром ПКЯ, развивающийся на фоне нарушения функции надпочечников или ЦНС.
Каждый из этих вариантов имеет особенности механизма развития, клинического течения, гормонального профиля, морфологической структуры яичников и различия в подходах к лечению.
Первичный синдром поликистозных яичников (яичниковая форма СПКЯ) является следствием нарушения функциональной активности гипоталамических структур, регулирующих пульсирующее выделение ЛГРГ, начиная с пубертатного возраста. Увеличение амплитуды и частоты выброса ЛГРГ ведет к избыточной секреции ЛГ аденогипофизом (рис. 5.11).
Избыточная секреция ЛГ приводит к гиперплазии тека–клеток, усилению синтеза в них андрогенов. Последние вызывают атрезию фолликулов. Увеличение секреции ингибина клетками гранулезы приводит к торможению выделения ФСГ из гипофиза. На фоне дефицита ФСГ происходит снижение количества рецепторов ФСГ в гранулезных клетках, нарушение их пролиферации, торможение роста и созревания фолликулов, снижение активности ароматаз и нарушение превращения андрогенов в эстрогены. Однако количество образующегося эстрадиола (Е2) достаточно для реализации механизма отрицательной обратной связи в отношении ФСГ, то есть торможения его секреции, и повышения чувствительности клеток аденогипофиза, секретирующих ЛГ, к ЛГРГ. Так формируется хронически существующий неадекватный механизм обратной связи со стороны эстрогенов, проявляющийся повышенной чувствительностью гипофиза к ЛГРГ и подавлением секреции ФСГ. Стойкое нарушение соотношение ЛГ /ФСГ замыкает порочный круг.
 Рис. 5.11. Патогенетические механизмы развития первичного СПКЯ: ЛГРГ–ЛГ–рилизинг–гормон; ЛГ – лютеинизирующий гормон; ФСГ – фолликулостимулирующий гормон; А – андростендион; Т – тестостерон; Е1 – эстрон; Е2 – эстрадиол; ССГ – сексстероидсвязывающий глобулин; черная стрелка – усиление; пунктирнаястрелка – угнетение
Рис. 5.11. Патогенетические механизмы развития первичного СПКЯ: ЛГРГ–ЛГ–рилизинг–гормон; ЛГ – лютеинизирующий гормон; ФСГ – фолликулостимулирующий гормон; А – андростендион; Т – тестостерон; Е1 – эстрон; Е2 – эстрадиол; ССГ – сексстероидсвязывающий глобулин; черная стрелка – усиление; пунктирнаястрелка – угнетение
На фоне гиперандрогении и относительного дефицита Е2 в печени снижается синтез сексстероидсвязывающего глобулина (ССГ), что в свою очередь ведет к увеличению в циркуляции свободных эстрогенов и андрогенов. Андрогены вызывают избыточный рост волос (гипертрихоз).
Свободные андрогены в стромальных клетках жировой ткани могут ароматизироваться в эстрогены. Последние, в свою очередь, способны стимулировать рост адипоцитов и усиливать ожирение.
Внегонадный синтез эстрогенов, увеличение содержания биологически активных свободных эстрогенов создают риск развития гиперпластических процессов эндометрия.
Среди возможных механизмов развития синдрома СПКЯ рассматривается роль инсулинорезистентности, гиперинсулинемии и инсулиноподобного фактора роста–1 (ИПФР–1).
Так, у больных без ожирения повышение уровня гормона роста (возможно, в ответ на стимуляцию андрогенами) активирует синтез ИПФР–1 в клетках гранулезы. Действуя паракринно, ИПФР–1 усиливает процесс связывания ЛГ с тека–клетками и повышает в них синтез андрогенов с последующей атрезией фолликулов. У больных с ожирением развиваются инсулинорезистентность и гиперинсулинемия. Инсулин является мощным стимулятором синтеза ЛГ аденогипофизом и андрогенов – яичниками, возможно при участии ИПФР–1, следствием чего является атрезия фолликулов.
Для больных первичным СПКЯ характерен женский морфотип. Молочные железы без признаков гипоплазии. Ожирение встречается у 46–50% женщин и чаще имеет универсальный характер (отношение объема талии к объему бедер – менее 0,85). Гипертрихоз появляется с возраста менархе и обычно не выражен: отмечается рост стержневых волос на задней поверхности бедер, голенях, промежности, над губой. У больных с ожирением и гиперинсулинемией при осмотре выявляется пигментация и гиперкератоз трущихся поверхностей кожи (acantosis nigricans) в подмышечных, паховых областях, под молочными железами.
Менархе наступает в 12–13 лет. С этого же возраста отмечается нарушение менструальной функции по типу олигоменореи с постепенным переходом во вторичную аменорею. Бесплодие всегда первичное.
При бимануальном исследовании иногда удается пропальпировать увеличенные, плотные, с гладкой поверхностью яичники.
Диагностика первичного СПКЯ основывается на приведенных выше особенностях клинической картины и данных дополнительных методов исследования: ультразвукового сканирования, определения уровня гормонов, лапароскопии, морфологического исследования биоптата яичников.
Ультразвуковыми критериями первичного СПКЯ являются симметричное увеличение размеров яичников (приблизительно до 5*4*3 см) с обеих сторон и их объема (более 9 см3), утолщение капсулы, множество кисточек (более 8–10) диаметром 8–10 мм по периферии в виде «ожерелья», увеличение стромальной плотности (строма составляет до 25% объема яичника).
Гормональные критерии: увеличение в крови содержания ЛГ и соотношения ЛГ/ФСГ (более 2,5, чаще 3), общего и свободного тестостерона, снижение уровня ССГ. Проба с дексаметазоном отрицательная. Концентрация 17–гидроксипрогестерона и дегидроэпиандростерона (ДЭА) – в пределах нормы.
Инсулинорезистентность диагностируется на основании увеличения уровня иммунореактивного инсулина и теста толерантности к глюкозе.
При лапароскопии обнаруживается двухстороннее увеличение яичников (длина до 5–6 см, ширина до 4 см), поверхность их гладкая, капсула плотная, жемчужно–белого цвета, по ее поверхности видны древовидно ветвящиеся мелкие сосуды. Сквозь нее практически не просвечиваются фолликулярные кисточки.
Для морфологической картины характерны склероз и утолщение белочной оболочки до 600 мкм, гиперплазия стромы и клеток внутренней теки, кистозная атрезия фолликулов, отсутствие желтых тел. У больных с гирсутизмом в гиперплазированной строме и тека–клетках могут обнаруживаться очаги лютеинизации.
Лечение больных с СПКЯ преследует следующие цели: регуляцию менструального цикла, восстановление овуляции и репродуктивной функции, профилактику гиперпластических процессов эндометрия, уменьшение явлений гипертрихоза. Исходя из цели определяется выбор средств и методов лечения (консервативное или оперативное).
В настоящее время лечение больных с первичным СПКЯ начинают с консервативного метода, который предполагает использование комбинированных эстроген–гестагенных препаратов, гестагенов, кломифена, гонадотропинов, агонистов ЛГРГ.
Комбинированные эстроген–гестагенные препараты (ригевидон, марвелон, диане–35, жанин, новинет) позволяют восстановить ритм менструаций, проводить профилактику гиперпластических процессов эндометрия, а при циклическом приеме в течение 8–12 месяцев – уменьшить проявления гипертрихоза.
Восстановление овуляции и фертильности достигается назначением антиэстрогена кломифена цитрата, гонадотропинов и агонистов гонадолиберина. Кломифен обычно назначают по 50–100 мг/сут с 5–го по 9–й день индуцированного эстроген–гестагенными препаратами цикла. Из гонадотропинов для стимуляции роста фолликулов используются аналоги рекомбинантного ФСГ (метродин, урофоллитропин, фертинорм).
Метродин вводят по 1 ампуле (75 МЕ ФСГ) с 3–го или 5–го дня цикла в течение 5–7 дней под контролем ежедневной ультразвуковой фолликулометрии. По достижении доминантным фолликулом диаметра 18–20 мм вводится овуляторная доза ХГ (профази, прегнил) 10.000 ЕД. Если на введение 75 ЕД метродина нет роста доминантного фолликула, дозу увеличивают до 150–225 ЕД.
Патогенетически обоснованным является применение агонистов ЛГРГ (бусерелина, гозерелина) в пульсирующем ритме.
Для профилактики гиперпластических процессов эндометрия назначают гестагены с 16–го по 25–й день условного цикла (норколут, примолютнор, дюфастон, утрожестан).
У больных с выявленной инсулинорезистентностью лечение проводят метформином по 1000–1500 мг/сут в течение 3–6 месяцев под контролем глюкозотолерантного теста.
Отсутствие эффекта от консервативной терапии является показанием для оперативного лечения: клиновидной резекции яичников, электро– или термокаутеризации при лапароскопии. Последнему методу в настоящее время отдается предпочтение, так как он несложен, эффективен, не дает спаечного процесса в области малого таза, сокращает продолжительность пребывания больных в стационаре.
Вторичный синдром поликистозных яичников (надпочечниковая форма СПКЯ) может формироваться у больных с надпочечниковой андрогенией, нейрообменно–эндокринным синдромом (НОЭС), гиперпролактинемией (центральная форма СПКЯ).
Надпочечниковая форма СПКЯ развивается на фоне постпубертатной формы адреногенитального синдрома (АГС), когда нарушения стероидогенеза в коре надпочечников, связанные с генетически обусловленным дефицитом фермента С21–гидроксилазы, появляются после периода полового созревания. Врожденный дефект фермента С21–гидроксилазы приводит к нарушению синтеза кортизола в коре надпочечников. По механизму обратной связи в аденогипофизе увеличиваются образование и секреция АКТГ. Это ведет к гиперстимуляции коры надпочечников с увеличением синтеза предшественников кортизола (прегненолона, прогестерона), из которых идет усиленное образование андрогенов (рис. 5.12).
Надпочечниковые андрогены в яичнике тормозят развитие антральных и предовуляторных фолликулов, увеличивают синтез ингибина. Последний тормозит выделение ФСГ аденогипофизом, что ведет к нарушению соотношения ФСГ и ЛГ в сторону преобладания последнего. ЛГ стимулирует синтез андрогенов тека–клетками яичников. Дефицит ФСГ приводит к нарушению пролиферации гранулезных клеток, роста и созревания фолликулов, ароматизации андрогенов в эстрогены и в конечном счете к кистозной атрезии фолликулов и развитию ПКЯ.
Для больных с надпочечниковой формой СПКЯ характерен морфотип, приближающийся к интерсексуальному, с нерезко выраженными признаками вирилизации: спортивный тип телосложения, высокий рост, длинные конечности, преобладание ширины плеч над поперечными размерами таза (в основном межвертельного). Молочные железы слегка гипопластичны, конической формы. Избытка массы тела нет. Гипертрихоз развивается до возраста менархе. Он более выражен, чем при первичном СПКЯ. Избыточный рост волос отмечается на конечностях, внутренней поверхности бедер, промежности, в нижней части живота; на лице – рост стержневых волос над губой, на подбородке, на щеках (бакенбарды). У некоторых больных на лице, груди и спине имеются acne vulgaris.
 Рис. 5.12. Механизм развития вторичного ПКЯ при постпубертатной форме АГС: АКТГ – адренокортикотропный гормон; ДЭА – дегидроэпиандростерон; АСД – андростендион; АС – андростерон; черная стрелка \ – повышенный уровень; пунктирная стрелка | – пониженный уровень
Рис. 5.12. Механизм развития вторичного ПКЯ при постпубертатной форме АГС: АКТГ – адренокортикотропный гормон; ДЭА – дегидроэпиандростерон; АСД – андростендион; АС – андростерон; черная стрелка \ – повышенный уровень; пунктирная стрелка | – пониженный уровень
Менархе наступает в 16–18 лет. Нарушения менструальной функции проявляются сразу по типу ДМК, олигоменореи, вторичной аменореи. Бесплодие чаще первичное. В связи с тем что при данной форме СПКЯ нарушение соотношения ЛГ/ФСГ менее выражено, чем при первичном СПКЯ, у части женщин периодически происходит созревание фолликула, овуляция и наступает беременность, которая часто прерывается в ранние сроки.
Наружные половые органы развиты правильно, иногда несколько гипопластичны, клитор незначительно увеличен. При бимануальном исследовании выявляется узкое влагалище, коническая или субконическая шейка и небольшое тело матки (меньше нормы). Яичники увеличены асимметрично, размеры их не так велики, как при первичном СПКЯ.
Диагностика заболевания основывается на особенностях клинической картины, изложенных выше, и результатах дополнительных методов исследования.
При УЗИ яичники увеличены незначительно, асимметрично, с кисточками диаметром 5–10 мм. Выраженного утолщения капсулы нет. Размеры матки свидетельствуют об ее умеренной гипоплазии.
Макроскопически (при лапароскопии) капсула яичников незначительно утолщена, сквозь нее хорошо просвечивается множество фолликулярных кисточек.
Для морфологической картины биоптата яичников характерны неравномерное утолщение капсулы, нерезко выраженная гиперплазия стромы, атрезирующиеся фолликулы, белые, а иногда желтые тела.
Гиперпластические процессы эндометрия практически не встречаются, так как при данной форме СПКЯ не происходит экстрагонадная ароматизация андрогенов в эстрогены.
Тесты функциональной диагностики выявляют низкую эстрогенную насыщенность.
Гормональными критериями надпочечниковой формы СПКЯ являются повышение в крови концентрации 17–гидроксипро–гестерона (17–ОН–прогестерона) и дегидроэпиандростерона (ДЭА), увеличение экскреции с мочой 17–КС (более выраженное, чем при болезни ПКЯ), положительная проба с дексаметазоном.
Повышение уровня ЛГ в плазме крови менее выражено, чем у больных с первичными СПКЯ, уровень ФСГ снижен. Соотношение ЛГ/ФСГ – 1,52: 1.
Лечение больных надпочечниковой формой СПКЯ заключается в назначении глюкокортикоидных гормонов, которые, подавляя по механизму отрицательной обратной связи секрецию АКТГ аденогипофизом, тормозят синтез андрогенов в коре надпочечников. Для лечения чаще применяется дексаметазон, доза которого подбирается индивидуально (0,25–0,5 мг/сут), в зависимости от исходного уровня 17–КС, ДЭА, 17–гидроксипрогестерона и их динамики в процессе терапии.
Об эффективности лечения судят по клиническим данным (восстановление ритма менструаций, наступление беременности) и результатам базальной термометрии (восстановление овуляции, полноценность лютеиновой фазы).
Если терапия глюкокортикоидами не вызывает овуляции, то лечение дополняется кломифеном в дозе 50–75 мг с 5–го по 9–й день цикла.
Для лечения гипертрихоза применяется антиандроген ципротерона ацетат в сочетании с этинилэстрадиолом (диане–35) с 5–го по 25–й день цикла, спиронолактон (верошпирон) по 100 мг в день, флутамид по 250–500 мг в день в течение 6 и более месяцев.
Оперативные методы лечения неэффективны, так как не устраняют основной причины заболевания.
Синдром поликистозных яичников (центральная форма) – в основе лежит дисфункция надгипоталамического и гипоталамического уровней регуляции репродуктивной системы.
Центральная форма СПКЯ может развиться на фоне нейрообменно–эндокринного синдрома (НОЭС), связанного и не связанного с беременностью, стрессом, гиперпролактинемией.
При воздействии неблагоприятных факторов внешней или внутренней среды (инфекции, интоксикации, эмоциональный психический стресс, физические нагрузки, переутомление) в надгипоталамической области нарушается выделение нейротрансмиттеров (эндорфинов, дофамина). Следствием этого могут стать нарушение ритма секреции ЛГРГ и усиление выброса ЛГ из клеток аденогипофиза, активация системы кортиколиберин – АКТГ – кора надпочечников, увеличение секреции пролактина (рис. 5.13). Далее включаются патогенетические механизмы, сходные с таковыми при первичном СПКЯ.
 Рис. 5.13. Патогенетические механизмы развития центральной формы СПКЯ: β–ЭНД – β–эндорфин; ДА – дофамин; АКТГ–РГ – рилизинг–гормон АКТГ; ЛГ–РГ – рилизинг–гормон ЛГ; ПРЛ – пролактин; черная стрелка – усиление; пунктирная стрелка – угнетение
Рис. 5.13. Патогенетические механизмы развития центральной формы СПКЯ: β–ЭНД – β–эндорфин; ДА – дофамин; АКТГ–РГ – рилизинг–гормон АКТГ; ЛГ–РГ – рилизинг–гормон ЛГ; ПРЛ – пролактин; черная стрелка – усиление; пунктирная стрелка – угнетение
Для клинической картины центральной формы СПКЯ характерны различные проявления гипоталамических нарушений: соматоформная дисфункция вегетативной нервной системы, часто по гипертоническому типу, головные боли, быстрая утомляемость, слабость, нарушение памяти, сна и бодрствования, эмоциональная неустойчивость (раздражительность, плаксивость), жажда, увеличение аппетита.
При осмотре больных обращает на себя внимание избыточная масса тела (ожирение III –IV степени) с отложением жировой ткани на плечевом поясе, в нижней половине живота, на бедрах, в области молочных желез. На коже груди, живота, бедер, ягодиц видны полосы растяжения белесоватого цвета. Гипертрихоз слабо выражен: единичные стержневые волосы имеются на лице, более интенсивный их рост отмечается по белой линии живота и внутренней поверхности бедер. Избыточный рост волос начинается вслед за ожирением и нарушением менструальной функции.
Особенностью менструальной функции является неустойчивый характер циклов с возраста менархе. Продолжительность менструальных циклов непостоянная, от 21 до 36 дней, в летние месяцы увеличивается до 1,5–2 месяцев. Возраст менархе – 12–13 лет. Развитие олигоменореи происходит на фоне быстрой прибавки массы тела (8–10 кг и более). Пусковыми моментами могут быть детские инфекции (корь, паротит, краснуха), ангины, аденовирусная инфекция, эмоционально–психические травмы, начало половой жизни, роды, аборты искусственные или самопроизвольные, травмы черепа.
Бесплодие у больных с центральной формой СПКЯ чаще вторичное.
Нарушения углеводного обмена могут выражаться в снижении толерантности к углеводам и гиперинсулинемии, гипергликемии, развитии сахарного диабета.
При гинекологическом осмотре у больных с СПКЯ на фоне НОЭС, не связанного с беременностью и родами, обнаруживается умеренное половое оволосение, гипоплазия наружных и внутренних половых органов (у рожавших женщин этих изменений может не быть). Яичники увеличены и всегда с гладкой поверхностью, подвижные, безболезненные.
Диагностика СПКЯ центрального генеза основывается на данных анамнеза и особенностях развития клинической картины заболевания.
Ультразвуковое сканирование выявляет умеренное увеличение яичников с кистозными включениями без утолщения капсулы. Этот метод может быть полезным для выявления гиперплазии эндометрия, риск развития которой связан с возможностью ароматизации андрогенов в эстрогены в жировой ткани.
При лапароскопическом исследовании, в зависимости от длительности заболевания, можно увидеть два типа макроскопических изменений в яичниках: ■ яичники не увеличены, со сглаженной капсулой без следов овуляции и желтых тел ■ при давности заболевания более 3 лет яичники увеличены (средние размеры 4,5 *4,0*3,5 см), с гладкой поверхностью, утолщенной белесоватой капсулой, через которую просвечиваются мелкие голубоватые кисточки диаметром 4–8 мм.
Тесты функциональной диагностики свидетельствуют об умеренной гипоэстрогении и отсутствии овуляции.
Уровень гормонов может колебаться в широких пределах, однако концентрация ЛГ в периферической крови повышена, уровень ФСГ не отличается от нормы, отношение ЛГ/ФСГ превышает норму, уровень ПРЛ у части больных может быть повышенным, содержание АКТГ кортизола, тестостерона, ДЭА, экскреция с мочой 17–КС находятся на уровне верхней границы нормы или повышены. Содержание эстрогенов снижено.
На рентгенограммах черепа у большинства больных выявляются признаки внутричерепной гипертензии («пальцевые» вдавления), утолщение или остеопороз костей свода черепа, уменьшение размеров и сужение входа турецкого седла. На ЭЭГ обнаруживаются изменения, характерные для нарушений функции гипоталамического отдела мозга, на РЭГ – асимметрия кровенаполнения сосудов мозга, нарушение венозного оттока.
Нарушения липидного обмена подтверждаются повышением уровня холестерина, триглицеридов, ЛПНП и ЛПОНП, углеводного обмена – увеличением уровня инсулина и нарушением толерантности к глюкозе.
Большой вклад в разработку патогенеза и принципов лечения НОЭС внесли В.Н. Серов, Л.Г. Тумилович, Л.Н. Улятовская (1988).
Они определили строгую этапность в лечении больных с НОЭС: ■ снижение массы тела и ликвидация обменных нарушений ■ регуляция нейромедиаторного обмена ■ восстановление овуляторных циклов и репродуктивной функции ■ лечение гиперпластических процессов.
Лечение следует начинать с мероприятий, направленных на снижение массы тела: диета с ограничением калорийности до 1200–1800 ккал; ограничение животных жиров и углеводов; питание 5–6–разовое, с разгрузочными днями 1–3 раза в неделю (фруктовые, овощные, молочные, творожные, мясоовощные); ограничение приема жидкости до 1,5 л; дозированная физическая нагрузка; прием верошпирона по 25 мг 3 раза в сутки в течение 2–6 месяцев, тироксина. Снижение массы тела на 12–15% может привести к восстановлению овуляции.
Для регуляции нейромедиаторного обмена показано назначение дилантина (дифенина 100 мг 2 раза в день), бромокриптина (парлодела). Дилантин изменяет чувствительность рецепторов серотонина и дофамина, нормализует секрецию дофамина и опосредованно – скорость секреции кортизола.
Больным с повышенным уровнем пролактина и гипертензией показано назначение агониста дофамина бромокриптина в дозе от 2,5 мг (1 таблетка) и выше (в зависимости от исходного уровня пролактина). Продолжительность приема – до 6 месяцев.
При выявлении инсулинорезистентности и интолерантности к глюкозе рекомендуется применение метформина (скофора) по 1500 мг/сут в течение 3–6 месяцев.
Выявление у больных диэнцефальных нарушений, патологических изменений ЭЭГ, РЭГ является показанием для назначения препаратов, улучшающих трофику (глютаминовая кислота, ноотропил, церебролизин) и микроциркуляцию мозга (стугерон, кавинтон, танакан).
Для лечения гирсутизма применяют флутамид (250 мг в день в течение 6 месяцев), верошпирон (6–8 таблеток в день), андрокур (50 мг в день) или низкодозированные комбинированные оральные контрацептивы (мерсилон, логест) в течение 6–12 месяцев.
Восстановление овуляции требует дополнительного назначения кломифена.
Для лечения гиперпластических процессов эндометрия применяются синтетические или природные гестагены по общепринятым схемам.
Клиновидная резекция или каутеризация яичников показана только при отсутствии эффекта от консервативной терапии или по онкологическим показаниям при рецидивирующей или атипической гиперплазии эндометрия.
У больных СПКЯ относительная гиперэстрогения создает риск развития гиперпластических процессов, предрака и рака эндометрия, особенно при избыточной массе тела (ароматизация андрогенов в эстрогены в жировой ткани), а также развития гормональнозависимой патологии матки (миома, эндометриоз) и молочных желез (мастопатия).
В связи с этим женщины с СПКЯ, даже в случае успешного восстановления менструальной и детородной функции, должны находиться под наблюдением гинеколога.
Беременность и роды у женщин с СПКЯ протекают с осложнениями: возможны невынашивание, развитие гестоза, несвоевременное излитие вод, слабость родовой деятельности, гипоксия плода.
Девочки, родившиеся у матерей с СПКЯ, нуждаются в наблюдении детского гинеколога для своевременного выявления и лечения у них нарушений репродуктивной системы (изолированное пубархе, гипоталамический синдром, СПКЯ) в период полового созревания.
Адреногенитальный синдром
Адреногенитальный синдром (АГС), или врожденная гиперплазия коры надпочечников, – это генетически обусловленная патология, характеризующаяся дефицитом отдельных ферментов, необходимых для синтеза стероидов в коре надпочечников: 3Р–ол–дегидрогеназы, 21–гидроксилазы, 11Р–гидроксилазы или 17–гидроксилазы. В 90% случаев развитие АГС обусловлено дефицитом 21–гидроксилазы, реже – 11Р–гидроксилазы.Частота АГС колеблется от 1 случая на 3500–5000 новорожденных до 1 на 10.000–15.000 новорожденных.
Адреногенитальный синдром является заболеванием с аутосомно–рецессивным типом наследования, при котором повреждается ген, ответственный за синтез 21–гидроксилазы. Этот ген сцеплен с системой генов ИЬА, локализованных на коротком плече 6–й хромосомы.
Дефицит 21–гидроксилазы приводит к снижению синтеза кортизола в коре надпочечников. При этом нарушается регуляция секреции АКТГ: отсутствие тормозящего влияния кортизола и стимулирующее действие 17–ОН–прогестерона по механизму обратной связи приводит к увеличению секреции АКТГ. Последний вызывает двухстороннюю гиперплазию коры надпочечников и активацию синтеза предшественников кортизола, из которых идет образование андрогенов. С увеличением уровня последних связаны основные проявления заболевания (рис. 5.14).
Классификация
В настоящее время принято выделять две формы дефицита 21–гидроксилазы: классическую (врожденную) и неклассическую (стертую, мягкую или позднюю). Последнюю форму некоторые авторы делят на пубертатную и постпубертатную (взрослую). Рис. 5.14. Схема патогенеза адреногенитального синдрома:АКТГ – адренокортикотропный гормон; ГТ – гонадотропины; ДЭА – дегидроэпиандростерон; АСД – андростендион; АС – андростерон; черная стрелка – стимуляция; пунктирная стрелка – торможение
Рис. 5.14. Схема патогенеза адреногенитального синдрома:АКТГ – адренокортикотропный гормон; ГТ – гонадотропины; ДЭА – дегидроэпиандростерон; АСД – андростендион; АС – андростерон; черная стрелка – стимуляция; пунктирная стрелка – торможение
При врожденной форме АГС нарушения функции коры надпочечников возникают внутриутробно, при пубертатной – в период гормонального покоя (до менархе), при постпубертатной – после менархе в период половой зрелости.
В зависимости от характера дефицита ферментных систем в коре надпочечников выделяют 3 формы врожденного АГС (рис. 5.15): ■ вирильную, обусловленную дефицитом 21–гидроксилазы и усилением образования андрогенов в сетчатой зоне коры надпочечников ■ сольтеряющую, связанную с дефицитом фермента 3Р–ол–дегидрогеназы и нарушением синтеза минералокортикоидов ■ гипертоническую, развивающуюся в результате дефекта фермента 11Р–гидроксилазы и усилением продукции дезоксикортикостерона. В гинекологической практике приходится иметь дело с больными, страдающими вирильной формой АГС.
Вирильная (классическая) форма АГС развивается в эмбриональном периоде. Под воздействием тестостерона происходит вирилизация наружных половых органов (женский псевдогермафродитизм). Внутренние половые органы и яичники формируются нормально. При рождении ребенка нередко возникают трудности в определении пола, так как отмечаются увеличение клитора различной степени (иногда он напоминает половой член), углубление преддверия влагалища, высокая промежность, слияние больших половых губ в виде мошонки, персистенция урогенитального синуса. Последний представляет собой слияние нижних двух третей влагалища и уретры и открывается под увеличенным клитором.
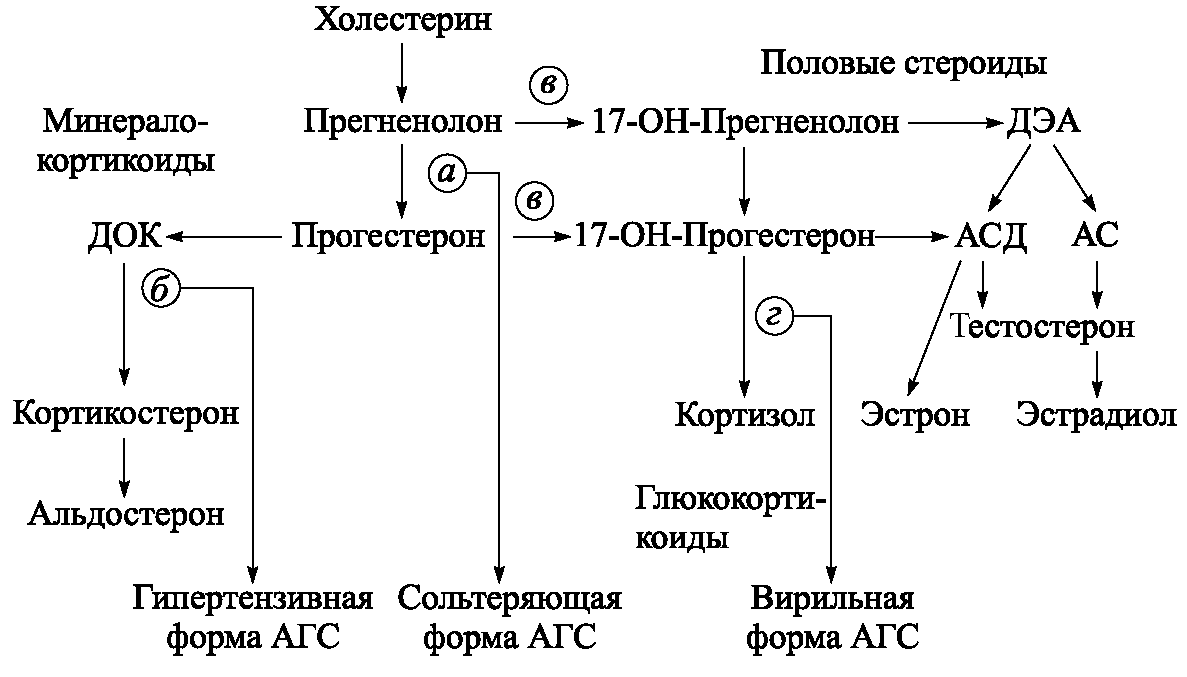 Рис. 5.15. Варианты нарушений стероидогенеза в коре надпочечников у больных с врожденным АГС:ДОК – дезоксикортикостерон; ДЭА – дегидроэпиандростерон; АСД – андростендион; АС – андростерон; а – 3р–ол–дегидрогеназа; б – 11–гидроксилаза; в – 17а–гидроксилаза; г – 21–гидроксилаза
Рис. 5.15. Варианты нарушений стероидогенеза в коре надпочечников у больных с врожденным АГС:ДОК – дезоксикортикостерон; ДЭА – дегидроэпиандростерон; АСД – андростендион; АС – андростерон; а – 3р–ол–дегидрогеназа; б – 11–гидроксилаза; в – 17а–гидроксилаза; г – 21–гидроксилаза
Степень вирилизации зависит от выраженности ферментного дефекта. В большей мере вирилизация выражена при дефиците 21–гидроксилазы, в меньшей мере – у больных с дефицитом других ферментов.
В постнатальном периоде в связи с анаболическим действием андрогенов наблюдаются быстрый рост детей, развитие мускулатуры, ускорение дифференцировки костного скелета. Костный возраст детей на 5–6 лет опережает хронологический. К 9–10 годам зоны роста начинают закрываться, в связи с чем рост больных с врожденной формой АГС низкий и колеблется от 120 до 160 см (в среднем 140–150 см).
Телосложение у девочек с АГС имеет диспластический характер: широкие плечи, узкий таз, короткие конечности. Трубчатые кости массивные. Из–за усиленного развития мускулатуры больные имеют вид атлетов.
Половое созревание больных АГС начинается с 3–5 лет и протекает по гетеросексуальному типу с развитием мужских вторичных половых признаков. Половое оволосение на лобке появляется в 2–5 лет. С 5–6 лет на коже лица и спины появляются acne vulgaris. К 10 годам наблюдаются понижение тембра голоса, гипертрофия перстневидного хряща гортани, рост бороды, усов, бакенбардов, усиливается рост волос на конечностях. Начинается облысение. Молочные железы не развиваются. Менструальная функция отсутствует.
При сольтеряющей форме признаки вирилизации наружных половых органов менее выражены, чем при вирильной. Отмечается повышенная пигментация мошонкообразных половых губ. В связи с нарушением синтеза минералокортикоидов на первый план выступают симптомы, связанные с потерей натрия и хлоридов и гиперкалиемией: рвота, поносы, отсутствие аппетита. Обильная рвота, не связанная с приемом пищи, часто наблюдается с первых дней жизни ребенка (реже на 4–5–й неделе). К ней присоединяется диарея, что усугубляет обезвоживание и ведет к быстрой потере массы тела. Кожа становится сухой, с землистым оттенком, вокруг глаз и рта – цианотичной. Отмечается также сухость слизистых оболочек. Мышечная гипотония может иногда сменяться судорогами. Без лечения развиваются коллапс, нарушение сердечного ритма, больные погибают.
В более легких случаях заболевание проявляется только отсутствием прибавки массы тела и повторными срыгиваниями.
Гипертоническая форма АГС встречается редко (1 случай на 20.000–30.000 родившихся), проявляется в 1–е десятилетие жизни. Кроме вирилизации, у больных этой формой АГС развиваются нарушения сердечно–сосудистой системы, обусловленные длительной артериальной гипертензией. У больных артериальное давление колеблется от нормальных величин до 230/170 мм рт. ст. Гипертонические кризы уже в раннем возрасте могут осложняться кровоизлияниями в мозг с развитием гемипарезов. Наблюдают вторичные изменения сосудов почек, сердца, глазного дна. В моче определяются лейкоциты, эритроциты, цилиндры, белок.
Диагностика классической формы АГС строится на клинических проявлениях и результатах рентгенологических, ультразвуковых, гормональных и генетических исследований.
Клинические особенности включают рождение ребенка с неопределенным строением гениталий (часто пенисообразный клитор и урогенитальный синус), раннее пубархе и преждевременное половое созревание по мужскому (гетеросексуальному) типу, мужской тип оволосения, низкий рост.
Рентгенологическое определениекостного возраста выявляет опережение календарного почти на 50% (исследуются ядра окостенения кистей рук).
Супраренография или томография надпочечников на фоне ретропневмоперитонеума выявляет увеличение надпочечников с сохранением треугольной формы, что подтверждает гиперпластический процесс и отрицает опухолевый процесс, для которого характерно одностороннее увеличение надпочечника.
Ультразвуковое исследование подтверждает наличие гипопластичной матки, яичников и гиперплазию надпочечников.
Из гормональных тестов наиболее информативными являются определение уровня андрогенов (тестостерона, ДЭА, ДЭА–сульфата) и их метаболитов. Для АГС характерно повышение содержания тестостерона в крови, в 5–10 раз превышающее возрастную норму, ДЭА, ДЭА–С, а также 17–ОН–прогестерона, андростендиона. Резко повышена экскреция с мочой 17–КС. Для гипертонической формы показательна высокая экскреция 11 – дезоксикортизола.
Проба с преднизолоном или дексаметазоном положительная (при опухоли надпочечников – отрицательная).
Генетическое исследование выявляет у больных АГС положительный половой хроматин и женский кариотип 46ХХ.
Основным методом лечения врожденной формы АГС является применение глюкокортикоидных гормонов (преднизолон, дексаметазон), которые компенсируют их недостаток, подавляют по механизму обратной связи секрецию АКТГ гипофизом, что в свою очередь ведет к снижению синтеза и секреции андрогенов. Лечение должно начинаться рано, проводиться постоянно и пожизненно. Наиболее эффективно лечение, начатое до 7 лет, так как оно обеспечивает половое развитие по женскому типу.
Доза преднизолона подбирается индивидуально: у детей до 1 года она обычно не превышает 2,5 мг/сут, до 5 лет – 5 мг, в 6–12 лет – 5–7,5 мг, в 13–18 лет – 10–15 мг. При лечении дексаметазоном необходимо учитывать, что 0,5 мг препарата эквивалентны по клиническому эффекту 3,5 мг преднизолона.
При стрессовых ситуациях (менархе, детские инфекции, операции и др.), а также с возрастом дозу увеличивают.
Подбор дозы контролируется уровнем экскреции 17–КС и считается адекватным, если содержание 17–КС в суточной моче остается в пределах средней возрастной нормы или верхней ее границы.
Хирургическую коррекцию наружных половых органов проводят обычно через 6–12 месяцев после начала лечения. Первый этап операции – удаление пенисообразного клитора – выполняется как можно раньше после установления диагноза (не позднее 3–4–летнего возраста). Второй этап – рассечение урогенитального синуса и формирование входа во влагалище – производится в 12–13 лет (не ранее 10–11 лет).
При сольтеряющей форме АГС кроме заместительной терапии глюкокортикоидами для восполнения потери солей и воды назначают внутрь поваренную соль и кортикостероиды, обеспечивающие задержку натрия.
Гипертензия, связанная с АГС, устраняется только кортизолом. Необходим постоянный контроль баланса электролитов, АД, массы тела и роста в сопоставлении с костным возрастом.
Пубертатная форма АГС является следствием недостаточности фермента 21–гидроксилазы коры надпочечников, но, как правило, менее выраженна, чем при врожденной форме АГС.
Клиническая картина пубертатной формы АГС более легкая: гипертрихоз проявляется в виде роста стержневых волос над верхней губой, на щеках, околососковых ареолах, по белой линии живота, на промежности, бедрах, голенях; кожа жирная, пористая; на спине, груди, лице появляются розовые угри (акне); молочные железы гипопластичные; половые органы развиты по женскому типу, но отмечаются увеличение клитора, умеренная гипоплазия малых и больших половых губ, матки.
В связи с усиленным ростом костей до менархе рост девочек с АГС выше, чем у здоровых сверстниц, но в дальнейшем происходит раннее закрытие эпифизарных хрящей и рост прекращается. Особенностью телосложения больных является некоторая вирилизация фигуры: увеличение ширины плеч, узкий таз, укорочение конечностей, невысокий рост, хорошо развитая мускулатура. Тембр голоса нормальный.
Менархе у большинства больных наступает в 15–16 лет, но менструации носят нерегулярный характер, становятся редкими (интервал между месячными составляет 34–45 дней) или прекращаются.
Выделение метаболитов андрогенов с мочой у больных превышает норму в 1,5–2 раза.
Постпубертатная форма АГС проявляется, как правило, после менархе или у взрослых женщин. Патология также обусловлена дефицитом 21–гидроксилазы, который до определенного времени компенсируется. Проявление дефекта ферментной системы может быть спровоцировано усилением функции надпочечников (эмоциональный стресс, начало половой жизни, беременность и ее прерывание). Избыток андрогенов тормозит выделение гонадотропинов, что в свою очередь нарушает циклические процессы в яичниках. Степень выраженности нарушения функции яичников может быть разной: от аменореи и олигоменореи до развития неполноценного желтого тела при наличии овуляции и регулярных менструаций.
Клинические проявления постпубертатной формы АГС характеризуются нарушением менструальной функции сразу после менархе: сначала отмечается задержка менструации, затем могут развиться гипоменструальный синдром, вторичная аменорея. Бесплодие часто первичное. Половое оволосение появляется до менархе и сразу приобретает избыточный характер.
У некоторых больных отмечается латентное течение АГС без клинических проявлений вирилизации. Менструальные циклы у них могут быть регулярными, овуляторными с недостаточностью лютеиновой фазы или ановуляторными. Беременность при наличии овуляции может наступать, но обычно самопроизвольно прерывается в ранние сроки, что связано с недостаточностью желтого тела, склерозированием сосудов эндо– и миометрия, хориона вследствие гиперандрогении.
Диагностика мягких форм АГС может представлять трудности. Необходимо учитывать данные анамнеза о наличии гипертрихоза, нарушений менструальной функции у сестер, матерей, родственниц по материнской и отцовской линии.
Клиническими особенностями данных форм АГС являются: ■ раннее появление и быстрое развитие чрезмерного полового оволосения ■ задержка менархе, нерегулярные менструальные циклы с тенденцией к задержкам месячных ■ телосложение с признаками вирилизации (суженный таз, широкие плечи), гипертрихоз, угревая сыпь, умеренная гипоплазия молочных желез ■ отсутствие ожирения ■ увеличение расстояния между основанием клитора и наружным отверстием уретры.
Ведущая роль в диагностике мягких форм АГС принадлежит гормональным исследованиям: определению уровня экскреции с мочой 17–КС; ДЭА, ДЭА–С, тестостерона и 17–гидроксипрогестерона в крови до и после проведения проб с глюкокортикоидами.
Для выявления латентной формы АГС проводится проба с АКТГ, при этом отмечаются значительное повышение в крови 17–гидроксипрогестерона и снижение кортизола.
Положительная проба с дексаметазоном и АКТГ подтверждает надпочечниковое происхождение андрогенов и исключает яичниковую гиперандрогению.
Ультразвуковое сканирование выявляет уменьшение размеров матки при нормальных размерах яичников. Этот метод позволяет исключить поликистозные яичники и вирилизирующую опухоль яичника.
Рентгенологически можно выявить преждевременное закрытие зон роста костей, исключить опухоль надпочечников (компьютерная томография в условиях ретропневмоперитонеума).
Лечение мягких форм АГС заключается в назначении поддерживающих доз глюкокортикоидных гормонов (кортизола или его синтетических аналогов – преднизолона и дексаметазона) под контролем содержания в суточной моче 17–КС, ДЭА и тестостерона в крови. Их уровень не должен превышать верхней границы нормы. Обычно используются небольшие дозы препаратов: преднизолон по 5 мг, дексаметазон по 0,5 мг. После нормализации показателей 17–КС, ДЭА, тестостерона и восстановления нормального менструального цикла глюкокортикоиды назначают в 1–ю фазу цикла.
Об эффективности лечения можно судить по следующим клиническим данным: укорочению продолжительности менструального цикла; появлению двухфазной базальной температуры, восстановлению овуляции; наступлению беременности. Если после нормализации продолжительности цикла овуляция не наступает или имеется недостаточность лютеиновой фазы, дополнительно назначается кломифен в дозе 50–100 мг с 5–го по 9–й день цикла. После наступления беременности лечение глюкокортикоидами следует продолжить для предупреждения самопроизвольного ее прерывания.
Для лечения гипертрихоза можно применять антиандроген ципротерона ацетат (андрокур). Он снижает уровень тестостерона в крови, тормозит образование дигидротестостерона из тестостерона, блокирует рецепторы тестостерона в волосяных фолликулах. Препарат назначают в дозе 50–100 мг/сут с 5–го по 25–й день цикла в течение длительного времени (от 4–6 месяцев до 1 года). Обычно ципротерона ацетат сочетают с этинилэстрадиолом (комбинированный препарат диане–35). Лечение в течение 4–6 месяцев приводит к ликвидации жирной себореи, угревой сыпи, тормозит рост волос на лице и туловище.
Для лечения гирсутизма у больных АГС можно использовать спиронолактон (верошпирон) по 25 мг 2–4 раза в день в течение 6 месяцев и более.
Прогноз при своевременном и адекватном лечении АГС благоприятный как для жизни, так и для восстановления менструальной и репродуктивной функции. При гипертонической форме он зависит от степени вовлечения в патологический процесс сердечно–сосудистой системы.
Профилактика врожденного АГС должна заключаться в назначении с началом беременности дексаметазона женщинам с высоким риском рождения больных детей под контролем содержания 17–гидроксипрогестерона, тестостерона и ДЭА в крови. При правильном лечении новорожденные имеют нормальную массу и рост, предотвращается их внутриутробная вирилизация.
Предменструальный синдром
Предменструальный синдром (ПМС) – это сложный патологический симптомокомплекс, возникающий в предменструальные дни и проявляющийся нервно–психическими, вегетативно–сосудистыми и обменно–эндокринными нарушениями. Симптомы ПМС возникают за 2–14 дней до начала менструации и исчезают (или резко уменьшаются) в первые ее дни.Впервые ПМС был описан R. Frank в 1931 г. под названием «Premenstrual tension» (предменструальное напряжение), и с тех пор это заболевание считается нозологической единицей, вошедшей в МКБ 10–го пересмотра.
Предменструальный синдром диагностируется у 9–20% женщин с регулярным менструальным циклом, хотя встречается на практике значительно чаще. С возрастом частота ПМС увеличивается: в 19–29 лет она составляет 20%, в 30–39 лет – 47%, в 40–49 лет – 55%. Известны случаи дебюта ПМС сразу после первой менструации (менархе) и в климактерии.
Социально–экономическая значимость заболевания определяется отрицательным влиянием окружающей среды на здоровье, трудоспособность и качество жизни больных, снижением уровня их семейной и социальной адаптации.
Этиология и патогенез ПМС остаются неясными. Развитию ПМС и более тяжелому его течению способствуют провоцирующие факторы: осложненные роды и аборты, нервно–психические стрессы, инфекции, наличие у женщины сопутствующей хронической экстрагенитальной патологии, профессиональных вредностей на работе. Этот синдром чаще развивается у женщин интеллектуального труда, эмоционально лабильных, астенического телосложения, с дефицитом массы тела.
Существует несколько теорий патогенеза ПМС.
Гормональная теория объясняет развитие ПМС абсолютной или относительной гиперэстрогенией. Эстрогены стимулируют секрецию ангиотензиногена печенью, что вызывает активацию системы ренин – ангиотензин – альдостерон, задержку натрия и жидкости в межклеточном пространстве и развитие отеков, нагрубание и болезненность молочных желез, головную боль, метеоризм. Аккумулируясь в лимбической системе, эстрогены могут приводить к развитию психоневрологической симптоматики ПМС; вызывая гипокалиемию и гипогликемию, могут быть причиной болей в области сердца, усталости и гиподинамии.
Теории водной интоксикации и гиперадренокортикальной активности близки по своей сути гормональной теории, так как объясняют развитие симптомов ПМС, в частности, общей задержкой жидкости в организме, мастодинией, повышением уровня эстрогенов и альдостерона.
Авитаминоз во 2–й фазе менструального цикла может способствовать развитию ПМС. Так, недостаток витамина В6 замедляет обмен эстрогенов и создает возможность их накопления с последующим развитием некоторых симптомов ПМС. Кроме того, витамин В6 действует как кофермент (пиридоксальфосфат) в заключительной стадии биосинтеза дофамина и серотонина, поэтому при его дефиците, вызванном избытком эстрогенов, могут наблюдаться изменения настроения и поведения (результат нарушения синтеза серотонина). Увеличение секреции пролактина и развитие симптоматики со стороны молочных желез могут быть следствием дефицита дофамина.
Недостаток магния может приводить к селективной недостаточности дофамина в мозге, чем объясняются симптомы беспокойства и раздражительности. Дефицит магния способствует увеличению секреции альдостерона и задержке натрия и жидкости в организме, развитию симптомов со стороны сердечнососудистой системы (тахикардия, экстрасистолия, мигренеподобные скачки АД), церебральных (давящая боль в голове, головокружение, страх, депрессия, плохая концентрация внимания), висцеральных (тошнота, рвота, спастические боли) симптомов.
Недостаточность ненасыщенных жирных кислот и обусловленное этим нарушение синтеза простагландинов могут способствовать развитию таких симптомов ПМС, как депрессия, раздражительность, нервозность, масталгия, боли и вздутие живота, повышение температуры тела. Недостаток ПГЕ1 и ПГЕ2 приводит к нарушению синтеза прогестерона и отностильной гиперэстрогении. Простагландины стимулируют секрецию антидиуретического гормона. Последний вызывает задержку жидкости, развитие отека и других симптомов ПМС (вздутие живота, масталгия, головная боль). Увеличение уровня ПГЕ2 приводит к сокращению интракраниальных сосудов и развитию мигрени, а дефицит ПГЕ1 вызывает депрессию. Недостаток ПГЕ1 и избыток ПГФ2а способствуют повышению уровня пролактина. Следствием этого могут быть циклические боли в молочной железе (масталгия).
Нейротрансмиттеры в ЦНС играют важную роль в регуляции нейроэндокринных процессов и поведенческих реакций. Адреналин вызывает тошноту, повышенный уровнь серотонина – нервное напряжение, бессонницу, сердцебиение, нарушение внимания. С колебаниями уровня серотонина могут быть связаны депрессия или агрессия. Эндорфины, ингибируя центральные биогенные амины, могут вызывать изменения настроения, повышение аппетита и жажду. Нагрубание молочных желез, задержка жидкости, запоры и вздутие кишечника могут быть результатом вызванного эндорфинами увеличения уровня пролактина, вазопрессина и ингибирующего влияния их на ПГЕ1 в кишечнике. Существенное падение уровня эндорфинов в плазме крови женщин с ПМС отмечается во время предменструального периода.
Согласно теории эндогенной гормональной аллергии, ПМС является следствием повышенной чувствительности к эстрогенам и прогестерону. У 74–80% женцин с ПМС отмечается положительная кожная реакция на введение половых стероидов.
При сенсибилизации к прогестерону преобладают симптомы, характерные для повышенного тонуса симпатической нервной системы: раздражительность, плаксивость, рассеянное внимание, бессонница или дробный сон, познабливание, зябкость, холодный липкий пот, холодные руки и ноги и их онемение, субфебрилитет или гипертермия до 38–39 °С, ощущение сухости во рту, учащенное сердцебиение, вздутие живота, запоры, редкое мочеиспускание, ухудшение самочувствия чаще днем или вечером. Возможно развитие аутоиммунного прогестеронзависимого дерматита (предменструальная крапивница).
Повышенная чувствительность к фракции эстрогенов проявляется симптомами ваготонии: слабость, апатия, депрессия, глубокий сон, спастические боли за грудиной, затрудненный вдох и выдох, колющие боли в сердце, аритмия, слюнотечение, тошнота, рвота, понос, ощущение жара в теле, жжение слизистых (языка, горла, вульвы), кратковременные обмороки, обильные менструации, частое мочеиспускание, ухудшение самочувствия чаще ночью и утром.
Таким образом, существование большого количества теорий свидетельствует о том, что этиология ПМС мультифакторная.
Клиническая картина ПМС насчитывает около 150 симптомов, которые можно распределить на три группы. В зависимости от преобладания тех или иных клинических симптомов выделяют нервно–психическую, отечную, цефалгическую и кризовую формы ПМС. Отечная форма чаще встречается в возрасте 20–24 лет, нервно–психическая – в 25–34 года, цефалгическая и кризовая – в переходном периоде жизни женщины.
Нервно–психическая форма ПМС характеризуется преобладанием таких симптомов, как раздражительность, депрессия, слабость, плаксивость, агрессивность. Поэтому нередко больные первоначально обращаются к психиатру или невропатологу и лишь в последнюю очередь, при выявлении стойкой цикличности возникновения симптомов, – к гинекологу. В гормональном статусе выявляется повышение уровня пролактина, гистамина, кортизола, альдостерона и эстрадиола.
Отечная форма ПМС проявляется болезненным нагрубанием молочных желез, отечностью лица, голеней, кистей рук, вздутием живота, раздражительностью, слабостью, потливостью, зудом кожи, увеличением массы тела, повышенной чувствительностью к запахам в предменструальные дни. Задержка жидкости в лютеиновую фазу цикла выявляется только у 75% больных, у остальных, несмотря на видимые отеки, диурез не меняется, что связано с перераспределением жидкости в тканях. В крови преимущественно отмечается снижение прогестерона и повышение уровня серотонина.
Цефалгическая форма ПМС характеризуется преобладанием в клинической картине головной боли различного характера: ощущение «сдавливания повязкой», «распирания» или односторонняя пульсирующая боль в лобно–височно–глазничной области по типу мигрени. У некоторых женщин отмечаются предвестники головной боли в виде чувства беспокойства, страха, повышенной раздражительности и возбудимости. Приступы головной боли нередко сопровождаются различными вегетативными проявлениями: тошнотой, рвотой, побледнением кожи лица, повышенной чувствительностью к световым и звуковым раздражителям, запахам. У каждой 3–й больной отмечаются депрессия, боль в области сердца, потливость, онемение рук, нагрубание молочных желез, отеки при положительном диурезе. На рентгенограмме черепа у этих больных выявляются признаки повышения внутричерепного давления и гиперостоз. В крови отмечается повышение уровня серотонина и гистамина.
Кризовая форма ПМС является наиболее тяжелой и развивается, как правило, на фоне тяжелых экстрагенитальных заболеваний. Она протекает в виде симпатоадреналовых кризов, которые начинаются с повышения артериального давления, чувства сдавления за грудиной и появления страха смерти, сопровождаются похолоданием и онемением конечностей, сердцебиением и заканчиваются обильным отделением светлой мочи. Кризы обычно возникают вечером или ночью и наблюдаются у женщин с нелеченными другими формами ПМС. При кризовой форме выявляется повышение уровня пролактина и серотонина во 2–й фазе цикла и гиперфункция коры надпочечников.
Классификация
По современным медицинским классификациям выделяют четыре типа ПМС в зависимости от преобладания той или иной гормональной нестабильности.Первый тип – высокий уровень эстрогенов и низкий прогестерона; на передний план выступают нарушения настроения, повышенная раздражительность, беспокойство и тревога.
Второй тип – нарастание уровня простагландинов; характеризуется усилением аппетита, головными болями, утомляемостью, головокружением, желудочно–кишечными нарушениями.
Третий тип – повышение уровня андрогенов; проявляется слезливостью, забывчивостью, бессонницей, устойчиво сниженным настроением.
Четвертый тип – усиленное выделение альдостерона; наблюдаются тошнота, увеличение массы тела, отечность, неприятные ощущения в молочных железах.
По степени тяжести ПМС делят на легкую и тяжелую формы. К легкой форме ПМС относится появление 3–4 симптомов за 2–10 дней до начала менструации при значительной выраженности 1–2 симптомов заболевания, к тяжелой – появление 5–12 симптомов за 3–14 дней до менструации, причем 2–5 из них (или все) резко выражены.
В течении ПМС выделяют три стадии: компенсированную, субкомпенсированную и декомпенсированную. При компенсированной стадии симптомы болезни с годами не прогрессируют, появляются во 2–й фазе менструального цикла и с наступлением менструации исчезают. При субкомпенсированной стадии тяжесть симптомов с годами усугубляется, симптомы ПМС исчезают только с прекращением менструации. При декомпенсированной форме симптомы ПМС не исчезают после прекращения менструации в течение нескольких дней, причем «светлые» промежутки между прекращением и появлением симптомов постепенно сокращаются.
Диагностика
Диагностика базируется на клинических проявлениях и результатах тестов функциональной диагностики.Многообразие симптомов ПМС заставляет больных обращаться за помощью к врачам разных специальностей. Основным критерием диагноза является циклический характер проявления патологических симптомов. Установлению диагноза помогает ведение в течение каждого менструального цикла дневника–опросника, в котором ежедневно отмечаются все имеющиеся патологические симптомы и степень их выраженности.
При тяжелых клинических формах ПМС проводится обследование с помощью тестов функциональной диагностики, определение уровней пролактина, эстрадиола, прогестерона в обе фазы цикла. Из дополнительных методов исследования проводят краниографию и электроэнцефалографию.
При преобладании в клинической картине ПМС отеков следует измерять диурез и количество выпитой жидкости в течение 3–4 дней в обе фазы цикла, исследовать выделительную функцию почек, определить показатели остаточного азота, креатинина, электролитов.
При болях и нагрубании молочных желез для исключения органической патологии показано проведение маммографии, УЗИ в 1–ю фазу менструального цикла.
При головных болях, наблюдающихся при цефалгической и кризовой формах ПМС, исследуют состояние глазного дна и периферические поля зрения, производят рентгенографию черепа, турецкого седла и шейного отдела позвоночника, ЭЭГ и РЭГ сосудов мозга, МРТ. Кроме того, при «кризовой» форме ПМС измеряют диурез и количество выпитой жидкости, артериальное давление. С целью дифференциальной диагностики с феохромоцитомой определяют содержание катехоламинов в крови или моче, проводят УЗИ надпочечников.
В зависимости от характера клинических проявлений для исключения патологии, не связанной с ПМС, больная должна быть проконсультирована соответствующими специалистами (терапевтом, невропатологом, психиатром, нефрологом, окулистом, аллергологом).
Лечение
Проводится длительно и зависит от степени тяжести заболевания. Начальный курс лечения – в течение года, циклическими курсами по 2–3 месяца с 2–месячными перерывами. В дальнейшем лечение повторяют по мере появления рецидивов, к которым больные с ПМС весьма склонны. Лечение ПМС должно быть комплексным, индивидуально подобранным и начинаться при появлении первых симптомов заболевания.Алгоритм лечения включает психотерапию, рациональное питание, лечебную физкультуру, применение транквилизаторов, антидепрессантов, витаминов, ингибиторов синтеза простагландинов, гормонов.
Лечение начинают с психотерапии, направленной на разъяснение сущности заболевания и снятие страха перед болью. Нервнопсихические нарушения могут быть скорректированы с помощью методов психоэмоциональной релаксации, стабилизирующих поведенческих техник. Психотерапевтические беседы должны проводиться не только с больной, но и ее родственниками.
Рациональное питание предполагает частый дробный прием пищи, включение в рацион продуктов с высоким содержанием клетчатки, ограничение алкоголя, напитков, содержащих кофеин (черный чай, кофе), кондитерских изделий, умеренное потребление жидкости, животных жиров, молока, соли.
В лечении ПМС могут быть полезны физические нагрузки: физические упражнения, пешие прогулки, утренние пробежки, аэробика, плавание, велосипедный спорт и др.
В программу лечебных мероприятий обязательно включаются комплексы, содержащие витамины А, В, С и Е (альвитил, аевит, триовит, супрадин, магне В6 и др.). Особое место среди них отводится пиридоксину, так как витамин В6 является кофактором, необходимым для синтеза нейротрансмиттеров (катехоламинов, дофамина). Это делает обоснованным его применение при явлениях депрессии, раздражительности, отеках, головной боли и метеоризме. Назначается по 50 мг 2 раза в день с постепенным увеличением дозы до 300 мг в сутки с 16–го по 28–й день или на протяжении всего менструального цикла в течение трех месяцев. Витамин Е назначают в дозе 400–600 ед. Он может облегчать симптомы болезненности молочных желез у больных ПМС.
Хороший эффект достигается при включении в комплекс лечения физиотерапевтических методов. Широко применяются общий массаж или массаж воротниковой зоны, водные процедуры (контрастные, жемчужные, хвойные ванны, гидромассаж), эндоназальная гальванизация, центральная электроанальгезия, транскраниальная электростимуляция, воротник по Щербаку, иглорефлексотерапия. Лечение начинают с 5–6–го дня цикла, всего назначают 8–10 процедур.
Ингибиторы синтеза простагландинов из группы нестероидных противовоспалительных средств (напросин, диклофенак, кетопрофен, раптен, рапид, пироксикам) могут быть препаратами выбора при лечении ПМС с наличием болевого синдрома.
Гормональное лечение ПМС применяется после обследования тестами функциональной диагностики или определения в крови уровня половых стероидов и назначается в зависимости от выявленных изменений.
При абсолютной или относительной гиперэстрогении показана терапия гестагенами (утрожестан 400 мг, дюфастон 20 мг в день внутрь; при масталгии прожестожель 2,5 мг 2 раза в день чрескожно на область молочных желез) во 2–й половине цикла или по контрацептивной схеме с 5–го дня цикла в течение 21 дня.
Предменструальный синдром развивается у женщины с овуляторными циклами, поэтому в его лечении используются препараты, подавляющие овуляцию: монофазные комбинированные оральные контрацептивы (регулон, новинет, фемоден, марвелон, логест, жанин, ярина), аналоги гонадолиберина (золадекс, диферелин и др. ), антигонадотропины (даназол, данол, дановал).
При повышении уровня пролактина препаратом выбора является парлодел (бромкриптин), назначаемый в дозе 1,25 мг во 2–ю фазу цикла за 2 дня до ухудшения состояния в течение 8–10 дней.
Больным с высокой аллергической предрасположенностью, повышением уровней серотонина и гистамина могут назначаться антигистаминные препараты (тавегил, диазолин или терален) на ночь ежедневно за 2 дня до ухудшения состояния, включая и 1–й день менструации. Терален, являясь препаратом фенотиазинового ряда, обладает выраженным антигистаминным и антисеротониновым действием с седативной активностью, оказывает также блокирующее влияние на дофаминергические рецепторы.
С целью улучшения кровоснабжения и энергетических процессов мозга, а также ингибиции пролактина показано применение ноотропила, аминалона с 1–го дня цикла в течение 2–3 недель (2–3 цикла).
У больных с отечной формой ПМС при повышении уровня альдостерона применяют его антагонист верошпирон по 25 мг 2–3 раза в день. Прием начинают за 4–го дня до появления симптомов ПМС и прекращают с началом менструации.
При эмоциональной лабильности с 10–го дня менструального цикла назначают психотропные средства: нейролептики (сонапакс) и транквилизаторы (сибазон, ксанакс, рудотель). Эффективен прием антидепрессантов – ингибиторов обратного захвата серотонина (сертралин, золофт, прозак и др.).
Перспективно в лечении ПМС применение анксиолитика грандаксина, занимающего промежуточное положение между малыми транквилизаторами и слабыми психоэнергетическими препаратами. Грандаксин показан при состояниях, сопровождающихся тревогой, эмоциональным напряжением, нерезко выраженными депрессивными расстройствами, вегетативными дисфункциями, апатией, пониженной активностью. Препарат применяется по 50 мг 2 раза в день в течение месяца.
В лечении ПМС может быть использована фитотерапия. Имеется опыт применения препарата агнукастон (экстракт плодов «авраамова дерева»), действующего на дофаминовые рецепторы гипоталамуса и нормализующего секрецию пролактина. Таким же действием обладает препарат растительного происхождения мастодинон.
Лечение ПМС проводят циклами по 3–6 месяцев с перерывами 3–6 месяцев. В 1–й цикл назначают психотерапию, витамино–, диетотерапию, физические упражнения, физиотерапию. Во 2–й и 3–й циклы назначают диуретические средства, препараты, действующие на ЦНС, парлодел, гормональные средства. Лечение в течение 3–6 месяцев, как правило, дает положительный эффект. Если симптоматика повторяется, то через несколько месяцев лечение можно повторить.
Посткастрационный синдром
Посткастрационный (постовариэктомический) синдром – это комплекс патологических симптомов, возникающих после тотальной или субтотальной овариэктомии в сочетании с удалением тела матки или без ее удаления. Посткастрационный синдром (ПКС) развивается у 60–80% оперированных женщин.Хирургическое выключение функции яичников или лучевая кастрация приводят к возникновению сложных реакций в нейроэндокринной системе, ответственной за механизм адаптации. Особая роль в механизмах адаптации отводится коре надпочечников, в которой в ответ на стресс (кастрацию) происходит активация синтеза глюкокортикоидов и андрогенов. ПКС развивается у женщин с функциональной лабильностью гипоталамо–гипофизарной системы, особенно у женщин предменопаузального возраста, поскольку овариэктомия в период возрастной инволюции приводит к срыву адаптации и развитию посткастрационного синдрома.
Одномоментное выключение функции яичников и остро возникающий дефицит эстрогенов ведут к резкому увеличению уровня гонадотропинов (особенно ФСГ), быстрому развитию симптомов, свойственных менопаузе, и более тяжелому их течению. Различные типы эстрогеновых рецепторов расположены не только в репродуктивных органах–мишенях, но и в центральной нервной системе, костной ткани, эндотелии сосудов, миокардиоцитах, соединительной ткани, урогенитальном тракте, в слизистых оболочках рта, гортани, конъюнктиве, толстом кишечнике, поэтому возникающий дефицит эстрогенов способствует системным изменениям в органах и тканях, приводя к глубоким метаболическим изменениям в организме, ухудшению здоровья и качества жизни женщины.
Постовариэктомический синдром развивается у всех женщин, причем симптомы могут появиться уже на 3–5–е сутки после операции, но чаще всего через 1–3 недели после удаления яичников. Максимальная выраженность патологических явлений наблюдается спустя 2–3 месяца и без лечения может сохраняться многие годы.
Симптомы ПКС делят на три группы: ■ нейровегетативные: приливы, потливость, тахикардия, аритмия, боли в области сердца, гипертонические кризы, головная боль, головокружение, ощущение онемения в конечностях ■ психоэмоциональные: раздражительность, бессонница, плаксивость, ослабление памяти, депрессия, чувство страха, быстрая утомляемость ■ обменно–эндокринные: ожирение, атрофический кольпит, цисталгия, изменения кожного и волосяного покрова, артериальная гипертензия, ишемическая болезнь сердца, остеопороз, развитие метаболического синдрома.
В 1–й год после операции в клинической картине преобладает нейровегетативный симптомокомплекс (в 85% случаев). Наиболее характерный симптом – приливы. Они проявляются резким расширением сосудов кожи лица и верхней части туловища, могут быть различной частоты и интенсивности и сопровождаться удушьем, чувством страха, иногда обмороками. Приливы усиливаются в летнее время, ночью, после еды.
Через 3–4 месяца после кастрации начинают развиваться атрофические изменения в половом аппарате: уменьшаются размеры матки, исчезают железы и их секрет, закрывается канал шейки матки. Влагалище сужается, его слизистая оболочка истончается и становится сухой. Атрофии подвергаются и молочные железы, в которых железистая ткань заменяется жировой.
Психоэмоциональные расстройства наиболее часто встречаются в первые 3 года после удаления яичников (62%), обменно–эндокринные превалируют через 3–5 лет (36%).
Степень тяжести посткастрационного синдрома зависит от исходного состояния здоровья женщины до удаления яичников. Тяжелое течение синдрома отмечается у женщин с экстрагенитальной патологией, причем в 1–й год после операции течение последней ухудшается. Более тяжелое течение ПКС наблюдается у больных с удаленными неизмененными яичниками.
Метаболический синдром чаще развивается у женщин с исходным избытком массы тела и при прогрессировании ожирения после удаления яичников. Он характеризуется абдоминальным ожирением, увеличением триглицеридов (более 1,7 ммоль/л), снижением липопротеинов высокой плотности (менее 1,29 ммоль/л), подъемом АД выше 130/85 мм рт. ст., гипергликемией натощак (более 5,6 ммоль/л). Увеличение индекса атерогенности способствует развитию атеросклероза, ишемической болезни сердца, инсультов.
Лечение комплексное. Патогенетически обоснованным является назначение заместительной гормональной терапии (ЗГТ). Для ЗГТ, как правило, применяют препараты натуральных эстрогенов, содержащие 17Р–эстрадиол (эстрофем, провера внутрь, дивигель для наружного применения, трансдермальная система климара), а также комбинированные эстроген–гестагенные препараты (фемостон, паузогест, дивитрен), препараты растительного происхождения (климонорм). Подробно о принципах ЗГТ см. «Климактерический синдром». У женщин молодого возраста могут быть использованы комбинированные оральные контрацептивы в различных дозировках в зависимости от тяжести проявления синдрома (например, марвелон или ригевидон по 1/4–1/2 таблетки) 21 день подряд. Курс повторяют после 7–дневного перерыва. Гормональное лечение должно проводиться не менее 3 месяцев. При отмене гормональных препаратов явления ПКС возобновляются, поэтому лечение проводят длительно, по крайней мере до возраста естественной менопаузы.
Гормональную терапию сочетают с физическими методами лечения. Назначаются жемчужные, кислородные, йодобромные, углекислые ванны; гальванизация шейно–лицевой области и др. Показано профилактическое назначение гепатопротекторов, дезагрегантов и антикоагулянтов (аспирин, курантил, трентал) с учетом данных коагулограммы.
Если кастрация произведена по поводу злокачественных новообразований половых органов или молочных желез, гормоны противопоказаны. В таких случаях применяют симптоматическую терапию – седативные, общеукрепляющие средства, витамины, физиолечение.
Препараты седативного действия показаны при выраженных психоэмоциональных расстройствах, не купирующихся на фоне ЗГТ. Применяют грандаксин по 0,05 г, седуксен по 0,005 г, тазепам по 0,01 г 2–3 раза в сутки в течение 2–3 месяцев. В последний месяц доза препарата уменьшается на 30–50%. Для лечения депрессивных расстройств применяют антидепрессанты селективного действия на нейронные структуры головного мозга, блокирующие обратный захват как серотонина, так и норадреналина (иксел, содержащий 50 мг милнаципрана, по 25 мг утром и днем после еды, курс до 7 дней).
Из витаминных препаратов назначают тиамина бромид (витамин В1), пиридоксина гидрохлорид (витамин В6), никотиновую кислоту, аскорбиновую кислоту в общепринятых дозировках. Курс лечения 1 месяц.
Больные с ПКС должны находиться под постоянным диспансерным наблюдением. Обязательно проводится контроль за состоянием молочных желез (УЗИ, маммография), гепатобилиарного тракта и свертывающей системы крови. Прогноз зависит от возраста, преморбидного фона, объема операции, своевременности начала терапии.
Глава 6. Воспалительные заболевания женских половых органов
Основные сведения о воспалительных заболеваниях
Воспалительные заболевания женских половых органов по–прежнему остаются актуальной проблемой современной гинекологии и занимают ведущее место в структуре гинекологических заболеваний, несмотря на существенные достижения в изучении этиологии, патогенеза, диагностики данной патологии, широкое внедрение и использование новейших противомикробных средств.Интерес к проблеме воспалительных заболеваний женских половых органов (ВЗПО) определяется многими факторами, в том числе высокой частотой встречаемости. По данным различных авторов (ГМ. Савельева, Л.В. Антонова, 1987; В.И. Бодяжина, Л.Г. Тумилович, В.П. Сметник, 1990; С.Н. Занько, А.Н. Косинец, Л.Я. Супрун, 1998), больные с ВЗПО составляют 60–65% гинекологических больных, обратившихся в женские консультации, и 20–30% пациенток, нуждающихся в стационарном лечении.
Частота хронических ВЗПО продолжает неуклонно нарастать и по той причине, что остаются неизлеченными больные с острыми и подострыми воспалительными процессами из–за поздней обращаемости, несвоевременной госпитализации, а используемая традиционная терапия не всегда является эффективной.
В роли возбудителя заболевания выступают ассоциации аэробов и анаэробов. Для обозначения обширной группы воспалительных заболеваний нижнего отдела гениталий в зарубежной и отечественной литературе употребляются термины «негонококковые», «неспецифические». Такое различие в терминологии нередко неправильно ориентирует практикующих врачей, поскольку названия не соответствуют определенному клиническому понятию.
Негонококковые воспалительные процессы нижнего отдела гениталий – обширная группа воспалительных заболеваний, обусловленных различными возбудителями: трихомонадами, грибами рода Candida, коринебактериями, вирусом генитального герпеса, папилломовирусами, бактериями. Негонорейные заболевания гениталий делят на 3 группы, учитывая пути передачи инфекции: 1–я группа – венерические болезни (мочеполовой трихомониаз, хламидиоз, инфекция, обусловленная коринебактериями, кондиломатоз); 2–я группа – венерические формы неполовых инфекций, когда передача инфекции возможна как половым, так и неполовым путем (генитальный кандидоз, генитальный герпес); 3–я группа – неспецифические воспалительные процессы, обусловленные бактериями.
Микробы попадают в 99% случаев половым путем, но существует и лимфогенный путь (прежде всего из кишечника); гематогенный путь (главным образом туберкулез, когда очаг инфекции в гениталиях является вторым очагом, а первый очаг расположен экстрагенитально), по протяжению (из воспаленного аппендикулярного отростка, при колитах, патологии кишки и интраканаликулярный путь при специфической инфекции – гонококк).
Механизм реализации переноса инфекции: ■ сперматозоиды – переносчики инфекции. Обладая отрицательным зарядом, который притягивает микроб, они таким образом являются транспортом для микроорганизмов ■ жгутиковые (трихомонады) – активный транспорт для микробов ■ пассивный путь (микроорганизмы попадают активно – половым путем, а затем пассивно распространяются по гениталиям).
Факторы, способствующие распространению инфекции: ■ внутриматочные вмешательства: аборты, диагностические выскабливания, гистеросальпингография, т.е. все инвазивные процедуры (зондирование полости матки, постановка и удаление внутриматочного контрацептива), роды и выкидыши ■ переохлаждение ■ ослабление организма в результате хронической инфекции экстрагенитального характера.
Защитные факторы организма (биоценоз влагалища): ■ бели, которые выделяют железы влагалища в количестве 1–2 мл/сут, являются нормальными; все, что больше, – патологические бели ■ микрофлора влагалища, которая представлена аэробами и анаэробами, но имеется динамическое равновесие между сапрофитными группами и условно–патогенными группами (аэробные микробы преобладают над анаэробными) ■ достаточное содержание лактобактерий – палочек молочнокислого брожения, которые создают кислую рН во влагалище за счет своего метаболизма, а кислая рН является защитным барьером на пути проникновения микроорганизмов ■ слизистая пробка – бактерицидная пробка цервикального канала; она имеет огромное значение по предупреждениюгенерализации инфекции: в слизистой пробке имеются неспецифические антитела как факторы защиты; за счет изменения своей вязкости она препятствует проникновению микробов. Прием оральных контрацептивов обеспечивает увеличение вязкости слизистой пробки, затрудняет проникновение сперматозоидов в вышележащие отделы гениталий – это один из эффектов контрацепции. Прием оральных контрацептивов, особенно женщинами с хроническими воспалительными заболеваниями (ХВЗГ) гениталий, снижает риск развития рецидивов и обострений воспалительного процесса ■ эндометрий: функциональный слой эндометрия ежемесячно отторгается, идет очищение организма, на месте отторгнувшегося эндометрия образуется лимфоцитарный вал. Для генерализации инфекции необходимо взаимоотношение макро– и микроорганизма. Агрессивность микроорганизма обусловливает его вирулентность и реактивность макроорганизма. У женщин с тяжелыми гнойными осложнениями при исследовании выделены ассоциации микробной флоры, причем сочетание аэробов и анаэробов, состояние иммунитета у них резко снижено, таким образом состояние макро– и микроорганизма определяет дальнейшее развитие заболевания.
Классификация
Все ВЗНЭ условно разделяются: ■ на ВЗНЭ нижнего отдела гениталий ■ ВЗНЭ верхнего отдела гениталий.К сожалению, на сегодняшний день единая классификация гнойно–воспалительных заболеваний (ГВЗ) женских половых органов отсутствует. В МКБ Х пересмотра раздел по ГВЗ женских гениталий представлен недостаточно последовательно.
Характерной особенностью современных воспалительных процессов наружных гениталий является их полиэтиологичность, наличие микробных ассоциаций анаэробов и аэробов. По мнению ряда авторов (В.И. Кочеровец, 1990), в этиологии и патогенезе анаэробной инфекции ведущее значение следует придавать бактериальному синергизму. Выявление микробных ассоциаций в возникновении воспалительного процесса мочеполового тракта является, несомненно, ведущим. Однако при установлении диагноза, и особенно при назначении лечения, следует учитывать, что в развитии воспаления наружных половых органов, кроме инфекционного начала, имеет значение целый ряд патогенетических факторов – реакция сосудистой и лимфатической систем, нарушения поверхностных клеточных и плазматических мембран, выраженные нарушения метаболических процессов в тканях, снижение окислительно–восстановительного потенциала, патологические изменения ферментных систем клеток и тканевого дыхания, нарушения общего и местного иммунитета. Клинические проявления воспалительных процессов наружных гениталий довольно часто определяются функциональным состоянием яичников.
Таким образом, общепризнанным является мнение о том, что воспаление наружных половых органов женщины – не только местная воспалительная реакция тканей, но и сложный динамический процесс с иммунологическими, морфоферментативными и гормональными сдвигами (табл. 6.1, 6.2). В практической гинекологии в настоящее время руководствуются классификацией воспалительных заболеваний наружных половых органов, предложенной А.А. Летучих (1985).
В современной отечественной классификации принято деление всех ГВЗ на 2 группы.
Первую из них составляют послеродовые инфекции, вторую – воспалительные заболевания женских половых органов, не связанные с родами. В каждой из указанных групп выделяют подгруппы и отдельные нозологические формы. Однако и у акушерских, и у гинекологических больных вследствие микробной инвазии поражаются одни и те же органы и ткани (влагалище, матка, маточные трубы и др.). Следовательно, развиваются соответствующие заболевания: вагинит, эндометрит, сальпингит, перитонит с той только разницей, что в одном случае они возникают после родов, а в другом – восходящим путем после абортов, операций, инструментальных исследований и других причин, чаще всего провоцируются эндогенными возбудителями. С целью терминологической унификации воспалительных заболеваний, более точной формулировки клинического диагноза, установления действительной этиологии и выбора необходимых методов лечения в каждом конкретном случае мы считаем целесообразным применять классификацию, предложенную Ю.В. Цвелевым и др.
В настоящее время в структуре воспалительных заболеваний наружных половых органов действительно произошли значительные изменения. Увеличение частоты выявления вирусных, хламидийных, микоплазменных инфекций гениталий можно объяснить внедрением в практику современных высокочувствительных методов диагностики, более целенаправленным обследованием больных групп риска врачами акушерами–гинекологами.
Таблица 6.1. Анатомо–топографическая классификация бактериальных инфекций женских половых органов
| Нозологические заболевания | Генерализованная инфекция | ||||||
|---|---|---|---|---|---|---|---|
| Наружных половых органов | внутренних половых органов | околоматочного пространства, тазовой клетчатки и брюшины | мягких тканей | молочных желез | |||
| влагалища | матки | придатков матки | |||||
| Вульвит | Вагинит (юльпит) | Цервицит, эндоцервицит | Сальпингит, перисальпингит | Параметрит | Целлюлит | Мастит | Сепсис |
| Фурункул вульвы | Вагиноз | Эндометрит | Оофорит, периоофорит | Тазовый целлюлит | Фасциит. Миозит | Абсцесс молочной железы | Септицемия, септикопиемия, эндокардит |
| Абсцесс вульвы | Вульвовагинит | Эндомиометрит | Сальпингоофоворит (аднексит, аднекстумор) | Тазовый тромбофлебит | Флегмона | Инфекционно–токсический (септический) шок | |
| Бартолинит | Уретрит, парауретрит | Метрит (панметрит) | Пиосальпинкс | Абсцессы малого таза | |||
| Периметрит | |||||||
| Абсцесс большой железы преддверия влагалища | Скинеит | Абсцесс матки | Абцесс маточной трубы, яичника, тубоовариальный | Тазовый перитонит (пельвиоперитонит) | – | – | – |
Таблица 6.2.Этиологическая классификация бактериальных инфекций женских половых органов
| Инфекции | |||
|---|---|---|---|
| Анаэробные клостридиальные | Анаэробные неклостридиальные | Аэробные | Смешанные (ассоциативные, микст–инфекции) |
| Cl. perfringens | Bacteroides sp. | Ps. aeruginosa | Вызванные двумя и более анаэробами |
| Cl. tetani | Fusobacterium sp. | Klebsiella sp. | Вызванные двумя и более аэробами |
| Cl. Oedematiensи др. | Peptococcus sp. идр | E. coli, Staphylococcus sp., Streptococcus sp. и др. | Анаэробно–аэробные |
Воспалительные заболевания неспецифической этиологии
К воспалительным заболеваниям неспецифической этиологии относятся: ■ вульвиты ■ фурункул вульвы ■ абсцесс вульвы ■ бартолинит ■ абсцесс большой железы преддверия влагалища.Вульвиты
Вульвиты – воспалительные заболевания наружных половых органов женщины. Практика показывает, что острый вульвит у женщин репродуктивного возраста – явление сравнительно редкое. Это может быть объяснено особенностями эпителиального покрова вульвы.Этиология
Возникновению вульвита, как правило, предшествует нарушение целости эпителия наружных гениталий, что способствует образованию входных ворот инфекции.ш1) патологический экссудат влагалища (при кольпитах, эндоцервицитах), приводящий к мацерации покрова наружных половых органов ■ загрязнение кожи вульвы мочой, особенно у больных сахарным диабетом ■ травмирование кожи вульвы при насильственных половых сношениях ■ повышенная потливость в области промежности у тучных женщин и склонность к мацерации и повреждению тканей в результате трения ■ фолликулиты, пиодермии, фурункулез, нередко развивающиеся при несоблюдении гигиенического режима ■ расчесы вследствие раздражения кожи вульвы острицами при гельминтозе ■ раздражение области вульвы инфицированной мочой при пиелитах, циститах, мочеполовых свищах ■ длительное воздействие аллергических, механических, термических факторов.
Разнообразие микроорганизмов, вегетирующих в области наружных половых органов, определяет полиэтиологичность заболевания. Ряд авторов отмечает преобладание анаэробов – бактероидов, грамположительных кокков. Встречаются также их ассоциации с факультативно–анаэробной флорой (эпидермальный стафилококк, энтерококк, кишечная палочка). Анатомическая близость анального отверстия обеспечивает интенсивную обсемененность вульвы представителями семейства энтеробактерий.
Клиническая картина
По клиническому течению вульвиты могут быть острыми, подострыми, хроническими.В острой стадии заболевания выражены гиперемия, отек больших и малых половых губ, клитора, преддверия влагалища. Кожа вульвы нередко покрывается слизисто–гнойным налетом, вызывая впоследствии синехии половых губ. Пациенты предъявляют жалобы на боли, жжение, зуд в области вульвы и промежности, особенно при мочеиспускании. Нередко больные отмечают повышение температуры тела, недомогание. Возможна пальпация увеличенных паховых лимфатических узлов.
При подостром течении вульвита явления воспаления ослабевают. Симптомы общей интоксикации слабо выражены или отсутствуют. При осмотре пораженной области обнаруживается умеренная или легкая гиперемия кожи, пальпация выявляет болезненность и напряжение, отечность и пастозность тканей. В современных условиях преобладающей клинической формой воспаления наружных гениталий является хроническая, характеризующаяся вялым и длительным течением, слабовыраженными симптомами заболевания. В связи с этим воспалительный процесс длительное время остается нераспознанным, запоздалое лечебное вмешательство оказывается недостаточно эффективным. Преобладание хронического течения заболевания обусловлено изменением этиологических факторов воспаления гениталий. Наиболее частой причиной возникновения воспаления наружных гениталий являются герпетическая, хламидийная, уреаплазменная, цитомегаловирусная инфекции и их сочетания. Несмотря на резкое различие в биологических свойствах возбудителей (вирусы, хламидии, микоплазмы), все они вызывают сходные заболевания мочеполовой системы человека, обусловливая бессимптомное носительство, стертое течение инфекции, высокий процент хронических форм патологии.
Влияние вульвитов на репродуктивное здоровье женщины заключается в следующем. ■ Наличие длительно существующего процесса, постоянного зуда, жжения и болей в области наружных гениталий ограничивает половую активность женщины. ■ Вульвит при хроническом течении нередко становится причиной восходящей инфекции женских половых органов (кольпита, цервицита, эндометрита, сальпингоофорита). ■ У больных с воспалительными процессами наружных половых органов возникает ряд серьезных проблем во время беременности и родов (невынашивание, пиелонефрит беременных, многоводие, хориоамнионит, преждевременное излитие околоплодных вод, аномалии родовой деятельности, патология прикрепления плаценты), в послеродовом периоде возможны различные проявления гнойно–септических заболеваний. ■ В настоящее время установлено, что вульвиты, особенно при хроническом длительном течении, нередко являются причиной внутриутробной инфекции, обусловливая заболевания плода и новорожденного. ■ Характерным осложнением вульвита является особое ощущение зуда (pruritusvulvae), чаще проявляющееся при хронической форме заболевания и описанное в литературе как зуд вульвы. Зудовые ощущения исключительно тягостны, они могут беспокоить женщину постоянно, травмируя психику. Зудовые парестезии особенно выражены в ночное время, когда отсутствуют внешние раздражители. В ряде случаев обычное гинекологическое обследование не позволяет выявить патологические изменения кожи наружных половых органов. Однако гистоморфологическое исследование биопсийного материала подтверждает наличие хронического воспаления и трофических нарушений в тканях. Не следует забывать о том, что причины зуда вульвы весьма разнообразны и могут быть экзогенного и эндогенного характера. К числу первых относятся хроническое раздражение кожи вульвы производственной пылью у женщин, занятых на табачном, хлопчатобумажном, химическом производствах. Раздражение кожи вульвы часто может быть обусловлено глистной инвазией, аллергизирующими моющими и стиральными средствами. Зуд вульвы может возникать при ряде экстрагенитальных заболеваний: сахарном диабете, гепатите, гломерулонефрите с нарушением функции почек и явлениями азотемии, авитаминозах, паразитарной и грибковой инвазии. В климактерическом и менопаузальном периодах к зуду приводят, как правило, гормональные изменения в организме, вызванные падением уровня эстрогенов, и связанное с этим развитие трофических расстройств в тканях половых органов, особенно наружных, которые богато обеспечены нервно–рецепторными окончаниями. ■ Особого внимания заслуживают изменения в тканях наружных половых органов, которые возникают у женщин, страдающих длительным, часто рецидивирующим хроническим течением воспалительного процесса. К ним относятся такие заболевания вульвы, как лейкоплакия и крауроз. Для лейкоплакии характерны пролиферация многослойного плоского эпителия и нарушение его дифференцировки и созревания. Обнаруживаются гистоморфологические признаки пара– и гиперкератоза, акантоза без выраженного клеточного и ядерного полиморфизма и нарушения базальной мембраны. Макроскопически лейкоплакия проявляется в виде сухих бляшек белесоватого цвета с перламутровым блеском, несколько возвышающихся над подлежащими тканями. Излюбленное место локализации лейкоплакических бляшек – малые половые губы, область клитора. Нередко процесс приобретает более распространенный характер, поражая все наружные половые органы. Прогрессируя, новообразование утолщается и изъязвляется. Крауроз вульвы характеризуется более выраженными атрофическими изменениями тканей. Кожа пораженных участков имеет белесоватый, почти пергаментный вид. При краурозе отмечаются атрофия сосочкового и сетчатого слоев кожи, гиалинизация соединительной ткани, гипертрофия эпидермиса с явлениями акантоза и воспалительной инфильтрацией подлежащей соединительной ткани, после чего наступает полная атрофия кожи половых губ. Ряд авторов описал характерную кольпоскопическую картину крауроза вульвы: выраженные телеангиэктазии, атрофичную кожу и сухие, хрупкие и легкоранимые, депигментированные слизистые оболочки. Наружное отверстие уретры и вход во влагалище резко сужены, затрудняя физиологические отправления. В 20–50% случаев на фоне этих заболеваний возникает рак наружных половых органов. ■ Частым осложнением длительно текущих рецидивирующих вульвитов является кондиломатоз наружных половых органов. Гистологическое строение кондилом представляется в виде папиллярных разрастаний, покрытых гипертрофированным многослойным плоским эпителием, содержащим расширенные кровеносные и лимфатические сосуды, мелкоклеточную инфильтрацию. Поверхность кондилом богато заселена разнообразной микрофлорой. В настоящее время доказана этиологическая роль папилломавирусной инфекции (ПВИ) в происхождении папиллом наружных половых органов и интраэпителиальной неоплазии вульвы. По–видимому, вирус является причиной гиперплазий слизистой вульвы, а папилломавирус–16 вызывает развитие неоплазии наружных половых органов.
Диагностика
В настоящее время в клинической практике широко используется система многоэтапного и комплексного выявления заболеваний женских половых органов (рис. 6.1). Наиболее интересными в этом плане нам представляются данные П.С. Русакевича (1998) о комплексном обследовании и врачебной тактике при воспалении наружных половых органов. Учитывая широкий микробный спектр в этиологии вульвитов, разнообразие клинических вариантов течения данной патологии с преобладанием хронических и субъективно асимптомных вариантов, наличие возможных осложнений и высокий риск малигнизации, мы считаем, что диагностика вульвитов также должна носить комплексный и двухэтапный характер с использованием клинических и углубленных методов исследования. Рис. 6.1. Схема обследования больных воспалительными заболеваниями вульвы
Рис. 6.1. Схема обследования больных воспалительными заболеваниями вульвы
Лечение
Лечение вульвитов должно быть комплексным, общим, местным, основанным на этиологии и клинической стадии заболевания.Основным принципом терапии является устранение причины, вызвавшей воспаление наружных половых органов: влагалищных, шеечных, маточных и трубных белей; гельминтов, сахарного диабета, последствий массивной антибактериальной терапии, аллергических и местно раздражающих факторов.
Общее лечение направлено на соблюдение правил личной гигиены, диеты (потребление углеводов, соли, острых блюд должно быть ограничено), половое воздержание. Обязательным является обследование и лечение полового партнера (при заболеваниях, передающихся половым путем).
Собственно противовоспалительное лечение включает применение фармакотерапевтических средств: ■ антибактериальных препаратов общего и местного воздействия. Антибактериальная терапия проводится при установленной инфекционной природе заболевания в соответствии с результатами бактериоскопического и бактериологического обследования ■ десенсибилизирующих средств ■ гормональных средств (преимущественно у лиц пожилого возраста) ■ витаминов ■ неспецифической иммунотерапии.
В острой стадии заболевания показаны постельный режим, антибактериальная терапия общая и местная. Местное противовоспалительное лечение начинают с аппликаций антисептиков на пораженную область, подмываний 3–4 раза в день, теплых сидячих ванн, влагалищных орошений. Выбор применяемого лекарственного препарата зависит от характера выделенной флоры: ■ при грамположительной флоре целесообразно использовать хлоргексидин, альбуцид, риванол, водорода пероксид, микроцид, фитопрепараты (ромашка, календула, хлорофиллипт, шалфей, зверобой, черничник), ■ при грамотрицательной флоре препаратами выбора могут быть нитрофураны, уротропин, хлорамфеникол, эктерицид' при микст–инфекциях – димексид, бетадин, диоксидин, водорода пероксид, хлоргексидин. Терапевтический эффект увеличивается при применении эстрогенных гормональных препаратов (микрофоллина, эстриола, овестина, прогиновы).
После стихания острых воспалительных процессов в комплекс противовоспалительных мероприятий включают физиопроцедуры: кварцевание области наружных половых органов, низкочастотное ультразвуковое озвучивание вульвы или ультразвуковой фонофорез официнальной мази глюкокортикоидов (гидрокортизон, флуцинар, целестодерм), лазерное облучение или лазерофорез лекарственных препаратов, озонирование.
Для повышения клинического эффекта необходимо восстановление нормального биоценоза влагалища путем местного применения эубиотиков. Широко используются различные варианты фитотерапевтических сборов.
Отвар трав с медом. Приготовить сбор: цветки ромашки лекарственной – 40 г, почки березы белой – 30 г, кора ивы – 30 г' 2 столовые ложки сухого измельченного сбора залить 0,5 л кипятка, варить при слабом кипении 5–7 мин, настоять 1–2 ч, процедить и пить по 150 мл 3 раза в день, добавляя по вкусу мед, в течение 1,5–2 месяцев.
Настойка календулы с экстрактом прополиса. Смешать в равных пропорциях настойку календулы и 10% спиртовой экстракт прополиса (или 20% настойку прополиса)' 1 столовую ложку смеси развести в 0,5 л теплой кипяченой воды и использовать для спринцеваний, ванночек и примочек.
Отвар трав и прополис. Приготовить сбор: кора дуба обыкновенного – 20 г, цветки календулы лекарственной – 20 г, цветки ромашки лекарственной – 15 г, трава тысячелистника обыкновенного – 15 г, трава зверобоя продырявленного – 15 г, цветки бессмертника песчаного – 15 г; 4–5 столовых ложек сухого измельченного сбора залить 1 л кипятка, варить при слабом кипении 5–7 мин, настоять 1–2 ч, процедить. Добавить 10 мл 20% настойки прополиса и использовать отвар теплым для спринцевания 1–2 раза в день (второй раз – на ночь).
Приготовить сбор: трава тысячелистника обыкновенного – 35 г, цветки ромашки лекарственной – 35 г, листья подорожника большого – 30 г; 3 столовые ложки сухого измельченного сбора залить 0,5 л кипятка, варить на слабом огне 15 мин, настоять 1–2 ч, процедить. Добавить 1 чайную ложку 20% настойки прополиса и использовать для спринцевания 2 раза в день, а также для сидячих ванночек.
Фурункул
Фурункул – гнойное воспаление волосяного мешочка и связанной с ним сальной железы с вовлечением в процесс окружающей его подкожной жировой клетчатки. Генерализованное образование фурункулов, нередко рецидивирующих, носит название фурункулеза. Несколько фурункулов, сливаясь, могут образовывать карбункул вульвы.Этиология
Заболевание редко бывает первичным, этиологическим фактором в этом случае является инфекция.Фурункулез вульвы чаще носит вторичный характер, возникая на фоне предрасполагающих факторов: ■ нарушения личной гигиены – постоянное загрязнение кожи вульвы ■ механического раздражения кожи вульвы и воздействия химических факторов ■ микротравм вульвы ■ наличия у женщины хронического рецидивирующего вульвита, крауроза вульвы ■ у ослабленных и истощенных больных, имеющих тяжелую эктрагенитальную патологию – сахарный диабет, нарушения обмена веществ, кахексию, злокачественные опухоли ■ на фоне иммунодефицита.
Клиническая картина
Клинически заболевание проявляется наличием в области наружных половых органов одного или нескольких резко болезненных плотных узелков темно–багрового или темно–красного цвета, с выраженным отеком и гиперемией окружающих тканей. В центре фурункула имеется некротический участок, так называемый «стержень». В течение нескольких дней воспаленная волосяная луковица и сальная железа с подлежащей клетчаткой подвергаются некрозу и отторгаются, после чего наступает следующий этап воспаления – грануляция и эпителизация дефекта ткани с образованием рубца.Лечение
Терапия включает: ■ устранение причин, предрасполагающих или приводящих к развитию фурункулов ■ соблюдение гигиенических мероприятий – туалет наружных половых органов антисептическими растворами, использование чистой одежды, обработка кожи вульвы вокруг фурункула спиртом ■ антибактериальная терапия в остром периоде – внутрь и местно в виде аппликаций официнальных мазей антибиотиков в зависимости от выделенной флоры и ее чувствительности ■ сухое тепло, осторожное КУФ–облучение области вульвы, лазеротерапия ■ антигистаминные препараты – димедрол, супрастин, тавегил и др. ■ при образовании гнойно–некротического «стержня» допустимо аккуратное хирургическое вмешательство – удаление его (не выдавливать!) ■ при рецидивирующем хроническом течении заболевания в комплекс лечебных мероприятий целесообразно включать витамины, иммуностимуляторы – продигиозан, тимолин, аутогемотерапию, антистафилококковый γ–глобулин или антистафилококковую плазму.Бартолинит. Абсцесс большой железы преддверия влагалища
Бартолинит – воспаление большой железы преддверия влагалища.Абсцесс большой железы преддверия влагалища – образование в области большой железы преддверия влагалища гнойной полости с пиогенной капсулой.
Этиология
Этиология заболевания всегда инфекционная. Чаще возбудителями заболевания являются строгие анаэробы, попадающие в бартолиниевую железу из влагалища или уретры.Бартолинит, как правило, бывает односторонним, иногда встречается двухстороннее поражение.
Клиническая картина
В клинической картине бартолинита наиболее типично представлены все признаки воспаления, проявляющиеся следующими симптомами: ■ в области наружных половых органов на стороне поражения – острая, пульсирующая боль, иррадиирующая в промежность, ногу, усиливающаяся при физическом напряжении и ходьбе ■ симптомы общей интоксикации – общая слабость, недомогание, ухудшение общего самочувствия ■ повышение температуры тела – до 38,0 °С и выше ■ отек и гиперемия в области большой железы преддверия влагалища ■ диспареуния ■ резкая болезненность при пальпации железы, нередко размягчение и флюктуация.Абсцесс большой железы преддверия влагалища бывает ложным и истинным.
Ложный абсцесс – острое гнойное воспаление в устье выводного протока бартолиниевой железы, не распространяющееся на саму железу. Клинически область большой половой губы отечна, гиперемирована, с багровым оттенком, резко болезненна. Больная ощущает местное повышение температуры и резкое ограничение движений. Нередко абсцесс спонтанно вскрывается (на медиальной поверхности большой половой губы) или подвергается обратному развитию без нагноения (значительно реже). При хроническом рецидивирующем бартолините возможно формирование кисты большой железы преддверия влагалища.
Истинный абсцесс большой железы преддверия влагалища – гнойное воспаление самой железы и окружающих ее тканей. Клиническая картина ярко выраженная: высокая температура тела с ознобами, усиление местных воспалительных реакций, более выраженный болевой симптом.
Лечение
Терапия острого бартолинита проводится в условиях гинекологического стационара и включает: ■ постельный режим ■ прикладывание холода на область пораженной железы ■ антибактериальные препараты ■ антигистаминные средства ■ воздействие электрическим полем УВЧ на область поражения ■ анальгезирующие препараты ■ терапию ложного и истинного абсцесса, заключающуюся в своевременном и широком вскрытии гнойника (как правило, вскрытие абсцесса производится на наружной поверхности большой половой губы с целью предотвращения возможного инфицирования влагалища) с последующим дренированием и антибактериальной терапией; при наличии кисты железы показано хирургическое удаление ее в «холодном» периоде.Кольпит
В последнее десятилетие среди женщин многих стран мира отмечен рост инфекций влагалища, которые прочно занимают 1–е место в структуре акушерско–гинекологических заболеваний. Их частота в различных популяциях женщин варьирует от 30 до 80%.Кольпит (вагинит) – воспаление слизистой оболочки влагалища. Заболевание является наиболее частой нозологической формой в структуре воспалительных заболеваний женских половых органов. Основными возбудителями неспецифических кольпитов считаются неспорообразующие анаэробы. Влияние на количественный и видовой состав микрофлоры влагалища могут оказывать ВМС, хирургические травмы или инвазивные злокачественные опухолевые процессы, снижающие сопротивляемость тканей к бактериальным инфекциям. Пораженные раком ткани, вероятно, являются хорошим питательным субстратом для размножения анаэробов. Повреждение тканей при хирургических вмешательствах, снижение их окислительновосстановительного потенциала и развитие ишемии создают условия, при которых отдельные представители нормальной микрофлоры начинают быстро размножаться.
Повышенный научный и практический интерес к данной проблеме обусловлен не только широким распространением кольпитов, но и тем, что они часто могут быть непосредственной причиной развития тяжелой инфекционной патологии женских половых органов, плода и новорожденного. Важно отметить, что состояние биоценоза влагалища имеет значение не только для здоровья женщины, но и для ее ребенка, который первую микрофлору получает в родах. При наличии воспаления влагалища увеличивается риск развития таких осложнений, как самопроизвольный выкидыш, преждевременные роды, преждевременное излитие околоплодных вод, хориоамнионит, внутриутробное инфицирование плода. В послеродовом периоде нарушения в балансе микрофлоры влагалища могут стать причиной серьезных инфекционных осложнений у родильниц – метроэндометрита, перитонита, сепсиса. Кроме того, микроорганизмы родовых путей рожениц являются одним из главных факторов колонизационной резистентности новорожденных.
Одним из факторов биологической защиты от инфекций является нормальная микроэкосистема влагалища. Понятие «микроэкосистема» может быть сформулировано как экологическая ниша со всеми присущими ей общебиологическими свойствами. Микроэкосистема влагалища включает в себя: особенности анатомического строения органа с локальным кровообращением, лимфооттоком и иннервацией; гистологическую структуру слизистой оболочки влагалища; биологические и биохимические свойства влагалищной жидкости; микрофлору влагалища и ее метаболиты. Слаженность и гармоничность деятельности микроэкосистемы влагалища координируются и регулируются эндокринной, иммунной системами, особенностями процессов обмена в организме, некоторыми факторами внешней среды и экзогенных влияний.
Известно, что продукция молочной кислоты во влагалище обусловлена расщеплением гликогена молочно–кислыми бактериями. Количество гликогена в слизистой оболочке регулируется концентрацией эстрогенов. Существует прямая связь между количеством гликогена и продукцией молочной кислоты. Кроме того, обнаружено, что некоторые виды стрептококков, стафилококков, грамотрицательных бактерий и дрожжевых грибов могут являться представителями нормальной флоры у здоровых женщин и также способны расщеплять влагалищный гликоген с выделением метаболитов, которые и используют палочки Дедерлейна для продукции кислоты.
В настоящее время установлено, что влагалищной флоре присущи ферментативная, витаминообразующая, иммунизирующая и другие функции. Ее следует рассматривать не только как индикатор определенного состояния влагалища, но и в определенной степени как индикатор здоровья в целом, так как влагалищный биоценоз является интегрированным показателем суммарных влияний эндокринной, иммунной, сосудистой и других систем организма. Нормальная бактериальная флора выполняет антагонистическую роль, препятствуя инвазии патогенных микроорганизмов, а любая инвазия в здоровый эпителий почти всегда сопровождается изменениями микрофлоры влагалища.
В женских половых органах постоянно происходят циклические изменения, связанные прежде всего с функцией яичников.
Следовательно, нормальную микрофлору можно представить в виде динамической системы, которая в физиологических условиях подвергается влиянию менструального цикла, ритма половой жизни, беременности, индивидуальных гигиенических мероприятий. Кроме того, на микрофлору могут оказывать воздействие инвазивные диагностические и лечебные манипуляции, применение антибиотиков, цитостатиков, гормональных препаратов, ионизирующее излучение, хирургические вмешательства и др. Однако, несмотря на постоянные изменения, микрофлора гениталий относительно стабильна, что, на наш взгляд, может быть связано с недостаточно изученными механизмами саморегуляции микробной популяции макроорганизма.
Классификация
С учетом современных достижений клинической бактериологии и знаний инфекционной патологии женских половых органов современная классификация микроэкосистемы влагалища включает 4 типа биоценоза и соответствующие каждому типу нозологические формы. ■ Нормоценоз, характеризующийся доминированием лактобактерий, отсутствием грамотрицательной микрофлоры, спор, мицелия, псевдогифов, наличием единичных лейкоцитов и «чистых» эпителиальных клеток соответственно фазе менструального цикла. Подобная картина отражает типичное состояние нормального биотопа влагалища. Генитальный тракт в основном колонизирован комплексной микрофлорой. Исследования влагалищной микрофлоры у здоровых женщин свидетельствуют, что у 87–100% из них обнаруживаются аэробные микроорганизмы, среди которых наиболее часты лактобактерии (45–88%), стрептококки (53–68%), энтерококки (27–32%), коагулазонегативные стафилококки (34–92%) и колиформные микроорганизмы. Лактобактерии являются типичными представителями микрофлоры половых путей здоровых женщин. Они обеспечивают защитный механизм путем конкуренции с патогенными микроорганизмами и поддерживают кислую среду во влагалище, создающую неблагоприятные условия для развития патогенной микрофлоры. Существует мнение, что защитные свойства лактобактерий осуществляются за счет продуцирования ими так называемых эндобиотиков – веществ, действие которых подобно антибиотикам. Особое значение в поддержании нормального биоценоза во влагалище принадлежит лактобактериям, вырабатывающим водорода пероксид. Такие лактобациллы присутствуют у 96% здоровых женщин. ■ Промежуточный тип биоценоза влагалища, характеризующийся умеренным или незначительным количеством лактобактерий, наличием грамположительных кокков, грамотрицательных палочек; обнаруживаются лейкоциты, моноциты, макрофаги, эпителиальные клетки. Является пограничным типом, часто наблюдается у здоровых женщин, редко сопровождается субъективными жалобами и клиническими проявлениями. ■ Дисбиоз влагалища, выражающийся в значительном уменьшении или полном отсутствии лактобацилл, характеризующийся обильной полиморфной грамотрицательной и грамположительной палочковой и кокковой микрофлорой, наличием ключевых клеток, вариабельным количеством лейкоцитов, отсутствием или незавершенностью фагоцитоза. Соответствует микробиологической картине бактериального вагиноза. ■ Вагинит – полимикробная картина мазка, большое количество лейкоцитов, макрофагов, эпителиальных клеток, наличие выраженного фагоцитоза, морфологический пейзаж воспалительного процесса. Соответствует неспецифическому вагиниту. При обнаружении гонококков, трихомонад, мицелия, псевдогифов, спор выставляется соответствующий этиологический диагноз.Предложенная классификация достаточно проста и информативна, так как сочетает в себе микробиологическую интерпретацию влагалищного мазка, характеристику клинической картины и соответствующую конкретную нозологическую форму.
Таким образом, в соответствии с концепцией экологической ниши половые пути женщины можно представить как совокупность участков нескольких типов, включающих плоский эпителий влагалища, цилиндрический эпителий шейки матки и уникальную среду цервикальных желез. Эти участки характеризуются определенными биохимическими и физиологическими свойствами, поэтому каждому из них присуща несколько отличная от других популяция микроорганизмов.
Выделяют простой, сенильный, язвенный кольпит.
Неспецифический вагинит (НВ). Основным признаком острого неспецифического вагинита являются обильные, обычно гноевидные выделения из половых путей. Больные предъявляют жалобы на островозникшие зуд, жжение и боли в области влагалища и вульвы, усиливающиеся при мочеиспускании, половой жизни. При осмотре влагалища отмечается выраженная гиперемия слизистой оболочки, которая покрыта серозным или гнойным налетом, легко кровоточит.
Серозно–гнойный вагинит характеризуется крайне разнообразной клинической картиной: от незначительных изменений слизистой оболочки влагалища до тяжелого гнойного воспаления, когда слизистая оболочка резко утолщена, отечна, гиперемирована на всем протяжении, местами эрозирована и покрыта обильным гнойным отделяемым.
Симптомы вагинита в зависимости от тяжести воспалительного процесса могут быть различными. Выделения (fluor–vaginalis) – основной симптом заболевания, могут быть жидкими, водянистыми, гнойными, иногда пенистыми. При сильном слущивании эпителия они могут становиться густыми' часто зловонными. При тяжелом течении кольпита появляются кровянистые выделения.
По данным Е.Ф. Киры, при остром НВ больные также жалуются на зуд в области преддверия влагалища (96%), обусловленный раздражающим действием вытекающих белей' жжение (82%)' ощущение давления, тяжести, жара в половых органах и малом тазу. У 68% пациенток наблюдаются дизурические расстройства. В связи с наличием болевого синдрома становятся невозможными половые сношения. Внутреннее исследование или введение зеркал подчас невозможно вследствие болезненности и отечности влагалищных стенок.
При хронических формах воспаления болевой синдром отсутствует. Больные, как правило, жалуются на бели, зуд, жжение и на небольшие изъязвления в области вульвы и наружной трети влагалища. Общее состояние страдает мало.
Диагностика
Диагноз НВ легко может быть поставлен уже во время визуального осмотра в зеркалах. Слизистая оболочка при простом кольпите (vaginitis simplex) резко утолщена, отечна, гиперемирована на всем протяжении, местами покрыта плотнолежащими серыми пленками. Эти налеты можно удалить соскабливанием, вызвав небольшие ссадины и кровотечение. Характерным признаком являются неоднородные по консистенции бели.При гранулярном кольпите (vaginitis granularis) отечные сосочки имеют вид ярко–красных мелких зернышек, возвышающихся над слизистой оболочкой. При диагностике НВ особенно важное значение имеет бактериоскопия влагалищных белей fluorvaginalis). В мазках необходимо определить грампринадлежность микроорганизмов и провести их идентификацию. Чаще обнаруживается несколько видов микроорганизмов. При НВ всегда встречается большое количество лейкоцитов (от 30 до 60 и более), некоторые другие форменные элементы крови, достаточно много клеток слущенного эпителия влагалища. Микроскопическая картина характерна для воспалительного экссудата.
Бактериологическая диагностика НВ мало информативная из–за большого разнообразия микроорганизмов во влагалище как в норме, так и при патологических состояниях. Наиболее достоверные результаты можно получить при использовании количественных методов исследования микрофлоры влагалища, используя обязательно строгую анаэробную технику.
Лечение
Лечение начинается с местной санации. Выбор антибактериального препарата определяется характером возбудителя и его чувствительностью. Для орошения влагалища используют препараты с антисептическими, антибактерицидными, дезинфицирующими свойствами. Влагалище спринцуют растворами, которые используют для санации вульвы, также применяют клотримазол в виде влагалищных таблеток или крема, полижинакс, имеющие широкий спектр действия; тержинан. Высокоэффективным при лечении вагинитов является универсальный антисептик широкого спектра действия и бактерицидного характера антимикробного действия – бетадин. Лечение бетадином проводится с учетом клинических особенностей и стадии заболевания.При острой форме кольпита используется жидкая форма препарата в комбинации с суппозиториями. Проводится обработка влагалища 5% раствором бетадина, после чего используются суппозитории – 2 раза в день по одному суппозиторию вводится глубоко во влагалище в течение 7 дней. При хронической форме инфекции назначается по одному суппозиторию в день, при этом вводят его во влагалище перед сном в течение 14 дней.
Больным с выраженным кандидозным кольпитом назначают антимикотические средства в виде влагалищных шариков с нистатином или леворином, макмироркомплекс, низорал–крем и др. Больным возрастными кольпитами вследствие дефицита эстрогенов показаны кремы с эстрогенами, влагалищные таблетки кольпосептин, влагалищные шарики кольпотрофин, овестин, эстрогель или их аналоги. Для получения стойкого лечебного эффекта после окончания санации влагалища этими препаратами желательно выполнять спринцевания лактобактерином.
Предложен следующий патогенетический способ лечения кольпита: влагалище обрабатывают 4% раствором хлоргексидина однократно с экспозицией 5 мин, затем на 8–10 ч вводят тампон, пропитанный взвесью лактобацилл штамма КЗМ24. Курс лечения продолжается 7 дней, после чего производятбактериологический контроль. В качестве биопрепаратов используют также бифидумбактерин, лактобактерин и ацилакт в течение 7 дней после санации влагалища дезинфектантами. Эффект от биологического лечения кольпита обычно отмечают через 5 дней. В результате быстрой нормализации местного иммунитета рецидивы возникают крайне редко.
При длительно текущих, устойчивых к фармакотерапии кольпитах используют немедикаментозные методы лечения: иглорекфлексотерапию, лазеротерапию и озонотерапию.
Широко должны применяться фитосборы. Приводим некоторые примеры.
Прополис при воспалениях влагалища. Взять 3% спиртовой раствор прополиса, смочить им тампон и ввести во влагалище, прижав его к шейке матки (секрет с нее предварительно следует удалить). Через 8–12 ч тампон вынуть. Курс лечения при бактериальных, грибковых и трихомонадных воспалениях влагалища, а также при эрозиях шейки матки составляет в среднем 7–10 дней (тампоны вводятся 1 раз в день). При использовании 10% спиртовой настойки прополиса ее нужно предварительно развести водой. Результаты такого лечения лучше, чем при использовании других медикаментов.
Мазь с календулой и прополисом. Взять 15 мл 20% настойки прополиса и столько же настойки календулы, смешать с 60 г ланолина, чтобы получилась гомогенная мазь. Использовать ее для лечения эрозий шейки матки: сначала удалить секрет, затем прижать тампон с мазью, через 10–12 ч тампон удалить за привязанную к нему ниточку. Вводить тампон 1 раз в сутки.
Отвар трав с медом. Приготовить сбор: цветки ромашки лекарственной – 40 г, почки березы белой – 30 г, кора ивы – 30 г; 2 столовые ложки сухого измельченного сбора залить 0,5 л кипятка, варить при слабом кипении 5–7 мин, настоять 1–2 ч, процедить и пить по 150 мл 3 раза в день, добавляя по вкусу мед, в течение 1,5–2 месяцев.
Настойка календулы с экстрактом прополиса. Смешать в равных пропорциях настойку календулы и 10% спиртовой экстракт прополиса (или 20% настойку прополиса); 1 столовую ложку смеси развести в 0,5 л теплой кипяченой воды и использовать для спринцеваний, ванночек и примочек.
Отвар трав и прополис. Приготовить сбор: кора дуба обыкновенного – 20 г, цветки календулы лекарственной – 20 г, цветки ромашки лекарственной – 15 г, трава тысячелистника обыкновенного – 15 г, трава зверобоя продырявленного – 15 г, цветки бессмертника песчаного – 15 г; 4–5 столовых ложек сухого измельченного сбора залить 1 л кипятка, варить при слабом кипении 5–7 мин, настоять 1–2 ч, процедить. Добавить 10 мл 20% настойки прополиса и использовать отвар теплым для спринцевания 1–2 раза в день (второй раз – на ночь).
Можно приготовить сбор: трава тысячелистника обыкновенного – 35 г, цветки ромашки лекарственной – 35 г, листья подорожника большого – 30 г; 3 столовые ложки сухого измельченного сбора залить 0,5 л кипятка, варить на слабом огне 15 мин, настоять 1–2 ч, процедить. Добавить 1 чайную ложку 20% настойки прополиса и использовать для спринцевания 2 раза в день, а также для сидячих ванночек.
Экзоцервиты и эндоцервициты
Экзоцервицит – воспаление влагалищной части шейки матки.Эндоцервицит – воспаление слизистой оболочки канала шейки матки.
Необходимо отметить, что шейка матки и влагалище представляют собой единую анатомо–функциональную систему, в связи с чем воспаления шейки матки, как правило, не бывают изолированными. Поэтому в современной классификации заболеваний нижнего отдела гениталий вагинитом называют воспаление влагалища в сочетании с экзо– и эндоцервицитом.
Этиология
Воспалительные процессы в экзо– и эндоцервиксе могут быть вызваны возбудителями неспецифической (условно–патогенные микроорганизмы – e. coli, стрептококки, стафилококки и др.) и специфической (хламидии, трихомонады, гонококки, кандиды, вирусы) этиологии.Предрасполагающими факторами к возникновению болезни являются рубцовая деформация шейки матки, опущение стенок влагалища и шейки матки. Эндоцервицит может быть следствием воспалительных процессов других отделов гениталий – эндометрита, сальпингоофорита.
Наиболее часто эта патология встречается у женщин репродуктивного возраста. Однако нередко в период перименопаузы у женщин возникают атрофические кольпиты и неспецифические цервициты в связи с возрастными изменениями и дефицитом эстрогенов.
Клиническая картина
В острой стадии воспаления клиническими симптомами неспецифического цервицита являются обильные или умеренные слизистые или слизисто–гнойные выделения. Нередко пациенты жалуются на зуд, реже – на тупые тянущие боли в нижних отделах живота и пояснице. При исследовании шейки матки с помощью зеркал отмечаются гиперемия, отек, иногда точечные кровоизлияния слизистой оболочки влагалища и шейки матки, слизистые или слизистогнойные бели. В случае тяжелого течения цервицита вследствие дистрофии эпителия появляются участки изъязвлений с образованием эрозий.В хронической стадии воспаления клинические проявления цервицита бывают стертыми, жалобы у больных практически отсутствуют. Иногда пациенты отмечают незначительные выделения из половых путей слизистого характера. При осмотре в зеркалах эпителиальный покров шейки матки изменен мало, шейка матки отечная, с очаговой гиперемией, в основном вокруг наружного зева. Затяжное и длительное течение цервицита при отсутствии соответствующей терапии приводит к гипертрофии шейки матки и образованию псевдоэрозий и рака.
Диагностика
Диагностика экзо– и эндоцервицита включает данные анамнеза, клинические признаки, лабораторные исследования, которые подразделяются на обязательные и дополнительные. К обязательным методам исследования относятся: микроскопические и бактериологические (позволяют определить этиологию воспаления, видовую принадлежность патогенных микроорганизмов и их чувствительность к антибактериальным препаратам), цитологические для оценки структуры и клеточного уровня повреждения тканей, а также расширенная кольпоскопия. Из дополнительных методов диагностики применяют исследования на хламидиоз, микоплазмоз, вирусные инфекции; определение типа биоценоза влагалища; биопсию шейки матки.Лечение
Терапия экзо– и эндоцервицитов должна быть комплексной, местной и общей, этиотропной и направлена на устранение предрасполагающих факторов (обменных, нейроэндокринных, функциональных, травматичных и др.) и сопутствующих заболеваний.Антибактериальная терапия проводится при выявлении этиологии цервицита и включает применение антибактериальных препаратов местно, орально или парентерально в зависимости от характера клинических проявлений и стадии заболевания.
Выбор антимикробного препарата определяется чувствительностью к нему микроорганизма.
Местная терапия заключается в назначении антибактериальных средств в виде орошений влагалища растворами натрия бикарбоната, димексида, хлорофиллипта, настоем эвкалипта; ванночек с протарголом, колларголом, йодокаром, бетадином; мазевых аппликаций.
Необходимым условием эффективности лечения является поддержание нормальной микроэкосистемы влагалища путем повышения кислотности (инстилляции слабыми растворами молочной или борной кислоты).
В комплекс лечебных мероприятий должны быть включены средства по восстановлению нормального микроценоза влагалища – эубиотики (бифидумбактерин, ацилакт, бификол и другие препараты местно и внутрь 15–30 дней).
При возрастных цервицитах применяется гормональная терапия. Более целесообразно местное применение эстрогенов, в частности овестина.
При упорных хронических цервицитах в комплекс терапии включают физиопроцедуры (эндоцервикальный электрофорез специальным конусным электродом растворов цинка или йода; СМВ–терапия на область влагалища; местная дарсонвализация влагалища; лазерное облучение вульвы контактной, лабильной методикой; ультрафонофорез влагалища (для фонофореза можно использовать 2% раствор водорода пероксида, 0,1% раствор калия перманганата, 1% раствор йодинола, 10% раствор димексида, 0,5% раствор этония, 0,25% раствор трихопола, мазь гидрокортизона).
Больным с рубцовой деформацией шейки матки после предварительной санации в стационаре выполняют пластическую операцию, объем которой определяется состоянием шейки.
Эндометрит
Эндометрит – воспаление слизистой оболочки матки. Однако изолированное воспаление слизистой оболочки матки встречается редко. Клинические проявления и гистологические исследования свидетельствуют о частом вовлечении в воспалительный процесс миометрия – эндомиометрит. При тяжелом течении инфекции возможно воспаление всех слоев матки и развитие панметрита. Различают эндометрит акушерский и гинекологический. Послеродовой эндометрит чаще развивается после оперативного родоразрешения (кесарево сечение, акушерские щипцы, плодоразрушающие операции), у инфицированных рожениц и родильниц, при наличии в анамнезе хронических воспалительных процессов органов малого таза. Провоцирующими факторами в гинекологии чаще являются медицинский или криминальный аборт, внутриматочные манипуляции (метросальпингографии, гистероскопии, диагностическое выскабливание слизистой оболочки полости матки, введение внутриматочной спирали и др.), нарушение гигиены половой жизни (половые контакты во время менструации), операции на матке.Воспалительная реакция при эндометрите характеризуется расстройствами микроциркуляции в пораженных тканях (расширение сосудов, замедление тока крови, тромбы), выраженной экссудацией (серозный, серозно–гнойный, гнойный экссудат). Отмечается отек и нейтрофильная инфильтрация миометрия.
Возбудителями эндометрита могут быть патогенные и условно–патогенные микроорганизмы. Характерной особенностью этой патологии в современном акушерстве и гинекологии является ее полимикробная этиология. Нередко заболевание связано преимущественно с грамотрицательными аэробными бактериями и неспорообразующими анаэробами, в этом случае возможна некротическая деструкция тканей. По современным представлениям, воспалительные заболевания матки развиваются не вследствие прогрессирующей инфекции, а в результате генерализованного воспаления, реакции организма, причем достаточно часто в виде септического состояния.
Классификация
По клиническому течению выделяют острый, подострый, хронический эндометрит. Наиболее часто встречается острый эндометрит. Повышенная вирулентность микроорганизмов, наличие высокоактивных ферментов и токсинов, недостаточность иммунных реакций макроорганизма, неблагоприятный аллергический фон, неадекватно начатое лечение нередко приводят к возникновению септического состояния на фоне эндометрита.Гистероскопически выделяют три клинических варианта течения эндометрита: ■ эндометрит ■ эндометрит с некрозом децидуальной ткани ■ эндометрит с задержкой остатков плацентарной ткани.
Частота выявления хронического эндометрита, по различным данным, варьирует от 0,2 до 66,3%, в среднем около 14%. Хронический эндометрит – понятие клинико–анатомическое.
По данным В.И. Бодяжиной, гистологическими критериями при постановке диагноза хронического эндометрита являются инфильтраты из лимфоидных и плазматических клеток, полиморфноядерных лейкоцитов и гистиоцитов.
Клиническая картина
Обычно заболевание развивается остро, начинаясь с ухудшения общего состояния. Появляются недомогание, боли в нижних отделах живота с иррадиацией в поясницу, крестец, промежность, паховую область. Чаще протекает в тяжелой форме и проявляется на 1–3–е сутки, иногда – на 4–5–е сутки после инфицирования. Характерными симптомами являются: лихорадка; при легкой, средней степени тяжести эндометрита температура тела 37–38 °С, при тяжелой –38,5°С и выше; ознобы; тахикардия; нарушение сократительной деятельности матки: при гинекологическом исследовании у больных пальпируется мягковатой консистенции, несколько увеличенная и болезненная матка; патологический характер выделений (либо яркие кровянистые, либо цвета «мясных помоев», либо слизисто–гноевидные с неприятным запахом – при анаэробной инфекции)Диагностика
В лабораторных показателях – изменение картины крови (умеренное ускорение СОЭ до 35 мм/ч, лейкоцитоз – до 12·109 /л, нейтрофильный сдвиг формулы влево, анемия, ЛИИ – до 1,5–3).Появляются УЗИ–признаки эндометрита: увеличение матки и ее полости, наличие в полости матки различных по величине и эхогенности включений, фибринозные наложения на стенках матки в виде линейных эхопозитивных структур, неоднородность структуры миометрия.
Гистероскопически наиболее тяжелым вариантом является эндометрит с некрозом децидуальной ткани (на 2–4–е сутки, состояние тяжелое, температура 39–40 °С, величина матки 16 и более недель, матка резко болезненна; выделения гнойные, зловонные).
При переходе заболевания в хроническую стадию больных периодически беспокоят тупые ноющие боли в низу живота и в пояснице, слизисто–гнойные выделения из половых путей. Общее состояние пациентов не нарушается, температура тела нормальная, показатели крови не изменены. Хронический эндометрит протекает, как правило, без ярких клинических проявлений. Характерными являются нарушения репродуктивной функции (невынашивание беременности, дисфункциональные маточные кровотечения).
Лечение
При остром эндометрите лечение проводится в стационаре, назначается постельный режим. Основными направлениями лечения являются следующие.Монотерапия антибиотиками в лечении эндометритов в акушерстве и гинекологии не рекомендуется. Определение чувствительности выделенных возбудителей инфекции к антибиотикам является основным принципом антибактериального лечения. Однако, как показывает опыт, в большинстве случаев антибиотики назначают до получения антибиотикограммы, в связи с чем следует назначать препараты с бактерицидной активностью и широким спектром антибактериального воздействия. Оптимальным вариантом является сочетание антибиотиков с одним типом действия на микробную клетку для достижения синергичного эффекта. Проводятся аспирационно–промывное дренирование подлости матки дезинфицирующими растворами, инфузионно–трансфузионная терапия. Назначают десенсибилизирующие средства, витаминотерапию. Проводят физиолечение. В острой стадии применяется УФ–облучение трусиковой зоны по Желоховцеву, воздействие электрическим полем УВЧ на область матки. В подострой и хронической стадии используют ДМВ–терапию, высокочастотную магнитотерапию на область матки, магний–электрофорез, местную дарсонвализацию при помощи влагалищного электрода, лазеротерапию, акупунктуру или лазеропунктуру.
Для реабилитации женщин, перенесших эндометрит, целесообразно назначать курортное лечение (пелоидотерапию, бальнеотерапию).
Сальпингоофорит (аднексит)
Сальпингоофорит – воспаление придатков матки, преобладающая форма воспалительных заболеваний внутренних половых органов. В настоящее время воспалительные заболевания придатков матки относят к смешанным полимикробным инфекциям, важнейшим возбудителем которых являются анаэробно–аэробные микроорганизмы (25–60%), гонококк (25–50%), хламидии (25–30%), микоплазмы (15%). Факторы риска развития сальпингоофоритов весьма разнообразны. Наиболее частыми являются: восходящая инфекция из нижних отделов гениталий; длительное применение ВМК (большинство исследователей считают, что при использовании ВМС риск развития воспалительных заболеваний органов малого таза повышается в 3–9 раз); беспорядочная половая жизнь, наличие большого числа половых партнеров; внутриматочные лечебно–диагностические манипуляции; осложненные аборты и роды; оперативные вмешательства на органах брюшной полости и малого таза.В слизистой оболочке маточной трубы развиваются гиперемия, расстройства микроциркуляции, экссудация, образуются периваскулярные инфильтраты. При распространении воспаления на мышечный слой труба отекает, утолщается и удлиняется. Проникающие через просвет трубы в брюшную полость микроорганизмы поражают серозную оболочку маточной трубы, покровный эпителий яичника. После разрыва фолликула инфицируется его гранулезная оболочка и, как следствие этого, воспаляется яичник.
Клиническая картина
Заболевание возникает остро, сопровождается выраженными симптомами интоксикации. Характерны резкие интенсивные боли в низу живота и в пояснице, при которой больная нередко занимает вынужденное положение. Наиболее типичными симптомами сальпингоофорита являются: резкое повышение температуры тела (38 °С и выше), озноб; дизурические и диспептические явления; болезненность живота при поверхностной и глубокой пальпации; болезненность в области придатков при смещении шейки матки и пальпации придатков матки; могут быть перитонеальные симптомы; возможно наличие гнойных выделений из половых путей; изменения картины крови (ускорение СОЭ, лейкоцитоз 10–12·109/л и более, увеличение ЛИИ выше 1,5); в области придатков определяют пастозность, пальпируют увеличенные придатки и часто без четких контуров, ограниченно подвижные, болезненные.Диагностика
Для уточнения диагноза и выбора тактики лечения применяют пункцию брюшной полости через задний свод, УЗИ, лапароскопию. Данные эхоскопии сегодня недостаточно информативны для диагностики острого сальпингоофорита, поэтому результаты эхоскопического исследования следует оценивать лишь в совокупности с клиническими и клиниколабораторными данными.Лечение
Лечение острого сальпингоофорита следует проводить в стационаре.Основным компонентом в комплексном лечении является антибактериальная терапия, которая должна проводиться в соответствии со следующими принципами. ■ В настоящее время среди возбудителей сальпингоофоритов преобладают ассоциации неспорообразующих анаэробных микроорганизмов, грамотрицательной и грамположительной микробной флоры в сочетании с трансмиссивными инфекциями, поэтому необходимо применять антибактериальные препараты широкого спектра действия или комбинации препаратов, влияющих на основные патогенные микроорганизмы. ■ Проведение направленной антибактериальной терапии возможно при наличии антибиотикограммы. ■ Основным правилом является подбор препаратов по принципу: «бактерицидный препарат сочетается с бактерицидным» и «бактериостатический с бактериостатическим». ■ Следует учитывать, что при комбинированном назначении антибиотиков кумулируются не только их положительные, но и отрицательные свойства, поэтому предпочтение отдается наименее токсичным препаратам. ■ Режим введения препаратов (путь введения, доза и кратность) должен обеспечивать поддержание терапевтической концентрации в очаге на протяжении всего лечения, длительность терапии не должна быть менее 7–10 дней.
В настоящее время наиболее эффективными и принятыми во всем мире для лечения больных ГВЗПМ являются следующие комбинации антибактериальных препаратов: ■ цефалоспорины 3–го поколения, которые очень хорошо действуют на гонококки и энтеробактерии в комбинации с тетрациклинами, уничтожающими хламидии ■ цефалоспорины 2–го поколения в сочетании с тетрациклинами ■ клиндамицин + гентамицин.
Новые исследования показывают, что гентамицин может быть заменен монобактамом типа азтреонам; этот режим более эффективен и менее токсичен.
Можно успешно использовать следующие комбинации антибактериальных средств: ■ цефуроксим + метрогил ■ цефуроксим + гентамицин ■ цефуроксим + доксициклин ■ цефуроксим + метрогил + гентамицин ■ клиндамицин + гентамицин ■ фортум + доксициклин ■ клафоран + доксициклин.
Характеристика современных антибактериальных препаратов приводится в прил. 1.
Осложнением длительной антибактериальной терапии нередко является подавление нормальной микрофлоры в кишечнике и влагалище, поэтому необходима коррекция биоценоза. Для этого назначают перорально эубиотики: бифидумбактерин, лактобактерин, колибактерин, бификол, ацилакт, бифидумбактерин–форте по 5 доз 3 раза при субкомпенсированных формах дисбактериоза и по 10 доз 3 раза при декомпенсиро–ванных формах в сочетании со стимуляторами роста нормальной микрофлоры кишечника (хилаком–фортепо 40–60 капель 3 раза в день или кальция пантотенатом) и ферментами (фестал, энзистал, мезим–форте, панзинорм) по 1 таблетке при каждом приеме пищи.
В острой стадии воспалительного процесса целесообразно проведение дезинтоксикационной терапии, которая включает применение корректоров электролитного обмена (изотонический раствор хлорида натрия, раствор Рингера – Локка, растворы глюкозы, реополиглюкин, плазмастерил), возмещение белковых потерь, улучшение реологических свойств крови и микроциркуляции.
При тяжелой степени интоксикации у больных ГВЗПМ трансфузионную терапию проводят в течение 7–10 дней: первые три дня ежедневно, а затем через день в объеме 1500–2000 мл/сут.
При средней степени интоксикации объем трансфузий уменьшается (до 500–1000 мл/сут), терапия также продолжается 7–10 дней.
Патогенетически оправданным является назначение нестероидных противовоспалительных средств.
Механизм действия препаратов (В.Г. Кукес, 1991) заключается в ограничении экссудативных проявлений воспалительного процесса и инактивации медиаторов воспаления, анальгетическом эффекте и антиагрегационном действии в отношении тромбоцитов. Нестероидные противовоспалительные препараты оказывают десенсибилизирующее и антипиретическое действие. Из этой группы лекарственных средств предпочтительнее назначать диклофенак (вольтарен) по 3 мл внутримышечно или в свечах ректально, ибупрофен (бруфен) по 1 таблетке 3 раза в день, индометацин (ректальные свечи) по 1–2 свече в течение 10 дней.
Для восстановления нарушенных метаболическихи гемостазиологических функций организма целесообразно назначение препаратов, улучшающих метаболические процессы в клетках и тканях, регулирующих окислительно–восстановительные процессы, участвующих в жировом, белковом, углеводном обменах – актовегин или солкосерил, а также коферментов – кокарбоксилазы, рибофлавина, кальция пантотената, липоевой кислоты.
С целью улучшения микроциркуляции, дезагрегирующего эффекта в курс противовоспалительного лечения включают трентал, курантил, эскузан. Необходимым компонентом терапии сальпингоофоритов является назначение десенсибилизирующих и седативных средств.
Для усиления анальгетического, противовоспалительного и рассасывающего эффектов в очаге воспаления, замедления прогрессирования воспалительного процесса применяется физиотерапевтическое лечение. В острой стадии воспаления придатков матки приемлемо воздействие электрическим полем УВЧ на область проекции придатков матки, УФ–облучение трусиковой зоны, внутривенное лазерное облучение крови. В подострой стадии назначают магний (цинк, кальций, антипирин) – электрофорез на область придатков, КУФ–облучение области придатков, низкочастотную магнитотерапию придатков, воздействие лазерного излучения на паховую область и через боковые своды влагалища.
После выписки из стационара рекомендуют провести реабилитационную терапию, которая заключается в коррекции иммунного статуса с помощью иммуномодулирующих препаратов.
Хронический сальпингоофорит
Развивается в случае нелеченного острого сальпингоофорита (при стертом течении) или недостаточной эффективности терапии. Происходят изменения сосудов маточных труб – склероз артериол и гипертрофия венул. Затем атрофируются гладкомышечные клетки и развивается склероз венул. В результате возникают декомпенсация, венозный сброс крови и варикозно расширяются сосуды в истмическом отделе труб. Функции слизистой и мышечной оболочек маточной трубы прекращаются, развивается соединительная ткань, сужается просвет сосудов, усиливаются склеротические процессы. Нередко маточные трубы становятся непроходимыми, вокруг яичников образуются спайки. Характерны глубокие нарушения регионарной гемодинамики. Степень нарушений кровотока зависит от активности воспаления и степени распространения спаечного процесса в малом тазу. Вследствие этого анатомически изменяются придатки, общепринятая терапия становится недостаточно эффективной.Отмечается стресс–индуцированная дисфункция нейроэндокринной и иммунной систем, определяется патологическая недостаточность адаптационных возможностей на стадии истощения. Вследствие этого возникает неадекватная реакция организма.
Клиническая картина
Больные в основном жалуются на тупые, ноющие боли в нижних отделах живота, часто иррадиирующие в поясницу, которые усиливаются при охлаждении, иногда перед или во время менструаций. Нарушения менструальной функции в виде полименореи, олигоменореи, альгодисменореи наблюдаются у 4–55% больных и преимущественно связаны с нарушением функции яичников (ановуляцией и др.).Чаще всего развивается гипофункция яичников. Проявлением хронических сальпингоофоритов является бесплодие.
Рецидивы заболевания обусловлены, как правило, переохлаждениями, переутомлениями, стрессами и другими факторами.
Лечение
Учитывая отсутствие четких критериев излеченности хронического процесса, наиболее приемлема для клинического применения классификация степеней излеченности: ■ 1–й уровень – клиническое выздоровление (улучшение общего состояния больной, исчезновение болевого синдрома и анатомических нарушений, характерных для обострения; ликвидация воспалительных сдвигов в крови) ■ 2–й уровень – нормализация эндокринной функции половой системы (восстановление менструальной функции) ■ 3–й уровень – восстановление адаптационно–защитных механизмов, коррекция нарушений гомеостаза и реабилитация репродуктивной функции.На 1–м уровне лечение включает назначение антибактериальных средств.
Антибиотикотерапия при хронических сальпингоофоритах показана в следующих случаях: ■ при обострении воспалительного процесса ■ если при лечении в острой и подострой стадиях антибиотики использовались нерационально ■ при наличии воспалительных процессов во влагалище или шейке матки ■ при производстве инвазивных вмешательств на органах малого таза у больных хроническим воспалением придатков матки.
По мере необходимости проводят детоксикационную и десенсибилизирующую терапию, витаминотерапию; 2–й и 3–й этапы требуют длительной терапии и, начинаясь в стационаре, продолжаются после стационарного лечения под контролем врача женской консультации.
Шире, чем в острой и подострой стадиях, должны применяться физиотерапевтические процедуры (лекарственный электрофорез области придатков с противовоспалительными средствами – натрия салицилат, вольтарен, делагил, бефунгин, ихтиол, унитиол); высокочастотная магнитотерапия придатков, воздействие ультразвука на область придатков, ультра–фонофорез области придатков, лазерное облучение придатков, нормобарическая гипокситерапия, ИГТ, углекислые и радоновые гинекологические орошения. С целью нормализации эндокринной функции половой системы обычно назначают комбинированные эстроген–гестагенные препараты по традиционным контрацептивным схемам.
Тубоовариальный абсцесс и пиосальпинкс
Пиосальпинкс – скопление гноя в маточной трубе при сальпингите, обусловленное заращением ампулы в маточной части трубы.Тубоовариальный абсцесс – полость в области маточной трубы и яичника, содержащая гной и отграниченная от окружающих тканей пиогенной мембраной.
Клиническая картина
Клиническая симпотоматика заболевания такая же, как у больных с острым сальпингитом: ■ боли в низу живота или тазовые боли в течение нескольких дней ■ генерализованная боль по всему животу при попадании гноя в брюшную полость ■ иррадиация боли в правый верхний квадрант живота, поясницу ■ усиление болевого синдрома при движении ■ вынужденное положение тела ■ озноб ■ потеря аппетита, недомогание, слабость ■ тошнота, рвота, понос ■ гнойные выделения из влагалища ■ лихорадка, температура тела 38–40°С ■ выраженная тахикардия, понижение АД ■ положительные симптомы раздражения брюшины ■ усиление болей при смещении шейки матки ■ матка нормальных размеров, болезненная ■ пальпируемое опухолевидное образование с одной или с обеих сторон от матки болезненное, с нечеткими контурами, мягкоэластической консистенции.Диагностика
Основана на данных анамнеза и объективного обследования, подкрепленных результатами УЗИ и лабораторных исследований, из которых наиболее характерен L–цитоз с явным сдвигом в сторону полиморфно–ядерных клеток, увеличение ЛИИ до 10, СОЭ до 30 мм/ч и выше, умеренно выраженная анемия.Лечение
На начальных этапах проводится консервативное лечение: необходимо соблюдение постельного режима, коррекция нарушений водно–электролитного баланса; назначение седативных антибактериальных препаратов, обязательное удаление ВМС при ее наличии.При отсутствии эффекта от проводимой терапии и ухудшении общего состояния необходимо решить вопрос о хирургическом лечении.
Показаниями к оперативному лечению являются: отсутствие эффекта от медикаментозного лечения; разрыв абсцесса; развитие инфекционно–токсического шока; развитие септического тазового тромбофлебита.
При операциях по поводу тубоовариальных абсцессов или пиосальпинксов следует определить объем оперативного вмешательства. Следует учитывать анамнез больной и ее желание сохранить фертильность или менструальную функцию. Удаление всех тканей, вовлеченных в патологический процесс, необходимо. Если больная не выражает желания сохранить фертильность, то показана гистерэктомия, что позволяет избежать впоследствии выраженного спаечного процесса. Классической операцией, производимой по поводу вскрывшегося абсцесса, является тотальная абдоминальная гистерэктомия и билатеральная сальпингоофорэктомия с дренированием малого таза.
Хирургу в подобных ситуациях следует помнить, что не существует единого правила лечения, подход всегда должен быть индивидуальным и сочетаться с желанием женщины и клиническими данными.
В настоящее время определены следующие показания для оперативного лечения воспалительных заболеваний органов малого таза: ■ гнойные тубоовариальные образования (пиосальпинкс, абсцесс яичника, пиовар, тубоовариальный абсцесс), неподдающиеся консервативной медикаментозной терапии (при отсутствии условий для эндохирургического лечения или дренирования их под контролем трансвагинальной эхографии) ■ рецидивирующее течение гнойной инфекции с тенденцией к генерализации и образованию тубоовариальных абсцессов ■ осложнения гнойных воспалительных заболеваний придатков матки, в том числе: угроза перфорации или перфорация пиосальпинкса, пиовара, тубоовариального абсцесса с развитием разлитого перитонита; сепсис; сформировавшиеся пузырнопридатковые, кишечно–придатковые и брюшностеночно–придатковые свищи; образование внутрибрюшных абсцессов (межкишечный, поддиафрагмальный, подпеченочный и др.).
Более того, традиционное хирургическое вмешательство является методом выбора при лечении больных гнойными тубоовариальными образованиями в пре– и постменопаузальном периоде, а также при сочетании инфекции гениталий с доброкачественными опухолями матки.
Вопрос о выборе объема хирургического вмешательства при гнойных воспалительных заболеваниях придатков матки по–прежнему остается одним из сложных. Бесспорно, что в каждой конкретной клинической ситуации объем оперативного лечения должен быть тщательно продуман и максимально индивидуализирован с учетом инициального момента заболевания, тяжести и распространенности воспалительного процесса, наличия сопутствующей гинекологической патологии, возможного риска возникновения гнойно–септических осложнений в послеоперационном периоде. Однако у молодых женщин удаление матки должно быть скорее исключением, чем правилом.
Радикальные хирургические вмешательства (экстирпация или надвлагалищная ампутация матки с одно– или двусторонним удалением придатков) производятся только в следующих клинических ситуациях: ■ септическое состояние больной, обусловленное хроническим течением инфекции, формированием множественных внутрибрюшных абсцессов ■ разлитой (диффузный) гнойный перитонит ■ первичное вовлечение в воспалительный процесс матки (эндомиометрит, панметрит), в том числе после родов, абортов, внутриматочных лечебно–диагностических манипуляций или вследствие применения ВМС ■ множественные генитальные свищи воспалительного генеза ■ двусторонние тубоовариальные абсцессы кистозносолидной структуры, множественные абсцессы в малом тазу, выраженные инфильтративные изменения параметральной клетчатки ■ сопутствующие заболевания тела и шейки матки (миома матки, аденомиоз, дисплазия шейки матки).
Учитывая особенности современных воспалительных заболеваний органов малого таза, их склонность к септическим проявлениям, накопление в крови и тканях биологически активных веществ и токсических метаболитов, целесообразным является применение методов усиления естественной детоксикации в лечении данной патологии. К таким направлениям терапии относятся эфферентные методы: гемодиализ, гемосорбция, плазмаферез, гемофильтрация, квантовая гемотерапия (лазерное и ультрафиолетовое облучение крови). Классификация основных методов элиминационной терапии, механизм их действия, показания и способы применения приведены в прил. 2.
Глава 7. Вопросы планирования семьи
Социальные и медицинские аспекты
В течение последних десятилетий научно обоснована тесная взаимосвязь между репродуктивным здоровьем женщины и состоянием здоровья ее ребенка. Установлено, что слишком ранние, частые и поздние роды, а также прерывание нежелательной беременности являются одной из причин младенческой и материнской смертности. Только предупреждение беременности у женщин моложе 19 и старше 35 лет, а также соблюдение интервалов между родами не менее 2–2,5 лет снижает материнскую и раннюю детскую смертность более чем в 2 раза. Поэтому планирование семьи для рождения только желанных детей следует рассматривать как неотъемлемое право женщины на сохранение своего здоровья и здоровья своих детей.В 70–90–е гг. XX в. под патронажем ООН был проведен ряд Всемирных конференций по вопросам народонаселения. В резолюциях последних подчеркивается, что планирование семьи является неотъемлемым компонентом прогрессивного развития человечества. Это существенный элемент первичной медицинской помощи, необходимый для сохранения здоровья и обеспечения регуляции детородной функции для рождения только желанных детей.
Несмотря на эффективность современной контрацепции, нежелательные беременности имеют место в большом количестве во всех странах мира. Каждый год на Земле выполняется от 40 до 60 млн абортов, примерно 20 млн из них – в небезопасных условиях. Беларусь и другие страны СНГ представляют собой неблагоприятную зону по абортам. Так, число абортов в Восточной Европе в 1993 г. составляло 80 на 100 родов, в Белоруссии – 75, России – 200, в странах Западной Европы – менее 20.
Аборт наносит организму женщины непоправимый вред, зачастую являясь началом развития гинекологических и эндокринных заболеваний. Ежегодно вследствие осложнений беременности, родов и абортов в мире умирает почти 500 тыс. женщин. Более 1/3 этих смертей, а также миллионы случаев нарушений в сексуальной и репродуктивной сфере являются следствием абортов. Установлено, что аборт в анамнезе имел место у 41% женщин с бесплодием и почти у половины женщин с внематочной беременностью. Осложнения беременности встречаются после искусственного аборта в три раза чаще. Согласно положению ООН, искусственный аборт не должен рассматриваться как метод регуляции рождаемости.
Медицинский аборт – прерывание беременности в сроки до 12 недель беременности.
Последствия аборта для организма женщины, как правило, неблагоприятны. Он способствует возникновению или обострению воспалительных процессов внутренних половых органов, дисфункции яичников и является одной из причин невынашивания беременности, бесплодия, эндометриоза, патологии шейки матки, функциональных нарушений репродуктивной и эндокринной систем, дисгормональных изменений в молочных железах. Аборт, особенно при 1–й беременности, увеличивает частоту преждевременных родов в 2 раза, а перинатальную смертность – в 1,5 раза.
Методы прерывания беременности в ранние и поздние сроки
Медицинский аборт может выполняться двумя способами: методом выскабливания матки и методом вакуум–экскохлеации. Операция производится только в стационарных лечебнопрофилактических учреждениях в условиях операционной с соблюдением всех правил асептики и антисептики под местным обезболиванием или внутривенным общим наркозом. Подготовка к операции включает обязательное опорожнение мочевого пузыря.Обезболивание (парацервикальная новокаиновая блокада).
Пулевыми щипцами захватывают переднюю губу шейки матки, обнажают правый боковой свод, куда вводят 0,5% раствор новокаина с добавлением ex tempore 0,1% раствора адреналина из расчета 5 капель на каждые 100 мл новокаина. Введение препарата осуществляется в подслизистую, причем игла постепенно продвигается на глубину 2 см (слегка кнаружи). Непосредственно перед введением рекомендуется потянуть поршень на себя, чтобы обнаружить, не введена ли игла в сосуд, и тем самым избежать инъекции новокаина в него. Таким же путем вводят новокаин и в левый боковой свод влагалища. В каждый свод вводят 40 мл раствора; 20 мл раствора новокаина вводят дополнительно в задний свод на глубину 0,5–2 см. Анестезия наступает моментально (действие на gangl i on cervi cal e).Техника выполнения выскабливания матки.
Первый момент операции – влагалищное исследование для уточнения положения, формы и размера матки.Второй момент операции – иммобилизация матки, для чего передняя губа шейки матки захватывается пулевыми щипцами и низводится до области входа во влагалище, что способствует выпрямлению канала матки. При положении матки в anteflexio надо подтянуть влагалищную часть кзади, к крестцовой кости, при retroflexio uteri, наоборот, кпереди. При этом угол между шейкой и телом матки значительно уменьшается.
Третий момент операции – зондирование матки с целью измерения длины ее полости и определения направления для введения расширителей.
Четвертый момент операции – расширение цервикального канала, которое может производиться расширителями Гегара, а также ламинариями – специальными водорослями, способными к значительному набуханию. Возможно применение простагландинов и вибродилататора.
Способ расширения шейки матки, предложенный Гегаром, заключается в последовательном введении в цервикальный канал бужей постепенно утолщающегося калибра. Основной принцип этого метода заключается в том, что толщина последующего бужа отличается от предыдущего лишь на самую незначительную величину. Номер бужа обозначает диаметр его поперечного сечения в миллиметрах. Разница в диаметре бужей, от самых тонких до 16 номера, – всего 0,5 мм. Заменяя более тонкий буж последующим, лишь несколько более толстым, каждый буж вводится с малым усилием. Таким образом расширяется маточный канал очень бережно и постепенно за счет упругости его стенок. При несоблюдении указанной последовательности или при употреблении чрезмерно толстых бужей наблюдаются разрывы слизистой оболочки цервикального канала в области внутреннего зева, что в дальнейшем может проявиться патологией шейки матки – истмико–цервикальной недостаточностью или, наоборот, стриктурой канала. Расширения шейки матки до размера, соответствующего расширителю Гегара № 12, является достаточным для того, чтобы без затруднений удалить плодное яйцо. У первобеременных пациенток расширение шейки матки производить значительно труднее, чем у рожавших.
Пятый момент операции – разрушение и удаление плодного яйца. Плодное яйцо разрушаетсякюреткой и удаляется кюреткой и абортцангом. Кюретки различаются по номерам (от № 1 до № 6). В полость матки кюретка вводится свободно, без усилия, «мягкой рукой», так как беременную матку легко перфорировать. При наличии сопротивления не следует форсировать продвижение кюретки. Вводят кюретку до самого дна матки, что узнается по легкому сопротивлению. Затем движениями сверху вниз, от дна матки в направлении к наружному зеву, производится последовательное удаление частей плодного яйца. При движении кюретки можно прилагать определенную силу, но при очень сильном надавливании на нее можно удалить всю слизистую оболочку матки вместе с базальным слоем, что впоследствии явится причиной облитерации полости матки, внутриматочных синехий и вторичной аменореи. Удалив рыхлые массы с передней и задней стенок матки, берут кюретку меньших размеров ■ чтобы удалить остатки яйца из области трубных углов. Полностью опорожненная матка быстро сокращается, что хорошо ощущается кюреткой и является признаком прекращения манипуляции. Во время контрольного выскабливания опорожненной матки (выполняется кюреткой № ■ при соприкосновении кюретки со стенками матки слышится характерный «хруст», свидетельствующий о том, что матка опорожнена полностью.
Техника выполнения вакуум–аспирации.
Вакуум–аспирация (экскохлеация) имеет преимущества перед кюретажем как более щадящий метод прерывания беременности. Специальные насадки с боковыми отверстиями и размельчающими устройствами внутри, соединенные с электровакуумным насосом, вводят после расширения шейки матки в ее полость. Создают отрицательное давление 0,6–0,8 атм. Манипулируя насадкой, как кюреткой, плодное яйцо удаляют за 1–2 мин.Вакуум–экскохлеатор незаменим для удаления пузырного заноса.
Операцию искусственного прерывания беременности ранних сроков (задержка менструации не превышает 20 дней) производят методом вакуум–аспирации, так как в это время еще нет плотной связи плодного яйца со стенкой матки. Вакуум–аспирацию разрешается проводить как в гинекологических отделениях, так и в женских консультациях, для чего в данных учреждениях должна быть выделена малая операционная и комната отдыха с кушетками для кратковременного пребывания женщин после операции.
Операция вакуум–аспирации производится с соблюдением правил асептики и антисептики, без расширения цервикального канала, путем введения в полость матки пластмассовой канюли диаметром 4–6 мм, соединенной с аппаратом для прерывания беременности АПГ–02. Аспирация производится при отрицательном давлении до 0,8–1,0 атм.
Вопрос об обезболивании операции решается индивидуально. С целью релаксации цервикального канала, снятия эмоционального напряжения перед операцией может вводиться внутримышечно 2–5 мл раствора баралгина, 1 мл 0,5% раствора седуксена или другие спазмолитические и седативные препараты.
После прерывания 1–й беременности женщинам с резус–отрицательной принадлежностью крови необходимо проводить иммунизацию иммуноглобулином антирезус Rh (D) человека по соответствующей методике.
В последние годы для проведения аборта в ранние сроки беременности (до 42 дней аменореи) используется антагонист прогестерона – мифепристон (пенкрофтон).
Прерывание беременности в поздние сроки.
Прерывание беременности в поздние сроки (с 12 до 22 недель беременности) осуществляется по медицинским или социальным показаниям, оговоренным приказом Министерства здравоохранения Республики Беларусь и устанавливаемым в медицинских учреждениях специально созданной комиссией. Показаниями к прерыванию беременности поздних сроков являются: пороки развития плода, несовместимые с жизнью или не поддающиеся коррекции; хромосомные болезни или нехромосомные заболевания, сопровождающиеся умственной отсталостью ребенка; наследственные нарушения обмена веществ; смерть мужа во время беременности; лишение женщины права материнства; развод во время беременности; беременность после изнасилования; инвалидность имеющегося ребенка и др.Методы прерывания беременности поздних сроков: интраамниальное введение 10% раствора хлорида натрия, 20% раствора глюкозы или 30–60% раствора мочевины; экстра–, интраамниальное и интрацервикальное введение простагландинов Е2 и F2a; малое кесарево сечение.
Преимущество отдается первым двум способам. Малое кесарево сечение производится при необходимости стерилизации, неэффективности консервативных методов и в тех ситуациях, когда требуется быстрое и неотложное родоразрешение (при кровотечении, декомпенсации сердечной деятельности, отеке легких и других ситуациях, угрожающих жизни женщины).
Прерывать беременность по желанию женщины разрешено в сроки до 12 недель. С 12 до 22 недель прервать беременность можно только по медицинским показаниям.
Медицинскими противопоказаниями к искусственному прерыванию беременности являются: ■ острые и подострые воспалительные заболевания любой локализации ■ острые инфекционные заболевания.
Перед направлением на операцию прерывания беременности ранних сроков женщине производится бактериологическое исследование мазков из уретры, цервикального канала и влагалища, анализ крови на RW методом экспресс–диагностики, общий анализ крови, первобеременным определяется резус–принадлежность крови. Рекомендуется пройти консультирование в кабинете планирования семьи для решения вопроса о последующей контрацепции.
Осложнения и их профилактика, реабилитация. Операция выскабливания беременной матки является серьезным вмешательством, которое врачи вынуждены производить, руководствуясь в основном осязанием, без визуального контроля.
В ходе этой операции и после нее могут возникнуть серьезные осложнения: ■ повреждение матки и соседних органов ■ неполное удаление плодного яйца ■ инфекция ■ последующие нарушение менструальной функции и бесплодие.
Наиболее серьезным, да и частым, осложнением, которое возникает во время искусственного прерывания беременности, является перфорация матки. Аборт не должен рассматриваться как простая и легкая операция. Такой корифей отечественного акушерства, как М.С. Малиновский, говорил, что прободения матки могут встречаться в практике самых опытных врачей и при наилучшей обстановке. Причины перфорации: патологические изменения маточной стенки после многократных абортов или родов в анамнезе, перенесенных эндометритов; наличие миоматозных узлов, рубцов на матке после кесарева сечения и консервативной миомэктомии; погрешности в технике выполнения операции. Нельзя производить выскабливание матки при сроке беременности более 12 недель, так как размягченные, растянутые стенки матки легко травмируются. Перфорация матки чаще происходит в тех случаях, когда до производства искусственного аборта не было получено четкого представления о расположении матки. Причиной перфорации может быть резкий перегиб матки кпереди и особенно часто кзади, когда расширители вводятся не в том направлении, как расположен цервикальный канал; а также форсированное введение инструментов (зонд, расширитель, кюретка) в матку.
Дальнейшая тактика врача зависит от того, в какой момент операции произведена перфорация, каким инструментом, в какой области матки. Прободение матки может быть произведено зондом, расширителем, кюреткой, абортцангом. При наличии неожиданного глубокого проникновения инструмента следует заподозрить перфорацию матки и тотчас же прекратить операцию. При перфорации матки зондом или расширителем (т.е. инструментами, которыми трудно нанести значительную травму), если при этом не возникает кровотечения и состояние женщины (пульс, артериальное давление, боли) не внушает опасений, можно воздержаться от оперативного вмешательства при тщательном наблюдении за больной. Назначается антибактериальная терапия, препараты, сокращающие матку, прикладывание пузыря со льдом на живот. При ухудшении состояния показана срочная операция.
Если перфорация произведена кюреткой или абортцангом, а тем более установлено извлечение через шейку матки петли кишечника или сальника, то надо немедленно произвести чревосечение и ревизию органов брюшной полости. При небольшом дефекте матки операция может быть ограничена иссечением краев перфорационного отверстия и ушиванием его. При наличии крупных дефектов, травмировании сосудистых пучков, разможжении краев раны, а также если с момента нанесения травмы до операции прошло более 2 ч, приходится удалять матку. Во всех случаях обязательным является проведение тщательной ревизии органов малого таза.
Если больная поступила по поводу внебольничного аборта, то в случае установления диагноза перфорации матки (данные влагалищного исследования, зондирования, кровотечение) чревосечение является обязательным. Во время чревосечения вопрос об удалении или сохранении матки решается в зависимости от ее состояния.
Неполный аборт.
Сохранение при выскабливании элементов плодного яйца или отпадающей оболочки, изредка и ненарушенного плодного яйца, зависит или от недостаточного опыта врача, или от объективных причин: больших размеров матки, значительного расслабления стенок матки при операции и вынужденной необходимости контролировать факт завершения операции лишь при помощи осязания. Клиническая картина этого осложнения: упорные кровянистые выделения из матки, схваткообразные боли, в дальнейшем – повышение температуры тела. При внутреннем исследовании: наружный маточный зев открыт, из канала шейки матки имеются кровянистые выделения. Ультразвуковое исследование дает возможность поставить окончательный диагноз: полость матки расширена, заполнена неоднородным содержимым с эхопозитивными включениями. При задержке в полости матки частей плодного яйца показано производство повторного выскабливания. Операция допустима, если пальпация матки и области придатков, брюшины, клетчатки малого таза не причиняет боли и отсутствуют другие признаки инфекции. При наличии сопутствующего метэндометрита выскабливание производят после предварительной подготовки больной под прикрытием антибактериальной терапии.Возникновение септического заболевания после операции выскабливания может быть связано или с наличием инфекции до операции, или внесением ее во время операции. Первая причина должна быть устранена путем тщательного обследования больной, вторая – соблюдением принципов асептики во время и после операции.
Наиболее характерными инфекционными осложнениями после медицинского аборта являются эндометриты, сальпингиты и воспаления тазовой брюшины. Эндометриты обычно возникают вследствие сохранения в матке тканей плодного яйца. Остатки плодного яйца служат средой, в которой начинает бурно развиваться даже нормальная влагалищная флора, что приводит к необходимости их повторного хирургического удаления из матки. Клинические симптомы появляются, как правило, в течение 48 ч после аборта.
Воспалительные заболевания органов малого таза после абортов обусловлены почти исключительно восходящей инфекцией и микроорганизмами, распространяющимися половым путем (хламидии – в 2/3 случаев, гонококки и микоплазмы, а также условно–патогенными грамотрицательными бактериями и анаэробной флорой). Нередки случаи микст–инфекции, когда больная инфицирована двумя или всеми этими микроорганизмами.
Нарушение менструальной функции в форме аменореи может возникнуть после чрезмерного соскабливания слизистой оболочки или от инфекции с последующим заращением просвета канала шейки матки. Первое может быть предупреждено при правильной технике операции, второе – соблюдением строгой асептики. Наконец, аменорея после выскабливания может быть объяснена и расстройствами функции эндокринных желез, связанными с внезапным нарушением их деятельности. Возникновение вторичного бесплодия может быть обусловлено нарушениями как воспалительного, так и эндокринного порядка.
При относительной простоте техники исполнения прерывание беременности поздних сроков чревато такими осложнениями, как отек мозга, некроз тканей матки, сердечная недостаточность, отек легких, анурия, коматозные состояния, септический шок, и другими угрожающими жизни состояниями. Эта операция производится только по медицинским показаниям при наличии заключения ВКК в стационарных медицинских учреждениях, где есть возможность круглосуточного оказания гинекологической и реанимационной помощи. Перечень этих учреждений устанавливается приказами управлений здравоохранения.
Методы контрацепции
Проблеме планирования семьи, составной частью которой является контрацепция, в настоящее время во всех странах придается первостепенное значение. Во многих из них благодаря внедрению современных методов предупреждения беременности успешно решаются демографические, социальные и медицинские проблемы, связанные со снижением числа абортов, материнской и детской смертности.Многочисленными исследованиями доказано, что риск применения любых контрацептивов для здоровья женщины в 10 и более раз ниже вероятности осложнений во время беременности, родов и абортов. При этом контрацепция не только уменьшает число абортов, но и является профилактикой ряда заболеваний, в частности онкологических (рака яичников, эндометрия, шейки матки). Неоценима роль контрацепции и в профилактике заболеваний, передающихся половым путем, которых ежегодно в мире регистрируется около 250 млн случаев (ВОЗ, 1993).
Преимущества контрацепции перед абортом неоспоримы. Однако идеальных методов контрацепции не существует, каждый имеет свои «за» и «против», осложнения и противопоказания, которые необходимо учитывать при их назначении. Общепризнано, что оптимальными в настоящее время являются оральные контрацептивы (ОК) и внутриматочные спирали (ВМС). По данным ВОЗ, при достижении 40% уровня использования ВМС и ОК частота искусственных абортов уменьшается в два раза. Однако, являясь наиболее эффективными, они могут оказывать наиболее сильное, к сожалению, не всегда благоприятное, воздействие на организм.
Эффективность противозачаточного действия контрацептивных средств принято оценивать по индексу Перля, который был предложен Raymond Pearle в 1939 г. и показывает число нежелательных беременностей у 100 женщин, пользующихся данным методом в течение года. Другими словами, индекс Перля отражает процент неэффективности данного вида контрацепции.
Классификация
Методы контрацепции подразделяются следующим образом. ■ Методы традиционной контрацепции: • биологический – продолжительная лактация и периодическое воздержание • прерванное половое сношение (coitus interruptus) • барьерные методы: механические (кондом, влагалищный колпачок, губки) и химические (кремы, таблетки и др.). ■ Внутриматочные спирали. ■ Гормональная контрацепция.До 1960 г., различные мужские и женские барьерные методы, coitus interruptus, ритмический и лактационный методы были единственными способами контроля рождаемости. В 60–е гг. ХХ в. научные технологии произвели революцию в регуляции фертильности практически одновременным созданием ОК и началом промышленного производства, а затем и широкого использования ВМС. Методы вагинальной контрацепции стали менее привлекательными. Однако наряду со многими их достоинствами в настоящее время стали заметны определенные недостатки ОК и ВМС в виде возможных достаточно серьезных осложнений, неизбежности системного влияния на организм. Это обусловило возврат интереса к традиционным методам контрацепции, которые, не обладая высокой эффективностью современных средств, лишены повреждающего действия последних. Оптимальная для каждой супружеской пары контрацепция предусматривает сочетание методов, чередование их в различные возрастные периоды и в различных жизненных ситуациях.
Биологические (естественные) методы контрацепции.
В отличие от постоянной мужской фертильности способность женщины к оплодотворению носит циклический характер. Наступление беременности возможно в период овуляции, которая наблюдается на 14–й день цикла и в течение нескольких периовуляторных дней, учитывая продолжительность жизни яйцеклетки (не больше 48 ч) и оплодотворяющую способность сперматозоида (48–72 ч, в отдельных случаях, при оптимальных условиях – 5–7 дней). При 28–дневном цикле следует избегать половых сношений с 10 по 17–й день менструального цикла. Для повышения эффективности метода требуется определять время овуляции ежемесячно. Для этого существуют два способа – температурный и цервикальный. Температурный основан на определении времени овуляции по графику базальной температуры. Цервикальный метод основан на увеличении количества слизи в цервикальном канале и изменении ее характера под влиянием овуляторного пика эстрогенов.На протяжении менструального цикла происходят циклические изменения в половых органах. По мере созревания яйцеклеток и увеличения секреции эстрогенов возрастает количество шеечной слизи. Она становится более жидкой и в значительном количестве выделяется во влагалище в виде прозрачной слизи, по виду похожей на сырой яичный белок. В момент овуляции симптом «зрачка», кристаллизации и растяжимости шеечной слизи достигают максимальной величины. Увеличенная секреция шеечной слизи вызывает увеличение влажности вульвы. День, когда выделяется наибольшее количество слизи, определяет конец фертильной фазы, наступающей через 4 дня после пика выделения слизи. Используется формула Огино–Клауса, которая показывает начало и конец фертильного периода: от самого короткого дня цикла надо вычесть 18, от самого длинного – 11. Однако биологический метод приемлем только для женщин с правильным менструальным циклом. Чем регулярнее цикл, тем более надежен данный метод. Чем большим колебаниям подвержена продолжительность менструального цикла от месяца к месяцу, тем продолжительнее становится фертильный период и короче безопасный.
Наиболее известным, распространенным и надежным методом контрацепции считалась лактация. Недавно проведенные научные исследования показали, что у кормящих грудью матерей вероятность овуляции накануне первых месячных и в течение 30 недель после родов составляет только 2%. Такая вероятность, однако, увеличивается, если начать отлучение ребенка от груди. Наиболее надежным индикатором восстановления фертильности в период лактации является появление шеечной слизи, которая не выделяется во время послеродовой аменореи. Появление ее в большей степени, чем месячные, свидетельствует о восстановлении фертильности и является сигналом для начала контрацепции.
Таким образом, естественная контрацепция может обеспечивать эффективное предохранение от беременности без осложнений, которыми чреваты искусственные средства. Однако эффективность метода колеблется в широких пределах – индекс Перля – 6–39,5, и пользоваться данным методом могут 30–50% женщин с регулярным менструальным циклом. Кроме того, для успешного использования естественных контрацептивных методов супружеские пары нуждаются в обучении компетентными и опытными специалистами.
Достаточной популярностью у супружеских пар пользуется метод прерванного полового акта (coitus interruptus), так как он применим в любых условиях, не требует использования противозачаточных средств, планирования половых сношений, высокой мотивации поведения. Однако его эффективность весьма низка, и для некоторых мужчин, особенно молодых, он совершенно неприемлем. Вместе с тем его можно использовать в сочетании с другими методами. Эффективность контрацепции по индексу Перля для прерванного полового акта и ритмического метода составляет 15–20, т.е. процент возможного наступления непланируемой беременности весьма высок. Осложнения при предохранении методом прерванного полового сношения: застойные явления в органах малого таза, фригидность, дисфункция яичников; у мужчин – неврастения, импотенция, гипертрофия простаты.
Механические методы контрацепции.
Барьерные методы препятствуют попаданию жизнеспособного сперматозоида в цервикальный канал. Они подразделяются на механические, создающие препятствие для продвижения сперматозоидов (презерватив, колпачки, губки), и химические (спермицидные), разрушающие оболочку сперматозоидов и снижающие их подвижность (фарматекс, делорен и др.). Совместное применение механических и химических методов значительно повышает их эффективность. В настоящее время актуальность барьерных методов возросла в связи с широким распространением заболеваний, передающихся половым путем, в профилактике которых презерватив играет существенную роль. Доказано, что использование барьерных методов контрацепции уменьшает риск возникновения заболеваний, передающихся половым путем, более чем в 2 раза. Защищают от инфицирования не только механические, но и химические средства. В основном это происходит за счет повреждающего воздействия спермицидов на возбудителей гонореи, генитального герпеса и трихомониаза.Презерватив (кондом) является старейшим методом мужской контрацепции, переживающим сейчас второе рождение. Это идеальное средство с точки зрения профилактики заболеваний, передающихся половым путем. Но по эффективности контрацепции он уступает современным методам. Выпускаются презервативы различных видов и расцветок, но, как правило, они имеют вид цилиндра длиной 15–20 см, диаметром 3–3,5 см и толщиной 0,03–0,07 мм. Основными недостатками метода являются достаточно частые разрывы презервативов и определенные неудобства их применения (использование непосредственно во время полового акта, снижение сексуального ощущения у партнеров). В случае разрыва кондома следует немедленно применить другой метод контрацепции. В некоторых случаях при использовании кондома возникает раздражение половых органов.
Влагалищную диафрагму (женский презерватив) применяют с целью контрацепции изолированно или в сочетании со спермицидами. Впервые диафрагмы были выпущены в 1840 г. в Германии, затем в Западной Европе, с начала ХХ в. – в США. Диафрагма представляет собой металлическое кольцо с резиновым колпачком, имеющим форму полушария. Они бывают разных размеров: от 50 до 105 мм. Наружный диаметр кольца является размером диафрагмы. Наиболее часто применяются диафрагмы 70–80 мм. Диафрагму вводят таким образом, чтобы закрыть шейку матки и создать механическое препятствие для прохождения сперматозоидов. Диафрагма располагается во влагалище диагонально, фиксируясь в заднем своде и в области лонного сочленения. Врач должен подобрать размер диафрагмы и обучить женщину правилам пользования. Сложенная в виде сигары, диафрагма вводится самой женщиной, сидя на корточках, по задней стенке влагалища до соприкосновения с задним сводом. После фиксации в области заднего свода передняя часть кольца фиксируется в области симфиза. Кольцо диафрагмы должно плотно соприкасаться со стенками влагалища и диафрагма не должна смещаться. Края и внутреннюю поверхность ее желательно смазать спермицидами. Диафрагма вводится за 1–2 ч до полового сношения и остается во влагалище в течение 8–12 ч. Индекс Перля – 12–20, он возрастает при использовании нетрадиционных сексуальных поз. К достоинствам метода относятся его простота, безвредность и возможность повторного использования.
Противопоказания: эндоцервицит, псевдоэрозия шейки матки, аллергия к резине или спермицидам, кольпиты, старые разрывы шейки матки, опущение стенок влагалища и матки.
Контрацептивные губки (collatex, влагалищные спирали) являются новым методом барьерной контрацепции. В настоящее время находятся на стадии экспериментального использования.
Химические противозачаточные средства.
Первые спермицидные суппозитории были выпущены в Англии в 1885 г. Основным требованием к спермицидам является способность разрушать сперматозоиды не более чем за 1–2 мин и при этом не оказывать раздражающего действия на слизистую влагалища. Спермициды выпускаются в виде кремов, желе и паст в тубах, влагалищных шариков, пенящихся таблеток и растворимых влагалищных пленок. Они могут использоваться сами по себе, но применение вместе с механическими средствами повышает их эффективность. Химические средства вводятся глубоко в область заднего свода влагалища за 5–15 мин до полового сношения, в положении лежа. Кремы, желе и пасты вводят специальным шприцем. После введения контрацептива вставать и ходить не рекомендуется, так как при этом таблетка может сместиться из области заднего свода и результативность средства уменьшится. Если половой акт осуществляется в нетрадиционной позе, спермицид также может вытекать и тем самым увеличивать риск нежелательной беременности. Клиническая эффективность по индексу Перля – 30. Отечественной промышленностью выпускается грамицидиновая паста, которая кроме контрацептивного обладает терапевтическим действием и может применяться для лечения кольпитов, эндоцервицитов, эрозий шейки матки.Влагалищные спринцевания непосредственно после полового сношения, которые применяются как традиционный метод, мало эффективны, так как уже через 90 с после эякуляции сперматозоиды обнаруживаются глубоко в цервикальном канале. Для влагалищных спринцеваний могут применяться растворы: молочной кислоты – 2 чайные ложки на 1 л воды; столового уксуса – 2 столовые ложки на 1 л воды; галаскорбина – 1 г на стакан воды; перманганата калия – в разведении 1: 1000.
Внутриматочная контрацепция.
Внутриматочная спираль (ВМС) является наиболее известным методом предохранения от беременности в странах СНГ. Впервые внутриматочное средство, предназначенное для контрацепции, было предложено в 1909 г., однако массовое использование ВМС началось только в 60–е гг. ХХ в. Метод отвечает таким требованиям, предъявляемым к контрацепции, как удобство и простота в применении, высокая надежность (индекс Перля 0,6–2,0) и экономичность. Первое внутриматочное средство представляло собой кольцо из шелковых нитей, которое в последующем было заменено проволокой из различных химически нейтральных металлов (сплав меди, никеля и цинка, золото, серебро и др.). ВМС так называемого 2–го поколения (после 1960 г) изготавливаются полностью из инертных пластиковых средств. В 70–е гг. XX в. в контрацептив введена медь в виде медной оплетки, что повысило эффективность и снизило частоту осложнений ВМС. В настоящее время использование инертных контрацептивов не рекомендуется из–за более высокой частоты осложнений по сравнению с медьсодержащими и прогестеронсодержащими средствами. Наиболее распространенной формой контрацептивов к настоящему времени являются различные модификации буквы «Т». Механизм действия ВМС, по мнению большинства авторов, заключается в изменении кинематики маточных труб, приводящей к нарушению транспорта яйцеклетки. Кроме того, ВМС вызывает структурную трансформацию эндометрия, нарушает выброс ЛГ и ФСГ и влияет на состав цервикальной слизи. Полагают, что медьсодержащие ВМС предупреждают оплодотворение, уменьшая как количество сперматозоидов, способных достигнуть матки, так и их активность, а также задерживая прохождение яйцеклеток в полость матки. Противопоказаниями к введению ВМС являются: наличие предполагаемой беременности; наличие злокачественных опухолей половых органов или подозрение на их наличие; острые, подострые и хронические с частыми обострениями воспалительные заболевания органов малого таза, в том числе шейки матки и влагалища; истмико–цервикальная недостаточность; предшествующая эктопическая беременность (риск ее увеличивается в 9 раз); кровотечения, анемия; полипоз цервикального канал, лейкоплакия или псевдоэрозия; полипоз, гиперплазия эндометрия; туберкулез гениталий; нарушения свертывающей системы крови; инфекционно–септические заболевания и лихорадящие состояния любой этиологии; наличие в анамнезе аллергических реакций на медь. Следует учитывать, что на фоне ВМС активизируются все дремлющие очаги инфекции в организме, что приводит к более частым обострениям, развитию активного очага инфекции в половых органах, и в первую очередь в маточных трубах. Относительным противопоказанием применения ВМС является наличие нескольких сексуальных партнеров (так как это повышает риск инфицирования); болезнь Вильсона; период лечения иммунодепрессантами; патология тела и шейки матки (миома, эндометриоз, пороки развития, деформация шейки матки, стеноз цервикального канала).Обязательным условием проведения внутриматочной контрацепции является бактериоскопическое исследование отделяемого из цервикального канала и уретры, общий анализ крови и мочи.
Ранее считалось, что оптимальным сроком для введения ВМС являются последние дни менструального кровотечения.
В настоящее время доказано, что наименьший процент осложнений и экспульсий наблюдается при введении с 4–го по 19–й день менструального цикла. ВМС можно вводить непосредственно после неосложненного аборта и через 2 месяца после родов. В ряде ситуаций оправдано введение ВМС на 5–6–е сутки после нормальных родов.
Техника введения. После предварительного влагалищного исследования в асептических условиях шейка матки обнажается в зеркалах, тщательно обрабатывается раствором эффективного антисептика и фиксируется за переднюю губу пулевыми щипцами. Измеряется длина полости матки с помощью зонда. При введении современных медьсодержащих ВМС (большинство из них имеет Т–образную форму) плечики контрацептива заправляются в проводник, который затем вводится в матку до дна, после чего проводник осторожно извлекается при статичном положении поршня, что ведет к освобождению плечиков. Некоторые типы ВМС вводятся без поршня с помощью одного проводника, при этом плечики ВМС свободно выступают за его края. Контрольные нити обрезаются на длину 1,5–2 см. Более короткие могут доставлять неудобство половому партнеру, более длинные подвержены самопроизвольной экспульсии. Согласно данным И.А. Мануиловой, трудности при введении ВМС отмечаются у 10,5% женщин, а в 8,8% случаев их установка невозможна.
При введении любого внутриматочного средства должна быть использована «бесконтактная» технология установки ВМС: подготовка ВМС к введению (заправка якоря контрацептива во вводную трубку) осуществляется внутри упаковки, после вскрытия последней со стороны трансцервикальных нитей. Недопустимо прикосновение маточного зонда и вводной трубки контрацептива к стенкам влагалища и зеркалам.
Для предотвращения болезненности при введении ВМС, особенно у нерожавших женщин, оправдано проведение парацервикальной анестезии 1% раствором лидокаина. Анестетик вводится парацервикально по 1–2 мл в две точки, соответствующие 4 и 8 ч. Обезболивание наступает через 2–5 мин. Крайне редко возникает необходимость инструментального расширения цервикального канала для введения внутриматочного противозачаточного средства.
В день введения и два последующих дня целесообразен прием антибиотиков широкого спектра действия (доксициклин по 0,1 г 2 раза в день), а также ингибиторов простагландиногенеза (индометацин, ибупрофен) по 1 таблетке 2 раза в день. Ингибиторы простагландинов рекомендуется применять и в первые 3 дня трех последующих менструальных циклов.
При истечении времени эксплуатации ВМС и отсутствии осложнений новое ВМС может быть введено сразу же после удаления предшествующего, перерыв на «отдых» в данном случае нецелесообразен.
В течение недели после введения ВМС половая жизнь запрещена. Врач должен осмотреть женщину через неделю после установки контрацептива, после 1–й менструации, через 3 месяца, в дальнейшем – ежегодно с проведением кольпоскопии и цитологического исследования.
Если на фоне ВМС наступила беременность, то ее при желании женщины можно сохранить, так как повреждающего воздействия ВМС на плод не выявлено. Однако частота угрожающих выкидышей повышается.
На мировом рынке представлено большое количество ВМС различных модификаций. В Республике Беларусь выпускаются следующие внутриматочные контрацептивы, имеющие международные сертификаты качества: «Юнона Био–Т 380» – основная базовая модель; «Юнона Био–Т 380 Ag» – с серебряным сердечником; «Юнона Био–Т 380 Super» – с прополисным покрытием, обладающим бактерицидным действием; «Юнона Био–Т» № 1 – кольцеобразный контрацептив для нерожавших женщин; «Юнона Био–Т» № 2 – кольцеобразный контрацептив для женщин, страдающих ИЦН.
Гормональная контрацепция.
В конце XIX в. было обнаружено, что фолликулы яичников не развиваются в ходе беременности. В 1921 г. физиолог Л. Хаберлант впервые осуществил торможение овуляции в эксперименте, предложил термин «гормональная стерилизация» и выдвинул идею о том, что экстракты из яичника могут использоваться в качестве контрацептивов. В 1929 г. из экстрактов тканей животных и мочи беременных женщин были выделены первые эстрогены, а в 1934 г. – первые гестагены. «Отцом контрацептивной таблетки» называют американского биолога Грегори Пинкуса, который в 50–х гг. XX в. предложил идею об использовании комбинации эстрогенов и гестагенов в одной таблетке. Первая такая таблетка появилась в 1960 г. С тех пор в ряде стран мира постоянно ведутся работы по усовершенствованию этих препаратов, благодаря чему содержание гормонов в каждой таблетке уменьшено в 50–100 раз по сравнению с первоначальным количеством. Несмотря на такое низкое содержание гормонов, контрацептивное действие препаратов сохранилось, а их побочные действия и потенциальный риск сократились до минимума.Высокая популярность гормональной контрацепции в большинстве экономически развитых стран связана с высокой ее эффективностью (индекс Перля 0,04–1,0), удобством применения и при правильном подборе почти полным отсутствием побочных эффектов и осложнений. Оральные контрацептивы относятся к числу уникальных лекарственных средств, которые назначаются не больным для коррекции нарушенных гормональных взаимоотношений, а здоровым людям. Ни одно из лекарств так многосторонне не обсуждалось, как ОК. Следует отметить несомненный триумф науки в этом направлении, который позволил путем значительного снижения суточной дозы гормональных составляющих, оптимального их соотношения и введения в препараты новых гестагенных производных минимализировать проявления побочных эффектов и осложнений. Естественно, все вышесказанное имеет место при учете существующих противопоказаний. В рекомендациях ВОЗ утверждается, что распространенность гормональной контрацепции благоприятно отражается на здоровье населения в целом и является столь же важным достижением медицины, как вакцинация и создание антибиотиков. В мире ОК пользуются от 80 до 100 млн женщин, в ряде стран Северной Европы – до 60% женщин репродуктивного возраста. В Беларуси это составляет 5%. Во многом это объясняется отсутствием отечественных производителей, малым опытом работы с этими препаратами у врачей и пациентов и высокой стоимостью их. Однако ОК являются средствами реального снижения количества абортов и гинекологической заболеваемости.
Гормональные контрацептивы можно условно разделить на две группы.
■ Комбинированные эстроген–гестагенные препараты, объединяемые в русскоязычной литературе общим названием «комбинированные оральные контрацептивы» (КОК). Выпускаются в таблетированной форме: • монофазные (ригевидон, марвелон, фемоден), которые содержат постоянную дозу эстрогенов и гестагенов в каждой таблетке • двухфазные (антеовин), где имеются таблетки условно 1–й фазы менструального цикла с преобладанием эстрогенного, и 2–й фазы – с преобладанием гестагенного компонента (в настоящее время не применяются) • трехфазные препараты (тризистон, триквилар, трирегол, милване, три–мерси) содержат те же компоненты, но в трехступенчато нарастающей дозе, соответствующей фазам менструального цикла. Они считаются наиболее физиологичными, практически не влияющими на углеводный и жировой обмен • чрескожные гормональные системы, основанные на хорошей адсорбирующей способности кожи (егга) • вагинальные гормональные контрацептивы представляют собой тонкое эластичное кольцо из низкоаллергенных материалов, выделяющее при температуре тела этинилэстрадиол (0,15 мг) и гестагенный препарат этоногестрел. Важным преимуществом новаринга является непрерывность и равномерность выделения гормонов в течение суток (что позволяет уменьшить среднесуточную дозу гормонов), а также отсутствие эффекта первичного прохождения гормонов через печень. Кольцо вводится во влагалище на один менструальный цикл (21 день), затем после 7–дневного перерыва заменяется новым. Во время полового акта и гинекологического осмотра оно остается во влагалище.
■ Чистые гестагенные препараты выпускаются в таблетированной, инъекционной, имплантируемой форме: • пилюли «мини–пили» (микролют, эксклютон) применяются в непрерывном режиме. Вследствие отсутствия эстрогенного компонента они не влияют на углеводный и жировой обмен и АД. В сравнении с КОК у них меньшая эффективность (индекс Перля 2,0–3,0) и частые побочные действия в виде метроррагий • инъекционные препараты (депо–провера) назначаются в случаях, когда женщина не может регулярно принимать таблетки. Положительным моментом является удобство применения и оказываемый при ряде заболеваний лечебный эффект, отрицательным – частые нарушения менструального цикла (70%). После трех–четырех инъекций ациклические метроррагии сохраняются у 25–30% женщин, у половины пациенток восстанавливается регулярный менструальный цикл, у 25% – развивается аменорея. Индекс Перля равен 0,3. В первые два месяца приема для предотвращения увеличения массы тела рекомендуется придерживаться рациональной диеты с ограничением жиров • имплантируемые гормональные контрацептивы (норплант) отличаются от инъекционных только путем введения.
Механизм действия гормональных методов основывается на блокаде овуляции посредством торможения секреции люлиберина гипоталамусом; развитии «железистой регрессии» эндометрия и изменении химико–физических свойств цервикальной слизи, заключающейся в уменьшении проницаемости последней для сперматозоидов и микробных тел. С последним во многом связано противовоспалительное действие гормонов.
При этом эстроген–гестагенные препараты в первую очередь вызывают подавление овуляции, а чистые гестагены воздействуют на слизистую матки и в первую очередь цервикального канала.
КОК различают по количеству активного вещества: имеются таблетки с высоким и низким содержанием гормонов. Таблетки с высокими дозами гормонов (0,05 мг этинилэстрадиола) в настоящее время не применяются. К низкодозным относятся препараты, в которых содержание ЕЕ не превышает 0,03 мг (ригевидон, трирегол, триквилар, фемоден, марвелон, милване и др.). Данные о составе ОК представлены в табл. 7.1.
Таблица 7.1. Комбинированные оральные контрацептивы (эстроген–гестагенные препараты)
| Наименование препарата | Этинилэстрадиол, мг | Гестаген | ||
|---|---|---|---|---|
| Латинское | Русское | Наименование | Доза, мг | |
| Монофазные препараты | ||||
| Diane 35 | Диане–35 | 0,035 | Ципротерон ацетат | 2 |
| Marvelon | Марвелон | 0,03 | Дезогестрел | 0,15 |
| Regulon | Регулон | |||
| Microgynon–28 | Микрогинон–28 | 0,03 | Левоноргестрел | 0,15 |
| Regevidon | Ригевидон | |||
| Femoden | Фемоден | 0,03 | Гестоден | 0,075 |
| Silest | Силест | 0,035 | Норгестимат | 0,25 |
| Logest | Логест | 0,02 | Гестоден | 0,075 |
| Lindynette | Линдинет | |||
| Novynette | Новинет | 0,02 | Дезогестрел | 0,15 |
| Jeanine | Жанин | 0,03 | Диеногест | 2 |
| Yarina | Ярина | 0,03 | Дроспиренон | 3 |
| Jaz | Джес | 0,02 | Дроспиренон | 3 |
| Трехфазные препараты | ||||
| Triquilar | Триквилар | 0,03 | Левоноргестрел | 0,05 |
| Triregol | Трирегол | 0,04 | 0,075 | |
| 0,03 | 0,125 | |||
| Milvane | Милване | 0,03 | Гестоден | 0,05 |
| 0,04 | 0,07 | |||
| 0,03 | 0,1 | |||
| Trimersi | Тримерси | 0,035 | Дезогестрел | 0,05 |
| 0,03 | 0,1 | |||
| 0,03 | 0,15 | |||
Гормональные препараты обладают лечебным эффектом. Так, прием ОК в течение 1–2 лет снижает риск развития рака яичников и эндометрия в два раза (В.П. Сметник, 1997), воспалительных заболеваний гениталий (исключая хламидиаз) – на 50%. Имеются данные о защитном эффекте ОК в возникновении фиброзно–кистозных мастопатий и миомы матки. Особые показания для назначения ОК включают также: эндометриоз, альгодисменорею, овуляторные боли, гиперполименорею, рецидивирующие воспалительные заболевания половой сферы, фиброзно–кистозную мастопатию (при исключении фиброаденомы молочных желез), дисфункциональные маточные кровотечения, железодефицитную анемию, предменструальный синдром, акне.
Различают абсолютные и относительные противопоказания для назначения гормональных противозачаточных средств.
При абсолютных противопоказаниях принимать ОК нельзя никогда, при относительных – применение гормональных противозачаточных препаратов требует особого внимания (могут применяться только низкодозные препараты и короткими курсами).
Абсолютные противопоказания к применению ОК: ■ беременность ■ тяжелые заболевания сердечно–сосудистой системы и сосудов головного мозга (ишемическая болезнь сердца, инфаркт миокарда в анамнезе, церебральная ишемия) ■ тромбофлебиты и тромбоэмболические процессы в настоящее время или в анамнезе ■ тяжелая форма гипертонии ■ тяжелые заболевания печени в настоящее время или в анамнезе, если функциональные показатели печени не вернулись к норме. Острые заболевания печени. Холестатическая желтуха, желтуха во время беременности или желтуха, вызванная приемом стероидных средств. Синдром Ротора, синдром Дубина – Джонсона ■ гормонально зависимые опухоли или подозрение на их наличие ■ вагинальные кровотечения неясной этиологии ■ порфирия ■ выраженная гиперлипопротеинемия ■ сахарный диабет при наличии ретинопатий.
Относительные противопоказания к приему ОК: ■ варикозное расширение вен ■ сахарный диабет ■ психические заболевания, сопровождающиеся депрессией, эпилепсия ■ миома матки ■ язвенный колит ■ сильные головные боли ■ артериальная гипертензия ■ болезни желчного пузыря ■ возраст старше 35 лет у курящих женщин (более 15 сигарет в день) ■ плановое хирургическое вмешательство не позднее 4 недель до него ■ острый мононуклеоз ■ возраст старше 40 лет ■ хронический пиелонефрит.
Следует помнить, что ОК не применяют при наличии заболеваний, возникших в период беременности или осложнивших течение предыдущей беременности (герпес беременных, предэклампсия и эклампсия, гемолитикоуремический синдром, хорея и отосклероз).
Перед назначением ОК врач общей практики должен обязательно убедиться в отсутствии: желтушности кожи и слизистых; уплотнений в молочных железах; патологии сосков; варикозного расширения вен на ногах; гипертензии (АД выше 160 мм. рт. ст.); тахикардии (выше120 уд/мин).
Показания к прекращению гормональной контрацепции: ■ беременность ■ выраженная мигрень ■ внезапные острые нарушения зрения ■ острые тромбоэмболические осложнения ■ желтуха, острые заболевания печени и желчных путей ■ повышение артериального давления ■ длительная иммобилизация ■ планируемые большие хирургические вмешательства ■ выраженная прибавка массы тела ■ изменение тембра голоса ■ рост миомы матки.
Многочисленные многоцентровые рандомизированные исследования, проведенные под эгидой ВОЗ в разных странах, позволили прийти к следующим выводам: прием препаратов не влияет на общую смертность; у здоровых женщин моложе 40 лет достоинства данных препаратов превосходят их недостатки. Эксперты ВОЗ подчеркивают, что беременность, продолжительный постельный режим и недавнее оперативное вмешательство более опасны в плане тромбоэмболий, чем оральные контрацептивы.
Побочные эффекты гормональных контрацептивов: в начале применения препаратов могут развиться головные боли, тошнота, нагрубание молочных желез, повышение аппетита, которое приводит к увеличению массы тела. В некоторых случаях отмечают кожные изменения (сыпь). Все эти побочные действия исчезают после прекращения приема препаратов.
Наименьшее количество побочных эффектов и осложнений дают трехфазные препараты и контрацептивы, содержащие гестагены 3–го поколения – гестоден, дезогестрел, норгестимат, так как они не влияют на углеводный и жировой обмен, а, следовательно, дают меньше побочных эффектов, чем препараты, содержащие левоноргестрел (2–е поколение). Однако в результате многоцентрового исследования, организованного ВОЗ, получены неожиданные данные, что препараты с новейшими прогестагенами дезогестрелом и гестоденом (фемоден, милване, марвелон) вызывают тромбообразование чаще, чем ОК с левоноргестрелом и норэтиндроном (ригевидон, трирегол, мини–зистон). Снижение эффективности ОК и увеличение риска наступления беременности отмечается в ситуациях: рвота, диарея, прием антибиотиков и других лекарств (барбитураты и др.), пропуск приема одной таблетки в месяц. Прием больших доз рифампицина, ампициллина, тетрациклина нейтрализует контрацептивный эффект ОК. В этом цикле приема следует добавить другой метод контрацепции (кондом, периодическое воздержание и др.).
Доказано, что длительный прием ОК не оказывает неблагоприятного влияния на течение последующей беременности и состояние плода, однако планировать наступление беременности рекомендуется через 2–3 месяца после прекращения приема таблеток. Если беременность наступила на фоне приема ОК, ее лучше прервать. Но, так как вредного воздействия на плод не доказано (И.А. Мануилова,1993), то в случаях настойчивого желания женщины (возраст старше 30 лет, бесплодие) беременность можно сохранить.
Мини–пили (континуин, фемулен) содержат чистые гестагены. Принимаются по 1 таблетке в день непрерывно на протяжении 6–12 месяцев, начиная с 1–го дня менструального цикла. Механизм действия мини–пили: уменьшают количество цервикальной слизи в середине цикла и повышают ее вязкость, уменьшая тем самым проницаемость для сперматозоидов. Этот эффект появляется через 2 ч и прекращается через 20– 22 ч после приема таблетки. В 40% вызывают ановуляцию, в остальных случаях – недостаточность лютеиновой фазы; в эндометрии мини–пили вызывают биохимические изменения, неблагоприятные для имплантации.
Контрацептивная эффективность несколько ниже, чем у ОК. Индекс Перля составляет 1,5–2. Преимуществами в сравнении с ОК является то, что мини–пили не вызывают метаболических изменений и артериальной гипертензии, практически не нарушают гемокоагуляцию.
Показания для применения мини–пили: лактация; возраст старше 40 лет; сопутствующие сердечно–сосудистые заболевания; курение у женщин старше 35 лет; мигрень и головные боли, возникшие при приеме комбинированных препаратов. Побочным действием являются межменструальные кровотечения, которые имеют место у 12–14% женщин. Противопоказаниями к их использованию являются острые и хронические заболевания печени, в том числе желтуха, перенесенная во время беременности.
Инъекционные и имплантируемые контрацептивы
Целесообразно рассматривать вместе, так как и те и другие содержат гестагены пролонгированного действия и отличаются только формой введения. Инъекционный контрацептив депо–провера выпускается во флаконах по 150 мл масляного раствора медроксипрогестерона ацетата, вводится 1 раз в 3 месяца в 1–5–й дни менструального цикла внутримышечно. Имплантируемые контрацептивы содержат депо–форму гестагена, заключенного в биодеградирующие силиконовые капсулы. В качестве гестагена в препарате норплант содержится 36 мг левоноргестрела, в препарате импланон – 3–кетодезогестрел. При помощи минимального разреза кожи 5–6 капсул имплантируются под кожу предплечья и обеспечивают контрацепцию в течение 4–7 лет. Введение осуществляется под местной анестезией. Время введения – в первые дни после менструации, после аборта, первые 6 недель после родов.Механизм действия: снижают проницаемость цервикальной слизи, частично подавляют овуляцию, вызывают частичную атрофию эндометрия.
Эффективность приближается к 100%, почти равна стерилизации, индекс Перля – 0,2–4. Методы безопасны, подходят для женщин всех возрастов, просты в использовании, уменьшают менструальную кровопотерю, обладают хорошей обратимостью, свободны от эстрогенных побочных эффектов.
Недостатки: при их использовании часты нарушения менструального цикла в виде кровомазания и нерегулярных кровотечений. В 1–й год применения кровотечения имеют место у 60% женщин, к 5–му году – у 45%. Из других побочных эффектов возможны головная боль, депрессия и нервозность, снижение либидо, изменение массы тела, головокружения, чувство напряжения в груди, изредка тошнота и появление акне.
Неудобства имплантатов: необходимость небольшого разреза для введения; удаление зачастую представляет значительные трудности; имеется незначительный риск воспаления в месте разреза.
Преимущества имплантатов: уменьшают риск карциномы матки и яичников, кистом яичников, уменьшают анемию, частоту возникновения сальпингитов, дисменорею.
Противопоказания: абсолютные – кровотечения из половых путей неясной этиологии, заболевания печени (в течение 6 месяцев), злокачественные новообразования молочных желез и половых органов, беременность; относительные – тромбоэмболия, тромбофлебит в анамнезе, гипертензия.
Диспансерное наблюдение осуществляется через 1 неделю после имплантации, через 3 месяца, затем каждые 6–2 месяцев
Внутриматочная рилизинг–система «Мирена» выделяет в полости матки прогестагенный препарат левоноргестрел, совмещая в себе, таким образом, два метода контрацепции – гормональный и внутриматочный со всеми их достоинствами и недостатками. Особо показана женщинам, страдающим маточными кровотечениями. Вводится на 5 лет.
В настоящее время признано неправильным использование прерывистых курсов, когда гормональные контрацептивы назначаются в течение 3,6 или 12 месяцев, а затем 2–3 месяца женщина «отдыхает». Доказано, что во время такого «отдыха» из–за характерного для гормональных препаратов синдрома отмены (rebaund–effect) каждая 3–4–я женщина получает нежеланную беременность, что делает бессмысленным весь предшествующий прием препарата. Заключение международной медицинской консультативной группы экспертов ВОЗ о гормональных оральных контрацептивах гласит: «Практически здоровые женщины могут принимать ОК многие годы. Нет необходимости для периодических перерывов в приеме ОК. Для женщин старше 40 лет таблетки должны назначаться с соблюдением мер предосторожности» (табл. 7.2).
Таблица 7.2. Гестагенные противозачаточные препараты
| Название препарата | Состав | Доза, мг |
|---|---|---|
| «Мини–пили» | ||
| Exluton | Линэстренол | 0,5 |
| Microlut | Левоноргестрел | 0,03 |
| Charozetta | Дезогестрел | 0,075 |
| Посткоитальные | ||
| Postonor | Левоноргестрел | 0,75 |
| Escapelle | Левоноргестрел | 1,5 |
| Инъекционные | ||
| Depo–Provera | Медроксипрогестерона ацетат | 150 |
| Имплантируемые | ||
| Norplant | Левоноргестрел | 36 |
Хирургическая стерилизация
Широко распространена в мире. Так, в США ее предпочитают более 30% супружеских пар. Осуществляется у женщин лапароскопическим доступом методом электрокоагуляции или механической окклюзии маточных труб, у мужчин вазэктомии. Существуют методы хирургической стерилизации женщин, выполняемые абдоминальным и вагинальным доступом. К недостаткам метода относится его необратимость. Поэтому он рекомендован для супружеских пар, закончивших деторождение. Однако в исключительных случаях в настоящее время возможно в дальнейшем восстановление проходимости маточных труб путем операции с использованием микрохирургической техники. Легче восстановить фертильность после механической окклюзии маточных труб специальными клипсами. Преимущества метода: 100% эффективность, минимальное количество побочных эффектов и осложнений, высокая экономичность и удобство. Он заслуживает более широкого распространения на территории нашей республики.Методы экстренной контрацепции (посткоитальные).
К экстренной (посткоитальной) контрацепции относятся методы, которые могут быть применены женщинами в первые несколько дней после незащищенного полового акта для предотвращения нежелательной беременности. ■ Постинор (0,75 мг левоноргестрела) применяется в течение 72 ч (лучше сразу) после незащищенного полового акта, еще 1 таблетку следует принять через 12 ч после первой. Эскапел принимается в течение 96 ч однократно ■ Ригевидон, марвелон: принимаются 4 таблетки в течение первых 72 ч, затем еще 4 таблетки через 12 ч. Из–за высоких доз гормонов при посткоитальной контрацепции у 75% женщин возникают побочные эффекты: тошнота, рвота, абдоминальные боли, маточные кровотечения. Механизм действия посткоитальной контрацепции: влияет на разрыв фолликулов, предупреждают зачатие и/или имплантацию оплодотворенной яйцеклетки; высокие дозы гестагенов блокируют развитие оплодотворенной яйцеклетки на ранней стадии. ■ Медьсодержащие ВМС с целью посткоитальной контрацепции вводятся в течение 7 дней после незащищенного coitus. ■ Антипрогестерон мифепристон – в дозе 600 мг принимается на 27–й день цикла однократно или по 200 мг с 23–го по 27–й день цикла. Эффективность достигает 98%.Следует помнить, что посткоитальная контрацепция является чрезвычайной мерой и не должна применяться вместо других методов контрацепции. Контрацептивные таблетки для экстренных случаев не пригодны для регулярной контрацепции.
Опыт применения гормональной контрацепции показывает, что правильный выбор препарата с учетом противопоказаний и гормональных особенностей организма женщины, а также ознакомление ее с ранними симптомами, предшествующими появлению осложнений, может свести риск их появлений до минимума. Статистика зарубежных стран показывает, что риск наступления нежеланной беременности после стерилизации составляет в настоящее время 0,4%, после применения ВМК – 4,2%, при использовании гормональных препаратов – 2,1%, при применении презервативов – 9,8%, при введении диафрагмы со спермицидными пастами – 16,3%, при воздержании от половых сношений в определенные дни цикла – 24%, при прерванном половом сношении – 23%, при половой жизни без предохранения от беременности – 90,0%.
Эти цифры зримо доказывают основной девиз контрацепции – лучше пользоваться любым средством, чем не пользоваться никаким.
Таким образом, существующий арсенал современных противозачаточных средств позволяет супружеской паре и врачу выбрать тот метод, который обеспечивает наиболее выраженный контрацептивный эффект при минимальном количестве побочных реакций и вредных воздействий на организм. Следует помнить, что идеальных методов предохранения от беременности не существует и в течение 20–25 лет, когда современная женщина нуждается в контрацепции, нужно комбинировать различные варианты и сочетания методов. Значительную роль играют национальные традиции и индивидуальные предпочтения женщины, но в любом случае надо исходить из того, что лучше использовать самый ненадежный метод контрацепции, чем не использовать ничего.
Глава 8. Доброкачественные и пограничные заболевания женских половых органов
Предопухолевые и опухолевидные заболевания вульвы и влагалища
Основными предопухолевыми заболеваниями вульвы являются крауроз и лейкоплакия (гиперкератозы), которые характеризуются различной морфологической картиной и часто сочетаются друг с другом.Лейкоплакия вульвы
Встречается чаще в климактерическом возрасте или в менопаузе. Возникновение этой патологии связывают с нейроэндокринными нарушениями.При лейкоплакии отмечается пролиферация многослойного плоского эпителия, нарушение его созревания и дифференцировки. Наблюдаются явления повышенного ороговения (гиперкератоз и паракератоз) с последующим развитием склеротического процесса и сморщивания тканей.
Заболевание характеризуется появлением на коже наружных половых органов сухих бляшек белесоватого или желтого цвета различной величины, которые могут располагаться на ограниченных участках либо распространяться на всю вульву.
Основной клинический симптом лейкоплакии – упорный кожный зуд в области наружных половых органов, в результате чего на коже вульвы появляются расчесы, ссадины и небольшие ранки.
Лечение
Назначают мази, содержащие эстрогенные препараты. При резко выраженных изменениях и сильном зуде возможно применение небольших доз эстрогенов внутрь или парентерально. Большое значение имеет соблюдение диеты (легкая растительная пища, уменьшение потребления поваренной соли и пряностей). Успокаивающее действие оказывают теплые сидячие ванны перед сном и седативные препараты.Крауроз вульвы
Также наблюдается чаще в климактерическом возрасте, или в менопаузе, хотя иногда может развиваться и в молодом возрасте. Предполагают, что возникновение этой патологии связано с нарушением выделения гистамина и гистаминоподобных веществ. В результате воздействия этих веществ на нервные рецепторы появляются зуд и бели. Большое значение имеют нарушения функции яичников и коры надпочечников, а также изменения обмена витаминов ( особенно А).Крауроз – это дистрофический процесс, который характеризуется атрофией сосочкового и ретикулярного слоев кожи, гибелью эластических волокон и геалинизацией соединительной ткани, изменением нервных окончаний. При краурозе исчезает подкожная жировая клетчатка больших половых губ, наступает атрофия сальных и потовых желез. Кожа истончается, становится сухой, хрупкой, легкоранимой, ткани сморщиваются, вход во влагалище резко суживается.
Заболевание обычно сопровождается зудом и жжением, что приводит к расчесам и вторичным воспалительным изменениям тканей.
Лечение
Назначают эстрогенные гормоны в сочетании с витамином А, в качестве симптоматического средства, уменьшающего зуд, можно применять преднизолоновую мазь или мазь с анестезином. Для нормализации трофической функции в подкожную клетчатку вводят раствор новокаина по методу тугого ползучего инфильтрата, производят пресакральную новокаиновую блокаду, денервацию вульвы путем рассечения полового нерва. При безуспешной консервативной терапии целесообразно хирургическое вмешательство. Операция состоит в иссечении пораженной части вульвы в пределах здоровой ткани или экстирпации вульвы.Кроме лейкоплакии и крауроза к предраковым состояниям наружных половых органов относят болезнь Боуэна и болезнь Педжета, а также хронические вульвиты, ограниченные пигментные пятна, склонные к росту и изъязвлению, остроконечные кондиломы и воспалительные процессы, сопровождающиеся обильными выделениями, вызывающими зуд, расчесы и трещины.
Болезнь Боуэна и Педжета
Болезнь Боуэна характеризуется картиной гиперкератоза с паракератозом и акантозом. Клинически это заболевание проявляется плоскими и приподнятыми пятнами с четкими краями и некоторой инфильтрацией подлежащих тканей.Болезнь Педжета отличается от предыдущего заболевания наличием своеобразных крупных светлых клеток в эпидермисе. Клинически выявляются единичные ярко–красные резко ограниченные экземоподобные пятна, имеющие зернистую поверхность с инфильтрацией кожи.
Болезни Боуэна и Педжета излечиваются хирургическим путем, объем операции ограничивается вульвэктомией.
Диагностика
Обследование больных с предопухолевыми заболеваниями должно включать детальный осмотр, кольпоскопию, цитологическое исследование отпечатков или поверхностных соскобов с их язвенных поверхностей, биопсию.Фиброма. Фибромиома. Липома. Фибролипома
К опухолям вульвы и влагалища относятся фиброма, фибромиома, липома, фибролипома.Фиброма – доброкачественная опухоль из соединительной ткани больших половых губ, реже – из фасции малого таза и параметральной клетчатки.
Фибромиома – доброкачественная опухоль из мышечных волокон круглой связки, заканчивающейся в больших половых губах.
Липома и фибролипома – доброкачественные опухоли из жировой и соединительной ткани.
Диагностика
Распознавание доброкачественных опухолей вульвы не представляет трудностей. Узлы располагаются на широком основании или на ножке, могут достигать больших размеров и доступны непосредственному осмотру. При нарушении кровообращения развиваются отек, кровоизлияние, некроз, присоединяется вторичная инфекция.Лечение
Проводится хирургическое лечение – удаление опухоли. На ножку опухоли накладывают зажимы, пересекают и лигируют, обращая внимание на тщательность гемостаза.Прогноз благоприятный.
Гидроаденома
Доброкачественная опухоль, которая развивается из потовых желез. Встречается редко. При осмотре под кожей или в толще больших половых губ выявляются одиночные и множественные узелки.Лечение
Проводится оперативное лечение – удаление опухоли.Прогноз при удалении доброкачественной опухоли благоприятный.
Доброкачественные опухоли влагалища (миома, фиброма, фибромиома, липома)
Встречаются относительно редко, Обычно они небольших размеров, располагаются под слизистой влагалища, внутри его стенки, в septum recto–vaginale или septum vesico–vaginale. Развиваются из соединительной и мышечной ткани влагалищной стенки. Растут чаще в виде одиночного узла, расположенного на широком основании или на длинной ножке, реже встречаются множественные узелки фибром, миом и фибромиом.Опухоли развиваются в возрасте от 20 до 50 лет, протекают бессимптомно, только при больших размерах возникает чувство инородного тела, затрудняется половое сношение, нарушаются мочеиспускание и дефекация.
Диагноз устанавливается при осмотре в зеркалах и влагалищном исследовании.
Гемангиома влагалища – Очень редкая сосудистая доброкачественная опухоль, имеющая синюю окраску и мягкую консистенцию, на разрезе напоминает кавернозное тело.
Папиллома – доброкачественные отдельные или множественные разрастания, напоминающие цветную капусту.
Лечение
Лечение доброкачественных опухолей влагалища хирургическое – удаление опухоли. Если опухоль имеет ножку, последняя лигируется, а опухоль отсекается. При расположении опухоли под слизистой она вылущивается.Прогноз благоприятный.
Фоновые заболевания шейки матки
Шейка матки образуется путем слияния мюллеровых каналов на 12–16–й неделе эмбриогенеза и в различные периоды жизни женщины имеет клинические, морфологические и функциональные особенности, которые предрасполагают к определенной топографо–анатомической локализации патологических процессов.Многослойный плоский эпителий влагалищной части шейки матки представляет собой высокодифференцированную ткань, имеющую сложное строение и функциональные особенности. Эпителий, покрывающий шейку матки, состоит их четырех слоев: базального, парабазального, промежуточного и поверхностного. Базальный слой представляет собой клетки, расположенные в один ряд на базальной мембране, которая отделяет плоский многослойный эпителий от подлежащей соединительной ткани. В парабазальном слое клетки расположены несколькими рядами. Клетки базального и парабазального слоев обладают митотической активностью. Слой промежуточных клеток состоит из 6–7 рядов умеренно дифференцированных клеток. Поверхностный слой представлен 2–3 рядами клеток, которые проявляют тенденцию к ороговению и легко подвергаются десквамации в зависимости от фазы менструального цикла.
Кровоснабжение многослойного плоского эпителия осуществляется кровеносными сосудами, расположенными под базальной мембраной. Образование терминальных петель капилляров находится в прямой зависимости от уровня половых гормонов (эстрогенов и прогестерона) в крови.
Основная функция многослойного плоского эпителия шейки матки – защитная. Механический барьер обеспечивают глыбки кератина, иммунный барьер – гликоген, благодаря которому повышается местный иммунитет влагалища.
Слизистая оболочка цервикального канала покрыта однорядным высоким цилиндрическим эпителием с базально расположенными ядрами.
Границей двух генетически различных типов эпителия в шейке матки является область перехода многослойного плоского эпителия влагалищной части в высокий цилиндрический эпителий слизистой оболочки цервикального канала. Цилиндрический эпителий слизистой оболочки цервикального канала вблизи перехода в многослойный плоский эпителий дополняется слоем резервных клеток, где они располагаются в несколько слоев и формируют у части женщин незрелый метапластический эпителий. Большинство исследователей признают возможность дифференцировки их в многослойный плоский или цилиндрический эпителий под влиянием различных факторов.
Зона перехода многослойного плоского эпителия в цилиндрический у большинства женщин репродуктивного возраста совпадает с областью наружного зева. Смещение переходной зоны на эктоцервикс называется эктопией, считается нормальным в период внутриутробного развития и может сохраняться до пубертатного возраста. У большинства девочек по мере роста и развития организма происходит уменьшение эктопии и к концу полового созревания граница между плоским многослойным и высоким цилиндрическим эпителием устанавливается на уровне наружного зева. В ряде случаев этот процесс задерживается и эктопия может наблюдаться у нерожавших женщин моложе 25 лет.
Наиболее часто заболевания шейки матки возникают у женщин молодого возраста. Причины возникновения и развития различных патологических процессов в шейке матки до настоящего времени окончательно не установлены.
Этиология
Выявлены наиболее значимые факторы в развитии заболеваний шейки матки, знание которых имеет большое значение для выбора оптимальных методов профилактики и лечения больных.К факторам риска развития патологии шейки матки относятся следующие. ■ Особенности становления менструальной функции – раннее наступление менархе и раннее половое созревание увеличивают риск заболеваний шейки матки в 5–7 раз. ■ Сексуальный анамнез–раннее начало половой жизни (до 16 лет многослойный плоский эпителий истончен, легко раним); беспорядочные половые связи, частая смена половых партнеров (есть данные о канцерогенном действии спермы на эпителий шейки матки за счет действия белков гестона и протамина). ■ Репродуктивная функция женщины – ранняя (до 16 лет) первая беременность и ранние первые роды, большое количество беременностей и родов, наличие родовых травм с последующим развитием эктропиона. ■ Травма шейки матки во время абортов, родов, выскабливаний цервикального канала. ■ Гормональный гемостаз – установлена большая значимость гиперэстрогении в развитии заболеваний шейки матки. Гормональные нарушения (ановуляция, неполноценная лютеиновая фаза, недостаточность обеих фаз, меноррагии, гиперполименорея и др.) встречаются у 72–73% больных с шеечной патологией. Кроме того, на возникновение патологии шейки матки влияют нарушения функции щитовидной железы и надпочечников. ■ Инфицированность женского организма банальной (кокки, палочки, хламидии, микоплазмы, гарднереллы, трихомонады) флорой и вирусами (герпес простой, вирус папилломы человека). ■ Производственные вредности. ■ Генетические (наследственные) факторы. ■ Курение.
Классификация
Для практического применения рекомендована классификация И.А. Яковлевой, Б.Г. Кукутэ (1977). Согласно данной классификации все патологические процессы подразделяются на следующие группы.Фоновые процессы. ■ Гиперпластические, связанные с гормональным нарушением: • эндоцервикоз: простой, пролиферирующий, заживающий • полипы: простой, пролиферирующий, эпидермизирующийся • папилломы • простая лейкоплакия.
Эндометриоз. ■ Воспалительные: истинная эрозия, цервициты. ■ Посттравматические: • разрывы • эктропион • рубцовые изменения • шеечно–влагалищные свищи.
Предраковые состояния: ■ Дисплазия, возникшая на неизмененной шейке или в области фоновых процессов: • слабо выраженная • умеренно выраженная • тяжелая. ■ Лейкоплакия с атипией клеток. ■ Эритроплакия. ■ Аденоматоз.
Я.В. Бохман в 1976 г. преложил более простую классификацию патологических процессов шейки матки: ■ фоновые процессы: псевдоэрозия, лейкоплакия, полип, плоские кондиломы ■ предраковый процесс: дисплазия – слабая, умеренная, тяжелая ■ преинвазивный рак (рак in situ), внутриэпигелиальный рак ■ микроинвазивный рак ■ инвазивный рак.
Диагностика
Для того чтобы правильно поставить диагноз, выделяют два этапа обследования: на 1–м этапе идет выявление–скрининг, на 2–м – углубленная диагностика, позволяющая заподозрить или исключить рак репродуктивной системы. ■ 1–й этап: общее обследование – осмотр шейки матки с помощью зеркал; бимануальное и ректальное обследование, цитологическое исследование ■ 2–й этап: общее обследование – осмотр влагалища и шейки матки в зеркалах, кольпоскопия простая и расширенная, прицельная цитология, обследование на ЗППП; бимануальное исследование.При подозрении на рак шейки матки проводятся следующие исследования: осмотр шейки матки в зеркалах, кольпоскопия, прицельная или конусовидная биопсия, выскабливание слизистой шеечного канала.
Диагностика на 1–м этапе проводится во время профилактических осмотров женщин в поликлиниках или женских консультациях. Первичный скрининг включает сбор анамнеза, общий осмотр, обследование молочных желез, осмотр наружных половых органов, влагалища и шейки матки в зеркалах, цитологическое исследование клеток экто– и эндоцервикса, бимануальное и ректальное исследование.
При сборе анамнеза выявляют количество беременностей, родов, абортов, их осложнения, наличие травм, воспалительных процессов, кровотечений после родов или аборта; гинекологические заболевания и их лечение; наличие сопутствующих экстрагенитальных заболеваний; характер менструальной функции.
Осмотр шейки матки с помощью зеркал позволяет определить ее величину и форму, форму наружного зева, различные патологические состояния (разрывы, эктопию, эктропион, полипы и др.).
Бимануальное исследование поможет определить стадию злокачественного процесса, а также определить, имеет ли место переход на параметральную клетчатку.
Цитологическое исследование – это метод морфологической диагностики, позволяющий оценить состояние эпителия при патологических процессах шейки матки, осуществить контроль эффективности консервативного и оперативного лечения этих больных. Цитологическая диагностика заключается в микроскопическом исследовании мазков–отпечатков с различных участков шейки матки. Цитологическое исследование считается полноценным, если материал взят с двух участков шейки матки – из цервикального канала (эндоцервикса), с поверхности шейки (эктоцервикса).
Различают скрининговое (при профилактических осмотрах) и прицельное (во время проведения эндоскопии) цитологическое исследование шейки матки. Скрининговое цитологическое обследование необходимо проводить всем женщинам старше 20 лет с началом половой жизни независимо от клинических данных. При наличии клинически выраженных патологических процессов на шейке матки мазки для цитологического исследования получают прицельно с места наиболее выраженного патологического процесса. Мазки берут до бимануального исследования и проведения расширенной кольпоскопии. Наиболее целесообразно цитологическое исследование выполнять во второй половине менструального цикла. Материал для цитологического исследования следует брать осторожно, не повреждая слизистую оболочку цервикального канала.
Существует много способов взятия цитологического материала из влагалища, шейки матки, эндоцервикса и полости матки: пипеткой (по Папаниколау); марлевым или ватным тупфером; в виде соскоба шпателем, ложечкой, проволочной петлей, краем предметного стекла, нейлоновой щеткой; смывом; пункцией; кюретажем с помощью желобоватого зонда; аспирацией шприцем Брауна содержимого цервикального канала или полости матки; с помощью губок из желатина или целлюлозы. Для забора материала из экто– и эндоцервикса используются различные модификации шпателя Эйра – металлические и пластиковые. Применение шпателя Эйра позволило увеличить частоту выявления предрака и рака шейки матки в 3 раза.
В мире (особенно в странах Скандинавии) широко распространен метод получения цитологического материла с помощью специальной щетки; этот метод рассматривают как альтернативу эндоцервикальному соскобу.
В ряде регионов Беларуси для взятия материала для цитологического исследования применяют одноразовые мягкие поролоновые кубики.
Аспираты из эндоцервикса уступают по информативности соскобам и потому не рекомендуются для цитологической оценки состояния эпителия.
В мазках–отпечатках влагалищной части шейки матки преобладают клетки плоского эпителия, преимущественно поверхностного или промежуточного типа.
Классификация результатов цитологического исследования по Папаниколау получила наибольшее распространение в мире и включает пять основных классов: ■ нормальная цитологическая картина ■ изменение морфологии клеток, обусловленное воспалительным процессом во влагалище или на шейке матки ■ единичные клетки с аномалией ядер и цитоплазмы ■ отдельные клетки с явными признаками озлакачествления ■ большое число типично раковых клеток.
Если цитологическое заключение представлено в виде описания клеточного состава, то следует обращать внимание на наличие клеток с дискариозом, который ассоциируется с CIN; койлоцитов, которые позволяют заподозрить папилломавирусную инфекцию. Наибольшую диагностическую информативность имеют клеточный и ядерный полиморфизм, выраженная анизохромия, высокий ядерно–цитоплазменный индекс.
Кольпоскопией называется осмотр наружных половых органов, влагалища и шейки матки с помощью кольпоскопа, состоящего из бинокулярной оптической системы с осветителем, позволяющим рассматривать объекты под увеличением в 10–30 раз.
Различают следующие методики кольпоскопического обследования: ■ простая кольпоскопия – осмотр влагалища и шейки матки при стандартном увеличении в 10–30 раз без использования медикаментозных средств ■ расширенная кольпоскопия – осмотр шейки матки с использованием различных эпителиальных сосудистых тестов, которые позволяют выявить более четкую кольпоскопическую картину. Наиболее часто используется обработка слизистой оболочки 3% уксусной кислотой и 2% раствором Люголя (проба Шиллера). Клетки поверхностного эпителия содержат гликоген, который реагирует с йодом и дает коричневую окраску. Нормальная слизистая при обработке будет окрашена в коричневый цвет ■ хромокольпоскопия – кольпоскопия с окраской влагалищной части шейки матки различными красителями (метиленовым синим, гематоксилином) ■ флюоресцентная кольпоскопия – расширенная кольпоскопия с использованием акридинового оранжевого и уранинового фиолетового, повышающая возможности топической диагностики ■ кольпомикроскопия – осмотр при увеличении в 160– 280 раз; эту методику называют прижизненным гистологическим исследованием, данные кольпомикроскопии и гистологических методов совпадают в 97–98% случаев; благодаря этому можно осмотреть эпителиальный покров и подэпителиальные сосуды на глубине 70 мкм.
При расширенной кольпоскопии выявляется неизмененная слизистая оболочка шейки матки – гладкая, блестящая, бледнорозового цвета. При обработке 3% уксусной кислотой слизистая становится несколько бледнее. При нанесении раствора Люголя на поверхность влагалищной шейки матки происходит равномерное темно–коричневое окрашивание.
Цервикоскопия – осмотр эндоцервикса. Как метод оптической оценки состояния цервикального канала особенно важен у женщин старше 40 лет в связи с перемещением стыка двух эпителиев выше наружного маточного зева.
Биопсия с гистологическим исследованием полученного материала является конечным этапом комплексного обследования и носит уточняющий характер.
Виды биопсии из шейки матки: ■ простая биопсия – материал для исследования берут из поверхности эктоцервикса под визуальным контролем из наиболее подозрительных видимых участков;. ■ пункционная биопсия – материал для гистологического исследования берут с помощью толстой иглы из нескольких участков ■ прицельная биопсия – материал берут из наиболее подозрительного участка шейки матки после расширенной кольпоскопии.
По современным требованиям онкологии любая биопсия из шейки матки должна быть прицельной.
Идеальным инструментом для забора тканей является хирургический скальпель. Недопустимо иссечение участка ткани электропетлей из–за изменения тканей под воздействием электрического тока, что затрудняет гистологическую диагностику.
Эндоцервикальный соскоб – биопсия эндоцервикса проводится, когда требуется дополнительная информация о состоянии верхней трети цервикального канала. Соскоб берут, используя кюретки небольшого размера (№ 1–2). Нецелесообразно делать повторные соскобы в короткие сроки после кюретажа, по данным которого патогистологом не поставлен диагноз.
Исследование с радиоактивным фосфором (32Р) основано на свойствах фосфора накапливаться в местах интенсивной клеточной пролиферации, очагах рака. Накопление радиоактивного фосфора свыше 140% свидетельствует о злокачественности поражения. Метод является диагностическим, позволяет выбрать место биопсии и служит контролем проводимого лечения.
Цитогенетический метод основан на определении полового хроматина (Х–хроматина), который изучают в гистологических срезах тканей, полученных при биопсии или эксцизии шейки матки после окраски гематоксилин–эозином. Определение Х–хроматина применяется для выявления интенсивности пролиферативных процессов, склонности к озлокачествлению, определения степени злокачественности и чувствительности опухоли к половым гормонам.
Лечение
Цель лечения – ликвидация патологического процесса на шейке матки и тех факторов, которые способствовали его возникновению и поддержанию длительного течения.Все методы лечения заболеваний шейки матки подразделяются на консервативные и хирургические. Хирургические методы лечения предполагают выполнение локальной деструкции шейки матки или радикального оперативного вмешательства (эксцизия, ампутация шейки матки, гистерэктомия).
Лечение должно состоять из нескольких этапов. На 1–м этапе следует начать лечение заболеваний, которыеспособствовали возникновению патологии шейки матки (хронические воспалительные заболевания, нарушения менструальной функции и т.д.). На 2–м этапе выбирают индивидуальный, наиболее рациональный способ воздействия на патологический очаг на шейке матки.
Консервативному лечению подвергаются больные с воспалительными заболеваниями шейки матки и влагалища с учетом возбудителя, а также больные с нейродистрофическими изменениями шейки матки (простая лейкоплакия), дисплазией легкой степени, атрофическим цервицитом. При консервативном лечении необходимо отсутствие дисплазии умеренной и тяжелой степени, длительность лечения должна быть в пределах 2–3 недель для снятия воспалительного процесса и 1–3 месяцев при дисгормональных нарушениях. В качестве лекарственных средств применяют препараты с антибактериальной, бактерицидной, антисептической, дезинфицирующей активностью. При назначении гормональных препаратов у молодых женщин предпочтение нужно отдавать трехфазным гормональным контрацептивам, курс лечения – 6–9 месяцев.
Для иммунокорригирующей терапии широко используют витамин Е, лейкинферон, тимактин, лейкоцитарный интерферон.
При заболеваниях шейки матки можно использовать химическую (лекарственную или физиотерапевтическую) коагуляцию патологических очагов. К физиотерапевтической коагуляции относится внутришеечный электрофорез с цинком по Г.А. Келлату. Для химической медикаментозной коагуляции используют солковагин (смесь органических и неорганических кислот) – препарат местного прижигающего действия, который можно использовать при истинных и псевдоэрозиях, простых лейкоплакиях, эктропионах. Препарат ватным тупфером наносят только на область поражения, при этом образуется струп, который отторгается на 3–4–й день. Через 2 недели повторяют еще 2–3 аппликации после контроля кольпоскопией. Солковагин хорошо переносится больными, не вызывает побочных явлений, после его применения отсутствует рубцовая деформация шейки матки. Препарат можно использовать для лечения полипов и грануляций без воспаления.
С целью лечения патологии шейки матки применяют также аппаратную физиотерапию (низкочастотный ультразвук через глюкокортикоидную мазь, коротковолновую УФ–терапию, микроволны сантиметрового диапазона). Из нетрадиционных методов можно использовать иглорефлексотерапию и лазеролечение. Магнитная терапия с помощью вагинального магнита показана при сочетании псевдоэрозии шейки матки с хроническим эндоцервицитом. Бальнеолечение проводится в виде влагалищных тампонов из смесей лечебной грязи из Тамбуканского озера и азотной или йодобромной воды.
Фитотерапию применяют в виде спринцеваний, фитованн, мазевых аппликаций чаще при сопутствующем воспалении влагалища и шейки матки.
К хирургическим методам лечения заболеваний шейки матки относятся такие, которые обеспечивают разрушение патологического очага в пределах здоровой ткани. Они подразделяются на методы локальной деструкции патологического очага (диатермокоагуляция, криокоагуляция, лазерная вапоризация, лазерная конизация) и радикальные методы (диатеромоэксцизия и конизация шейки матки).
Диатермокоагуляция – метод хирургического воздействия высокочастотным током на ткань тела пациента для ее коагуляции. Диатермокоагуляцию применяют в амбулаторных условиях или в стационаре после антисептической обработки шейки матки. Обезболивания не требуется. Силу тока определяют индивидуально, так чтобы образовался белый струп, но не происходило обугливание тканей. Заживление происходит медленно, струп отпадает на 7–10–е сутки, эпителизация заканчивается к концу 3–4–го месяца после операции. Показаниями для применения метода являются доброкачественные фоновые процессы без деформации и гипертрофии шейки матки, дисплазия легкой и средней степени тяжести в возрасте до 40 лет, дискератозы в молодом возрасте.
Криодеструкция – воздействие холодом – является одним из эффективных методов лечения, основана на использовании для деструкции тканей низких температур. В качестве хладагента чаще использует жидкий азот (температура кипения равна 196°). Криодеструкция проводится в женской консультации и в стационаре в асептических условиях. Глубина криогенного воздействия не превышает 5–8 мм, некроз тканей заканчивается через 7–10 дней, струп образуется более нежный, после отторжения его эпителизация наступает через 7–10 недель.
Лазерная деструкция проводится с помощью высокоэнергетических лазеров (углекислотный, неодимовый, аргоновый и др. ), которые позволяют резать, испарять, коагулировать ткани за счет сильного поглощения ими лазерного излучения; лазерную коагуляцию выполняют в амбулаторных условиях на 4–7–й день менструального цикла. После лазерной вапоризации раны заживают с меньшей лейкоцитарной инфильтрацией, без лейкореи, что приводит к более быстрому заживлению в течение 4 недель.
К методам радикального хирургического лечения относится конизация шейки матки.
При диатермоэлектроэксцизии (ДЭЭ) проводится конусовидное иссечение патологически измененных тканей шейки матки с вершиной, обращенной к внутреннему зеву. В результате такого иссечения по всему конусу коагулируется слизистая, образуется струп, после отторжения которого наступает стойкое заживление. Показаниями для ДЭЭ является сочетание фонового процесса с деформацией шейки матки, тяжелая степень дисплазии.
К хирургическим радикальным операциям относятся различные методы ампутации шейки матки (по Шредеру, Штурмдорфу и др.), реконструктивно–пластические операции с восстановлением нормальной анатомии канала шейки матки по В.И. Ельцову–Стрелкову, гистерэктомия.
Эктопии
Смещение границы между многослойным плоским и цилиндрическим эпителием на влагалищную часть шейки матки, которое связывают с возрастом и гормональным балансом организма. В норме эктопия может наблюдаться у молодых нерожавших женщин (моложе 25 лет). В климактерическом периоде на фоне резкого снижения синтеза половых гормонов яичников преобладают инволюционные процессы, в связи с чем переходная зона эпителия смещается в нижнюю треть эндоцервикса. Однако наступление постменопаузы не всегда сопровождается атрофическими изменениями эпителия шейки матки и влагалища из–за воздействия гормонов, компенсаторно вырабатываемых надпочечниками.Прием гормональных контрацептивов в течение 6–12 месяцев может привести к развитию эктопии на шейке матки, которая спонтанно проходит после отмены гормональных препаратов.
Клинические симптомы эктопии отсутствуют. При осмотре шейки матки в зеркалах вокруг цервикального канала видна зона ярко–красной окраски с четкими границами, отсутствует патологическая секреция и воспалительные изменения.
При цитологическом исследовании материала с участка эктопии определяются клетки высокого цилиндрического эпителия и в небольшом количестве – клетки плоского многослойного эпителия, в постменопаузе в связи с атрофическими изменениями эпителия шейки матки в мазках преобладают парабазальные клетки.
Кольпоскопическая картина эктопии характеризуется участками ярко–красного цвета, состоящими из сосочков, которые располагаются вокруг цервикального канала и имеют четкие границы. При обработке уксусной кислотой сосочки становятся более четкими, рельефными из–за сокращения сосудов и уменьшения отека эпителия. При проведении пробы Шиллера участки эктопии окрашиваются в светло–коричневый цвет. В климактерическом возрасте при кольпоскопии наблюдается следующая картина: шейка матки покрыта неравномерно истонченным многослойным плоским эпителием, под которым просвечивают субэпителиальные сосуды стромы с правильным ходом, часто кровоточащие и не всегда сокращающиеся в ответ на пробу с 3% уксусной кислотой. Проба Шиллера слабо положительная.
Лечения эктопии не требуется.
Истинная эрозия
Это травма эпителия, т.е. отсутствие эпителия на каком–то участке, существует в течение нескольких дней. В дальнейшем эрозия регенерирует и покрывается многослойным плоским либо цилиндрическим эпителием, который характерен для цервикального канала.Кольпоскопически различают посттравматические, которые вызываются чаще гинекологическими манипуляциями, и воспалительные истинные эрозии. При кольпоскопии посттравматическая истинная эрозия выглядит в виде ярко–красного пятна с четкими, местами завернутыми краями эпителия на фоне неизмененной слизистой оболочки. При истинной эрозии воспалительного характера края обычно размытые, нечеткие, дно менее яркое, иногда темно–красного или коричневого цвета, имеет зернистый рельеф. Проба с уксусной кислотой мало изменяет картину кольпоскопии. Проба Шиллера остается отрицательной в области дефекта эпителиального покрова.
Если эрозия, находящаяся на эктоцервиксе, покрывается цилиндрическим эпителием, то образуется псевдоэрозия, т.е. участок слизистой оболочки шейки матки, который покрыт неправильным эпителием, не тем, который должен быть в этом месте. Таким образом, создаются условия для процессов пролиферации.
Существуют следующие теории возникновения псевдоэрозии: ■ механическая – в основе этого процесса лежит слущивание многослойного плоского эпителия в результате механического воздействия с последующим присоединением воспалительного процесса (травмы во время родов, абортов, выскабливаний матки) ■ воспалительная – основой патологического процесса являются перенесенные воспалительные процессы половых путей, преимущественно шейки матки и влагалища; до недавнего времени была основной концепцией развития псевдоэрозии ■ гормональная – заболевания шейки матки в 5–6 раз чаще встречаются у женщин с нарушениями менструального цикла, дисгормональные нарушения приводят к дифференцировке эпителия шейки матки в цилиндрический путем метаплазии резервных клеток ■ аутоиммунная – выявлена тесная связь между показателями местного гуморального иммунитета и степенью морфологических изменений шейки матки, что может свидетельствовать о возможном влиянии иммуноглобулинов различных классов на возникновение и прогрессирование фоновых заболеваний (А.Ф. Куперт,1989).
Согласно классификации, предложенной Е.Б. Рудаковой (1996), выделяют псевдоэрозию врожденную, приобретенную, рецидивирующую. Псевдоэрозия может протекать в двух формах: неосложненной и осложненной.
Врожденная псевдоэрозия, или эктопия, характеризуется смещением границ цилиндрического эпителия за пределы наружного зева. Это происходит еще в период внутриутробного развития, в основе процесса лежат нарушения своевременного разделения многослойного плоского и цилиндрического эпителия. По некоторым данным, смещение переходной зоны на эктоцервикс во внутриутробном развитии является нормальным этапом развития шейки матки и объясняется гормональным воздействием эстрогенов, которые продуцируются материнским организмом. Врожденные эрозии могут сохраняться до 20–25 лет.
Приобретенная псевдоэрозия бывает осложненной или неосложненной.
Неосложненная псевдоэрозия характеризуется гладкой ровной поверхностью, выстланной однорядным плоским эпителием. Рядом с базальным слоем имеется слой резервных клеток, процессы пролиферации эпителия отсутствуют.
Кольпоскопическая картина характеризуется наличием эктопии с зоной превращения.
Псевдоэрозия осложненная – наблюдается сочетание ее с воспалительным процессом шейки матки и влагалища, с разрывами, рубцами, деформацией шейки матки, с нарушениями менструальной функции, которые играют большую роль в персистенции псевдоэрозии. Кроме того, они не позволяют провести полноценное обследование пациенток и изменяют клиническую картину при исследовании мазков–отпечатков.
Пациентки с псевдоэрозией, как правило, жалоб не предъявляют. При наличии сопутствующих воспалительных процессов половых органов могут быть жалобы на бели, боли, иногда – контактные кровянистые выделения.
При осмотре в зеркалах можно заподозрить псевдоэрозию при наличии вокруг наружного зева пятна с неправильными очертаниями ярко–красного цвета, окруженного бледно–розовой слизистой. Псевдоэрозии бывают разной величины и формы, легко кровоточат.
При расширенной кольпоскопии псевдоэрозия представлена эктопией и различными сочетаниями ее с зоной превращения. Участки эктопии представляют собой гроздевидные скопления округлых или продолговатых сосочков ярко–красного цвета, что обусловлено просвечиванием кровеносных сосудов через однослойный цилиндрический эпителий. Зона превращения на фоне ярко–красной поверхности эктопии выделяется в виде нежных бледно–сероватых язычков многослойного плоского эпителия; при этом могут быть открытые и закрытые железы, а также выраженная сосудистая сеть.
При цитологическом исследовании в мазках определяются клетки поверхностного и промежуточного типов, базальные и парабазальные клетки плоского эпителия, а также клетки цилиндрического и высокого цилиндрического эпителия преимущественно без существенных изменений. В мазках также могут встречаться эритроциты, сегментоядерные эритроциты, гистиоциты, лимфоциты, плазматические клетки. Мазки–отпечатки необходимо брать с влагалищной части шейки матки, переходной зоны, непосредственно с поверхности эктопии и нижней трети цервикального канала.
Основным методом диагностики псевдоэрозии является морфологическое исследование ткани шейки матки, полученной после прицельной биопсии шейки под контролем кольпоскопии. При гистологическом исследовании выделяют две формы псевдоэрозии – железистую и папиллярную.
При железистой псевдоэрозии определяется разрастание железистого эпителия, который замещает многослойный плоский эпителий, железы ветвятся, образуют складки, дают боковые выросты. Просвет желез выстлан цервикальным эпителием, обильно продуцируется слизь.
При папиллярной псевдоэрозии на первый план выступают сосочковые выросты, покрытые железистым эпителием, строма рыхлая, богатая сосудами, с лимфоплазмоцитарной инфильтрацией.
Лейкоплакия
Занимает особое место в структуре заболеваний шейки матки, поскольку до настоящего времени остается спорным вопрос о патогенезе, злокачественности и доброкачественности течения. Частота лейкоплакии в структуре заболеваний шейки матки составляет 5,2%, злокачественная трансформация многослойного плоского эпителия наблюдается у 31,6% этих больных (М.Ю. Новикова, 1995).Лейкоплакия – это полиэтиологическое заболевание, к возникновению которого предрасполагают воспалительные заболевания половых органов, нарушения иммунного статуса, гормональные изменения (гиперэстрогения, дефицит прогестерона), травмы шейки матки во время родов, абортов, неправильное и неадекватное лечение патологии шейки матки (1/3 больных с лейкоплакией ранее получали интенсивное и неадекватное медикаментозное лечение по поводу псевдоэрозии шейки матки, у 33% ранее была произведена диатермокоагуляция) и др.
Характерно бессимптомное течение заболевания, лишь небольшое количество женщин жалуется на обильные бели и контактные кровянистые выделения.
При осмотре в зеркалах лейкоплакия выглядит в виде белого пятна на шейке матки. Это тонкая белая пленка, которая может легко слущиваться, или плотные глыбчатые бляшки с четкими контурами. Внешние проявления простой лейкоплакии зависят от толщины кератинового слоя. После его удаления видны блестящие участки розового цвета, по которым можно судить об истинных размерах поражения.
Проба Шиллера отрицательная, сосуды не видны, так как на участке лейкоплакии они отсутствуют.
При кольпоскопии лейкоплакия выглядит как белое пятно с гладким или мелкозернистым рельефом, пятна имеют перламутровый блеск различной степени выраженности. Форма и размер пятен разнообразны, границы четкие, извилистые. При проведении пробы Шиллера лейкоплакия определяется как йоднегативный участок, покрытый одинаковыми по величине красными точками, которые представляют собой соединительнотканные сосочки в многослойном плоском эпителии с петлями капилляров. Поля лейкоплакии видны в виде рисунка мозаики, при обработке уксусной кислотой картина мозаики становится более отчетливой.
При цитологическом исследовании в мазках–отпечатках определяются глыбки кератина, а также скопления поверхностных клеток, лишенных ядер, цитоплазма которых окрашивается по методу Папаниколау в желтый или оранжевый цвет. В мазках встречаются пласты полигональных ороговевающих клеток с пикнотическим ядром неправильной формы–дискерациты. Нужно помнить, что из–за наличия рогового слоя на поверхности многослойного плоского эпителия в мазки не попадают клетки с дискератозом из глубоких слоев, где возможны нарушения дифференцировки, пролиферация и атипия.
Основным методом диагностики является биопсия шейки матки под контролем кольпоскопии с морфологическим исследованием биоптата. Одновременно с биопсией необходимо произвести выскабливание слизистой цервикального канала, так как лейкоплакия может развиваться и в участках плоскоклеточной метаплазии слизистой цервикального канала.
Морфологическая картина лейкоплакии характеризуется следующими изменениями многослойного плоского эпителия: ■ утолщением покровного эпителия за счет увеличения числа клеток шиповидного слоя с сохранением их комплексности (может быть обусловлено акантозом, т.е. погружением эпителиальных пластов в подэпителиальную соединительную ткань) ■ наличием рогового слоя на поверхности эпителия, который в норме отсутствует ■ наличием зернистого слоя, расположенного под роговым и представленным 2–3 рядами клеток, цитоплазма которых заполнена умеренным количеством базофильных гранул ■ рассеянной или очаговой лимфоидной инфильтрацией подэпителиальной соединительной ткани. В участках лейкоплакии гликоген всегда отсутствует, часто встречается паракератоз – неполное ороговение многослойного плоского эпителия.
Лейкоплакия без атипизма клеток является доброкачественным процессом шейки матки и относится к фоновым заболеваниям, при наличии атипизма – к предраку и классифицируется так же, как и дисплазия шейки матки в зависимости от степени выраженности атипии. Лейкоплакия с атипией озлокачествляется в 75% случаев. Макроскопически представляет собой белое пятно, возвышающееся над поверхностью с бугристым рельефом, трещинами. При цитологическом исследовании мазков признаки атипии отмечаются в пролиферирующих элементах базального и промежуточного слоев и сочетаются с усиленным ороговением клеток функционального слоя. Наряду с ороговевшими клетками часто обнаруживаются клетки промежуточного, парабазального и базального слоев с признаками ороговения и дискариоза.
При цервикоскопии нужно оценить состояние стенок цервикального канала у пациенток с лейкоплакией шейки матки, обнаружить атипичные клетки, произвести прицельную биопсию.
Эктропион
Выворот слизистой цервикального канала в результате разрывов шейки матки во время родов, абортов.При эктропионе слизистая цервикального канала попадает в несвойственную ей среду, подвергается травматизации, что способствует развитию хронического эндоцервицита. Нарушение кровообращения и питания тканей шейки матки создает условия для очаговых гиперпластических процессов, появления пролиферативных изменений и дисплазии эпителия, свойственных предопухолевому состоянию и истинному опухолевому росту.
Гистологически участки эктропиона не отличаются от слизистой цервикального канала. Однако в участках эктропиона могут быть тяжи грубоволокнистой соединительной ткани и пучки гиперплазированной мышечной ткани, попавшие сюда в результате разрыва.
Полипы цервикального канала
Это соединительнотканные выросты, покрытые эпителием, которые в структуре доброкачественных заболеваний шейки матки составляют 22,8%. Полипами называются разрастания различных размеров на шейке матки, висящие на ножке. Чаще встречаются в возрасте от 30 до 50 лет, могут быть одиночными и множественными, длина полипов колеблется от 2 до 10 мм. Наиболее частая локализация – это цервикальный канал и область наружного зева. Различают полипы железистые, которые имеют эпителиальный покров из ПЭ, и эпидермизированные, которые обнаруживаются на влагалищной части матки и покрыты МСЭ (папилломы).Клинически, как правило, ничем не проявляются. Только при сопутствующих воспалительных процессах, которые обусловлены чаще травмой и носят преимущественно очаговый характер, могут быть патологические бели, кровянистые выделения.
Диагностика: осмотр в зеркалах, цервикоскопия, кольпоскопия, цитологическое исследование.
Кольпоскопически полип определяется как зона доброкачественной незаконченной или законченной трансформации, может встречаться зрелый многослойный эпителий с возможными признаками гиперплазии, дисплазии.
Цитологическая картина при полипах почти не отличается от эндоцервикоза. В мазках обнаруживаются клетки плоского эпителия, расположенные разрозненно, в виде групп, в которых отмечаются признаки секреции, дистрофии. Цитологически дифференцировать железистый полип и железистую эрозию практически невозможно.
Кондиломы
Вызываются вирусами: вирусом герпеса 2–го серотипа и вирусом папилломы человека (HPV). Заражение молодых женщин (в возрасте 22–29 лет) происходит только половым путем при активной половой жизни и несоблюдении правил личной гигиены.При серологическом исследовании можно обнаружить специфические клетки, характерные для поражения вирусом папилломы человека, – измененные клетки многослойного эпителия. Клетки приобретают воздушную форму (пойлоциты, воздушные клетки) – около ядра образуется кайма воздуха. При электронной микроскопии обнаруживают специальные включения в ядре, что патогномонично. Иммунохимический метод также выявляет эти вирусы. При иммунопероксидазном методе в цитоплазме и ядре обнаруживают специальные включения, которые появляются только при поражении многослойного плоского эпителия. С помощью моноклональных антител и молекулярно–биологическим способом можно обнаружить вирусы. Определение титра антител в крови не актуально.
По морфологическим признакам выделяют три типа кондилом: ■ 1–й тип – экзофитный (классическая остроконечная кондилома с определенной клинической и кольпоскопической картиной) ■ 2–й тип – эндофитная, или инвертирующая, форма ■ 3–й тип – интраэпителиальная, или плоская, кондилома.
Экзофитная, или остроконечная, кондилома представляет собой папиллярные единичные или множественные образования, которые имеют вид цветной капусты или петушиного гребня. Локализация различна, в основном в местах возможной мацерации: малые половые губы, влагалище, шейка матки, устье уретры, клитор, область ануса, прилегающие кожные покровы.
Сосочки состоят из рыхлой соединительной ткани, часто отечной с выраженной воспалительной инфильтрацией, с центрально расположенными сосудами. Каждый сосочек покрыт утолщенным многослойным плоским эпителием с признаками паракератоза, акантоза, гиперплазией клеток базального и парабазального слоев.
Эндофитная, или инвертирующая, форма – редкое заболевание, которое проявляется тем, что кондилома локализуется в криптах слизистой оболочки цервикального канала. Клинически проявляется резко выраженной гипертрофией и уплотнением шейки матки. Диагноз ставится, как правило, на удаленном препарате шейки матки.
Интраэпителиальная, или плоская, кондилома развивается на фоне плоскоклеточной метаплазии в переходной зоне шейки матки, располагается в толще эпителия и практически не видна невооруженным глазом, клинической картины не имеет.
При расширенной кольпоскопии могут определяться участки белесоватого цвета с ровными контурами, но не выступающими над поверхностью эпителия, могут обнаруживаться шиповидные выросты эпителия, мозаика, немые йоднегативные участки, зона превращения (типичная и атипичная).
При цитологическом исследовании в мазках определяются койлоциты (клетки многослойного плоского эпителия промежуточного и поверхностного типа) и дискерациты (клетки многослойного плоского эпителия небольших размеров с гиперхромными ядрами разной величины). Койлоциты – это клетки сквамозного эпителия, который характеризуется выраженной зоной просветления вокруг ядра.
Основным методом диагностики является биопсия шейки матки с гистологическим исследованием, при котором определяются койлоциты, дискерациты, а также акантоз, пара– и дискеритоз.
При лечении кондилом применяют физические и химические методы, разрушающие кондиломы, а также противовирусные, иммуномодулирующие и антипролиферативные (цитостатические) препараты.
Предраковые процессы шейки матки.
Решением Комитета экспертов ВОЗ все предопухолевые процессы шейки матки в 1973 г. объединены термином «дисплазия». Кроме дисплазии в эту группу входят также лейкоплакия с атипией клеточных элементов, эритроплакия и аденоматоз.Диспластические изменения различной степени тяжести в зарубежной литературе называются цервикальной интраэпителиальной неоплазией (cervical intraepithelial neoplasia – CIN). При этом CIN 1–й степени тяжести является синонимом слабой дисплазии, CIN 2–й степени – умеренной, CIN 3–й степени тяжести обозначает тяжелую дисплазию, а также преинвазивную карциному.
Фоновый процесс не обязательно предшествует раку шейки.
Дисплазия – это понятие чисто морфологическое, так как при отсутствии фонового процесса клинические проявления также могут отсутствовать.
К факторам риска развития дисплазий относят: раннее начало половой жизни и частую смену половых партнеров, посттравматические (послеродовые и послеабортные) изменения шейки матки, воспалительные заболевания, инфицирование организма вирусами, хламидиями, изменения гормонального статуса, влияние вредных условий производства и экологии, низкий социально–жизненный уровень.
Предлагают термин «цервикальная интраэпителиальная неоплазия». Дисплазия по гистологической классификации ВОЗ (1981) – это патологический процесс, при котором в части толщи эпителиального слоя появляются клетки с различной степенью атипии покровного эпителия шейки матки, с нарушением его слоистости, но в процесс не вовлекаются поверхностный эпителий и строма.
По глубине поражения эпителия, степени клеточной атипии и сохранению архитектоники эпителиального пласта выделяют легкую, умеренную и тяжелую степени диспазии.
При легкой дисплазии происходит умеренная пролиферация 1/3 нижних слоев эпителия. Наибольшие изменения происходят в базальных и парабазальных клетках. Изменяется структура клеток, появляются полиморфизм, вакуолизация, митозы, нарушается соотношение ядра и цитоплазмы.
При умеренной дисплазии поражаются клетки многослойного плоского эпителия, где можно найти измененные клетки, имеется атипизм нижних клеток – гиперхроматоз ядра; в них изменяется ядерно–цитоплазматическое отношение.
При тяжелой дисплазии пролиферативные и структурные нарушения занимают почти весь эпителиальный пласт, но на поверхности всегда сохраняется слой неизмененных клеток плоского эпителия.
При цитологическом исследовании выявляется дискариоз. Это пограничное состояние, при котором цитологическая атипия выражена главным образом в ядрах клеток, тогда как при раковых патологических процессах находят изменения как в ядрах, так и в цитоплазме. При обнаружении в цитограммах дискариоза показано гистологическое исследование. При слабой дисплазии в мазках преобладают клетки промежуточного слоя многослойного плоского эпителия с признаками дискариоза. При умеренной дисплазии в мазках определяются преимущественно клетки парабазального слоя с признаками атипии ядер, количество клеток базального слоя с явлениями дискариоза колеблется в пределах 20–40%. При выраженной дисплазии в цитограмме обнаруживаются в значительном количестве клетки базального и парабазального слоев с выраженными признаками дискариоза, отмечается некоторый полиморфизм ядер, гипертрофия и гиперхромия многих из них, наличие митозов.
Эритроплакия
Относительно нечастая патология, локализуется в области эндоцервикозов, полипов, эктропионов или на неизмененной шейке матки. Причина заболевания – дисгормональные изменения в организме женщины.При осмотре – это приподнятое пятно, имеющее яркокрасный цвет из–за просвечивания сосудистой сети слизистой шейки матки через истонченный слой многослойного плоского эпителия, легко кровоточит при контакте.
При цитологическом исследовании в мазках определяются клетки парабазального и базального слоев с признаками дисплазии и атипии отдельных элементов, которые располагаются отдельными экземплярами, группами и платами.
Основной метод диагностики – гистологическое исследование биоптата, при котором покровный эпителий истончен до нескольких видов клеток, отсутствует гипер– и паракератоз, ядра гипо– и гиперхромные, имеют разную форму и величину, в строме выявляются полнокровные сосуды и лимфоидная, гистиоцитарная инфильтрация, подэпителиальная ткань разрыхлена, отечна.
Аденоматоз шейки матки (атипическая железистая гиперплазия)
Локализуется в цервикальном канале и эктоцервиксе, напоминает подобные изменения в эндометрии и относится к предраковым процессам.В цитологических препаратах обнаруживается много железистых структур, преобладают клетки резервного или призматического эпителия, ядра резко гиперхромны, округлой и палочковидной формы.
При гистологическом исследовании определяется очаговая гиперплазия желез в виде клубка, как в эндометрии. Железы имеют разную форму и величину, расположены близко одна к другой, между ними есть соединительнотканные прослойки. Железы выстланы эпителием, который утратил сходство с шеечным. Эпителий желез индифферентно маточный, низкопризматический с пролиферирующими резервными клетками, цитоплазма не содержит слизи.
При выборе оптимальной тактики ведения больных учитываются следующие факторы: степень тяжести морфологических изменений в тканях шейки матки, возраст больной, анатомическое строение и локализация диспластического процесса, наличие фоновых процессов и экстрагенитальной патологии.
При дисплазии легкой степени чаще проводится локальная деструкция, при средней и тяжелой степени основным методом лечения является радикальное хирургическое вмешательство.
Фоновые и предраковые заболевания эндометрия
К фоновым и предраковым заболеваниям эндометрия относятся гиперпластические процессы, частота которых увеличивается к пременопаузе. Эти процессы развиваются, как правило, при наличии гиперэстрогении. Развитие избыточной пролиферации эндометрия обусловливается как общими нарушениями в эндокринно–метаболическом состоянии, так и местными изменениями в ферментном, иммунном и рецепторном аппаратах слизистой оболочки матки. В эндометрии имеются рецепторы стероидных гормонов, и сбалансированное гормональное воздействие обеспечивает физиологические циклические превращения слизистой оболочки матки в течение менструального цикла. Нарушение же гормонального статуса женщины, повышенная чувствительность эндометрия к эстрогенам приводит к изменению дифференцировки и роста клеток эндометрия и может вызвать гиперпластический процесс.К избыточной пролиферации эндометрия могут привести нарушения центральной регуляции менструальной функции, вызывающие недостаточность лютеиновой фазы и ановуляцию; гиперпластические процессы в яичниках (стромальная гиперплазия, гиперплазия тека–клеток и гранулезных клеток); нарушение тканевой рецепции; нарушение жирового обмена, так как в подкожно–жировой клетчатке идет повышенная продукция эстрогенов за счет метаболизма андростендиона в эстрон; нарушение метаболизма половых гормонов при патологии гепатобилиарной системы и желудочно–кишечного тракта; нарушение функции щитовидной железы.
К фоновым процессам эндометрия относятся: ■ железистая гиперплазия, железисто–кистозная гиперплазия (очаговая и диффузная) ■ полипы эндометрия (железистые, железисто–фиброзные, фиброзные).
Предраковыми заболеваниями эндометрия являются атипическая гиперплазия эндометрия (аденоматоз: очаговый и диффузный), а также аденоматозный полип эндометрия.
Рецидивирующее течение гиперпластических процессов при сочетании их с нейроэндокринной патологией (ожирение, сахарный диабет, гипертоническая болезнь) также расценивается как предрак. К предраку нужно относить гиперплазию эндометрия, особенно рецидивирующую, у женщин в менопаузе. В этом возрасте рецидивирующее течение гиперпластических процессов часто обусловлено такими патологическими процессами в яичниках, как стромальный гипертекоз, текома, гранулезоклеточная опухоль.
По гистологической классификации ВОЗ (1975) все гиперпластические процессы эндометрия подразделяются следующим образом. Железистая, железисто–кистозная гиперплазия и полипы (железистые, железисто–фиброзные, фиброзные) относятся к фоновым процессам. Атипическая гиперплазия или аденоматоз очаговый или диффузный, а также аденоматозный полип расценивают как предраковый процесс в любом возрасте.
Гиперпластические процессы эндометрия развиваются, как правило, на фоне абсолютной или относительной гиперэстрогении и значительно реже – при ненарушенных гормональных соотношениях (И. Д. Хохлова, Е.А. Кудрина, 1996). Кроме того, развитие избыточной пролиферации эндометрия обусловливается как общими нарушениями в эндокринно–метаболическом статусе, так и местными изменениями в ферментном, иммунном и рецепторном аппаратах слизистой матки (О.И. Клыга, 2001).
Железистая и железисто–кистозная гиперплазия эндометрия
Являются близкими понятиями. При гиперплазии эндометрия под воздействием эстрогенов процессы пролиферации наблюдаются не только в железе, но и в строме. При железистой гиперплазии эндометрий макроскопически утолщен до 1–1,5 см, поверхность слизистой при осмотре может быть гладкой или с отдельными полипообразными выступами. При гистологическом исследовании такого эндометрия не выявляется разделения слизистой оболочки на компактный и спонгиозный слои. Железы в строме располагаются бессистемно, на отдельных участках лежат более тесно, на других редко. Как правило, встречаются кистозно–расширенные железы. Вследствие пролиферации эпителия железы удлиняются, извиваются, поэтому одна железа попадает в препарат при срезе многократно, что создает впечатление увеличения их количества.Железистая гиперплазия эндометрия может быть разделена на активную и покоящуюся. Для активной формы типично увеличение числа митозов в эпителии желез эндометрия. Покоящаяся форма характеризуется отсутствием митозов в эпителии желез, однорядным расположением ядер.
Полипы эндометрия
Развиваются вследствие пролиферации базального слоя эндометрия и имеют ножку, часто растут из дна матки и трубных углов, потому что там имеется переход эндометриального эпителия в цилиндрический эпителий маточных труб, железистые полипы исходят из базального и функционального слоя эндометрия. Фиброзные полипы растут из подэпителиального слоя, строма их представлена фиброзной тканью, полип же покрыт эндометрием. Эти полипы нечувствительны к действию гормонов (в отличие от железистых).При атипической гиперплазии, аденоматозном полипе в структуре патологических тканей находят элементы атипии. Аденоматоз характеризуется изменениями в строении желез и эпителия, железы имеют причудливую форму, сильно извиты, тесно прилежат друг к другу, в эпителии возникают структуры типа аденоакантоза с большим числом светлых клеток.
Обоснование факторов риска и формирование группы риска является обязательным условием раннего выявления патологии эндометрия (Е.Е. Вишневская, 1998).
К факторам риска относятся: ■ ановуляция (прежде всего в репродуктивном возрасте) ■ хроническая гиперэстрогения ■ болезнь поликистозных яичников, синдром Штейна–Левенталя ■ бесплодие (эндокринное) ■ гинекологические заболевания: миома матки, эндометриоз ■ гормоноактивные опухоли яичников ■ поздняя (старше 50 лет) менопауза ■ отсутствие половой жизни более 10 лет в репродуктивном возрасте ■ прием эстрогенов более 10 лет ■ злокачественные опухоли репродуктивных органов и толстой кишки в анамнезе ■ ожирение ■ сахарный диабет ■ гиперлипидемия ■ гипотиреоз, который опосредованно ведет к ановуляции ■ заболевания гепатобилиарной системы (нарушение связывания и разрушения эстрогенов) ■ репродуктивный анамнез: первая беременность после 30 лет, рождение ребенка с массой более 4 кг ■ низкий паритет беременностей (менее двух) ■ оперативные и различные инвазивные вмешательства на органах репродуктивной системы.
К группе высокого риска относятся те женщины, у которых вследствие сочетания возрастных, генетических, эндокринных, метаболических и других факторов опасность возникновения патологической трансформации и рака эндометрия очень высока (Е.Е. Вишневская, 1998).
Основными клиническими симптомами гиперплазии эндометрия являются маточные (мено– и/или метроррагии) кровотечения, причиной которых является отторжение гиперплазированного эндометрия с выраженными дистрофическими изменениями и участками некроза, резко расширенными кровеносными сосудами и тромбозом. В репродуктивном возрасте больные жалуются на кровянистые выделения из половых путей между менструациями, до или после месячных, их часто беспокоят контактные кровянистые выделения. В климактерическом периоде женщин беспокоят нерегулярные обильные менструации с длительными кровомазаниями или кровотечения. В менопаузе появляются скудные кратковременные или длительные обильные кровотечения.
Такие больные часто предъявляют жалобы, обусловленные обменными и эндокринными нарушениями: головные боли, ожирение, патологическое оволосение, нарушение сна, периодически возникающая жажда, розовые стрии, пониженная работоспособность, раздражительность.
В схему комплексного обследования пациенток с подозрением на фоновые и предраковые процессы эндометрия обязательно включаются следующие методы. ■ Сбор и оценка анамнеза (нарушение менструальной функции, первичное бесплодие, позднее наступление менопаузы, отягощенный семейный анамнез по раку репродуктивной системы и толстой кишки, наличие гинекологических заболеваний). ■ Гинекологический осмотр, включающий осмотр шейки матки и влагалища с применением ложкообразных зеркал, бимануальное влагалищное и ректовагинальное исследование, при которых обязательно оценивают состояние параметральной клетчатки и клетчатки таза. ■ Мазки для цитологического исследования с эндо– и экзоцервикса и кольпоцитология. ■ Аспирация содержимого из полости матки для цитологического исследования с помощью шприца Брауна, специального катетера, вакуум–аппарата. Полученный материал наносят тонким слоем на предметное стекло и высушивают. Если в аспирационном материале оказываются кусочки ткани, их направляют для гистологического исследования. Цитологическое исследование аспирата из полости матки позволяет определить выраженность пролиферативных изменений эндометрия, однако не дает четкого представления об его патоморфологической структуре. Этот метод используется также для контроля эффективности лечения при динамическом наблюдении за женщинами групп высокого риска. ■ Гистероскопия позволяет детально изучить состояние эндометрия, провести четкую топическую диагностику и проконтролировать результаты выскабливания, прицельного удаления полипов, гиперплазированного эндометрия, так как неполное удаление патологически измененной слизистой матки в последующем может приводить к необоснованному заключению о рецидиве заболевания; выявить сопутствующую внутриматочную патологию (аденомиоз, субмукозные узлы). Гиперплазия эндометрия представлена неравномерно утолщенными складками разной высоты бледно–розового или ярко–розоватого цвета, полипы эндометрия чаще располагаются в устьях маточных труб или в дне матки, бывают единичными и множественными, большинство имеет ножку, форма их разная – от округлой до продолговатой, аденоматозные полипы выглядят более тусклыми, серого цвета с неровной поверхностью. ■ Раздельное диагностическое выскабливание матки и цервикального канала с последующим гистологическим исследованием соскобов – основной метод диагностики фоновых, предраковых процессов и рака эндометрия ■ УЗИ для определения состояния матки и яичников, в том числе с вагинальным датчиком. При нормальном менструальном цикле толщина эндометрия в 1–й фазе 3–4 мм, постепенно увеличивается во 2–й фазе цикла до 12–15 мм. При гиперплазии эти показатели значительно выше. Полипы эндометрия имеют вид округлых или овальных образований с четкими контурами и тонким эхонегативнымободком на фоне расширенной полости матки. В постменопаузе увеличение срединного М–эхо до 5 мм и более может явиться косвенным признаком гиперплазии эндометрия. Все это позволяет расценивать УЗИ как высокоинформативный скрининговый метод исследования эндометрия. Кроме того, имеется возможность одновременного исследования состояния яичников и диагностики опухолей и их поликистоза. ■ Гистерография выполняется при подозрении на сочетанную внутриматочную патологию (аденомиоз, миома матки) или при невозможности проведения гистероскопии. Ее проводят на 7–8–й день цикла. Гиперплазия эндометрия и полип имеют вид дефектов наполнения или неровности контуров матки. В последние годы изучают также стероидные рецепторы в эндометрии; важным является изучение состояния печени, щитовидной железы, ЦНС. ■ Радиоизотопное исследование с 32Р основано на способности радионуклидов накапливаться в гиперплазированном эндометрии в больших, чем в здоровых тканях, концентрациях. Так, в секреторном эндометрии накопление 32Р в среднем 173%, в гиперплазированном – 250–300%. Локальное накопление 32Р до 260% наблюдается при полипах и очаговой гиперплазии. При аденомиозе – 340% и более. Метод не дает представления о патоморфологической структуре эндометрия, но позволяет судить о степени пролиферации клеток.
Организация скрининга патологии эндометрия в группах риска проводится в два этапа (Е.Е. Вишневская, 1998): ■ 1–й этап – в женской консультации оценивают анамнез, берут мазки на онкоцитологию из эндо– и экзоцервикса, проводят аспирацию эндометрия, УЗИ органов малого таза ■ 2–й этап – если данные комплексного исследования не позволяют с уверенностью установить или отвергнуть диагноз патологии эндометрия, то больная направляется в стационар для гистероскопии, раздельного диагностического выскабливания, гистологического исследования полученного материала с целью уточнения характера патологического процесса эндометрия. Важно также установить возможную причину этих патологических изменений эндометрия. Больные с фоновыми и предраковыми заболеваниями эндометрия подлежат диспансерному наблюдению и динамическому обследованию у участкового акушера–гинеколога. Лечение гиперпластических процессов зависит от патоморфологической характеристики эндометрия, возраста, сопутствующей генитальной и экстрагенитальной патологии. Основные направления следующие. ■ Остановка кровотечения путем удаления патологически измененных тканей. В ювенильном возрасте остановка кровотечения проводится в основном с помощью гормональной терапии, в репродуктивном и климактерическом – путем раздельного диагностического выскабливания (РДВ) под контролем гистероскопии до и после выскабливания. Показаниями для РДВ с контролем гистероскопии в пубертатном возрасте является обильное кровотечение, тяжелое состояние, связанное с постгеморрагической анемией (гемоглобин меньше 70 г/л, гематокрит меньше 20%, низкое АД, тахикардия). После остановки кровотечения индивидуально решается вопрос о необходимости лечения постгеморрагической анемии: производится переливание эритроцитарной массы, плазмы, назначают препараты железа, инфузионную терапию для улучшения реологических свойств крови и нормализации водно–электролитного баланса, гемостатические препараты (кальция глюконат, викасол, Е–аминокапроновая кислота, витамины группы В, С, фолиевая кислота). ■ С целью профилактики рецидива гиперплазии эндометрия лечение должно быть направлено на устранение ановуляции, а также нормализацию менструальной функции. Оно заключается в назначении гормональных препаратов с учетом возраста и характера патологического процесса в эндометрии. В пубертатном и раннем репродуктивном возрасте необходимо восстановление овуляторного менструального цикла, в перименопаузальном периоде нужно добиться ритмичной менструальноподобной реакции или стойкого прекращения менструальной функции. В постменопаузе при наличии гиперплазии эндометрия предпочтение отдается оперативному лечению, при противопоказаниях для хирургического вмешательства из–за тяжелой экстрагенитальной патологии возможно проведение гормонального лечения. В ювенильном возрасте гормональное лечение при гиперплазии эндометрия проводится с использованием комбинированных оральных контрацептивов (ригевидон, триквилар, тризистон и др. ) или назначаются чисто гестагенные препараты per os (норколут, примолютнор, дюфастон, норлютен), или внутримышечно (прогестерон, 17–ОПК) во 2–ю фазу менструального цикла. Продолжительность лечения – 3–6 месяцев с УЗ–контролем через 1, 3 и 6 месяцев. В репродуктивном возрасте с целью восстановления нормальной менструальной функции назначают оральные контрацептивы по контрацептивной схеме. Также можно использовать чисто гестагенные препараты внутрь (норколут, примолютнор, провера) с 16–го по 25–й день цикла или внутримышечно (12,5% раствор 17–ОПК – 2 мл, депо–провера – 200 мг, депостат – 200 мг) на 14–й и 21–й день менструального цикла в течение 3–6 месяцев. С целью контроля эффективности лечения через 3 месяца проводят эхографию, цитологическое исследование аспирата из полости матки, через 6 месяцев – контрольное раздельное диагностическое выскабливание с гистероскопией. Для формирования овуляторного менструального цикла в дальнейшем возможно применение стимуляции овуляции. После установления нормального менструального цикла лечение прекращают, но пациентки подлежат диспансерному наблюдению в течение 12–24 месяцев. Показанием для снятия с диспансерного учета является стойкая нормализация менструальной функции. В перименопаузальном периоде гормональное лечение железисто–кистозной гиперплазии эндометрия и полипов предусматривает назначение только чисто гестагенных препаратов внутрь (норколут, примолютнор, норлютен 10 мг) с 16–го по 25–й или с 5–го по 25–й день цикла или внутримышечно (12,5% раствор 17–ОПК – 2 мл, депо–провера – 200 мг, депостат – 200 мг) на 14–й и 21–й день цикла или 1 раз в неделю. Продолжительность лечения – 6 месяцев. Циклично назначают препараты с целью сохранения ритмичных менструальноподобных выделений (до 50 лет), для стойкого прекращения менструальной функции гестагены применяют в непрерывном режиме. Помимо гестагенов пациенткам этого возраста назначают даназол (производное 17–этинилтестостерон) по 400–600 мг ежедневно и гестринон или неместран (производные 19–норспирадов) по 2,5 мг 2–3 раза в неделю в непрерывном режиме в течение 6 месяцев. Эти препараты дают выраженный антигонадотропный эффект, подавляют функцию яичников, вызывают гипоплазию и атрофию эндометрия. Контроль за эффективностью лечения проводят через 3 месяца путем УЗИ, цитологического исследования аспирата из матки; через 6 месяцев – РДВ с ГС. Диспансерное наблюдение после окончания лечения проводят в течение 12–24 месяцев. Показанием для снятия с диспансерного учета является достижение стойкой менопаузы или нормализация менструальной функции. В менопаузе необходимо выявить сопутствующую генитальную и экстрагенитальную патологию. Наличие гиперпластических процессов в этом возрасте требует оперативного лечения (экстирпация матки с придатками, лапароскопическая аднексэктомия, аблация эндометрия). Гормональное лечение в этом возрасте проводится только при тяжелой экстрагенитальной патологии, при которой оперативное лечение противопоказано. В этом случае используют гестагены пролонгированного действия (17–ОПК, депо–провера, депостат) в непрерывном режиме в течение 6 месяцев. Проводят УЗИ, цитологический контроль аспирата из полости матки и РДВ и ГС через 3 и 6 месяцев. Рецидив гиперпластических процессов в репродуктивном возрасте свидетельствует о недостаточной терапии или о наличии в яичниках гормонально активных структур, что требует уточнения их состояния путем эндоскопической биопсии. При отсутствии морфологических изменений в яичниках гормональные препараты назначают в более высоких дозах по контрацептивной схеме или в непрерывном режиме. Рецидив гиперплазии эндометрия в перименопаузальном возрасте или сочетание ее с миомой матки, аденомиозом является показанием к оперативному лечению (электро–, крио–, лазерная аблация эндометрия, экстирпация матки с придатками). ■ Коррекция эндокринных и метаболических нарушений: нормализация жирового обмена (диета с низким содержанием жиров, углеводов, жидкости); нормализация функции щитовидной железы; улучшение функции печени (назначают метионин, линетол, фестал, эссенциале, корсил, легалон, минеральную воду и др.); назначение средств, улучшающих водноэлектролитный обмен (верошпирон, триампур, панангин); улучшающих функции головного мозга (ноотропил, циннаризин, пирацетам и т.д.); проведение седативной терапии (нейролептики, антидепрессанты, транквилизаторы), витаминотерапии: 1–я фаза – витамины группы В, фолиевая кислота, 2–я фаза – витамины группы С, А, Е; назначение десенсибилизирующих препаратов (супрастин, тавегил). ■ Физиолечение – радоновые и йодбромные ванны, эндоназальный электрофорез с витамином В1, иглорефлексотерапия, электро– и лазеропунктура, бальнеолечение. ■ Лечебная физкультура. ■ Криолечение – тотальная или прицельная криодеструкция наконечником диаметром 6 мм при температуре воздействия 170–196°С. После криохирургии отмечается болевой синдром (2–4 ч), длительные водянистые выделения (7–30 дней), иногда с примесью крови. Восстановление менструальной функции после тотального замораживания эндометрия происходит в течение 2–3 месяцев. ■ Лазерная деструкция эндометрия (лазервапоризация) – проводится АИГ–неодимовым и аргоновым лазером под контролем гистероскопии. ■ Диатермокоагуляция (электродеструкция) эндометрия проводится также под контролем гистероскопии.
Показаниями для экстирпация матки с придатками являются: ■ отсутствие эффекта от консервативного лечения ■ рецидив гиперплазии либо переход ее в атипичную форму ■ сочетание гиперплазии эндометрия с патологией матки (миома, аденомиоз), яичников (поликистоз), шейки матки (дисплазия) ■ возраст – менопауза.
Лечение полипов эндометрия зависит от возраста женщины, гистологического вида полипа, функционального состояния эндометрия, яичников, сопутствующей гинекологической патологии. После установления диагноза проводят удаление полипа, раздельное диагностическое выскабливание под контролем гистероскопии.
Фиброзные полипы при наличии секреторной трансформации эндометрия, отсутствии признаков нарушения функции яичников гормональному лечению не подлежат, проводится диспансерное наблюдение у участкового акушера–гинеколога.
При полипах эндометрия на фоне гиперплазии эндометрия необходимо гормональное лечение чистыми гестагенами пролонгированного действия (17–ОПК, депо–провера) в течение 6 месяцев, затем – повторное раздельное диагностическое выскабливание под контролем гистероскопии и гистологическое исследование соскобов.
При рецидивирующих полипах эндометрия необходимо эндоскопическое хирургическое воздействие на зону роста (ножку полипа) – криодеструкция, лазервапоризация, резектоскопия.
Терапия больных с предраковыми процессами эндометрия проводится гестагенами в непрерывном режиме в течение 6 месяцев: 12,5% раствор 17–ОПК – 500 мг внутримышечно 2 раза в неделю; депостат 200–400 мг внутримышечно 1 раз в неделю; депо–провера 200–400 мг внутримышечно 1 раз в неделю; провера – 30 мг ежедневно.
В перименопаузальном периоде эти препараты назначают в более высоких дозах: 17–ОПК – 500 мг 3 раза в неделю, депо–провера и депостат – по 400–600 мг внутримышечно 1 раз в неделю. Курс лечения – 6 месяцев.
В последние годы для лечения аденоматоза эндометрия широко используют препараты с выраженным антигонадотропным действием, такие как даназол – 400–600 мг ежедневно и гестринон – 2,5 мг 2–3 раза в неделю непрерывно в течение 6 месяцев. Эти препараты способствуют подавлению функции яичников и, как следствие, вызывают гипоплазию и атрофию эндометрия.
При наличии аденоматозных полипов в репродуктивном возрасте назначают: чистые гестагены – норколут – 5–10 мг/сут с 16–го по 25–й день цикла, 17–ОПК – 250 мг внутримышечно на 16–й и 21–й день цикла в течение 9–12 месяцев; в постменопаузе – 17–ОПК – 500 мг внутримышечно через день 3 месяца, затем дозу уменьшают.
Для оценки эффективности лечения через 3 месяца проводят эхографию и цитологическое исследование аспирата из полости матки либо радионуклидное исследование, а также раздельное диагностическое выскабливание под контролем гистероскопии. После завершения лечения через 6 месяцев обследование проводят снова. Наступление стойкой менопаузы является прогностически благоприятным признаком.
Повторное выявление аденоматоза эндометрия, а также наличие предрака эндометрия в менопаузе требует оперативного лечения (эндоскопическая аблация эндометрия, экстирпация матки с придатками, лапароскопическая аднексэктомия).
Миома матки
Миома матки – доброкачественная опухоль, состоящая из гладкомышечных и фиброзных соединительнотканных элементов. Название опухоли зависит от того, какие элементы в ней преобладают. Если опухоль состоит преимущественно из мышечных элементов, она называется миомой или лейомиомой, если из соединительнотканных – фибромой, при одинаковом содержании двух видов тканей – фибромиомой. В последние годы гинекологи чаще пользуются названием миома матки, так как выявить преобладающие элементы в опухоли можно только при гистологическом исследовании.Миома встречается у 20% женщин, достигших 35–летнего возраста. Риск заболевания существенно возрастает после 35–40 лет. Частота миомы у женщин, достигших пременопаузального периода, достигает 30–35%. Следовательно, тенденция к росту опухоли возрастает в период, предшествующий и совпадающий с началом климактерия. В постменопаузе, как правило, происходит обратное развитие опухоли. В последние годы эта опухоль нередко выявляется в возрасте 20–25 лет, как казуистические случаи описаны миомы матки у девочек 14–15 лет.
В развитии миомы матки выделяют три последовательные стадии: образование активной зоны роста в миометрии, появляющейся вокруг мелких сосудов с активированным клеточным метаболизмом; рост опухоли без признаков дифференцировки; рост опухоли с дифференцировкой и созреванием клеток мышечной и соединительной тканей. В толще микроскопически видимого узла выявляются структурные участки, свойственные активным зонам роста, которые формируются вокруг сосудов; эти участки обладают высоким уровнем обмена и повышенной сосудисто–тканевой проницаемостью, что, по–видимому, способствует росту опухоли.
Выделяют простые и пролиферирующие опухоли; последние встречаются у каждой четвертой больной с миомой матки. Мышечные клетки в пролиферирующих миомах не атипичны, но более многочисленны в сравнении с миомами без признаков пролиферации. В пролиферирующих миомах нередко возрастает число тучных, плазматических и лимфоидных клеток. В клетках простых миом митозы отсутствуют, в пролиферирующих – митотическая активность повышена. Пролиферирующие миомы в два раза чаще встречаются у больных с быстрорастущими опухолями, чем у больных с умеренным или медленным темпом роста опухолей. Выделение двух указанных форм миомы по особенностям гистогенеза имеет важное практическое значение, особенно при выборе врачебной тактики. Вокруг миоматозных узлов формируется псевдокапсула из мышечных, соединительнотканных элементов, а также за счет брюшинного покрова, по периферии узла проходят кровеносные сосуды. На срезе ткань опухоли гладкая, плотная, розоватобелая (цвет зависит от степени кровоснабжения).
Опухоль начинает расти межмышечно, затем в зависимости от направления роста развиваются: ■ интерстициальные узлы – в толще стенки матки (60–70%) ■ подбрюшинные или субсерозные узлы опухоли ■ субмукозные узлы, растущие в сторону слизистой оболочки матки ■ узлы опухоли, расположенные межсвязочно; при этом интралигаментарный узел находится между листками широкой связки матки, в параметрии рядом с сосудами и мочеточником (редкие случаи) ■ шеечные узлы (располагаются забрюшинно, иногда бывают больших размеров) ■ миома круглой связки матки (крайне редко).
Подбрюшинные узлы могут быть связаны с телом матки широким основанием или растут непосредственно под брюшиной и связаны с маткой только ножкой. Такие узлы очень подвижны, и ножки легко подвергаются перекручиванию. В 95% случаев миома развивается в теле матки и лишь в 5% – в шейке матки.
Миома матки растет и развивается в гормонально–зависимом органе, и это обусловливает выявление ее в период функциональной активности репродуктивной системы. У таких женщин в анамнезе часто имеют место нарушение менструального цикла, генитальный инфантилизм, ювенильные кровотечения, бесплодие эндокринного генеза, а также нарушение функции яичников, связанное с хроническими воспалительными процессами. Нарушение рецепторных зон для гормонов, как правило, бывает следствием местных патологических процессов: травматичные роды, множественные аборты, различные внутриматочные вмешательства, воспалительные процессы матки и придатков.
По современным представлениям, миома матки является дис–гормональной опухолью с нарушениями в системе гипоталамус – гипофиз – кора надпочечников – яичники. Дисгормональная природа опухоли обусловливает наличие ряда метаболических нарушений, функциональную недостаточность печени, а также нередко нарушения жирового обмена. При исследовании продукции гонадотропных гормонов гипофиза выявляется, что на протяжении менструального цикла она не отличается от нормы. Содержание эстриола в крови таких женщин не увеличено, прогестерон находится на нижней границе нормы, что может обусловливать неполноценность 2–й фазы менструального цикла. В то же время количество ядерных эстрогенных рецепторов при миоме матки значительно ниже, чем в норме, также снижено количество суммарных прогестероновых рецепторов. Это свидетельствует о том, что для миомы матки характерно нарушение периферических звеньев, ответственных за репродуктивную функцию. Менструальный цикл при миоме матки может быть овуляторным, однако у многих больных имеют место ановуляции или неполноценность 2–й фазы цикла. У больных миомой матки часто (60–80%) выявляется железисто–кистозная гиперплазия эндометрия, а поликистоз и стромальная гиперплазия яичников – у трети таких пациенток. У женщин с миомой матки отмечаются нарушения функции сердечно–сосудистой системы, нарушения гемодинамики, белкового и жирового обмена, водноэлектролитного баланса, неврологические расстройства (вегето–сосудистая дистония, астеноневротический синдром).
Клиническая картина
Далеко не у всех женщин развитие миомы сопровождается четко определенными клиническими симптомами. Почти у каждой третьей больной опухоль выявляется лишь при очередном гинекологическом исследовании или оказывается случайной находкой при лапароскопии, чревосечении или аутопсии.Наиболее характерные клинические проявления, сопутствующие росту и развитию миомы матки: кровотечения, боли, ощущения тяжести и давления в низу живота, нарушение функции соседних органов. По мере роста опухоли к указанным симптомам могут добавляться проявления как вторичных дегенеративных и воспалительных процессов в ткани опухоли, так и общих системных изменений. Клинические проявления заболевания во многом зависят от расположения, величины и направленности роста миоматозных узлов.
Самым частым симптомом миомы матки является маточное кровотечение, проявляющееся в виде повышенной менструальной кровопотери (гиперполименорея) или реже – ациклических кровотечений. Нормальная менструальная кровопотеря составляет 60–80 мл, увеличение ее свыше 80 мл приводит к развитию железодефицитной анемии, столь часто обнаруживаемой у больных миомой матки. Причины кровотечений при миоме матки довольно разнообразны. Одно из ведущих мест в генезе кровотечений занимают изменения сократительной способности мышечной оболочки матки. К другим возможным причинам кровотечения относятся: нарушения кровообращения в толще мышечной оболочки матки вследствие расширения венозных сплетений или нарушение процесса отслойки функционального слоя эндометрия во время менструальноподобных кровотечений, что связано с железисто–кистозной гиперплазией эндометрия. При наличии множественной миомы матки увеличивается объем полости матки и площадь менструирующей поверхности. Наиболее характерны для субмукозной локализации миоматозных узлов мено– и метроррагии.
У каждой третьей женщины развитию миомы матки сопутствуют болевые ощущения, которые могут иметь различные причины. Даже небольшие узлы могут давать боль, которая чаще всего связана с нарушением иннервации. Нервы и сосуды проходят по капсуле опухоли, поэтому боль появляется при ее растяжении. Боли могут усиливаться после менструации за счет сдавления и ишемии капсулы узла. Довольно часто миома матки сочетается с аденомиозом. При этом боли носят циклический характер, появляются накануне и в первые дни менструации и заканчиваются после ее окончания. При межмышечной локализации узлов небольших размеров наблюдается альгодисменорея; схваткообразные боли характерны для подслизистых миом, а также для перекрута ножки подбрюшинных узлов. Постоянно ноющие боли наблюдаются при выраженном росте узлов, возникновении кровотечений в ткани опухоли, некрозе и дегенерации, ущемлении узлов опухоли в малом тазу, межсвязочном развитии опухоли. Боли относятся к типу непостоянных симптомов. Большие миомы дают боль при сдавлении нервных стволов тазового сплетения, соседних органов.
При большой величине подбрюшинных узлов, ретро– или антецервикальном расположении узлов могут возникать симптомы нарушения функции соседних органов – мочевого пузыря и кишечника. Узел, растущий из передней стенки матки и оказывающий давление на мочевой пузырь, шеечная и перешеечная локализация узлов часто дают задержку мочеиспускания. Это может привести к нарушению трофики, возникновению пузырно–влагалищных свищей. При интралигаментарном расположении узла возможно сдавление мочеточника, крупных магистральных сосудов, нервных сплетений. Мочеточник вытягивается, истончается и во время операции может травмироваться. Такая локализация приводит к нарушению пассажа мочи. Возникает гидроуретер, гидронефроз.
Нарушение функции кишечника бывает по типу запора вследствие застойных явлений в малом тазу, что ухудшает перистальтику кишечника, приводит к образованию геморроя.
В отдельных случаях при возникновении осложнений (некроз, перекрут ножки узла) развивается клиническая картина острого живота. Самым частым из перечисленных осложнений является перекрут ножки узла, который сопровождается появлением резких схваткообразных болей в низу живота и пояснице с последующим появлением признаков раздражения брюшины (рвота, повышение температуры, лейкоцитоз, повышение СОЭ, нарушение функции мочевого пузыря и прямой кишки).
Из вторичных изменений при миоме матки часто наблюдается отек узла. При длительном нарушении микроциркуляции в ткани миомы с явлениями отека развивается асептический некроз, а в дальнейшем иногда происходит размягчение и рассасывание отдельных участков узла с образованием полостей, содержащих серозную жидкость и остатки некротической ткани.
Особого внимания требуют больные с подслизистым ростом миомы матки. Подслизистые миомы деформируют полость матки, они связаны со стенкой матки широким основанием, затем, разрастаясь и как бы отшнуровываясь, сохраняют с ней связь на тонкой мышечной ножке. В дальнейшем по мере роста узла, а также при неизбежных сокращениях окружающего его миометрия ножка истончается, удлиняется, узел постепенно смещается в нижние отделы матки и позже может произойти его рождение. К типичным клиническим проявлениям рождения подслизистых миом относятся нарастающие по мере развития заболевания схваткообразные боли в низу живота и пояснице; при некрозе опухоли появляются жидкие, иногда буроватого цвета бели со зловонным запахом. Происходит раскрытие маточного зева, и при исследовании больной нередко удается пальцем достичь нижнего полюса опухоли. Рождающийся миоматозный узел с явлениями некроза может быть ошибочно принят за саркому или неполный аборт.
Особую форму представляют шеечные миомы, которые чаще всего развиваются из надвлагалищной части шейки матки и располагаются в полости малого таза, частично межсвязочно, реже исходят из влагалищной части шейки матки. Наиболее типичными симптомами являются боли, нарушения детородной функции и симптомы сдавления смежных органов. Все описанные выше клинические проявления заболевания характерны для больных с опухолями больших размеров.
Клинические симптомы миомы матки в значительной степени определяются сочетанием ее с другими гинекологическими и экстрагенитальными заболеваниями.
Диагностика
Диагностика миомы матки, как правило, несложна. Тщательно собранный гинекологический и общий анамнез, а также данные специального исследования при достаточном опыте врача помогают установить диагноз миомы матки без особых затруднений. Наименьшие затруднения вызывает установление диагноза при подбрюшинном расположении миоматозных узлов на широком основании и при множественных межмышечных узлах.При бимануальном исследовании удается пальпировать увеличенную за счет миоматозных узлов матку с неровной поверхностью. Консистенция узлов в большинстве случае бывает равномерно плотной. Данные бимануального гинекологического исследования, производимого после соответствующей подготовки больной к осмотру, позволяют получить представление о форме роста опухоли, ее размерах и локализации, включая межсвязочное расположение узлов. Сопоставление размеров опухоли в процессе контроля за ее ростом (с помощью как обычного гинекологического обследования, так и вспомогательных методов) целесообразно проводить в идентичных условиях, в одни и те же с сроки менструального цикла. При этом следует учитывать, что размеры опухоли могут оставаться стабильными в течение ряда лет.
Для диагностики миомы матки в настоящее время используют широкий спектр дополнительных методов исследования: УЗИ органов малого таза, рентгенологические, эндоскопические и др. Для выявления миомы матки ультразвуковое сканирование проводят в продольных плоскостях и при наполненном мочевом пузыре, а также влагалищным датчиком не только для характеристики вариантов и формы роста опухоли, но и для оценки ее размеров. Ультразвуковое исследование открывает широкие возможности для контроля темпа роста миомы и эффективности проводимого консервативного лечения.
Разнообразные методы рентгенологического исследования также позволяют получить информацию о локализации и размерах миомы матки. К их числу относятся простая гистеросальпингография (ГСГ), рентгенотелевизионная гистеросальпингография (РТВ ГСГ), флебография. Применение каждого метода должно проводиться по строго обоснованным показаниям при невозможности установления диагноза с помощью обычных клинических методов и ультразвукового исследования.
Для проведения ГСГ применяются водорастворимые контрастные вещества, что позволяет выполнять исследование контуров полости матки. В случае подозрения на подслизистую миому матки первый рентгеновский снимок следует выполнить после введения в полость матки 1–2 мл водного контраста для выявления симптомов «обволакивания» или «обтекания» подслизистого узла, так как при тугом заполнении полости матки он не всегда выявляется. Второй снимок выполняют после введения всего объема контраста. При подслизистом узле миомы выявляется увеличение полости матки, деформация и «дефект наполнения».
Кроме контрастирования полости матки в клинической практике определенное место занимает рентгенологическое исследование органов малого таза на фоне искусственно созданного пневмоперитонеума (геникография, пневмогеникография, газовая рентгенопельвиография и т.п.). Подобная методика используется также в сочетании с ГСГ и рентгенологическим исследованием смежных органов (толстый кишечник, органы мочевыделения). Такой прием представляет большие диагностические возможности для проведения дифференциального диагноза между подбрюшинной миомой матки и опухолями яичников, опухолями гениталий и опухолями экстрагенитальной локализации. Применение газовой рентгенопельвиографии позволяет выявить контуры внутренних половых органов, их размеры и форму, взаимоотношения их различных отделов и смежных тазовых органов. В случае межмышечной локализации узлов опухоли на пневмогеникограмме определяется увеличенная матка, обычно имеющая неровные контуры. Однако у некоторых больных при обширных анатомических изменениях в малом тазу (повторные чревосечения по поводу различных гинекологических заболеваний, обширный спаечный процесс в малом тазу и т. д.) для уточнения диагноза приходится прибегать к биконтрастной рентгенопельвиографии.
Наряду с описанными методами обследования больных с миомой матки в настоящее время широко применяются эндоскопические методы исследования: лапаро–, кульдо–, гистеро– и кольпоцервикоскопия. При заполнении позадиматочного пространства опухолью или мощными спайками, при фиксированном загибе матки кзади и пороках развития половых органов предпочтение отдается лапароскопии. После перенесенного перитонита и бывших ранее чревосечений в связи с возможностью сращений передней брюшной стенки и кишечника, при чрезмерном ожирении в области передней брюшной стенки безопаснее прибегать к кульдоскопии. Гистероскопия служит ценным дополнительным методом исследования больных с миомой матки, дает возможность визуально выявить внутриматочную патологию, определить точную локализацию и величину миоматозных узлов и степень распространенности патологического процесса, а при необходимости позволяет произвести прицельную биопсию. Применение гистероскопии в комплексе с другими методами представляет несомненную практическую ценность, ибо позволяет существенно снизить процент диагностических ошибок и своевременно выбрать рациональный метод лечения.
Для исследования состояния эндометрия используется цитологическое исследование содержимого полости матки, а также гистологическое исследование соскоба слизистой шейки и тела матки, который может быть получен как с помощью обычного выскабливания под гистероскопическим контролем, так и путем вакуум–кюретажа.
Дифференциальная диагностика при миоме матки проводится со злокачественными новообразованиями матки (саркома, рак, аденокарцинома), опухолями яичников, воспалительными заболеваниями матки и придатков, беременностью.
Лечение
Для лечения миомы матки используются консервативные и оперативные методы лечения. Консервативное лечение применяется на разных стадиях развития опухоли, а также после хирургических вмешательств.При решении вопроса о консервативном лечении необходимо учитывать: наличие онкологической настороженности, морфофункциональную характеристику опухолевого роста, специфическую чувствительность ткани миометрия к различным гормональным влияниям.
К числу основных направлений лечения относятся: ■ раннее выявление и лечение сопутствующих гинекологических и экстрагенитальных заболеваний ■ коррекция гормонального статуса ■ лечение анемии, волемических и метаболических расстройств ■ торможение роста опухоли ■ нейротропное воздействие.
Рациональная диета, коррекция метаболических нарушений необходимы практически всем женщинам с данным заболеванием независимо от избранной лечебной тактики.
Наиболее перспективным из всех видов гормонального воздействия при миоме матки у женщин как репродуктивного возраста, так и в пре– и перименопаузе до настоящего времени остается применение гестагенов, относящихся к производным норстероидного ряда. Положительное влияние норстероидов при миоме матки обусловлено их многосторонним биологическим эффектом, включающим воздействие не только на отдельные звенья репродуктивной системы женщины, но и на минералкортикоидную функцию коры надпочечников. Аналоги норэтистерона (норколут, примолутнор) назначают в дозе 5 мг с 16–го по 25–й день цикла в течение 6–9 месяцев. При этом отмечается сокращение менструальной кровопотери, улучшение общего состояния, торможение роста и уменьшение размеров опухоли. В последние годы широко применяются гестагены пролонгированного действия (17–ОПК, депо–провера), агонисты гонадолиберина.
Из физических методов лечения используются шейно–лицевая ионогальванизация, эндоназальный электрофорез, магнитные поля в импульсном режиме, ультразвук. Применение электрофореза цинка и меди основывается на их способности влиять на обмен стероидных гормонов.
Показаниями к оперативному лечению являются: ■ большие размеры опухоли (свыше 15 недель беременности) даже при отсутствии жалоб ■ кровотечения, приводящие к анемизации больной ■ наличие симптомов нарушения функции соседних органов (учащенное мочеиспускание, нарушение акта дефекации) ■ быстрый рост опухоли (4 недели в год). ■ подбрюшинный узел на ножке, так как существует опасность его перекрута ■ подслизистая миома матки ■ интралигаментарное расположение узла ■ шеечные узлы миомы матки ■ сочетание миомы матки с рецидивирующей гиперплазией эндометрия, опухолью яичника ■ некроз миоматозного узла ■ бесплодие, связанное с миомой матки.
Больным с миомой матки производят радикальные и консервативные операции. К каждому из этих методов имеются показания и противопоказания. Объем операции зависит от возраста женщины, ее общего состояния, степени анемизации, сопутствующих заболеваний, расположения и величины миоматозных узлов.
Консервативные операции производятся для сохранения генеративной или менструальной функции женщины.
При миоме матки выполняют следующие консервативные операции: энуклеация миоматозных узлов, дефундация и высокая ампутация матки. Консервативные операции по поводу миом матки сопряжены с риском возникновения рецидивов заболевания в 12–14% случаев. Однако после консервативнопластических операций на матке многие женщины беременеют и рожают, что вполне оправдывает проведение реконструктивнопластических операций. Показанием к консервативной миомэктомии является молодой возраст женщины (до 40 лет).
Следует с сожалением отметить, что удельный вес реконструктивно–пластических операций среди общего числа оперативных вмешательств, производимых у больных миомой матки, все еще сравнительно невысок, хотя отмечается возрастающая тенденция к проведению щадящих органосохраняющих операций с использованием эндоскопической техники. В частности, получили распространение удаление узлов миомы матки небольшого размера с помощью оперативной лапароскопии, хирургическое воздействие на узел опухоли подслизистой локализации. Противопоказаниями для выполнения консервативных операций при миоме матки являются тяжелое состояние больной, выраженная анемия, рецидив миомы матки после проведенной ранее консервативной миомэктомии, вторичные изменения в узлах, сопутствующие воспалительные процессы в малом тазу.
К радикальным операциям относятся надвлагалищная ампутация и экстирпация матки.
Полное удаление матки проводится при наличии сопутствующих заболеваний: гиперпластических процессов эндометрия, патологических изменений шейки матки, злокачественных процессов в эндометрии, возникновении саркоматозного роста в миоматозном узле. Эти изменения чаще возникают у женщин старшего возраста.
Вопрос об удалении придатков решается во время операции. Если в молодом возрасте при консервативной миомэктомии имеются кистозные изменения яичников, показана их клиновидная резекция, если же сопутствующая опухоль яичника – удаление опухоли. В постменопаузе при наличии патологических изменений яичников их следует удалить.
Операции по поводу миомы матки производят в экстренном и плановом порядке. Экстренные показания возникают при кровотечении, связанном с опасностью для жизни больной, перекруте ножки миоматозного узла, некрозе или нагноении миоматозного узла. Подготовка больной имеет большое значение для исхода оперативного вмешательства. Необходимо полное клиническое обследование. Для определения объема операции обязательно проведение цитологического исследования, расширенной кольпоскопии, а при необходимости – биопсии шейки матки, гистероскопии с раздельным диагностическим выскабливанием слизистой шейки и тела матки.
Профилактика миомы матки должна включать в себя соблюдение рационального гигиенического режима с периода полового созревания, планирование семьи с исключением инвазивных вмешательств для прерывания беременности, коррекцию возможных гормональных нарушений и адекватное лечение возникающих гинекологических заболеваний и акушерских осложнений. Следует также избегать чрезмерных инсоляций и неадекватных температурных воздействий в поздней репродуктивной фазе и на начальных стадиях климактерия.
Доброкачественные опухоли яичников
Доброкачественные опухоли яичников являются распространенной патологией среди женщин. По данным литературы, частота опухолей яичников составляет 8–19% всех гинекологических заболеваний; 11–12% чревосечений выполняется в гинекологических отделениях по поводу опухолей яичников или их осложнений. Отсутствие специфической симптоматики, опасность малигнизации, тенденция к росту заболеваемости делают проблему особенно актуальной.Этиология и патогенез. Этиология опухолей яичников неизвестна, однако, учитывая большое разнообразие этих опухолей, можно предположить мультифакторность начала развития опухолей яичников. К факторам риска развития опухолей яичника относятся нарушения функциии яичников, хронические воспалительные заболевания гениталий, оперативные вмешательства в малом тазу в анамнезе, маточные кровотечения в постменопаузальном периоде.
До настоящего времени все еще не имеется цельного, научно обоснованного представления о патогенезе опухолей яичников, однако определенные моменты и звенья патогенеза известны. В возникновении опухолей большую роль играет нарушение гормонального баланса в системе гипофиз – яичник. Механизм возникновения опухоли можно схематически представить следующим образом: первичное ослабление функции яичников и снижение уровня овариальных эстрогенов; компенсаторное повышение уровня гонадоторопинов, в первую очередь ФСГ.
В условиях длительного повышения секреции ФСГ в яичниках возникает вначале диффузная, затем очаговая гиперплазия и пролиферация клеточных элементов, которая может закончиться образованием опухоли (Н.Д. Селезнева, Б.И. Железнов,1982).
Возрастные изменения в организме женщины также способствуют развитию опухолей, что может быть связано с иммунными нарушениями (И.В. Дуда, Вл.И. Дуда, В.И. Дуда,1999).
Определенная роль в развитии опухолей яичников, в частности серозных цистаденом, принадлежит онкогенным вирусам: вирусу папилломы человека и вирусу герпеса 2–го серотипа, вызывающим также заболевания шейки матки.
Большое значение имеют генетические факторы. Известно, что опухоли нередко развиваются у близнецов, близких родственников. Стрессовые факторы также играют определенную роль как индуцирующие факторы развития опухолей. Опухоли яичников отличаются от опухолей других органов большим разнообразием морфологического и клинического течений.
Классификация
В соответствии с Международной классификацией опухолей яичников (ВОЗ, 1997) выделяют:Эпителиальные опухоли. ■ Серозные опухоли: • доброкачественные: ♦ цистаденома и папиллярная цистаденома ♦ поверхностная папиллома ♦ аденофиброма и цистаденофиброма • пограничные (потенциально низкой степени злокачественности): ♦ цистаденома и папиллярная цистаденома ♦ поверхностная папиллома ♦ аденофиброма и цистаденофиброма • злокачественные: ♦ аденокарцинома, папиллярная аденокарцинома и папиллярная цистаденокарцинома ♦ поверхностная папиллярная карцинома ♦ злокачественная аденофиброма и цистаденофиброма. ■ Муцинозные опухоли: • доброкачественные: ♦ цистаденома ♦ аденофиброма и цистаденофиброма;. • пограничные (потенциально низкой степени злокачественности) • злокачественные: ♦ аденокарцинома и цистаденокарцинома ♦ злокачественная аденофиброма и цистаденофиброма. ■ Эндометриоидные опухоли: • доброкачественные: ♦ аденома и цистаденома ♦ аденофиброма и цистаденофиброма • пограничные (потенциально низкой степени злокачественности): ♦ аденома и цистаденома ♦ аденофиброма и цистаденофиброма • злокачественные: ♦ карцинома: аденокарцинома; аденоакантома; злокачественная аденофиброма и цистаденофиброма ♦ эндометриоидная стромальная саркома ♦ мезодермальные (мюллеровы) смешанныеопухоли, гомологичные и гетерологичные. ■ Светлоклеточные (мезонефроидные) опухоли: • доброкачественные: аденофиброма • пограничные (потециально низкой степени злокачественности) • злокачественные: карцинома и аденокарцинома. ■ Опухоли Бреннера: • доброкачественные • пограничные (пограничной злокачественности) • злокачественные. ■ Смешанные эпителиальные опухоли: • доброкачественные • пограничные (потециально низкой степени злокачественности) • злокачественные. ■ Недифференцированная карцинома. ■ Неклассифицируемые эпителиальные опухоли.
Опухоли стромы полового тяжа. ■ Гранулезо–стромально–клеточные опухоли. • гранулезоклеточная опухоль (доброкачественная, злокачественная) • группа теком–фибром: ♦ текома (доброкачественная, злокачественная) ♦ фиброма ♦ неклассифицируемые. • смешанные. ■ Андробластомы, опухоли из клеток Сертоли и Лейдига: • высокодифференцированные: ♦ тубулярная андробластома; опухоль из клеток Сертоли ♦ тубулярная андробластома с накоплением липидов; опухоль из клеток Сертоли с накоплением липидов (липидная фолликулома Лесена) ♦ опухоль из клеток Сертоли и Лейдига ♦ опухоль из клеток Лейдига; опухоль из хилюсных клеток • промежуточной (переходной) дифференцировки • низкодифференцированные (саркоматоидные) • с гетерологическими элементами. ■ Гинандробластома. ■ Неклассифицируемые опухоли стромы полового тяжа.
Липидоклеточные опухоли.
Герминогенные опухоли. ■ Дисгерминома. ■ Опухоль эндодермального синуса. ■ Эмбриональная карцинома. ■ Полиэмбриома. ■ Хорионэпителиома. ■ Тератомы. • незрелые • зрелые: ♦ солидные ♦ кистозные: дермоидная киста; дермоидная киста с малигнизацией • монодермальные (высокоспециализированные): ♦ струма яичника ♦ карциноид ♦ струма яичника и карциноид ♦ другие.
Гонадобластома. ■ Чистая (без примеси других форм). ■ Смешанная (с дисгерминомой и другими формами герминогенных опухолей).
Опухоли мягких тканей, неспецифичные для ячников.
Неклассифицированные опухоли.
Вторичные (метастатические) опухоли.
Опухолевидные процессы. ■ Лютеома беременности. ■ Гиперплазия стромы яичников и гипертекоз. ■ Массивный отек яичника. ■ Единичная фолликулярная киста желтого тела. ■ Множественные фолликулярные кисты (поликистозные яичники). ■ Множественные лютеинизированные фолликулярные кисты и/или желтые тела. ■ Эндометриоз. ■ Поверхностные эпителиальные кисты–включения (герминальные кисты–включения). ■ Простые кисты.
■. Воспалительные процессы. ■ Параовариальные кисты.
К наиболее часто встречающимся доброкачественным опухолям и опухолевидным образованиям яичников относят следующие: ■ Эпителиальные опухоли: • серозные (цистаденома и папиллярная цистаденома, поверхностная папиллома, аденофиброма и цистаденофиброма) • муцинозные (цистаденома, аденофиброма и цистаденофиброма) • опухоли Бреннера (доброкачественные). ■ Опухоли стромы полового тяжа: • гранулезоклеточная опухоль, текома, фиброма. ■ Герминогенные опухоли: • тератомы (зрелые и незрелые), струма яичника. ■ Опухолевидные процессы яичников: • фолликулярные кисты • кисты желтого тела • тека–лютеиновые кисты • параовариальные кисты.
Клиническая картина
Клиническая картина доброкачественных опухолей яичников характеризуется, с одной стороны, разнообразием симптомов, нередко специфических для каждого вида опухоли, с другой – их скудностью.Эпителиальные опухоли яичников (цистаденомы). Наибольшую группу доброкачественных опухолей яичников представляют цистаденомы. Они составляют приблизительно около 1/3 опухолей этого органа. В зависимости от характера строения эпителиальной выстилки и внутреннего содержимого их подразделяют на серозные и муцинозные цистаденомы. В свою очередь их делят на гладкостенные и папиллярные.
Гладкостенная серозная цистаденома (гладкостенная цилеоэпителиальная кистома) составляет 11% от всех опухолей яичников и 45% – от числа всех цистаденом (В.И. Бычков с соавт., 1969). По данным Н.Д. Селезневой и Б.И. Железнова (1982), возраст больных с этими опухолями колеблется от 15 до 71 года (в основном от 30 до 50 лет) и составляет в среднем 42,2 года. В большинстве случаев опухоль односторонняя. Макроскопически поверхность опухоли гладкая. Форма ее круглая или овальная. Чаще опухоль однокамерная, реже имеет двух– или многокамерное строение. Величина цистаденом различна: от нескольких миллиметров до 30 см в диаметре. Очень больших размеров они достигают лишь в отдельных случаях (в единичных наблюдениях их содержимое составляет 20 л). Обычно содержимое опухоли представлено прозрачной серозной жидкостью соломенного цвета, в которой могут быть обнаружены мелкие мерцающие кристаллы (Н.Д. Селезнева, Б.И. Железнов, 1982). Эпителий, выстилающий стенку опухоли, однорядный, чаще кубический, реже цилиндрический. Эпителий на отдельных участках стенки может терять реснички и уплощаться, а местами на большом протяжении отсутствовать (Н.Д. Селезнева, Б.И. Железнов, 1982).
 Рис. 8.1. Серозная цистаденома яичника. Поперечное ТА–сканирование: 1 – матка; 2 – опухоль
Рис. 8.1. Серозная цистаденома яичника. Поперечное ТА–сканирование: 1 – матка; 2 – опухоль
В большинстве случаев какая–либо симптоматика при гладкостенных кистомах отсутствует. Иногда больные обращаются к врачу после того, как сами замечают увеличение живота или прощупывают опухоль. В ряде случаев могут отмечаться боли в низу живота или крестце. При больших цистаденомах иногда наблюдаются запоры или учащенное мочеиспускание. Асцит при гладкостенных серозных цистаденомах наблюдается только при очень больших размерах опухоли. Малигнизация опухоли отмечается в 1,4% случаев (рис. 8.1).
На сканограммах гладкостенные серозные цистаденомы изображаются как полностью анэхогенные жидкостные образования с гладкой поверхностью. По данным В.Н. Демидова
А.И. Гус, Л.В. Адамян (1999), в подавляющем большинстве случаев гладкостенные цистаденомы бывают односторонние. Диаметр опухоли колеблется от 5 до 16 см. Форма опухоли небольших размеров в основном округлая, больших – овальная. Цистаденомы небольших размеров (до 6 см в диаметре) обычно располагаются сзади и сбоку от матки. Толщина стенки образования составляет 0,1 см.
Форма шаровидная или овальная, поверхность гладкая, блестящая, белесоватого цвета. Содержимое кистомы прозрачное, с желтоватым оттенком. По внешнему виду серозные гладкостенные цистаденомы напоминают фолликулярные кисты, но в отличие от ретенционных образований опухоль имеет различную окраску – от голубоватой до белесовато–серой, что обусловлено неравномерной толщиной капсулы.
Папиллярная серозная цистаденома наблюдается реже гладкостенных серозных цистаденом. По данным Е.Н. Петровой и В.С. Фриновского (1962), они составили 7,8% от всех опухолей яичников и 34,8% – от числа всех цистаденом. Возраст больных с этой опухолью колеблется от 15 до 74 лет.
Основной особенностью этих цистаденом является наличие папиллярных разрастаний. Они располагаются неравномерно на стенках отдельных камер и могут возникать не в каждой из них. Своим видом разрастания напоминают цветную капусту или коралловые кустики. Множественные очень мелкие папиллы придают поверхности стенки бархатистый вид. В некоторых опухолях папиллярные разрастания в более мелких камерах заполняют всю ее полость, создавая солидный участок. Папиллы в основном мягкие, нежные. Однако на тех участках, где происходит отложение извести, они очень плотные, твердые. В ряде случаев папиллы могут прорастать на наружную поверхность опухоли и обсеменять париетальную брюшину и соседние органы. Диссеминация сосочков по брюшине, по мнению Н.Д. Селезневой и Б.И. Железнова (1982), не свидетельствует о злокачественности папиллярных цистаденом. Папиллы имеют соединительнотканную основу, состоящую из рыхлой ткани с проходящими капиллярами. Эпителиальный покров сосочков однорядный, характеризуется большим сходством с трубным эпителием. Некоторые папиллярные цистаденомы отличаются очень богатым ветвлением тонких сосочков, почти лишенных соединительнотканной основы, покрытых местами многоядерным, нередко атипичным, эпителием. Такие пролиферирующие папиллярные цистаденомы часто рассматриваются как особенно склонные к переходу в рак (Н.Д. Селезнева, Б.И. Железнов, 1982).
Клиническое течение папиллярных цистаденом, особенно на ранних стадиях заболевания, часто бессимптомно. Основные клинические проявления заболевания: боли в низу живота, увеличение размеров живота, дизурические явления. Довольно часто при сосочковых цистаденомах отмечается асцит. При двусторонних опухолях он встречается в 5 раз чаще, чем при односторонних. Одним из наиболее серьезных осложнений папиллярной цистаденомы является ее способность перехода в рак. Частота малигнизации опухоли может достигать 50%. В настоящее время эхография является ведущим методом в диагностике папиллярных цистаденом. На сканограммах (рис. 8.2, 8.3) определяются папиллярные цистаденомы круглой, реже овальной формы. Их размеры колеблются от 1,8 см до 12 см в диаметре. Однако в основном они имеют 3,5–7 см в диаметре. По данным В.Н. Демидова, А.И. Гуса, Л.В. Адамян (1999), в подавляющем большинстве случаев опухоли бывают односторонними; двусторонняя их локализация отмечена только в 6% наблюдений. В основном папиллярные цистаденомы располагаются сбоку и сзади от матки. В подавляющем большинстве случаев опухоль однокамерная (двухкамерность отмечена в 15,2% наблюдений). Толщина стенок и перегородок опухоли колеблется от 1 до 2 мм. В 80,2% наблюдений в полости опухоли определяется различное количество мелкодисперсной взвеси, которая смещалась при перкуссии образования. Наиболее характерным эхографическим признаком папиллярных серозных цистаденом является наличие на их внутренней поверхности плотных пристеночных разрастаний. В основном разрастания множественные, диаметром от 0,2 до 1,7 см, округлой формы. Одной из основных особенностей папиллярных разрастаний является губчатость их внутреннего строения. Исчезновение губчатости разрастаний свидетельствует об их склерозе и кальцинозе.
 Рис. 8.2. Папиллярная серозная цистаденома. Поперечное ТВ–сканирование: 1 – опухоль
Рис. 8.2. Папиллярная серозная цистаденома. Поперечное ТВ–сканирование: 1 – опухоль
 Рис. 8.3. Папиллярная серозная цистаденома яичника. Поперечное ТВ–сканирование: 1 – опухоль
Рис. 8.3. Папиллярная серозная цистаденома яичника. Поперечное ТВ–сканирование: 1 – опухоль
Опухоль обычно имеет вид образования с плотной, непрозрачной белесоватой капсулой. Содержимое цистаденом бывает жидким, прозрачным и имеет коричневый, красноватый или грязно–желтый цвет.
Поверхностная серозная папиллома (поверхностный папилломатоз, энвертирующая папиллярная кистома) – редкая опухоль яичника. Источником опухоли является поверхностный эпителий яичников, происходящий из целомического эпителия половых складок эмбриона. Макроскопически опухоль напоминает цветную капусту и имеет папиллярное строение. В патологический процесс может вовлекаться либо вся поверхность яичника, либо какая–то его часть. В отдельных случаях на разрезе опухоли могут быть обнаружены мелкие кистозные полости, заполненные папиллярными разрастаниями. По данным Н.Д. Селезневой и Б.И. Железнова (1982), при поверхностной папилломе значительно чаще, чем при папиллярной цистаденоме, встречается двустороннее поражение яичников, отмечаются боли, наблюдается асцит. В ряде случаев эпителиальный компонент серозной поверхности папилломы яичника может подвергаться озлокачествлению. Если это происходит, то в патологический процесс вовлекается брюшина малого таза. Несмотря на то что размеры серозной поверхностной папиллярной карциномы могут не превышать 5 см в диаметре, возможно раннее появление отдаленных метастазов (Н. Фокс, 1976). Выделяют два варианта эхографического изображения поверхностной серозной папилломы яичника (В.Н. Демидов, А.И. Гус, Л.В. Адамян,1999). При первом варианте на сканограммах (рис. 8.4, 8.5) отмечается локальное увеличение расстояния от фолликулярного аппарата до наружной поверхности яичника до 0,5 см и более, в то время как на других участках оно остается нормальным и составляет 0,3–0,4 см. Отмечается также большая губчатость тканей в зоне утолщения по сравнений с другими участками яичника. При втором варианте поверхностная серозная папиллома на сканограммах определяется как различных размеров опухолевидное образование губчатой структуры средней эхогенности и высокой звукопроводимости. Одной из характерных особенностей данной опухоли является то, что она непосредственно примыкает к одному из яичников, в то время как сами яичники в своем эхографическом изображении остаются нормальными.
 Рис. 8.5. Поверхностная папиллома яичника. Поперечное ТВ–сканирование: 1 – матка; 2 – папиллома
Рис. 8.5. Поверхностная папиллома яичника. Поперечное ТВ–сканирование: 1 – матка; 2 – папиллома
 Рис. 8.4. Поверхностная папиллома яичника: 1 – яичник; 2 – папиллярные разрастания
Рис. 8.4. Поверхностная папиллома яичника: 1 – яичник; 2 – папиллярные разрастания
Опухоль выглядит как образование с плотной капсулой белесоватого цвета с сосочковыми разрастаниями на наружной поверхности капсулы. При выраженной диссеминации капиллярных разрастаний эвертирующую опухоль можно принять за рак.
Муцинозная цистаденома – довольно частая опухоль яичников. По данным Н.Д. Селезневой, Б.И. Железнова (1982), она составляет 14,7% по отношению ко всем опухолям яичников. Возраст больных с муцинозной кистомой колеблется от 21 до 60 лет. Чаще опухоль односторонняя; двусторонняя локализации наблюдается только в 5,1% наблюдений. Опухоль часто бывает больших размеров – 15–30 см. Муцинозные цистаденомы почти всегда многокамерные. Наружная и внутренняя поверхность гладкая. Стенки большей частью тонкие, но местами их толщина может достигать 5–10 мм. Камеры заполнены тягучим (прозрачным или мутным) желеобразным содержимым. Весьма характерным для муцинозных цистаденом является их способность к образованию слизи (муцина), которая содержит гликопротеины и гетерогликаны. Стенку цистаденомы выстилает одноядерный высокий цилиндрический эпителий с базально расположенным ядром, имеющим сходство с эпителием цервикального канала. Иногда в муцинозных цистаденомах обнаруживается кубический или уплощенный эпителий. Папиллярные разрастания в муцинозных цистаденомах наблюдаются редко (от 0,4 до 15%). Опухоль при небольших размерах обычно ничем клинически себя не проявляет. При значительных размерах отмечается увеличение живота. В ряде случаев могут отмечаться боли в низу живота, запоры, дизурические расстройства. Озлокачествление опухоли наблюдается у 7,6% больных (Н.Д. Селезнева, Б.И. Железнов, 1982).
На сканограммах (рис. 8.6, 8.7) небольшие муцинозные кистомы (до 6 см в диаметре) в основном располагаются сбоку и сзади от матки, а больших размеров образования (свыше 7 см) – выше ее дна. Толщина капсулы опухоли составляет 1–2 мм. Часто перегородка располагается на каких–либо отдельных участках кистозной полости. В ряде случаев множественные перегородки формируют образование наподобие пчелиных сот. Одним из наиболее характерных признаков муцинозной цистаденомы является наличие в ее полости средней или высокой эхогенности несмещаемой мелкодисперсной взвеси (В.Н. Демидов, А.И. Гус, Л.В. Адамян,1999).
 Рис. 8.7. Муцинозная цистаденома яичника. Поперечное ТВ–сканирование: 1 – опухоль
Рис. 8.7. Муцинозная цистаденома яичника. Поперечное ТВ–сканирование: 1 – опухоль
 Рис. 8.6. Муцинозная цистаденома. Поперечное ТВ–сканирование: 1 – опухоль
Рис. 8.6. Муцинозная цистаденома. Поперечное ТВ–сканирование: 1 – опухоль
Поверхность опухоли большей частью неровная, с многочисленными выпячиваниями из–за наличия камер. Размер опухоли колеблется в широких пределах. Опухоль неправильной формы с плотной, толстой непрозрачной капсулой, цвет – от белесоватого до синюшного. При боковом освещении видна граница между камерами.
Опухоли Бреннера представляют собой фиброэпителиальные опухоли, состоящие из стромы яичника и гнезд многогранных или крупных эпителиальных клеток переходного типа. По данным литературы, частота опухолей Бреннера среди всех овариальных новообразований варьирует от 0,6 до 2,6% (Н.Д. Селезнева, Б.И. Железнов,1982). Опухоль Бреннера возникает не только из поверхностного эпителия яичника, но и из хилюса.
Величина опухоли в основном колеблется от нескольких миллиметров до размеров головы взрослого человека.
Опухоли Бреннера чаще бывают односторонними, притом левосторонняя их локализация встречается чаще. Опухоль имеет округлую или овоидную форму и гладкую наружную поверхность. Капсула обычно отсутствует. Некоторые из опухолей бывают окружены овариальной тканью, подвергшейся сдавлению. Опухоль по внешнему виду, плотности и волокнистому строению напоминает фиброму. Цвет ее белесый или белесовато–серый. В ткани опухоли могут наблюдаться мелкие полости, содержимое полостей слизистое.
Средний возраст больных с доброкачественной опухолью Бреннера варьирует от 46,2 до 56,5 года. При небольших размерах опухоли она обычно ничем себя не проявляет. При значительных размерах отмечается увеличение живота. В ряде случаев могут отмечаться боли в низу живота, запоры, дизурические расстройства. Озлокачествление опухоли наблюдается редко (Н.Д. Селезнева, Б.И. Железнов,1982).
Опухоли стромы полового тяжа. Гранулезоклеточные и тека–клеточные опухоли яичников принадлежат к феминизирующим эстрогенпродуцирующим опухолям яичников. Следствием гормональной активности этих опухолей являются высокий уровень эстрогенов в крови, моче, кале и в самих опухолях, нарушения менструального цикла в молодом возрасте и у девушек, маточные кровотечения у женщин в период постменопаузы и у детей. Высокий уровень эстрогенов в организме приводит к патологическому «омоложению» в период постменопаузы, преждевременному половому созреванию детей и задержке овуляции у молодых женщин, результатом чего является бесплодие.
В эндометрии нередко наблюдаются гиперпластические процессы в виде железистой, железисто–кистозной и атипической гиперплазии, полипов и очагового аденоматоза; иногда отмечается выраженная гипертрофия мышечной ткани матки.
Гранулезоклеточная опухоль (фолликулома, фолликулярная эпителиома, фолликулярная аденома, феминизирующая мезенхиома) может встречаться в любом возрасте, но наиболее часто – в возрасте 40–60 лет. В 3,5–4% случаев опухоль встречается у девочек в препубертатном возрасте (Б.И. Железнов, 1980). Частота гранулезоклеточных опухолей, по данным разных авторов, составляет от 0,6 до 3% по отношению ко всем новообразованиям яичников (И.С. Краевская, М.Ф. Глазунов
1961) и 5–10% по отношению к злокачественным опухолям яичников (R.E. Scully, 1977). Гранулезоклеточная опухоль чаще бывает односторонней. В зависимости от макроскопического строения гранулезоклеточные опухоли могут быть плотными, плотноэластической и мягковатой консистенции. Опухоли солидного строения чаще бывают относительно небольшого размера. Кистозный тип гранулезоклеточной опухоли встречается очень редко. Величина новообразований варьирует от 3–4 мм до размеров головы взрослого человека, в среднем составляя около 10 см в диаметре. Форма опухоли округлая, овоидная, почковидная. Капсула ее достаточно четко выражена: поверхность гладкая или неровная.
Тека–клеточная опухоль (текома) встречается в любом возрасте, но наиболее часто (у 65–70% больных) в период постменопаузы. Текомы составляют 2,1% по отношению ко всем новообразованиям яичников. Опухоли обычно бывают односторонние, исключительно редко – двусторонние. Размеры их колеблются от миниатюрных до значительных, в среднем составляя около 8 см в диаметре. Форма опухоли округлая или овальная, поверхность гладкая, реже неровная (при дольчатом строении). Капсула у текомы обычно отсутствует. На разрезе опухоль желтоватого цвета с серо–белого цвета волокнистыми прослойками. Текомы развиваются из клеток наружной и внутренней оболочек фолликулов, стромы яичников, эмбриональной мезенхимы. Наиболее часто в качестве источника возникновения теком указываются овариальная строма и стромальная гиперплазия.
Фиброма яичников развивается из стромы яичников. В Международной гистологической классификации опухолей яичников (1973, 1977) они занимают отдельное место среди группы опухолей, именуемых «текомы – фибромы». Фиброма является нефункционирующей опухолью. Частота фибром по отношению ко всем опухолям яичников варьирует от 2,5 до 12,6%. Встречаются, как правило, у пожилых женщин. Фибромы яичника чаще бывают односторонними. Величина их варьирует от нескольких миллиметров до размера головы взрослого человека и более. Обычно опухоль бывает округлой, овоидной или почковидной формы, с гладкой поверхностью, плотной, нередко деревянистой консистенции. Плотность образования приводит к тому, что опухоль нередко принимают за подбрюшинный миоматозный узел. Цвет опухоли белый или серо–белый. На разрезе фиброма имеет волокнистое строение, при некрозе (последний, как и отек, чаще обнаруживается в центральных отделах опухоли) на фоне белого цвета наблюдаются участки желтоватого цвета. Фиброма яичника может сопровождаться синдромом Мейгса (асцит, гидроторакс, анемия). Фибромы яичника отличаются медленным ростом. Малигнизируются крайне редко.
Согласно определению ВОЗ (1977) к андробластомам относятся опухоли, содержащие клетки Сертоли и Лейдига разной степени зрелости, а в некоторых случаях – индифферентные гонадные клетки эмбрионального вида. В данной классификации указывается, что высокодифференцированные формы этих опухолей являются почти всегда доброкачественными, в то время как менее дифференцированные более склонны к озлокачествлению.
Высокодифференцированные андробластомы в зависимости от типа клеток и функциональной активности бывают: ■ из клеток Сертоли ■ из клеток Сертоли с накоплением липидов ■ из клеток Сертоли и Лейдига ■ из клеток Лейдига.
Опухоль из клеток Сертоли (тубулярная андробластома) встречается очень редко. Величина рассматриваемых новообразований варьирует от 2 до 18 см в диаметре. Капсула их часто четко выражена, строение нередко дольчатое. На разрезе они обычно солидные, желтой, оранжевой или оранжево–серой окраски; в отдельных наблюдениях обнаруживаются мелкие полостные образования. Во всех случаях опухоль из клеток Сертоли является доброкачественной.
Опухоль из клеток Сертоли с накоплением липидов (синоним – тубулярная андробластома с накоплением липидов) – исключительно редкий вариант описанной выше опухоли из сертолиевых клеток. Отличительной особенностью ее является насыщенность липидами клеток Сертоли, вследствие чего последние увеличены в объеме. Ранее эта опухоль была описана под названием «липидная фолликулома Лесена». Рассматриваемая опухоль характеризуется преимущественно эстрогенной активностью.
Опухоль из клеток Сертоли и Лейдига (синонимы – тубулярная аденома, тестикулярная аденома, опухоль Пика, тубулярная андробластома) впервые была описана L. Pick в 1905 г. Эта опухоль, имеющая сходство с незрелыми или крипторхическими яичками, встречается редко, однако несколько чаще, чем тубулярная андробластома. Опухоль односторонняя. Диаметр опухолей подобного типа варьирует от 0,5 до 20 см, в среднем составляя 5–6 см. Они обычно хорошо отграничены, имеют четко выраженную капсулу. В небольших опухолях можно обнаружить ткань яичника. В отдельных наблюдениях при наличии мелких опухолей из клеток Сертоли и Лейдига удается установить место их развития: обычная локализация их в таких случаях – область ворот яичника. Поверхность рассматриваемых опухолей, как правило, гладкая. На разрезе они имеют желтый, желто–белый или желто–серый цвет, нередко дольчатое строение. Иногда в опухоли встречаются мелкие кистозные образования, очаговые кровоизлияния. Опухоль образована из тубулярных структур, выстланных клетками сертолиевого типа, между которыми располагаются в том или ином количестве клетки Лейдига; последние и определяют андрогенное действие. Однако эти опухоли бывают и инертными в гормональном отношении, редко феминизирующими. Как и при тубулярной андробластоме, у некоторых женщин с высокодифференцированной опухолью из клеток Сертоли и Лейдига обнаружены врожденные аномалии внутренних половых органов, в частности отсутствие матки. Рассматриваемая подгруппа опухолей характеризуется склонностью к сочетанию с тестикулярной феминизацией.
Опухоль из клеток Лейдига (синонимы – опухоль из хилюсных клеток, хилюсно–клеточная опухоль, лейдигома, интерстициально–клеточная опухоль, симпатикотропная опухоль) аналогична лейдигоме яичка. Опухоль состоит исключительно из клеток Лейдига (хилюсных клеток). Согласно определению ВОЗ (1977) эта опухоль может быть представлена как андробластома с односторонним развитием, или опухоль из клеток Сертоли–Лейдига, или может возникать непосредственно из хилюсных клеток. Опухоль встречается в основном у женщин 25–35 лет. Она почти всегда односторонняя. Размеры опухоли варьируют от 1 до 15 см. Очень редко они бывают более 10 см в поперечнике; большая их часть диаметром менее 5 см. Обычно опухоль, развивающаяся в области ворот яичника и мезовария, представляет собой четко отграниченный, но не имеющий капсулы узел. Консистенция опухоли, как правило, мягкая, особенно до фиксации. Поверхность опухоли коричневая, желтая или оранжевая, на разрезе чаще всего желтой, иногда охряно–желтой окраски. Наиболее часто подобная опухоль сопровождается симптомами дефиминизации (аменорея, бесплодие, атрофия молочных желез), сменяющимися затем явлениями вирилизации (оволосение по мужскому типу, снижение тембра голоса, гипертрофия клитора). Морфологически высокодифференцированные опухоли из клеток Лейдига являются доброкачественными.
Герминогенные опухоли. Тератомы яичников. Тератомы яичников возникают в результате формирования специфических тканей в эмбриональном периоде развития (Е.Е. Вишневская, 1997). Зародышевые клетки–предшественники половых клеток содержат генетическую информацию, которая позволяет им дифференцировать структуры всех трех зародышевых листков – эктодермы, мезодермы и энтодермы. В зависимости от степени дифференциации тканей тератомы делят на зрелые и незрелые. Соотношение зрелых и незрелых тератом составляет примерно 1/100 (Б.И. Зыкин с соавт., 1997).
Зрелая кистозная тератома (доброкачественная кистозная тератома, дермоидная киста, дермоид, тератоид) полностью состоит из дифференцированных зрелых тканей. Обычно опухоль выстлана эпидермисом, хотя встречаются также ткани эндодермального и мезодермального происхождения (Н.Д. Селезнева, Б.И. Железнов,1982). Зрелые тератомы составляют 26,3% от числа всех доброкачественных опухолей яичников. В основном они обнаруживаются у больных в возрасте 18–45 лет, однако в ряде случаев выявляются и у детей (Е.Е. Вишневская, 1997
В.И. Кулаков с соавт., 1994). Расположение опухоли в основном одностороннее, двусторонняя локализация отмечается только в 8,2% случаев (Н.Д. Селезнева, Б.И. Железнов, 1982). Форма зрелых тератом различна: шаровидная, овоидная, почковидная и др. Часто опухоль имеет длинную ножку. Размеры опухоли различны – от косточки вишни до головы взрослого человека. Зрелая тератома располагается сбоку и сзади от матки, при размерах более 6 см в диаметре – выше ее дна.
Стенка зрелой тератомы гладкая и блестящая, имеет сухожильно–белый цвет, иногда с желтым оттенком. Наружная ее поверхность нередко похожа на нормальную кожу. Стенка состоит из плотной кожистой соединительной ткани. Внутренняя поверхность стенки выстлана цилиндрическим или кубическим эпителием. В стенке тератомы имеется плотное образование. Оно называется дермоидным отростком, паренхиматозным или головным бугорком. Это образование является главной частью опухоли. Оно может иметь различную форму и величину. Редко наблюдается несколько бугров. Величина бугра чаще не больше грецкого ореха; в редких случаях он достигает величины куриного яйца. Форма бугра различная. Иногда он бывает плоским, а в ряде случаев может даже вообще не обнаруживаться. В редких случаях бугор отшнуровывается и остается соединенным со стенкой опухоли посредством очень тонкой ножки, включающей питающие его кровеносные сосуды. Бугор состоит из зрелых тканей; часто встречаются зубы (в основном в количестве 1–3). На разрезе бугра можно видеть жировую, иногда костную и хрящевые ткани, часто встречаются волосы. В редких случаях обнаруживаются части кишечной трубки, щитовидная железа (И.Ф. Жордания, 1962; Е.Н. Петрова, B.C. Фриновский, 1962; Н.Д. Селезнева, Б.И. Железнов, 1982). Тератома на разрезе напоминает мешок, имеющий одну или несколько полостей. Они заполнены продуктами жизнедеятельности дермоидного бугорка и представляют собой густую массу, состоящую из сала и волос. Сравнительно редко опухоль содержит мутную жидкость, в которой взвешены шарики величиной с косточку вишни, являющиеся комками сала. Зрелые тератомы растут медленно по 15–25 лет и более. Жалобы при зрелой тератоме обычно встречаются редко. Болевой синдром отмечается в небольшом числе наблюдений. В ряде случаев может встречаться перекрут ножки опухоли и ее нагноение. Чрезвычайно редко (1–2%) при зрелой тератоме возникает злокачественный процесс. В основном это плоскоклеточный рак (рис. 8.8, 8.9).
 Рис. 8.8. Зрелая тератома яичника. Поперечное ТА–сканирование: 1 – мочевой пузырь; 2 – тератома; 3 – дермоидный бугорок
Рис. 8.8. Зрелая тератома яичника. Поперечное ТА–сканирование: 1 – мочевой пузырь; 2 – тератома; 3 – дермоидный бугорок
 Рис. 8.9. Зрелая тератома яичника. Поперечное ТВ–сканирование: 1 – тератома, 2 – дермоидный бугорок
Рис. 8.9. Зрелая тератома яичника. Поперечное ТВ–сканирование: 1 – тератома, 2 – дермоидный бугорок
Струму яичника относят к тем тератомам, в которых тиреоидная ткань преобладает или является значительным компонентом опухоли. Однако в 20–30% опухоль бывает представлена только тканью щитовидной железы. На долю струмы приходится 1–3% доброкачественных тератом яичника. Макроскопически опухоль, как правило, представляет собой одностороннее образование неправильной формы с гладкой поверхностью размерами от 1 до 20 см. В 60–70% случаев она имеет вид четко ограниченного узла, который располагается в стенке, перегородке доброкачественной тератомы (10%) или муцинозной цистаденомы (10%). На разрезе опухоль имеет плотную, местами мягкую или «мясистую» консистенцию, солидное или солидно–кистозное строение. Кистозные включения заполнены коричневым или желто–белым содержимым. Струма содержит йод, но в меньшем количестве, чем нормальная щитовидная железа. В 5–15% случаев она клинически проявляет себя признаками гипертиреоза. Малигнизация опухоли наблюдается редко (Н.Д. Селезнева, Б.И. Железнов, 1982). Струма яичника на сканограммах (рис. 8.10, 8.11) изображается как различных размеров образование мелкогубчатого строения преимущественно средней эхогенности, приближающееся в отдельных случаях в своем эхографическом изображении к ткани щитовидной железы. Эхография может способствовать правильной диагностике струмы яичника. Однако для точной постановки данного диагноза необходимо тщательное исследование всех элементов опухоли.
 Рис. 8.10. Струма яичника. Поперечное ТВ–сканирование: 1 – опухоль; 2 – элементы железистой ткани
Рис. 8.10. Струма яичника. Поперечное ТВ–сканирование: 1 – опухоль; 2 – элементы железистой ткани
 Рис. 8.11. Струма яичника. Поперечное ТВ–сканирование: 1 – опухоль; 2 – элементы железистой ткани
Рис. 8.11. Струма яичника. Поперечное ТВ–сканирование: 1 – опухоль; 2 – элементы железистой ткани
Незрелая тератома (тератобластома, солидная тератома, эмбриома, эмбриональная тератома, тератокарцинома) относится к злокачественным новообразованиям яичников. По данным А. Д. Нечаевой (1987), частота незрелых тератом составляет 8,2% по отношению ко всем злокачественным опухолям неэпителиального происхождения. Опухоль выявляется в любом возрасте, однако чаще встречается у молодых девушек и женщин 20–30 лет (Е.Н. Петрова, B.C. Фриновский, 1962; Е.Е. Вишневская, 1997). Эти опухоли характеризуются очень быстрым ростом, гематогенным и лимфогенным метастазированием, в том числе и в отдаленные органы (Е.Н. Петрова
B.C. Фриновский, 1962; Е.Е. Вишневская, 1997). Размеры опухоли обычно большие. Форма ее неправильно–овоидная или круглая. Цвет опухоли белесоватый с разнообразными оттенками в зависимости от наличия кровоизлияний или распада. Консистенция ее мягкая; местами может быть плотной. Поверхность ровная или бугристая, иногда с просвечивающими небольшими кистами. На разрезе чаще имеет солидно–кистозное, реже – солидное строение. Солидные участки могут быть мозговидными или более плотными. Кистозные полости имеют различную величину (рис. 8.12). Содержимое их жидкое, водянистое или густое, слизистое, часто мутноватое или геморрагическое. Кровоизлияния встречаются часто. Макроскопически в опухоли могут определяться кость, хрящ, зубы, жировая ткань и редко – волосы (Е.Н. Петрова, B.C. Фриновский, 1962). Микроскопически опухоль состоит из тканей различной степени зрелости и дифференцировки с выраженной наклонностью к разрастанию. Ткани, отличаясь эмбриональным характером, соответствуют разным стадиям эмбриогенеза. Органоидные образования встречаются значительно реже, чем в зрелой тератоме, и являются менее дифференцированными. Полное вызревание тканей, имеющих уже определенную дифференцировку, часто отсутствует. Нередко незрелые ткани отличаются неясной тканевой принадлежностью (Е.Н. Петрова, B.C. Фриновский, 1962).
Часто клиническим признаком незрелой тератомы является наличие в малом тазу опухолевого плотного образования неравномерной консистенции и ограниченной подвижности. Больные с незрелой тератомой обычно жалуются на боли в низу живота, общую слабость, вялость, быструю утомляемость, снижение трудоспособности. Менструальная функция чаще не нарушена. Со стороны крови выявляются изменения, присущие злокачественным опухолям. Часто отмечается повышение уровня α–фетопротеина в крови. При распаде опухоли может быть субфебрильная температура. Иногда при быстрорастущей незрелой тератоме клиническая картина заболевания из–за интоксикации, распада и метастазирования опухоли бывает схожа с таковой общесоматического или простудного заболевания. Это часто приводит к проведению неадекватного лечения и запущенности процесса к моменту распознавания заболевания (Е.Н. Петрова, B.C. Фриновский, 1962; Е.Е. Вишневская, 1997).
 Рис. 8.12. Незрелая тератома яичника (тератобластома). Поперечное ТА–сканирование: 1 – тератома
Рис. 8.12. Незрелая тератома яичника (тератобластома). Поперечное ТА–сканирование: 1 – тератома
 Рис. 8.13. Фоликулярная киста. Поперечное ТВ–сканирование: 1 – киста
Рис. 8.13. Фоликулярная киста. Поперечное ТВ–сканирование: 1 – киста
 Рис. 8.14. Фоликулярная киста. Продольное ТВ–сканирование: 1 – киста
Рис. 8.14. Фоликулярная киста. Продольное ТВ–сканирование: 1 – киста
Опухолевидные процессы (кисты яичников). Фолликулярная киста – это доброкачественное ретенционное образование, характеризующееся отсутствием истинного пролиферативного роста. Возникает вследствие скопления жидкости в неовулирующем фолликуле. Накопление жидкости в полости кисты происходит за счет транссудации ее из кровеносных сосудов. Фолликулярные кисты составляют 83% от всех кист яичников. Развитие этих кист происходит в основном в репродуктивном возрасте. В редких случаях они могут возникать в постменопаузе (в первые 5 лет после окончания менструаций), т.е. когда еще частично сохраняется гормональная функция. Макроскопически фолликулярные кисты представляют собой небольшие гладкостенные и тонкостенные кистозные образования. Содержимое их – это прозрачная светлая лимоно–желтого цвета жидкость. Иногда в полости кисты может определяться примесь крови. Стенка кисты состоит из фолликулярного эпителия, расположенного в несколько слоев. Кнаружи за слоем фолликулярного эпителия располагаются тека–лютеиновые клетки и затем фиброзная соединительная ткань, часто с наличием гиалиновой мембраны. По мере увеличения кисты фолликулярный эпителий претерпевает дистрофические изменения, истончается, слущивается и исчезает. При этом величина образований, теряющих эпителий, составляет 4 см и более.
В большинстве случаев клинически фолликулярные кисты себя ничем не проявляют, однако могут встречаться у женщин с нарушением менструального цикла и воспалением придатков матки. Они обнаруживаются при гинекологическом исследовании и эхографии. На эхограммах (рис. 8.13, 8.14) фолликулярные кисты представляют собой однокамерные образования круглой формы, располагающееся в основном сбоку или сзади от матки. Они редко бывают двусторонними. Диаметр кист колеблется от 2 до 12 см. Внутренняя структура полностью однородная, анэхогенная, обладает высокой звукопроводимостью. Стенка фолликулярной кисты ровная, гладкая; ее толщина составляет в среднем 1,0±0,3 мм. Особенностью фолликулярных кист является то, что они подвергаются постепенной регрессии и обычно исчезают в течение 1–3 менструальных циклов. Динамическое эхографическое наблюдение показывает, что в течение 1–го менструального цикла спонтанной регрессии подвергается 25,9%, 2–го – 33,4%, 3–го – 40,7% фолликулярных кист.
 Рис. 8.15. Киста желтого тела. Продольное ТВ–сканирование: 1 – киста
Рис. 8.15. Киста желтого тела. Продольное ТВ–сканирование: 1 – киста
 Рис. 8.16. Киста желтого тела. Поперечное ТВ–сканирование: 1 – киста; 2 – труба; 3 – фимбрии
Рис. 8.16. Киста желтого тела. Поперечное ТВ–сканирование: 1 – киста; 2 – труба; 3 – фимбрии
Эндоскопическая картина: фолликулярные кисты обычно односторонние, их диаметр 2–12 см, форма круглая, они имеют тонкую стенку, однокамерное строение и тугоэластическую консистенцию. Капсула гладкая, белесоватая или бледно–розовая, содержимое прозрачное. Собственная связка яичника не изменена. Ход сосудов мезоовариума имеет обычную направленность.
Киста желтого тела возникает вследствие скопления жидкости и крови в месте лопнувшего фолликула. Эти кисты составляют 5% от всех кистозных образований яичников. Они возникают только при двухфазном менструальном цикле. Содержимое кист обычно геморрагическое. В клетках стенки кисты желтого тела происходят те же изменения, что и в менструальном желтом теле, т.е. наблюдаются последовательно все 4 стадии развития. Клинически киста желтого тела обычно ничем себя не проявляет. В отдельных случаях в момент ее возникновения могут отмечаться боли в низу живота. Киста имеет размеры от 2 до 8 см. Описано 4 эхографических варианта строения кисты желтого тела (рис. 8.15–8.18).
 Рис. 8.18. Киста желтого тела. Продольное ТВ–сканирование: 1 – киста
Рис. 8.18. Киста желтого тела. Продольное ТВ–сканирование: 1 – киста
При 1–м варианте наиболее часто киста имеет сетчатое строение средней эхогенности. В большинстве случаев сетчатый компонент заполняет всю или большую часть кисты.
 Рис. 817. Киста желтого тела. Продольное ТА–сканирование: 1 – мочевой пузырь; 2 – киста; 3 – матка
Рис. 817. Киста желтого тела. Продольное ТА–сканирование: 1 – мочевой пузырь; 2 – киста; 3 – матка
При 2–м варианте содержимое кисты однородно и анэхогенно. В ее полости определяются множественные или единичные нежные, полные или неполные, неправильной формы перегородки.
При 3–м варианте в полости кисты определяются плотные высокой эхогенности включения (сгустки крови). Чаще они имеют небольшие размеры (1–1,7см) в диаметре, единичные (1–3) и локализуются пристеночно. Эти образования могут иметь как неправильную форму, так и форму булавы или веретена.
При 4–м варианте содержимое кисты полностью однородное и анэхогенное. Ее эхографическое изображение напоминает фолликулярную кисту. Несмотря на различия внутреннего строения кист желтого тела, их звукопроводимость всегда высока. Толщина стенок колеблется от 2 до 4 мм, составляя в среднем 2,8±0,4 мм.
У большинства женщин кисты регрессируют самопроизвольно. Продолжительность инволюции зависит от размеров, а не от внутреннего строения кисты. В отличие от фолликулярных кист кисты желтого тела в подавляющем большинстве наблюдений (86,2%) регрессируют в течение 1–2 менструальных циклов.
Эндоскопическая картина: кисты желтого тела, как правило, односторонние, хотя не исключено наличие небольшой кисты (до 4 см в диаметре) и в другом яичнике. Размеры кисты – 2–8 см, форма округлая или овальная, стенка кисты утолщена, отмечают складчатость внутренней поверхности, содержимое геморрагическое. Киста имеет синюшно–багровый оттенок. Собственная связка яичника не изменена. Ход сосудов мезоовариума имеет обычную направленность. При энуклеации кисты стенка с большим трудом отделяется от ткани яичника, нередко рвется.
Тека–лютеиновые кисты возникают вследствие избыточной лютеинизации тека–клеточного компонента под влиянием повышенной продукции гормонов передней доли гипофиза и воздействия хорионического гонадотропина (ХГ). Они образуются непосредственно из фолликулов при пузырном заносе или хорионкарциноме. Возраст больных в основном репродуктивный. Тека–лютеиновые кисты чаще двусторонние. Они могут иметь различные размеры, достигая в единичных случаях 30 см. Форма кист в основном круглая или овальная, а поверхность чаще дольчатая. Стенка кисты тонкая, гладкая. Их внутреннее содержимое представлено прозрачной, янтарного или кровянистого оттенка жидкостью. Иногда появление этих кист сопровождается выпотом в брюшную полость. На сканограмме (рис. 8.19, 8.20) тека–лютеиновые кисты выявляются как многокамерные образования, диаметр которых колеблется от 4 до 9 см. Часто они двусторонние и расположены выше дна матки. Стенка кисты тонкая (около 1 мм). Содержимое тека–лютеиновых кист однородное, анэхогенное.
При подозрении на тека–лютеиновые кисты необходимо осуществлять исследование матки для выяснения наличия пузырного заноса или хорионкарциномы. Тека–лютеиновые кисты обычно спонтанно исчезают в течение 1–3 месяцев после ликвидацииосновного заболевания.
 Рис. 8.19. Тека–лютеиновая киста. Поперечное ТВ–сканирование: 1 – киста
Рис. 8.19. Тека–лютеиновая киста. Поперечное ТВ–сканирование: 1 – киста
 Рис. 8.20. Тека–лютеиновая киста. Поперечное ТВ–сканирование: 1 – киста
Рис. 8.20. Тека–лютеиновая киста. Поперечное ТВ–сканирование: 1 – киста
Паровариальные кисты относят к образованиям перитубарной области и связочного аппарата органов репродуктивной системы. Они возникают из зачатков мезонефрального протока, онофорона, папраофорона, а также целомического эпителия. Паровариальные кисты составляют 10–12% от всех опухолевых и опухолевидных образований придатков матки. В основном они возникают в возрасте от 20 до 40 лет. Однако в ряде случаев паровариальные кисты могут возникать у девочек и девушек пубертатного возраста. Их размеры колеблются от 3 до 15 см. Располагаются между листками широкой связки.
Паровариальные кисты имеют тонкую стенку (от 1 до 3 мм). В ней различают два слоя: наружный, являющийся как бы капсулой кисты, образующийся из листков широкой связки, и внутренний, представляющей собой собственно стенку кисты. Внутренний слой состоит их соединительной ткани и мышечных пучков, а изнутри киста выстлана однослойным кубическим эпителием. Киста заполнена прозрачной водянистой жидкостью с небольшим содержанием белка.
Клинически паровариальные кисты часто ничем себя не проявляют. Единственно, на что жалуются пациентки, – это боли в низу живота (69,8%). Клиническая диагностика паровариальной кисты представляет значительные трудности. Основной и практически единственный ультразвуковой признак паровариальных кист (рис. 8,21, 8.22) – выявление отдельно расположенного яичника. Только при диаметре кисты более 5 см во всех случаях при трансвагинальном УЗИ определяется неизмененный яичник. В отличие от фолликулярных кист и кист желтого тела паровариальные кисты не регрессируют. К основным осложнениям паровариальных кист относится перекрут их ножки. Крайне редким осложнением является озлокачествление.
 Рис. 8.22. Паровариальная киста. Продольное ТВ–сканирование: 1 – яичник; 2 – киста
Рис. 8.22. Паровариальная киста. Продольное ТВ–сканирование: 1 – яичник; 2 – киста
 Рис. 8.21. Паровариальная киста. Продольное ТВ–сканирование: 1 – яичник; 2 – киста
Рис. 8.21. Паровариальная киста. Продольное ТВ–сканирование: 1 – яичник; 2 – киста
Эндоскопическая картина: одностороннее образование размером 10–15 см в диаметре, прочная, содержимое прозрачное. В зависимости от величины кисты маточная труба располагается по–разному, иногда она распластана на поверхности кисты. Паровариальная киста и яичники определяются как отдельные анатомические образования.
Диагностика
Своевременная диагностика опухолей яичников чрезвычайна важна, так как от правильного поставленного диагноза зависят тактика ведения больной, своевременность хирургического вмешательства и оперативный доступ.Наиболее эффективной представляется поэтапная схема обследования женщин для выявления опухоли яичников (Е.Е. Вишневская, А.Е. Океанов, Т.М. Литвинова,1998).
Первый этап проводится в смотровых кабинетах, женских консультациях, при осуществлении массовых профилактических осмотров. Основной задачей на этом этапе является выявление женщин, имеющих факторы риска развития опухолей яичника. К таковым относятся женщины с ранним и поздним менархе, первичным бесплодием, маточными кровотечениями в постменопаузе и поздней (после 50 лет) менопаузой, а также пациентки с миомой матки, генитальным эндометриозом, эстрогенным типом кольпоцитологической реакции в постменопаузе, ранее болевшие раком органов репродуктивной системы и желудочно–кишечного тракта, женщины, у которых близкие родственники болели раком органов репродуктивной системы, больных ожирением, гиперлипидемией и сахарным диабетом.
Схема комплексного обследования больных с подозрением на опухоли яичников должна включать: ■ оценку анамнестических данных о наличии факторов риска ■ пальпацию и перкуссию живота ■ гинекологический осмотр с обязательным ректовагинальным исследованием ■ взятие мазков из экто– и эндоцервикса на атипические клетки у пациенток всех возрастов и из сводов влагалища на тип кольпоцитологической реакции у женщин менопаузального возраста ■ бимануальное исследование с фиксацией шейки матки пулевыми щипцами ■ зондирование полости матки ■ трансвагинальная или трансректальная пункция брюшной полости через задний свод влагалища и цитологическое исследование материала; УЗ–сканирование (с использованием абдоминального и трансвагинального датчиков) для определения патологических образований в брюшной полости, их характера, особенностей кровотока ■ КТ и МРТ – эти методы позволяют до операции осуществлять дифференциальную диагностику между доброкачественными и злокачественными новообразованиями, уточнять данные клинического исследования о локализации, размерах, форме, контурах, внутренней структуре опухоли и взаимоотношении ее с окружающими органами и тканями. Точность КТ и МРТ превышает 90% и позволяет определить состояние клетчатки параметрия и регионарных лимфатических узлов ■ определение онкомаркеров: определение содержания антигена СА–125 используют для исключения рака яичника. Это исследование обязательно при подготовке к операциям, особенно у женщин в постменопаузе. Концентрация антигена менее 35 ЕД/мл характерна для доброкачественных образований. Однако чувствительность и специфичность метода варьируют, содержание СА–125 может увеличиваться при различных доброкачественных заболеваниях. Так, у 80% женщин наблюдается повышенное содержание антигена на фоне беременности, эндометриоза, миом, острого и хронического сальпингита. Поэтому сочетание опухоли яичника с повышенной концентрацией маркера СА–125 не может служить достоверным признаком злокачественного характера опухоли ■ эндоскопическая диагностика – точность лапароскопического диагноза в отношении опухолей и опухолевидных образований яичников составляет 96,5%. Лапароскопическая диагностика объемных образований яичников предполагает также дифференциальную диагностику между функциональными кистами и истинными опухолями.
Функциональные кисты имеют тонкую просвечивающуюся стенку. У фолликулярных кист просвечивает прозрачное бесцветное содержимое. Кисты желтого тела имеют желтоватое содержимое с геморрагической примесью, что придает капсуле этих кист синюшно–желтый цвет. Серозная цистаденома имеет более толстую капсулу, содержимое соломенного цвета. Эндометриоидная киста имеет толстую капсулу темносинего оттенка, часто прорастающую в ворота яичника, содержимое шоколадного цвета.
Собственная связка яичника, пораженная опухолью, бывает утолщенной, удлиненной. При наличии в яичнике функциональной кисты собственная связка яичника не изменена.
Ход сосудов мезоовариума при истинных опухолях яичников имеет форму гребня; при функциональных кистах этого явления не наблюдается.
Лечение
Поскольку паровариальные кисты наблюдаются у молодых женщин, предпочтительным методом является хирургическая лапароскопия.Осложнения при доброкачественных опухолях яичников следующие: ■ Перекрут ножки опухоли. Анатомическая ножка опухоли состоит из растянутых воронко–тазовой и собственной связки яичника и части заднего листка широкой связки. В ножке кистомы проходят сосуды, питающие опухоль (яичниковая артерия, анастомоз ее с маточной артерией), лимфатические сосуды и нервы. Хирургическая ножка – образование, которое приходится пересекать во время операции при удалении опухоли. Чаще всего в хирургическую ножку помимо анатомической входит маточная труба. Перекрут ножки опухоли иногда связан с резкими движениями, переменой положения тела, физическим напряжением. Чаще он происходит у девочек и девушек. Нередко перекрут возникает во время беременности и в послеродовом периоде. Может произойти внезапно, остро или постепенно, может быть полным или частичным. Может произойти перекручивание ножки любой кистомы. В этом отношении наиболее опасны подвижные опухоли, не спаянные с окружающими органами. При полном перекруте ножки опухоли резко нарушаются кровоснабжение и питание в опухоли, появляются кровоизлияния и наступает некроз. Клинически это проявляется картиной острого живота. Возникают внезапные резкие боли, напряжение передней брюшной стенки, положительный симптом Щеткина – Блюмберга, нередко появляются тошнота или рвота, парез кишечника, задержка стула, реже понос. Температура повышена. Пульс частый. У больной отмечаются бледность, холодный пот; общее состояние тяжелое, артериальное давление снижено. Опухоль увеличена в размере за счет кровоизлияний. Попытки ее смещения вызывают резкую болезненность. В этих случаях больные нуждаются в срочной операции – удалении опухоли. При частичном перекруте ножки опухоли все отмеченные симптомы развиваются более медленно и вначале менее выражены. ■ Сращение опухоли с соседними органами и ее инфицирование. Возникновению сращений благоприятствуют перекрут ножки опухоли и связанные с этим нарушения питания, кровоизлияния в стенку опухоли. Перекрут ножки опухоли и образование сращений способствует развитию редкого в настоящее время осложнения – инфицирования опухоли. Прорыв опухоли в соседние органы, разрыв ее стенки – редкие осложнения, однако часто встречаются у детей. При разрыве стенки опухоли обычно возникают острые боли в животе и клинические симптомы шока; реже наблюдаются симптомы внутрибрюшного кровотечения вследствие разрыва сосудов, питающих опухоль. Разрыв стенки кистомы создает опасность дальнейших осложнений (имплантация элементов опухоли; метастазирование при злокачественной опухоли; развитие псевдомиксомы брюшины при разрыве муцинозной кистомы). Малигнизация опухоли – самое тяжелое осложнение. Все доброкачественные опухоли яичников следует рассматривать как предраковые состояния, поэтому они подлежат только хирургическому лечению. При энуклеации функциональных кист стенку трудно отделить полностью, не нарушая ее целостности. Стенку кисты истинных опухолей при определенных технических навыках можно полностью отделить.
Лечение доброкачественных опухолей яичников осуществляется хирургическим методом.
При выполнении оперативных вмешательств необходимо соблюдать следующие правила: ■ в детском и пубертатном возрасте следует стремиться к сохранению неизмененной ткани яичников как при односторонних, так и при двусторонних опухолях ■ в репродуктивном возрасте также должны соблюдаться принципы органосохраняющего или щадящего лечения (оставление второго яичника, матки) ■ в постменопаузальном периоде показана радикальная операция – удаление матки с придатками ■ в предменопаузальном периоде (46–49 лет) вопрос о тактике лечения решается индивидуально, в зависимости от вида опухоли, ее потенциальной возможности малигнизации. В случае сохранения второго яичника целесообразно сделать его резекцию для патологоанатомического исследования. В.Н. Серовым и Л.И. Кудрявцевой (2001) была предложена скрининговая программа дифференцированного ведения больных с опухолями яичников.
Алгоритмы диагностики опухолей малого таза представлены в схемах 8.1–8.5. Схема 8.1
 Схема 8.2
Схема 8.2
 Схема 8.3
Схема 8.3
 Схема 8.4
Схема 8.4
 Схема 8.5
Схема 8.5

Глава 9. Эндометриоз
Эндометриоз – общее заболевание организма, характеризующееся ростом и функционированием ткани, схожей с эндометрием, за пределами обычной локализации слизистой оболочки матки. Впервые эндометриоз описан в 1860 г. В структуре гинекологической заболеваемости он занимает третье место, уступая по частоте воспалительным заболеваниям гениталий и миоме матки.Актуальность проблемы эндометриоза гениталий определяется большой частотой и темпами возрастания этой патологии, тяжелым, прогрессирующим течением заболевания, нарушением менструальной, детородной и других функций полового аппарата, снижением трудоспособности, недостаточной эффективностью лечения.
Этиология, патогенез, классификации
Этиология эндометриоза остается предметом исследований. Многие авторы относят его к полиэтиологичному заболеванию. К факторам, которые в той или иной степени могут способствовать возникновению эндометриоза, относят гормональные, иммунологические, метаболические нарушения, позднее начало половой жизни, сексуальные нарушения, аборты, осложненные роды, использование с целью контрацепции ВМС. Ряд авторов относят эндометриоз к генетически обусловленным заболеваниям с семейной предрасположенностью.Патогенез эндометриоза не установлен. Согласно теории целомической метаплазии эндометриоз развивается из мезотелия брюшины вследствие перерождения (метаплазии). Эмбриональная теория предполагает возникновение эндометриоза из остатков мюллеровых протоков и первичной почки. Согласно индукционной теории отторгающийся эндометрий выделяет вещества, стимулирующие развитие эндометриоза из стволовых клеток соединительной ткани. Получила распространение имплантационная теория, согласно которой эндометриоз развивается в результате ретроградного заброса в брюшную полость клеток эндометрия, отторгнувшегося во время менструации. Однако установлено, что явления ретроградной менструации имеют место у здоровых женщин. Поступлению клеток эндометрия способствует большая длительность менструального кровотечения, атрезия шеечного канала, широкий просвет маточных труб, снижение в перитонеальной жидкости концентрации прогестерона, функции макрофагов и киллеров.
Для больных эндометриозом характерно наличие в анамнезе нервно–психической травмы, перенесенных операций, ДЭК шейки матки, большое число сопутствующей гинекологической и экстрагенитальной патологии. Возникновению эндометриоза у большинства больных предшествует хламидийная, уреаплазменная и другие инфекции, которые способны индуцировать иммунодефицит, нарушения гормонального гомеостаза и регионарного кровотока. Больным эндометриозом свойственна внутренняя напряженность, раздражительность, высокая тревожность, которые обусловливают снижение устойчивости к эмоциональному стрессу, что приводит к восприятию любых раздражителей как стрессорных, а следовательно, к развитию общего перенапряжения и психосоматического варианта дезадаптации. Определенная роль в патогенезе эндометриоза отводится состоянию механизмов защиты в брюшной полости, адгезии и инвазии, синдрому лютеинизации неовулировавших фолликулов, снижению способности клеток эндометрия к апоптозу. Предполагают, что причина снижения интенсивности апоптоза связана с избыточным накоплением в клетках кальция.
Классификация эндометриоза гениталий. Существует около 20 классификаций эндометриоза (табл. 9.1, 9.2).
Таблица 9.1. Клинико–эндоскопическая классификация наружного генитального эндометриоза по А.Н. Стрижакову и А.Н. Давыдову (1995)
| Клинические признаки | Балл | Эндоскопические признаки | Балл |
|---|---|---|---|
| Бесплодие: | Типичные: | ||
| первичное | 16 | темные пятна на поверхности брюшины | 2 |
| вторичное | 4 | ||
| Тазовая боль: | Рубцовая ткань, окружающая имплантаты: желто–коричневые пятна на брюшине | 2 | |
| легкая | 4 | 2 | |
| средняя | 8 | ||
| тяжелая | 16 | ||
| Диспареуния: | Типичный спаечный процесс в малом тазу (в том числе подъяичниковые сращения) | 2 | |
| легкая | 4 | ||
| средняя | 8 | ||
| тяжелая | 16 | ||
| Дисменорея: | Эндометриоидные кисты яичников: | ||
| легкая | 4 | односторонние | 2 |
| средняя | 8 | двусторонние | 4 |
| тяжелая | 16 | ||
| Болезненность при влагалищном исследовании: | Нетипичные: | ||
| легкая | 4 | железистые структуры на брюшине | 1 |
| средняя | 8 | петехиальная брюшина | 1 |
| тяжелая | 16 | белые непрозрачные бляшки, окруженные рубцовой тканью | 1 |
| «пламеподобные» пятна | 1 | ||
| гиперваскулярные зоны | 1 | ||
Таблица 9.2. Классификация перитонеального эндометриоза (American Fertility Society, 1998)
| Орган | Характер поражения эндометриозом | Оценка | ||
|---|---|---|---|---|
| 1 | 2 | 3 | ||
| Брюшина | < 1 см | 1–3 см | > 3 см | |
| Поверхностный | 1 балл | 2 балла | 4 балла | |
| Глубокий | 2 балла | 4 балла | 6 баллов | |
| Яичник правый | Поверхностный | 1 балл | 2 балла | 4 балла |
| Глубокий | 4 балла | 16 баллов | 20 баллов | |
| Яичник левый | Поверхностный | 1 балл | 2 балла | 4 балла |
| Глубокий | 4 балла | 16 баллов | 20 баллов | |
| Облитерация прямокишечно–маточного углубления | Частичная | 4 балла | 4 балла | 4 балла |
| Полная | 40 баллов | 40 баллов | 40 баллов | |
| Спайки | Вовлечено в процесс | <1/3 | 1,3–2,3 | >2, 3 |
| Яичник правый | Тонкие | 1 балл | 2 балла | 4 балла |
| Плотные | 4 балла | 8 баллов | 16 баллов | |
| Яичник левый | Тонкие | 1 балл | 2 балла | 4 балла |
| Плотные | 4 балла | 8 баллов | 16 баллов | |
| Труба правая | Тонкие | 1 балл | 2 балла | 4 балла |
| Плотные | 4 балла | 8 баллов | 16 баллов | |
| Труба левая | Тонкие | 1 балл | 2 балла | 4 балла |
| Плотные | 4 балла | 8 баллов | 16 баллов | |
К генитальному (половому) относят: ■ внутренний – тело матки, перешеек, интерстициальный отдел маточных труб ■ наружный – эндометриоз яичников, ретроцервикальной области, маточных труб, брюшины (выстилающей углубления малого таза), влагалища, влагалищной части шейки матки, наружных половых органов, промежности.
Предложена классификация, в основу которой положено разделение эндометриоза на внутрибрюшной (яичники, маточные трубы, брюшина, выстилающая углубления малого таза) и экстраперитонеальный (наружные половые органы, влагалище, влагалищная часть шейки матки, ретроцервикальная область).
Классификация наружного эндометриоза тазовой локализации по А. Acosta (1978): ■ Малые формы: • единичные гетеротопии на тазовой брюшине • редкие гетеротопии на поверхности яичника без спаек. ■ Средние формы: • поражение одного или двух яичников с образованием мелких кист • нерезко выраженный периовариальный или перитубарный спаечный процесс • поражение брюшины прямокишечно–маточного пространства со смещением матки, без перехода процесса на толстый кишечник. ■ Тяжелые формы: • эндометриоз яичника или обоих с кистами до 2 см • поражение яичников с выраженным спаечным процессом • эндометриоз маточных труб с нарушением проходимости • облитерация прямокишечно–маточного пространства • эндометриоз крестцово–маточных связок и брюшины прямокишечно–маточного пространства с выраженным спаечным процессом • вовлечение в процесс кишечника или мочевыводящих путей.
Степень тяжести процесса определяется согласно классификации (см. табл. 9.1): ■ легкая степень – до 16 баллов ■ умеренная степень – 17–36 баллов ■ тяжелая степень – 37 и более баллов.
Если фимбриальный конец трубы запаян, оценка – 16 баллов, 1–я стадия (минимальная) – 1–5 баллов; 2–я стадия (легкая) 6–15 баллов; 3–я стадия (умеренная) – 16–40 баллов; 4–я стадия (тяжелая) – более 40 баллов.
Патологоанатомическая характеристика. Макроскопически эндометриоз может иметь форму узлов инфильтратов, кистозных образований с геморрагическим содержимым.
Очаги состоят из желез и стромы. Трубчатые железы во 2–й половине менструального цикла становятся извитыми, но слизеобразовательная их способность небольшая. В стадии секреции количество гликогена в эпителии очагов по сравнению с эндометрием незначительное, что свидетельствует о слабом влиянии на них прогестерона. Строма очагов эндометриоза обладает свойствами гистолиза мышечных фибрилл, эластических волокон и промежуточной соединительной ткани, что обеспечивает возможность инвазии в окружающие ткани.
Соотношение железистого эпителия и цитогенной стромы в очагах эндометриоза различной локализации неодинаково. В случаях отсутствия железистого эпителия эндометриоз относят к стромальному, что встречается редко.
Формы генитального эндометриоза
Внутренний эндометриоз тела матки.
Матка поражается эндометриозом чаще других органов (60–70%). Рост эндометрия, окруженного цитогенной стромой в мышце матки, как правило, носит диффузный характер. Поражения в виде узелков, очагов встречаются реже. Врастания эндометрия ведут к гипертрофии мышечных волокон, утолщению стенок матки. Наиболее частой локализацией эндометриоза является задняя стенка матки и дно.Кистозные полости по величине варьируют от мелкого зерна до ореха, наполнены кровянистым темным (шоколадного цвета) содержимым. Степень разрастания кистозных образований и глубина поражения могут быть разными. Единичные кистозные образования крупных размеров встречаются редко. При диффузном эндометриозе матки имплантаты имеют вид свищей, при узловой форме определяются плотные инфильтраты без четких контуров. В случаях утолщения стенок матки за счет гиперплазии мышечных волокон (I–III степень поражения) употребляют термин «аденомиоз».
Железистые образования выстланы однослойным цилиндрическим эпителием, реже – мерцательным или кубическим. Очаги эндометриоза могут сообщаться с полостью матки. В этих случаях контрастное вещество при гистерографии заполняет ходы, располагающиеся в мышечном слое за пределами контуров полости матки.
Классификация диффузной формы внутреннего эндометриоза (научный центр акушерства, гинекологии, перинатологии РАМН).
Согласно этой классификации выделяют следующие стадии: ■ 1–я стадия – патологический процесс ограничен подслизистой оболочкой тела матки ■ 2–я стадия – патологический процесс переходит на мышечные слои ■ 3–я стадия – распространение патологического процесса на всю толщу мышечной стенки матки до ее серозного покрова ■ 4–я стадия – вовлечение в патологический процесс помимо матки париетальной брюшины малого таза и соседних органов.
Клиническая картина.
Заболевание развивается постепенно. Клиническая картина при эндометриозе матки определяется степенью поражения мышцы матки. Характерным является наличие обильных, длительных меноррагий, которые носят прогрессирующий характер и не поддаются консервативной терапии. Кровотечения, ведущие к анемии, характерны для больных диффузным эндометриозом матки. Причиной мено–метроррагий могут быть нарушения сократительной способности матки, изменения в соотношениях половых гормонов, увеличение площади слизистой матки, сопутствующая гинекологическая и экстрагенитальная патология.Следующим ведущим симптомом заболевания является альгодисменорея, частота которой достигает 50%. Боли возникают за 3–4 дня до месячных, усиливаются во время них. Продолжительные и разные по интенсивности боли локализуются в глубине таза, в области крестца и нижних отделах живота, наблюдаются не в каждую менструацию. Особенно интенсивными боли бывают после перенесенного стресса, физического переутомления. Обезболивающие препараты малоэффективны. Боли могут возникать при половых сношениях. Болевые ощущения особенно выражены при очаговой форме эндометриоза матки с локализацией узелков в области трубных углов, перешейка матки, при прорастании эндометриоза до брюшины.
Для больных эндометриозом матки характерно ощущение чувства тяжести в низу живота накануне менструации. Этот симптом также имеет прогрессирующий характер по мере распространения эндометриоза матки.
Частота и степень выраженности симптомов при эндометриозе матки значительно варьируют.
Для эндометриоза матки характерны циклические колебания величины матки, набухание и болезненность узелков эндометриоза накануне и во время месячных. За 3–4 дня до месячных и во время них матка увеличивается в размерах на 1–3 недели беременности, а по окончании месячных уменьшается.
Малигнизация эндометриоза наступает редко. Характерным является сочетание эндометриоза матки с инфекцией, передающейся половым путем, миомой матки (до 70%), кистами и кистомами яичников и экстрагенитальной патологией.
Роды у больных эндометриозом матки могут осложняться кровотечением, разрывом матки.
Диагностика
Диагноз устанавливают на основании углубленного изучения анамнеза, клинической симптоматики, данных осмотра больной.К информативным методам исследования относят: ■ УЗ–сканирование трансвагинальное (увеличен переднезадний размер матки, в миометрии – кистозные полости размерами 3–5 мм) ■ ядерно–магнитный резонанс ■ компьютерную томографию ■ гистероскопию (визуализация устьев эндометриоидных ходов, при узловой форме – расширение и деформация полости матки) ■ гистеросальпингографию с уротрастом, верографином на 7–10–й день цикла или после выскабливания эндометрия (рис. 9.1) ■ рентгентелевизионную гистеросальпингографию (неровность контуров полости матки, закругление трубных углов в сочетании с деформацией полости матки).
 Рис. 9.1. Схематическое изображение (а – д) контуров полости матки при внутреннем эндометриозе (Ю.Д. Ландеховский, 1994). Описание в тексте
Рис. 9.1. Схематическое изображение (а – д) контуров полости матки при внутреннем эндометриозе (Ю.Д. Ландеховский, 1994). Описание в тексте
Варианты рентгенологической картины внутреннего эндометриоза: ■ полость матки неправильной треугольной формы с увеличенным продольным размером, расширением истмического отдела и канала шейки матки ■ полость матки неправильной треугольной формы с неровными контурами ■ полость матки неправильной треугольной формы с увеличенным поперечным размером ■ полость матки неправильной треугольной формы с дефектом наполнения ■ полость матки неправильной треугольной формы с закругленными углами.
Генитальный эндометриоз
Эндометриоз яичников
Занимает первое место среди локализаций наружного эндометриоза и второе – после поражений матки.Существует мнение, что эндометриоз яичника берет начало от поверхностного очага на брюшине, что кисты яичника образуются путем инвагинации коркового слоя, в том числе в местах овуляции. По мере скопления менструальной крови очаги превращаются в кистозные полости, наполненные густой жидкостью темно–коричневого цвета. При локализации очагов на глубине более 5 мм течение процесса более активное. При нарушении целостности стенки кисты ее содержимое попадает в брюшную полость, развивается клиническая картина острого живота. Эндометриоидные кисты, как правило, сращены с задним листком широкой маточной связки, передней стенкой прямой кишки, задней поверхностью матки петлями тонкого кишечника. Отмечается инфильтрация тканей этих органов, т.е, эндометриозу яичников сопутствует выраженный спаечный процесс. По форме, величине, цвету, содержанию железистых элементов эндометриоз яичников отличается большим многообразием. Он часто сочетается с кистами, кистомами яичника и другими локализациями эндометриоза (рис. 9.2).
Размеры яичника, пораженного эндометриозом, меняются в динамике менструального цикла, увеличиваясь накануне и во время месячных. Как правило, это одно– или двусторонние опухолевидные образования неравномерной консистенции – от тугоэластической до плотной, бугристые, размерами от 0,8 до 15 см в диаметре, фиксированы спайками, чувствительны при пальпации. Мелкие кисты локализуются преимущественно в корковом слое яичника.
 Рис. 9.2. Видеоизображение органов малого таза при лапароскопии: 1 – матка; 2 – правый яичник; 3 – очаги эндометриоза
Рис. 9.2. Видеоизображение органов малого таза при лапароскопии: 1 – матка; 2 – правый яичник; 3 – очаги эндометриоза
Поверхность кист неровная, она покрыта спайками и геморрагическими наложениями. Толщина стенок неравномерная. Встречается ткань яичника с элементами фолликулов и желтым телом.
При исследовании в области придатков или позади матки определяются образования овоидной формы размерами 6–15 см, консистенции от тугоэластической до плотной, ограниченные в смещении, болезненные при пальпации.
Классификация
Предложена в научном центре акушерства, гинекологии перинатологии РАМН. ■ 1–я стадия – мелкие точечные эндометриоидные образования на поверхности яичников, брюшине прямокишечноматочного пространства без образования кистозных полостей ■ 2–я стадия – эндометриоидная киста одного яичника диаметром не более 5–6 см с мелкими эндометриоидными включениями на брюшине малого таза. Незначительный спаечный процесс в области придатков матки без вовлечения яичника ■ 3–я стадия – эндометриоидные кисты обоих яичников (диаметр кисты одного яичника более 5–6 см и небольшая эндометриома другого), эндометриоидные гетерокопии небольших размеров на серозном покрове матки, маточных труб и на париетальной брюшине малого таза. Выраженный спаечный процесс в области придатков матки с частичным вовлечением кишечника ■ 4–я стадия – двусторонние эндометриоидные кисты яичников больших размеров (более 6 см) с переходом патологического процесса на соседние органы: мочевой пузырь, прямую и сигмовидную кишку. Распространенный спаечный процесс.Клиническая картина
Проявления эндометриоза яичников разнообразны. Ведущим является болевой синдром различной интенсивности. Боли иррадиируют в прямую кишку, поясницу, усиливаются накануне и во время менструации. Альгодисменорея прогрессирует, но интенсивность ее неодинакова в различные менструальные циклы.Как при малых формах эндометриоза, так и при кистах больших размеров клинические проявления могут отсутствовать, что наблюдается редко.
Эндометриоз яичников необходимо дифференцировать с рецидивирующим воспалением придатков матки, пельвиоперитонитом, раком яичника, доброкачественными опухолями яичников, субсерозной миомой. В пользу эндометриоза свидетельствует проявление заболевания в период месячных.
При перфорации кист в брюшную полость возникают симптомы раздражения брюшины, сильные боли, тошнота, рвота, обморочное состояние, озноб, повышается температура. Клиническая картина кист сходна с таковой при нарушенной внематочной беременности, перекручивании ножки кистомы, остром аппендиците, перфорации язвы желудка и двенадцатиперстной кишки, деструктивно–калькулезном холецистите.
К осложнениям эндометриоидных кист следует отнести их нагноение и малигнизацию.
Гистологическая диагностика эндометриоза яичников основана на идентификации железистых структур, окруженных цитогенной стромой, выстланных цилиндрическим эпителием по типу эндометрия, который не всегда удается обнаружить.
Диагностика
В диагностике эндометриоза определенное значение придается опухолевым и генетическим маркерам, иммунным компонентам крови, перитонеальной жидкости. Диагноз подтверждается на основе гистологического исследования тканей, полученных при лапароскопии, лапаротомии.К информативным методам диагностики относят лапароскопию, эхографию органов малого таза, компьютерную томографию, магнитно–резонансную томографию (рис. 9.3).
Основными признаками патологии при УЗ–диагностике являются: ■ мелкоточечная внутренняя структура (мелкодисперсная эхопозитивная взвесь на фоне повышенного уровня звукопроводимости) ■ округлая форма образования ■ утолщенная эхо–плотная капсула кисты ■ обнаружение вблизи кист небольших размеров ткани «неизмененного» яичника ■ отсутствие изменений эхоструктуры при динамическом обследовании в различные фазы менструального цикла (в ряде наблюдений этот признак способствует дифференциальной диагностике эндометриоидных и ретенционных кист яичников с внутриполостным кровоизлиянием, т.е. установлению нозологической принадлежности шоколадных кист).

 Рис. 9.3. Трансабдоминальные сонограммы: 1 – аденомиоз матки, 2 – эндометриоидная киста яичника (Т. С. Дивакова, 2000). Эхографические признаки эндометриоидных кист яичников (А.Н. Стрижакова, А.И. Давыдова, 1995)
Рис. 9.3. Трансабдоминальные сонограммы: 1 – аденомиоз матки, 2 – эндометриоидная киста яичника (Т. С. Дивакова, 2000). Эхографические признаки эндометриоидных кист яичников (А.Н. Стрижакова, А.И. Давыдова, 1995)
Эндометриоз маточных труб
Как правило, наблюдается в сочетании с эндометриозом тела матки и яичников. Отмечается увеличение трубы в объеме. Эндометриоз маточных труб сопровождается болями, усиливающимися во время менструации, бесплодием или трубной беременностью.При перитонеальном эндометриозе на начальных этапах брюшина покрыта мелкоточеными петехиями (1–2 мм), затем очаги приобретают синюшно–багровый оттенок.
Очаги эндометриоза на брюшине могут быть типа мелких кистозных образований с прозрачным геморрагическим содержимым, с массой шоколадного цвета или рубцово измененные; отличаются по содержанию железистых элементов, стромы, цвету. К наиболее активным относят небольшие кисточки, наполненные прозрачным или геморрагическим содержимым. Менее активные наполнены шоколадного цвета массой и склеротически изменены. Доказано, что очаги эндометриоза, локализующиеся на глубине более 5 мм, имеют двухслойный эндометрий, претерпевают циклическую трансформацию и характеризуются прогрессирующим течением.
Ретроцервикальный эндометриоз
Располагается позади шейки матки в области прикрепления крестцово–маточных связок. Распространяется он на прямокишечно–влагалищную перегородку, задний свод, паравагинальную клетчатку.Объективные данные: крестцово–маточные связки утолщены, могут пальпироваться отдельные болезненные узелки от 0,3 см до 1 см в диаметре, плотные, мелкобугристые. Консистенция и размеры поражения многообразны.
Эндометриоидный инфильтрат обладает выраженным инфильтрирующим ростом. Он состоит из фиброзной соединительной ткани, железистых и кистозных образований с цитогенной стромой и кровоизлияниями.
При ректороманоскопии слизистая кишки гиперемирована, отечна, выбухает внутрь, просвет ее сужен, особенно во время месячных. При осмотре в зеркалах задний свод деформирован, просвечиваются небольшие синюшного цвета кисточки, окруженные мелкобугристым инфильтратом.
Классификация
Выделяют несколько стадий: ■ 1–я стадия – эндометриоидные очаги располагаются в пределах ректовагинальной клетчатки ■ 2–я стадия – прорастание эндометриоидной ткани в шейку матки и стенку влагалища с образованием мелких кист ■ 3–я стадия – распространение патологического процесса на крестцово–маточные связки и серозный покров прямой кишки ■ 4–я стадия – вовлечение в патологический процесс слизистой оболочки прямой кишки, распространение процесса на брюшину прямокишечно–маточного пространства с образованием спаечного процесса в области придатков матки.Клиническая картина
Клиническое течение ретроцервикального эндометриоза обусловлено степенью распространения процесса. Больных беспокоят боли в низу живота, в области поясницы, таза, отдающие в прямую кишку и усиливающиеся во время месячных, при акте дефекации, физической нагрузке и половых сношениях.В случаях вовлечения в процесс стенки прямой кишки может развиваться частичная кишечная непроходимость. Врастание эндометриоза в прямую кишку сопровождается сдавлением кишки за счет рубцовых изменений и кровоотделением в кишку.
Для исключения опухоли необходимо производить биопсию.
Эндометриоз влагалища
Первичный встречается редко. Он может быть в виде отдельных узелков, состоящих из железистых включений и фиброзной ткани или мелких кистозных полостей, наполненных темно–коричневой жидкостью, тесно сращенных с окружающими тканями. Отмечается мелкоклеточная инфильтрация. Кистозная форма эндометриоза влагалища встречается реже узловой.Чаще поражается задняя стенка верхней трети влагалища.
При осмотре в зеркалах накануне месячных видны мелкие кисточки бледно–голубого или багрово–синюшного цвета. Отмечаются боли во влагалище от слабых до выраженных (зависит от глубины поражения). Интенсивные боли появляются за 3–4 дня до месячных и во время них. Может возникать чувство жжения во влагалище. Реже наблюдаются кровянистые ациклические и контактные выделения, боли при половых сношениях.
Эндометриоз шейки матки
Чаще встречается у женщин, перенесших диатермокоагуляцию или другие операции на шейке матки.Макроскопически при эндометриозе шейки матки имеются образования в виде узелков, мелких кисточек или полосок красного или багрово–синего цвета. Во время месячных из отдельных очагов могут появляться темно–кровянистые выделения, после месячных окраска очагов бледная, они уменьшаются в размерах.
В 50% случаев эндометриоз шейки протекает бессимптомно. Болевой синдром появляется при прорастании эндометриоза в область перешейка. Для эндометриоза шейки матки характерны незначительные кровянистые выделения за 4–5 дней до месячных и после них. Кровянистые выделения могут быть после полового сношения.
Эндометриоз шейки отличается благоприятным течением.
Для подтверждения диагноза используют кольпоскопию, цервикоскопию, гистологическое исследование биопсийного материала.
Экстрагенитальный эндометриоз
Эндометриоз кишечника
Изолированный встречается редко. Сигмовидный отдел и прямая кишка вовлекаются в процесс у каждой пятой больной эндометриозом тазовой области. Из различных отделов кишечника поражается прямая кишка, одновременно прямая и сигмовидная, только сигмовидная и реже – слепая, тощая кишка и дистальный отдел тонкого кишечника. В литературе описан эндометриоз аппендикулярного отростка.Клиническая картина
Симптоматика зависит от локализации эндометриоза, глубины поражения стенки кишки. Очаги эндометриоза по размерам широко варьируют. Железистая ткань выстлана цилиндрическим эпителием, окружена цитогенной стромой. Плотная фиброзная ткань может сочетаться с гиалинизированной. Как правило, в процесс вовлекаются субсерозный и наружный мышечный слой кишки. Прорастание очагов эндометриоза может вести к гипертрофии мышечных волокон и повреждению слизистой кишечника.Больных беспокоят ноющие или приступообразные боли, не связанные с приемом пищи. При поражении прямой кишки боли усиливаются при акте дефекации, половых сношениях.
Накануне месячных могут появляться тенезмы. Характерным является чередование поносов и запоров, появление в кале примеси крови. Указанные симптомы могут сочетаться с альгодисменореей, меноррагией. В дни менструаций могут быть явления кишечной непроходимости, обусловленные ростом очагов эндометриоза, развитием спаечного процесса.
Диагностика
При ректороманоскопии отмечается гиперемия, отечность слизистой, сужение просвета кишки. Эндометриоз кишечника необходимо дифференцировать с раком кишечника, хроническим аппендицитом, спаечной болезнью, колитом, геморроем. В отличие от эндометриоза, рост которого начинается с серозной оболочки, патологический процесс при раке начинается со стороны слизистой.Эндометриоз послеоперационного рубца
Чаще возникает после операций, сопровождающихся вскрытием полости матки, реже – после аппендэктомии, грыжесечения, удаления желчного пузыря и т. д.Развитие эндометриоза в рубце может возникать через 4–5 недель или спустя десятки лет после операции.
В области рубца появляются уплотнения в виде узлов или инфильтратов серовато–голубоватого цвета. Гистологически определяется крупноволокнистая соединительная ткань с мелкими кистозно расширенными железами,окруженными цитогенной стромой. Эпителий желез подобен эндометрию. Встречаются гемосидерин и кровоизлияния. Узлы сращены с окружающими тканями. Накануне и во время месячных очаги эндометриоза могут приобретать багрово–синюшный цвет и кровоточить. Встречаются очаги типа грануляционной ткани. Узлы и инфильтраты увеличиваются и становятся болезненными во время месячных.
Эндометриоз пупка
Характерно появление плотных узелков от 0,2 до 2 см в диаметре или инфильтрата с образованием полипозных разрастаний. Кожа гиперемирована, повышена влажность. Во время менструации очаги приобретают багровосинюшную окраску. Отделяемое может быть сукровичным или темно–коричневым. Боли в области пупка, кожный зуд появляются за несколько дней до месячных.Эндометриоз мочевого пузыря
Как правило, возникает вторично при наличии поражения матки, ее шейки, яичников. Чаще поражается дно и задняя стенка. Картина очагов в области мочевого пузыря сходна с таковой при других локализациях эндометриоза.Больных беспокоят боли в глубине таза, в области мочевого пузыря, рези, учащенное мочеиспускание. Появление гематурии свидетельствует о прорастании эндометриозом слизистой мочевого пузыря. Накануне и во время месячных болевой синдром резко выражен. При цистоскопии на отечной, гиперемированной слизистой выступают кисточки диаметром 0,2–0,4 см от голубоватого до багрового–синюшного цвета.
Эндометриоз мочеточника
Может быть первичным или вторичным при распространении процесса с органов таза.Боли могут быть ноющими или коликообразными, периодически повышается температура. Отмечаются частые позывы к мочеиспусканию, гематурия наблюдаются при распространении процесса. Может наступить стенозирование мочеточника с развитием гидронефроза.
Эндометриоз почек
Встречается редко. Характерными симптомами являются гематурия во время месячных, боли в пояснице, субфебрильная температура, нарастание интенсивности болей по мере прогрессирования заболевания.Эндометриоз уретры
Может быть диффузным или в виде полипа. Больных беспокоят боли, чувство жжения в мочеиспускательном канале, могут появляться сукровичные выделения. Как правило, имеется поражение эндометриозом других органов малого таза. Для подтверждения диагноза необходимо инструментальное обследование и гистологическое исследование биопсийного материала.Типичным симптомом эндометриоза легких является совпадающее с менструациями кровохарканье. Могут быть боли, жжение в грудной клетке. Как правило, дыхательные движения на интенсивность болей не влияют. Во время операции в легких, чаще субплеврально, находят узлы плотной консистенции диаметром от 0,2 до 3 см сероватого цвета, содержащие небольшие кисты, выстланные однослойным кубическим или цилиндрическим эпителием.
Диагноз эндометриоза легких необходимо дифференцировать с туберкулезом и новообразованием. Поражение эндометриозом плевры может вести к скоплению геморрагической жидкости в плевральной полости.
Лечение
При эндометриоидной болезни проводится сочетанное хирургическое и гормональное медикаментозное или только гормональное и медикоментозное лечение.Выбор метода лечения зависит от локализации эндометриоза, степени его распространения, особенностей клинического течения, возраста женщины, заинтересованности в беременности, характера сопутствующей гинекологической и экстрагенитальной патологии, наличия противопоказаний для гормональной терапии. Во всех случаях лечению должно предшествовать обследование на хламидийную, уреаплазменную и другие инфекции, передающиеся половым путем.
Операции выполняются с использованием эндоскопических методов, крио– и лазерной техники, микрохирургии.
Показания к хирургическому лечению: ■ сочетание эндометриоза с заболеваниями внутренних половых органов, подлежащих оперативному лечению ■ наличие противопоказаний к гормональной терапии (сахарный диабет, гипертоническая болезнь, гепатит, цирроз печени и др.) ■ отсутствие эффекта от консервативного лечения больных эндометриозом в течение 4–6 месяцев ■ аденомиоз, сопровождающийся гиперплазией миометрия ■ внутренний эндометриоз в сочетании с предраком эндометрия или с гиперпластическими процессами яичников ■ эндометриоидные кисты яичников.
Объем операции зависит от локализации эндометриоза, степени его распространения, вовлечения в процесс смежных органов.
Производится иссечение очагов эндометриоза в пределах здоровых тканей, сальпинголизис, пластика труб, пресакральная нейротомия, операции на кишечнике, мочевом пузыре и других органах.
Органосохраняющие операции с сохранением детородной функции выполняются в возрасте до 40 лет. При распространенном эндометриозе, наличии тяжелой сопутствующей патологии производится экстирпация матки с придатками. Регресс очагов эндометриоза в этих случаях наступает через 2–4 года.
Действие гормональных препаратов, используемых в комплексном лечении больных эндометриозом, направлено на предотвращение реализации биологического эффекта эндогенных гормонов, с действием которых связана стимуляция роста и развития очагов эндометриоза. Выраженная гипоэстрогения сопровождается аменореей, атрофией эндометрия и частичной регрессией очагов эндометриоза. С этой целью применяются агонисты гонадотропин–рилизинг гормона, ингибиторы гонадотропинов, прогестагены, антипрогестины, антиэстрогены и оральные контрацептивы.
К наиболее эффективным в лечении эндометриоза относят агонисты ГнРГ (нафарелин, гозерелин, декапептил–депо, золадекс и др.), под влиянием которых снижается чувствительность рецепторов передней доли гипофиза, возникает выраженная гипоэстрогения и аменорея.
Золадекс в дозе 3,6 мг вводят на 5–6–й день менструального цикла подкожно в переднюю брюшную стенку через 28 дней в течение 6 месяцев. Через 2 месяца от начала лечения при выраженных гипоэстрогенных симптомах (приливы, потливость, сухость во влагалище, депрессия и др.) рекомендуется эстрадиола валериат по 1 мг/сут. После 2–3 инъекций золадекса или декапептила–депо можно продолжить терапию введением депо–провера по 150 мг внутримышечно 1 раз в месяц на протяжении 4–6 месяцев. Лечение приводит к улучшению общего состояния, исчезновению болевого синдрома, меноррагии. Менструальный цикл восстанавливается через 1–2 месяца после последней инъекции золадекса.
Прогестагены – синтетические соединения, по химической структуре и биомеханизму действия аналогичные прогестерону.
К ним относят: ■ дериваты гидроксипрогестерона (медроксипрогестерон, мегестрол, хлормадинон); ■ производные 19–нортестостерона (норэтинодрел, норэтистерон, линестренол, дидрогестерон).
Прогестины обладают антиэстрогенным и антипрогестероновым действием (связываются в тканях–мишенях с рецепторами к эстрогенам и прогестерону).
Депо–провера вводится внутримышечно по 150 мг с интервалом в 2–4 недели на протяжении 6 месяцев. Наступает обратимая аменорея. Возможно увеличение массы тела.
Дуфастон, норколут, оргаметрил назначают по 5–10 мг/сут. С 5–го по 25–й или с 16–го по 25–й день менструального цикла или в непрерывном режиме на протяжении 6–12 месяцев.
Антипрогестины – гестринон (неместран) и мифепристон подавляют предовуляторные пики ЛГ и ФСГ, что сопровождается снижением уровня эстрадиола и прогестерона.
Гестринон рекомендуется в дозе 2,5 мг 2 раза в неделю на протяжении 6 месяцев. По окончании курса лечения наблюдается быстрое восстановление менструации.
Антиэстрогены (тамоксифен, фарестон, зитазониум и др.) обладают способностью блокировать эстрадиолзависимые рецепторы в органах–мишенях и подавлять синтез простагландинов, отвечающих за рост и созревание фолликулов.
Тамоксифен используют при эндометриозе по 10 мг 2 раза в сутки в течение 6 месяцев. При сочетании эндометриоза с гиперпролактинемией или миомой матки тамоксифен рекомендуется по 10 мг/сут. в непрерывном режиме на протяжении 6 месяцев в сочетании с парлоделом по 2,5 мг/сут.
Антигонадотропины (даназол, данол, дановал, даноген, даноприн, динобанин) блокируют пиковые выбросы ФСГ и ЛГ в гипоталамусе при сохранении их базального уровня секреции. Даназол назначают в непрерывном режиме от 200 до 800 мг/сут на протяжении 3–6 месяцев. В виде свечей препарат вводится в задний свод влагалища в суточной дозе 200–400 мг. Менструальный цикл восстанавливается после аменореи через 1–2 месяца.
Побочные действия даназола: гирсутизм, повышение аппетита, себорея, увеличение массы тела, повышение АД.
Эстроген–гестагенные препараты (марвелон, ригевидон, регулон и др.) применяются при эндометриозе с лечебной и контрацептивной целью. Установлено, что на фоне приема монофазных оральных контрацептивов яичники уменьшаются в размерах, возрастает число атретических фолликулов и развиваются фиброзные изменения стромы. В эндометрии наступает регрессия пролиферативных изменений, секреторная трансформация.
Оральные контрацептивы назначаются при эндометриозе по контрацептивной схеме в случаях органосохраняющих операций, при неполном удалении очагов эндометриоза, при малых формах заболевания, с целью профилактики рецидива эндометриоза.
Применение гормональных препаратов позволяет, как правило, купировать болевой синдром, меноррагии, прогрессирование эндометроиза, значительно улучшить общее состояние больных, но не приводит к ликвидации морфологического субстрата эндометриоза. Длительность ремиссии во многом зависит от продолжительности аменореи и проводимой медикаментозной терапии. Предупреждению рецидива эндометриоза способствует беременность.
Исследования гомеостаза при эндометриоидной болезни позволили раскрыть многочисленные звенья патогенеза заболевания.
Исходя из этого, терапия больных эндометриозом должна предусматривать: ■ исключение физической, умственной и эмоциональной перегрузок ■ коррекцию нарушенных обменных процессов ■ снятие тревожно–депрессивного состояния и напряжения адаптивных систем организма ■ подавление синтеза простагландинов ■ коррекцию иммунных нарушений ■ нормализацию функции щитовидной железы ■ восстановление гемодинамики органов малого таза и функций полового аппарата ■ лечение сопутствующей патологии ■ использование гепатопротекторов и энтеросорбентов.
Все больные обследуются на инфекции, передающиеся половым путем (хламидии, микоплазмы, герпетическую и цитомегаловирусную и др.). Изучается состояние щитовидной железы, гепатобилиарной системы, вен нижних конечностей. При наличии показаний производится холецистэктомия, струмэктомия, удаление варикозно расширенных вен. С учетом характера возбудителя проводится антибактериальное лечение, уточняется форма эндометриоза (узловая, диффузная, кистозная), степень его распространения, вовлечение в процесс смежных органов, наличие сопутствующей патологии. Изучается аллергоанамнез. Уточняются возраст женщины, семейное положение, отношение к беременности. ■ Обязательным компонентом лечения является иммунокоррекция. Рекомендуется последовательное назначение аутосеротерапии, спленина, циклоферона. Аутосыворотка готовится из крови больного в асептических условиях. Кровь (25 мл) на 30 мин помещают в термостат при 37°С, затем на 30 мин в холодильник при 4°С, 5 мин центрифугируют при 1000 оборотах в минуту, сыворотку отсасывают и по 0,5 мл запаивают в стерильные ампулы, хранят замороженной до 20 дней. Вводят внутрикожно в область предплечья или бедра по 0,2 мл в 3–4 точки ежедневно в течение 15–20 дней. Спленин вводят по 2 мл внутримышечно ежедневно 20 дней. Наряду с влиянием на иммунитет спленин нормализует функции печени, коры надпочечников, снижает уровень гистамина крови. Циклоферон или неовир вводят по 2 мл внутримышечно в 1, 2, 4, 6, 8–й дни менструального цикла, затем через 2 недели по 2 мл внутримышечно через день еще 5 инъекций. ■ Поливалентные ингибиторы протеаз (антогозан или овомин) инактивируют протеолитические ферменты, уровень которых повышен у больных эндометриозом. Овомин вводится внутривенно в условиях стационара. ■ Препараты седативного и анксиолитического действия назначают за 3–4 дня до и во время менструации: настойка валерианы по 25 капель 3 раза в день, пустырника по 30–50 капель 3 раза в день, комплексный растительный препарат новопассит по 1 чайной ложке 2–3 раза в день, магне В6 по 1 таблетке 2–3 раза в сутки, ноотропил (пирацетам) по 1 капсуле 3 раза в день на протяжении 20–30 дней. Ксанакс (алпразолам) по 0,25 мг 1–3 раза в день, ксанакс ретард по 0,25–0,5 мг в день (успокаивающее, антидепрессивное, вегетотропное и сосудистостабилизирующее действие). Выбор препаратов проводят с учетом характера, степени выраженности симптоматики, наличия психотравмирующих ситуаций. Оксибутират лития в виде 20% раствора вводят внутримышечно по 2 мл 1 раз в сутки 14 дней (стресс–лимитирующий эффект, нормализует циркадный ритм гормонов). ■ Антиоксидантная терапия – витамин Е (α–токоферол ацетат) – по 100 мг в сутки в течение 14 дней. Каротин (β–каротин) – по 15 мг 3 раза в день 14 дней и др. ■ Внутрисосудистый лазер с мощностью излучения 1,5 мВт, длиной волны 0,63 мкм, волокнистый оптический световод диаметром 400 мкм, в кубитальную вену по 30 мин в течение 5 дней. ■ При доступных локализациях эндометриоза – введение в очаги 1–2% раствора прогестерона по 0,2–0,5 мл в очаги эндометриоза через день 3–5 раз в лютеиновую фазу цикла на протяжении 3–4 месяцев. Метод высокоэффективен при эндометриозе рубца, пупка, шейки матки, влагалища, 1% раствор йода по 0,1–0,2 мл в доступные очаги эндометриоза через 1–2 дня с 6–го по 14–й день цикла на протяжении 3–4 циклов. ■ Магнитотрон МКМ 1 – индукция 40 мТл на область кожной проекции селезенки в положении больной лежа на правом боку, экспозиция 10 мин в течение 3 дней. ■ Гипербаричекая оксигенация – давление 1,5 АТ, экспозиция от 40 до 50 мин, курс 6–10 процедур. ■ Радоновые ванны продолжительностью 10 мин, с концентрацией радона 72–100 нКи/л, температурой 37°С через день или ежедневно, 2 курса с интервалом 12 месяцев. Орошения гинекологические продолжительностью 15 мин, курс 10–15 процедур. ■ КВЧ–терапия, выходная мощность 15–45 мВт, длительность сеанса 20 мин, курс 10 процедур (аппараты «Явь–1» и «Адра»).
Таблица 9.3. Симптоматическое лечение
| Препарат | Доза |
|---|---|
| При болях | |
| Напросин (напроксен) | По 1 таблетке 250 мг 2 раза в сутки |
| Свечи ректальные по 250 мг | |
| Диклофенак натрия | Свечи ректальные 50 мг 1 раз в день 10 дней |
| Магне В6 (магния лактат 500 мг, пиридоксина гидрохлорид 125 мг) | По 1 таблетке 2–3 раза в сутки за 3–4 дня до и во время менструации |
| При меноррагии | |
| Изоптин (верапамила гидрохдорид) | По 40 мг 1–2 раза в сутки в течение 3 суток |
| 0,25% раствор 2 мл в шейку матки 1–2 раза в сутки в течение 3 суток | |
| При длительном гормональном лечении, хроническом холецистите, гастрите, колите 1–2 курса в год | |
| Энтерогель | По 1 столовой ложке 3 раза в день через 2 ч после приема пищи на протяжении 20 дней |
| Панзинорм | По 1 драже 3 раза в сутки во время еды |
| Холензим | По 1 таблетке 1–3 раза в сутки |
| Фестал | По 1 драже 1–3 раза в сутки во время или сразу после еды |
| Сирепар | По 2–3 мл внутримышечно или внутривенно на протяжении 2–6 недель |
| Эссенциале | По 2 капсулы 2–3 раза в сутки во время еды в течение 1–2 месяцев |
| При сочетании эндометриоза с воспалением придатков матки | |
| Унитиол | 5% раствор 5 мл внутримышечно, 5 инъекций |
| Натрия тиосульфат | 30% раствор по 10 мл внутривенно через день, 15 инъекций |
| Натрия тиосульфат | 1% растовор по 50 мл в виде микроклизмы (противоспалительное, десенсибилизирующее действие, способствует рассасыванию зрелого коллагена), 20 инъекций |
| Димексид | 30% расотвор в тампонах во влагалище |
| В случаях повышения секреции пролактина | |
| Бромкриптин, бромэргон | Таблетки по 2,5 мг, 4–6 месяцев |
Таблица 9.4. Варианты гормонотерапии
| Эндометриоз, варианты клинической ситуации | Варианты лечения | Продолжительность лечения |
|---|---|---|
| Произведена органосохраняющая операция, планируется беременность | Золадекс 3,6 мг 6 месяцев (1 раз в месяц), или 10,8 мг 2 раза в 6 месяцев, или другие агонисты ГнРГ. После родов – монофазные ОК с преобладанием гестагенов (овидон, ригевидон, микрогион, марвелон) | № 6По контрацептивной схеме 1–3 года |
| Органосохраняющая операция со стерилизацией | Депо–провера по 150 мг внутримышечно | Через 2 недели № 4, через 3 недели № 5, затем через 3 месяца № 3 |
| Сочетание эндометриоза и миомы матки. Органосохраняющая операция, планируется беременность | а) Золадекс (другие α–ГнРГ). Роды, с восстановлением менструации – монофазные ОК с преобдаданием гестагенов по контрацептивной схеме | № 6 |
| 1–3 года | ||
| б) Тамоксифен 10–20 мг 1 раз в сутки в непрерывном режиме и парлодел 2,5 мг, затем монофазные ОК с преобладанием гестагенов | 6–8 месяцев | |
| 1–3 года | ||
| Малые формы эндометриоза. Консервативное лечение без операции | а) Золадекс (другие α–ГнРГ), затем монофазные ОК с преобладанием гестагенов по контрацептивной схеме | № 61–2 года |
| б) Золадекс, депо–провера 150 мг через 21 день | № 2 № 6 | |
| С восстановлением менструации после лечения или родов ОК по контрацептивной схеме | 1–2 года | |
| в) Депо–провера 150 мг через 14 дней № 4, через 21 день № 6 | 6–8 месяцев | |
| С восстановлением менструации монофазные ОК по контрацептивной схеме | 1–3 года | |
| Малые формы эндометриоза в сочетании с миомой матки, не пре вышающей 7 недель беременности. Консервативное лечение (без операции) | а) Тамоксифен 10–20 мг и парлодел 2,5 мг. | 6–7 месяце |
| Затем монофазные ОК по контрацептивной схеме. | 1–3 года | |
| б) Депо–провера 150 мг через 21 день | 6–8 месяцев | |
| Тамоксифен по 10 мг, | 4–6 месяцев | |
| затем монофозные ОК по контрацептивной схеме | 1–2 года | |
| Эндометриоз шейки, влагалища, ретроцервикальный, рубца, пупка в сочетании с другими локализациями | Прогестерон 1–2% раствор и (или) йод 1% раствор в очаги эндометриоза | 3–4 месяца |
| Депо–провера. | 6 месяцев | |
| Затем монофазные ОК по контрацептивной схеме | 1–2 года | |
| Эндометриоз шейки, влагалища, рубца, пупка или другой доступный очаг | Прогестерон 1–2% раствор или/и йод 1% растовр в очаги № 3–5. | 3–4 месяца |
| Затем монофазные ОК или гестагены в режиме контрацепции | 1–2 года | |
| Экстирпация матки с придатками | Один из гестагенов с учетом возраста: депо–провера 150 мг 1 раз в 3 месяца | 6–7 месяцев |
| Дюфастон по 0,5 мг | 6–7 месяцев | |
| Микролют 0,03 мг | ||
| Норэтистерон 0,5 мг | ||
| Примолютнор 5 мг | ||
| Норколут 5 мг | ||
| Затем один из следующих препаратов: климонорм, климен, прогинова, гинодиан–депо, ливиал | 1–3 года и более |
Учитывая удельный вес эндометриоза в структуре гинекологической заболеваемости, быстрые темпы его роста, тяжесть течения, влияние на трудоспособность, деторождение, необходима диспансеризация этой категории больных. В задачи диспансеризации больных эндометриозом должна входить: коррекция нарушений параметров гомеостаза; трудовая и социальная реабилитация больных; предупреждение рецидива эндометриоза; создание гипоэстрогенного фона или псевдоменопаузы для подавления пролиферативных процессов в очагах эндометриоза; предупреждение побочных действий длительного гормонального лечения; терапия сопутствующей патологии; обеспечение адекватного наблюдения в связи с высоким риском онкозаболеваний; проведение заместительной терапии в случаях радикальных операций и в постменопаузальном периоде с целью профилактики остеопороза, сердечно–сосудистой патологии и оптимизации качества жизни женщины.
Профилактика
■ Четкая организация санитарно–просветительной работы, направленной на популяризацию здорового образа жизни, охраны репродуктивного здоровья, культуры сексуальных отношений. ■ Предупреждение в пре– и пубертатном периоде гипоплазии гениталий, ювенильных кровотечений и высокого инфекционного индекса. ■ Диспансеризация женщин, имеющих конституциональнонаследственную предрасположенность к развитию эндометриоза. ■ Профилактика инфекции, передающейся половым путем, ранняя ее диагностика. ■ Предупреждение стрессовых ситуаций, снятие напряжения неспецифической защитно–адаптационной реакции организма на чрезмерный или длительный стресс. ■ Снижение числа абортов, инвазивных методов исследования в гинекологии. ■ Исключение у женщин группы риска по эндометриозу использования внутриматочных контрацептивов. ■ Широкое внедрение при планировании семьи низкодозированных оральных контрацептивов. ■ Замена диатермохирургических вмешательств на шейке матки на криодеструкцию или лазерную вапоризацию.Глава 10. Бесплодный брак
По определению ВОЗ, бесплодный брак – это брак, в котором не возникает беременности при регулярной половой жизни без применения каких–либо противозачаточных средств в течение одного года при условии детородного возраста супругов. Бесплодный брак – ситуация уникальная в медицине, поскольку эта «болезнь» может проистекать сразу от двух индивидов. Уникальность ситуации усугубляется тем, что это в значительной мере явление социальное и психологическое. Частота бесплодного брака колеблется от 10 до 20%.Социальное значение проблемы, связанной с отсутствием детей в браке, трудно переоценить ввиду ее многообразия, включающего неустойчивость семейных отношений, возникновение комплексов неполноценности у супругов и снижение их социальной активности. Показатели структуры бесплодного брака в значительной степени отражают состояние здоровья людей репродуктивного возраста, а также косвенно характеризуют уровень оказания медицинской помощи. Кроме того, социальное значение проблемы бесплодия заключается в том, как оно сказывается на демографических показателях в стране наряду с такими факторами, как невынашивание беременности и перинатальная патология. При частоте бесплодного брака 15% и выше эта патология является государственной проблемой.
Виды бесплодного брака
Медицинская значимость проблемы бесплодия определяется результатами обследования, выяснением причин и лечением супругов. Биологическая сторона бесплодных браков характеризуется тем, что супруги в них раньше стареют, имеют меньшую продолжительность жизни, у них чаще выявляются злокачественные новообразования, после лечения наблюдается больше патологических мутаций у родившихся детей.Классификация женского бесплодия
Первичное бесплодие характеризуется отсутствием беременности в течение 1–2 лет с начала половой жизни, вторичное – отсутствием беременности при регулярной половой жизни без применения противозачаточных средств после одной или нескольких беременностей (включая внематочную), окончившихся родами, абортом или оперативным вмешательством.Абсолютное бесплодие – возможность беременности полностью исключена в связи с крайней степенью гипоплазии или отсутствием матки, яичников, маточных труб, аномалиями развития половых органов и др.
Относительное бесплодие – беременность возможна при устранении причин, вызвавших бесплодие (лечение воспалительных заболеваний половых органов, нарушений менструального цикла и др.). Разделение бесплодия на абсолютное и относительное условно, так как в настоящее время применяется экстракорпоральное оплодотворение и бесплодие при отсутствии маточных труб стало относительным.
Бесплодие может быть физиологическим (в детском, старческом возрасте и в период лактации).
В браке у каждого из супругов бесплодие может быть первичным или вторичным и обусловлено несколькими факторами.
Женское бесплодие: ■ трубный фактор – изменение проходимости и/или сократительной активности маточных труб ■ перитонеальный фактор – перитубарные спайки, изменяющие соотношение фимбриальных отделов труб и яичников, препятствующие транспорту гамет ■ эндокринный фактор – нарушение процессов овуляции вследствие поражения гипоталамо–гипофизарно–яичниковой системы или общих и системных заболеваний ■ маточный фактор – патологические состояния эндометрия, пороки развития матки ■ шеечный фактор – анатомические и функциональные изменения шейки матки, препятствующие движению сперматозоидов или приводящие к их гибели.
Эндокринное бесплодие, как и перитонеальный фактор, встречается у 30% женщин с бесплодием; трубный фактор в сочетании с перитонеальным – у 25%; иммунологический фактор выявляется у 5% обследованных; психосексуальные расстройства диагностируются у 3% и бесплодие неясного генеза – у 6%.
Причины женского бесплодия многообразны. Они могут быть обусловлены патологией гениталий, а также экстрагенитальными заболеваниями женщин.
К числу важнейших причин следует отнести: ■ воспалительные заболевания половых органов ■ заболевания желез внутренней секреции ■ недоразвитие (инфантилизм и гипоплазия) половых органов ■ неправильные положения половых органов ■ эндометриоз матки, труб и яичников ■ опухоли половых органов ■ экстрагенитальные заболевания (ревматизм, нефрит, туберкулез и др.) ■ неполноценное в количественном и качественном отношении питание ■ иммунологические факторы.
Классификация мужского бесплодия
Мужское бесплодие связано с отсутствием сперматозоидов и с их качественными изменениями.Мужское бесплодие: ■ аспермия – отсутствие эякулята ■ азооспермия – отсутствие сперматозоидов и эякулята ■ некроспермия – отсутствие подвижных спермиев в эякуляте ■ астенозооспермия – подвижность сперматозоидов менее 25% через 60 мин после эякуляции ■ олигозооспермия – концентрация сперматозоидов менее 20»106 в 1 мл ■ тератозооспермия – наличие менее 50% морфологически нормальных форм сперматозоидов ■ расстройства эякуляции – запоздалая, преждевременная, ретроградная ( в мочевой пузырь) ■ урогенитальная инфекция ■ психосексуальные расстройства ■ иммунологические факторы ■ бесплодие «неясного» генеза – отсутствие каких–либо видимых причин, приводящих к бесплодию в браке.
С учетом этиологии заболевания выделяют следующие факторы мужского бесплодия. ■ Нарушение регуляции функции яичек: нарушение секреции ФСГ и ЛГ; гиперпролактинемия. ■ Первичные нарушения в яичках: идиопатические; варикоцеле; хромосомные (синдром Клайнфелтера); крипторхизм; действие химических агентов и лекарств; орхиты (травматологические и воспалительные); хронические заболевания; иммунологические; неподвижность сперматозоидов в результате отсутствия семенных нитей. ■ Непроходимость семявыносящего протока: врожденная; воспалительного происхождения; ввязанная с бронхоэктазами. ■ Расстройства дополнительных половых желез: простатиты; везикулиты; врожденное отсутствие семенного канатика или семенных пузырьков. ■ Нарушение полового акта: редкие половые сношения; применение смазывающих веществ; импотенция; гипоспадия; ретроградная эякуляция. ■ Психологические факторы.
Трубное и трубно–перитонеальное бесплодие
Приблизительно у 60–70% женщин, страдающих бесплодием, наблюдается патология маточных труб или спаечный процесс в области малого таза. Чаще всего трубно–перитонеальное бесплодие развивается в результате воспаления маточных труб (гонококковые, хламидийные, микоплазменные, бактероидные и другие сальпингиты, туберкулез половых органов). Важным механизмом в приеме яйцеклетки и перемещении гамет являются сокращения фимбрий и мышц, движение ресничек и ток жидкости. После перенесенного сальпингоофорита нарушается транспортная функция маточных труб вследствие образования в них сужений, переходящих в облитерацию просвета на любом уровне, заращение фимбриального конца трубы; атрофии реснитчатого эпителия внутренней поверхности маточных труб, а также в результате функциональных нарушений кинетики маточных труб (дискоординация, гипо– и гипертонус). Органические поражения маточных труб могут быть после пельвиоперитонита или общего перитонита, аппендицита с последующей аппендэктомией, оперативных вмешательств на внутренних половых органах (миомэктомия, резекция яичников, перевязка маточных труб), послеродовых заболеваний. Перитонеальная форма бесплодия развивается также после многократного применения гидротубаций и использования масляных растворов при гистеросальпингографии. Причиной может быть психоэмоциональная неустойчивость, гипофункция яичников, гиперандрогения, гипер– или гипопростагландинемия, увеличение метаболитов простоциклина и тромбоксана А2. Более быстрое или медленное перемещение эмбриона может отразиться на развитии плода в последующем.Кроме того, трубное бесплодие может быть обусловлено анатомо–функциональными изменениями (врожденные аномалии, генитальный эндометриоз, полипы эндометрия).
Эндокринное бесплодие. Эта форма бесплодия является собирательным понятием, поскольку речь идет о многих эндокринных заболеваниях, имеющих различные причины, патогенез и клиническую картину. Для эндокринного бесплодия характерны расстройства функций в системе гипоталамус – гипофиз – яичники, изменения в сопряженных эндокринных железах (щитовидной, надпочечниках), приводящие к нарушению процесса овуляции. Внедрение в клиническую практику методов определения гормонов в сыворотке крови (радиосатурационный, иммуноферментный, иммунофлюоресцентный) позволяет выявить поражения гипоталамо–гипофизарно–яичниковой системы и разделить пациенток с бесплодием, обусловленным немеханическими факторами, на 7 групп в зависимости от этиологии заболевания. Выделение этих групп было предложено экспертами ВОЗ, и в настоящее время эти группы используются во многих странах мира для диагностики причин функционального бесплодия и назначения патогенетической терапии.
Группа 1. Гипоталамо–гипофизарная недостаточность.
Симптомы: ■ аменорея ■ снижены или отсутствуют эстрогены яичникового генеза ■ уровень гонадотропинов низкий ■ пролактин не повышен ■ опухоль в гипоталамо–гипофизарной системе не определяется ■ недоразвитие половых органов: недоразвитие матки, трубы удлинены, тонкие, извитые, шейка матки коническая, влагалище узкое, недостаточно емкое ■ гипоменструальный (редко гиперменструальный) синдром ■ выражены аномалии развития половых органов.
Выделяют три степени гипоталамо–гипофизарной недостаточности:
А – легкая степень. Пациентки, имеющие вторичную аменорею, правильный женский фенотип, положительные пробы с прогестероном, люлиберином, отрицательную – с кломифеном
Б – умеренная степень. Пациентки, имеющие первичную (64%) или вторичную (36%) аменорею, диспропорциональный тип телосложения, отрицательную пробу с прогестероном и положительную с люлиберином
В – тяжелая степень. Пациентки, имеющие евнухоидный тип телосложения, отрицательные пробы с прогестероном и люлиберином.
Группа 2. Гипоталамо–гипофизарная дисфункция.
В эту группу входят женщины с различными расстройствами менструального цикла (недостаточность лютеиновой фазы, ановуляторные циклы или аменорея), а также больные со склерокистозными яичниками (в яичниках продуцируется много андрогенов, подавлена овуляция, развивается гипертрихоз, ожирение).
Симптомы: ■ дисфункциональные маточные кровотечения ■ повышенная секреция эстрогенов ■ невысокий уровень гонадотропинов и пролактина.
Группа 3. Яичниковая недостаточность.
Симптомы: ■ аменорея, сопровождающаяся значительным снижением эстрогенов ■ «приливы» ■ повышение уровня ФСГ ■ различные хромосомные аномалии (синдром Шерешевского – Тернера, дисгенезия гонад, тестикулярная феминизация).
Группа 4. Врожденные или приобретенные нарушения половой системы. Женщины с аменореей, не реагирующие на курсы эстрогенной терапии.
Симптомы: ■ облитерация полости матки ■ синехии в полости матки (синдром Ашермана).
Группа 5. Гиперпролактинемия при наличии опухоли в гипоталамо–гипофизарной области. Женщины с различными расстройствами менструального цикла (недостаточность лютеиновой фазы, ановуляторные циклы или аменорея).
Симптомы: ■ повышенный уровень пролактина ■ подавлена продукция ФСГ и ЛГ ■ наличие опухоли в гипоталамо–гипофизарной области (микро– или макроаденома гипофиза).
Группа 6. Гиперпролактинемия без поражения гипоталамо–гипофизарной области.
Симптомы: ■ повышенный уровень пролактина ■ ановуляторные циклы ■ аменорея ■ может быть галакторея (синдром Киари – Фроммеля).
Группа 7. Аменорея на фоне опухоли в гипоталамо–гипофизарной области.
Симптомы: ■ снижение продукции рилизинг–гормонов и гонадотропинов ■ снижение экскреции эстрогенов ■ ановуляторные циклы ■ аменорея при нормальном уровне пролактина ■ обнаружение опухоли в гипоталамо–гипофизарной области.
К бесплодию могут привести также нарушения в гипоталамо–гипофизарно–яичниковой системе в результате поражения других желез внутренней секреции (щитовидной, надпочечников, поджелудочной).
Иммунологическое бесплодие
Причиной этой формы бесплодия является образование антиспермальных антител. Известны два вида антител: антитела, образующиеся в семенной плазме сперматозоида, что приводит к аутоагглютинации сперматозоидов, и антитела, образующиеся в слизистой оболочке цервикального канала и вызывающие полную иммобилизацию сперматозоидов. Антитела могут образовываться также в эндометрии и маточных трубах, чаще иммунные антитела к сперматозоидам появляются у женщин после полового акта. Сперма из влагалища, матки, брюшной полости захватывается макрофагами и достигает антителообразующих органов, причем антитела могут возникать ко многим компонентам спермы. Наличие антител в сыворотке крови не всегда совпадает с наличием их в слизи шейки матки.В организме женщины вырабатываются следующие антиспермальные антитела: ■ спермио–агглютинирующие ■ спермиоиммобилизующие ■ спермиоцитотоксические. Наибольшее значение имеет иммобилизация сперматозоидов, которая возникает при их встрече с антителами, имеющимися в слизи канала шейки матки, или при контакте с яйцеклеткой при имплантации зиготы в матку.
Антигены могут содержаться в сперме или в секретах придаточных желез и веществах, покрывающих сперматозоиды. В последние годы выделяют аллоиммунные факторы, при которых иммунный ответ направлен против клеток и тканей наполовину чужеродного плода. К этим факторам относят совместимость по HLA, изменения в клеточно–опосредуемом иммунном механизме, в частности в Т–хелперном звене. Другая группа факторов – аутоиммунные, при которых иммунный ответ матери направлен против собственных клеток и тканей (антифосфолипидный синдром, антитела к β–хорионическому гонадотропину человека, антитела к прогестерону, к тиреоидным гормонам).
Развиваются антитела к другим антигенам репродуктивной системы (к оболочке яйцеклетки, компонентам и гормонам плаценты) и в последующем могут вызывать бесплодие и невынашивание иммунного генеза.
На включение механизмов иммунной защиты существенное влияние оказывают воспалительные процессы гениталий, лимфоциты спермы, различные иммуносупрессоры (некоторые фракции спермы, простагландины). Чаще эти механизмы развиваются местно.
Маточная форма бесплодия.
Причиной бесплодия могут быть пороки развития матки, гиперантефлексия и гиперретрофлексия матки, опухоли матки, внутриматочные синехии. Они могут образовываться после воспалительных заболеваний матки (чаще туберкулезного поражения эндометрия), травматических выскабливаний по поводу абортов, маточных кровотечений, грубого отделения плаценты, послеродовых и послеоперационных осложнений, воздействия химических прижигающих веществ. Синехии представляют собой бессосудистые тяжи в полости матки, идущие между ее стенками, чаще в области дна, деформирующие полость матки. Клиническим проявлением этой патологии является так называемый синдром Ашермана (аменорея или гипоменорея в сочетании с овуляторным бесплодием). Выделяют три степени тяжести процесса. Тяжелая форма: синехии занимают более четверти полости матки, дно матки облитерировано, трубные углы облитерированы. Форма средней тяжести: синехии занимают менее четверти полости матки, дно матки облитерировано частично, трубные углы облитерированы. Легкая форма: синехии тонкие, нитеобразные, занимают менее четверти полости матки, трубные углы свободные или облитерированы частично.При миоме матки, эндометриозе, опухолях яичников беременность возможна, но способность к зачатию понижена.
Шеечный фактор, обусловливающий бесплодие.
Под влиянием стероидных гормонов в цервикальном канале накапливается слизь, через которую сперматозоиды проникают в полость матки, затем – в маточные трубы. Этот процесс осуществляется в середине менструального цикла, в другие периоды миграция сперматозоидов затруднена или невозможна. Изменение структуры цервикальной слизи также может быть причиной бесплодия, что обусловлено воспалительными заболеваниями, гормональными нарушениями (особенно гипоэстрогения), наличием антител к сперматозоидам. Такая патология шейки матки анатомического характера, как полипы, разрывы и деформация после родов, абортов, операций, последствия конизации, а также воспалительного характера (эндоцервициты различной этиологии – хламидийной, микоплазменной, гонорейной и др.) может препятствовать попаданию эякулята в матку или оказывать на сперматозоиды губительное воздействие.Психосексуальные расстройства
Могут быть у женщин с эмоционально неустойчивой психической сферой при конфликтных ситуациях в семье, на работе; они связаны со стрессовыми ситуациями и длительным психоэмоциональным напряжением. У таких женщин могут развиться чувство неполноценности, одиночества, истерические состояния в период очередной менструации. Такая патология может быть обусловлена неудовлетворенностью половой жизнью, настойчивым желанием иметь ребенка или, наоборот, боязнью беременности, способной вызвать нарушение овуляции.Бесплодие неясного генеза.
При этом виде бесплодия в результате тщательного обследования супругов выяснить причину не всегда удается. Пациентки этойгруппы не могут забеременеть, несмотря на отсутствие видимых объективных причин нарушения репродуктивной функции при сохраненной фертильности супруга. Частота бесплодия неясного генеза колеблется от 4–40% в разных странах мира, что объясняется рядом факторов: особенностями популяции, контингентом обследуемых больных, методологическими подходами при обследовании бесплодной пары, квалификацией врача, технической оснащенностью клиники и лаборатории.Несомненно, с совершенствованием методов обследования и знания причин бесплодия число таких больных будет уменьшаться.
Организация помощи по диагностике и лечению бесплодия в браке
Специализированный прием по бесплодию организуется в консультациях «Брак и семья» и в кабинетах по бесплодию женских консультаций и должен быть обеспечен консультациями андролога, сексопатолога, окулиста, психоневролога, генетика, эндокринолога, терапевта и юриста. На специализированный прием пациентки направляются врачами женских консультаций после первичного осмотра и обследования. На первом специализированном приеме желательно присутствие обоих супругов.Учитывая внедрение в клиническую практику методов определения гормонов в сыворотке крови (радиосатурационный, иммуноферментный, иммунофлюоресцентный), позволяющих выявить поражения гипоталамо–гипофизарно–яичниковой системы и разделить пациенток с бесплодием на 7 клинических групп, предложена следующая схема обследования (рис. 10.1).
 Рис. 10.1. Схема обследования при бесплодии
Рис. 10.1. Схема обследования при бесплодии
I этап.
Важное значение в выявлении причин бесплодия имеет правильно собранный анамнез.Опрашивать женщин рекомендуется по определенной схеме, предложенной ВОЗ: ■ число и исходы предыдущих беременностей: самопроизвольные и искусственные аборты (в том числе криминальные), внематочная беременность, пузырный занос, число живых детей, послеродовые и послеабортные осложнения ■ продолжительность первичного или вторичного бесплодия ■ используемые методы контрацепции и продолжительность их применения после последней беременности или при первичном бесплодии ■ системные заболевания: сахарный диабет, туберкулез, заболевания щитовидной железы, коры надпочечников и др. ■ медикаментозное лечение, которое может оказать кратковременное или длительное отрицательное воздействие на процессы овуляции: цитотоксические препараты и рентгенотерапия органов брюшной полости, психофармакологические средства (транквилизаторы) ■ операции, которые могли способствовать возникновению бесплодия: аппендэктомия, клиновидная резекция яичников, операции на матке и другие операции (по поводу язвенных колитов или пересадка почки и пр.), течение послеоперационного периода ■ воспалительные процессы в органах малого таза и заболевания, передающиеся половым путем (трансмиссивные заболевания), тип возбудителя, продолжительность и характер терапии ■ заболевания шейки матки, их характер и лечение (консервативное, крио– или электрокоагуляция) ■ наличие выделений из молочных желез, связь их с лактацией, продолжительность ■ производственные факторы и окружающая среда, эпидемические факторы, злоупотребление алкоголем, прием токсических средств, курение, материально–бытовые условия ■ наследственные заболевания с учетом родственников 1–й и 2–й степени родства ■ менструальный и овуляторный анамнез (менархе, регулярные циклы, олигоменорея, аменорея I или II), полименорея (продолжительность цикла менее 25 дней или нерегулярные менструации, 1–й день последней менструации), дисменорея ■ половая функция, болезненность при половом сношении (диспареуния) – поверхностная или глубокая.
Объективное обследование: ■ рост, масса тела, индекс массы тела; при наличии ожирения – его тип, когда отмечена прибавка массы тела (после замужества, родов, аборта, в пубертатном периоде) и ее характер (медленное или быстрое нарастание массы тела) ■ наличие галактореи, степень развития молочных желез, характер оволосения, наличие гипертрихоза и его степень, состояние кожи (сухая, влажная, жирная), наличие угревой сыпи, полос растяжения (их количество, места расположения, цвет) ■ рентгенография черепа и турецкого седла ■ исследование глазного дна и полей зрения (цветных) ■ гинекологическое бимануальное исследование и осмотр шейки матки в зеркалах (при осмотре следует указать день цикла, соответствующий дате исследования). Обращается внимание на развитие наружных половых органов, особенно клитора (увеличение более 2 см характерно для вирилизации), на состояние уретры, парауретральных ходов, шейки матки, особенности строения влагалища, его положение, размеры, консистенцию, форму, подвижность, болезненность матки, состояние придатков, сводов влагалища, крестцово–маточных связок (утолщены, напряжены, болезненны при эндометриозе), характер выделений из половых путей ■ при показаниях кольпоскопия.
Таким образом исключают грубые анатомические изменения половых органов как причину бесплодия, некоторые экстрагенитальные заболевания.
Далее нужно применить методы второго этапа обследования.
II этап.
Специальные методы:■ тесты функциональной диагностики используют для определения гормональной активности яичников и с целью выявления овуляции в течение 2–3 циклов ■ гистеросальпингография производится на 6–7–й день менструального цикла (по строгим показаниям) водорастворимым контрастом. Это позволяет выявить пороки развития матки, проходимость маточных труб, диагностировать спаечный процесс в малом тазу и степень его выраженности.
В настоящее время используется чрескатетерная реканализация маточных труб, что позволяет выполнить селективную сальпингографию и получить информацию о наличии изменений в дистальных отделах маточных труб. Эта процедура дает не только диагностические, но и терапевтические возможности ■ гормональные пробы при отсутствии менструации (аменорея) ■ кимографическая пертубация маточных труб, с помощью которой определяется не только проходимость маточных труб, но и их сократительная активность ■ ультразвуковое исследование – динамическое измерение диаметра фолликулов на 13–17–й день менструального цикла и толщины эндометрия. Это необходимо для установления факта овуляции, критериями которой являются: • подъем базальной температуры во 2–й фазе менструального цикла до 37,2–37,4°С в течение 8–10 дней • уровень прогестерона – 15 ммоль/л • секреторная трансформация эндометрия за 3–4 дня до менструации • наличие стигмы в яичнике. В настоящее время с успехом применяется домашний физиотест «Клиаплан» для определения дня овуляции.
Особое значение имеет УЗИ при наличии патологии яичников: выявление увеличения яичников, поликистозных изменений, опухолей.
С использованием анэхогенных и гиперэхогенных контрастных веществ с помощью УЗИ осуществляется контрастная эхогистеросальпингоскопия, которая позволяет получить информацию о полости матки и маточных трубах. При этом визуализируется такая внутриматочная патология, как полипы эндометрия, субмукозная лейомиома, пороки развития, синехии и др. ■ Посткоитальный тест (ПКТ) проводится на 12–14–й день менструального цикла для оценки качества слизи шеечного канала для установления проникновения через нее сперматозоидов. С этой целью используется тест Щуварского – Хунера: исследование цервикальной слизи, взятой после полового сношения, подсчет в ней числа сперматозоидов с активной поступательной подвижностью под микроскопом. При обнаружении больше 5 подвижных сперматозоидов в поле зрения количество сперматозоидов принято считать более чем 20·106 в 1 мл. Тест Шуварского – Хунера: определение проникновения сперматозоидов в каплю цервикальной слизи. Проба проводится на подогретом до 37°С предметном стекле. Положительным считается результат, при котором сперматозоиды совершают поступательное движение на границе контакта со слизью и подвижность их сохраняется в течение 6 ч. Исследуется также наличие антител в крови, что позволяет сделать количественную оценку их концентрации (рис. 10.2). ■ Всем женщинам, страдающим бесплодием, целесообразно провести бактериоскопическое и, при необходимости, бактериологическое обследование, определение содержимого влагалища на степень чистоты. ■ Дополнительные методы обследования. При нарушении проходимости маточных труб показана консультация фтизиогинеколога в тубдиспансере, при необходимости – обследование в условиях кожно–венерологического диспансера; при патологии менструального цикла, выраженном гирсутизме, при наличии в анамнезе абортов или детей с пороками развития следует осуществить медико–генетическое консультирование; при выраженных особенностях поведения рекомендуется консультация психоневролога, при сексуальных расстройствах – консультация сексопатолога; иногда требуется консультация психиатра, эндокринолога.
 Рис. 10.2. Обследование бесплодных женщин с регулярным циклом без клинических проявлений эндокринопатий
Рис. 10.2. Обследование бесплодных женщин с регулярным циклом без клинических проявлений эндокринопатий
III этап.
Этот этап обследования проводится в специализированных гинекологических учреждениях, оснащенных лапароскопами и гистероскопами, позволяющими проводить гистологическое исследование биоптатов эндометрия, яичников, брюшины и маточных труб, а также гормональные исследования (рис. 10.3). ■ Диагностическое выскабливание производится строго по показаниям, биопсия эндометрия за 2–3 дня до начала менструации выявляет наличие секреции. Кроме того, возможно выявление туберкулезного эндометрита, гиперплазии эндометрия, полипоза эндометрия, наличия субмукозной миомы матки, аденомиоза и др. Материал может быть получен с помощью вакуум–аспирациий. Гистологический метод исследования соскоба эндометрия является достаточно точным методом оценки функции яичников. Следует сочетать диагностическое выскабливание с гистероскопией, что позволяет выявить синехии, пороки развития матки и др. ■ Лапароскопия является наиболее информативным методом оценки состояния маточных труб, тазовой брюшины и соседних органов. Рис. 10.3. Алгоритм ведения пациенток с бесплодием
Для оценки спаечного процесса используется следующая классификация:
• I степень – нежные, прозрачные, единичные, бессосудистые спайки
• II степень – спайки сосудистые, единичные, часто нарушающие расположение труб относительно яичников, яичники прикрыты спайками на 1/3
• III степень – грубые, сосудистые, множественные спайки, нарушающие положение органов малого таза, яичники просматриваются на 1/3
• IV степень – область малого таза не визуализируется ввиду обширного спаечного процесса.
Лапароскопия часто проводится с одновременной хромосальпингоскопией метиленовым синим или индигокармином. Трубы осматривают без введения контраста, затем прослеживают движение контраста по трубе и его излитие из фимбриальных отделов, которое классифицируется как свободное или затрудненное. Диагностическая ценность лапароскопии увеличивается при применении гибкого эндоскопа для ампулосальпингоскопии, так как его использование дает и терапевтический эффект. Катетеризация маточных труб под лапароскопическим контролем позволяет обнаружить и устранить межфимбриальные спайки. Для оценки состояния маточных труб может быть использована их микробиопсия, а также радиоизотопное сканирование.
Гистеросальпингография в сочетании с лапароскопией позволяет диагностировать в 85% случаев нарушение проходимости маточных труб.
Лапароскопия позволяет уточнить диагноз при подозрении на синдром поликистозных яичников, выявить характер аномалий развития матки, выяснить причины тазовых болей, выполнить консервативные, малые оперативные вмешательства. В последние годы предлагается использовать фертилоскопию – эндоскопический метод, включающий гистероскопию, трансвагинальную гидролапароскопию (ТВГЛ), сальпингоскопию и микросальпингоскопию. Малая инвазивность, доступность и простота выполнения позволяют рекомендовать ТВГЛ в качестве скрининг–метода для пациенток на начальном этапе обследования супружеской пары.
■ Гормональное обследование – диагноз эндокринного бесплодия ставится после исключения анатомических изменений в органах малого таза и трубах при положительной пробе на биологическую совместимость спермы и шеечного содержимого. Основным симптомом заболевания является снижение функции яичников по типу ановуляции и реже – неполноценной лютеиновой фазы. Важным в этом отношении является определение уровня пролактина, что позволяет выделить две группы больных: с гипер– и нормопролактинемией. Для этого предложена следующая схема:
• группа 1 – гипофункция гипофиза, гипоталамуса
• группа 2 – дисфункция гипофиза, гипоталамуса
• группа 3 – недостаточность яичников
• группа 4 – врожденные или приобретенные аномалии половых путей
• группа 5 – бесплодие с гиперпролактинемией, связанной с опухолью в области гипофиза, гипоталамуса
• группа 6 – бесплодие с гиперпролактинемией без обнаруживаемой опухоли в области гипофиза, гипоталамуса
• группа 7 – аменорея без увеличенного пролактина в плазме крови, связанная с опухолью в области гипофиза, гипоталамуса.
Рис. 10.3. Алгоритм ведения пациенток с бесплодием
Для оценки спаечного процесса используется следующая классификация:
• I степень – нежные, прозрачные, единичные, бессосудистые спайки
• II степень – спайки сосудистые, единичные, часто нарушающие расположение труб относительно яичников, яичники прикрыты спайками на 1/3
• III степень – грубые, сосудистые, множественные спайки, нарушающие положение органов малого таза, яичники просматриваются на 1/3
• IV степень – область малого таза не визуализируется ввиду обширного спаечного процесса.
Лапароскопия часто проводится с одновременной хромосальпингоскопией метиленовым синим или индигокармином. Трубы осматривают без введения контраста, затем прослеживают движение контраста по трубе и его излитие из фимбриальных отделов, которое классифицируется как свободное или затрудненное. Диагностическая ценность лапароскопии увеличивается при применении гибкого эндоскопа для ампулосальпингоскопии, так как его использование дает и терапевтический эффект. Катетеризация маточных труб под лапароскопическим контролем позволяет обнаружить и устранить межфимбриальные спайки. Для оценки состояния маточных труб может быть использована их микробиопсия, а также радиоизотопное сканирование.
Гистеросальпингография в сочетании с лапароскопией позволяет диагностировать в 85% случаев нарушение проходимости маточных труб.
Лапароскопия позволяет уточнить диагноз при подозрении на синдром поликистозных яичников, выявить характер аномалий развития матки, выяснить причины тазовых болей, выполнить консервативные, малые оперативные вмешательства. В последние годы предлагается использовать фертилоскопию – эндоскопический метод, включающий гистероскопию, трансвагинальную гидролапароскопию (ТВГЛ), сальпингоскопию и микросальпингоскопию. Малая инвазивность, доступность и простота выполнения позволяют рекомендовать ТВГЛ в качестве скрининг–метода для пациенток на начальном этапе обследования супружеской пары.
■ Гормональное обследование – диагноз эндокринного бесплодия ставится после исключения анатомических изменений в органах малого таза и трубах при положительной пробе на биологическую совместимость спермы и шеечного содержимого. Основным симптомом заболевания является снижение функции яичников по типу ановуляции и реже – неполноценной лютеиновой фазы. Важным в этом отношении является определение уровня пролактина, что позволяет выделить две группы больных: с гипер– и нормопролактинемией. Для этого предложена следующая схема:
• группа 1 – гипофункция гипофиза, гипоталамуса
• группа 2 – дисфункция гипофиза, гипоталамуса
• группа 3 – недостаточность яичников
• группа 4 – врожденные или приобретенные аномалии половых путей
• группа 5 – бесплодие с гиперпролактинемией, связанной с опухолью в области гипофиза, гипоталамуса
• группа 6 – бесплодие с гиперпролактинемией без обнаруживаемой опухоли в области гипофиза, гипоталамуса
• группа 7 – аменорея без увеличенного пролактина в плазме крови, связанная с опухолью в области гипофиза, гипоталамуса.
Обследование мужа состоит из нескольких этапов.
I этап: ■ первичный опрос ■ общее медицинское обследование: • оценка физического развития (рост, вес, артериальное давление, тип распределения волосяного покрова) • обследование половых органов, пальпация яичек, пальпация простаты при ректальном исследовании, пальпация семенного канатика с целью выявления варикоцеле и его стадий • клинический анализ крови • общий анализ мочи с определением степени бактериурии.
II этап: микроскопическое исследование эякулята мужа.
Нормоспермограмма: ■ оценка сперматозоидов: плотность > 20 млн/мл ■ подвижность > 25% с активно–прогрессивным движением сперматозоидов; определяется через 60 мин с момента эякуляции ■ морфология > 50% нормальных форм ■ агглютинация – нет ■ оценка семенной жидкости: объем – 2,0 мл ■ вид и вязкость – нормальная ■ рН – от 7,2 до 7,8 ■ лейкоциты – 1,0·106 / мл ■ культура – негативная или 1000 бактерий в 1 мл ■ биохимия – нормальная.
Исследование выполняется дважды с интервалом в 15 дней с половым воздержанием 4–5 дней и однократным бактериологическим исследованием. Следует проводить анализ сока простаты с его микроскопией и бактериологическим исследованием. При выявлении большого количества патологических по строению (аномальных) сперматозоидов показано дополнительное исследование – морфологический анализ спермы, который позволяет более точно определить характер патологии сперматозоидов, количество нормальных форм и служит одним из критериев выбора метода лечения бесплодия (табл. 10.1).
Таблица 10.1. Клинические схемы терапии больных с гормональным бесплодием
| Основные лекарственные средства | Альтернативные комбинации лекарственных средств |
|---|---|
| Заместительная терапия при недостаточности лютеиновой фазы прогестероном по 1 мл 2,5% раствора внутримышечно с 16–го по 23–й день цикла | Нарколут по 5 мг per os с 16–го по 23–й день менструального цикла. |
| Дюфастон по 10 мл per os с 16–го по 23–й день менструального цикла | |
| Кломифена цитрат (клостильбегит, кломид) с 5–го по 9–й день цикла с 50 мг, при неэффективности доза повышается до 150 мг/сут. Рекомендуется 6 циклов подряд | Хориальный гонадотропин на 2,4,6–й дни повышения базальной температуры после назначения кломифена в дозе 1500–2000 МЕ (до 10.000 МЕ) внутримышечно. Максимально проводят не более 3 циклов. Для суперовуляции сочетают кломифен с пергоналом: кломифен в суточной дозе 50–150 мг, начиная со 2–3–го дня менструального цикла в течение 5 дней. Пергонал вводится через день на 3,5,7–й дни после селекции доминантного фолликула – ежедневно, до достижения лидирующим фолликулом диаметра 16–18 мм и уровня эстрадиола, соответствующего 200–400 м/кг на каждый фолликул диаметром более 14 мм |
| Тамоксифен (обладает сходным с кломифеном действием) назначают с 5–го по 9–й день цикла в дозе 10–20 мг в день | – |
| При гиперпролактинемии назначается бромокриптин 2,5–7,5 мг/сут per os в течение 4–6 циклов с 1–го дня. Парлодел может назначаться с 1/4–1/2 таблетки (в таблетке 2,5 мг), постепенно дозу увеличивают до 2,5 мг (не более 12,5 мг/сут) | Абергин – 4–16 мг/сут на 2–3 приема. Дозы подбираются индивидуально. Норпролак – начальная доза 0,025 мг 1 раз в сутки в течение 3 дней; 0,05 мг – последующие 3 дня; с 7–го дня суточная доза 0,075 мг. |
| Достинекс – 0,5 мг 2 раза в неделю. Мастодион в дозе 30 капель 3 раза в день внутрь на протяжении 3 месяцев без перерыва | |
| Комбинированные эстроген–гестагенные препараты назначают в целях reboud–эффекта в течение 2–3 курсов с 5–го по 25–й день цикла. Проводить не менее 3 циклов | – |
| При гиперандрогении применяется дексаметазон по 0,25–0,5 мг/сут в течение 6 месяцев | Возможно сочетание дексаметазона и кломифена, назначение эстроген–гестагенных препаратов после проведения лечения дексаметазоном в течение 6 месяцев. Ципротерона ацетата (ЦА) в первые 10 дней цикла при выраженном гирсутизме 12,5–25 мг/сут, на 10–15–й дни цикла. ЦА по 50 мг с 5–го по 25–й день менструального цикла, с 15–го по 25–й день дополнительно эстрогель по 3 мг (можно «Прогинова» по 2 мг) 10–20 дней. Диане 35, 50; Диане 35 + Андрокур. Агонисты гонадотропин–рилизинг–гормона (нафарелин, госерилин и др.). Нестероидные антиандрогены: верошпирон, флутамид, циметидин, низорал |
| Люлиберин по 10 мкг каждые 2 ч подкожно и внутривенно в дозе 5 или 20 мкг соответсвенно каждые 2 или 3 ч во 2–ю фазу цикла. При по–ликистозе яичников лечение курсами эстроген–гестагенными препаратами (препаратом выбора является Диане–35), кломифеном по описанным схемам. | Дюфастон 20 мг/сут или утражестан 200 мг при пероральном приеме 300 мг при интравагинальном назначении с 16–го по 25–й день цикла, 3–6 месяцев. Диане–35 в сочетании с андрокуром. Мастодинон в дозе 30 капель 3 раза в день внутрь на протяжении 3 месяцев без перерыва. Жаннин, белара, ярина. Антиэстрогены и ингибиторы |
| Проводится не более 6 циклов | ароматазы (кломифена цитрат, тамоксифен, летрозол). Гонадотропины: мочевые (человеческий менопаузный гонадотропин – ЧМГ) и рекомбинантные препараты ФСГ (фоллитропин–альфа) ЛГ (лутропин–альфа), ХГЧ (хориогонадотропин–альфа). Аналоги ГнРГ (агонисты и антагонисты). Сенситайзеры к инсулину (розиглитазон, пиоглитазон, метформин). Препараты других групп, потенцирующие эффекты кломифена (КОК, дексаметазон). Оперативное лечение является 2–м этапом терапии. После клиновидной резекции яичников или демедуляции яичников при отсутсвии эффекта возможно проведение названного гормонального лечения |
| Блокаторы простагландиногенеза (напросин, аспирин, индометацин) | – |
III этап. Совместимость слизи канала шейки матки и спермы, посткоитальный тест. Ценность его заключается в том, что он позволяет уточнить индивидуальную совместимость спермы и цервикальной слизи у данной супружеской пары и исключить или с большой степенью вероятности подтвердить иммунологическое бесплодие.
IV этап. При обследовании мужчины в трудных для диагностики случаях определяется его гормональный статус, иногда необходима биопсия яичка, вазография, везикулография.
При подозрении на хромосомную патологию проводят медикогенетическое консультирование, исследование полового хроматина и кариотипа супругов.
Для дополнительного исследования используют маммографию, компьютерную томографию, ядерно–магнитный резонанс.
В зависимости от результатов обследования анатомо–физиологических особенностей, характера менструальной функции, гормональных нарушений определяется выбор метода лечения.
Лечение
Трубно–перитонеальное бесплодие.
Лечение бесплодия трубного и перитонеального генеза с анатомическими изменениями предусматривает купирование воспалительного процесса, восстановление проходимости маточных труб и их функциональной полноценности.Учитывая частое поражение маточных труб факторами воспалительного генеза, вначале проводится противовоспалительное лечение препаратами в соответствии с выявленными микробными агентами и определением их чувствительности к антибактериальным средствам. Это лечение обязательно для обоих супругов. При хронических процессах широко используются продигиозан, гоновакцина, биогенные стимуляторы, физиопроцедуры, провоцирующие обострение заболевания с целью усиления эффективности антибактериальной терапии. В последующем применяются иммунокорректоры, ферменты, бальнеотерапия, воздействие физическими факторами и санаторно–куротное лечение через 6 месяцев после обострения воспалительного заболевания. Широко используются иглорефлексотерапия, грязелечение, гинекологический массаж. Назначение гидротубаций для восстановления проходимости маточных труб в настоящее время дискутабельно. Широкое распространение получили эфферентные методы лечения – плазмаферез, эндоваскулярное лазерное облучение крови, озонотерапия крови.
По показаниям может быть проведена гормональная коррекция менструального цикла.
При отсутствии эффекта от консервативной терапии используется хирургическое лечение (пластические операции на трубах).
Основные виды операций: ■ фимбриолиз – освобождение фимбрий от сращений ■ сальпинголизис – разделение сращений вокруг труб, ликвидация перегибов и искривлений ■ сальпингостоматопластика – создание нового отверстия в маточной трубе с запаянным ампулярным концом ■ сальпинго–сальпингооанастомоз, заключающийся в резекции трубы с иссечением суженной облитерированной части ■ пересадка трубы в матку, которая производится при окклюзии трубы в интрамуральной части и сохранении ее проходимости в среднем и дистальном отделах.
Следует помнить о том, что для проведения микрохирургических пластических операций на маточных трубах существует много противопоказаний: туберкулез половых органов; возраст больной старше 30 лет, длительность трубного бесплодия более 2–3 лет и бесперспективное консервативное лечение более 1,5–2 лет, частые обострения воспалительного процесса в придатках матки и недавно (до года) перенесенный острый воспалительный процесс, наличие больших гидросальпинксов, при удалении которых остается не более 5 см трубы, выраженный (III степень) спаечный процесс в малом тазу.
Многие виды оперативных вмешательств выполняются при лапароскопии. Лапаротомия для выполнения реконструктивнопластических операций на маточных трубах почти не применяется, поскольку такое оперативное вмешательство приводит к образованию выраженного спаечного процесса. При операции на маточных трубах важна не только техника выполнения, но и те мероприятия, которые параллельно во время операции и в послеоперационном периоде проводятся для предотвращения спаечного процесса в малом тазу.
Лечение является успешным в 30–60% случаев благодаря внедрению в практику современных медикаментозных средств, немедикаментозной терапии, лапароскопии, при которой с высокой эффективностью проводятся операции на трубах, коагуляция эндометриоидных гетеротопий, устранение спаечного процесса в малом тазу, клиновидная резекция яичников, коагуляция и каутеризация поликистозных яичников. Реабилитация больных после операций на маточных трубах включает проведение комплексного противовоспалительного лечения, общеукрепляющей терапии, коррекции гормонального статуса больной, иммунокоррекцию, санаторно–куротное лечение. Эти пациентки включаются в диспансерную группу больных в женской консультации.
Лечение функционального трубного бесплодия включает использование седативных препаратов, психотерапию, аутосуггестию, применение транквилизаторов, спазмолитических средств, блокаторов простагландинов, гормональную коррекцию. Применяется также бальнеотерапия, физиопроцедуры, в том числе электростимуляция маточных труб.
Эндокринное бесплодие.
Ановуляция – одна из наиболее частых причин гормонального бесплодия.Основные формы эндокринного бесплодия: ■ гонадотропная недостаточность ■ синдром поликистозных яичников ■ яичниковая недостаточность ■ гиперпролактинемия ■ гипотериоз.
Ановуляция может быть результатом недостаточности лютеиновой фазы менструального цикла (НЛФ). Эта патология возникает в результате нарушения функции яичников как результат гипофункции желтого тела яичника. В слизистой матки не происходит секреторной трансформации эндометрия, изменений функции маточных труб, имплантации оплодотворенной яйцеклетки. Не только бесплодие, но и невынашивание может быть результатом недостаточности лютеиновой фазы менструального цикла. Функция желтого тела яичника определяется не только недостаточностью прогестерона, но и содержанием окситоцина, вазопрессина, уровнем ЛГ, ПРЛ, эстрогенов и простагландинов.
По данным литературы, восстановление генеративной функции и бесплодия гормонального генеза происходит в 30– 60% случаев, овуляторный менструальный цикл определяется у 70–90% женщин, проходящих лечение и др.
Во время лечения больная должна обследоваться в дни, соответствующие овуляции, для определения эстрогенной насыщенности по тестам функциональной диагностики, во 2–й фазе цикла (на 7–9–й день подъема базальной температуры) – для определения гиперстимуляции яичников. Измерять базальную температуру необходимо во всех циклах лечения, при задержке менструации более 16–18 дней, повышении базальной температуры до 37,5°С необходимо провести исследование с целью диагностики беременности (определение уровня хорионического гонадотропина, УЗИ). До уточнения диагноза следующие циклы лечения назначать нельзя. Терапию бесплодия при функциональной гиперпролактинемии следует начинать с лечения заболеваний органов малого таза, являющихся ведущими в генезе бесплодия у данного контингента больных. Парлодел в непрерывном режиме назначают только при устойчивом повышении уровня пролактина, не снижающегося после терапии органической патологии органов малого таза.
Комплексная поэтапная терапия бесплодия у пациенток с функциональной гиперпролактинемией с учетом всех факторов генеза заболевания позволяет восстановить репродуктивную функцию у 47,2% больных.
У женщин с эндокринным бесплодием после наступления беременности вероятно неблагоприятное ее течение, многоплодие, невынашивание, осложнения родов. Исходы для новорожденных противоречивы, врожденные пороки развития у них встречаются чаще. В настоящее время разработаны методы антенатальной диагностики, стимуляции овуляции, новые технологии в лечении бесплодия, поэтому беременность наступает и заканчивается родами у женщин не только до 35 лет, но и более старших по возрасту. Однако следует помнить о риске для матери и плода с учетом возраста женщины, длительности бесплодия, особенностей гормональной патологии, наличия экстрагенитальных заболеваний и др.
Маточные формы бесплодия.
Лечение больных с маточной формой аменореи: пациентки с так называемыми немыми циклами, у которых нет реакции на заместительную гормональную пробу (отторжения эндометрия при этом не происходит), лечению не подлежат. Остальным больным лечение назначается в зависимости от причин бесплодия. При туберкулезном эндометрите проводят специфическое лечение в противотуберкулезном диспансере, при наличии синехий – под контролем гистероскопии необходимо произвести их разрушение, возможно введение ВМС после этого на 2–3 месяца и циклическая гормональная терапия. Мнения по поводу последующего введения ВМС в настоящее время разноречивы, так как при этом возникает асептическое воспаление эндометрия. После окончания лечения проводится контрольная ГСГ.При выявлении аномалий развития матки, фибромиомы проводится хирургическое лечение – реконструктивно–пластические операции. Они применяются и при патологии шейки матки, если в результате предшествующих родов, абортов, операций имеет место рубцовая деформация шейки или аномалии ее развития.
Поражение матки эндометриозом предполагает специальное лечение.
Прогноз при маточном генезе бесплодия недостаточно благоприятный, результат лечения зависит от степени и глубины поражения базального слоя эндометрия.
Одним из методов вспомогательной репродукции стало так называемое суррогатное материнство. Эмбрион целесообразно имплантировать в матку приемной матери тогда, когда у генетической матери отсутствует или значительно недоразвита собственная матка, но функционируют яичники. Оплодотворение извлеченных из них яйцеклеток сперматозоидами мужа обеспечивает формирование генетического для данной пары эмбриона, который и переносится в матку суррогатной матери.
Эта программа используется также в случаях, когда женщина не имеет шанса стать матерью из–за тяжелых заболеваний (сердца, почек и т.д.).
В настоящее время таким способом зачаты и рождены десятки тысяч детей, хотя дискуссии об этических проблемах суррогатного материнства продолжаются до сих пор.
Шеечный фактор.
Устранение шеечного фактора бесплодия проводится в зависимости от причины этой патологии. Чаще всего требуются противовоспалительное лечение, нормализация гормонального гомеостаза. При наличии антиспермальных антител рекомендуется применение презервативов в течение 6 месяцев на фоне десенсибилизирующей терапии; если это лечение оказывается неэффективным, используются технологии искусственного осеменения; при наличии анатомических изменений шейки матки необходимо применить реконструктивно–пластические операции.Иммунологическое бесплодие.
К методам лечения женского бесплодия этого генеза относится искусственное осеменение – введение чужеродного генетического материала в виде спермы в половые пути женщины с целью наступления беременности.Различают следующие методы введения спермы: ■ влагалищный ■ внутришеечный ■ внутриматочный (введение спермы в полость матки) – наиболее эффективный способ.
Искусственное осеменение может проводиться спермой мужа или спермой донора.
Искусственное осеменение спермой мужа (ИОСМ) проводят при наличии показаний со стороны мужа: гипоспадия уретры, импотенция, отсутствие эякуляции, олигоспермия с сохраненной нормальной подвижностью сперматозоидов при отсутствии морфологических изменений в них.
Показания со стороны женщины: наличие анатомических изменений шейки матки, не поддающийся лечению вагинизм, наличие антиспермальных антител в цервикальной слизи. Противопоказания: острые и хронические воспалительные заболевания половых органов, эрозии и псевдоэрозии шейки матки.
Процедуру ИОСМ проводят амбулаторно 2–3 раза в течение менструального цикла на 12–14–й день цикла (при 28–дневном цикле).
Женщинам с неполноценной лютеиновой фазой цикла рекомендуется после искусственного осеменения введение препаратов, стимулирующих развитие желтого тела, при удлиненной фолликулярной фазе цикла проводят стимуляцию созревания фолликула и овуляции. Обязательным условием наблюдения после искусственного осеменения является измерение базальной температуры.
Искусственное осеменение спермой донора (ИОСД) (рис. 10.4) проводят при наличии показаний: абсолютное – азооспермия мужа; относительные – олигоастеноспермия с морфологическими изменениями сперматозоидов, не поддающийся лечению иммунологический конфликт по резус–фактору, наследственные, генетически обусловленные заболевания в семье мужа.
 Рис.10.4. Введение в матку сперматозоидов
Рис.10.4. Введение в матку сперматозоидов
Многие авторы считают, что недопустимо проведение ИОСД у незамужних, разведенных и овдовевших женщин, без согласия женщины под наркозом, по евгенетическим причинам, из расистских побуждений «облагораживания расы».
Противопоказания – те же, что и при ИОСМ.
Процедуру проводят после получения согласия обоих супругов. Донор должен быть моложе 36 лет, физически и психически здоровым, не иметь наследственных заболеваний и нарушений развития. У родственников 1–й степени родства не должно быть более одного случая потери плода и спонтанного аборта. При подборе донора учитывают резус– и групповую принадлежность крови, обязательной является постановка реакции Вассермана, реакции на СПИД. Учитывается фенотип донора: цвет волос, глаз, телосложение, рост.
Для ИОСД используют нативную и консервированную сперму. Наиболее распространенным методом консервации является криоконсервация в жидком азоте, позволяющая создавать банк спермы и длительно хранить ее. В течение трех последовательных циклов следует применять сперму одного донора.
Частота беременности после ИОСМ и ИОСД примерно одинакова и достигает 30–70%. Течение беременности и родов такое же, как при нормальном зачатии, аномалии развития плода отмечают не чаще, чем в популяции.
 Рис. 10.5. Введение сперматозоида в цитоплазму яйцеклетки
Рис. 10.5. Введение сперматозоида в цитоплазму яйцеклетки
Одним из методов осеменения является трансабдоминальное введение свободных от семенной плазмы сперматозоидов вместе с полученной ранее пункцией фолликула 1–2 яйцеклетками. Процедуру повторяют 3–5 раз в течение менструального цикла (рис. 10.5). Применяется также механический метод контрацепции в течение 6 месяцев для устранения фактора антителообразования на фоне десенсибилизирующей терапии. Глюкокортикоиды для этой цели в последнее время применять не рекомендуется.
При лечении бесплодия, обусловленного иммунологическими факторами, применяется и антибактериальная терапия, так как инфекция способствует образованию антиспермальных антител.
Экстракорпоральное оплодотворение.
Экстракорпоральное оплодотворение (ЭКО) и трансплантация эмбриона (ТЭ) – оплодотворение яйцеклетки (ооцитов) вне организма и пересадка дробящихся эмбрионов в полость матки.Показания для ЭКО: ■ абсолютное трубное бесплодие (состояние после двусторонней тубэктомии) ■ непроходимость или затрудненная проходимость обеих маточных труб при отсутствии эффекта от ранее проведенного или длительного (более 5 лет) консервативного лечения ■ бесплодие неясного генеза после проведенного полного клинического исследования, включая гормональное, эндоскопическое, иммунологическое ■ субфертильность спермы мужа при отсутствии эффекта при проведении гомологического осеменения.
Условия проведения ЭКО: ■ сохраненная в полном объеме функциональная способность матки к имплантации и вынашиванию беременности ■ отсутствие противопоказаний к беременности и родам (соматические, психические, генетические заболевания) ■ сохраненная способность яичников к адекватному ответу на стимуляцию овуляции (экзогенную или эндогенную) ■ отсутствие новообразований, воспалительных и анатомических изменений в органах малого таза.
При отсутствии этих условий, а также женщинам старше 40 лет ЭКО проводить нежелательно, хотя в последнее время появились сообщения о рождении детей у женщин в состоянии постменопаузы.
Последовательность проведения метода: ■ стимуляция суперовуляции ■ аспирация ооцитов ■ оплодотворение ооцитов ■ культивирование оплодотворенных ооцитов ■ перенос дробящихся эмбрионов в матку.
Индукция суперовуляции (гормональная стимуляция яичников) проводится для получения сразу нескольких зрелых яйцеклеток в течение одного менструального цикла. Это повышает вероятность наступления беременности в программах ЭКО.
Для контроля ранних сроков развивающейся беременности проводят динамическое определение β–субъединицы хорионического гонадотропина, которое помогает установить беременность с 7–9–го дня после ТЭ. При наступлении беременности за женщинами ведется постоянное наблюдение методами, принятыми для ведения беременности и родов женщин с отягощенным акушерским анамнезом.
Частота наступления беременности достигает, по данным разных авторов, 50%, частота абортов – 29%, внематочной беременности – 6%, многоплодной беременности – 12%.
При этом дети при длительном наблюдении за их развитием практически не отличаются по основным показателям врожденной патологии и заболеваемости от детей в общей популяции.
В настоящее время расширился круг показаний к использованию методов вспомогательной репродукции. ЭКО стали применять при мужской инфертильности, эндометриозе и т.д. При проходимых маточных трубах предложено переносить эмбрионы и даже гаметы непосредственно в трубы без оплодотворения in vitro, а также осуществлять совместный перенос гамет (яйцеклеток и сперматозоидов) при идиопатическом бесплодии в неизмененные маточные трубы – ГИФТ, аналогичный перенос зигот (эмбрионов на стадии пронуклеусов) при сомнении наступления оплодотворения в случае сниженнных показателей спермы – ЗИФТ.
Достижения в криоконсервации биологических объектов способствуют использованию донорских гамет и эмбрионов в некоторых случаях бесплодия.
Новым рубежом в развитии методов вспомогательной репродукции стали успехи в разработке микроманипуляционной работы с половыми клетками и эмбрионами. С помощью специального оборудования проводят диссекцию (микрохирургическую или с помощью лазера) блестящей оболочки для оплодотворения in vitro при значительном снижении концентрации и подвижности сперматозоидов, а также для оптимизации процесса «вылупления» бластоцист. Разработка техники инъекции сперматозоида непосредственно в ооплазму создает перспективу получения беременности при наличии в эякуляте хотя бы одного живого (не обязательно подвижного) сперматозоида (ИКСИ). При азоо– и аспермии мужские половые клетки можно получить непосредственно (рис. 10.5, 10.6) из яичка путем его пункции (ТЕЗА) или придатка яичка (МЕЗА). Это варианты программы ИКСИ, которую проводят при отсутствии сперматозоидов в эякуляте, когда с помощью консервативных (гормональное, противовоспалительное) или хирургических методов не удается преодолеть мужское бесплодие.
 Рис. 10.6. Схема пункции яичка и придатка яичка
Рис. 10.6. Схема пункции яичка и придатка яичка
Важным достижением в разработке и осуществлении вспомогательной репродукции является разработка технологий предимплантационной диагностики, что позволяет диагностировать у эмбриона наследственную патологию еще до имплантации. Предимплантационная диагностика позволяет избежать инвазивных процедур (амниоцентез и хорионбиопсия) для выявления патологии плода и при необходимости – искусственного прерывания беременности.
В последние годы разрабатываются методы предимплантационной и внутриутробной генной терапии.
Таким образом, разработка методов вспомогательной репродукции позволяет преодолеть бесплодие в самых тяжелых случаях патологии у мужчин и женщин. Ежегодно около 700.000 супружеских пар в мире обретают радость появления детей с помощью центров репродукции.
В связи с трудностями диагностики и лечения больных, страдающих бесплодием, и не всегда положительными результатами терапии важное значение имеет своевременное предупреждение бесплодия. Оно должно начинаться еще в детском возрасте с предупреждения воспалительных заболеваний половых органов, которые нередко возникают на фоне перенесенных детских инфекций – паротита, скарлатины, дифтерии, кори, влияющих на процесс образования фолликулов в яичниках и нарушающих формирование полового аппарата у девочек, что может явиться причиной первичного бесплодия. При обнаружении отклонений от нормы в общем физическом развитии или нарушении менструальной функции школьный врач и детский гинеколог обязаны взять таких девочек на диспансерный учет для своевременного проведения лечения.
Выявленные у женщин воспалительные заболевания внутренних половых органов, возникшие после абортов, родов, оперативных вмешательств на органах малого таза, должны быть излечены, так как в противном случае могут возникнуть спаечные процессы в придатках матки, которые и нарушат проходимость труб.
Необходимо проводить широкую санитарно–просветительную работу среди женщин по разъяснению вреда абортов и опасности возникновения воспалительных заболеваний в матке и ее придатках, вреда венерических заболеваний, которые могут явиться причиной бесплодия.
Профилактикой бесплодия также можно считать гигиену брака. Физиологически организм женщины может быть подготовлен к материнству в возрасте 18–20 лет, но не в период полового созревания. Поэтому ранняя половая жизнь может привестик нарушению всех функций женского организма. Важной составной частью санитарно–просветительной работы является половое воспитание. Новобрачные должны обращаться в консультацию медико–генетических учреждений в тех случаях, когда в роду одного из будущих супругов имеется наследственная патология.
Следует отметить, что чем раньше начата реабилитационная терапия, тем больше вероятность достижения положительного результата при совместных усилиях педиатра, терапевта, венеролога, эндокринолога, акушера–гинеколога.
Глава 11. Аномалии положения женских половых органов
Проблема аномалий положения женских половых органов продолжает оставаться в центре внимания хирургов–гинекологов, так как несмотря на многообразие различных методов, при хирургическом лечении этих больных все еще имеют место рецидивы заболевания, связанные не только с несостоятельностью восстановленных мышц тазового дна, но и с несовершенством проведенного оперативного лечения. Решение этой проблемы особенно важно при лечении больных репродуктивного и трудоспособного возраста.Из аномалий положения женских половых органов наиболее широко распространены в гинекологической практике опущение и выпадение внутренних половых органов, которые наблюдаются у 10,0% женщин моложе 30 лет, у 40,2% женщин в возрасте от 30 до 45 лет и у 50% женщин старше 50 лет. В структуре показаний к плановому оперативному лечению гинекологических больных пролапс гениталий занимает третье место после доброкачественных опухолей матки и яичников, эндометриоза.
Аномалии положения половых органов – это стойкое отклонение от их нормального положения, возникающее в связи с гинекологическими заболеваниями (воспалительные процессы, эндометриоз, опухоли и др.); повреждениями промежности, влагалища, связочного аппарата (например, при родовых травмах); врожденными нарушениями и приобретенными заболеваниями, снижающими тонус тканей половых органов и мышечно–соединительнотканных структур.
Нормальным считается положение половых органов у здоровой небеременной и некормящей женщины фертильного возраста, находящейся в вертикальном положении, при опорожненных мочевом пузыре и прямой кишке.
В период половой зрелости матка располагается по средней линии малого таза на одинаковом расстоянии от симфиза и крестца, боковых стенок малого таза. Дно матки обращено кверху и кпереди и не выходит за пределы плоскости входа в малый таз. Влагалищная часть шейки матки и наружный зев цервикального канала находятся на уровне спинальной плоскости; влагалищная часть шейки матки обращена книзу и кзади, наружное отверстие цервикального канала примыкает к стенке влагалища в области заднего свода. На месте перехода тела матки в шейку образуется тупой угол, открытый кпереди; вершина угла находится на уровне внутреннего зева. Маточные трубы располагаются почти горизонтально, на уровне яичников они изгибаются книзу и кзади, вследствие чего их ампулярные концы приближаются к яичникам. Яичники находятся на задних листках широких связок и примыкают к брюшине задней стенки малого таза, косо направляясь снизу и спереди вверх и кзади. Передняя и задняя стенки влагалища соприкасаются, задний свод примыкает к матке на более высоком уровне, чем передний.
Физиологическое положение матки, труб и яичников обеспечивается: ■ подвешивающим аппаратом, к которому относятся круглые и широкие маточные связки; собственные и подвешивающие связки яичника ■ закрепляющим аппаратом – крестцово–маточные, кардинальные, пузырно–маточные и пузырно–лобковые связки ■ поддерживающим аппаратом, включающим мышцы тазового дна, наиболее важными из которых в плане обеспечения противодействия внутрибрюшному давлению являются мышцы, поднимающие задний проход.
Нормальному положению половых органов способствует ряд факторов: собственный тонус половых органов, определяемый уровнем половых гормонов, кровообращением, функциональным состоянием нервной системы; согласованная деятельность диафрагмы, передней брюшной стенки и тазового дна, при которой регулируется внутрибрюшное давление и обеспечивается прилегание друг к другу поверхностей внутренних органов.
Положение половых органов зависит от возраста: в детстве матка и придатки располагаются высоко в малом тазу; в старческом возрасте вследствие атрофии мышц тазового дна и связок матка опускается книзу и нередко отклоняется кзади.
Этиология и патогенез
Этиологические факторы ретродевиаций матки разнообразны, но часто непосредственной причиной является расслабление связочного аппарата (подвешивающего, закрепляющего) и мышц тазового дна вследствие гипоплазии, возрастной гипотрофии и атрофии половых органов; многократных частых родов, особенно осложненных хирургическими вмешательствами и инфекцией. Кроме того, возникновению ретроверзии и ретрофлексии матки способствуют воспалительные заболевания женских половых органов и наружный эндометриоз, сопровождающиеся образованием спаек и рубцов, опухоли передней поверхности матки.Аномалии положения половых органов наблюдаются чрезвычайно редко у нерожавших женщин или у женщин, имеющих одни неосложненные роды. Они обусловлены конституциональными особенностями организма (инфантилизм, астеническое телосложение, неполноценное питание), тяжелым физическим трудом (особенно при его раннем начале и достаточной продолжительности), системным дефектом соединительной ткани (дисплазией). У многорожавших женщин данная патология встречается довольно часто вследствие расслабления мышц передней брюшной стенки и тазового дна.
Смещения матки и влагалища могут возникать вследствие таких аномалий развития, как spina bifida, когда развивается паралич III и IV крестцовых нервов, иннервирующих мышцы тазового дна.
Опущение и выпадение внутренних половых органов – по–лиэтиологическое заболевание. Основными причинами возникновения пролапса гениталий являются повышение внутрибрюшного давления экзо– или эндогенного характера и несостоятельность мышц тазового дна, связочного аппарата матки, которые обусловлены: ■ повреждениями мышц промежности и тазовой диафрагмы в родах, особенно заканчивающихся родоразрешающими оперативными вмешательствами (наложение акушерских щипцов, извлечение плода за тазовый конец, вакуум–экстракция плода и др. ). Определенное значение в развитии акушерского травматизма имеет снижение эластичности тканей родовых путей и промежности (пожилой возраст первородящей, рубцы после предшествующих травм и др.) ■ несостоятельностью соединительнотканных структур в виде «системной» недостаточности, что проявляется наличием грыж других локализаций, опущением других внутренних органов ■ нарушением синтеза стероидных гормонов (эстрогенная недостаточность, приводящая к процессам возрастной атрофии матки, ее связочного аппарата и мышц тазового дна, нарушению трофики эпителия мочепузырного треугольника и уретры, к снижению чувствительности адренорецепторов шейки мочевого пузыря и тургора тканей за счет их обезвоживания) ■ хроническими заболеваниями, сопровождающимися нарушением обменных процессов, микроциркуляции, внезапным частым повышением внутрибрюшного давления.
У пациенток с опущением и выпадением половых органов наличие ярко выраженной наследственной предрасположенности, частое сочетание пролапса с грыжами другой локализации, спланхноптозом, варикозной болезнью, гипермобильностью суставов указывают на возможность генетически детерминированной дисплазии соединительной ткани.
Опущению и особенно выпадению матки и влагалища сопутствуют значительные изменения в половой и мочевой системе. Изменяется положение прямой кишки, мочевого пузыря и уретры, тазовых отделов мочеточников, происходит смещение, изменение положения устьев мочеточников, нередко возникает расширение и снижение тонуса не только мочеточников, но и сфинктера мочевого пузыря. Вследствие топографических изменений у 85,5% больных с пролапсом гениталий развиваются функциональные расстройства смежных органов: недержание мочи – у 70,1% пациенток, нарушение дефекации – у 36,5%, диспареуния – у 53,3%.
Отмечаются сухость стенок влагалища, истончение слизистой оболочки или, наоборот, резкое ее утолщение, пролежни; при гистологических исследованиях обнаруживают нарушения микроциркуляции, гипер– и паракератоз, воспалительные инфильтраты и склероз. Наблюдаются элонгация шейки матки и ее гипертрофия, псевдоэрозия, полипы канала шейки матки, лейкоплакия, эндоцервицит.
Особую значимость приобретает неуклонное прогрессирование заболевания, приводящее к развитию не только гинекологических, но и социальных проблем: к снижению трудоспособности вплоть до полной ее утраты, социальной дезадаптации, психоневрологическим нарушениям.
Классификация и клиническая картина
Различают следующие аномалии положения половых органов.Неправильные загибы (флексии) и наклонения (верзии) матки: ■ гиперантефлексия матки – патологический перегиб тела матки кпереди (между телом и шейкой матки создается острый угол менее 70°) ■ ретроверзия – тело матки наклонено кзади, шейка матки – кпереди ■ ретрофлексия – перегиб тела матки кзади; угол между телом матки и ее шейкой открыт кзади ■ ретродевиация матки – сочетание ретрофлексии и ретроверзии ■ декстроверзия – тело матки наклонено вправо, шейка матки – влево ■ синистроверзия – тело матки наклонено влево, шейка матки – вправо.
Смещение женских половых органов в вертикальной плоскости: опущение и выпадение влагалища и матки, опущение яичников и труб, выворот и приподнятие (элевация) матки.
Опущение влагалища характеризуется выпячиванием из половой щели нижней его трети, выпадение – опущением и верхней трети.
Опущение и выпадение стенок влагалища может быть изолированным или сочетаться с опущением или выпадением стенки мочевого пузыря (при опущении (выпадении) передней стенки влагалища) и опущением или выпадением передней стенки прямой кишки (при опущении (выпадении) задней стенки влагалища).
Опущение матки – расположение ее ниже нормального уровня: влагалищная часть шейки матки (наружный зев) находится ниже интерспинальной плоскости, но из половой щели не показывается даже при натуживании.
Выпадение матки – матка выходит за пределы половой щели полностью (полное выпадение) или частично, иногда только шейка (неполное выпадение). По классификации К.Ф. Славянского различают:
Смещение влагалища книзу: ■ опущение передней стенки влагалища, задней или обеих вместе, но стенки не выходят за пределы входа во влагалище ■ частичное выпадение передней влагалищной стенки и части мочевого пузыря, задней и части передней стенки прямой кишки или комбинация обоих выпадений; стенки выходят кнаружи от влагалищного входа ■ полное выпадение влагалища, которое сопровождается выпадением матки.
Смещение матки книзу: ■ опущение матки – шейка матки находится на уровне lig. interspinalis, но не выходит за пределы входа во влагалище даже при повышении внутрибрюшного давления ■ частичное (начинающееся) выпадение матки – шейка матки выходит за пределы половой щели при физическом напряжении и повышении внутрибрюшного давления (потуживание, кашель, чихание, поднятие тяжестей и др.) ■ неполное выпадение матки: вне половой щели определяется не только шейка матки, но и часть тела матки ■ полное выпадение матки: вне половой щели, между выпавшими стенками влагалища, определяется вся матка, при этом можно свести указательный и средний пальцы обеих рук над дном матки.
Опущение матки обычно сочетается с опущением влагалища.
Различают пять степеней опущения стенок влагалища, матки и их выпадения: ■ I степень – начальная стадия опущения, при которой половая щель зияет, а передняя и задняя стенки влагалища незначительно опущены ■ II степень – опущение стенок влагалища сопровождается опущением мочевого пузыря и передней стенки прямой кишки ■ III степень – матка опущена, шейка доходит до входа во влагалище ■ IV степень – неполное выпадение матки, при котором шейка выступает за пределы входа во влагалище ■ V степень – полное выпадение матки с выворотом стенок влагалища.
Элевация – смещение матки вверх, когда наружный зев шейки оказывается выше интерспинальной линии, дно матки располагается выше плоскости входа в малый таз.
Смещение матки в горизонтальной плоскости или изменение позиции – это смещение матки, при котором сохраняется нормальный тупой угол между шейкой и телом: ■ антепозиция – смещение матки кпереди ■ ретропозиция – смещение матки кзади ■ латеропозиция – боковое смещение матки: декстропозиция – смещение матки вправо; синистропозиция – смещение матки влево.
Редкие виды аномалий положения женских половых органов: ■ ротация матки – поворот матки вокруг продольной ее оси ■ торсия матки – поворот матки при фиксированной шейке.
Клиническая картина
Гиперантефлексия матки клинически проявляется тянущими болями в крестце и в низу живота, нарушениями менструального цикла (позднее менархе, скудные, нерегулярные и болезненные менструации, бесплодие), половой функции (болезненность, фригидность), белями.При наступлении беременности часто происходит самопроизвольный аборт; при донашивании ее и нормальных родах клинические проявления патологии, как правило, исчезают.
Ретродевиация матки у многих женщин не вызывает никаких симптомов и выявляется случайно. Некоторые пациентки жалуются на боли в крестце и пояснице, в низу живота, во время полового акта, альгоменорею, меноррагию, бесплодие, бели, расстройства функции тазовых органов (дизурические явления, запор), реже – привычный выкидыш. Беременность в большинстве случаев протекает нормально благодаря самопроизвольному выправлению матки с 4–го месяца.
Начальные формы опущения влагалища и матки могут не сопровождаться какими–либо клиническими симптомами. Прогрессирование заболевания неблагоприятно отражается на общем состоянии больной, приводит к нарушению специфических функций половой системы и функции смежных органов, снижению трудоспособности, а в ряде случаев – к инвалидности.
Женщины жалуются на боли и чувство тяжести в низу живота, расстройства мочеиспускания и дефекации, ощущение постороннего тела в половой щели.
На шейке матки и стенках влагалища при выпадении половых органов нередко развиваются пролежни, которые приводят к развитию инфекции, распространяющейся на мочевые пути. Выпадающая часть шейки матки подвергается постоянному трению об одежду, высыханию, инфицированию, что ведет к образованию трофических изъязвлений, нередко с гнойными налетами. Стенки влагалища становятся грубыми, неэластичными, отечными, легко возникают трещины. Выпавшая матка, как правило, отечна, цианотична вследствие нарушения лимфооттока и кровообращения. В горизонтальном положении больной матка может вправляться.
Начавшееся выпадение матки сопровождается недержанием мочи при натуживании, прогрессирование его – затруднением мочеиспускания и реже острой задержкой мочи. Ректоцеле характеризуется затрудненной дефекацией, часто отмечается недержание газов.
При полном выпадении матки могут возникать осложнения в виде ущемления и отека выпавшей матки, невозможности ее вправления, что приводит к задержанию мочеиспускания и дефекации.
Диагностика и лечение
Диагноз аномалий положения женских половых органов не представляет трудностей и устанавливается на основании анамнеза, жалоб больной, данных специального гинекологического исследования. Диагностика опущений и выпадений влагалища и матки предполагает установление не только основного заболевания, но и сопутствующих патологических процессов. С этой целью уролог проводит исследование мочевой системы (лабораторное исследование мочи, хромоцистоскопию, экскреторную урографию, УЗИ почек и др.). При наличии показаний (лейкоплакия, псевдоэрозия и др.) обязательными методами исследования являются кольпоскопия, биопсия шейки матки и гистологическое исследование биоптата. При подозрении на гиперплазию, полип, рак эндометрия проводят ультразвуковое исследование матки и придатков, обследование полости матки с применением эндоскопических и гисто–морфологических методов. При ректоцеле необходимо провести ректальное исследование.Собирая анамнез, следует уточнить: ■ характер менструальной функции ■ наличие экстрагенитальных заболеваний, сопровождающихся повышением внутрибрюшного давления ■ количество беременностей, родов, абортов; течение родов и послеродового периода; наличие послеродовых травм и реконструктивных операций; воспалительные изменения после родов ■ гинекологические заболевания и их лечение ■ проведенное обследование и его результаты ■ вид и длительность терапии, ее исход ■ наличие сопутствующих заболеваний.
Специальное гинекологическое исследование начинают с осмотра наружных половых органов. При этом у женщин с опущением стенок влагалища и матки половая щель зияет, отмечается расхождение леваторов, задняя стенка влагалища непосредственно прилежит к стенке прямой кишки. Чтобы иметь представление о степени опущения и выпадения внутренних половых органов, больной предлагают потужиться, причем при опущении влагалища обнаруживаются крупные поперечные складки передней, задней или обеих стенок. При выпадении влагалища выявляются грыжеподобные, полушаровидной формы, эластической консистенции опухоли – cystocele и rectocele. При опущении матки в половой щели можно увидеть шейку матки.
Однако натуживание не всегда дает представление о степени выпадения, поэтому необходимо захватить шейку матки пулевыми щипцами и низвести ее умеренным потягиванием книзу. При извлечении наружу выпавшей матки тщательно осматривают стенки влагалища и шейку матки для обнаружения вторичных изменений (трещины, язвы, пролежни, полипы, эрозии). Более точное представление о длине матки можно получить при зондировании ее полости; границы мочевого пузыря в случаях цистоцеле определяют введением катетера; степень участия стенки прямой кишки при ректоцеле определяется ректальным исследованием.
Состояние мышц тазового дна определяется следующим приемом: двумя указательными пальцами, введенными во влагалище, проводят исследование замыкающей способности луковично–пещеристой мышцы промежности.
При бимануальном исследовании представляется возможным установить ширину входа во влагалище, состояние промежности, мышц тазового дна, длину влагалища, глубину влагалищных сводов, длину и состояние влагалищной части шейки матки, положение, величину, консистенцию, подвижность, болезненность тела матки и состояние придатков.
При гиперантефлексии обнаруживают резко отклоненную кпереди матку небольших размеров, удлиненную, конической формы шейку матки, узкое влагалище и уплощенные влагалищные своды. При ретрофлексии матка отклонена кзади, угол между телом и шейкой матки открыт кзади.
При исследовании мочевой системы в анализах мочи часто находят патологические отклонения, в том числе бактериурию; при хромоцистоскопии – трабекулярность и углубления слизистой оболочки, изменения в положении устьев мочеточников, цистит, понижение тонуса сфинктеров; при экскреторной урографии – атонию и расширение мочеточников, нефроптоз; при сканировании почек и реографии – нарушение функции почек.
Дифференциальный диагноз опущения и выпадения стенок влагалища и матки проводится с опухолью передней стенки влагалища (киста влагалища, киста продольного протока придатка); родившимся фиброматозным узлом (для родившегося узла характерен валик растянутого наружного зева, окружающего узел); выворотом матки (на «опухоли», покрытой эндометрием, можно обнаружить внутренние отверстия труб). Декубитальную язву, располагающуюся на стенках влагалища и влагалищной части шейки матки, необходимо дифференцировать от раковой опухоли. Для этого используют данные кольпоскопии и прицельной биопсии.
Принципы лечения.
При гиперантефлексии матки лечение сводится к устранению причин и последствий данной аномалии положения.При ретрофлексии матки, протекающей бессимптомно, лечение не показано. При выраженных симптомах проводят лечение, направленное на устранение основной причины заболевания или его последствий. При фиксированной ретрофлексии, обусловленной воспалительным процессом в малом тазу, после исключения эндометриоза широко используют различные виды физиотерапии, санаторно–курортное лечение, гинекологический массаж. Хирургическую коррекцию проводят по строгим показаниям в качестве сопутствующего мероприятия при оперативном лечении других заболеваний (новообразования, киста, гидросальпинкс и др.).
Способы лечения опущения и выпадения стенок влагалища и матки делятся на неоперативные (консервативные) и оперативные.
Выбор тактики лечения, рационального способа оперативного пособия определяется: ■ степенью опущения внутренних половых органов ■ анатомо–функциональными изменениями органов половой системы (наличием и характером сопутствующей гинекологической патологии) ■ возможностью и необходимостью сохранения или восстановления детородной, менструальной функции ■ особенностями нарушения функции толстой кишки и сфинктера прямой кишки ■ возрастом больных ■ сопутствующей экстрагенитальной патологией, степенью риска хирургического вмешательства и анестезиологического пособия.
Консервативные методы лечения показаны: ■ при начальных стадиях опущения влагалища и матки (при опущении передней и задней стенок влагалища и отсутствии цисто– и ректоцеле) ■ наличии противопоказаний к оперативному вмешательству (сахарный диабет, артериосклероз, обширное расширение вен и склонность к тромбофлебиту, тяжелые заболевания сердечно–сосудистой системы и др. ) ■ подготовке больных к хирургическим вмешательствам (устранение патологических процессов в половых органах, лечение сопутствующих экстрагенитальных заболеваний).
Неоперативное лечение должно быть комплексным, направленным на повышение тонуса мышц тазового дна и передней брюшной стенки.
Оно включает: ■ сбалансированное полноценное питание ■ освобождение от работы, связанной с подъемом и ношением тяжестей ■ коррекцию дефицита эстрогенов путем их местного введения в виде вагинальных свечей, вагинального крема ■ назначение лечебной гимнастики с включением упражнений, укрепляющих мышцы живота (сгибание и разгибание туловища, боковые повороты, сгибание и разгибание ног в положении лежа) и тазового дна (ходьба с полуприседанием, поднимание ног под прямым углом к туловищу, упражнение Кегеля (изометрические сокращения поперечно–полосатых мышечных волокон, входящих в состав тазового дна), Юнусова (произвольное сокращение мышц тазового дна во время мочеиспускания до прекращения тока мочи) и др.) ■ физиотерапию: индуктотермия, грязевые тампоны, орошения ■ ортопедический метод – использование пессария, чаще всего имеющего кольцевидную форму. Его вводят во влагалище на определенное время, так как продолжительное ношение может вызвать раздражение, отек слизистой оболочки влагалища, изъязвления или обширные глубокие пролежни, врастание в ткани влагалища, образование пузырно– и прямокишечновлагалищных свищей. Метод в связи с указанными недостатками применяется при наличии абсолютных противопоказаний к операции у лиц старческого возраста.
В современных условиях предпочтение отдается хирургическим методам лечения. Вид оперативного вмешательства выбирают с учетом степени смещения матки и влагалища, сопутствующих патологических процессов в половых органах, экстрагенитальных заболеваний и возраста больной.
Наиболее распространенными вариантами хирургического вмешательства являются следующие группы операций (В.И. Краснопольский и соавт., 1997). ■ 1–я группа – операции, направленные на укрепление тазового дна – кольпоперинеолеваторопластика. Производятся при опущении и выпадении стенок влагалища вследствие старых разрывов промежности или снижения тонуса тканей. Учитывая, что мышцы тазового дна патогенетически всегда вовлекаются в патологический процесс, кольпоперинеолеваторопластику следует проводить во всех случаях хирургических вмешательств по поводу опущений и выпадений половых органов как дополнительное или основное пособие. Сюда же можно отнести пластические операции на передней стенке влагалища, направленные на укрепление пузырновлагалищной фасции. ■ 2–я группа – операции с применением различных модификаций укорочения и укрепления подвешивающего аппарата матки. Они производятся при опущении и выпадении стенок влагалища и матки у пожилых женщин, часто дополняют операции на влагалище и промежности. После этих операций иногда возникает болевой синдром, что снижает трудоспособность, нарушается питание матки, отмечается учащенное мочеиспускание. Наиболее типичными и часто используемыми являются укорочение круглых маточных связок с их фиксацией к передней или задней поверхности матки, укорочение круглых связок матки через паховые каналы по Алексендеру – Адамсу, вентросуспензия матки по Долери – Джильямсу, вентрофиксация матки по Кохеру и др. Однако эта группа операций считается малоэффективной, поскольку после них наблюдается наибольший процент рецидивов заболевания. Это обусловлено тем, что в качестве фиксирующего материала используется заведомо несостоятельная ткань – круглые связки матки. ■ 3–я группа – операции, направленные на укрепление фиксирующего аппарата матки (кардинальных, крестцово–маточных связок) за счет сшивания их между собой, транспозиции и т.д. Однако и эти операции, несмотря на то что они подразумевают закрепление матки за счет наиболее мощных связок, задачу до конца не решают, так как устраняют одно звено в патогенезе заболевания. К этой группе операций можно отнести «манчестерскую операцию», которая показана при опущении и частичном выпадении матки, особенно при элонгации шейки матки и наличии цистоцеле. Во время этой операции часто прибегают к ампутации шейки матки (при ее гипертрофии, элонгации, разрывах, наличии эрозий), что нарушает последующую беременность или исключает ее возможность, поэтому не рекомендуют применять эту операцию в детородном возрасте. ■ 4–я группа – операции с жесткой фиксацией выпавших органов к стенкам таза (к лобковым костям, к крестцовой кости, сакроспинальной связке и т.д.). ■ 5–я группа – операции с использованием аллопластических материалов для укрепления связочного аппарата матки и ее фиксации. Они не уменьшают число рецидивов заболевания в результате нередкого отторжения аллопласта, приводят к развитию свищей. ■ 6–я группа – операции, направленные на частичную облитерацию влагалища (срединная кольпорафия Лефора – Нейгебауэра, влагалищно–промежностный клейзис – операция Лабгардта). Срединная кольпорафия показана женщинам пожилого и старческого возраста, не живущим половой жизнью, при полном выпадении матки, рецидиве выпадения влагалища после влагалищной экстирпации матки в отсутствие какого–либо заболевания матки и шейки матки. Ее недостатками являются исключение возможности половой жизни, недоступность шейки матки для осмотра и лечения. ■ 7–я группа – радикальный способ хирургического лечения выпадения внутренних половых органов: влагалищная экстирпация матки. Ее производят обычно при полном выпадении матки у больных пожилого возраста с патологическими процессами влагалищной части шейки матки (псевдоэрозии, трофические язвы, лейкоплакия и др.), а также при имеющейся миоме матки. Эта операция не устраняет основной причины выпадения матки – слабости мышц тазового дна, поэтому она должна сочетаться с пластикой промежности и влагалища.
Больные для оперативного лечения поступают в отделение оперативной гинекологии в плановом порядке после амбулаторного обследования по месту жительства. В ходе подготовки к оперативному вмешательству необходимо лечение сопутствующих экстрагенитальных заболеваний, санация мочевых путей, устранение патологических процессов в половых органах. Целесообразно назначение в течение 7–10 дней овестина – 2 мг/сут, эстриола – 0,5–2 мг/сут, вагинальных капсул, свечей или таблеток, мазевых аппликаций с антибиотиками и биостимуляторами, ванночек с антисептиками, немедикаментозных методов (КУФ–лучи и др.). Операции выполняются только при I–II степени чистоты влагалища.
В послеоперационном периоде проводят: ■ адекватное обезболивание наркотическими и ненаркотическими анальгетиками (с 3–х суток – преимущественно нестероидные противовоспалительные средства: диклофенак 3,0 мл внутримышечно через день и др.) ■ антибактериальную терапию пациенткам группы риска (старше 60 лет, с нарушением жирового обмена, наличием хронических очагов инфекции в бронхолегочной и мочевой системах, сопутствующих заболеваний: сахарный диабет, анемия, недостаточность кровообращения), а также при длительных и травматичных вмешательствах, выполнении операции вагинальным доступом, применении избыточной диатермокоагуляции, наличии патологической кровопотери, использовании синтетических протезов ■ профилактику тромбоэмболических осложнений (бинтование эластичным бинтом голеней и бедер, ношение эластичных чулок, ранняя активизация больных в послеоперационном периоде, антикоагулянтная, дезагрегационная, ангиопротекторная и спазмолитическая терапия) ■ лечение сопутствующих заболеваний.
Ежедневно 1–2 раза в сутки обрабатывают швы на промежности раствором антисептика (1–2% раствор бриллиантового зеленого; 5–7% раствор перманганата калия). Швы с промежности снимают на 5–7–й день после операции, с 7–го дня после снятия швов показано промывание влагалища с помощью резинового катетера 3% раствором водорода пероксида; с 10–11–го дня – спринцевание влагалища раствором антисептиков. Вставать больным после влагалищных операций разрешается на 1–2–е сутки, садиться – после 28–го дня от момента операции.
Выписывают пациенток после полного заживания швов, восстановления всех функций соседних органов (на 15–18–й день после операции). В течение 3 месяцев рекомендуют ограничение подъема тяжести (не более 3 кг), до 6 месяцев освобождают от тяжелого физического труда.
Профилактика опущения и выпадение половых органов заключается: ■ в рациональном режиме труда, особенно в детском и пубертатном возрасте ■ бережном ведении родов, восстановлении целостности промежности после родов с правильным сопоставлением тканей ■ применении гормональной терапии при гипоэстрогенных состояниях ■ лечении экстрагенитальной патологии, приводящей к повышению внутрибрюшного давления ■ выполнении комплекса физических упражнений для укрепления мышц тазового дна и брюшного пресса.
Глава 12. Неотложные состояния в гинекологии
Острый живот при кровотечениях в брюшную полость
Внематочная беременность
Внематочная беременность – беременность при которой плодное яйцо имплантируется вне матки. В зависимости от локализации плодного яйца внематочную беременность подразделяют на трубную, яичниковую, брюшную и расположенную в рудиментарном роге матки.Классификация
По МКБ–10 различают следующие формы внематочной беременности (рис. 12.1). ■ Абдоминальная (брюшная) беременность. ■ Трубная беременность: • беременность в маточной трубе • разрыв маточной трубы вследствие беременности • трубный аборт. ■ Яичниковая беременность. ■ Другие виды внематочной беременности: • шеечная • комбинированная • в роге матки • внутрисвязочная • в брыжейке матки • неуточненная. Рис. 12.1. Локализация плодного яйца при эктопической беременности
Рис. 12.1. Локализация плодного яйца при эктопической беременности
Эктопическая, или внематочная, беременность является одной из главных причин внутреннего кровотечения у женщин репродуктивного возраста.
Наиболее часто имплантация оплодотворенной яйцеклетки происходит в маточной трубе. Среди всех случаев трубной беременности в зависимости от места плодовместилища различают ампулярную, истмическую и интерстициальную. Из редко встречающихся форм можно отметить яичниковую беременность, которая может быть в двух вариантах: развивающаяся на поверхности яичника – эпиофоральная и внутри фолликула – интрафолликулярная.
Вторая редкая форма – это беременность в зачаточном роге матки; ее можно отнести к эктопической разновидности маточной беременности.
Брюшная беременность также встречается редко. Различают первичную и вторичную брюшную беременность. При первичной оплодотворенная яйцеклетка имплантируется на брюшине, сальнике и других внутренних органах. При вторичной эктопическая беременность формируется как исход трубной беременности, если плодное яйцо изгоняется из трубы и вторично имплантируется в брюшной полости.
Внематочная беременность встречается в 0,8–6% случаев. Исследования последних лет свидетельствуют об увеличении частоты данной патологии.
Риск смерти снизился за последние годы, но эта патология занимает второе место среди причин материнской смертности. Росту внематочной беременности способствуют процессы урбанизации, раннее начало половой жизни, увеличение числа женщин с заболеваниями, передаваемыми половым путем. В связи с этим остаются актуальными своевременная диагностика внематочной беременности и применение адекватных методов лечения.
Этиология и патогенез. Основными причинами возникновения внематочной беременности являются нарушение транспортной функции маточных труб или патология со стороны яйцеклетки.
По мнению многих авторов, к нарушению транспортной функции маточной трубы приводят многочисленные анатомические изменения в стенке маточной трубы или в области малого таза. Они в основном возникают в результате инфекционных процессов в органах малого таза.
Инфекционный процесс в слизистой оболочке маточной трубы приводит к ее сужению, нарушению перистальтики, а также к хроническим воспалительным заболеваним органов малого таза, при которых, как правило, поражаются обе маточные трубы. Если раньше считали, что преобладающую роль играет неспецифическая инфекция, возникающая после абортов, внутриматочных диагностических вмешательств, внутриматочной контрацепции, осложненных родов и послеродового периода, перенесенного аппендицита, то в настоящее время неоспорима роль специфической инфекции: гонореи, туберкулеза и особенно хламидиозного инфицирования.
Сужение маточной трубы, приводящее к возникновению эктопической беременности, может быть обусловлено опухолями трубы, миомой матки с локализацией узла в трубном углу, врожденными дефектами маточной трубы, эндометриозом труб.
Хирургические вмешательства на маточных трубах, матке, яичниках и других органах в области малого таза могут быть причиной возникновения внематочной беременности. Многие авторы указывают на половой инфантилизм, при котором трубы длинные, извитые, перистальтика их неполноценна, что может привести к имплантации плодного яйца вне матки.
На сократительную деятельность трубы оказывает влияние гормональное состояние организма. Характер перистальтических движений трубы зависит от гормональных влияний яичника. На функцию труб также оказывают воздействие и простагландины.
Не исключается изменение транспорта плодного яйца в результате нарушения миграции яйцеклетки: ■ из правого яичника в левую маточную трубу или наоборот ■ прохождение оплодотворенной яйцеклетки через матку в противоположную трубу. Эти состояния чаще связаны с хирургическими вмешательствами на придатках.
Среди факторов возникновения эктопической беременности некоторые авторы указывают на повышенную функциональную активность трофобласта.
Имплантация плодного яйца при трубной беременности происходит в эндосальпинксе.
Отсутствие мощной слизистой и подслизистой оболочки в трубе, яичнике и в брюшной полости приводит к растяжению плодовместилища, а ворсины хориона разрушают подлежащие ткани и кровеносные сосуды, что сопровождается кровотечением. Несмотря на то что мышечный слой трубы гипертрофируется, он не может обеспечить нормальные условия для развития плодного яйца. Обычно на 4–6–й неделе беременности происходит ее прерывание. В редких случаях она может продолжаться до 8 недель.
Прерывание беременности может происходить по типу наружного разрыва плодовместилища или по типу трубного аборта. В связи с улучшением диагностики в последние годы чаще диагностируют прогрессирующую трубную беременность.
Клиническая картина
Нельзя выделить симптомы, типичные только для прогрессирующей трубной беременности. Для нее характерны такие же признаки, какие могут быть при физиологической маточной беременности: тошнота, извращение вкуса, нагрубание молочных желез. Задержка менструации может быть, а может и не быть. Можно отметить цианоз влагалища и слизистой шейки матки. Матка увеличена в размере за счет гиперплазии и гипертрофии мышечного слоя и превращения слизистой оболочки в децидуальную. Иногда можно пропальпировать увеличенную трубу. Больная может предъявлять жалобы на периодические незначительные боли в низу живота. Иммунологическая реакция на беременность положительная. Если беременность прогрессирует более 4–6 недель, то можно обнаружить отставание размеров матки от предполагаемого срока беременности. При подозрении на прогрессирующую трубную беременность необходимо динамическое наблюдение за больной в условиях стационара.Исключительно редко внематочная беременность (при локализации ее в брюшной полости, роге матки) достигает больших сроков, когда можно выявить ее достоверные признаки: выслушать сердцебиение плода, определить его части. В редких случаях происходит донашивание брюшинной беременности до срока родов. Подтвердить диагноз прогрессирующей трубной беременности позволяет определение ХГ, УЗИ и лапароскопия. Если женщина не заинтересована в беременности, то можно произвести выскабливание матки и гистологическое исследование удаленной ткани.
Прервавшаяся трубная беременность имеет разнообразные клинические проявления: от незначительно выраженных симптомов до признаков внутреннего кровотечения.
Беременность, нарушенная по типу разрыва трубы, для диагностики обычно не представляет трудностей. В таких случаях наблюдается массивное кровотечение в брюшную полость, шок. Характерно острое начало заболевания. Обычно у больной на фоне задержки менструации (а ее может и не быть) внезапно возникают боли в нижних отделах живота справа или слева, иррадиирующие в прямую кишку, плечо, лопатку, подреберье (френикус–симптом, обусловленный раздражением диафрагмального нерва). Появляются тошнота или рвота, головокружение, холодный пот, вплоть до потери сознания и до развития геморрагического шока. При объективном осмотре обращает на себя внимание бледность кожных покровов и слизистых оболочек, тахикардия, пульс слабого наполнения, артериальное давление понижено. Живот при пальпации вздут, отмечается болезненность в нижних отделах, особенно со стороны разрыва трубы. Здесь же выявляются симптомы раздражения брюшины (Щеткина – Блюмберга). Перкуторно – признаки свободной жидкости в брюшной полости.
При осмотре с помощью зеркал можно обнаружить цианоз влагалища и шейки матки. При влагалищном исследовании матка незначительно увеличена, мягковатая, легко смещается (плавающая матка). При бережном бимануальном исследовании можно выявить пастозность в области придатков матки или опухолевидные образования. Задний свод уплощен или выпячен, болезненный при пальпации (крик Дугласа). При попытке смещения шейки матки возникает резкая боль.
Могут быть кровянистые выделения из половых путей, но не всегда.
При прерывании беременности по типу трубного аборта клиническая картина развивается более медленно и зависит от интенсивности кровотечения. Больные жалуются на приступообразные боли в низу живота, кровянистые выделения (вследствие отслойки плодного яйца от плодовместилища). Часто бывают кратковременные обморочные состояния. Вследствие медленного течения заболевания и незначительного кровотечения в брюшную полость клиническая картина при трубном аборте смазана, состояние больной длительное время остается удовлетворительным, что представляет большие трудности для диагностики. Основные симптомы: боль, возникающая приступообразно, и кровянистые выделения из половых путей. Задержка менструации не всегда является определяющим симптомом, так как ее может и не быть.
При осмотре больной обнаруживается бледность кожных покровов и слизистых оболочек. Пульс обычно ритмичный, удовлетворительного наполнения. Артериальное давление чаще нормальное, иногда несколько снижено. Напряжение мышц живота обычно отсутствует. Если кровотечение значительно, то появляются симптомы раздражения брюшины ввиду наличия свободной жидкости в брюшной полости. При влагалищном исследовании матка мягковатая, слегка увеличена.Пальпируется опухолевидное образование в области одного из придатков, болезненное при пальпации. Отмечаются болезненность при пальпации заднего свода влагалища и болезненность при смещении матки, но эти симптомы выражены слабее, чем при разрыве трубы. Нередко происходит выделение децидуальной оболочки из полости матки. Для уточнения диагноза имеет значение наблюдение за больной в условиях стационара и применение дополнительных методов исследования.
Диагностика и дифференциальная диагностика.
Диагноз внематочной беременности можно поставить на основании жалоб больной (боли в нижних отделах живота, патологические кровянистые выделения из половых путей, часто задержка на фоне менструации). В анамнезе больные отмечают воспалительные заболевания органов малого таза, бесплодие, операции на органах малого таза. Помогают установить диагноз данные влагалищного исследования (размягченная, несколько увеличенная матка, пастозность или опухолевидное образование в области придатков). При необходимости проводят дополнительные исследования.Кульдоцентез – пункция брюшной полости через задний свод влагалища, проводится для выявления свободной крови в брюшной полости (рис. 12.2). При наличии крови в брюшной полости в пунктате она темная, не свертывается и содержит мелкие сгустки. Содержимого в пунктате может и не быть, если имеются спайки, что не снимает диагноза внематочной беременности. Определяют ХГТ в крови – проба положительна во всех случаях эктопической беременности, в моче – в 50% случаев. Уровень ХГТ в крови при нормальной беременности каждые 2 дня удваивается.
 Рис. 12.2. Кульдоцентез – пункция брюшной полости через задний свод влагалища
Рис. 12.2. Кульдоцентез – пункция брюшной полости через задний свод влагалища
Ультразвуковое исследование органов малого таза может выявить наличие плодного яйца в маточной трубе, более точные результаты получают с помощью трансвагинального датчика.
Лапароскопия является эффективным методом для постановки диагноза, дающим возможность осмотреть маточные трубы и яичник. При прогрессирующей трубной беременности характерен вид расширенной сине–багровой маточной трубы. Если женщина не заинтересована в сохранении возможной маточной беременности, можно использовать для диагностики гистологическое исследование соскоба эндометрия. Полученная децидуальная ткань без ворсин хориона указывает на эктопическую беременность. Больную нельзя выписывать из стационара с неуточненным диагнозом.
Дифференциальный диагноз эктопической беременности проводится с некоторыми хирургическими и рядом гинекологических заболеваний (табл. 12.1).
Таблица 12.1. Дифференциальная диагностика внематочной беременности
| Трубный аборт | Нарушенная маточная беременность | Апоплексия яичника | Острый аднексит | Острый аппендициг |
|---|---|---|---|---|
| Внезапно возникают боли схваткообразного характера, мажущие кровянистые выделения из половых путей, обморочное состояние, коллапс | Аменорея. Кровотечение из половых путей различной интенсивности. Боли схваткообразного характера над лоном, нарастают постепенно | Острые боли в низу живота головокружение, тошнота, рвота | Постоянные ноющие боли в низу живота | Боли вначале локализуются в подложечной области, затем в правой подвздошной области, рвота |
| Задержка менструации на 3–5 недель | Задержка менструации различной длительности и более 5 недель | Задержки менструации нет | Задержки менструации обычно не бывает | Задержки менструации нет |
| Имеется френикус–симптом | Френикус–симптом отсутствует | Может быть френикус–симптом | Френикус–симптом отсутствует | Френикус–симптом отсутствует |
| Температура тела нормальная или субфебрильная | Нормальная или субфебрильная | Нормальная или субфебрильная | Субфебрильная или выше 39°С | Субфебрильная (ректальная выше аксиллярнюй) |
| При наружной пальпации имеется напряжение мышц передней брюшной стенки | Напряжение мышц передней брюшной стенки отсутствует | Имеется напряжение мышц передней брюшной стенки и слабо положительный симптом раздражения брюшины | Отмечается болезненность при пальпации в низу живота. | Напряжение мышц выражено в правой подвздошной области. Положительный симптом раздражения брюшины и все симптомы, характерные для острого аппендицита |
| Имеются явления раздражения брюшины | Явления раздражения брюшины отсутствуют | Может быть слабо выражен симптом раздражения брюшины | ||
| При влагалищном исследовании матка увеличена, болезненна при пальпации. Размер ее не соответствует: сроку беременности. Справа или слева от матки пальпируется вытянутое образование | Матка увеличена соответственно сроку задержки менструации | Матка нормальных размеров. Область придатков резко болезненна при пальпации | Матка нормальной величины, безболезненна при пальпации. Придатки резко болезненны при пальпации | Пальпация хатки и придатков безболезненна |
| Данные ректального исследования те же | Данные ректального исследование те же | Данные ректального исследование те же | Данные ректального исследование те же | Боли при ректальном исследовании Внутренние половые органы безболезненны |
| Кровянистые выделения из половых путей незначительные, темного цвета | Значительные кровянистые выделения, могут быть со сгустками | Отсутствуют | Отсутствуют | Отсутствует |
| Тест на беременность положительный | Положительный | Отсутствует | Отсутствует | Отсутствует |
| Анализ крови: гемоглобин снижен или снижается в динамике | Может быть снижение количества гемоглобина и числа эритроцитов | Снижение числа эритроцитов, снижение гемоглобина | Лейкоцитоз | Нарастающий лейкоцитоз |
| При кульдоцентезе брюшины обнаруживается кровь в брюшной полости | Крови в брюшной погости нет | Получаем кровь из брюшной полости | Можно получить небольшое количество серозной жидкости | Крови в брюшной полости нет |
| Гистологическое исследование эндометрия – децидуальная реакция без элементов хориона | Остатки плодного яйца | Соответствует фазе менструального цикла | Соответствует фазе менструального цикла | Иногда картина эндометрита |
Симптоматика разрыва маточной трубы ярко выражена, и распознавание ее не представляет трудностей.
Лечение
Лечение внематочной беременности хирургическое. Если трубная беременность прерывается путем разрыва трубы и сопровождается значительным кровотечением в брюшную полость, необходимо сразу же начинать операцию и одновременно проводить реанимационные мероприятия, которые включают инфузионную терапию и адекватное замещение кровопотери.При разрыве маточной трубы, сопровождающемся коллапсом, не следует стремиться вывести больную из этого состояния, а потом оперировать. Вначале необходимо начать операцию и одновременно проводить реанимационные мероприятия.
Характер операции зависит от многих факторов: локализации плодного яйца, выраженности патологических изменений в пораженной и противоположной трубе, степени кровопотери, общего состояния, возраста женщины и желания больной иметь беременность в будущем.
Лечение складывается из следующих этапов: ■ операция ■ борьба с кровотечением, шоком и кровопотерей ■ реабилитация. Если прерывание беременности сопровождается обильным кровотечением, то имеет значение фактор времени и совместные действия гинеколога и анестезиолога. В данной ситуации удаляют измененную маточную трубу, наложив зажимы на мезосальпинкс и маточный угол трубы (рис. 12.3). Применять предпочтительнее эндотрахеальный наркоз с миорелаксантами. Одновременно проводят реанимационные мероприятия и инфузию крови.
Объем трансфузии определяется величиной кровопотери и состоянием женщины. Можно производить реинфузию аутокрови. Необходимо адекватно замещать кровопотерю, что способствует более быстрой реабилитации больных. Излившуюся в брюшную полость кровь следует максимально удалить в целях профилактики спаечного процесса.
При отсутствии массивного кровотечения сальпингэктомия проводится у женщин старше 35 лет и у женщин, не заинтересованных в сохранении репродуктивной функции.
У большого числа больных при трубной беременности можно осуществлять консервативно–пластические операции на трубах с целью сохранения репродуктивной функции. Выполнение этих операций возможно при удовлетворительном состоянии больной, при отсутствии большой кровопотери и при желании женщины сохранить детородную функцию. Проводить такие операции желательно с помощью микрохирургической техники.
 Рис. 12.3. Операция удаления маточной трубы: а – выведение беременной трубы: 1 – сальник; 2 – яичник; 3 – связка, подвешивающая яичник; 4 – место имплантации плодного яйца; б, в – брыжейка маточной трубы пережата и рассечена
Рис. 12.3. Операция удаления маточной трубы: а – выведение беременной трубы: 1 – сальник; 2 – яичник; 3 – связка, подвешивающая яичник; 4 – место имплантации плодного яйца; б, в – брыжейка маточной трубы пережата и рассечена
В последние годы при прогрессирующей трубной беременности и прерванной трубной беременности с минимальной кровопотерей (трубный аборт) операции проводят с помощью лапароскопии.
Лапароскопия имеет ряд преимуществ по сравнению с традиционным методом лечения внематочной беременности. Отмечаются меньшее количество осложнений и более благоприятные отдаленные результаты. Лапароскопия также является более современным и экономически выгодным методом оперативного вмешательства, поскольку сокращает сроки стационарного лечения и нетрудоспособности и позволяет проводить органосохраняющие операции на маточных трубах.
За последние годы появились данные о возможности резорбции плодного яйца. С этой целью используют ряд препаратов, в основном метотрексат, который способствует разрушению трофобласта без повреждения слизистой оболочки маточной трубы, резорбции плодного яйца. Но пока этот метод не нашел широкого применения.
Реабилитация. У большинства женщин, перенесших операцию по поводу трубной беременности, в последующем возникает бесплодие или повторная эктопическая беременность, что обусловлено воспалительным процессом во второй трубе. Поэтому необходимо проведение реабилитационных мероприятий после операции. Реабилитационные мероприятия начинают с 4–5–го дня послеоперационного периода. Назначается неспецифическая терапия: общеукрепляющая, гемостимулирующая, десенсибилизирующая, физиотерапия. Все мероприятия должны быть направлены на предупреждение спаек и восстановление функциональной активности маточных труб. В течение 5–6 месяцев после операции проводят 3 курса реабилитационной терапии. Затем целесообразно санаторнокурортное лечение.
Апоплекеия яичника
Апоплексия яичника – это внезапно наступившее кровоизлияние в яичник, сопровождающееся нарушением целости его ткани и кровотечением в брюшную полость.Частота апоплексии яичника составляет 0,5–2,5% среди внутрибрюшных кровотечений. Внутреннее кровотечение может возникнуть из разорвавшегося сосуда яичника, из разрыва гематомы и весьма редко – из кистомы яичника. Кровотечению из яичника предшествует образование гематомы в его тканях, которая вызывает резкие боли из–за нарастания внутриовариального давления. Затем наступает разрыв ткани яичника. Кровотечение в брюшную полость может быть даже при небольшом отверстии в яичнике.
Этиология и патогенез.
Предрасполагающими моментами при апоплексии яичника являются воспалительные процессы, мелкокистозные изменения, склероз сосудов, варикозно расширенные сосуды, хронический аппендицит. Нельзя исключить нарушения в эндокринной и нейровегетативной системах, заболевания крови.Провоцирующими моментами могут быть: беременность, менструации, физическое напряжение, травмы живота, половой акт. Апоплексия яичника может произойти в разные фазы менструального цикла, но чаще всего связана с разрывом фолликула между 12–м и 16–м днями менструального цикла, в период созревания и функционирования желтого тела во время беременности. Апоплексия наблюдается преимущественно у женщин в возрасте от 16 до 36 лет. Чаще поражается правый яичник, из–за более обильного кровоснабжения.
Клиническая картина и диагностика.
Заболевание начинается с внезапно возникшей боли в низу живота, справа или слева. Апоплексии яичника также сопутствует внутреннее кровотечение.В зависимости от того, какой из симптомов преобладает, выделяют следующие клинические формы заболевания; анемическую, болевую, смешанную. Чаще боли возникают на фоне полного здоровья. Если кровотечение в брюшную полость массивное, то развиваются симптомы вторичной анемии: кожа и слизистые оболочки бледные, пульс частый, артериальное давление снижается. Иногда отмечают появление кровянистых выделений из половых путей. Боли могут иррадиировать в прямую кишку. Может быть положительным френикус–симптом. Живот несколько вздут, болезнен при пальпации. Отмечаются симптомы раздражения брюшины. Выраженность их зависит от интенсивности внутреннего кровотечения. При перкуссии отмечается притупление перкуторного звука в отлогих местах живота.
При гинекологическом осмотре признаков беременности не обнаруживается. Цианоз влагалища и шейки матки отсутствует, при пальпации матка нормальных размеров, в области придатков выявляется образование, похожее на кисту яичника, если кровотечение интенсивное. Может определяться нависание, болезненность влагалищных сводов, болезненность при смещении шейки матки. В клиническом анализе крови – анемия.
При анемической форме апоплексии яичника часто дифференциальный диагноз проводят с внематочной беременностью. Имеет значение отсутствие задержки менструации и признаков беременности, отрицательный тест на определение хорионического гонадотропина. Если у больной имеется выраженная картина внутреннего кровотечения, то дифференциальный диагноз между яичниковым кровотечение и внематочной беременностью не имеет практического значения, так как в обоих случаях показана срочная лапаротомия.
Болевую форму апоплексии яичника часто принимают за острый аппендицит.
При остром аппендиците отсутствует связь заболевания с фазами менструального цикла. Точка наибольшей болезненности во время пальпации чаще определяется на середине линии, соединяющей пупок с передневерхней остью правой подвздошной кости (точка Мак Бурнея). При апоплексии наибольшая болезненность локализуется ниже этой точки. При влагалищном исследовании пальпация и смещение внутренних половых органов при апоплексии яичника вызывают более резкую болезненность, чем при аппендиците. При аппендиците лейкоцитоз в крови выше, чем при яичниковом кровотечении. Быстрое нарастание лейкоцитоза чаще говорит об остром аппендиците.
Лечение
Если удается установить диагноз апоплексии яичника и отсутствует обильное кровотечение в брюшную полость, то можно ограничиться консервативными мероприятиями: положить пузырь со льдом на живот, провести противовоспалительную терапию.При значительном кровотечении показана операция – чревосечение, резекция или ушивание яичника.
Операция проводится с максимальным сохранением яичника. Яичник удаляется полностью только при максимальном кровотечении и обширной гематоме. При разрыве желтого тела рекомендуется ушить разрыв, не производя резекцию. Больная с подозрением на апоплексию яичника должна быть срочно госпитализирована в гинекологическое отделение.
Больным, перенесшим апоплексию яичника, показана комплексная медикаментозная терапия.
Рекомендуется прием препаратов, улучшающих обменные процессы в ЦНС, мочегонных средств, транквилизаторов.
Необходим прием комбинированных эстроген–гестагенных оральных контрацептивов в течение 3–6 месяцев с целью подавления овуляции и коррекции гормональных нарушений.
Септические заболевания в гинекологии
Пельвиоперитонит
Пельвиоперитонит – воспаление брюшины малого таза, обычно возникающее вследствие воспалительных заболеваний органов малого таза. Начало заболевания может быть связано с менструацией, абортами, переохлаждениями, внутриматочными манипуляциями. Пельвиоперитонит может быть частичным – местным (перисальпингит, периоофорит, периметрит) или диффузным – распространяющимся на париетальную и висцеральную брюшину малого таза. Э.К. Айламазян, И.Т. Рябцева (2003) под местным ограниченным перитонитом подразумевают воспалительный инфильтрат или абсцесс в каком–либо органе брюшной полости (пиосальпинкс, пиовар, тубоовариальный абсцесс). При местном неограниченном перитоните процесс локализуется в одном из карманов брюшины, который может быть закрытым за счет развития сращений между петлями кишки, сальником и органами малого таза, или открытым – при свободном сообщении области малого таза с вышележащими отделами брюшной полости.Этиология
Пельвиоперитонит чаще возникает вторично, в результате проникновения микроорганизмов из маточных труб. Первичный очаг инфекции может быть также в яичниках, матке, клетчатке малого таза, аппендиксе и других органах, откуда инфекция поступает лимфогенным или гематогенным путем, а также путем контакта и по продолжению. Пельвиоперитонит может возникнуть при нагноении позадиматочной гематомы, кисты или кистомы при перфорации вследствие их инфицирования.Возбудителями заболевания могут быть гонококки, стафилококки, кишечная флора (эшерихии, энтерококки), стрептококки и другие аэробные и анаэробные микроорганизмы или смешанная флора.
По степени остроты воспалительный процесс бывает острый и хронический, а по характеру экссудата – серозный, фибринозный и гнойный, при этом фибринозно–гнойная форма может переходить в гнойную.
Патогенез
Воспалительная реакция в острой стадии пельвиоперитонита характеризуется расстройством микроциркуляции, повышением проницаемости сосудов, появлением серозного экссудата, выходом из сосудистого русла альбумина, фибриногена, форменных элементов.В эндотелии брюшины возникают дистрофические изменения. При уменьшении острой воспалительной реакции происходит ограничение воспалительного процесса в малом тазу вследствие образования спаек между брюшиной, тонким и толстым кишечником, мочевым пузырем. При возникновении гнойного пельвиоперитонита ограничение процесса происходит медленнее со скоплением гноя в позадиматочном пространстве. Для гонорейного пельвиоперитонита характерно отложение большого количества фибрина и довольно быстрое ограничение воспалительного процесса.
Клиническая картина
В острой стадии пельвиоперитонита клинические признаки похожи на таковые при начальной стадии распространенного перитонита, но при пельвиоперитоните эти признаки менее выражены, а местные явления преобладают над общими. Заболевание начинается остро, отмечается высокая температура до 38–39°С, учащение пульса, опережающее температурную реакцию, познабливание или озноб, плохое самочувствие. При осмотре обращает внимание гиперемия лица. Язык суховат, может быть обложен белым налетом, отмечаются тошнота, икота, одно– или двукратная рвота. Живот умеренно вздут, но участвует в акте дыхания. Боли локализуются в нижних отделах живота и при покашливании усиливаются.При этом наибольшая интенсивность болей соответствует месту расположения гнойного образования. Имеется напряжение мышц передней брюшной стенки в гипогастральном отделе, здесь же положительный симптом Щеткина – Блюмберга, однако ослабленная перистальтика выслушивается.
Влагалищное исследование при пельвиоперитоните затруднено из–за резкой болезненности и напряжения нижних отделов живота. Сильные боли возникают при смещении шейки матки. В первые дни отмечаются только ригидность и болезненность заднего свода влагалища. В последующие дни в этой области выявляется экссудат, выпячивающий в виде купола задний свод.
Для пельвиоперитонита хламидийной инфекции характерно постепенное нарастание симптомов и склонность к спаечному процессу. При этом, несмотря на тяжесть общего состояния, температура часто остается субфебрильной, а СОЭ и лейкоцитоз ниже, чем при процессах, вызванных кокковой инфекцией, отмечается резкая лимфопения. При кокковой и палочковидной инфекции выпот чаще носит гнойный характер, при гонорейной – гнойно–геморрагический, при хламидийной – серозный и серозно–гнойный.
В крови резко повышается СОЭ, отмечаются лейкоцитоз, сдвиг лейкоцитарной формулы влево, признаки токсической анемии и появление дегенеративных форм элементов красной крови, резко положительная реакция на С–реактивный белок.
У каждой третьей больной с гнойными тубоовариальными образованиями на фоне острого пельвиоперитонита происходит перфорация в смежные органы с формированием генитальных свищей либо образование межкишечных или поддиафрагмальных абсцессов (В.И. Краснопольский, С.Н. Буянова, Н.А. Щукина, 2006).
Диагностика
Диагноз не вызывает затруднений и основывается на характерных клинических проявлениях заболевания и обнаружении инфильтрата кзади от матки, выпячивающего задний свод влагалища; в сомнительных случаях следует произвести диагностическую лапароскопию. При ультразвуковом исследовании определяется свободная жидкость в полости малого таза, которая представляет собой эхонегативное содержимое, не имеющее капсулы и меняющее форму при перемене положения тела.Лечение
Лечение пельвиоперитонита проводят в зависимости от причины его возникновения. В настоящее время врачи склонны к активной тактике ведения больных с пельвиоперитонитом. Чаще стали применяться хирургические методы лечения: пункция, удаление гноя, дренирование и лапароскопия. Лечение пельвиоперитонита состоит из медикаментозной терапии (антибактериальной и инфузионной) и эвакуации гнойного экссудата (хирургический компонент). Ведущая роль в комплексе лечебных мероприятий принадлежит антибактериальной терапии, которую проводят по тем же принципам, по которым осуществляют лечение тяжелых форм острых воспалительных процессов в придатках матки. В связи с тем что инфекция почти всегда имеет смешанный характер, антибактериальная терапия должна воздействовать на весь спектр микроорганизмов. С целью детоксикации проводится инфузионно–трансфузионная терапия, включающая белковые растворы, реологически активные плазмозамещающие препараты, солевые растворы, глюкозу, физиологический раствор. При выраженной интоксикации в течение суток вводят 2–3 л жидкости под контролем артериального давления, пульса, диуреза, а в случае снижения диуреза назначают мочегонные средства. Широко применяются десенсибилизирущие, неспецифические противовоспалительные и обезболивающие препараты, витамины.Метод хирургического вмешательства может быть различным. Методом «малого» хирургического вмешательства является пункция маточно–прямокишечного пространства через задний влагалищный свод. Пункция брюшной полости через задний свод может быть выполнена при отсутствии двухсторонних придатковых образований. Кольпотомию производят только в случаях, когда предполагается последующее аспирационно–промывное дренирование, что позволяет получить хороший результат. Наиболее эффективным методом хирургического лечения является лапароскопия. Хирургического лечения требует пельвиоперитонит, протекающий на фоне пиосальпинкса, пиовара или тубоовариального абсцесса. При лапароскопии следует удалить гнойный экссудат, а при необходимости и источник инфекции – гнойное образование (пиосальпинкс, пиовар). Использование лапароскопии является обязательным компонентом у нерожавших пациенток и в группе женщин резерва родов, желающих иметь детей. Лапароскопия выполняется сразу при поступлении в стационар при сомнении в диагнозе или через 48 ч при отсутствии эффекта от интенсивной антибактериальной терапии; в остальных случаях оперативное вмешательство производится после купирования острого воспаления. Продолжительность предоперационной подготовки у больных с пельвиоперитонитом зависит от эффекта проводимой терапии: при появлении отрицательной динамики (признаки генерализации инфекции – разлитого гнойного перитонита или сепсиса) необходимо экстренное оперативное вмешательство после проведения предоперационной подготовки в течение 1–1,5 ч.
Лапаратомия производится при подозрении на разрыв или наличии разрыва тубоовариального образования, при отсутствии эффекта при комплексной терапии и через 24–36 ч после лапароскопического дренирования на фоне интенсивной противовоспалительной терапии.
При наличии абсцесса прямокишечно–маточного пространства его пунктируют через задний свод или опорожняют путем кольпотомии.
В большинстве случаев заболевание заканчивается выздоровлением, но при ослаблении иммунной системы организма и вирулентной инфекции может возникнуть распространенный перитонит. Чтобы уменьшить частоту рецидивов не следует стремиться к сокращению длительности пребывания больных в стационаре. Наступление беременности у женщин репродуктивного возраста является основным показателем эффективности лечения.
Распространенный перитонит
Несмотря на достижения современной медицины, частота гнойно–воспалительных заболеваний остается в гинекологии по–прежнему высокой. В хирургической и гинекологической практике под термином «перитонит» понимают острое воспаление брюшины. Перитонит является тяжелейшим осложнением различных острых заболеваний органов брюшной полости, нередко приводящим к летальному исходу. Гинекологический перитонит является следствием таких деструктивных процессов, как расплавление стенки пиосальпинкса, пиовара или гнойного тубоовариального образования; различных гинекологических операций; криминальных абортов, в том числе осложненных перфорацией стенки матки; некроза опухоли яичника вследствие перекрута ее ножки или разрыва капсулы опухоли.Летальность при послеоперационных хирургических перитонитах составляет 55–90% (Н.А. Ефименко, 1999), а частота перитонитов после операции Кесарева составляет 0,2–0,8%, тогда как летальность остается высокой и составляет 26–35% (И.М. Миров, 1991; В.Н. Серов и др., 1984).
Этиология
Заболевание вызывается стафилококками, кишечной палочкой, гонококками, анаэробами, хламидиями, вирусами и смешанной флорой. Так, при микробиологическом исследовании выпота из брюшной полости установлено, что в 75% случаев воспаление брюшины протекало с участием смешанной аэробно–анаэробной микрофлоры, в 14% – с участием только анаэробов и в 11% случаев – только аэробов. Среди анаэробных микроорганизмов преобладали бактероиды. Большинство аэробных и анаэробных микроорганизмов обладало β–лактамазной активностью, что позволяло ингибировать действие пенициллинов и цефалоспоринов. Бактероиды и протей продуцируют в 100% случаев каталазу, что обеспечивает их защиту от водорода пероксида. Значительное число патогенных стафилококков и бактероидов продуцирует фермент гиалуронидазу, который способствует распространению микроорганизмов.Бактероиды, вырабатывая гепариназу, вызывают гиперкоагуляцию с развитием септического тромбофлебита и ДВС–синдрома (А.Н. Косинец, 1994; В.П. Сметник, Л.Г. Тумилович, 2005).
Патогенез
Гинекологический перитонит характеризуется рано возникающей эндогенной интоксикацией. Патогенез перитонита сложен и не до конца изучен, но следует сказать, что в результате воздействия биологически активных веществ у больных возникают выраженные генерализованные сосудистые расстройства, в основном в микроциркуляторной части сосудистого русла. Неполноценность кровоснабжения органов и тканей вызывает развитие тканевой гипоксии, нарушение обменных процессов и способствует быстрому возникновению деструктивных изменений в почках, поджелудочной железе, печени, тонкой кишке. Особая роль в патогенезе перитонита принадлежит функциональной непроходимости желудочно–кишечного тракта. Ухудшение барьерной функции кишечника вызывает прогрессирующее усиление интоксикации. При функциональной непроходимости кишечника невозможно полноценное питание, что усугубляет все виды обменных процессов, обусловливает дефицит витаминов, обезвоживание, нарушение электролитного баланса, адреналовой и ферментативных систем. Развитие и течение перитонита всегда сопряжено с большими потерями организмом белка, особенно велики потери альбумина.Классификация
Различают первичный и вторичный перитонит.При первичном (идиопатическом) перитоните инфицирование брюшины происходит гематогенным или лимфогенным путем (без наличия гнойного очага в брюшной полости).
Вторичный перитонит – распространение инфекции на брюшину – осуществляется из гнойно–деструктивных очагов брюшной полости.
В зависимости от обширности поражения брюшины при перитоните и степени вовлечения анатомических областей различают следующие виды перитонита: ■ местный (поражение одной анатомической области) ■ распространенный (поражение нескольких анатомических областей) ■ общий (разлитой) – поражение всех отделов брюшной полости.
По типу клинического течения различают острый, подострый и хронический перитониты; некоторые ученые выделяют молниеносную форму патологии.
К.С. Симонян в 1971 г. предложил классификацию перитонита, которая характеризует динамику патологического процесса. Автор выделил три фазы течения перитонита: I фаза – реактивная; II фаза – токсическая; III фаза – терминальная.
При реактивной фазе компенсаторные механизмы сохранены. Состояние больных ближе к удовлетворительному. Они эйфоричны, возбуждены. Тахикардия несколько не соответствует температуре тела и опережает ее. В периферической крови отмечается умеренный лейкоцитоз с небольшим сдвигом формулы влево.
Токсическая фаза перитонита характеризуется нарастающей интоксикацией. Больные становятся вялыми, изменяется цвет кожных покровов, начинаются икота и рвота. Изменяется электролитный баланс, появляются гипо– и диспротеинемия. Живот вздут, перистальтики кишечника нет. Нарастает лейкоцитоз и сдвиг лейкоцитарной формулы влево, появляется токсическая зернистость нейтрофилов.
В терминальной фазе состояние больных крайне тяжелое, выражены симптомы поражения ЦНС. Пульс аритмичный, выражена одышка, артериальное давление снижается. Больные адинамичны, заторможены. Перистальтика кишечника отсутствует.
Клиническая картина
Клинические проявления выражены достаточно отчетливо. Отмечается возникновение или усиление болей в животе, что является симптомом перфорации гнойных образований придатков. Боль усиливается при движении, перемене положения тела, кашле. Нарастают тошнота, икота, появляются рвота, слабость, понос, затрудненное дыхание. В тяжелых случаях присоединяется цианоз, похолодание нижних конечностей, ознобы, коллапс. При осмотре больных обращает внимание бледность и сероватый оттенок кожных покровов. Для гинекологических форм перитонита характерным признаком является то, что живот перестает участвовать в акте дыхания, язык становится сухим и с налетом. Отмечается вздутие живота, пальпация живота болезненна во всех отделах, а глубокая пальпация невозможна, живот напряжен. Положительные симптомы раздражения брюшины наблюдаются, как правило, в начале заболевания, а по мере прогрессирования и увеличения интоксикации становятся менее четкими, а в некоторых случаях могут и вообще не определяться. Упорный парез кишечника, несмотря на проводимую терапию, отмечается в токсическую стадию и является кардинальным симптомом для нее, всегда определяется при аускультации, ультразвуковом и рентгенологическом исследованиях. В этой стадии наблюдается выраженное вздутие живота, рвота и задержка стула. Кишечные шумы могут определяться в виде отдельных всплесков, а потом исчезать. Перкуторно определяется свободная жидкость в брюшной полости.Терминальная стадия перитонита характеризуется адинамией, изредко – спутанностью сознания. У больной характерный вид: заостренные черты лица, «впалые» глаза, бледное, цианотичное, покрытое крупными каплями пота лицо (лицо Гиппократа). Имеет место обильная рвота застойным содержимым с характерным «каловым» запахом, а запоры сменяются поносами. Нарастает полиорганная недостаточность, которая проявляется в одышке, олигурии, иктеричности кожи и слизистых оболочек, выраженной тахикардии, которая сменяется брадикардией.
Перитонит, обусловленный анаэробной инфекцией, имеет ряд особенностей – специфический, неприятный запах раневого отделяемого, черный или зеленый цвет экссудата, некрозы в тканях, септический тромбофлебит.
Диагностика
Диагностика перитонита обычно не представляет затруднений и основывается на клинической картине, хотя степень распространения процесса можно только предполагать.Между клиническими симптомами перитонита и лабораторными данными имеется выраженное несоответствие, которое проявляется в запаздывании лабораторных данных. Для перитонита характерен выраженный лейкоцитоз, сдвиг лейкоцитарной формулы влево, быстрый подъем температуры. Лейкоцитарный индекс интоксикации больше 4, повышен уровень щелочной фосфотазы, снижается число тромбоцитов. Нарастающий лейкоцитоз и резкий сдвиг лейкоцитарной формулы влево свидетельствуют о прогрессировании процесса, а появление лейкопении при прогрессирующем сдвиге лейкоцитарной формулы влево – плохой прогностический признак. В анализах мочи имеет место снижение относительной плотности мочи, появление белка и цилиндров и снижение диуреза. В биохимическом анализе крови отмечается снижение белка, особенно альбумина. В КОС – метаболические нарушения в виде ацидоза и алкалоза. Для больных перитонитом характерна выраженная и нарастающая гипокалиемия, что является плохим признаком, свидетельствующим о наличии полиорганной, в первую очередь почечной, недостаточности.
В реактивной стадии перитонита формируются хроническая и подострая формы ДВС–синдрома, а при прогрессировании процесса – острая и подострая формы ДВС.
Эхографическими критериями перитонита являются: наличие свободной жидкости в маточно–прямокишечном пространстве, латеральных каналах брюшной полости, между петлями кишечника, под печенью, диафрагмой; появление большого количества газа и жидкости в перерастянутых петлях кишечника; резкое ослабление или отсутствие перистальтических волн.
Основным рентгенологическим признаком перитонита является картина паралитической кишечной непроходимости: перерастяжение стенок кишечника с наличием множества горизонтальных уровней жидкости и чаш Клойбера.
Если клинические симптомы не позволяют поставить диагноз и провести дифференциальный диагноз, решающая роль в уточнении диагноза и определении тактики ведения больных должна быть отведена лапароскопии.
Лечение
Лечение состоит из следующих мероприятий (А.Н. Косинец, 1994, Э.К. Айламазян, И.Т. Рябцева, 2003): ■ мероприятия, направленные на борьбу с инфекцией и эндогенной интоксикацией в дооперационном периоде: • предоперационная подготовка занимает 1–2 ч и включает декомпрессию желудка; катетеризацию подключичной вены; проведение инфузионной терапии, направленной на ликвидацию гиповолемии и метаболического ацидоза, на коррекцию водного, электролитного и белкового баланса, детоксикацию организма • преднаркозное внутривенное введение антибиотиков в максимально возможных дозах с обязательным учетом особенностей их побочного действия ■ мероприятия, направленные на борьбу с инфекцией и эндогенной интоксикацией во время операции: • экстренная операция по устранению источника перитонита • санация брюшной полости 0,02% раствором хлоргексидина биглюконата или его комбинацией с 3%раствором водорода пероксида в соотношении 10: 1 • декомпрессия кишечника • интракорпоральная детоксикация (промывание кишечника растворами энтеросорбентов) • дренирование брюшной полости ■ мероприятия, направленные на борьбу с инфекцией и эндогенной интоксикацией в послеоперационном периоде: • комбинированая антибактериальная терапия. Применяются следующие антибиотики: • комбинации пенициллинов с ингибиторами β–лактамаз, например тикарциллин/клавулановая кислота (тиментин) 3 г • цефалоспорины 3–го поколения, например, цефотаксим (клафоран) 2 г или цефтазидим (фортум) 2 г в сочетании с нитроимидазолами (клион, метрогил) 0,5 г • меропенемы (меронем) в дозе 1 г или тиенам в дозе 1 г. • декомпрессия кишечника и интракорпоральная детоксикация • иммунокорригирующая терапия • применение стресс–протекторов для ограничения влияния стресс–реакции на специфический клеточно–опосредованный иммунитет и нормализации нейроэндокринного баланса • гепаринотерапия • применение ингибиторов протеолитических ферментов (контрикал и т.д.) • форсированный диурез.Одно из центральных мест в лечении перитонита занимает восстановление моторно–эвакуаторной функции желудка и кишечника. С этой целью применяют назогастральное зондирование; длительную перидуральную блокаду; внутривенное введение церукала по 2 мл 3 раза в сутки; ганглиоблокаторы типа 2,5% раствора бензогексония по 0,5 мл 4 раза в сутки внутривенно или внутримышечно; подкожное введение 1 мл 0,1% раствора прозерина.
Не менее важным является применение адекватного обезболивания в послеоперационном периоде. Метод выбора – длительная эпидуральная анестезия у всех больных, не имеющих абсолютных противопоказаний к данному методу обезболивания. Известно, что эпидуральная блокада является не только способом анестезии, но и терапевтическим методом. Эпидуральная блокада позволяет сохранить самостоятельное дыхание в послеоперационном периоде в полном объеме. Ввиду отсутствия болей в ране и брюшной полости больные активно поворачиваются в постели, рано садятся, глубоко дышат, возможны осложнения в виде гипостатической или аспирационной пневмонии ■ нормализация функций органов и систем, коррекция нарушений гомеостаза: • коррекция водно–электролитных и белковых расстройств • коррекция кислотно–щелочного состояния • восстановление моторики кишечника • коррекция нарушений гемостаза и микроциркуляции • профилактика и устранение дыхательной и сердечнососудистой недостаточности • нормализация функции печени и почек.
Анаэробный сепсис
Анаэробная инфекция известна более 170 лет (в 1839 г. A. Velpeau впервые описал газовую инфекцию). Анаэробные бактерии обеспечивают себя энергией и осуществляют все реакции биосинтеза, не прибегая к молекулярному кислороду. Термином «анаэробная инфекция» прежде обозначали анаэробную газовую инфекцию, вызванную клостридиями. Но существует большое количество анаэробных бактерий, образующих в процессе своей жизнедеятельности газ. В связи с этим следует различать анаэробную клостридиальную (спорообразующую) и анаэробную неспорообразующую инфекции. Именно неклостридиальная инфекция и превалирует в структуре гнойно–воспалительной патологии половых органов женщин. Хотя клостридиальные и неклостридиальные инфекции представляют собой по сути одну группу анаэробных воспалительных процессов, они обладают многими клиническими особенностями.Этиология и патогенез
В настоящее время большинство исследований указывает на преобладание анаэробных ианаэробноаэробных ассоциаций в инфекционном процессе, обладающих синергическим действием. Синергизм представляет не случайные механические, а физиологически обусловленные сочетания бактерий. Выделенные из патологических очагов ассоциации микробов имеют эволюционно закрепленный характер взаимоотношений того биотопа, из которого они происходят.Патогенез воспалительных процессов гениталий при анаэробной инфекции сложен и остается недостаточно изученным. Анаэробы чаще всего поражают поперечно–полосатую мускулатуру скелета и миометрий, что вероятно связано с богатством в мышцах гликогена, обеспечивающего анаэробам бескислородное существование.
Анаэробная инфекция проникает в мышцу со стороны соединительной ткани и ее прослоек между мышечными пучками, через лимфатические щели и по лимфатическим периваскулярным пространствам. Своими токсинами, богатыми протеолитическими и липолитическими ферментами, анаэробы прежде всего действуют на сосудистую стенку, поэтому в первую очередь обнаруживается расстройство кровообращения: расширение сосудов, отеки, тромбы, кровоизлияния. Характерная гистологическая картина выражается в отсутствии лейкоцитарной реакции. В сосудистой системе наибольшие изменения выявляются в капиллярах, которые принимают извитую форму, просвет их резко сужается.
Размножение микроорганизмов сопровождается образованием ферментов, повышающих активность вырабатываемых токсинов. Одновременно под воздействием ферментов происходит клеточный распад с образованием токсических продуктов. С массовым распадом бактерий происходит обильное освобождение специфических токсинов. Важнейшим патогенетическим компонентом при газовой инфекции является α–токсин, оказывающий местное некротическое, летальное и гемолитическое действие. Прямое воздействие токсинов на эритроциты приводит к утрате фосфолипидов мембранами эритроцитов и тем самым к образованию сфероцитов и микросфероцитов. Сфероциты набухают и разрываются, выделяя гемоглобин, который вскоре насыщает гаптоглобины и другие транспортные протеины, давая начало метгемальбумину. Гемоглобин циркулирует в плазме и других жидкостях, оседает в клетках, придавая коже бронзовый оттенок. Пигмент также выводится почками, поэтому моча приобретает темный цвет.
Развитие диссеминированной внутрисосудистой свертываемости, сопровождающей наиболее тяжелые формы анаэробной инфекции, объясняется гидролизом тромбоцитарных фосфолипидов, в результате чего образуется тромбопластин и появляется тромбоцитопения. Развитие кровотечения вызвано истощением запаса фибриногена в период внутрисосудистой свертываемости. Может быть и прямое некротическое действие токсинов анаэробов на капиллярные стенки. Кроме того, В. Flagilis и его группа способна продуцировать фермент гепариназу, в результате чего поражаются мелкие венулы с развитием тромбофлебита. Попадание инфицированных тромбов в легкие приводит к развитию метастатической пневмонии.
Большая часть послеродовых и послеабортных эндометритов вызывается смешанной анаэробно–аэробной микрофлорой и сопровождается гиперкоагуляцией и другими гемостазиологическими нарушениями. Поэтому вполне оправданно считать, что эти изменения являются косвенными признаками участия в патологическом процессе бактероидов группы В. Flagilis, особенно при появлении тромбофлебитов и вторичных септических очагов в легких (Ю.В. Цвелев и др., 1989).
Клиническая картина
Заболевание обычно возникает после криминальных абортов, реже – после родов, кесарева сечения, гинекологических операций, осложнившихся раневой инфекцией, на фоне хориоаминонита, гнойно–воспалительных заболеваний придатков матки и гнойных очагов малого таза.Заболевание начинается остро с неоднократных ознобов и повышения температуры тела до 40–41°С, появления мышечных болей, которые усиливаются при соприкосновении. Пульс учащается до 100–120 уд/мин, слабого наполнения и напряжения. Часто наблюдаются признаки сердечно–сосудистой недостаточности. Тоны сердца приглушены, выслушивается акцент II тона над легочной артерией, систолический шум над верхушкой сердца, особенно часто у больных с септическим эндокардитом.
При отсутствии кровотечения отмечается прогрессирующее снижение артериального давления. Нарастает тахипноэ до 30 и более в 1 мин. Развивается триада Нюрнберга в виде бронзовой окраски кожи, темного цвета мочи и темно–коричневого цвета плазмы крови.
Гемолиз эритроцитов, обусловленный непосредственным действием токсинов и ферментов, вызывает развитие гемолитической анемии. В крови отмечаются гемоглобинемия, гипербилирубинемия, а в моче – гемоглобинурия.
На коже появляются цианотичные и багрово–красные пятна на фоне ее мраморной окраски, а также мелкие и крупные кровоизлияния на месте инъекции, что указывает на развитие ДВС–синдрома. Затем кожа к концу 1–х суток болезни приобретает землистый цвет, а в дальнейшем – желтовато–бронзовый.
Уровень гемоглобина резко снижается, количество лейкоцитов достигает 30.000–50.000 и более. Лейкоцитарная формула в этот период характеризуется сдвигом влево с появлением миелоцитов и юных лейкоцитов и нарастанием количества палочкоядерных лейкоцитов. Наблюдаются лимфопения и моноцитопения, токсическая зернистость нейтрофилов. Характерный признак анаэробного сепсиса – снижение общего белка до 38–40 г/л, повышение уровня трансаминаз и общего билирубина. Если при этом печень увеличивается в размерах, то это указывает на печеночную недостаточность. Для анаэробного сепсиса характерна олигурия (ниже 20 мл/ч). В моче отмечается большое количество белка, гемоглобиновых глыбок. По мере роста количества метгемоглобина в крови на первый план выступает картина кислородного голодания, от которого гибнут 16–20% больных. Именно на этой стадии анаэробного сепсиса может развиться септический шок.
Инфекционно–токсический шок характеризуется резким ухудшением состояния больных. Нередко он развивается после кюретажа инфицированной матки, когда происходит массивное одномоментное поступление в кровь продуктов метаболизма анаэробов и тканевых токсинов. Особенностью инфекционно–токсического шока является сочетание выраженных гемодинамических расстройств и нарушений кровотока в легких с последующим развитием гипотензии, отека легких, поражением надпочечников. При гипотензии продолжительностью 8–24 ч и более выявляется полиорганная патология в виде острой почечной, печеночной, легочной недостаточности.
Если больные выдерживают кислородное голодание, их состояние постепенно начинает улучшаться. Картина крови и мочи медленно нормализуется, но количество мочи остается низким (20–100 мл/сут) и постепенно развивается уремия. Больные вялые, сонливые и апатичные. Отмечается дыхание Кусмауля. Появляется частая рвота, изо рта – запах ацетона.
Развивается азотемия. При отсутствии своевременной помощи многие больные погибают при явлениях уремии. При благоприятном исходе к 10–11–му дню заболевания начинает повышаться диурез и количество выделяемой мочи достигает 2–4 л/сут. При этом проходят отеки, прекращается рвота, повышается гемоглобин и снижается количество остаточного азота. Формула крови нормализуется.
Лечение
При острых гнойных процессах анаэробной этиологии прежде всего решается вопрос о хирургическом лечении, а также вопросы предоперационной подготовки, выбора анестезиологической помощи и активного ведения послеоперационного периода. Предоперационная подготовка направлена на повышение центрального венозного давления, улучшение микроциркуляции, реологических свойств крови, дезинтоксикацию, введение антибиотиков и продолжается несколько часов, что зависит от локализации и распространенности процесса.Установленный диагноз анаэробной инфекции служит показанием к неотложной операции: ■ при стабильном артериальном давлении (100–120/70– 80 мм рт. ст.) оперативное вмешательство выполняется сразу после установки диагноза, на фоне проведения инфузионной терапии ■ при нестабильности АД выполняется предварительная инфузионная подготовка в течение 1–2 ч (до стабилизации артериального давления), после чего осуществляется операция на фоне продолжающейся инфузионно–трансфузионной терапии.
Объем хирургических вмешательств при острых анаэробных гнойных заболеваниях органов малого таза предусматривает выполнение по показаниям гистерэктомии с удалением маточных труб, удаление тубоовариального или другого абсцесса малого таза, двустороннюю тубэктомию. Также выполняется ревизия брюшной полости, адекватное дренирование через открытый купол влагалища после экстирпации матки или посредством задней кольпотомии при сохраненной матке, выведение через контрапертуры на переднюю брюшную стенку дополнительных трубок.
При абсцессе большой железы преддверия и стенок влагалища делается их вскрытие, удаление некротических масс и гноя с последующим пассивным или активным дренированием.
Если при бактериоскопии определяются грамположительные палочки (семейство Clostridiaceae), то назначается внутривенно пенициллин в дозе 20–30 млн Ед/сут в сочетании с метронидазолом – 1,5–2 г/сут; при обнаружении грамположительных кокков (Peptococcus, Peptostreptococcus anaerobius) и
грамотрицательных палочек (семейство Bacteroides) – антибиотики широкого спектра действия (цефалоспорины 3–4–го поколения – цефоперазон, цефепим, аминогликозиды 3–го поколения – амикацин, нетромицин) в сочетании с метронидазолом, а также целесообразен в виде эмпирической монотерапии амоксациллин/клавулановая кислота 2 г 3 раза.
Лечение анаэробной инфекции дает положительный результат только при радикально выполненной хирургической операции и своевременно начатой комплексной терапии с использованием таких современных методов, как лазерное облучение, ультразвуковая кавитация в растворах антибиотиков, низкочастотная ультразвуковая терапия, местная оксигенотерапия и т.д.
Инфицированный аборт
Аборт, протекающий с признаками общего или местного инфекционного поражения, называется инфицированным абортом. Инфекционные осложнения абортов занимают ведущее место в структуре материнской заболеваемости и смертности. Особое место при этом занимают внебольничные аборты. У 30–90,7% пациенток внебольничный аборт осложняется эндометритом, в том числе тяжелой его формой – гнойно–резорбционной лихорадкой (ГРЛ), а у 9,3% больных – сепсисом (В.В. Абрамченко, Д.Ф. Костючек, Э.Д. Хаджиева, 2005). При этом на высокую летальность от септического аборта (1,5–5%) указывают А.С. Слепых и соавт. (1977), В.И. Кулаков и соавт. (1984), A. Richards et al. (1985).Этиология и патогенез.
Наиболее вероятными возбудителями являются ассоциации микроорганизмов: факультативные анаэробы (кишечная палочка, протей, энтерококк, клебсиелла, золотистый стафилококк, стрептококк, грамотрицательные бактерии, облиготин); неспорообразующие анаэробы: бактероиды, чаще Bacteroides fragilis, Bacteroides melani nogenes, фузобактерии, пептококки, пептострептококки; условно–патогенные возбудители в ассоциациях; при ассоциации аэроб – анаэроб может возникнуть синергичное действие бактерий. При длительном течении самопроизвольного аборта возможно развитие восходящей инфекции из влагалища (стафилококк, хламидии, эшерихии, стрептококк и др.) с последующим инфицированием эндометрия и плодного яйца. При искусственном прерывании беременности, особенно запрещенными способами и вне лечебного учреждения, часто происходит занесение инфекции. Инфекция возникает при наличии в матке значительной раневой поверхности. Часто она развивается на фоне сниженной иммунологической реактивности, нередко у ослабленных больных, с экстрагенитальными заболеваниями. Попавшая в матку патогенная флора инфицирует части плодного яйца. Кровь и оставшиеся части плодного яйца являются хорошей средой для развития в ней инфекции. Нередко женщина после самопроизвольного изгнания плодного яйца не обращается к врачу. Между тем в матке обычно остаются части хориона и децидуальной оболочки. При длительном течении аборта содержимое матки инфицируется. Из матки микробы распространяются гематогенным и лимфогенным путем на яичники, маточные трубы, тазовую брюшину и в околоматочную клетчатку, вызывая развитие различных локализованных и генерализованных осложнений вплоть до септицемии.В патогенезе инфекционного аборта выделяют общие положения развития воспаления: микробный фактор (вид, вирулентность, степень обсеменности, длительность воздействия); очаг инфекции (область и величина поражения органа, место внедрения микробов, пути распространения, характер кровообращения органа); реактивность макрорганизма. Патогенетической основой ГРЛ является фактор нагноения и фактор резорбции, при котором имеются токсико–дегенеративные и аноксемические, атрофические изменения со стороны ЦНС, атрофические изменения многих органов и тканей, несовершенство отграничительных грануляционных процессов, наличие замкнутых полостей в матке.
Следовательно, беременная женщина с осложнениями аборта должна входить в группу риска по развитию локализованных и генерализованных форм инфекции из–за присутствия всех трех факторов патогенеза, а вирулентность микробного фактора связана с особеностью воздействия токсинов. Изменения микроциркуляции и прямое действие токсинов бактерий лежит в основе тяжелых функциональных, а затем и органических расстройств важнейших органов.
Классификация
Основная диагностическая задача состоит в определении распространенности инфекционного процесса, его клинической формы и варианта течения. С этой целью удобнее всего использовать классификацию С.В. Сазонова, А.В. Бартельса (1973), адаптированную для гнойно–септической инфекции после аборта, с дополнением В.В. Абрамченко, Д.Ф. Костючек, Э.Д. Хаджиева (2005). ■ I этап распространения локализованной инфекции – неосложненный инфицированный (лихорадящий) аборт, характеризующийся ограниченным инфицированием плодного яйца и децидуальной оболочкой матки. ■ II этап – осложненный инфицированный аборт, при котором инфекция вышла за пределы матки, но осталась в малом тазу (поражены мышцы матки, маточные вены, трубы, яичники, параметральная клетчатка и тазовая брюшина). Вариант течения осложненного аборта – гнойно–резорбционная лихорадка, нередко трактуемая как «септическое состояние», «сепсис», «септический аборт», требует выделения в особую группу риска по генерализации процесса. ■ III этап – сепсис, при котором инфекция распространилась за пределы малого таза и стала генерализованной (септицемия, септикопиемия, перитонит, инфекционно–токсический шок, анаэробный сепсис).Анализируя вопросы современной классификации гнойносептической инфекции после аборта, следует отметить, что по общим проявлениям он близок к генерализованной форме и является пограничным состоянием
Клиническая картина
При неосложненнам лихорадочном выкидыше отмечаются повышение температуры тела, слабость, головная боль, учащение пульса (он соответствует температуре), лейкоцитоз. Явления общей интоксикации отсутствуют. Наблюдаются мутные кровянистые выделения с запахом. При влагалищном исследовании матка соответствует сроку задержки месячных, безболезненна при пальпации, придатки матки, тазовая брюшина и клетчатка не изменены.Осложненный лихорадочный выкидыш характеризуется ухудшением общего состояния больной, появлением болей в низу живота, ознобом, высоким лейкоцитозом, повышенной СОЭ. Матка чувствительна при пальпации, определяется одно– или двустороннее увеличение придатков.
Клиническая картина заболевания будет зависеть от характера процесса, степени распространения и вирулентности микрофлоры. Инфекция распространяется за пределы матки гематогенными или лимфогенным путем либо по маточным трубам. В связи с этим может возникнуть воспаление придатков, тазовой брюшины, околоматочной клетчатки, что способно сочетаться с нагноением и образованием пиосальпинкса или пиовара и скоплением гноя в маточно–прямокишечном углублении. При нагноительном процессе клиническая картина становится более тяжелой, возникают ознобы, нарастает температура, нарушается функция нервной системы, возникают изменения в других органах и системах, меняется картина крови. Возникают симптомы, типичные для сальпингоофорита, параметрита или пельвиоперитонита. Если в воспалительный процесс вовлечена тазовая брюшина, то в нижних отделах живота отмечаются перитонеальные явления. При влагалищном исследовании матка чувствительна при пальпации, определяется одно– или двустороннее увеличение придатков. При специальном гинекологическом обследовании наблюдаются структурные изменения шейки матки (размягчение, укорочение, раскрытие цервикального канала), травмы на слизистой шейки матки, матка чувствительна при пальпации, размягчена, отмечаются кровянистые, гнойно–кровянистые или гнилостные выделения.
Клинически гнойно–резорбционная лихорадка (ГРЛ) характеризуется рядом достоверных симптомов: высокая температура (39°С и выше), озноб, одышка, боли в низу живота, вздутие кишечника, бледность кожных покровов, желтушность склер, токсические изменения паренхиматозных органов (печень, почки, селезенка), язык сухой, кожа становится бледной, возникает желтоватый или сероватый оттенок, снижается диурез, наблюдаются лимфопения, изостенурия. Появляются ознобы, температура высокая и не соответствует учащению пульса. Нередко развиваются септический перитонит, тромбофлебиты и метастатические абсцессы в легких, почках и других органах. При влагалищном исследовании выраженных воспалительных процессов в малом тазу может не быть.
Диагностика
Анализ крови: при значительной или длительной кровопотере отмечаются анемия, умеренный лейкоцитоз до 10–12·109/л, отсутствие токсических изменений в крови, лимфопения, повышение СОЭ. Умеренное снижение содержания общего белка за счет уменьшения альбуминовой фракции, высокий титр С–реактивного белка, небольшая задержка натрия.Лечение
Лечение инфицированных абортов представляет собой сложную задачу. Своевременная санация локализованной в пределах матки инфекции может быть радикальной и приводить к излечению. В то же время манипуляции по удалению инфицированных остатков плодного яйца, а также наличие в сосудах инфицированных тромбов могут способствовать «прорыву инфекта» с развитием инфекционно–токсического шока – как при локализованных, так и при генерализованных формах инфекции. Наиболее безопасен консервативновыжидательный метод лечения, при угрожающем жизни кровотечении – активный метод.Последовательность лечебных мероприятий следующая: ■ интенсивная антибактериальная терапия двумя антибиотиками широкого спектра действия (предпочтительно полусинтетическими препаратами группы пенициллина, ампициллина, ампиокс в сочетании с аминогликозидами – канамицином, гентамицином, карбенициллином в максимальных терапевтических дозах), смена антибиотиков по результатам антибиотикограммы ■ инфузионная терапия коллоидными и кристаллоидными растворами (растворы Рингера – Локка, полифера, реополиглюкина, полиглюкина, полидеза, гемодеза, полиионные растворы, альбумин, протеин, сухая нативная плазма, гемотрансфузия по показаниям), общее количество – не менее 1,5–2 л/сут ■ витаминотерапия (аскорбиновая кислота с унитиолом, витамины группы В), десенсибилизирующая терапия (димедрол, тавегил, пипольфен), транквилизаторы, седативные, кардиотонические средства.
При неосложненном инфицированном аборте необходимо отсроченное на 12–24 ч и более (после нормализации температуры тела) удаление остатков плодного яйца абортцангом и тупой кюреткой или методом вакуум–аспирации под внутривенным обезболиванием калипсолом.
При осложненном аборте или ГРЛ принципы лечения идентичны таковым при послеродовой септической инфекции. Назначаются антибактериальные препараты широкого спектра, общеукрепляющие, болеутоляющие, десенсибилизирующие, дезинтоксикационные средства (В.И. Кулаков, Н.Д. Селезнева, С.Е. Белоглазова, 2006; Л.А. Суслопарова, 2005). Положительная динамика на фоне интенсивной терапии наблюдается через 12– 24 ч. Сохранение состояния гипотонии, низкого пульсового давления свидетельствует о продолжающемся сосудистом спазме и является ранним симптомом инфекционно–токсического шока.
При больших сроках беременности (более 15–16 недель), при наличии плода в матке и невозможности одномоментного опорожнения, не дожидаясь снижения температуры, с целью ускорения изгнания инфицированных остатков плодного яйца назначают простагландины, окситоцин со спазмолитиками по традиционным схемам и комплекс интенсивной терапии с небольшими дозами кортикостероидов для профилактики инфекционнотоксического шока.
Наличие профузного кровотечения даже при высокой температуре тела и явлениях общей интоксикации вынуждает по жизненным показаниям производить немедленное удаление абортцангом свободно лежащих частей плода и кюретаж тупой кюреткой или пальцевое удаление остатков плодного яйца, при продолжающейся антибактериальной и инфузионной терапии, при необходимости проводят гемотрансфузии. После кюретажа во всех случаях применяются сокращающие матку средства (окситоцин, метилэргометрин по 1 мл 2 раза в сутки).
По мере нарастания клинических проявлений заболевания (сепсис) и усугублении состояния больной производится лапаротомия – экстирпация матки с трубами; вопрос относительно яичников решается индивидуально.
Антибактериальная, инфузионная и общеукрепляющая терапия продолжается до клинического выздоровления и стабилизации лабораторных показателей. Выписка из стационара – не ранее 12–13–х суток после операции.
Таким образом, уточнение клинической формы инфекции в первые часы наблюдения способствует выработке более оптимальной лечебной тактики, особенно в группе с осложненным абортом, протекающим с выраженной ГРЛ.
Инфекционно–токсический шок
Инфекционно–токсический (септический, бактериальный) шок – тяжелое течение сепсиса, характеризующееся развитием артериальной гипотензии даже при адекватной инфузионной терапии, гипоперфузии тканей, приводящей к нарушению функции органов и систем. Впервые он был описан в 1956 г. Studdiford и Douglas. По частоте инфекционно–токсический шок стоит на третьем месте после геморрагического и кардиального, а по смертности – на первом; при его возникновении погибают до 80% больных. Инфекционно–токсический шок развивается на любом этапе гнойного заболевания, но чаще он наблюдается при очередном обострении гнойного процесса или в момент хирургического вмешательства, а также в любое время у больных с сепсисом, при инфицированных внебольничных абортах, пельвиоперитонитах, распространенных перитонитах и раневой инфекции. Установлено, что в США каждый год регистрируется 30.000–50.000 случаев сепсиса.Этиология
В большинстве случаев инфекционно–токсический шок вызывается различными формами бактериальной инфекции. До использования антибиотиков широкого спектра действия чаще возбудителями сепсиса была грамположительная флора – стрептококки, энтерококки и стафилококки, но с появлением новых сильных антибиотиков все большую роль стали играть нозокомиальная грамотрицательная инфекция (кишечная палочка, протей, клебсиелла, синегнойная палочка). При разрушении этих бактерий выделяется эндотоксин. Сегодня частота случаев грамположительного и грамотрицательного сепсиса приблизительно одинакова, но пока не ясно, как эта тенденция влияет на патогенез септического процесса.Причиной развития шока могут быть и анаэробы, в первую очередь Clastridia pergingens, а также риккетсии, вирусы (v. herpes zoster, cytomegalovirus), простейшие и грибы.
Патогенез
Для возникновения инфекционно–токсического шока необходимо кроме инфекции наличие снижения общей резистентности проникновения возбудителя или его токсинов в кровоток.Новые открытия в области молекулярной биологии позволили лучше понять многие патогенетические механизмы развития сепсиса. В сущности сепсиса и инфекционно–токсический шока лежит системный воспалительный ответ, который опосредован продукцией большого количества медиаторов. Эффекты и взаимодействие этих веществ обусловливают сложное течение заболевания, которое по этой причине в каждом случае носит индивидуальный характер. Эффект обратной связи, который заложен в этом процессе, может приводить как к увеличению надежности системы, так и к ухудшению состояния больного.
В патогенезе инфекционно–токсического шока можно выявить следующие моменты: ■ гипердинамию сердечно–сосудистой системы, которая характеризуется увеличением сердечного выброса и низким сосудистым сопротивлением ■ повышение проницаемости сосудов ■ усиление агрегации тромбоцитов ■ дефицит объема циркулирующей крови, приводящий к уменьшению венозного возврата, шунтированию крови по периферии, централизации кровообращения, что приводит к нарастанию клеточной гипоксии и развитию легочной, печеночной недостаточности.
В патогенезе инфекционно–токсического шока различают гипердинамическую и гиподинамическую фазы. При гипердинамической фазе инфекционно–токсический шока периферический кровоток остается довольно высоким, но капиллярная перфузия снижена. Нарушено усвоение кислорода и энергетических веществ. Наступает гиперактивация тромбоцитарного и прокоагулентного звеньев гемостаза с развитием ДВС–синдрома. Избирательный спазм венул в сочетании с прогрессированием ДВС–синдрома способствует секвестрации крови в системе микроциркуляции. Повышение проницаемости стенок сосудов способствует просачиванию жидкой части крови, а затем и форменных элементов в интерстициальное пространство.
Гиподинамическая фаза инфекционно–токсического шока характеризуется снижением артериального давления, которое носит стойкий характер. В этой фазе шока прогрессирующее нарушение тканевой перфузии приводит к дальнейшему углублению тканевого ацидоза на фоне резкой гипоксии.
Таким образом, для инфекционно–токсического шока характерны уменьшение системного сопротивления и артериальная гипотензия при увеличении сердечного выброса. Одним из ключевых моментов развития инфекционно–токсического шока является угнетение сократительной способности миокарда, несмотря на начальное увеличение сердечного индекса. Состояние сократительной способности миокарда часто определяет исход.
Клиническая картина
Клиническая картина септического шока довольно типична. Выраженность симптомов зависит от фазы инфекционно–токсического шока, длительности его течения, от степени выраженности повреждения различных органов, от заболевания, на фоне которого развился шок.Для врача важно определить ранние симптомы септического шока в соответствии с критериями международной согласительной конференции (1992).
Сепсис–системный ответ на инфекцию характеризуется 8 и более признаками: температура тела – более 38°С или менее 36°С, ЧСС – более 90 уд/мин, частота дыхания более 20 в минуту, рСО2 – менее 32 мм рт. ст., лейкоциты – более 12.000/мл или менее 4000/мл или незрелые формы – более 10%.
Тяжелый сепсис характеризуется нарушением функции органов, гипоперфузией тканей и артериальной гипотензией. Возможны лактатацидоз, олигурия, нарушение сознания.
Инфекционно–токсический шок – сепсис с артериальной гипотензией, развивающейся, несмотря на адекватную инфузионную терапию; гипоперфузей тканей, лактатацидозом, олигурией, нарушением сознания. При инотропной поддержке АД удается стабилизировать, но гипоперфузия остается.
Инфекционно–токсический шок наступает остро после операций или каких–либо мероприятий в очаге инфекции, при которых возникают предпосылки для проникновения микроорганизмов или их токсинов в кровеносное русло.
Развитию шока всегда предшествует гипертермия до 39– 41°С, держится от нескольких часов до 1–3 суток, затем резко снижается на 2–4°С до субфебрильных, нормальных или субнормальных цифр, характерны повторяющиеся ознобы. Ведущим признаком инфекционно–токсического шока будет снижение артериального давления без предшествующей кровопотери или не соответствующее ей. При гипердинамической («теплой») фазе шока систолическое артериальное давление снижается до 80–90 мм рт. ст. (10,6–12,0 кПа). На этих цифрах артериальное давление удерживается от 15 мин до 2 ч. В связи с этим данная фаза шока иногда пропускается врачебным персоналом. Гиподинамическая («холодная») фаза шока обусловлена быстрым и длительным снижением артериального давления. Это состояние может продолжаться от нескольких часов до несколько суток. Иногда у больных возникает короткая ремиссия. Однако необходимо учитывать, что инфекционно–токсический шок может развиться и при нормальном артериальном давлении. У отдельных больных могут наблюдаться даже повышенные показатели артериального давления. Возникает тахикардия (120– 140 уд/мин). Шоковый индекс (частное от деления частоты пульса на величину систолического артериального давления) превышает 1,5 (норма 0,5), что свидетельствует о снижении ОЦК. Рано возникает одышка (от 30 до 60 дыханий в минуту), что указывает на нарастание тканевого ацидоза и формирование «шокового» легкого. Нарушение со стороны ЦНС выражается в эйфории, возбуждении, дезориентации, бреде, слуховых галлюцинациях, вялости и затем адинамии. Эти нарушения ЦНС могут предшествовать снижению артериального давления.
В первые часы шока багрово–красный цвет кожных покровов резко контрастирует с цианотичной окраской губ, ногтевого ложа и кончиков пальцев. Таким образом, изменения со стороны кожных покровов характеризуются гиперемией и сухостью, затем кожные покровы бледнеют, холодеют и покрываются липким холодным потом. К 6–12–му часу заболевания на коже губ, носа и других участках появляются высыпания геморрагического характера. Может возникнуть Herpes labialis. При развитии печеночной недостаточности кожа имеет желтушный цвет. Появление акроцианоза, петехиальной сыпи на лице, груди, животе, на сгибательных поверхностях конечностей отмечается позже. Геморрагический некроз кожи лица, синюшность кожи рук, ног, носа, щек и ушных раковин указывают на признаки ДВС–синдрома.
Пациентки отмечают боли непостоянного характера и локализации; появление последних связывают с нарушением кровообращения и кровоизлияниями в ткани. Часто наблюдается рвота, которая со временем приобретает «кофейный» цвет, что связано с кровоизлияниями и некрозом в слизистой желудка.
Часто присоединяются симптомы ОПН, ОДН и кровотечения в результате развития ДВС крови. В диагностике инфекционно–токсического шока крайне важное значение имеет оценка функции легких, которая нарушается вследствие блокады легочного кровотока тромбоцитарно–фибриновыми агрегатами. Обычно нарушения функции легких проявляются в виде отека и развития острой легочной недостаточности, для которых характерны тахипноэ и метаболический ацидоз. Рентгенологически во всех отделах легких обнаруживают облаковидные затемнения – проявление интерстициального отека легочной ткани.
В литературе выделяется 3–я фаза – «необратимая», или «вторичный» шок. Она характеризуется анурией, дыхательной и сердечной недостаточностью, комой.
Диагностика
Диагноз ставится на основании анализа данных анамнеза, результатов клинического и лабораторного обследования, свидетельствующих о проявлениях бактериемии, а также с использованием инструментальных методов исследования.В связи с тем что необратимые изменения в организме наступают быстро (в пределах 6–12 ч), очень важна ранняя диагностика, основывающаяся на следующих данных: ■ наличие септического очага ■ высокая температура с частыми ознобами, затем резкое снижение температуры тела ■ снижение артериального давления, не соответствующее кровопотере ■ тахикардия ■ тахипноэ ■ расстройства сознания ■ боли в животе, грудной клетке, конечностях, пояснице, головная боль ■ уменьшение диуреза до анурии ■ петехиальная сыпь, некроз кожи.
Для уточнения диагноза инфекционно–токсического шока и проведения целенаправленной терапии в первую очередь необходимы следующие мероприятия: контроль артериального и центрального венозного давления, частоты дыхания каждые 30 мин; измерение ректальной температуры 4 раза в сутки, особенно после озноба, для сопоставления с данными температуры тела в подмышечной области; посевы крови в момент госпитализации и во время ознобов с определением чувствительности выделенной микробной флоры к антибиотикам; почасовой контроль за диурезом; выделение микробной культуры из мочи, определение чувствительности микробов к антибиотикам; определение электролитов сыворотки, азота, мочевины, креатинина, мочевой кислоты, газов артериальной крови, рН; постоянный мониторный контроль ЭКГ, частоты сердечных сокращений; рентгенологическое исследование грудной клетки, брюшной полости при вертикальном положении пациентки для обнаружения свободного газа под диафрагмой, а также исключения инородного тела в брюшной полости; общий анализ крови с оценкой лейкоцитарной формулы, определение гематокрита; исследование показателей свертываемости крови: количество тромбоцитов, фибриногена, растворимых комплексов мономеров фибрина, продуктов деградации фибрина и фибриногена, антитромбина III, показателей тромбоэластограммы.
Ультразвуковое и рентгенологическое исследование, компьютерную и магнитно–резонансную томографию выполняют для уточнения расположения первичных и вторичных (метастатических) гнойных очагов.
Лечение
Проводится комплексное лечение. Оно направлено на борьбу с шоком и инфекцией, профилактику и терапию осложнений септического шока: ОПН, ОДН и кровотечений вследствие нарушений свертывающей системы крови. Лечение инфекционно–токсического шока можно разделить на местное (хирургия септического очага) и общее (инфузионно–трансфузионная терапия, антибиотикотерапия, инотропная поддержка, иммунотерапия и др.).Интенсивная терапия проводится совместно реаниматологом и акушером–гинекологом при условиях жесткого постоянного контроля за температурой тела, состоянием кожных покровов и слизистых, частотой дыхания и пульса, почасовым диурезом, данными артериального давления, центрального венозного давления, гематокрита, белковым, электролитным, кислотноосновным составом плазмы крови, состоянием свертывающей системы, билирубина и азотистых шлаков, ЭКГ.
Удаление очага инфекции необходимо поставить на первое место. Следует помнить, что пока не будет удален септический очаг, будет нарастать полиорганная недостаточность, и все вышеуказанные методы общей терапии необходимо рассматривать как подготовку к оперативному вмешательству.
При местном лечении гнойных очагов важно отметить радикальность хирургического вмешательства и адекватность дренирования. Наиболее радикальным способом борьбы с очагом инфекции является удаление матки. Промедление с радикальным удалением септического очага, связанное как с преодолением морального барьера неизбежности удаления матки у молодых женщин, так и с необходимостью оперативного лечения у женщин, находящихся в тяжелом состоянии, может стоить жизни больной. Операция должна быть произведена в объеме экстирпации матки с удалением маточных труб, дренированием параметриев и брюшной полости (Э.К. Айламазян, И.Т Рябцева, 2003).
При гнойных маститах, осложненных инфекционно–токсическим шоком, показано широкое вскрытие гнойников с обеспечением хорошего оттока, а при гангренозной форме необходима мастэктомия.
Лечение инфекционно–токсического шока при гестационном пиелонефрите начинают с создания хороших условий для оттока мочи путем катетеризации мочеточников. В случае апостематозного пиелонефрита или карбункула почки объем операции определяется и осуществляется урологом: от декапсуляции, вскрытия и дренирования абсцессов до нефрэктомии.
Целенаправленная антибактериальная терапия возможна после определения возбудителя и его чувствительности к антибиотикам. До этого следует применять эмпирическую антибиотикотерапию, принимая во внимание характер первичного очага инфекции, функциональное состояние печени, почек, иммунной системы. В настоящее время наиболее частой причиной инфекционно–токсического шока являются грамотрицательные бактерии (в первую очередь, кишечная палочка) часто в сочетании с анаэробной флорой. Этим и определяется выбор антибактериальной терапии, причем дозы препаратов должны значительно превышать средние, вводить антибиотики необходимо внутривенно.
Популярный тройной режим антибиотикотерапии ушел в прошлое. В этом плане препаратами первого выбора являются карбопенемы – меронем или тиенам с учетом максимально широкого спектра антибактериальной активности этих препаратов и значительной устойчивости к β–лактамазам. Бактерицидный эффект после введения такого препарата проявляется сразу. Начальная доза карбапенема должна быть максимальной (1–2 г) и вводиться внутривенно микроболюсно (для меронема) или капельно в течение 60 мин (для тиенама). Последующие введения – каждые 8 ч по 500–1000 мг. При грамположительном лидере в микробной ассоциации предпочтительнее тиенам, при грамотрицательном – меронем.
Для усиления антимикробного эффекта и расширения спектра действия антибактериальные препараты можно комбинировать, учитывая определенную направленность их влияния. Большинство представителей грамположительных аэробов чувствительны к полусинтетическим пенициллинам (ампициллин, оксациллин, ампиокс), цефалоспоринам (цефопиразин, цефотаксим, цефтриаксон, цефтазидим, цефепим и др.), линкозаминам (клиндамицин, линкомицин), фторхинолонам (ципрофлоксацин, офлоксацин, пефлоксацин). Грамотрицательная аэробная флора чувствительна к аминогликозидам (гентамицин, амикацин, нетилмицин, тобрамицин), большинству представителей цефалоспоринов 2, 3, 4–го поколений, фторхинолонам.
Основными средствами, к которым проявляют высокую чувствительность неспорообразующие анаэробные бактерии, являются метронидазол, линкозамины, карбанем (Э.К. Айламазян, И.Т. Рябцева, 2003). При явных признаках анаэробного, а именно бактероидного компонента инфекции (при позднем перитонеальном сепсисе, билиарной форме инфекционно–токсического шока, анаэробной флегмоне в области операционной раны), препаратами выбора является комбинация цефепима (максипина) в максимальной дозе 2 г внутривенно медленно (за 3–5 мин) с последующим введением 1–2 г препарата каждые 12 ч. Оптимальной комбинацией является сочетание максипина с клиндамицином или метронидазолом.
Наряду с плевропульмональной и перитонеальной формами инфекционно–токсического шока сочетание максипин + метронидазол особенно показано при уродинамической форме инфекционно–токсического шока.
При комбинированной антибиотикотерапии рекомендуется однократное применение аминогликозидов с целью уменьшения их токсичности, что в сочетании с длительно действующими цефалоспоринами дает достаточный эффект и более безопасно. Расширение антибактериального спектра можно обеспечить однократным применением суточной дозы аминогликозидов 3–го поколения (амикацина или нетилмицина) по 1 г.
При существенном поражении функции почек и желчевыводящих путей может быть избрано сочетание цефтриаксона или цефпиразона с амикацином. Цефтриаксон (роцефин или его генерики – лендацин или лонгацеф) вводят внутривенно медленно в дозе 30 мг/кг в течение 30 мин с последующим введением дозы цефтриаксона 1 г каждые 12 ч. При нарушении функции почек показан цефобид, который не требует коррекции дозы. Введение спустя 6–8 ч после цефобида суточной дозы амикацина (1 г) или 500 мг нетромицина закрепляет достигнутый эффект санации циркулирующей крови за счет максимального расширения антибактериального спектра.
Если основным возбудителем являются стафилококки, любому β–лактамному препарату следует предпочесть гликопептидные антибиотики – ванкомицин или тейкопламин. Ванкомицин (ванкоцин, ванкосан, эдицин) вводят в начальной дозе 1 г внутривенно капельно в течение 50–60 мин с повторением каждые 12 ч.
При высокоинвазивных псевдомонадных инфекциях рекомендуются комбинации: имепенем и амикацин, цефтазидим и тобрамицин, ципрофлоксацин и азлоциллин.
Необходимо произвести забор материала для микробиологического исследования до начала антибактериальной терапии и во время операции. Возможно утяжеление состояния больной после введения больших доз антибиотиков вследствие гибели бактерий и массивного высвобождения эндотоксинов.
Если после достижения нормального ОЦК артериальное давление остается низким, то с цельюувеличения сердечного выброса и сосудистой резистентности необходимо использовать допамин или добутамин; если и в этом случае коррекция АД не удалась, возможно применение адреналина. Низкие дозы дофамина (1–5 мкг/кг·мин) уменьшают сопротивление почечных сосудов, увеличивают почечный кровоток и клубочковую фильтрацию, что повышает эффективность действия препарата при инфекционно–токсическом шоке. С этой целью 5 мл 0,5% раствора дофамина разводят в 125 мл изотонического раствора натрия хлорида или 5% раствора глюкозы и вводят внутривенно очень медленно по 2–10 капель в минуту.
В качестве инфузионных сред на 1–м этапе лечения предпочтительнее использовать кровозаменители с гемодинамическим эффектом, созданные на основе гидроксиэтилкрахмала, желатина, декстрана, полиэтиленгликоля. Эти препараты восстанавливают и улучшают реологические свойства крови и тем самым способствуют уменьшению вязкости, устранению стаза и агрегации форменных элементов, улучшению микроциркуляции. Кроме того, указанные кровозаменители значительно повышают ОЦК за счет привлечения жидкости из межтканевого пространства. Немаловажным достоинством данных инфузионных сред является способность адсорбировать токсины и выводить их из организма (Э.К. Айламазян, И.Т. Рябцева, 2003).
Чтобы предотвратить нежелательные побочные свойства этих сред, используют средние дозы плазмозаменителей, так как крупномолекулярные декстраны способны блокировать ретикулоэндотелиальную систему, а низкомолекулярные – вызывать осмотический нефроз. Кровезаменители на основе декстрана (полиглюкин, реополиглюкин) и гидроксиэтилкрахмала (ХАЕС–Стерил, волекам, стабизол) снижают сосудисто–тромбоцитарный и плазменный гемостаз. В связи с этим при наличии ДВС–синдрома необходимо пользоваться препаратами желатина (желатиноль, гелофузин) и полиэтиленгликоля (полиоксидин). Скорость инфузии 5–20 мл/ч и объем (3500–4500 мл и более) определяются реакцией организма на ее проведение по показателям частоты пульса, величины артериального давления и центрального венозного давления. Коллоиды и кристоллоиды применяются в соотношении 2,5: 1. Трансфузия крови показана при гемоглобине менее 80 г/л и в виде эритроцитарной массы, а еще лучше – отмытых эритроцитов. Если артериальное давление повышается, то обычно коагулопатия ликвидируется. Если имеет место кровотечение вследствии коагулопатии потребления, то показана заместительная терапия – это тромбоцитарная масса при тромбоцитопении, криопреципитат при гипофибриногенемии и свежезамороженная плазма при недостатке факторов свертывания.
На фоне улучшения реологических свойств крови используются сердечные гликозиды, курантил, вазодилататоры.
Абсолютным показанием к искусственной вентиляции легких является снижение рО2 менее 60–70 мм рт. ст. при ингаляции 100% кислородом.
Диуретики применяются только на ранних стадиях инфекционно–токсического шока при наличии олиго– или анурии.
Использование антикоагулянтов в настоящее время хотя и является логичным, но остается спорным. В настоящее время более эффективно назначение пролонгированных низкомолекулярных аналогов гепарина – фраксипарина по 0,4 мл 1 раз в сутки или клексана в дозе 20 мг (0,2 мл) 1 раз в сутки. Их вводят подкожно в переднюю или заднелатеральную область брюшной стенки на уровне пояса. При введении препаратов необходимо соблюдать ряд условий: при инъекции игла должна располагаться вертикально и проходить всю толщу кожи, зажатой в складку; место инъекции нельзя растирать. Для тучных больных, имеющих массу более 100 кг, дозы гепарина и его аналогов удваиваются. Противотромботическую терапию необходимо сочетать с восполнением уровня антитромбина III и плазминогена за счет переливания свежей или свежезамороженной плазмы. В зависимости от показателей коагулограммы проводится заместительная терапия 1000–2000 мл свежезамороженной плазмы с предварительным назначением ингибиторов протеаз крови: гордокса в дозе 300.000–500.000 ЕД, контрикала в дозе 800.000–1 500.000 ЕД/сут или трасилола в дозе 125.000–200.000 ЕД/сут.
Всем больным показано применение дезагрегантов (антиагрегантов). В состав инфузионной терапии включают реополиглюкин, применяют также курантил (трентал). Последний включают в инфузионные среды в среднем по 100–200 мг/сут, а при необходимости (невозможность применения прямых антикоагулянтов) доза может быть увеличена до 500 мг/ сут с постепенным введением препарата.
Продолжает дискутироваться вопрос об использовании кортикостероидов для лечения инфекционно–токсического шока. Данные литературы свидетельствуют в пользу этих препаратов (М.И. Лыткин и др., 1980; Б. Л. Гуртовой и др., 1981; И.Т. Рябцева и др., 1982; Я.П. Сольский и др, 1982). Кортикостероиды не только способствуют улучшению гемодинамики, но и оказывают положительное действие на многие патогенетические звенья инфекционно–токсического шока. Глюкокортикоиды, увеличивая сердечный выброс, оптимизируют деятельность сердца; обладая умеренным сосудорасширяющим свойством, улучшают микроциркуляцию; снижая поступление тканевого тромбопластина и предупреждая нарастание агрегации тромбоцитов, уменьшают выраженность ДВС–синдрома. Поддержание в плазме достаточной концентрации стероидов ведет к подавлению системных реакций на эндотоксины. Кроме этого, кортикостероиды могут блокировать прокоагулентную активность альвеолярных и почечных макрофагов и предупреждать сосудистый микротромбоз. К тому же эти препараты стимулируют деятельность ферментов, участвующих в окислительных процессах, повышают толерантность клеток к недостатку кислорода, способствуют стабилизации мембран, предупреждают развитие шокового легкого, обладают антигистаминным свойством.
При инфекционно–токсическом шоке, необходимо вводить антигистаминные препараты: 1–2 мл 1% раствора димедрола, 1–2 мл 2,5%раствора дипразина (пипольфена), 1–2 мл 2%раствора супрастина или 2 мл тавегила.
Наряду с нормализацией гемодинамики целью инфузионной терапии при инфекционно–токсическом шоке должна быть коррекция кислотно–основного и электролитного гомеостаза.
Иммунотерапия должна быть направлена на блокирование эффектов эндотоксина, TNF, П–6 и других медиаторов и проводиться после ликвидации очага инфекции.
После выписки из стационара больная в течение 5 лет нуждается в диспансерном наблюдении с целью своевременного выявления и лечения возможных отдаленных последствий перенесенного инфекционно–токсического шока: хронической почечной недостаточности, синдрома Шихена, диэнцефального синдрома по типу болезни Иценко – Кушинга, сахарного диабета, синдрома Уотерхауса – Фридериксена.
Острый живот при нарушении кровоснабжения органов и опухолей
Основные причины развития симптомокомплекса нарушения кровообращения во внутренних половых органах: ■ перекрут ножки опухоли или кисты яичника ■ перекрут здоровых придатков матки ■ кровоизлияние в кисту или опухоль яичника ■ миома матки с нарушением питания в узле ■ перекрут тонкого основания подбрюшинной миомы матки ■ перекрут ножки опухоли яичника.Перекрут ножки опухоли яичника.
Одна из причин возникновения острой тазовой боли. Опухолевидные образования и истинные опухоли яичников – нередкая патология половых органов. Чаще происходит перекрут ножки опухоли или опухолевидного образования яичника. Различают анатомическую и хирургическую ножку опухоли яичника. Возможность осложненного течения опухоли яичника обусловлена подвижностью образования и наличием анатомической ножки, включающей подвешивающую связку, собственную связку яичника и часть заднего листка широкой маточной связки. В ножке опухоли проходят сосуды, которые питают опухоль (яичниковая артерия и анастомоз ее с маточной артерией), лимфатические сосуды и нервы. Хирургическая ножка, образовавшаяся в результате перекрута, может включать и другие органы: перерастянутую маточную трубу, сальник, петли кишечника. Но чаще в перекрут ножки опухоли яичника попадает маточная труба. Не всякий анатомический перекрут ножки кисты имеет характерную клиническую картину. Поэтому понятие «перекрут ножки кисты» является клинико–анатомическим.Перекрут ножки может быть у опухолей разной гистологической структуры, но, как правило, не спаянных с соседними органами и имеющих выраженную ножку.
Этиология и патогенез.
Причины перекрута ножки кисты (опухоли) яичника не всегда ясны. Известную роль в этом осложнении могут играть следующие факторы: повышение давления крови в венах ножки кисты (опухоли) и в самом образовании; физическое напряжение; резкая смена положения тела; усиленная перистальтика кишечника; переполнение мочевого пузыря; переход кисты (опухоли) из малого таза в брюшную полость; половое сношение; длинная ножка. Вследствие этих причин перекрут ножки опухоли часто происходит у девочек, девушек и даже у новорожденных.Часто встречается перекрут ножки опухоли и у многорожавших женщин с перерастянутой передней брюшной стенкой. Перекрут ножки опухоли может возникнуть во время беременности и в послеродовом периоде; этому может способствовать усиленная перистальтика и переполненный мочевой пузырь.
Интенсивность нарушения кровообращения при перекруте ножки подвижного образования зависит от величины угла перекрута и быстроты его развития. В связи с этим различают частичный и полный перекрут, который может произойти внезапно или постепенно. При полном перекруте (свыше 360°) ножки опухоли яичника образуется резко выраженный венозный стаз, который ведет к разрыву капилляров и мелких сосудов, кровоизлиянию в стенку опухоли, ее полость и ткань ножки. Разрывы капилляров оболочки опухоли ведут к точечным кровоизлияниям с последующим выпадением фибрина на поверхности, из–за чего происходит раздражение окружающей брюшины и образование спаек с кишечником и сальником, в последующем развивается некроз (А.Н. Стрижакова, А.И. Давыдова, Л. Д. Белоцерковцева, 2004). Образование меняет окраску, становится сине–багровым, затем коричневым. Это приводит к потере подвижности кисты (опухоли). В особенно тяжелых случаях, когда сдавливаются не только вены, но и артерии, опухоль лишается питания и в ней происходят ишемические и некротические изменения. Это может привести к тяжелым септическим осложнениям.
Клиническая картина
При перекруте ножки кисты (опухоли) прежде всего нарушается ее питание и развиваются симптомы, характерные для перекрута. Выраженность клинической картины заболевания не всегда определяется степенью перекрута. Иногда уже при сравнительно небольшом перекручивании ножки (на 90–120°) возникают выраженные симптомы заболевания, в то время как при более значительной степени перекрута (иногда даже до 360°) признаки заболевания могут отсутствовать или оставаться невыраженными.Чаще всего заболевание начинается остро: внезапно в нижних отделах живота появляются сильные боли приступообразного характера, иррадиирующие в ноги и поясницу, возможна иррадиация в позвоночник, а также тошнота, рвота рефлекторного характера, задержка стула и газов. Резкий болевой синдром может сопровождаться симптомами шока: бледностью кожных покровов и слизистых оболочек, похолоданием конечностей, частым пульсом, резким снижением артериального давления и т.д. Пальпация живота выявляет выраженную локальную болезненность и напряжение мышц брюшной стенки больше на стороне поражения. На почве раздражения брюшины рефлекторно возникает парез кишечника с метеоризмом и нередко дизурические явления (частое мочеиспускание). Симптомы раздражения брюшины выражены не всегда. Температура тела в первые часы заболевания остается нормальной, лейкоцитарная реакция не выражена.
Очень важным нюансом является то, что в силу быстрой гибели нервных окончаний в опухоли она может быть безболезненной, а вся болезненность будет локализоваться у угла матки, т.е. резко болезненной будет хирургическая ножка.
Далее развиваются симптомы интоксикации и воспалительных процессов (лейкоцитоз до 16·109/л, ускоренная СОЭ). При частичном перекруте все явления значительно менее выражены и могут проходить без лечения, боли локализуются в области расположения опухоли; симптомы то стихают, то появляются вновь. В последующем во время операции находят вторичные изменения в опухоли.
Диагностика
Уточнению диагноза способствуют данные бимануального исследования, при котором определяют образование или его нижний полюс в области придатков матки, резко болезненное при пальпации и попытке смещения, туго– или плотноэластической консистенции, с гладкой поверхностью, ограниченно подвижное, резко болезненное при пальпации и смещении. Важным признаком перекручивания ножки кисты (опухоли) является увеличение ее размеров вследствие отека и венозного полнокровия. Этот признак имеет большое диагностическое значение в тех случаях, когда больная находится под систематическим врачебным наблюдением. Киста яичника обычно располагается кзади и несколько сбоку от матки (спереди от матки обычно находятся только дермоидные кисты). Матка и придатки обычно не изменены. Может наблюдаться билатеральная болезненность в области придатков матки при смещении шейки матки, а болезненность заднего свода влагалища отсутствует. Из–за напряжения и болезненности передней брюшной стенки достаточно часто приходится проводить исследование больной под наркозом.Диагноз не вызывает трудностей у больных, знавших о наличии у них опухоли яичника; в остальных случаях диагноз редко устанавливается до операции. Лабораторные и аппаратные методы исследования мало помогают. Однако часто клиническая картина перекрута ножки опухоли яичника настолько характерна, что диагноз ставится без особого труда. Резкие боли, болезненность живота при пальпации, нередко тяжелое общее состояние больных, явления шока свидетельствуют о картине абдоминальной катастрофы, что требует экстренной лапаротомии и удаления пораженных придатков матки.
Диагноз ставится на основании клинической картины и данных влагалищного исследования: обнаружения опухолевидного образования в малом тазу. В связи с малой информативностью ультразвуковое, рентгенологическое исследование и пункция заднего свода влагалища вряд ли целесообразны и затягивают время операции. В дифференциальной диагностике важную роль играют данные трансвагинальной эхографии, позволяющие определить в области придатков матки жидкостное образование округлой формы с четкими контурами и мелкодисперсной внутренней эхоструктурой вследствие кровоизлияния в полость опухоли.
Дифференциальный диагноз перекрута опухоли яичника нужно проводить с нарушенной трубной беременностью, воспалением придатков, апоплексией яичника, перекрутом гидросальпинкса или субсерозного миоматозного узла, аппендицитом, кишечной непроходимостью, почечной коликой.
При внематочной беременности имеется задержка менструации, появляются темные кровянистые выделения из половых путей, преобладают симптомы внутреннего кровотечения и коллапса, а не явления раздражения брюшины. Необходимо обращать внимание на характер болей и их локализицию. При разрыве трубы они обычно бывают острые и сильные, а при трубном аборте – схваткообразные. Боли почти всегда иррадиируют в область прямой кишки и наружных половых органов, реже – в плечо и ключицу (френикус–симптом). Температура тела при прервавшейся внематочной беременности чаще бывает нормальной или же несколько повышенной, артериальное давление при сильном кровотечении значительно снижается. При влагалищном исследовании в области придатков матки выявляется образование тестоватой консистенции, без четких границ, вытянутой формы, а не тугоэластическое, округлое, как при кисте яичника. Надавливание на задний свод влагалища вызывает резкую боль. Матка несколько увеличена и размягчена. При пункции заднего свода обычно удается получить темную кровь с небольшими сгустками. При дифференциальной диагностике этих двух заболеваний решающее значение имеют указания в анамнезе на кисту или опухоль яичника, отсутствие признаков беременности и кровянистых выделений из половых путей.
Трудно дифференцировать перекрут ножки опухоли яичника от синдрома гиперстимуляции яичников, тем более что при последнем перекрут ножки яичника также возможен.
Апоплексия яичника чаще всего наблюдается в середине менструального цикла (в момент овуляции) или же в начале периода развития желтого тела. Клиническая картина мало чем отличается от симптоматики внематочной беременности и протекает по типу внутреннего кровотечения.
Диагностика острой кишечной непроходимости и почечной колики обычно не вызывает больших затруднений. При острой кишечной непроходимости имеются схваткообразные боли в животе, рвота, метеоризм, задержка стула и газов. Клинический диагноз основывается на определении симптомов кишечной непроходимости – локальном усилении перистальтики, «шуме плеска» при аускультации, обнаружении чаш Клойбера при обзорной рентгенографии органов брюшной полости, а также визуализации неизмененных яичников и матки при УЗИ половых органов. При почечной колике боли обычно иррадиируют вниз, имеются дизурические расстройства и положительный симптом Пастернацкого, а отсутствие нарушения пассажа мочи согласно результатам хромоцистоскопии, расширения чашечно–лоханочного комплекса по данным УЗИ и теней конкрементов на рентгенограммах позволяют правильно поставить диагноз. Микрогематурия в 70% наблюдений сопутствует урологической патологии, в частности почечной колике. В то же время отсутствие примеси крови в моче не исключает почечную колику, поскольку моча может поступать в мочевой пузырь только из здоровой почки. К казуистическим относят наблюдения, когда за кисту принимают почку, дистопированную в таз, при наличии нарушений уродинамики (Н.М. Подзолкова, О.Л. Глазкова, 2005).
Перекрут гидросальпинкса происходит сравнительно редко, так как воспалительно измененная труба, содержащая экссудат, обычно бывает спаяна с близлежащими органами. Симптомы перекрута гидросальпинкса почти аналогичны таковым при перекручивании ножки опухоли яичника. В этих случаях большое диагностическое значение имеют анамнестические указания на перенесенный хронический воспалительный процесс придатков матки с накоплением жидкости в маточной трубе. Пиосальпинкс и пиоварий обычно имеют неправильную ретортообразную форму, неровную поверхность, плотную консистенцию. Однако эти признаки могут быть весьма вариабельны, в связи с чем постановка окончательного диагноза возможна иногда только во время операции. Киста яичника обычно пальпируется в виде округлого образования с гладкой поверхностью тугоэластической консистенции.
Субсерозный узел миомы отличается от кисты яичника более плотной консистенцией.
При остром аппендиците боли обычно начинаются в эпигастральной области или в области пупка и лишь затем локализуются в правой подвздошной области; аппендикулярные симптомы (Ровзинга, Ситковского и др. ) положительные, при влагалищном исследовании патологических изменений со стороны матки и придатков не находят. При дифференциальной диагностике с острым аппендицитом особые трудности возникают при тазовом расположении червеобразного отростка. Здесь большое значение приобретают данные, полученные при гинекологическом исследовании. Одностороннее образование, расположенное в области придатков матки, боли в надлобковой области характерны для перекрута ножки овариального образования.
Особые трудности возникают при диагностике перекрута ножки кисты при беременности.
Лечение
Лечение заключается в экстренной операции. Введение наркотиков перед транспортировкой больной противопоказано. Транспортировка должна быть щадящей. Вследствие неясности характера опухоли и невозможности исключения ее злокачественности брюшная полость вскрывается срединным разрезом.При доброкачественных опухолях объем операции зависит от строения опухоли, состояния второго яичника и матки.
При экстренной операции и отсутствии уверенности в характере опухоли вопрос об объеме операции решается в зависимости от возраста и состояния матки и второго яичника. У женщин до 40 лет при односторонней опухоли и нормальной шейке производят одностороннее удаление придатков и резекцию второго яичника с целью исключения опухолевого роста. После 40 лет удаляются придатки с обеих сторон.
Во время операции на перекрученную ножку опухоли, не раскручивая ее во избежание эмболии из затромбированных сосудов, накладывают зажимы, между ними ножку перерезают. Перитонизацию культи проводят листками широкой связки или круглой связкой. Однако с такой тактикой оперативного вмешательства согласны не все гинекологи. Следует отметить, что ранее широко распространенный запрет раскручивать ножку образования при перекруте постепенно ослабевает. Вместо того чтобы удалять придатки, большинство зарубежных гинекологов во время лапароскопии «раскручивают» образование и наблюдают за восстановлением кровообращения. При неполном перекруте ножки опухоли яичника или отсутствии выраженных изменений (массивных кровоизлияний, некроза) у пациенток репродуктивного возраста возможно восстановление анатомии внутренних половых органов и проведение органосохраняющей операции – резекции яичника в пределах здоровых тканей (И.Б. Манухин, 2007). Сразу же после удаления опухоли ее необходимо вскрыть. Гладкая внутренняя поверхность свидетельствует о доброкачественном характере образования. При различных уплотнениях, хрупких сосочках, мозговидном содержимом показано срочное гистологическое исследование препарата для решения вопроса об объеме оперативного вмешательства.
В осложненных случаях проводят такие же мероприятия, как и при перитоните. Неблагоприятное течение послеоперационного периода после экстренного вмешательства по поводу опухоли яичника отмечается несколько чаще, чем после плановых оперативных вмешательств из–за наличия воспалительных и дегенеративных изменений, а также невозможности хорошей подготовки больной к операции в экстремальных условиях.
Неотложные состояния при миоме матки.
Миома матки является одним из наиболее распространенных заболеваний женских половых органов в позднем репродуктивном периоде и в пременопаузе. Осложненное течение миомы матки часто служит показанием к хирургическому лечению, а в ряде случаев требует оказания неотложной помощи. Миома матки может являться причиной острой тазовой боли, обусловленной рождающимся подслизистым миоматозным узлом, некрозом миоматозного узла или перекрутом ножки подбрюшинного узла миомы на тонком основании.Нарушение кровоснабжения в миоматозных узлах чаще обусловлено механическими факторами (сдавление, перегиб, перекрут). Наиболее частым осложнением миомы матки является некроз опухоли, который сопровождается клинической картиной острого воспалительного процесса вплоть до развития картины острого живота. Дегенеративные изменения в узлах миомы могут возникать в результате нарушения системы сложных биохимических процессов в сосудах, питающих опухоль, а также перекрута ножки подбрюшинных миоматозных узлов. При беременности у больных с миомой матки вследствие особенностей гемодинамики (снижение кровотока в матке, повышение сосудистого тонуса, затруднение венозного оттока) также могут возникнуть нарушения в кровообращении узлов. Наиболее часто нарушение питания в узле миомы и особенно некроз узлов возникают на фоне беременности, в послеродовом периоде и на фоне продолжительной терапии аналогами гонадолиберина, а также после эмболизации маточных артерий. При нарушении кровообращения узла миомы матки возникает некроз. Частота некроза фиброматозных узлов составляет около 7%. В литературе описаны различные дистрофические процессы в миоматозных узлах (отек, очаги некроза, кровоизлияния, гиалиновое перерождение, дегенерация). Различают сухой, влажный и красный некроз миомы матки.
При сухом некрозе происходит постепенное сморщивание участков некротизированной ткани, при этом образуются пещеристые полости с остатками омертвевшей ткани. При влажном некрозе размягчаются ткани опухоли и в ней образуются кистевидные полости. Красный некроз миоматозных узлов возникает в основном при беременности и в послеродовом периоде с интрамуральном расположением узлов (А.В. Прахов и соавт., 2005). Узлы опухоли имеют красный или коричневокрасный цвет, мягкую консистенцию. Некроз миоматозных узлов осложняется инфицированием, что может привести к развитию перитонита. Инфекция в основном проникает в узел гематогенным или лимфогенным путем.
Клиническая картина
Нарушение питания миоматозного узла зависит от степени выраженности расстройства в нем кровообращения и характеризуется болями в низу живота, интоксикацией и перитонеальными явлениями.Если боли в животе возникают вследствие перекрута миоматозного узла на ножке, то клинические проявления такие же, как и при перекруте придатков. В связи с этим нелегко дифференцировать эти заболевания на основании только данных анамнеза и объективного исследования. При перекруте ножки, питающей узел, в нем происходит отек, кровоизлияние и некроз. Такие же изменения могут развиваться не только при перекруте ножки миоматозного узла, но и вследствие нарушения питания межмышечного или субсерозного узла миомы на широком основании. Это обусловлено нарушением кровообращения в опухоли. Вследствие некроза происходит расплавление ткани, иногда в узле образуются полости, заполненные серозным содержимым. Патологические изменения в миоматозных узлах приводят к возникновению типичной картины острого живота. Основным симптомом является острая тазовая боль, которая при некрозе узла миомы развивается постепенно, а при перекруте ножки опухоли появляется внезапно. Боль чаще локализуется в лобковой области, но может отмечаться и в паховой области, в зависимости от расположения пораженного миоматозного узла на тонком основании. Возможны тошнота и однократная рвота. Отмечается повышение температуры тела, высокий лейкоцитоз. При пальпации обнаруживают болезненность и напряжение мышц передней брюшной стенки в нижних отделах живота, положительные симптомы раздражения брюшины, ослабление перистальтики кишечника.
Диагностика
Диагностика некроза миоматозного узла не представляет особых трудностей. При бимануальном исследовании определяют увеличение матки за счет узлов миомы, один из которых размягчен и резко болезнен при пальпации. Для уточнения диагноза можно использовать трансвагинальную эхографию, при которой внутри опухоли можно обнаружить признаки отека узла, образование в нем полостей, содержащих жидкость, эхопозитивные и эхонегативные участки, представляющие собой зоны некроза. Наличие некротических изменений узла может привести к его нагноению и прорыву гнойного содержимого в брюшную полость с развитием разлитого перитонита. В случае перекрута ножки миоматозного узла при влагалищном исследовании определяется плотная резко болезненная опухоль, пальпируемая отдельно от матки. При определении отдельно от матки округлого образования с четкими контурами, по эхоструктуре напоминающего миометрий, и одновременной визуализации неизмененных яичников следует думать о подбрюшинном узле миомы, в то время как выявление жидкостного образования в области придатков указывает на опухоль яичника. Не всегда на основании бимануального и ультразвукового исследования удается установить правильный диагноз, в затруднительных случаях с диагностической целью может быть использована лапароскопия.Лечение
Больных с подозрением на некроз узла миомы матки необходимо срочно госпитализировать в гинекологический стационар для обследования и оперативного лечения. Обычно вначале прибегают к консервативному лечению: спазмолитики, антибактериальная и инфузионная терапия. Если боли, несмотря на лечение, продолжают нарастать, повышается температура тела, возникают изменения со стороны крови, то показано оперативное вмешательство. При перекруте ножки подбрюшинного узла на тонком основании целесообразны лапароскопия, коагуляция, пересечение ножки и удаление узла из брюшной полости. В случае некроза и нагноения межмышечного узла миомы показана экстренная лапаротомия и экстирпация матки с маточными трубами.У молодых бездетных женщин может выполняться консервативное миомэктомия на фоне адекватной антибактериальной терапии в послеоперационном периоде.
При нарушении кровоснабжения миоматозных узлов при беременности вначале проводится консервативное лечение с применением противовоспалительных средств. Прогрессирование дегенеративных изменений и отсутствие эффекта от проводимой терапии являются основанием для оперативного вмешательства, которое заключается в энуклеации субсерозных и небольших интерстициальных узлов с последующим сохранением беременности. Некроз узла с перитонитом или подозрением на злокачественное перерождение является поводом для расширения объема оперативного вмешательства до экстирпации или ампутации матки с плодом (Вл.И. Дуда, В.И. Дуда, И.В. Дуда, 2002).
Рождающийся субмукозныйузел.
Подслизистая миома нередко встречается у женщин старше 40 лет с частыми абортами в анамнезе и после ручного обследования послеродовой матки как следствие нарушения рецепторов эндометрия.Клиническая картина
Характеризуется маточными кровотечениями, резкими, схваткообразными болями в лобковой области, на фоне которых может происходить «рождение» узла за пределы матки. На начальном этапе общее состояние больных страдает мало. Отмечаются умеренная тахикардия как реакция на болевое раздражение, болезненность при пальпации живота над лоном. Симптом мышечной защиты и перитонеальные симптомы отсутствуют. Температура тела нормальная. Лейкоцитоз нехарактерен. При продолжительном и обильном маточном кровотечении могут возникнуть признаки анемии, геморрагического шока, проявляющиеся обморочными состояниями, бледностью кожных покровов, цианозом губ, тахикардией, снижением артериального давления. Однако такие состояния возникают довольно редко, поскольку выраженный болевой синдром и обильное кровотечение заставляют женщину быстро обращаться за медицинской помощью. Боли появляются вследствие раздражения опухолью рецепторов области перешейка и сокращения миометрия. Узел может выходить во влагалище или оставаться в матке в зависимости от локализации и длины ножки.Диагностика
Постановка диагноза не представляет трудности и основывается на данных характерного клинического проявления заболевания и гинекологического исследования, при котором определяются сглаженная шейка матки, раскрытие цервикального канала и наличие в нем, а в ряде случаев и во влагалище округлого образования с четкими контурами бледно–розового цвета, плотного при пальпации; в последующем может происходить его инфицирование и некроз в результате нарушения кровообращения. Цвет узла при некрозе становится серовато–черным, ткань опухоли хрупкая, легко разрывается. При этом повышается температура, увеличивается лейкоцитоз и СОЭ. Пальцем, введенным в шейку или полость матки, удается обойти узел и определить положение его ножки. Матка, как правило, увеличена в размерах, болезненна при исследовании. Отсутствие задержки менструации и признаков беременности, а также данные гинекологического исследования позволяют исключить неполный самопроизвольный выкидыш. В затруднительных случаях помогает УЗИ.Лечение
Лечение заключается в срочном оперативном вмешательстве. С этой целью щипцами Мюзо захватывают верхушку узла, ножницами подсекают основание узла и путем вращения удаляют его либо ножку узла пересекают с помощью ножниц под контролем пальца, введенного в полость матки. Затем осуществляют гистероскопический контроль и выскабливание слизистой оболочки тела матки. При возникновении массивного кровотечения производится лапаратомия – экстирпация матки.Глава 13. Оперативная гинекология
Особенности предоперационной подготовки при гинекологических операциях
Подготовка больной к плановой операции занимает обычно несколько дней. Это время используется для уточнения диагноза, показаний к операции, исключения противопоказаний и непосредственной подготовки больной.Пища больной в дни подготовки к операции должна быть питательной, богатой витаминами, но не обильной. Необходимо строго следить за работой кишечника. При запорах назначают слабительные препараты и очистительные клизмы. Очень полезна лечебная гимнастика по назначению врача. Накануне операции в обед исключают второе блюдо, вечером отменяют ужин. Женщина принимает теплый душ, в 21 ч ей делают очистительную клизму и на ночь назначают снотворное. В день операции утром (в 7 ч) снова ставят очистительную клизму.
Непосредственно перед операцией моча выводится катетером. При влагалищных операциях перед поступлением в стационар женщине выбривают волосы на наружных половых органах.
Особенное внимание при данном виде оперативного вмешательства уделяют степени чистоты влагалища, так как при наличии патологических выделений возможны осложнения воспалительного характера. Противопоказанием к влагалищным операциям является III –IV степень чистоты.
Непосредственно перед самой операцией наружные половые органы обрабатывают тупфером, смоченным спиртом, причем в положении больной по Тренделенбургу. Область наружных половых органов и верхнюю часть внутренней поверхности бедер смазывают 5% раствора йода. На ноги больной надевают стерильные бахилы.
Не следует назначать больную на плановую операцию перед менструацией или во время нее: в этот период снижаются защитные свойства организма и понижается свертываемость крови, что может усилить кровотечение во время операции.
Особенности предоперационной подготовки при плановых гинекологических операциях у женщин с экстрагенитальной патологией и аллергическими состояниями. Для проведения предоперационной подготовки плановых гинекологических больных с экстрагенитальной патологией требуется определенное время. В амбулаторных условиях она может быть проведена без торопливости, с учетом психологической настроенности больной.
Экстрагенитальные заболевания являются сопутствующей патологией у 30–60% гинекологических больных. Первое место среди экстрагенитальной патологии занимают заболевания сердечно–сосудистой системы. Определенный «вклад» вносят и болезни крови, туберкулез, патология печени и желчевыводящих путей, сахарный диабет, аллергические состояния.
Независимо от характера заболевания каждой гинекологической больной в процессе подготовки к операции проводятся: общий анализ крови и мочи, анализ крови на реакцию Вассермана; определение группы и резус–принадлежности крови; биохимический анализ крови и коагулограмма; рентгенография грудной клетки, электрокардиограмма; бактериологическое исследование мазков из зева и влагалища на флору и чувствительность к антибиотикам; цитологическое исследование мазков из цервикального канала; консультация терапевта. При сопутствующих экстрагенитальных хронических и острых заболеваниях рекомендуется проведение соответствующего лечения до полного выздоровления или снижения до минимума степени риска во время и после операции.
Дополнительные методы обследования больных до операции зависят от характера заболевания и проводятся преимущественно в специализированном стационаре.
Хирург, акушер–гинеколог, анестезиолог, терапевт должны совместно определить с учетом тяжести состояния больной предполагаемый объем хирургического вмешательства, возможную кровопотерю, степень риска самой операции, наиболее щадящий метод операции, вид обезболивания и принцип послеоперационного ведения больной. У женщин с сопутствующей экстрагенитальной патологией риск самого оперативного вмешательства и связанные с ним возможные осложнения должны быть сведены к минимуму.
Ведение послеоперационного периода
По окончании полостной брюшно–стеночной операции на рану накладывают повязку, которую приклеивают клеолом. Больную после операции помещают в палату интенсивной терапии, где укладывают в приготовленную постель. В первые часы после операции больная нуждается в индивидуальном уходе. Особенно бдительным должно быть наблюдение за состоянием больной до полного ее пробуждения, если она была оперирована под общим наркозом. Для предупреждения рвоты больной следует сразу после операции ввести 1–2 мл 1% раствора промедола или другое болеутоляющее и снотворное средство в соответствующей дозе, повернуть голову набок, чтобы уменьшить опасность аспирации рвотных масс. На случай западения языка или появления рвоты необходимы роторасширитель, языкодержатель, тазик, полотенце, которые должны быть в послеоперационной палате.После спинномозговой, эпидуральной анестезии пить кипяченую воду малыми порциями можно разрешать уже в первые часы после операции.
В первые двое суток после полостной операции принимать пищу не следует. Начать прием пищи можно после отхождения газов, однако не следует допускать ее обильного потребления и обильного питья. До нормализации деятельности пищеварительного аппарата употребленная пища, особенно в больших количествах, а также жидкость не усваиваются и обусловливают вследствие развития гнилостных процессов обильное образование газов и токсинов, что в свою очередь приводит к развитию пареза кишечника. При этом перистальтика кишок отсутствует, газы не отходят, живот непомерно увеличивается, диафрагма оттесняет легкие и сердце кверху и тем самым затрудняет их деятельность, развивается обезвоживание организма вследствие перемещения жидкости из тканей в просвет кишок. Предупредить возникновение этих явлений значительно легче, чем с ними бороться.
Для ускорения нормализации функции кишечника необходимо освободить его от токсического содержимого, чего можно достичь с помощью очистительных или гипертонических клизм, введения раствора прозерина и гипертонического раствора натрия хлорида.
После отхождения газов больной можно дать бульон, чай, немного кефира; на следующий день добавить 50–100 г сухарей, до 20 г сливочного масла, рисовую и манную кашу, яйцо всмятку. С 4–го дня рекомендуется пища, богатая белками и достаточной энергетической ценности: отварное мясо, яйца, творог.
После нормализации функции кишечника, что при неосложненном течении послеоперационного периода происходит к концу 2–х, на 3–и и 4–е сутки, больную следует постепенно перевести на общий стол, если к этому нет специальных противопоказаний.
В ранний послеоперационный период, в связи с тем что питание больных крайне недостаточно, а потеря жидкости организма повышена, следует, особенно после больших и травматических операций, регулярно ежедневно внутривенно вводить плазмозаменители по показаниям – кровь или ее компоненты, а также кристаллоидные растворы (растворы глюкозы, Рингера – Локка, изотонический раствор натрия хлорида и т.д.).
В ранний послеоперационный период больные нуждаются в адекватном обезболивании, что достигается введением болеутоляющих и седативных средств (промедол, седуксен, анальгин и др. ).
Если у больной до операции или во время нее была большая кровопотеря, то следует ее восполнить введением одногруппной крови или эритроцитарной массы. Наблюдать за состоянием больных в послеоперационный период нужно очень внимательно, обязательно периодически измерять артериальное давление, исследовать пульс, состояние органов дыхания, выслушивать сердечные тоны.
Необходимо в течение всего послеоперационного периода содержать в чистоте тело и полость рта больной, что легко достигается обыкновенными общедоступными мерами (обтирание, обливание, туалет половых органов, чистка зубов и полоскание рта).
Активное положение больной в постели предупреждает развитие послеоперационных осложнений. Уже в первые часы после операции больной следует поворачиваться; если же она не может этого делать сама, надо осторожно, не причиняя боли, помочь ей.
С 1–го дня рационально делать дыхательные упражнения, на 2–й день уже с утра садиться, а к концу 2–х суток – вставать и начинать ходить, сначала около кровати. В последующие дни количество упражнений и длительность их выполнения должны определяться строго индивидуально. Активное поведение больной улучшает кровообращение, дыхание, повышает обмен веществ, а также предупреждает развитие застойных явлений в легких, повышает аппетит. Противопоказано раннее вставание при тромбофлебите, тяжелых сердечно–сосудистых заболеваниях, при наличии тампонов в брюшной полости. Не следует забывать о лечебной физкультуре, которая благотворно влияет на состояние больных после операции.
Швы следует снимать на 7–8–е сутки, а у некоторых больных с осложненным течением послеоперационного периода сроки устанавливаются индивидуально.
Вопрос о выпискеиз стационара решается с учетом общего состояния больных, объема и характера перенесенной операции.
Следует особо остановиться на ведении больных с влагалищными операциями в послеоперационном периоде. Швы на промежности после данного вида операции лучше оставлять открытыми, так как повязка плохо удерживается, легко смачивается мочой и влагалищными выделениями. Желательно, чтобы мочеиспускание с 1–го дня после операции было самостоятельным, но наружные половые органы после этого должны быть тщательно обмыты стерильным антисептическим раствором, осушены и смазаны 50% раствором спирта этилового или спиртовым раствором бриллиантового зеленого. Если больная не может мочиться самостоятельно, что наблюдается у некоторых больных в первые дни после влагалищных операций, особенно связанных со смещением мочевого пузыря кверху, мочу выпускают катетером 2–3 раза в сутки со строжайшим соблюдением правил асептики.
Утром на следующий день после операции необходимо извлечь тампон из влагалища. Для успешного заживления операционных ран желательно, чтобы опорожнения кишечника не было в течение 5–6 суток со дня операции. Противопоказано применение газоотводных трубок и очистительных клизм. Если по истечении этого срока опорожнение кишечника затруднено, больной назначают 15–30 г касторового масла внутрь или с помощью катетера в прямую кишку вводят 50 г любого растительного или вазелинового масла.
В течение 7–9 суток после влагалищной операции больная должна находиться в горизонтальном положении, однако ей следует поворачиваться на бок сразу же, как только ее доставят в палату, желательно лежать на животе (по 5–10 мин. ). Это облегчает выделение из влагалища раневого отделяемого. На 5–8–й день больной разрешают вставать. Так как при первом вставании с постели может возникнуть головокружение и потеря равновесия, необходимо, чтобы при этом присутствовал медицинский работник. Затем еще в течение 2–3 недель больной не рекомендуется приседать на корточки, натуживаться, поднимать тяжести.
Если на края раны промежности наложены шелковые швы, их снимают на 5–7–е сутки, однако чаще накладывают кетгутовые швы, не подлежащие снятию.
Оперативные вмешательства с влагалищным доступом
Клиновидная ампутация шейки матки. Данный вид операции применяется для удаления удлиненной шейки матки или устранения разрыва ее наружного зева. Перед операцией необходимо устранить воспаление (добиться I–II степени чистоты влагалища). Для обезболивания используют обычно 0,5% раствор новокаина, который вводят парацервикально в целях блокады нервных проводников, идущих от шейки матки. После соответствующей дезинфицирующей обработки шейку матки обнажают с помощью зеркал, фиксируют пулевыми щипцами за переднюю и заднюю губы. На каждой губе клиновидно иссекают патологически измененную ткань, вследствие чего на передней и задней губах образуется как бы два лоскута. Их сшивают отдельными кетгутовыми лигатурами, формируя новую шейку. Операция заканчивается подведением к образованной шейке марлевого тампона (на сутки), который впитывает отделяемое, способствует очищению раны.Конусовидная ампутация шейки матки.
Применяется в случаях патологических изменений на шейке и влагалищной ее части, в канале шейки матки. Операция описана Штурмдорфом.Обе губы шейки матки ближе к каналу берут на пулевые щипцы; скальпелем проводят на границе слизистой оболочки влагалищной части шейки матки и канала круговой разрез. Затем, потягивая фиксирующие щипцы на себя, конусовидно иссекают патологически измененную часть шейки матки вместе со слизистой оболочкой канала. Ушивание раневой поверхности осуществляется следующим образом: кетгутовую лигатуру, отступив на 0,5 см от края разреза, проводят по направлению к каналу шейки матки, другой конец этой же нитки, отступив от первого укола на 1,5 см, выводят также по направлению к нему; оба конца кетгутовой нити выкалывают через канал и затягивают шов.
Раневая поверхность закрывается и формируются передняя и задняя губы шейки матки. На сутки к шейке матки подводится марлевый тампон.
Манчестерская операция.
Применяется при опущении и выпадении матки небольшой степени. После операции женщины могут беременеть. Однако при манчестерской операции прибегают к ампутации шейки матки (при ее гипертрофии, элонгации, разрывах и при наличии эрозий), что нарушает последующую беременность или исключает ее возможность, поэтому не рекомендуется применять эту операцию в детородном возрасте.На передней стенке влагалища отсепаровывают овальной формы лоскут, затем отделяют мочевой пузырь от шейки матки кверху, выделяют кардинальные связки матки. Нижние отрезки кардинальных связок берут на зажимы, пересекают и в случае необходимости укорачивают. Выполняют клиновидную либо конусовидную ампутацию шейки матки. Натянутые культи кардинальных связок пришивают к передней стенке матки в области внутреннего зева. Зашивают влагалищно–пузырную фасцию, разрез стенки влагалища, формируют культю шейки матки. Выполняют обычную кольпоперинеоррафию.
Укороченные кардинальные связки удерживают матку в более высоком положении, чем до операции.
Операции при опущении и выпадении половых органов.
Передняя кольпоррафия применяется при начальных формах опущения стенок влагалища и матки (1–я степень), когда клинически выражено лишь опущение передней стенки влагалища. Одновременно проводится укрепление мышечнофасциального слоя мочевого пузыря.На передней стенке влагалища иссекают овальной формы лоскут, отсепаровывают стенки влагалища от мочевого пузыря на 1–2 см от краев раны в стороны, затем отделяют мочевой пузырь от шейки матки кверху и погружают его несколькими кисетными или поперечными швами. После этого соединяют края влагалищной раны, а у переднего свода 2–3 швами захватывают также ткани шейки, что укрепляет приподнятое положение мочевого пузыря.
Кольпоперинеопластика применяется при 1–й и 2–й степенях опущения стенок влагалища и матки без удлинения, гипертрофии шейки матки, причем преобладает опущение задней стенки влагалища.
Техническая сторона данной операции заключается в отсепаровывании на задней стенке влагалища лоскута треугольной формы. Во многих случаях это удобнее и безопаснее делать снизу, постепенно продвигаясь кверху. После этого приступают к леваторопластике, которую можно выполнить как без выделения, так и с выделением мышц, поднимающих задний проход, из фасции. Хотя последнее выполнить труднее, зато при хорошо сохранившихся мышцах такая операция имеет значительные преимущества перед сшиванием мышц, поднимающих задний проход вместе с покрывающими их фасциями.
Затем приступают к соединению краев влагалищной раны, после чего сшивают края раны промежности, на кожу накладывают шелковые швы.
Вентросуспензия направлена на прикрепление матки к передней брюшной стенке.
Способ вентросуспензии (Долери – Джиллиама) заключается в подвешивании матки за круглые связки к передней брюшной стенке, фиксации круглых связок к апоневрозу после их проведения через тоннели, образованные в прямых мышцах живота и апоневрозе. Существуют различные модификации этого способа. Так, способ Кинарского заключается в предварительном пришивании круглых связок к передней стенке матки, затем ход операции аналогичен таковому при способе Долери – Джиллиама. По Бардеску выведенные петли круглых связок над апоневрозом сшивают между собой, а по Бальди–Вебстеру круглые связки укорачивают путем проведения их через отверстия в широких связках на заднюю стенку матки, где связки сшивают между собой и прикрепляют к матке.
После операций, основанных на вентросуспензии матки, постепенно удлиняются круглые связки и нередко возникают рецидивы.
С учетом недостатков операции вентросуспензии в последние десятилетия разработаны способы фиксации матки с использованием аллопластических материалов.
Способ заключается в следующем: проводят серединную нижнюю лапаротомию; переднюю брюшную стенку крючками приподнимают кверху и резко отводят в левую сторону. Через соединительнотканное мышечное образование (латеральная часть пупартовой связки) между верхней и нижней передними остями подвздошных костей с помощью изогнутой иглы сквозь толщу тканей, в том числе и брюшину, проводят толстую лавсановую нить. Последнюю завязывают не очень туго, чтобы не вызвать резкого сдавления тканей и не нарушить васкуляризацию. От места завязывания нити иглу проводят под брюшиной до круглой связки. Круглую связку нанизывают в нижних ее отделах на иглу, которую выводят у места прикрепления круглой связки к матке слева. Дальше нить продвигают через толщу передней стенки матки. Правую круглую связку нанизывают в нижних отделах в обратном порядке. Нить подтягивают до создания необходимого натяжения и крепят ее к соединительнотканному мышечному образованию справа. Место завязывания нитей перитонизируют кетгутом.
В результате операции матка находится в физиологическом положении между мочевым пузырем и прямой кишкой, следовательно, функция последних не нарушается. В отличие от других методов нить крепится к неподвижным образованиям, поэтому при движении у женщины не возникает боль.
Эту же операцию успешно можно применять в целях фиксации культи шейки матки или влагалища. Нить проводят соответственно через крестцово–маточные связки или через задние отделы соединительной ткани влагалища.
Влагалищная экстирпация матки.
Существует немало способов этой операции, отличающихся друг от друга некоторыми особенностями (способы Елкина, Мейо, Александрова, Персианинова и др.).Нередко наблюдаются такие поражения матки, при которых более целесообразно выполнять трансвагинальную гистерэктомию, что позволяет одновременно производить пластические операции на стенках влагалища и ликвидировать их опущение. К таким заболеваниям относятся: миома матки, рецидивирующая железистая гиперплазия, рецидивирующая эрозия шейки матки, эрозированный эктропион, эндоцервицит, выраженная гипертрофия шейки матки, рецидивирующий по–липоз шейки и тела матки, рецидив выпадения и опущения матки и стенок влагалища. Данный вид операции оправдан также у женщин с ожирением. При влагалищной экстирпации матки послеоперационный период протекает легче, чем при абдоминальной лапаротомии. Отдаленные результаты после операции вполне хорошие.
Способ операции заключается в следующем. На передней стенке влагалища отсепаровывают овальной формы лоскут, а в области сводов с боков и сзади производят циркулярный разрез слизистой оболочки. Отсепаровывают мочевой пузырь кверху, а с боков и сзади – слизистую оболочку влагалища. Пересекают кардинальные связки, производят переднюю и заднюю кольпотомию. Матку выводят чаще через переднее отверстие. Пересекают сосудистые пучки и крестцово–маточные связки, а затем вышележащий параметрий с круглыми связками, трубами и собственными связками яичника. Матку удаляют и производят высокую перитонизацию кисетным швом, культи связок выводят наружу. Мочевой пузырь погружают несколькими кисетными швами. Попарно сшивают культи придатков, а затем кардинальные связки, которые нередко нужно укорачивать. Проводят переднюю кольпоррафию, слизистую оболочку влагалища подшивают к культе, применяют бестампонное и тампонное дренирование культи. Затем производят кольпоперинеопластику.
Весьма важным условием правильного выполнения этой операции при выпадении матки является точное создание тазового дна, фиксация тем или иным способом культи влагалища.
Операции на придатках матки
Операции на маточных трубах.
Сальпингоэктомия (удаление маточной трубы) производится по поводу трубной беременности, реже – при наличии изолированного пио– и гидросальпинкса.После послойного вскрытия брюшной полости, отграничения операционного поля от сальника и петель кишечника введенной в малый таз рукой отыскивают измененную трубу. Ее по возможности выводят в разрез. Если это не удается, матка фиксируется пулевыми щипцами или прошивается в области дна крепкой лигатурой и выводится в разрез. На брыжейку трубы последовательно накладываются зажимы от ампулярного конца к углу матки. При этом зажимы должны ложиться параллельно ходу трубы. Трубу отсекают над зажимами, участки брыжейки под зажимами прошивают кетгутом или синтетическими нитями (дексон, ПГА и др.) и перевязывают (рис. 13.1).
Иссечение трубного угла матки, применявшееся ранее, в настоящее время не производят. Это обусловлено тем, что риск развития беременности в интрамуральном участке удаленной маточной трубы значительно меньше риска разрыва матки по рубцу при наступлении маточной беременности.
Убедившись в надежности гемостаза, производят перитонизацию культи брыжейки. Перитонизация может быть осуществлена за счет круглой связки, которую подшивают к задней поверхности матки (рис. 13.2).
 Рис. 13.1. Удаление маточной трубы. Отсечение трубы после наложения зажимов на лизосальпинкс
Рис. 13.1. Удаление маточной трубы. Отсечение трубы после наложения зажимов на лизосальпинкс
Затем производят ревизию органов брюшной полости и малого таза, туалет брюшной полости и рану на передней брюшной стенке ушивают послойно наглухо.
Пластические операции на маточных трубах.
Проводятся с целью лечения трубного бесплодия. При этом должно быть точно установлено место непроходимости.Существует несколько разновидностей оперативного вмешательства: ■ сальпинголизис – разделение перитубарных спаек и придание трубе нормальной подвижности ■ сальпингостомия – создание нового отверстия при непроходимости трубы в ампулярном отделе ■ сальпинго–сальпингоанастомоз – удаление непроходимой части трубы и соединение между собой проходимых участков ■ имплантация здоровой части трубы в матку после резекции облитерированного участка.
 Рис. 13.2. Удаление маточной трубы. Перитонизация
Рис. 13.2. Удаление маточной трубы. Перитонизация
Сальпинголизис – освобождение трубы из сращений. Эта операция может быть как самостоятельной, так и вспомогательной при вмешательствах по поводу трубного бесплодия. В настоящее время она производится в основном лапароскопическим методом.
При сальпингостомии вскрывают брюшную полость. В рану подтягивают матку, высвобождают и расправляют трубу вместе с мезосальпинксом. Часть ампулярного конца трубы отсекают круговым разрезом (рис. 13.3).
Края трубы обшивают отдельными кетгутовыми швами. При этом слизистую оболочку слегка выворачивают наружу (рис. 13.4). Далее производится туалет брюшной полости и малого таза и ушивание передней брюшной стенки. Сальпинго–сальпингоанастомоз проводят в тех случаях, когда непроходимость сформировалась в истмическом отделе трубы при проходимости в ампулярном и интерстициальном отделах.
 Рис. 13.3. Сальпингостомия. Гидросальпинкс. Контуры разреза в апулярном конце трубы
Над непроходимым участком рассекают брюшину и затем удаляют часть непроходимой трубы.
Рис. 13.3. Сальпингостомия. Гидросальпинкс. Контуры разреза в апулярном конце трубы
Над непроходимым участком рассекают брюшину и затем удаляют часть непроходимой трубы.
Через ампулярный конец продвигают полиэтиленовый протектор и проводят его через рассечение части трубы (рис. 13.5).
 Рис. 13.4. Сальпингостомия. Конечный этап
Рис. 13.4. Сальпингостомия. Конечный этап
 Рис. 13.5. Сальпингосальпингоанастомоз. Проведение протектора в трубу
Рис. 13.5. Сальпингосальпингоанастомоз. Проведение протектора в трубу
 Рис. 13.6. Сальпингосальпингоанастомоз. Сшивание пересеченных концов трубы
Рис. 13.6. Сальпингосальпингоанастомоз. Сшивание пересеченных концов трубы
Тонкими кетгутовыми швами, используя атравматические иглы, сшивают между собой концы пересеченной трубы, прошивая мышечный и серозный слои (рис. 13.6).
Свободный конец протектора прикрепляют одним шелковым швом к трубе или матке, а остальную часть выводят на переднюю брюшную стенку. Протектор удаляется легким подергиванием. Имплантацию проходимого участка трубы в матку производят при непроходимости ее в интерстициальном отделе или в начальной части истмического отдела.
После вскрытия брюшной полости, выведения матки с придатками в рану и расправления трубы иссекают непроходимый участок. При этом периферический конец трубы просто пересекается, а центральный – иссекается из угла матки. В оставшийся участок трубы вводят полиэтиленовый протектор (рис. 13.7).

 Рис. 137. Имплантация проходимой трубы в матку: а – зонд–пинцет выведен через трубы, труба рассечена на две лопасти, через которые проведены кетгутовые лигатуры; б – проведение полиэтиленовой трубки через маточную трубу, в стенке матки сделано сквозное отверстие; в – проведение трубы в матку; г – труба введена в матку, схема положения протектора
Рис. 137. Имплантация проходимой трубы в матку: а – зонд–пинцет выведен через трубы, труба рассечена на две лопасти, через которые проведены кетгутовые лигатуры; б – проведение полиэтиленовой трубки через маточную трубу, в стенке матки сделано сквозное отверстие; в – проведение трубы в матку; г – труба введена в матку, схема положения протектора
Полиэтиленовый протектор выводят через цервикальный канал во влагалище. Протектор способствует сохранению проходимости в период формирования рубца. Операцию завершают обычным способом.
Хирургическая стерилизация – это преднамеренное создание непроходимости маточных труб для предупреждения наступления беременности.
Хирургическая стерилизация чаще всего проводится во время других операций (кесарево сечение).
В настоящее время широкое распространение получила лапароскопическая стерилизация.
Существует значительное количество методов хирургической стерилизации женщин, однако наилучшие результаты дает резекция маточной трубы на протяжении.
 Рис. 13.8. Этапы операции стерилизации: а – рассечение серозного покрова маточной трубы; б – выделение трубы; в – труба пересечена и культи ее перевязаны; г – погружение концов трубы между листками брыжейки маточной трубы; д – зашивание раны
Рис. 13.8. Этапы операции стерилизации: а – рассечение серозного покрова маточной трубы; б – выделение трубы; в – труба пересечена и культи ее перевязаны; г – погружение концов трубы между листками брыжейки маточной трубы; д – зашивание раны
 Рис. 13.9. Стерилизация по Мадленеру: а – пережатие трубы; б – наложение лигатуры
Рис. 13.9. Стерилизация по Мадленеру: а – пережатие трубы; б – наложение лигатуры
Для выполнения этой операции после выведение матки в операционную рану натягивают брюшину маточной трубы между зажимами и рассекают ее над маточной трубой на протяжении. Трубу освобождают от брюшины, производят ее резекцию между двумя наложенными капроновыми лигатурами.
После этого культи трубы погружаются между двумя листками мезосальпинкса, а листки его сшивают, производя стерилизацию (рис. 13.8).
Хирургические вмешательства на яичниках предпринимаются значительно чаще, чем на трубах. Объясняется это тем, что при различных заболеваниях женских половых органов изменения в яичниках встречаются значительно чаще, чем в других органах.
Одной из наиболее простых и в то же время достаточно надежной операцией является стерилизация по Madlener. Труба вместе с небольшим участком мезосальпинкса вытягивается с помощью зажима в форму петли, и основание петли раздавливается зажимом. В месте пережатия накладывается капроновая лигатура. Общая длина трубы, оказывающаяся в петле, не должна превышать 1,5 см (во избежание значительного некроза, рис. 13.9).
Операции на яичнике
Органосохраняющие операции (резекции) производят у молодых женщин по поводу развившихся в яичниках ретенционных образований (фолликулярная киста, киста желтого тела), а также поликистоза яичников, дермоидных кист и воспалительных изменений. Рис. 13.10. Резекция яичника: а – ножка яичника окружена марлевой петлей; б – иссечение измененной части яичника; в – ушивание резецированного яичника
Рис. 13.10. Резекция яичника: а – ножка яичника окружена марлевой петлей; б – иссечение измененной части яичника; в – ушивание резецированного яичника
Резекция яичника.
Подготовка больных к этой операции такая же, как и для любого чревосечения. Свободный от сращений яичник рекомендуется приподнять и обернуть его ножку (брыжейка яичника, собственная и подвешивающая связки) широкой марлевой петлей (рис. 13.10, а). Этот прием одновременно способствует уменьшению кровопотери, так как указанной петлей несколько сжимают питающие яичник сосуды. Устанавливают границу между здоровой тканью и измененной частью яичника. Острым скальпелем клиновидно иссекают патологическую ткань (рис. 13.10, б).Зашивание раны яичника необходимо производить только круглой иглой, что уменьшает его травматизацию и не приводит к прорезыванию швов. Во избежание прорезывания не следует также чрезмерно затягивать швы (рис. 13.10, в).
Швы следует накладывать таким образом, чтобы не подхватить лигатурой сосуды со стороны брыжейки.
Удаление яичника.
Производится, как правило, при наличии доброкачественных опухолей. Кисту или кистому яичника подводят к разрезу на передней брюшной стенке, так чтобы ее ножка была доступна для обозрения и наложения зажимов с обеих сторон (рис. 13.11, а).При значительном размере опухоли яичника помимо анатомической ножки, в которую входят собственная, подвешивающая связки и брыжейка яичника, образуется и так называемая хирургическая. В нее входит дополнительно маточная труба, на которую в этих случаях также накладывают зажим (рис. 13.11, б).
Яичник вместе с опухолью удаляют, и все перечисленные образования лигируются капроном или синтетическими саморассасывающимися нитями (рис. 13.11, в).
Перитонизацию осуществляют, сшивая круглую связку с задним листком широкой связки (рис. 13.11, г).
 Рис. 13.11. Овариэктомия: а – начальный этап: наложение зажимов на воронкотазовую и собственную связки яичника; б – наложение зажимов на анатомическую ножку опухоли; в – лигирование культи;г – перитонизация
Рис. 13.11. Овариэктомия: а – начальный этап: наложение зажимов на воронкотазовую и собственную связки яичника; б – наложение зажимов на анатомическую ножку опухоли; в – лигирование культи;г – перитонизация
Производят туалет брюшной полости. Брюшную стенку ушивают послойно наглухо. Опухоль или киста яичника, имеющая ножку, может изменять свое положение в брюшной полости. Иногда при этом происходит перекрут ножки с нарушением питания опухоли (рис. 13.12).
В случае значительного нарушения кровотока в сосудах ножки возникает клиническая картина острого живота, что требует экстренного хирургического лечения. При удалении таких образований раскручивать ножку не следует во избежание возможных осложнений в виде разрыва сосудов, измененных вследствие перекручивания тканей и остановки кровотечения. Кроме того, может произойти отрыв тромба, имеющегося в сосудах выше перекрута, с возникновением эмболии. Поэтому зажимы необходимо накладывать на всю толщу перекрученной ножки, ближе к матке (рис. 13.13).
 Рис. 13.12. Перекрут ножки кисты яичника
Рис. 13.12. Перекрут ножки кисты яичника
 Рис. 13.13. Наложение зажимов на перекрученную ножку опухоли
Рис. 13.13. Наложение зажимов на перекрученную ножку опухоли
Операции на матке
Хирургические вмешательства, предпринимаемые по поводу заболеваний матки, по частоте занимают одно из первых мест. Разнообразие причин, диктующих необходимость хирургического лечения, предусматривает выполнение различного объема вмешательств на матке. В одних случаях они ограничиваются удалением одиночных фиброматозных узлов либо дефундацией или надвлагалищной ампутацией матки, в других может потребоваться экстирпация матки без придатков или с придатками.Исходя из этого, все операции, проводимые на матке делятся: ■ на консервативные с отсечением субсерозного миоматозного узла на ножке; вылущиванием узлов, расположенных интерстициально, т.е. в толще стенки матки ■ полурадикальные (высокая ампутация, дефундация) ■ радикальные (надвлагалищная ампутация матки без придатков или с придатками, экстирпация матки без придатков или с придатками).
Отсечение субсерозного миоматозного узла на ножке.
После вскрытия передней брюшной стенки отсекается ножка опухоли от матки, затем накладываются кровоостанавливающие швы и производится перитонизация. Отсечение субсерозного узла от матки производится так, чтобы линия разреза проходила не у самого основания ножки опухоли, а на 1–1,5 см выше и имела круговое направление (рис. 13.14). Рис. 13.14. Направление разреза при удалении субсерозного узла миомы матки
Рис. 13.14. Направление разреза при удалении субсерозного узла миомы матки
Так поступают для того, чтобы не создавалось чрезмерного натяжения при последующей перитонизации и заживании ложа опухоли. После проведения кругового разреза узел захватывается пулевыми щипцами, приподнимается и выделяется тупым путем. После отсечения узла производится тщательный гемостаз, который осуществляется наложением погружных мышечно–мышечных швов. Перитонизация раны на матке осуществляется за счет серозного покрова, выделенного из ножки при выполнении первоначального разреза.
Удаление интрамурального узла.
Операция проводится в том случае, если есть единичный узел, расположенный в толще стенки. Суть операции заключается в следующем. Рассекаются ткани, расположенные над опухолью, – брюшина и истонченная мышечная ткань. Разрез производят по выпуклости узла в направлении, соответствующем ходу сосудов матки (рис. 13.15, а).Разрез проводят до капсулы узла, которую легко можно узнать по светлой окраске и плотной консистенции. Затем рассекают капсулу и интракапсулярно острым и тупым путем выделяют узел, при этом потягивая его кверху с помощью щипцов Мюзо (рис. 13.15, б).
Ложе опухоли тщательно ушивают многоэтажными кетгутовыми швами (рис. 13.15, в).
 Рис. 13.15. Удаление интрамурально расположенного узла миомы матки: а – рассечение капсулы узла; б – вылущивание узла; в – зашивание ложа узла; г – наложение последнего ряда швов
Последний (поверхностный) шов является мышечно–брюшинным, причем края брюшины должны хорошо прилегать друг к другу (рис. 13.15, г).
Рис. 13.15. Удаление интрамурально расположенного узла миомы матки: а – рассечение капсулы узла; б – вылущивание узла; в – зашивание ложа узла; г – наложение последнего ряда швов
Последний (поверхностный) шов является мышечно–брюшинным, причем края брюшины должны хорошо прилегать друг к другу (рис. 13.15, г).
Дефундация матки.
Эта операция представляет собой удаление дна матки. Операция проводится у молодых женщин, если миоматозные узлы расположены в дне матки. При этом удаляется патологический очаг (дно матки с расположенными в ней узлами) и сохраняется менструальная функция женщины, что достигается сохранением большей части тела матки с выстилающей ее слизистой оболочкой.После произведенной лапаротомии матка захватывается щипцами Мюзо и выводится в разрез. Затем на маточные трубы и собственные связки яичников с обеих сторон накладываются зажимы Кохера, придатки отсекаются от матки, зажимы заменяются лигатурами (рис. 13.16).
После отделения придатков производится перерезка и пересечение восходящей ветви маточной артерии ниже места предполагаемого отсечения дна матки. Дно матки удаляется с помощью разреза, направление которого должно быть параллельно дну. Затем рана на матке зашивается двухэтажным швом с последующей перитонизацией (рис. 13.17).
 Рис. 13.16. Отсечение дна матки
Рис. 13.16. Отсечение дна матки
Высокая надвлагалищная ампутация матки.
Операция производится при расположении узлов в области дна или верхней части тела матки. После этой операции сохраняется менструальная функция.Техника высокой надвлагалищной ампутации матки похожа на технику операции дефундации, однако имеются особенности: ■ производится отсечение от матки не только придатков, но и круглых маточных связок ■ перевязанные культи придатков и круглых маточных связок вместе с брюшной тупым путем низводятся для освобождения ветвей восходящей маточной артерии до уровня предполагаемого отсечения матки.
 Рис. 13.11. Перитонизация после удаления дна матки
Рис. 13.11. Перитонизация после удаления дна матки
На этом уровне пересекаются и перевязываются маточные сосуды. Отсекают дно и часть тела матки так, чтобы линия отсечения была направлена параллельно основному ходу сосудов в этой области.
 Рис. 13.18. Высокая надвлагалищная ампутация матки: а – отсечение части тела матки; б – завершение операции
Рис. 13.18. Высокая надвлагалищная ампутация матки: а – отсечение части тела матки; б – завершение операции
После удаления части матки (рис. 13.18, а) приступают к формированию оставшейся части – последовательно и послойно снижают мышечный и серозный слои без прошивания эндометрия. Затем к боковой поверхности сформированной небольшой матки подшивают ранее отсеченные придатки, одновременно используя круглые маточные связки для перитонизации (рис. 13.18, б).
Далее проводится туалет брюшной полости и ушивание передней брюшной стенки.
Надвлагалищная ампутация матки без придатков и с придатками.
Операция производится, как правило, у женщин в пре– и менопаузе. Иногда эту операцию проводят и у более молодых пациенток. Это бывает в тех случаях, когда опухоль имеет большие размеры, быстрый рост и т.д. Вопрос о придатках решается во время операции.По вскрытии брюшной полости вводятся расширяющие рану зеркала, органы полости отграничиваются салфетками. Щипцами Мюзо матка захватывается за дно и выводится за пределы раны (рис. 13.19).
После выведения матки на маточные трубы, на собственные связки яичников и круглые маточные связки с обеих сторон накладывают зажимы, отступив 2–3 см от матки, контрклеммы – на уровне матки (рис. 13.20, а).
Затем пересекаются связки и маточные трубы. Зажимы заменяются капроновыми лигатурами (рис. 13.20, б).
За лигатуры–держалки, наложенные на дистальные отделы пересеченных образований, придатки оттягивают в сторону и марлевым тупфером слегка разводят края раны, обнажая сосудистые пучки.
 Рис. 13.19. Выведение матки в рану
Рис. 13.19. Выведение матки в рану
За лигатуры круглые маточные связки оттягивают в стороны и между ними в поперечном направлении производится рассечение пузырно–маточной складки, которую предварительно захватывают пинцетом в месте наибольшей ее подвижности (рис. 13.20, в).
Таким образом пузырно–маточная складка брюшины вместе с частью отделенного пузыря низводится по направлению к шейке несколько ниже внутреннего зева шейки матки, берется на зажим и отводится надлобковым зеркалом (рис. 13.20, г). Следующий этап операции – клеммирование, пересечение и перевязка сосудистых пучков с обеих сторон. На сосуды накладывают клеммы на уровне внутреннего зева. После пересечения сосудистые пучки лигируются капроновыми нитями. Возможен вариант, когда сосудистые пучки клеммируются с обеих сторон и тело матки отсекается на уровне внутреннего зева, причем отсечение должно идти в виде «конуса» с вершиной, направленной к просвету шеечного канала (рис. 13.20, д, е).
После удаления препарата сосуды лигируют и зашивают культю шейки матки. Конусовидное отсечение тела матки дает возможность хорошо сопоставлять края оставшейся культи шейки матки отдельными узловыми швами. Внимательно осмотрев операционное поле и убедившись в надежности гемостаза, приступают к перитонизации образовавшихся раневых поверхностей.
Перитонизация осуществляется за счет брюшины пузырноматочной складки и листков широких связок непрерывным швом (рис. 13.20, ж, з).



 Рис. 13.20. Надвлагалищная аплутация матки: а – зажимы наложены на круглую и собственную связку и трубы, контрклеммы; б – придатки отсечены; в – пересечение пузырно–маточной складки брюшины; г – отделение мочевого пузыря; д – отсечение тела матки; е – направление разареза при отсечении матки и наложение швов на культю шейки матки; ж, з – перитонизация культи
Рис. 13.20. Надвлагалищная аплутация матки: а – зажимы наложены на круглую и собственную связку и трубы, контрклеммы; б – придатки отсечены; в – пересечение пузырно–маточной складки брюшины; г – отделение мочевого пузыря; д – отсечение тела матки; е – направление разареза при отсечении матки и наложение швов на культю шейки матки; ж, з – перитонизация культи
Надвлагалищная ампутация матки с придатками.
Техника операции существенно не отличается от предыдущей. Однако тактика в отношении придатков матки иная.Для удаления придатков необходимо наложить зажимы на воронкообразную (подвешивающую) связку яичника. Во избежание случайного захвата мочеточника, проходящего в основании этой связки, пинцетом приподнимают кверху трубу, а при ее натягивании воронкообразная связка яичника приподнимается, что дает возможность наложить зажимы ближе к придаткам и тем самым избежать повреждения мочеточника (рис. 13.21).
В дальнейшем ход операции осуществляется в том же порядке, что и при обычной надвлагалищной ампутации матки.
Экстирпация матки без придатков.
Первые этапы экстирпации матки в основном такие же, как при надвлагалищной ампутации. Они включают: вскрытие брюшной полости, выведение матки с придатками в рану, наложение зажимов на круглые, собственные связки яичников и маточные трубы с обеих сторон, затем их пересечение и лигирование. Далее вскрывают пузырно–маточную складку. Мочевой пузырь частично острым, частично тупым путем отслаивают книзу до уровня переднего свода влагалища. С этого момента экстирпация по технике выполнения существенно отличается от ампутации. Матку максимально приподнимают кпереди и производят разрез брюшины, покрывающей заднюю поверхность надвлагалищной части шейки над местом прикрепления крестцово–маточных связок. Брюшина тупо отслаивается пальцем или тупфером до границы влагалищной части шейки матки (рис. 13.22, а). Рис. 13.21. Наложение зажимов на подвешивающую связку яичника
Рис. 13.21. Наложение зажимов на подвешивающую связку яичника


 Рис. 13.22. Экстирпация матки без придатков: а – отделение брюшины от шейки матки сзади; б – пересечение крестцово–маточных связок; в – пересечение маточных сосудов; г – вскрытие переднего свода влагалища; д – отсечение матки от влагалища; е – перитонизация культи
Рис. 13.22. Экстирпация матки без придатков: а – отделение брюшины от шейки матки сзади; б – пересечение крестцово–маточных связок; в – пересечение маточных сосудов; г – вскрытие переднего свода влагалища; д – отсечение матки от влагалища; е – перитонизация культи
После отделения брюшины от шейки матки сзади накладываются зажимы на крестцово–маточные связки с обеих сторон. Последние пересекаются и лигируются (рис. 13.22, б).
Для перевязки маточных артерий отводят книзу брюшину по ребрам матки, доводя ее до уровня влагалищных сводов. Немного ниже внутреннего маточного зева, несколько отступив кнаружи, накладывают зажим на основной ствол маточной артерии и чуть выше – контрклемму, между которыми пересекают сосуды. Дистальный отдел сосудистого пучка вместе с прилегающей к нему клетчаткой отодвигают книзу и латерально, чтобы не мешать последующему удалению матки. Сосуды лигируют капроном (рис. 13.22, в).
После перевязки сосудов и освобождения матки от окружающих тканей передний свод влагалища захватывается зажимом, приподнимается кверху и вскрывается (рис. 13.22, г).
Через отверстие, проделанное в своде, во влагалище вводят тампон, смоченный йодом, а затем под визуальным контролем отсекают матку от влагалищных сводов, захватывая последние зажимами Кохера по мере их отсечения (рис. 13.22, д).
Культя влагалища лигируется, проверяется гемостаз. Затем производится перитонизация: на передний и задний листки брюшины накладывают непрерывный кетгутовый шов, кисетным швом с обеих сторон закрывают культи придатков.
Производят туалет брюшной полости и послойное ушивание передней брюшной стенки.
Экстирпация матки с придатками.
Техника экстирпация матки с придатками почти не отличается от вышеописанной. Для удаления придатков необходимо наложить зажимы на воронкотазовую связку яичника с обеих сторон. Далее ход операции не отличается от такового при экстирпации матки без придатков.Глава 14. Некоторые вопросы урогинекологии
Цистит и цисталгия
Цистит – воспаление слизистой мочевого пузыря. Часто встречается после акушерских и гинекологических операций, что связано с травмой пузыря во время катетеризации, нарушением правил асептики.В патогенезе заболевания определенное значение имеют нарушения кровообращения, возникающие во время оперативных вмешательств. Значительную роль в их возникновении играют воспалительные заболевания гениталий.
Острый цистит характеризуется частым мочеиспусканием в дневное и ночное время. Отмечаются боли в конце акта мочеиспускания. Это связано с тем, что слизистая оболочка соприкасается с мочепузырным треугольником, где заложено большое количество нервных окончаний. Боли иррадиируют в паховую область, промежность, влагалище. При осмотре моча мутная, может быть терминальная гематурия. Поражение мочевого пузыря бывает ограниченное и диффузное. По глубине поражения процесс, как правило, не распространяется глубже субэпителиального покрова слизистой оболочки.
В диагностике большое значение имеет правильно собранный анамнез. Из лабораторных методов ведущую роль играет общий анализ (желательно второй порции) мочи. В ней будет содержаться большое количество лейкоцитов.
Цистоскопию при остром цистите делать не рекомендуется.
Лечение продолжается 7–10 дней и включает обильное питье, назначение спазмолитиков, анальгетиков, химиопрепаратов (5–НОК). Широко используется фитотерапия (палин, полпола, листья брусничника, медвежьи ушки, фитолизин).
Хронический цистит имеет длительное течение. Клинические прояления его менее выражены. Наблюдаются пиурия и гематурия в конце акта мочеиспускания. Поллакиурия обусловлена уменьшением емкости мочевого пузыря в связи с вовлечением в патологический процесс мышечной оболочки.
Диагноз ставится на основании жалоб, общего анализа мочи. Ведущую роль играет цистоскопия (слизистая гиперемирована, теряет блестящий вид, сосуды не визуализируются).
Лечение – комплексное. Обязательна санация воспалительных процессов в половых органах. Назначаются диуретики, спазмолитики, анальгетики. Из физиотерапевтических методов используют диатермию и грязелечение. Широкое распространение получила иглорефлексотерапия.
Цисталгия – это болезненное состояние мочевого пузыря с чистой мочой, при котором доминируют частые позывы к мочеиспусканию. Встречается у 10–15% урологических больных, причем чаще болеют женщины в возрасте 20–45 лет.
Этиология и патогенез.
До настоящего времени не выявлены многие стороны этиологии и патогенеза. Причиной этого заболевания некоторые авторы считают бактериурию.Исследования многих авторов убедительно показывают, что развитие цисталгии у женщин связано с гормональными нарушениями. Подтверждением тому служит появление цисталгии у больных с гипоэстрогенией, тяжелыми нарушениями менструального цикла. Роль эндокринного фактора в генезе заболевания подтверждается обострениями болей и дизурических явлений во время менструации, в период менопаузы.
Существует связь цисталгии с заболеваниями половых органов. Среди гинекологических заболеваний, вызывающих эту патологию, наибольшую роль играют воспалительные процессы, опухоли гениталий, опущение стенок влагалища.
Некоторые больные связывают начало заболевания с сексуальными конфликтами, стрессовыми ситуациями, психическими травмами.
Установлена также роль аллергенов в развитии заболевания.
Таким образом, цисталгию следует рассматривать как заболевание, развивающееся вследствии функционального поражения нервно–мышечных структур мочевого пузыря, поскольку сохранена его емкость и отсутствуют воспалительные изменения. Заболевание отличается длительным хроническим течением, приводит к развитию невротических состояний и иногда – к инвалидности.
Клиническая картина
Имеют место две основные группы жалоб: ■ расстройства мочеиспускания ■ боли в области мочевого пузыря, в промежности и неприятные ощущения в уретре.Расстройства мочеиспускания проявляются поллакиурией, болезненным мочеиспусканием, особенно к концу акта, чувством неполного опорожнения мочевого пузыря.
Мочевые симптомы обычно проявляются после стрессовых ситуаций, неудовлетворенных в психическом и физическом отношении половых актов. Они усиливаются после переохлаждения и приема острых блюд.
Боли в промежности и в надлобковой области тупые, тянущие, четко локализованные. Они могут иррадиировать в подвздошную и пояснично–крестцовую область. Боли появляются во время или вне акта мочеиспускания, иногда при половом сношении. Зачастую они появляются без видимой причины. Перечисленные симптомы беспокоят больных в основном в дневное время и чаще в осенне–зимний период. Причем, как правило, вначале нарушается мочеиспускание, а затем развертывается весь симптомокомплекс.
Диагностика
Постановка диагноза учитывает данные анамнеза, при сборе которого большое внимание необходимо уделять перенесенным гинекологическим заболеваниям, операциям. Уточняются способы предохранения от беременности, состояние сексуальной сферы.Лабораторными и рентгенологическими методами определяют функцию почек, верхних и нижних мочевых путей; моча у таких больных не содержит патологических примесей. Эндоскопическое исследование позволяет определить емкость мочевого пузыря, состояние слизистой оболочки, которая имеет, как правило, нормальную картину.
Проводится исследование функции яичников с помощью специальных методов. Психоневрологическое обследование необходимо для выявления у таких пациенток психических расстройств.
Лечение
Терапия цисталгии, как и многих других заболеваний, эффективна при устранении этиологических факторов. Больные женщины частоизбавляются от болей и дизурических явлений после удаления миоматозных узлов или передней кольпоррафии.Иногда боли исчезают после лечения заболеваний шейки матки. Лечебный эффект объясняется эмбриологическим строением мочепузырного треугольника, который формируется из вольфова канала.
Если цисталгия возникает вследствие гормонального дисбаланса, то необходима гормональная терапия.
Важную роль играет патогенетическая терапия. Оправдано назначение седативных и анальгезирующих препаратов, спазмолитиков.
Хороший эффект дает иглорефлексотерапия, которая через сегментарную иннервацию воздействует на патогенетические факторы цисталгии.
Важную роль в лечении играет диетотерапия. Из рациона необходимо исключить острые блюда и алкогольные напитки.
Таким образом, цисталгия – это заболевание не имеющее морфологического субстрата, длительно протекающее и требующее комплексного лечения.
Недержание мочи
Непроизвольное мочеиспускание – симптом различных заболеваний, распространенный у женщин. Международное общество урологов определяет недержание мочи и непроизвольное мочеиспускание как социальную и гигиеническую проблему. Эта патология может быть результатом нарушения накопительной и выделительной функций мочевого пузыря или поражения сфинктера уретры и выводного механизма. Возможно сочетание обоих факторов.В соответствии с классификацией международного общества урологов существует связь типов недержания мочи, возникающих самостоятельно или в комбинации: ■ истинное стрессовое недержание ■ позывное недержание ■ рефлекторное недержание ■ недержание от перенаполнения ■ экстрауретральное недержание.
Истинное недержание мочи – непроизвольное мочеиспускание через интактный мочеиспускательный канал в результате резкого повышения внутрибрюшного давления, например во время физической нагрузки, в отсутствие сокращений детрузора. Эта патология часто связана с несостоятельностью мышц тазового дна, которая возникает вследствие патологических родов, оперативных вмешательств на женских половых органах. Стрессовое недержание мочи может встречаться у пациенток в менопаузе в связи с недостатком эстрогенов, что вызывает урогенитальную атрофию.
При позывном недержании неконтролируемое содержание детрузора приводит к непроизвольному мочеотделению. Это может быть связано с циститом, дефицитом эстрогенов, психосоматическими нарушениями.
Рефлекторное недержание связано с гиперрефлексией детрузора и непроизвольным расслаблением уретры при отсутствии позыва к мочеиспусканию. Данный тип наблюдают у пациенток с различными неврологическими заболеваниями.
Недержание от перенаполнения – непроизвольное мочеиспускание, связанное с перерастянутым мочевым пузырем. Причинами могут быть обструкция в области шейки мочевого пузыря, нарушение иннервации детрузора часто после перенесенных гинекологических операций и в раннем послеродовом периоде.
Экстрауретральное недержание – мочевыделение, связанное с мочеполовыми свищами, аномалиями развития мочеполовой системы.
Процесс мочеиспускания у женщин осуществляется следующим образом: сокращается детрузор, открывается шейка мочевого пузыря и расслабляются мышечные сфинктеры. Последние закрываются после опорожнения мочевого пузыря, и в это время расслабляется детрузор. В какой–то степени акт мочеиспускания можно сравнить с раскрытием шейки матки при рождении плода.
Повреждения одного или нескольких компонентов данной системы может приводить к недержанию мочи: механизмы нарушений отличаются при разных типах недержания, поэтому назначение адекватного лечения требует детального изучения всех факторов.
Классификация степени тяжести недержания мочи: ■ легкая степень: мочевыделение во время кашля, смеха ■ средняя степень: мочевыделение во время ходьбы, бега, подъема по лестнице ■ тяжелая степень: мочевыделение в положении стоя.
Диагностика
Для постановки диагноза недержания мочи требуется комплексное урологическое, гинекологическое, эндокринологическое и неврологическое обследование, что позволяет установить тип этого заболевания.Алгоритм обследования включает: ■ сбор анамнеза ■ анализ мочи ■ клинический осмотр ■ гинекологический осмотр ■ исследование уродинамики ■ рентгенологическое и ультразвуковое исследование мочевого пузыря и уретры ■ ультразвуковое исследование почек и мочеточников ■ цистоскопию, уретроскопию, внутривенную урографию, неврологическое исследование по показаниям.
Подробный сбор анамнеза позволяет предположить тип недержания. Так, мочеиспускание во время физической нагрузки предполагает стрессовое недержание. Учащение мочеиспускания, никтурия, дизурия характерны для недержания позывного типа. Частое мочеиспускание малыми порциями является признаком недержания от перенаполнения. Формирование свища можно заподозрить у пациенток с недержанием, развившимся после перенесенной гинекологической операции.
До начала лечения проводят анализ мочи и исследование на микрофлору. При наличии инфекции мочевых путей показано лечение. Клинический осмотр и исследование нервной системы – обязательные компоненты диагностической программы у женщин с недержанием мочи.
Гинекологическое обследование является важным этапом в диагностике типа недержания мочи. Это связано с тем, что у большинства больных такая патология обусловлена несостоятельностью мышц тазового дна. Следствием является опущение и выпадение половых органов различной степени.
Во время осмотра влагалища в зеркалах определяют состояние его стенок. Внимательно осматривается также шейка матки. Во время такого осмотра можно обнаружить пузырновлагалищные и мочеточно–влагалищные свищи.
Гинекологический осмотр включает тест элевации шейки мочевого пузыря. Во влагалище вводят указательный палец и на уровне мочепузырного треугольника сгибают концевую фалангу. Таким образом выправляют уретральную ось мочевого пузыря. Предлагают больной покашлять. Тест считается положительным, если моча при кашле не вытекает из наружного отверстия уретры (рис. 14.1).
 Рис. 14.1. Тест элевации шейки мочевого пузыря (а, б)
Рис. 14.1. Тест элевации шейки мочевого пузыря (а, б)
При отсутствии анатомических изменений со стороны половых органов и «кашлевого симптома» нужно убедиться в целости мочевого пузыря и мочеиспускательного канала.
Затем проводится бимануальное исследование тазовых органов для выяснения сопутствующей патологии.
Дальнейшее обследование проводится специалистами–урологами с использованием специфических методов диагностики.
Лечение
Консервативное лечение проводится больным с легкой степенью недержания мочи, как правило, молодым женщинам, планирующим беременность. Успех такой терапии достигается в результате восстановления равновесия между детрузором и сфинктерами мочевого пузыря.Консервативная терапия включает: ■ налаживание образа жизни, подразумевающее исключение ненужных нагрузок на тазовое дно, ограничение пищевых продуктов, провоцирующих ожирение и запоры, избежание тяжелого физического труда, прекращение курения, профилактику хронических обструктивных заболеваний легких ■ заместительную терапию эстрогенами, если имеется их дефицит ■ назначение α–адренергических препаратов с целью повышения уретрального давления в покое путем стимуляции α–рецепторов проксимального отдела мочеиспускательного канала и шейки мочевого пузыря ■ физиолечение с целью укрепления тазового дна. Хороший эффект дает электростимуляция тазового дна с использованием влагалищного и ректального электродов ■ лечебную физкультуру, гимнастические упражнения; они направлены в первую очередь на укрепление сфинктеров мочевого пузыря и прямой кишки и, кроме того, на укрепление мышц тазового дна ■ лечение пессариями (альтернатива оперативному лечению у пациентов старшего возраста).
Оперативное лечение проводится у больных, страдающих недержанием мочи средней и тяжелой степени, у которых консервативная терапия безуспешна. Цель различных видов хирургических вмешательств заключается в восстановлении нормальной анатомии нижних отделов мочевых путей, повышении давления закрытия уретры в покое, улучшении передачи давления с мочевого пузыря на мочеиспускательный канал. Различные виды операций, которые проводятся при стрессовом недержании мочи, описаны в соответствующих руководствах.
Мочеполовые свищи
Наиболее частыми причинами возникновения мочеполовых свищей являются акушерский травматизм и травмы при гинекологических операциях. При этом они могут формироваться при травмировании мочевого пузыря или мочеточников во время оперативного вмешательства. Это возникает в случаях, когда травма не была диагностирована в ходе операции, либо в результате неправильного лечения острой травмы.Еще одной причиной возникновения свищей является некроз тканей, вызванный длительным сдавлением их в родах, раздавливанием инструментами во время операций, наложением лигатур. Более редкими причинами формирования мочеполовых свищей являются тяжело протекающие гнойные процессы в малом тазу.
Классификация
Классификация свищей построена по анатомическому принципу (рис. 14.2).Классификация по М.С. Малиновскому: ■ свищи нижнего отдела мочевых путей (уретровлагалищные) ■ свищи среднего отдела мочевых путей (пузырно–влагалищные, пузырно–шеечные, пузырно–маточные) ■ свищи верхнего отдела мочевых путей (все виды мочеточниковых свищей) ■ комбинированные свищи (мочеточниково–пузырно–влагалищные, уретропузырно–влагалищные).
Диагностика свища в большинстве случаев не представляет трудностей. Уже на основании хорошо собранного анамнеза, анализа клинического течения заболевания и осмотра больной можно установить наличие высоко расположенных маленьких фистул, открывающихся в рубцово–измененные ткани.
Обследование больных проводится по следующей схеме: ■ сбор анамнеза и гинекологический осмотр ■ введение красящего вещества в мочевой пузырь ■ цистоскопия или вагинография ■ УЗИ почек ■ в случае выявления изменений при УЗИ или цистоскопии– экскреторная урография, радиоизотопная ренография, цистография в трех проекциях.
 Рис. 14.2. Пузыррно–генитальные свищи: 1 – пузырно–придатковые, 2 – пузырно–параметральные; 3 – пузырно–маточные; 4 – пузырно–шеечные; 5 – пузырно–влагалищные (низкого, среднего, высокого уровней)
Рис. 14.2. Пузыррно–генитальные свищи: 1 – пузырно–придатковые, 2 – пузырно–параметральные; 3 – пузырно–маточные; 4 – пузырно–шеечные; 5 – пузырно–влагалищные (низкого, среднего, высокого уровней)
После тщательно собранного анамнеза приступают к осмотру больной. При осмотре с помощью зеркал и зондирования свищевого хода можно установить, к какому отделу мочевой системы относится свищ. Но если свищевой ход извитой, то зондирование малоинформативно. Проба с использованием красящего вещества (метиленовый синий) позволяет определить, относится свищ к мочевому пузырю или к мочеточнику. В мочевой пузырь вводится 200 мл раствора красящего вещества. Если при наполнении мочевого пузыря промывная жидкость не вытекает во влагалище, то следует предположить наличие мочеточникового влагалищного свища. При свищах небольшого диаметра эту пробу рекомендуют проводить с введением во влагалище марлевого тампона. Влагалище по всей длине рыхло тампонируют, пациентку просят походить в течении 20–30 мин. При пузырно–влагалищных свищах окрашиваются верхние 2/3 тампона. При наличии мочеточниково–влагалищного свища промокает, но не окрашивается верхняя часть тампона. Если окрашивается самый нижний край тампона, то наиболее вероятный диагноз – стрессовое недержание мочи. Информативным методом в диагностике свищей является цистоскопия, позволяющая установить локализацию фистулы, ее форму, оценить морфологическое состояние тканей вокруг свища. Вагинография позволяет выявить свищи, которые не были обнаружены во время гинекологического осмотра и эндоскопического исследования. Она дает четкое представление о конфигурации и емкости мочевого пузыря при обширных свищах. О состоянии верхних мочевых путей можно судить по результатам хромоцистоскопии, экскреторной урографии и радиоизотопной ренографии.
Лечение
Лечение мочеполовых свищей – задача крайне сложная. Консервативное лечение в большинстве случаев неэффективно. Основным методом восстановления здоровья таких больных является хирургический. Определение срока оперативного вмешательства по закрытию свища с момента его возникновения должно быть индивидуальным для каждой больной. Необходимо учитывать общее состояние больной, причину возникновения свища, состояние краев свищевого отверстия и окружающих тканей. Оптимальным сроком закрытия свищей являются 3–4 месяца после их возникновения.Непосредственно оперативному вмешательству должна предшествовать тщательная подготовка, в которую входят: ■ применение уросептиков за 3–4 недели до оперативного вмешательства ■ санация влагалища ■ общеукрепляющее лечение и витаминотерапия ■ пациенткам в постменопаузальном периоде рекомендуется применение эстрогенов перорально или местно.
Главная цель хирургического пособия – создать максимально благоприятные условия для течения репаративных процессов. Это достигается за счет максимальной интраоперационной санации операционной зоны, адекватно выполненного хирургического пособия независимо от его объема, полноценного дренирования. Доступ к операционному полю может быть различным. Оперативное вмешательство по закрытию уретрального свища и области сфинктера мочевого пузыря всегда должно производиться вагинальным путем.
Выбор метода операции ушивания пузырно–влагалищного свища зависит прежде всего от высоты его расположения в мочевом пузыре и во влагалище, а также от отношения его к устью мочеточника. При выборе метода операции необходимо также учитывать степень рубцовых изменений краев свища и окружающих тканей и сращения их со стенками таза.
Операции по закрытию пузырно–влагалищного свища могут быть осуществлены: ■ вагинальным путем (методы прямой пластики дефекта, аутопластика с использованием близлежащих к свищу тканей стенки влагалища, шейки и тела матки, малых и больших половых губ или кожных лоскутов на ножке) ■ трансвезикальным ■ трансперитонеальным ■ комбинированным.
Подавляющее большинство пузырно–влагалищных свищей, в том числе и высоко расположенных и открывающихся в культе влагалища, может быть ушито влагалищным путем методом расщепления. Влагалищный путь обеспечивает широкую мобилизацию краев дефекта мочевого пузыря без нанесения дополнительной травмы последнему.
Пузырно–шеечные свищи небольшого диаметра, открывающиеся вблизи наружного отверстия шейки матки, также рационально зашивать со стороны влагалища.
Трансвезикальный метод ушивания свища показан в тех случаях, когда свищевое отверстие в мочевом пузыре граничит с устьем мочеточника.
Устье мочеточника во время операции необходимо видеть, чтобы не травмировать его при отслойке краев свищевого отверстия и наложении лигатур, особенно если нет возможности предварительно катетеризировать мочеточники.
Недостатком этого метода является то, что при свищах небольшого диаметра для отсепаровки края свища мочевого пузыря от стенки влагалища или шейки матки необходимо увеличить размеры свищевого отверстия в мочевом пузыре, что крайне нежелательно.
Показанием для чревосечения у больных с пузырно–влагалищными свищами являются свищи труднодоступные ушиванию со стороны влагалища, непосредственно граничащие с устьями мочеточников, когда может возникнуть необходимость одновременно произвести неоимплантацию мочеточника в мочевой пузырь, а также комбинированные пузырно–мочеточниково–влагалищные свищи, диагностированные до операции.
Комбинированные методы операции (вагинально–абдоминальный, вагинально–экстраперитонеальный, вагинально–трансвезикальный, абдоминально–трансвезикальный) используются при сложных свищах.
При наличии мочеточниково–влагалищных свищей операции могут осуществляться несколькими методами и путями.
При свищах, расположенных в юкстовезикальном и интрамуральном отделах мочеточника, может быть с успехом применена операция уретероцистонеостомии. Необходимым условием операции является вшивание мочеточника в мочевой пузырь без натяжения. Эти операции могут быть произведены как внутрибрюшинным путем, так и экстраперитонеально.
При низких мочеточниковых свищах уретероцистонеостомия может быть осуществлена вагинальным путем.
При больших дефектах мочеточника применяются операции по замещению дефекта, среди которых на первом месте стоит кишечная пластика.
Операция сшивания мочеточника «конец в конец» при старых мочеточниково–влагалищных свищах не должна иметь места, так как ткань мочеточника в области свища и окружающие его ткани рубцово изменены и после подобной операции либо наступает рецидив свища, либо стриктура мочеточника.
Послеоперационный период у больных с мочеполовыми свищами включает: ■ постельный режим на 5–7 дней ■ тампонирование влагалища на 24–48 ч ■ длительное, в течении 8–10 дней дренирование мочевого пузыря ■ использование уросептиков, начиная с 1–х суток после операции ■ санацию влагалища.
Беременеть женщинам, перенесшим операцию по поводу мочевых свищей, можно не ранее чем через 1,5–2 года. За это время заканчиваются репаративные процессы, восстанавливается функция почек, нормализуется произвольное мочеиспускание. В течении этих 1,5–2 лет женщинам рекомендуется использовать оральные контрацептивы.
Беременность у таких пациенток, как правило, протекает гладко. Необходим постоянный контроль за состоянием мочевыделительной системы и функцией почек, так как сохраняется высокий риск возникновения пиелонефрита.
Вопрос о методе родоразрешения необходимо решать в каждом случае индивидуально. Из всех методов родоразрешения предпочтение отдается кесареву сечению. Причем операцию необходимо проводить продольным корпоральным разрезом без вскрытия и отсепаровки пузырно–маточной складки.
Ведение послеоперационного периода и профилактику осложнений необходимо осуществлять по обычной схеме ведения родильниц после операции кесарева сечения.
Глава 15. Принципы реабилитации и врачебно–трудовой экспертизы в гинекологии
Реабилитационное направление деятельности всех акушерско–гинекологических учреждений отражает стремление к качественно более совершенной организации оказания медицинской помощи с учетом не только состояния биологических функций женского организма, но и оздоровительной роли всего комплекса экологических, социально–гигиенических и общественных факторов.Профилактическая направленность лечения акушерско–гинекологической патологии предполагает осуществление раннего и точного распознавания болезни и рациональной ее терапии (своевременной, индивидуально адаптированной, комплексной).
В повседневной практической деятельности по охране здоровья населения нельзя четко разграничить мероприятия профилактического, лечебного и собственно реабилитационного характера. Особенно это относится к акушерско–гинекологической практике, требующей оценки весьма неустойчивых параметров физиологического и патологического течения всех специфических функций женского организма. Различия носят условный характер и касаются в основном последовательности проведения мероприятий.
В частности, лечебные мероприятия отличаются большей направленностью на устранение конкретного заболевания, притом в клинически выраженной стадии развития (острой, подострой). Для реабилитационных мероприятий характерна большая нацеленность их на нормализацию гомеостаза организма в целом, а также на восстановление его гармонии с окружающим миром (в семье, на производстве и т. д.).
Многоплановые реабилитационные мероприятия подразделяются на медицинские, профессиональные и социальные.
Медицинская реабилитация осуществляется усилиями медицинского персонала женских консультаций, родильных домов, гинекологических и онкологических отделений, а также учреждений санаторно–курортного профиля.
Она включает: ■ этиопатогенетическую терапию распознавания заболевания, цель которой – максимальное сохранение функций поврежденных органов ■ психотерапию и лечебно–охранительный режим, направленные на устранение связанных с заболеванием (беременностью) неблагоприятных психоэмоциональных сдвигов ■ физиотерапию, лечебную физкультуру, лечебный массаж и санаторно–куротное лечение для устранения остаточных анатомических изменений и восстановление функциональной полноценности половых органов.
Проводимая медицинская реабилитация может быть ранней и поздней. Задача первой состоит в предупреждении клинически развитых и осложненных форм акушерско–гинекологической патологии. Она представляет собой комплекс лечебно–профилактических мероприятий, направленных на выявление и быстрейшее устранение доклинических, ранних клинических форм патологии беременности, осложнений послеродового периода, а также острых и подострых форм гинекологических заболеваний.
Поздняя медицинская реабилитация акушерско–гинекологических больных состоит в комплексном долечивании их после выписки из стационара, а также лечении женщин, страдающих хроническими гинекологическими заболеваниями. Она направлена на предупреждение обострений и рецидивов заболеваний, ликвидацию их резидуальных проявлений. Поздняя реабилитация касается в основном тех больных, которые страдают заболеваниями, ведущими к возникновению стойких анатомических и функциональных последствий.
Для эффективности проводимых в женской консультации реабилитационных мероприятий медицинского характера необходимы: ■ четкая организация диспансерного наблюдения за беременными и больными на участках, что позволяет оказывать профилактическую медицинскую помощь планово и активно, с учетом влияния средовых факторов и индивидуальных особенностей организма (факторов риска) ■ совершенство диагностики, которая должна обеспечивать своевременность и полноту распознавания заболеваний ■ рациональность терапевтических воздействий, программа которых должна отвечать требованиям индивидуализации, профилактической направленности и комплексности лечения с учетом единства психоэмоциональных и эндокринно–соматических функций организма.
В акушерстве и гинекологии степень реабилитационного эффекта тесно связана с физиологической адекватностью терапевтических мероприятий и щадящим отношением к структуре и функциям органов матери и плода.
В связи с коллективным характером всех видов медицинской помощи, а также обязательностью активного отношения к охране и укреплению собственного здоровья со стороны населения принципы реабилитации наиболее полно удается реализовать в организационных рамках так называемого терапевтического сообщества, функционирующего в условиях адекватной терапевтической среды.
Эти понятия охватывают всю совокупность материальнотехнических, профессионально–кадровых, организационно–методических и морально–этических факторов, обеспечивающих эффективность и высокую культуру медицинской помощи в лечебно–профилактических учреждениях.
После медицинской реабилитации проводятся мероприятия, направленные на восстановление профессионального статуса пациентки. Последствия акушерско–гинекологических заболеваний, как правило, не требуют смены профессии.
Что касается социальной реабилитации, то в состав мероприятий в обязательном порядке должны включаться психологические и педагогические воздействия. Целью данной работы является преодоление связанной с заболеванием и его последствиями психической травмы и обучение пациентки правильному поведению с учетом переменившегося состояния специфических функций ее организма.
Основными организационно–методическими принципами реабилитации являются: ■ единство биологических и психотерапевтических методов воздействия ■ физиологичность и профилактическая направленность лечебно–диагностической работы ■ комплексность реабилитационных мероприятий ■ непрерывность, последовательность, преемственность и индивидуальный характер реабилитационных программ.
В определении качества этих программ важную роль играет врачебно–трудовая экспертиза (ВТЭ), которая представляет собой очень ответственный и весьма сложный элемент врачебного труда.
В своей деятельности в области ВТЭ врач акушер–гинеколог должен руководствоваться: ■ большой социально–экономической значимостью этого вида работы ■ профилактической ролью ВТЭ ■ необходимостью научно обоснованного подхода к определению степени и продолжительности нетрудоспособности ■ необходимостью постоянного врачебного (диспансерного) контроля за динамикой состояния здоровья нетрудоспособных ■ пониманием того, что главной задачей ВТЭ является не столько установление самого факта нетрудоспособности, сколько быстрейшее восстановление здоровья и работоспособности.
Врачи женских консультаций чаще всего осуществляют экспертизу так называемой временной нетрудоспособности.
При этом устанавливаются: ■ факт утраты трудоспособности и особенности гигиенической характеристики профессии ■ причины утраты трудоспособности (диагноз заболевания) ■ прогноз в отношении длительности и степени нетрудоспособности ■ план лечения (реабилитации) и характер лечебного режима ■ наличие оснований для направления на врачебнотрудовую экспертную комиссию.
Таким образом, экспертиза временной нетрудоспособности требует от врача оценки не только медицинских аспектов заболевания, но и особенностей профессионального труда заболевшей женщины (степень физической и нервно–психической напряженности, наличие потенциальных вредностей). Некоторые факторы профессионального труда (работа в вынужденном положении, сотрясение тела, химически активная пыль, длительное физическое напряжение и др.) могут неблагоприятно влиять на течение уже существующих (возникших в результате действия других этиологических причин) гинекологических заболеваний. Лечение их в таких условиях затрудняется, выздоровление затягивается, могут наступать обострения и рецидивы. Поэтому в отношении определенной группы женщин освобождение их от работы на время лечения, а также рациональное трудоустройство в последующем приобретает значение важных лечебно–профилактических мероприятий (табл. 15.1).
Временная нетрудоспособность часто возникает при воспалительных процессах половых органов, расстройствах менструальной функции, опухолях матки и яичников и др. В целом в структуре причин временной нетрудоспособности гинекологическим заболеваниям принадлежит одно из первых мест. Однако при правильной организации медицинской помощи большинство гинекологических заболеваний (80–85%) успешно излечиваются в центрах женской консультации.
Таблица 15.1. Примерные сроки временной нетрудоспособности после гинекологических операций
| Название болезни | Объем оперативного вмешательства | Сроки пребывания в стационаре, дней | Общая продолжительность нетрудоспособности, дней |
|---|---|---|---|
| Киста и кистома яичников | Удаление придатков матки с одной или обеих сторон | 12–14 | 25 ± 3 |
| Миома или другие заболевания матки (полипоз, эндометриоз) | Надвлагалищная ампутация матки без придатков | 13–15 | 30 ± 3 |
| То же в сочетании с заболеваниями придатков | Надвлагалищная ампутация матки с придатками | 14–16 | 35 ± 3 |
| То же в сочетании с заболеваниями шейки матки | Экстирпация матки с придатками или без них | 16–18 | 40 ± 4 |
| Опущение или выпадение стенок влагалища и матки | Пластические операции на влагалище с лапаротомией и фиксацией матки | 18–20 | 40 ± 4 |
| Внематочная беременность | Сальпингэктомия | 12–20 | 30 ± 3 |
| Заболевания шейки матки | Пластика шейки матки | 10–12 | 20 ± 3 |
| Гнойные опухоли придатков | Удаление придатков матки, в том числе с ампутацией ее тела | 18–20 | 35 ± 3 |
| Субсерозная миома матки | Энуклеация миоматозного узла | 10–12 | 20 ± 3 |
Необходимость строгой преемственности экспертных оценок нетрудоспособности особенно очевидна в случаях оперативного лечения гинекологических больных.
Важным разделом экспертной работы врачей женской консультации является установление срока предоставления дородового и послеродового декретных отпусков. Качество этой работы определяется сроками первичной явки беременных в женскую консультацию, тщательностью динамического наблюдения за развитием беременности и комплексным использованием современных методов диагностики срока беременности. Срок начала дородового декретного отпуска – 30 недель при неосложненном течение беременности и 28 недель при наличии осложнений и неблагоприятных факторах профессиональной деятельности.
Наиболее частыми причинами нетрудоспособности при патологическом течении беременности являются гестозы беременных, угроза досрочного прерывания ее, различные сопутствующие заболевания, изоиммунизация материнского организма.
Значительному снижению нетрудоспособности среди беременных способствует правильно поставленная работа по своевременному выявлению факторов акушерского и перинатального риска с последующим формированием соответствующих групп повышенного риска, что позволяет интенсифицировать наблюдение, оказывать беременным дифференцированную медицинскую помощь как в условиях специализированных отделений роддома, так и в условиях дневных стационаров женской консультации.
Организация работы по экспертизе временной нетрудоспособности и постоянный контроль за ее качеством осуществляется заведующим женской консультации и начмедом родильного стационара. Они контролируют экспертную работу лечащих врачей, участвуют в определении сроков нетрудоспособности, проверяют правильность оформления соответствующей документации, на основании результатов анализа работы на ВТЭ разрабатывают организационно–методические мероприятия.
Стойкая временная нетрудоспособность в акушерско–гинекологической практике встречается сравнительно редко. Связана она в основном с онкогинекологическими заболеваниями и патологически протекающим климактерическим периодом. Право устанавливать инвалидность имеет только ВТЭК. Направляются на ВТЭК больные с неблагоприятным прогнозом трудовой деятельности. Длительно болеющие должны обследоваться во ВТЭК не позднее чем через 4 месяца после начала болезни. В целом эти случаи составляют малую долю в структуре гинекологической заболеваемости.
Приложения
1. Характеристика современных антибактериальных препаратов
| Название препарата | Группа | Механизм действия | Действие на β–лактамазные штаммы | Преимущественное антимикробное действие | Отрицательные моменты | Путьв ведения | Дозы | Побочные действия |
|---|---|---|---|---|---|---|---|---|
| Пиперациллин | Полусинтетический пенициллин | Бактерицидный | – | Большинство аэробных и анаэробных Г+, Г– бактерий | Не действует на стафилококк и β–лактамазные штаммы | в/в | 200–300 мг/кг в сутки (кратность введения –2–4 раза) | Крапивница, бронхоспазм, эозинофилия |
| Тикарциллин | Полусинтетический пенициллин | Бактерицидный | – | Большинство аэробных и анаэробных Г+, Г– бактерий | Не действует на β–лактамазные штаммы | в/в | 200–300 мг/кг в сутки (кратность введения –2–4 раза) | Диспептические явления, лейкотромбоцитопения, анемия, гипокалемия |
| Амоксиклав | Полусинтетический пенициллин | Бактерицидный | – | Большинство аэробных и анаэробных Г+, Г– бактерий | Не действует на β–лактамазные штаммы | в/в | 200–300 мг/кг в сутки (кратность введения –2–4 раза) | Диспептические явления, лейкотромбоцитопения, анемия, гипокалемия |
| Цефуроксим (зинацеф, кетацеф) | Цефалоспорин 2–го поколения | Бактерицидный | + | Г+ и некоторые Г– бактерии (эшерихии, клебсиеллы, протей, интеробактерии и др.) | Не действует на некоторые Г– бактерии и анаэробы | в/в, в/м, per os (зиннат) | По 0,75–1,5 г 3 раза в/в или в/м | В основном кожныеаллергические и диспептические реакции |
| Цефокситин (мефоксим) | Цефалоспорин 2–го поколения | Бактерицидный | + | Г+ и некоторые Г– бактерии (эшерихии, клебсиеллы, протей, интеробактерии и др.) | Не действует на некоторые Г– бактерии и анаэробы | в/в, в/м, per os (зиннат) | По 1–2 г 2 раза в сутки | В основном кожные аллергические и диспептические реакции |
| Цефотетан | Цефалоспорин 2–го поколения | Бактерицидный | + | Г+ и некоторые Г– бактерии (эшерихии, клебсиеллы, протей, интеробактерии и др.) | Не действует на некоторые Г– бактерии и анаэробы | в/в, в/м | По 1–2 г 2 раза в сутки | В основном кожные аллергические и диспептические реакции, нарушения свертывающей системы крови |
| Цефотаксим (клафоран) | Цефалоспорин 3–го поколения | Бактерицидный | + | Действует бактерицидно на Г+ и все Г–β–лактамазные штаммы, устойчивые к другим препаратам | Менее активен в отношении стрепто–, пневмо–, стафило–, гоно– и менингококков, бактероидов | в/в, в/м | По 1–2 г 3–4раза в сутки | В основном кожныеаллергичесике и диспептические реакции |
| Ценфтриаксон (лонгацеф, роцефин) | Цефалоспорин 3–го поколения | Бактерицидный | + | Г+, Г– бактерии (действует бактерицидно на все Г+ и Г– β–лактамазные штаммы, устойчивые к другим препаратам) | Не действует на хламидии | в/в, в/м | По 2 г 1 раз в сутки (в очень тяжелых случаях по 2 г 2 раза в сутки) | В основном кожные аллергичесике и диспептические реакции |
| Цефтазитим (фортум, кефадим) | Цефалоспорин 3–го поколения | Бактерицидный | + | Г+, Г– бактерии (действует бактерицидно на все Г+ и Г– β–лактамазные штаммы, устойчивые к другим препаратам) | Не действует на хламидии | в/в, в/м | По 1 г 3 раза или 2 г 2 раза в сутки (в очень тяжелых случаях до 6 г) | В основном кожные аллергические и диспептические реакции |
| Цефаперазон (цефобид) | Цефалоспорин 3–го поколения | Бактерицидный | + | Действует на все Г+ и Г– β–лактамазные штаммы, анаэробы, синегнойную палочку | Не действует на хламадии | в/в, в/м | По 1 г 2 раза или 2 г 2 раза в сутки (в очень тяжелех случаях до 8 г/сут) | В основном кожные аллергические и диспептические реакции |
| Азтреонам | Группа монобактамов | Бактерицидный | – | Большинство Г–бактерий, в том числе штаммы, продуцирующие β–лактамазу, синегнойная палочка | Не действует на анаэробы и Г+, Г– бактерии | в/м, в/в | По 0,5–2 г каждые 8–12 ч (максимальная суточная доза 8 г) | – |
| Меронем | Карбапенем, β–лактамный антибиотик | Бактерицидный | + | Большинство аэробных и анаэробных Г+, Г– бактерий | Не действует на хламадии | в/в, в/м | По 0,5 г 2–3 раза в сутки | Диспептические явления, зуд, повышение уровня трансаминаз и билирубина |
| Гентамицин | Аминогликозид 2–го поколения | Бактерицидный | – | Большинство Г– бактерий, синегнойная палочка | Слабоедействие на Г+, не действует на анаэробы | в/м | По 0,08 г каждые 8 ч | – |
| Тобрамицин | Аминогликозид 3–го поколения | Бактерицидный | – | Большинство Г– бактерий, синегнойная палочка | Слабоедействие на Г+, не действует на анаэробы | в/в | По 0,21–0,35 г каждые 8 ч | – |
| Амикацин | Аминогликозид 3–го поколения | Бактерицидный | – | Большинство Г–бактерий, синегнойная палочка | Слабоедействие на Г+, не действует на анаэробы | в/в | По 0,08 г каждые 12 ч | – |
| Тетрациклин | Тетрациклины | Бактериостатический | – | Большинство аэробных Г– бактерий, клостридии, хламидии, микоплазмы | Не действует на анаэробы | per os | По 0,2–0,25 г3–4 раза в сутки | Диспептические явления, стоматит |
| Доксициклин (вибрамицин) | Тетрациклины | Бактериостатический | – | Большинство аэробных Г– бактерий, клостридии | Не действует на анаэробы | в/вper os | 1–й день 0,2 г (одномоментно или по 0,1 г через 12 ч, в последующие дни по 0,1 г или 0,2 г однократно) | Диспептические явления, стоматит |
| Офлоксацин (таривид) | Тетрацилины | Бактерицидный | + | Действует на все Г–, некоторые Г+ (стафилококки), а также микоплазмы и хламидии | Не действует на анаэробы, кроме B.Urealiticus | per os | По 0,2–0,3–0,4 г 2 раза в сутки | Сыпь, васкулиты, фотосенсибилизация, нарушение сна, обоняния, осязания |
| Цефлоксацин (абактал) | Фторхинолоны | Бактерицидный | + | Действует на все Г–, некоторые Г+ бактерии (стафилококки), а также микоплазмы и хламидии | Не действует на анаэробы, кромеB.Urealiticus | в/вper os | По 0,4 или 0,8 г 2 раза в сутки в/в или per os по 0,4 г 2 раза в сутки | Сыпь, васкулиты, фотосенсибилизация, нарушение сна, обоняния, осязания |
| Ципрофлоксацин (циплокс, циприхол, ципробай, ципроканитор) | Фторхинолоны | Бактерицидный | + | Действует на все Г–, некоторые Г+ бактерии (стафилококки), а также микоплазмы и хламидии | Не действует на анаэробы, кромеB.Urealiticus | в/вper os | По 0,25–0,5–0,75 г 2 раза в сутки в/в или per os по 0,5 г 2 раза в сутки | Сыпь, васкулиты, фотосенсибилизация, нарушение сна, обоняния, осязания |
| Эритромицин | Макролиды (азолиды) | Бактериостатический | – | Большинство Г+, Г– бактерий, хламидии, микоплазмы, возбудители токсоплазмоза | Не действует на анаэробы | в/в | 0,2 г 2–3 раза в сутки per os по 0,25 г 4 раза в сутки | Диспептические расстройства, повышение активности печеночных ферментов |
| Азитромицин (сумамел) | Макролиды (азолиды) | Бактериостатический | – | Большинство Г+, Г– бактерий, хламидии, микоплазмы, возбудители токсоплазмоза | Не действует на анаэробы | per os | 0,25–0,5–1 г 1 раз в сутки | Диспептические расстройства, повышение активности печеночных ферментов |
| Клиндамицин (далацин С) | Группарезерва | Бактериостатический | – | Г+ бактерии и некоторые анаэробы | Не действует на анаэробы | в/м, в/в | По 0,3–0,45 г каждые 6 ч | Гипотония, слабость, расслабление скелетной мускулатуры |
| Метронидазол (клион, фрагил, трихопол) | Нитроимидазол | Бактерицидный | – | Облигатные споро– и неспорообразующие анаэробы, простейшие (трихомонады, ляблии). Анаэробные бактерии | Не действует на анаэробы | в/в | 0,5 г (100 мл)3 раза в сутки, per os 0,5 г3 раза в сутки | – |
| Амоксикар | Полусинтетический пенициллин | Бактерицидный | – | Г+ (стафилококк, стрепкококк) и Г– бактерии (менингококк, гонококк, кишечная палочка, шигелла, сальмонелла, клебсиелла, хеликобактер) | Не действует на β–лактамазные штаммы | per os | По 25–500 мг через каждые ч (3 раза в сутки) | Аллергические реакции, диспептическое расстройства |
| Мегакар | Полусинтетический пенициллин | Бактерицидный | + | Большинство Г+, Г– бактерий, анаэробы (Clostridium sp. Pertococcus sp.) | Не действует на хламидии | per os | По 250–500 мг через 6 ч (суточная доза не превышает 2 г) | Кожная сыпь, расстройства ЖКТ, дисбактериоз |
| Кларикал | Макролиды | Бактериостатический | – | Действует на стрептококки, стафилококки, листерии, микоплазмы,хламидии, уреаплазмы | Не действует на β–лактамазные штаммы | per os | По 250 мг каждые 12 ч (при тяжелых инфекциях доза может быть увеличена до 1 г) | Кожная сыпь, расстройства ЖКТ, головная боль, временное повышение уровня печеночных ферментов |
| Азикар | Азолиды | Бактериостатический | – | Большинство Г+, Г– бактерии (стафилококки, стрептококки, кишечная палочка, бактероиды, гонококки, хламидии, возбудители токсоплазмоза и сифилиса) | Не действует на β–лактамазные штаммы | per os | 1–й день –500 мг, затем – по 250 мг в сутки (суточная доза 1–2 г) | Кожная сыпь, временное повышение уровня печеночных ферментов |
2. Основные методы детоксикации, используемые у больных с генерализованными формами гнойной инфекции
| Название метода | Механизм | Показания, эффект | Недостатки | Способ применения |
|---|---|---|---|---|
| Гемосорбция | Элиминация токсинов из крови путем ее экстракорпоральной перфузии через сорбенты | Наличие у больных эндогенной интоксикации и почечнопеченочной недостаточности. Быстро снижает критические показатели нарушенного гомеостаза – креатинина, мочевины, билирубина, увеличивает почасовой диурез. Улучшает состояние ЦНС – у пациенток исчезает заторможенность, эйфория, возбуждение | Медленно снижается содержание средних молекул, некротических тел, циркулирующих иммунных комплексов. К 3–5–му дню лечения уменьшаются эритроцитоз, лейкоцитоз, тромбоцитоз в среднем на 10–40% | Артериовенозная либо веновенозная перфузия с предварительной гепаринизацией. Гемосорбцию проводят в течение 1,5–2 ч со скоростью 50–100 мл/мин с контролем артериального давления, пульса и показателей времени свертывания |
| Лимфосорбция | Элиминация токсинов из крови путем ее экстракорпоральной перфузии через сорбенты | Наличие эндогенной интоксикации. Оказывает стойкий детоксикационный эффект, способствует качественному улучшению дренажной функции лимфатической системы и эвакуации дегенеративно–воспалительных элементов из зоны воспаления и некроза, повышает уровень основных иммуноглобулинов | Происходит естественная потеря форменных элементов, имеющихся в лимфе, в частности лимфоцитов, т.е. длительная лимфосорбция дополнительно угнетает иммунные реакции организма, что требует обязательной иммунокоррекции | Лимфа, полученная наружным дренированием грудного лимфатического протока, который выделяется на протяжении 1,5 см, берется на лигатуры и катетеризируется. Катетер, чаще диаметром до 0,8 см, вводится против тока лимфы без усилий на 0,7–1 см и фиксируется в бесклапанной зоне протока. После дренирования и получения первых порций лимфы для стимуляции лимфооттока проводят инфузионную терапию гипертоническими дезагрегантами |
| Плазмаферез | Замена токсической плазмы свежей донорской или нативной плазмой с возвращением собственных форменных элементов в кровеносное русло | Синдром эндогенной интоксикации при распространенном перитоните или сепсисе. Позволяет в кратчайший срок удалить из организма больного большинство продуктов патологических метаболических процессов. Способствует выраженному уменьшению содержания средних молекул, некротических тел, циркулирующих иммунных комплексов и протеолитической активности крови | Не отмечено | Пламаферезу должна предшествовать инфузионная терапия с целью создания умеренной гемодилюции для выведения токсинов в кровеносное русло. Эксфузию крови осуществляют из периферических катетеризированных вен без гепаринизации в полимерные контейнеры «Гемакон 500» или «Гемакон 500/300».В процессе плазмафереза заменяют около 2 л плазмы, при этом контролируют показатели гемодинамики, величину гематокрита и количество эритроцитов. При тяжелом интоксикационном синдроме сеансы плазмафереза проводят ежедневно в течение первых 4–5 дней |
| Ультрафиолетовое облучение аутокрови (УФО) | Фотомодификация крови в результате УФО | Гнойная интоксикация. Улучшает реологические свойства крови, функцию сердечно–сосудистой системы, снижает концентрацию средних молекул, циркулирующих иммунных комплексов, опосредованно улучшает перистальтику кишечника | Не отмечено | 100–150 мл крови вводят во флакон с консервантом, в течение 20 мин облучают ультрафиолетом и оксигенируют, затем реинфузируют больной |
| Гипербарическая оксигенация (ГБО) | Ликвидация или уменьшение всех форм кислородной недостаточности организма | Гнойная интоксикация. В результате воздействия на все виды гипоксии улучшается функция сердечно–сосудистой системы, печени, почек, кишечника. Непосредственно воздействует на ряд лактогенов (анаэробные кокки, кишечную, синегнойную палочку), стимулирует иммунитет | Не отмечено | Сеансы длительностью 45–60 мин в барокамере «Ока–2» в режиме 1,5–2 атм. |
Последние комментарии
7 часов 2 минут назад
15 часов 53 минут назад
15 часов 56 минут назад
2 дней 22 часов назад
3 дней 2 часов назад
3 дней 4 часов назад