Глазные болезни [Валентина Григорьевна Копаева] (fb2) читать онлайн
[Настройки текста] [Cбросить фильтры]
[Оглавление]
Коллектив авторов
Аветисов Эдуард Сергеевич – доктор мед. наук, профессор, заслуженный деятель науки РФАветисов Сергей Эдуардович – доктор мед. наук, профессор, директор НИИ глазных болезней РАМН, заведующий кафедрой глазных болезней Московской медицинской академии им. И. М. Сеченова
Белоглазов Владимир Георгиевич – доктор мед. наук, профессор, главный научный сотрудник отдела реконструктивной хирургии НИИ глазных болезней РАМН
Бровкина Алевтина Федоровна – доктор мед. наук, профессор, член–корреспондент РАМН, заслуженный деятель науки РФ, руководитель отдела офтальмоонкологии, радиологии Московского НИИ глазных болезней им. Гельмгольца
Волков Вениамин Васильевич – доктор мед. наук, профессор, почетный член РАЕН, действительный член РАМТН и ЛАН, лауреат Государственной премии СССР, заслуженный деятель пауки РФ, Герой Социалистического Труда
Груша Ярослав Олегович – канд. мед. наук, ассистент кафедры глазных болезней ММА им. И. М. Сеченова
Гундорова Роза Александровна – доктор мед. паук, профессор, член–корреспондент РАЕН, заслуженный деятель науки и заслуженный врач РФ, руководитель отдела травм, восстановительной и пластической хирургии и глазного протезирования Московского НИИ глазных болезней им. Гельмгольца
Даниличев Владимир Федорович – доктор мед. паук, профессор, заслуженный деятель науки РФ, начальник научно–исследовательской лаборатории микрохирургии глаза и контактной коррекции зрения при кафедре офтальмологии Военно–медицинской академии
Дога Александр Викторович – канд. мед. наук, заместитель Генерального директора МНТК "Микрохирургия глаза"
Егоров Евгений Алексеевич – доктор мед. наук, профессор, действительный член РАЕН и РАМТН, лауреат премии Правительства РФ, заведующий кафедрой глазных болезней лечебного факультета Российского государственного медицинского университета
Ивашина Альбина Ивановна – доктор мед. наук, профессор, лауреат премии Ленинского комсомола в области пауки и техники, руководитель отдела рефракционной хирургии глаза МНТК "Микрохирургия глаза"
Кащенко Тамара Павловна – доктор мед. наук, профессор, руководитель отдела охраны зрения детей Московского НИИ глазных болезней им. Гельмгольца
Киваев Анатолий Александрович – доктор мед. паук, профессор, руководитель отдела контактной коррекции зрения Московского НИИ глазных болезней им. Гельмгольца
Копаева Валентина Григорьевна – доктор мед. наук, профессор, действительный член ЛАН, лауреат академической премии им. К. Л. Чижевского, директор Научно–педагогического центра МНТК "Микрохирургия глаза”
Копаев Сергей Юрьевич – канд. мед. паук, заведующий операционным блоком МНТК "Микрохирургия глаза"
Либман Елена Соломоновна – доктор мед. паук, профессор, заслуженный деятель науки, действительный член РАЕН и РАМТН, руководитель отдела Федерального центра экспертизы и реабилитации инвалидов
Майчук Юрий Федорович – доктор мед. наук, профессор, заслуженный деятель пауки РФ, действительный член Международной академии информатики, директор Сотрудничающего центра ВОЗ, руководитель отдела инфекционных и аллергических заболеваний Московского НИИ глазных болезней им. Гельмгольца
Максимов Игорь Борисович – доктор мед. наук, профессор, заслуженный врач РФ, главный офтальмолог Главного Военного клинического госпиталя им. Н. Н. Бурденко, профессор кафедры глазных болезней Российской медицинской академии последипломного образования
Мизгирева Алевтина Петровна – канд. мед. паук, доцент кафедры офтальмологии Российской медицинской академии последипломного образования
Мошетова Лариса Константиновна – доктор мед. паук, профессор, член–корреспондент РАМН, лауреат премии Правительства РФ, ректор Российской медицинской академии последипломного образования
Нестеров Аркадий Павлович – доктор мед. паук, профессор, действительный член РАМН, заслуженный деятель пауки РФ
Саксонова Елена Олимпиевна – канд. мед. наук, старший научный сотрудник лаборатории микрохирургии глаза Российского государственного медицинского университета
Семенов Александр Дмитриевич – доктор мед. паук, заслуженный врач РФ, действительный член ЛАН
Серова Наталья Константиновна – доктор мед. наук, заведующая отделением офтальмологии НИИ нейрохирургии им. акад. Н. И. Бурденко РАМН
Слепова Ольга Семеновна – доктор биол. наук, профессор, главный научный сотрудник лаборатории иммунологии и вирусологии Московского НИИ глазных болезней им. Гельмгольца
Сомов Евгений Евгеньевич – доктор мед. наук, профессор, член–корреспондент Петровской академии паук и искусств, заведующий кафедрой глазных болезней Санкт–Петербургской педиатрической медицинской академии
Тахчиди Христо Периклович – доктор мед. наук. Генеральный директор МНТК "Микрохирургия глаза", профессор кафедры глазных болезней Московского государственного медико–стоматологического университета
Шамшинова Анжелика Михайловна – доктор мед. наук, профессор, главный научный сотрудник Московского НИИ глазных болезней им. Гельмгольца
Ярцева Нонна Сергеевна – канд. мед. наук, доцент кафедры глазных болезней Московского государственного медико–стоматологического университета
Предисловие
Каждый новый век, имея новые идеи, приобретает новые глаза.В учебнике "Глазные болезни" представлены систематизированные данные по основным разделам офтальмологии с учетом последних достижений в этой области медицины. Можно сказать, что это фундамент и некоторые линии горизонта в данной специальности.Г. Гейне
Материал в учебнике изложен согласно общепринятому плану в анатомической последовательности. Изучение болезней невозможно в отрыве от знаний топкого строения и функций соответствующих частей глаза. Не зная нормального строения, нельзя распознать патологию. Для удобства изучения каждой темы (с учетом небольшого общего количества часов, отведенных в учебной программе изучению глазных болезней) во всех разделах вначале приведено описание нормальных анатомо–физиологических особенностей оболочки или части оптической системы глаза, а затем рассмотрены возможные аномалии развития, виды патологии и общие принципы лечения.
Для того чтобы при изучении частных вопросов сохранилось общее представление об органе зрения, в разделе, посвященном анатомии глаза, представлены строение зрительного анализатора в целом, его иннервация и кровоснабжение, а также взаимосвязь с придаточным аппаратом глаза.
Учебник написан в соответствии с программой изучения глазных болезней в медицинских вузах страны. Последовательность изложения материала в нем такова, что изучение первых глав помогает усвоению последующих. Основное внимание уделено часто встречающимся видам патологии. В копне каждой главы приведены вопросы для самоконтроля усвоения основных положений, рассмотренных в ней.
Врач любой специальности должен научиться диагностировать патологию глаза, при которой требуется неотложная помощь, принимать необходимые меры, уметь использовать глазные симптомы в диагностике других заболеваний.
В написании учебника приняли участие ведущие педагоги и ученые–офтальмологи России. Коллектив авторов стремился к тому, чтобы учебник был достаточно кратким и вместе с тем содержал сведения о последних достижениях в офтальмологии, в частности глазной хирургии, в том числе лазерной, а также о возможностях новых методов диагностики и лечения глазных болезней.
Учебник иллюстрирован красочными рисунками, схемами и фотографиями, содержащими надписи на поле рисунков, что существенно сокращает время их изучения и делает рисунки более доходчивыми. В учебнике использованы некоторые иллюстрации из предыдущих изданий учебника Т. И. Брошевского и А. А. Бочкаревой с согласия автора рисунков проф. Б. Ф. Черкупова.
Учебник предназначен для студентов медицинских факультетов высших учебных заведений. Кроме того, ом будет полезен врачам–офтальмологам при прохождении интернатуры и в первые годы их практической деятельности.
Все замечания и конструктивные предложения по совершенствованию учебника будут приняты авторами с благодарностью.
Профессор В. Г. Копаева
Глава 1. Краткая история развития офтальмологии
Из всех органов чувств человека глаз всегда признавался наилучшим даром и чудеснейшим произведением творческой силы природы.Офтальмология – наука об органе зрения (глаз – лат. oculus, греч. ophthalmos) и его заболеваниях – зародилась в глубокой древности. До наших дней дошли высеченные на надгробном камне имя и изображение Пени Анк Ири – одного из целителей, лечивших глазные болезни, который жил в Египте еще в середине II тысячелетия до пашей эры.Г. Гельмгольц
Письменные памятники древних цивилизаций Египта, Вавилона, Индии, Китая, Греции и Рима свидетельствуют о том, что медикам и жрецам уже тогда были известны такие болезни глаз, как катаракта и фистула слезного мешка, и способы их лечения.
На рубеже нашей эры величайшие врачи античности Гиппократ и Гален определили развитие европейской медицины па несколько столетий вперед. Вплоть до VIII–IX вв. во многих странах пользовались их рекомендациями по лечению заболеваний глаз.
В период расцвета культуры арабских халифатов (IX–XIV вв.) появились первые фундаментальные руководства, в которых был обобщен опыт выдающихся арабских врачей времен античной медицины в области офтальмологии: "Сокровище оптики" Ибн Аль–Хайсама (Альгазепа) и "Книга о глазе в 10 беседах" Хунаины бен Исхака.
Большую роль в развитии офтальмологии сыграл "Медицинский канон", написанный в начале II тысячелетия нашей эры выдающимся таджикским философом, ученым, поэтом и медиком Ибн Синой (Авиценной). Ему удалось изложить офтальмологию той эпохи в наиболее полном и систематизированном виде. В течение пяти веков "Канон" являлся важнейшим руководством для медиков. Он был переведен на латинский язык, а с появлением книгопечатания выдержал более 30 изданий.
В средневековье авторитет выдающихся ученых древности оставался непререкаемым, поэтому вплоть до XVIII в. медицина в Европе развивалась крайне медленно. В этот период исключительно важную роль в развитии офтальмологической пауки сыграли работы выдающегося астронома Иоганна Кеплера, заложившего к 1604 г. основы современной экспериментальной оптики. Ученый впервые стал рассматривать глаз как оптическую систему, позволяющую получать на сетчатке обратное уменьшенное изображение объектов внешнего мира. И. Кеплер определил сущность близорукости и дальнозоркости, объяснил действие не только положительных, но и отрицательных линз. Результаты его исследований опровергли вековые заблуждения ученых, утверждавших, что органом зрения и световосприятия является только хрусталик глаза.
Так, в 1708 г. Королевская академия паук в Париже па основании доклада Бриссо официально признала возможность зрения без участия хрусталика. Спустя 40 лег соотечественник Бриссо Жак Давиэль впервые доказал возможность восстановления зрения после удаления из глаза больного помутневшего хрусталика (катаракты). Следует уточнить, что до этого на притяжении многих веков помутневший хрусталик не извлекали из глаз, а проталкивали (реклинировали) в стекловидное тело.
В 50–60–е годы XIX столетия на смену эмпирической пришла научная офтальмология. Так, в 1862 г. Снеллен предложил табличный метод определения остроты зрения, основанный на оценке минимального зрительного угла. Франс Дочдерс в 1864 г. создал стройное учение об аномалиях рефракции и аккомодации. В 1851 г. Герман Гельмгольц изобрел офтальмоскоп и разработал основы новой науки – физиологической оптики. Этот ученый, прошедший яркий жизненный путь от эскадронного хирурга до руководителя кафедры физиологии в Гейдельберге и в то время крупнейшей в мире кафедры физики в Берлине, сделал очень много для развития офтальмологии. Он является создателем первого офтальмоскопа и офтальмометра, а также ставших классическими теорий аккомодации и цветовосприятия. По меткому выражению А. Н. Маклакова, изобретением офтальмоскопа Г. Гельмгольц "...если не создал, то возродил офтальмологию". В настоящее время имя Г. Гельмгольца носят клиники и институты в разных странах мира.
Становление клинической офтальмологии справедливо связывают с именем Альбрехта Грефе. В возрасте 26 лет (в 1854 г.) он основал первый в мире офтальмологический журнал, до сих пор носящий его имя и являющийся одним из лучших журналов по офтальмологии. Многие работы А. Грефе открыли новые страницы офтальмологии. Так, он сформулировал кардинальную симптоматику глаукомы, ввел в клиническую практику периметрию, создал учение о глазных мышцах и их патологии, дал описание множества изменений на глазном дне, характерных для различных заболеваний, в том числе обтурации центральной артерии сетчатки. А. Грефе разработал ряд новых глазных операций и изобрел инструменты для их выполнения. Он впервые произвел успешную операцию по избавлению больного от острого приступа глаукомы. В Берлине установлен и до сих пор бережно охраняется оригинальный памятник А. Грефе: по правую руку от фигуры ученого из гранита высечена символическая группа страждущих, а по левую – ликующая толпа прозревших и благодарных своему исцелителю людей.
Значительный вклад в развитие мировой офтальмологии в XIX столетии был сделан нашими соотечественниками, учениками А. Грефе, основавшими собственные офтальмологические школы в Санкт–Петербурге (Э. А. Юнге) и Москве (Г. И. Браун). В 1862 г. Г. И. Браун написал первое ’’Руководство к глазным болезням”.
В то время в отсталой России свирепствовали инфекционные заболевания, вызывающие слепоту (оспа, трахома, гонобленнорея). Положение слепых было поистине ужасным, что нашло яркое отражение в произведениях искусства и литературы того времени (например, картина "Слепцы" художника Н. Л. Ярошенко, повесть "Слепой музыкант В. Г. Короленко и др.). Благодаря пожертвованиям ряда прогрессивных деятелей того времени, в том числе некоторых членов царской семьи, а также высокопоставленных чиновников и представителей русской медицины, были открыты первые благотворительные специализированные глазные больницы. 11 февраля 1805 г. "Московские ведомости" сообщили об открытии "особой больницы для лечения страждущих глазами при клиническом институте Московского университета под смотрением доктора и профессора Ф. А. Гильтебранта". Это была первая в мире специализированная глазная больница (сгорела во время пожара в 1812 г.). Восстановленную больницу возглавил профессор Г. Н. Браун. Аналогичная глазная лечебница была создана в Санкт–Петербурге в 1806 г.
Развитию офтальмологии в России в огромной мере содействовала и организация самостоятельных кафедр офтальмологии в высших медицинских учебных заведениях. Первая такая кафедра в России и вторая (после венской) в мире была создана в 1818 г. в Медико–хирургической академии Санкт–Петербурга (ныне Военно–медицинская академия). Кафедру возглавил воспитанник венской школы, ученик И. Беера Иосиф (Осип) Груби. При его активном участии Санкт–петербургскими оптиками был создан первый в стране набор пробных очковых стекол. Вслед за петербургской были открыты кафедры офтальмологии на медицинских факультетах Московского, Харьковского, Казанского, Киевского и других университетов. Лекции по глазным болезням читали хирурги и физиологи.
Важным поводом для создания в России первой самостоятельной кафедры глазных болезней именно в Медико–хирургической академии послужило массовое распространение в войсках после окончания войны с Наполеоном эпидемических конъюнктивитов и трахомы, названных тогда египетскими болезнями глаз. В конце XIX – начале XX в. по инициативе профессора Медико–хирургической академии Л. Г. Беллярминова и под руководством его многочисленных учеников (С. В. Очаповского на Кавказе, Д. Н. Данилова в Средней Азии и др.) для борьбы со слепотой от трахомы создавались "летучие глазные отряды". Действуя в рамках программы Общества попечительства о слепых, созданного в 1881 г. под покровительством императрицы Марии Александровны (матери Николая II), врачи из этих отрядов выезжали в "затрахомленные" районы страны, оказывали больным непосредственную помощь и, что особенно важно, обучали медицинских работников, способствовали открытию глазных стационаров на местах. За 20 лет своей профессиональной деятельности врачи 527 "летучих отрядов" приняли более 1 млн больных и сделали более 300 тыс. операций на глазах. Первым председателем Общества попечительства о слепых был К. К. Грот (1815–1897) – выпускник Царскосельского лицея. Его бюст, установленный в петербургской школе для слабовидящих детей, сохранился до настоящего времени. У подножья памятника скульптор изваял слепую девочку, читающую книгу пальцами рук по азбуке Брайля.
В дореволюционное время основателями офтальмологических школ в нашей стране были профессора Е. В. Адамюк (Казанский университет), А. Н. Маклаков и А. А. Крюков (Московский университет), В. И. Добровольский и Л. Г. Беллярминов (ученики Э. А. Юнге, Медико–хирургическая академия), А. В. Иванов и А. В. Ходин (Киевский университет), Л. Л. Гиршман (Харьковский университет) и др. Все они были прогрессивными общественными деятелями и учеными с мировым именем, которые внесли большой вклад в развитие отечественной офтальмологии. Ниже приведены краткие сведения о наиболее известных российских ученых–офтальмологах, творивших на рубеже XIX–XX вв.
Е. В. Адамюк (1839–1908) известен работами по изучению влияния симпатической иннервации на внутриглазное кровообращение и офтальмотонус. Он автор ряда руководств, основоположник Казанской школы офтальмологов.
A. И. Маклаков (1837–1895) – создатель аппланационной тонометрии, остающейся и в настоящее время одним из наиболее простых и точных способов измерения внутриглазного давления. Один из организаторов Московской школы офтальмологов.
B. Я. Добровольский с 1882 по 1893 г. возглавлял кафедру офтальмологии в Петербургской медико–хирургической академии; выполнил фундаментальные работы по изучению рефракции и аккомодации глаза; открыл хрусталиковый астигматизм и возможность самокоррекции за счет неравномерной аккомодации. Всех обучавшихся в это время на кафедре снабжали офтальмоскопами. Один из основателей Петербургского офтальмологического общества.
Л. Г. Беллярминов (1859–1930) академик, крупнейший отечественный офтальмолог конца XIX – начала XX столетия, ученый с мировым именем. На притяжении 30 лет (с 1893 по 1923 г.) возглавлял кафедру глазных болезней в Петербургской медико–хирургической академии. Под его руководством выполнено свыше 100 диссертаций. Одиннадцать учеников Л. Г. Беллярминова стали профессорами и возглавили кафедры в различных вузах страны. Его вклад в науку касается практически всех областей офтальмологии, но особенно значимыми были работы по физиологической оптике и созданию объективных методов регистрации зрачковых реакций. Л. Г. Беллярминов – соавтор фундаментального руководства по офтальмологии. О значении "летучих отрядов", инициатором создания которых он был, сообщалось выше.
С. С. Головин (1866–1931) – питомец Московского университета, ученик А. Н. Маклакова и А. А. Крюкова. Переехав в 1903 г. в Одессу, он создал офтальмологическую школу Новороссийского университета. Однако его основные работы все же связаны с Московским университетом, куда он вернулся в 1911 г. В трудных условиях военного и революционного времени С. С. Головин продолжал издание журнала "Вестник офтальмологии" после А. В. Ходина и А. А. Крюкова. Главный труд его жизни – учебник "Клиническая офтальмология", по которому обучалось не одно поколение офтальмологов, – увидел свет в 1923 г.
С. С. Головин являлся почетным членом немецкого и французского офтальмологических обществ.
В начале XX в. в дореволюционной России насчитывались сотни тысяч слепых, более 1 млн больных трахомой. При этом число глазных врачей и количество специализированных коек было ничтожно малым Для такой массы больных. Так, в 1913 г. во всей России было только 209 специалистов–офтальмологов (к 1980 г. в Советском Союзе – более 15 тыс.).
С 1920 г. Наркомздрав РСФСР (а затем СССР) развернул плановую работу по борьбе со слепотой вследствие трахомы. В стране были созданы шесть самостоятельных научно–исследовательских институтов глазных болезней и сеть государственных трахоматозных диспансеров. Во всех медицинских институтах страны в обязательном порядке стали открывать кафедры глазных болезней, число которых вместе с различными глазными лабораториями приблизилось к 100.
В 30–е и последующие годы XX столетия на смену Е. В. Адамюку, Л. Г. Беллярминову, С. С. Головину, Л. Л. Гиршману и другим известным ученым–офтальмологам пришло новое поколение профессоров. Так, в Ленинградской военно–медицинской академии Л. Г. Беллярминова сменил его ученик В. Н. Долганов, а в 1–й Ленинградский медицинский институт из Казани прибыл В. В. Чирковский – ученик Е. В. Адамюка. Другой его ученик К. X. Орлов возглавил кафедру в Ростове–на–Дону. В Москве руководителем кафедры 1–го Московского медицинского института стал В. П. Одинцов – воспитанник А. Н. Маклакова и А. А. Крюкова, а другие их ученики – М. И. Авербах и В. П. Филатов – возглавили вновь созданные глазные институты соответственно в Москве и Одессе.
Однако особенно "плодовитой" была все же школа Л. Г. Беллярминова. Руководителями уже существовавших и вновь открываемых кафедр офтальмологии были избраны в Киеве А. Г. Васютинский, в Томске – С. В. Лобанов, в Смоленске – А. С. Чемолосов, в Омске – А. А. Бугаев, в Днепропетровске – И. И. Казас, в Краснодаре – С. В. Очаповский, в Варшаве – К. Ноишевский, в Таллине – А. Я. Поппен, в Ленинграде – Н. И. Адогский, Я. В. Зеленковский, А. В. Лотин, В. Н. Долганов. Пост главного офтальмолога страны в течение многих лет занимал также один из учеников Л. Г. Беллярминова – А. С. Савваитов. В это время в процессе преподавания офтальмологии наряду с учебниками С. С. Головина, Л. Г. Беллярминова и А. И. Мерца стали использовать прекрасный учебник В. П. Одинцова, сменивший учебник А. Л. Крюкова в преподавании глазной хирургии обращались к руководству В. П. Ont нова и К. X. Орлова, а также к атлас В. Н. Долганова.
К числу наиболее крупных офтальмологов раннего советского периода справедливо относятся М. И. Авербах, В. П. Одинцов, В. П. Филатов, В. В. Чирковский, В. Н. Долганов. Более подробные сведения об эти; выдающихся ученых, внесших огромный вклад в развитие отечественной офтальмологии, представлены ниже
М. И. Авербах (1872–1944) – академик, талантливый клиницист, видный ученый и организатор в области офтальмологии в советский период. В 1936 г. организовал первый в Советском Союзе Научно–исследовательский институт глазных болезней, бессменным директором которого являлся до конца жизни. Одновременно руководил кафедрам» глазных болезней 2–го Медицинского государственного университета и Центрального института усовершенствования врачей. Автор блестящих по форме и глубоких по содержанию научных трудов офтальмологические очерки" и др.). М. И. Авербахом была создана крупнейшая в стране офтальмологическая школа, отличительной чертой которой было сочетание фундаментальных научных исследований с клиническими работами, что способствовало изучению патогенеза различных заболеваний органа зрения и разработке новых методов их профилактики и лечения.
В. П. Одинцов (1876–1938) приступил с заведованию кафедрой глазных болезней 1–го Московского медицинского института в 1917 г. Талантливый педагог и блестящий клиницист, он организовал преподавание в лучших традициях отечественной медицины. Не случайно созданный им учебник по глазным болезням выдержал несколько изданий и в течение многих лет считался лучшим. Совместно : профессором К. X. Орловым им написано руководство по глазной хирургии.
В.П. Филатов (1875–1956) – академик, Герой Социалистического Труда, необыкновенно одаренный и разносторонне образованный ученый, часы досуга отдававший живописи и поэзии. Создатель и руководитель всемирно известного Одесского научно–исследовательского института глазных болезней, который носит его имя. В. П. Филатовым усовершенствованы методы пластических операций с использованием круглого стебля, разработаны и обоснованы способы тканевой терапии, а также методы консервирования и пересадки роговины, что с 1932 г. открыло новую эпоху в пластической хирургии и определило ее развитие на десятки лет вперед.
В. В. Чирковский (1875–1956) – действительный член АМН СССР, организатор и руководитель первого в Советском Союзе Научно–исследовательского трахоматозного института в Казани. С 1929 г. и в течение двух последующих десятилетий он руководил кафедрой офтальмологии I–го Ленинградского медицинского института имени академика И. П. Павлова. В. В. Чирковский – автор фундаментальных исследований, результаты которых обобщены в монографии "Трахома", за которую он был удостоен Государственной премии СССР.
В. Н. Долганов возглавлял кафедру офтальмологии Ленинградской военно–медицинской академии с 1923 по 1941 г. Одновременно он на несколько сроков избирался директором первого в мире Клинического института усовершенствования врачей, названного Еленинским институтом по имени великой княжны Елены Павловны, открывавшей и опекавшей многие годы это учебное заведение. В. Н. Долганов – создатель различных приспособлений для защиты глаз от повреждения мелкими осколками, создатель специальной маски, имитирующей поверхность липа, для обучения технике выполнения операций на энуклеированных глазах. Им написан ряд пособий по военной офтальмологии.
Усилиями большой армии советских офтальмологов и организаторов здравоохранения под научно–методическим руководством директора Московского научно–исследовательского института глазных болезней им. Гельмгольца А. В. Рославцева и группы сотрудников – Т. И. Воиновой, Н. Д. Зацепиной, 3. Т. Дюдиной, а также Н. С. Зайцевой и A. А. Шаткина, работавших под руководством академика М. П. Чумакова, трахома как массовое заболевание была ликвидирована в нашей стране уже в 50–е годы.
В начале 70–х годов перед отечественной офтальмологией встала задача разработки эффективных способов борьбы с травмами глаз – важнейшими причинами слепоты. Новое поколение советских офтальмологов прежде всего должно было использовать опыт оказания помощи раненым в годы Великой Отечественной войны. Особенно значимыми для практической офтальмологии того времени стали труды Б. Л. Поляка ("Военно–полевая офтальмология” и "Повреждения органа зрения"), М. Б. Чутко ("Осколки стекла и камня в глазу"), а также работы
B. Н. Архангельского, Н. А. Вишневского, И. Э. Барбеля, А, А. Колена, Д. И. Березинской, М. Л. Краснова, В. П. Страхова, Э. Ф. Левкоевой, 3. А. Павловой–Каминской, П. Е. Тихомирова, Е. Ж. Трона, А. М. Водовозова и других ученых, получившие отражение в VII томе "Опыта советской медицины в Великой Отечественной войне 1941–1945 гг.". В связи с появлением ядерного оружия и наличием угрозы массовых лучевых и термических поражений глаз исключительную актуальность приобрели в то время работы П. И. Лебехова, FL В. Преображенского и других авторов, посвященные профилактике и лечению этих повреждений, выполненные под руководством Б. Л. Поляка. Параллельно велись исследования, касающиеся ожогов глаз, под руководством Н. А. Пучковской в Украинском научно–исследовательском институте глазных болезней и тканевой терапии. В Москве разрабатывались методы диагностики и лечения отслойки сетчатки (М. Ю. Розенблюм, Р. А. Гаркави).
Б. Л. Поляк (1899–1971), генерал–майор медицинской службы, фактически явился создателем военной офтальмологии в нашей стране. За 25 лет руководства кафедрой офтальмологии в Ленинградской военно–медицинской академии (1942–1967) он воспитал целое поколение военных офтальмологов. Б. Л. Полисом были созданы организационные основы оказания офтальмологической полоши на войне, разработаны экспертные требования к органу зрения военнослужащих. Его перу принадлежит ряд значительных трудов в области офтальмотравматологии. Ученым выполнены фундаментальные исследования в области патологии слезоотведения, изучения различных аспектов глаукомы и физиологической оптики.
A. Я. Самойлов (1897–1979) возглавил кафедру 1–го Московского медицинского института после смерти своего учителя З. П. Одинцова. Разносторонность научных интересов А. Я. Самойлова (глаукома, туберкулез, проблемы нейроофтальмологии) отразилась и на выборе направлений научной деятельности многих его учеников – профессоров А. Б. Кацнельона, Н. Е. Браунштейна, Н. С. Азарозов, А. Н. Добромыслова, Д. И. Березинкой, Д. С. Каминского и др.
B. Н. Архангельский (1897–1973) – ученик В. П. Одинцова, последовательно развивавший морфологические исследования в офтальмологии. Он был главным Редактором пятитомного руководства по офтальмологии, автором дважды издававшегося учебника но глазным болезням, удостоен премии М. И. Авербаха за монографию "Морфологические основы офтальмоскопической диагностики". В течение 20 лет В. Н. Архангельский был редактором журнала "Вестник офтальмологии” и председателем Всесоюзного общества офтальмологов.
Н. А. Пучковская (1908–2001) в конце Великой Отечественной войны работала фронтовым окулистом. После демобилизации из армии она получила приглашение в Одесский институт глазных болезней, где со временем вошла в число лучших учеников академика В. П. Филатова и вскоре стала действительным членом АМН СССР. Возглавив после его смерти институт, Н. А. Пучковская успешно развивала все традиционные направления деятельности института и в первую очередь способствовала совершенствованию кератопластики и других методов лечения ожоговых поражений глаз различной этиологии. Она была избрана депутатом Верховного Совета СССР и Украины, удостоена звания Герой Социалистического Труда. В рамках содружества городов–побратимов Одессы и Генуи она наладила регулярные деловые контакты между итальянскими и украинскими коллегами. В руководимом Н. Л. Пучковской институте грудились такие известные ученые, как В. В. Войно–Ясенецкий, В. Е. Шевалев, С. Ф. Кальфа, Д. Г. Бушмич, Т. У. Горгиладзе, И. Т. Ершкович, Н. Г. Гольдфельд и др.
В 70–е годы на первый план среди офтальмологических проблем наряду с травматическими поражениями глаз выхолит глаукома как одна из главных причин слепоты. В этот период ученые–офтальмологи проводят массовую диспансеризацию населения, одним из инициаторов которой был Б. В. Протопопов, осуществляют исследования по изучению патогенеза и созданию методов диагностики глаукомы (М. Я. Фрадкин, М. Б. Вургафт, А. Я. Виленкина В. И. Козлов и др.), разрабатывают новые операции, в частности на микрохирургическом уровне, готовят профессиональные кадры. За проведение работ в этой области офтальмологии профессорам Т. И. Брошевскому, М. М. Краснову и А. П. Нестерову была присуждена Государственная премия СССР. В союзных и автономных республиках СССР создаются национальные офтальмологические школы (П. С. Плитас, Н. А. Пучковская, Т. В. Бирич, Э. И. Дактаравичене, Г. Р. Дамбите, Л. X. Шоттер, С. К. Каранов, М. К. Камилов, Н. Г. Храмелашвили, И. А. Сихарулидзе, Д. Н. Антелава, Г. А. Ульданов, У. X. Мусабейли, 3. А. Алиева, Р. Г. Кудояров и др.). В стране была создана сеть противотуберкулезных офтальмологических учреждений и санаториев (А. Я. Самойлов, А. А. Суконщикова и др.), сформирована нейроофтальмологическая служба (И. И. Меркулов, А. Я. Самойлов, Е. Ж. Трон и др.), идет подготовка детских офтальмологов (Л. А. Дымшиц, В. И. Григорьева и др.), развивается и совершенствуется ультразвуковая диагностика (Ф. Е. Фридман, Р. К. Мармур и др.) и офтальмоиммунология (Н. С. Зайцева, Н. С. Шульгина и др.). Как самостоятельные разделы науки выделены офтальморентгенология (М. М. Балтин, Е. С. Вайнштейн), охрана зрения детей (Э. С. Аветисов, Е. М. Белостоцкий, Т. И. Сергиевский и др.), офтальмотрансплантология, офтальмогеронтология (Н. А. Пучковская), лазерная офтальмология, офтальмоонкология. Ученые–офтальмологи продолжают начатые еще в XIX в. А. В. Ивановым фундаментальные исследования в области офтальмоморфологии (Э. Ф. Левкоева, В. Н. Архангельский) и офтальмофизиологии, в том числе физиологической оптики (С. В. Кравков, А. И. Богословский, Е. Н. Семеновская, И. П. Кричагин, Е. Б. Рабкин, А. И. Дашевский и др.). Широкое распространение получает контактная коррекция зрения, завоевывают популярность рефракционные операции (С. Н. Федоров и др.).
Офтальмохирургические отделения и центры развиваются в отдаленных регионах России: во Владивостоке (М. В. Зайкова), в Новосибирске (А. А. Колен), Красноярске (М. А. Дмитриев, П. Г Макаров), Иркутске (З. Г. Франк–Каменецкий), Свердловске (P. X. Микаэлян), Перми (И. Г. Ершкович и Н. Г. Гольдфельд), Новокузнецке (О. И. Шершевская, Г. Л. Старков), Челябинске (А. Б. Кацнельсон), Краснодаре (С. В. Очаповский, Н. А. Юшко), Астрахани (Н. И. Артемьев) и др.
В этих преобразованиях заметную роль сыграл член–корреспондент АМН СССР, Герой Социалистического Труда, профессор Т. И. Брошевский, создавший представительную школу офтальмологов под стать школе Л. Г. Беллярминова. Ученики Т. И. Брошевского возглавили кафедры глазных болезней во многих городах страны: В. Г. Абрамов в г. Иванове, А. П. Нестеров в Казани, а затем в Москве, С. Н. Федоров в Архангельске, а затем в Москве, А. А. Бочкарева в Ростове–на–Дону, С. Б. Стукалов в Воронеже, Б. Ф. Черкунов в Рязани, Д. С. Кроль в Курске, В. А. Мачехин в Куйбышеве, а затем в Тамбове, В. М. Малов в Куйбышеве, Н. М. Савушкина в Чите.
Продолжая исследования, которые проводили его учителя К. А. Юдин и В. П. Филатов, Т. И. Брошевский много внимания уделял изучению проблем кератопластики и консервирования роговицы. Вместе с учениками ему удалось создать системы для длительного храпения роговицы с использованием глицерина и γ–глобулина в качестве криопротекторов. Т. И. Брошевский был первым офтальмологом в СССР, успешно проводившим хирургическое лечение врожденной глаукомы у детей с помощью гониопупктуры. При научных консультациях Т. И. Брошевского защищено более 20 докторских диссертаций.
Один из учеников Т. И. Брошевского академик РАМН и РАЕН, член–корреспондент РАН, профессор, Герой Социалистического Труда С. Н. Федоров (1927–2.000) занимает особое место в истории не только советской, но и мировой офтальмологии. В 1968 г. на базе курса глазных болезней он организовал кафедру офтальмологии в Московском медицинском стоматологическом институте (в настоящее время – Московский государственный медико–стоматологический университет), которую возглавлял до последних дней своей жизни. С. Н. Федоров дал импульс развитию сразу нескольких основополагающих направлений, без которых немыслима современная офтальмология. Он способствовал широкому распространению в нашей стране и за рубежом операций по имплантации искусственного хрусталика после удаления катаракты, усовершенствовал эту операцию и сделал ее массовой. Фундаментальные труды С. Н. Федорова по проблемам кератопротезирования, глаукомы, атрофий зрительного нерва, витреоретинальной хирургии стали классикой мировой офтальмологии. Он основоположник рефракционной и лазерной хирургии в офтальмологии.
С. Н. Федоров ввел в практику здравоохранения новые организационые формы работы: бригадный метод, арендный подряд, оплату по труду вместо единой для всех "тарифной ставки", передвижные диагностические и хирургические клиники (автобус, корабль, филиалы за рубежом). В советский период при бесплатной медицинской помощи в клинике, которую возглавлял С. Н. Федоров, производили около 600 операций в день. Разработанные С. Н. Федоровым конвейерные диагностические и операционные линии позволяли четко выполнять работу такого объема с одинаково высоким качеством.
Растущая слава искусного офтальмохирурга, изобретателя и организатора привлекли к нему внимание правительства страны. В конце 1985 г. в СССР для быстрого и эффективного внедрения передовых технологий были созданы межотраслевые научно–технические комплексы в разных областях науки и отраслях промышленности. С. Н. Федоров возглавил Межотраслевой научно–технический комплекс (МНТК) "Микрохирургия глаза”, который в настоящее время носит его имя, организовал в 12 городах России хорошо оснащенные современным оборудованием филиалы, ставшие центрами микрохирургии в регионах и показавшие свою жизнеспособность в самые трудные кризисные периоды. В последние годы жизни С. Н. Федоров активно проявил себя также как общественный деятель: был депутатом Государственной Думы России, баллотировался на пост президента России, создал политическую "Партию самоуправления трудящихся".
Следует отметить, что постсоветский период в истории российской офтальмологии характеризуется ослаблением связей с коллегами из республик бывшего Советского Союза. В Россию "ворвались" мощные зарубежные фирмы, заполонив фармацевтический рынок мало доступными для многих по цепе лекарственными препаратами, контактными линзами, очками. Наряду с сохранившейся системой государственных глазных клиник, в том числе МНТК "Микрохирургия глаза" с его филиалами, возникла обширная сеть мелких частных клиник. Широкое распространение получили рефракционные операции с использованием эксимерлазерной энергии. В новой системе организации здравоохранения значительный ущерб был нанесен профилактической направленности медицины, в том числе в офтальмологии.
Несмотря на это, развитие научных исследований и создание новых хирургических технологий продолжаются: совершенствуется методика ультразвуковой факоэмульсификации, создана технология лазерного удаления катаракты с введением в полость глаза эластичных хрусталиков через небольшие разрезы, благодаря чему не требуется герметизации их швами; приоткрывается завеса над механизмом развития глаукомы без явных признаков основного симптома заболевания – глазной гипертензии. Ранняя, "донозологическая", диагностика глаукомы становится реальностью благодаря использованию современных технологий исследования глазного дна при сканирующей лазерной офтальмоскопии и ретинотомографии, возможностям оценки тончайших зрительных нарушений (при компьютерной периметрии) и, наконец, применению адекватных глаукоме нагрузочных проб (по типу вакуум–периметрической).
Ученые проводят исследования с целью изучения проблемы аутотканевых конфликтов, возникающих внутри глаза при некоторых врожденных и приобретенных нарушениях мембранных барьерных функций, например в виде избыточной витреоретинальной пролиферации, ведущей к отслойке сетчатки, или патологического роста сосудов в ответ па ишемию сетчатки при диабете, у недоношенных детей, а также но другим причинам. Рождаются казавшиеся ранее фантастическими проекты пересадки сетчатки, вживления электродов в затылочные доли коры головного мозга с целью создания особого электронного зрения больным, безнадежно слепым по существующим представлениям. При этом в качестве рецепторов света и проводников поглощенной фотоэнергии используют ультразвуковые датчики и телевизионные системы.
Глава 2. Эволюция органа зрения
Посредством глаза, но не глазом смотреть на мир умеет разум.Зрительный анализатор человека сформировался в результате биологической эволюции всего живого на Земле.В. Блейк
Способностью воспринимать свет обладают растения: листья поворачиваются к свету, цветы распускаются и закрываются, подчиняясь световому режиму дня. Это – положительный гелиотропизм. Микробы, наоборот, проявляют отрицательный фототропизм.
Развитие глаза в филогенезе.
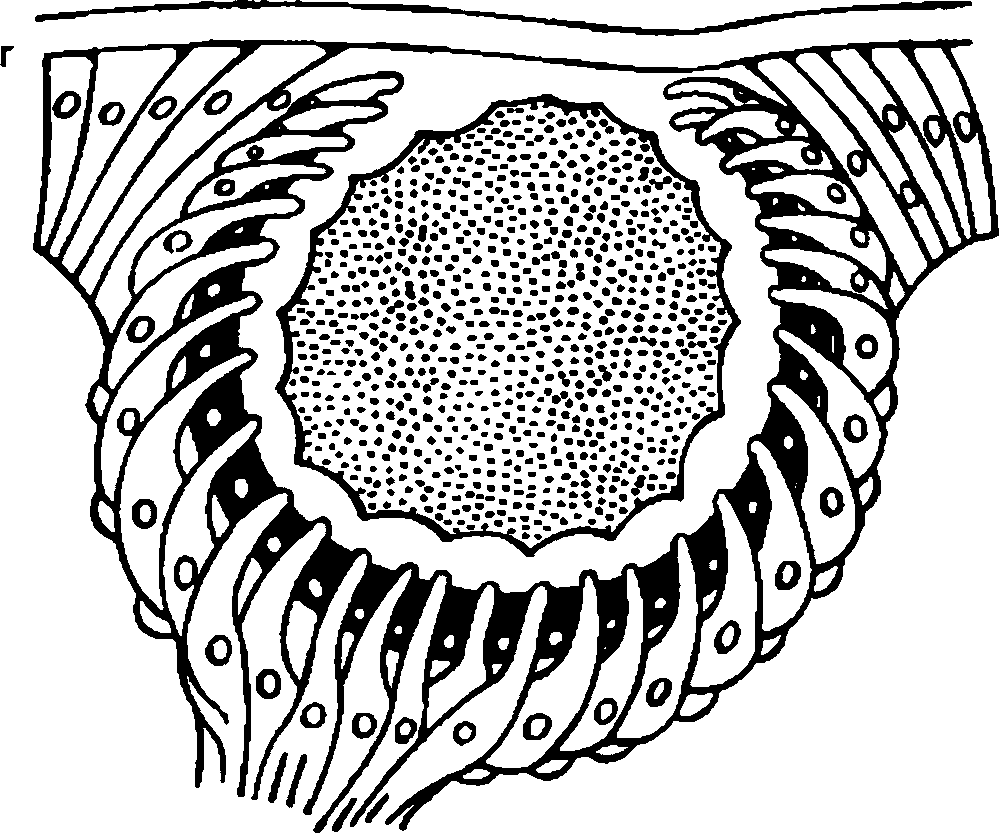
У низших животных первичные органы зрения представляют собой скопления пигмента в цитоплазме покровных клеток. У дождевых червей обособленных глаз еще нет, но многочисленные клетки эпителия обнаруживают чувствительность к свету (рис. 2.1, а). В глазу пиявок "зрительные” клетки уже объединяются в группы по 5–6 (рис. 2.1, б). Эти клетки располагаются в одной плоскости с покровом тела и имеют форму бокала. Какой–либо связи с нервными элементами эти образования еще не имеют, но они могут точно локализовать направление света.У иглокожих, в том числе у морской звезды, имеется большое количество зрительных клеток в эпителиальном покрове и обнаруживаются клетки наподобие нейроэпителиальных, отростки которых объединяются в нервный ствол. Снаружи глаз имеет форму ямки, прикрытой покровным эпителием (рис. 2.1, в).
Строение глаза кольчатых червей еще более сложно. Он имеет вид эллипсовидной полости, заполненной первичным стекловидным телом. Световоспринимающие концы нейроэпителиальных клеток глаза обращены к потоку света. Между чувствительными нейроцитами располагаются поддерживающие клетки – сустентоциты. Глаз залегает под кутикулой тела червя. Он не имеет хрусталика, но по своему строению сложнее, чем глаз пиявки и морской звезды (рис. 2.1, г).
У моллюсков, в том числе у улитки, в процессе эволюции глаз "получил" принципиально повое строение, появились более совершенные функциональные возможности. У улитки, стоящей на сравнительно низкой ступени филогенетического развития, свободные окончания световоспринимающих клеток повернулись от света к слою однорядного пигментного эпителия (рис. 2.1, д). Возникла принципиально новая система восприятия света, опосредованная через фотохимический процесс. Такая схема расположения светочувствительных элементов представляет собой инвертированный (перевернутый) тип сетчатки, который имеется у всех высших организмов, в том числе у человека.
У позвоночных в формировании глаза принимают участие не только клетки покровного эпителия и мезодермы, по и нейроэктодермальные клетки, из которых образуется головной мозг. По мере усложнения общего строения организма под влиянием изменяющихся условий внешней среды возникает связь глаза с головным мозгом, совершенствуется зрительная функция, появляетсявозможность точного восприятия предметов окружающего мира. Орган зрения обретает защитный аппарат в виде век и слезных органов (рис. 2.1, е).
 светочувствительная клетка в покровном эпителии дождевого червя
светочувствительная клетка в покровном эпителии дождевого червя
 В глазу морской звезды зрительные клетки обращены к свету, имеют нервные волокна
В глазу морской звезды зрительные клетки обращены к свету, имеют нервные волокна
 В глазу улитки светочувствительные клетки обращены к пигментному эпителию
В глазу улитки светочувствительные клетки обращены к пигментному эпителию
 Группы зрительных клеток в покровном эпителии пиявки
Группы зрительных клеток в покровном эпителии пиявки
 Полость глаза кольчатого червя заполнена стекловидным телом
Полость глаза кольчатого червя заполнена стекловидным телом
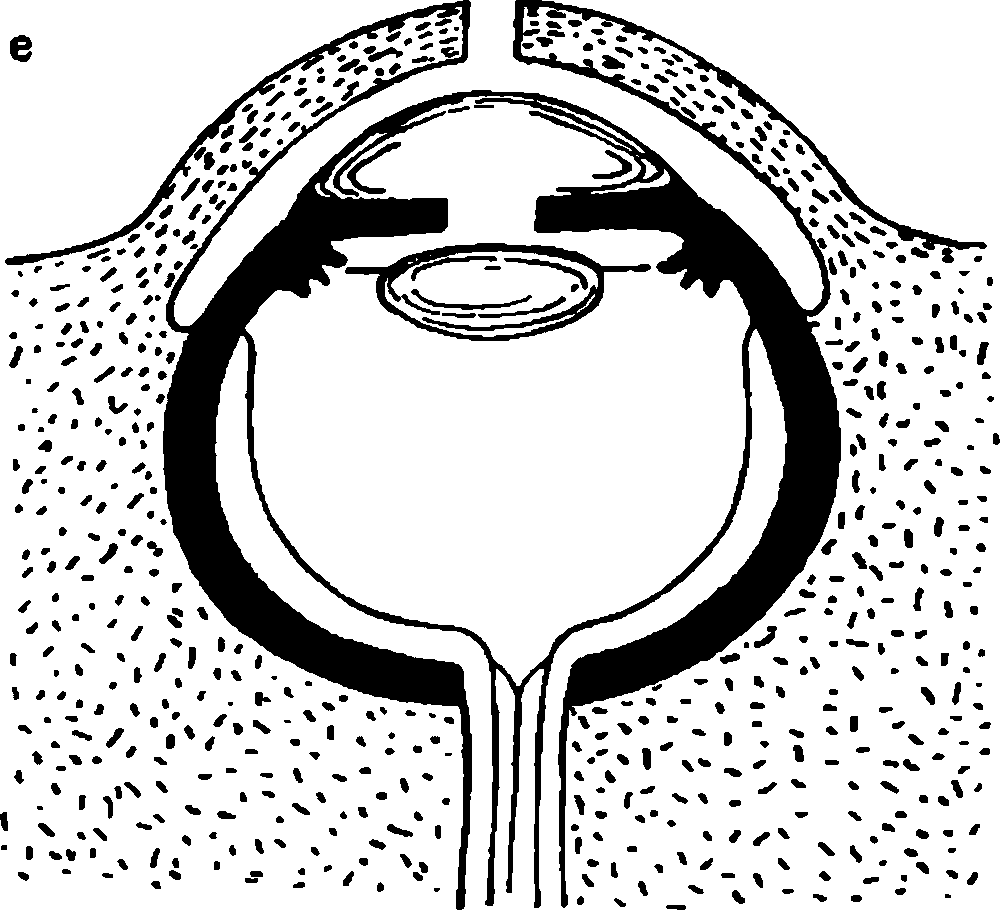 Рис. 2.1. Развитие глаза в филогенезе. Объяснение в тексте.
Рис. 2.1. Развитие глаза в филогенезе. Объяснение в тексте.
Глаз позвоночных имеет сложную оптическую систему, инвертированный тип сетчатки, защитный аппарат (веки и слезные органы)
Глаз человека как парный орган сформировался в процессе эволюции и является периферической частью зрительного анализатора. Отдельно сформировались проводящие пути, включающие зрительные нервы, хиазму и два зрительных тракта. Третья важнейшая часть зрительного анализатора человека возникла в виде подкорковых центров и корковых образований в затылочной доле большого мозга, в области ее шпорной борозды. Зрительный анализатор человека воспринимает световую энергию в диапазоне от 380 до 800 нм, определяет направление света, его энергию, спектральный состав и поляризацию световых волн в указанном диапазоне.
В филогенетическом аспекте самой первой, наиболее древней функцией органа зрения является светоощушение, наиболее сложной – психофизиологическая функция бинокулярного зрения. В процессе эволюции она появилась позднее других зрительных функций и отмечается только у приматов. Этому способствовала анатомическая особенность строения черепа – два глаза расположены в одной фронтальной и одной горизонтальной плоскостях, Поля зрения правого и левого глаза стали совмещаться.
Развитие и совершенствование зрительного анализатора человека происходили в процессе эволюции па протяжении тысячелетий (филогенетическое развитие) и осуществляются в индивидуальном эмбриогенезе на основе общего биогенетического закона (онтогенетическое развитие). В 1866 г. немецкий зоолог Геккель сформулировал общебиологический закон: онтогенез есть быстрое и краткое повторение филогенеза.
Развитие глаза человека в онтогенезе.
Зачатки глаза у зародыша человека появляются очень рано. Они возникают из той же части эктодермальной бороздки, из которой затем развиваются мозговые пузыри и формируется головной мозг. Эти зачатки получили название "глазные ямки" (рис. 2.2, а). Из них образуются первичные глазные пузыри, которые растут, перемещаются и принимают боковое положение на стенке эктодермальной мозговой трубки (рис. 2.2, б). Эта стадия определяется в конце 3–й педели развития зародыша при его длине всего в 3 мм. В конце 4–й недели развития эмбриона первичные глазные пузыри превращаются во вторичные (рис. 2.2, в), состоящие из двух слоев (рис. 2.2, г). Второй слой (внутренний) образуется в результате погружения части наружной стенки внутрь глазного пузыря. Глазной бокал формируется благодаря быстрому росту задних и боковых частей первичного глазного пузыря. Быстро растущие клетки накрывают переднюю и нижнюю части глазного бокала, в результате чего образуется зародышевая щель глаза. В эту щель входит мезодерма, из которой формируются первичное мезодермальное стекловидное тело и сосудистая сеть хориоидеи (рис. 2.2, д). Из эктодермы, втягивающейся в полость глазного бокала, образуется зачаток хрусталика. На 5–6–й неделе развития происходит закрытие зародышевой глазной щели. Вокруг хрусталикового пузырька формируется сосудистая сумка, обеспечивающая рост волокон внутри хрусталика из удлиняющихся эпителиальных клеток. Первичное мезодермальное стекловидное тело также пронизывается сосудами. Возникает закладка роговицы и первичного нейроэпителия.При длине эмбриона 17–19 мм (7–я неделя развития) нервные волокна, идущие от ганглиозных клеток периферических отделов сетчатки, входят в канал зрительного нерва. Продолжают развиваться хрусталик и радужка, происходит закладка век и поперечно полосатых мышц глаза. На 8–й неделе в закладке глаза эмбриона развивается склера, формируются зрительный нерв, зрительный тракт и частичный перекрест волокон в хиазме. На 10–й неделе развития зародыша нейроэпителиальные клетки дифференцируются на палочки и колбочки. В то же время возникает цилиарное тело – его мышца и отростки. На 12–й неделе завершается полный период развития эмбриона.
 Закладка глазных ямок на мозговой трубке
Закладка глазных ямок на мозговой трубке
 Формирование глазного бокала. Закладка хрусталика из эктодермы
Формирование глазного бокала. Закладка хрусталика из эктодермы
 Образование первичных глазных пузырей
Образование первичных глазных пузырей
 Вторичные глазные пузыри
Вторичные глазные пузыри
 Закладка век, хрусталика, внутренних оболочек глаза, первичного стекловидного тела
Рис. 2.2. Развитие глаза человека в онтогенезе. Объяснение в тексте.
1 – эктодерма; 2 – мезодерма; 3 – глазные ямки; 4 – мозговая трубка; 5 – первичный глазной пузырь; 6 – вторичный глазной пузырь; 7 – закладка хрусталика из эктодермы; 8 – зрительный нерв; 9 – зачатки век; 10 – зачаток роговицы; 11 – первичное стекловидное тело.
Закладка век, хрусталика, внутренних оболочек глаза, первичного стекловидного тела
Рис. 2.2. Развитие глаза человека в онтогенезе. Объяснение в тексте.
1 – эктодерма; 2 – мезодерма; 3 – глазные ямки; 4 – мозговая трубка; 5 – первичный глазной пузырь; 6 – вторичный глазной пузырь; 7 – закладка хрусталика из эктодермы; 8 – зрительный нерв; 9 – зачатки век; 10 – зачаток роговицы; 11 – первичное стекловидное тело.
Вирусные и эндокринные заболевания матери, прием химических веществ (алкоголь, стероиды, нестероидные противовоспалительные средства) в период развития эмбриона оказывают на него эмбриотоксическое и тератогенное действие: возникают типичные поражения глаза катаракта (обычно двусторонняя), микрофтальмия, гидрофтальм, изменения в сетчатке.
После 12 нед развивающийся организм называют плодом. Последующие месяцы жизни плода характеризуются тонкой дифференцировкой всех тканей и окончательным формированием функциональных систем. Ко времени окончания эмбрионального периода уже имеются ганглиозные клетки в той области, где позже образуется желтое пятно. Затем возникает слой нервных волокон, из которых формируется центральный пучок зрительного нерва, дифференцируются внутренний, безъядерный и плексиформный слои, появляются артерии сетчатки. На V месяце возникает наружный межъядерный слой, формируются фоторецепторы, определяются слезные пути, которые уходят в носовую полость. К концу VI месяца оформляется центральная ямка сетчатки. К этому сроку слой пигментного эпителия сетчатки уже хорошо развит. На VII месяце исчезают мембрана, закрывающая зрачок, и артерия стекловидного тела.
В течение 8–го месяца внутриутробной жизни плода происходит развитие решетчатой пластинки зрительного нерпа. Вместе с тем исчезает сосудистая сумка хрусталика. На IX месяце образуются миелиновые чехлы волокон хиазмы и зрительного нерва и полностью исчезают сосуды стекловидного тела.
В процессе онтогенеза в первую очередь избирательно созревают те части органа или системы, которые участвуют в приспособительной деятельности плода и новорожденного. С этим связана гетерохрония (разновременность) в закладке, темпах развития и созревания разных систем организма и даже разных частей одной системы. У новорожденного наиболее созревшими являются органы, обеспечивающие сосание и хватательный рефлекс.
В зрительной системе цитологическая дифференцировка клеток ретикулярной формации среднего мозга, воспринимающих свет, происходит раньше, чем формируются клетки периферической части зрительного анализатора. У всех позвоночных и человека закладка органа зрения происходит раньше, чем закладка внутренних органов и сердечно–сосудистой системы. Окончательное развитие глазного яблока, формирование оптической системы и совершенствование зрительных функций продолжаются после рождения ребенка.
Глава 3. Нормальная анатомия органа зрения человека
Анатомия есть наука первая, без нея ничъто же суть во врачевъстве.Древнерусский рукописный лечебник по списку XVII в.
Врач не анатом не только бесполезен, но и вреден.Зрительный анализатор человека относится к сенсорным системам организма и в анатомо–функциональном отношении состоит из нескольких взаимосвязанных, но различных по целевому назначению структурных единиц (рис. 3.1): ■ двух глазных яблок, расположенных во фронтальной плоскости в правой и левой глазницах, с их оптической системой, позволяющей фокусировать на сетчатке (собственно рецепторная часть анализатора) изображения всех объектов внешней среды, находящихся в пределах области ясного видения каждого из них; системы "переработки”, кодирования и передачи воспринятых изображений по каналам нейронной связи в корковый отдел анализатора; вспомогательных органов, аналогичных для обоих глазных яблок (веки, конъюнктива, слезный аппарат, глазодвигательные мышцы, фасции глазницы) ■ системы жизнеобеспечения структур анализатора (кровоснабжение, иннервация, выработка внутриглазной жидкости, регуляция гидокторо– и гемодинамики).Е. О. Мухин (1815)
Глазное яблоко (bulbus oculi)
Глаз человека, приблизительно на ⅔ расположенный в полости глазницы, имеет не совсем правильную шаровидную форму. У здоровых новорожденных его размеры, определенные путем расчетов, равны (в среднем) по сагиттальной оси 17 мм, поперечной 17 мм и вертикальной 16.5 мм. У взрослых людей с соразмерной рефракцией глаза эти показатели составляют 24,4; 23,8 и 23.5 мм соответственно. Масса глазного яблока новорожденного находится в пределах до 3 г, взрослого человека – до 7–8 г.Анатомические ориентиры глаза: передний полюс – соответствует вершине роговицы, задний полюс – его противоположной точке на склере. Линия, соединяющая эти полюса, называется наружной осью глазного яблока. Прямая, мысленно проведенная для соединения задней поверхности роговицы с сетчаткой в проекции указанных полюсов, именуется его внутренней (сагиттальной) осью. Лимб – место перехода роговицы в склеру – используют в качестве ориентира для точной локализационной характеристики обнаруженного патологического фокуса в часовом отображении (меридианальный показатель) и в линейных величинах, являющихся показателем удаленности от точки пересечения меридиана с лимбом (рис. 3.2).
В целом макроскопическое строение глаза представляется, на первый взгляд, обманчиво простым: две покровные (конъюнктива и влагалище глазного яблока) и три основные оболочки (фиброзная, сосудистая, сетчатая), а также содержимое его полости в виде передней и задней камер (заполнены водянистой влагой), хрусталика и стекловидного тела. Однако гистологическая структура большинства тканей достаточно сложна.
 Рис. 3.1. Строение зрительного анализатора человека (схема).
Рис. 3.1. Строение зрительного анализатора человека (схема).
Тонкое строение оболочек и оптических сред глаза представлено в соответствующих разделах учебника Данная глава дает возможность увидеть строение глаза в целом, понять функциональное взаимодействие отдельных частей глаза и его придатков, особенности кровоснабжения и иннервации, объясняющие возникновение и течение различных видов патологии.
Фиброзная оболочка глаза (tunica fibrosa bulbi)
Фиброзная оболочка глаза состоит из роговицы и склеры, которые по анатомической структуре и функциональным свойствам резко отличаются друг от друга. Рис. 3.2. Строение глазного яблока человека.
Рис. 3.2. Строение глазного яблока человека.
Роговица (cornea) – передняя прозрачная часть (~1/6) фиброзной оболочки. Место перехода ее в склеру (лимб) имеет вид полупрозрачного кольца шириной до 1 мм. Наличие его объясняется тем, что глубокие слои роговицы распространяются кзади несколько дальше, чем передние. Отличительные качества роговицы: сферична (радиус кривизны передней поверхности –7,7 мм, задней 6,8 мм), зеркально блестящая, лишена кровеносных сосудов, обладает высокой тактильной и болевой, но низкой температурной чувствительностью, преломляет световые лучи с силой 40–43 дптр.
Горизонтальный диаметр роговицы у здоровых новорожденных равен 9,62 ± 0,1 мм, у взрослых достигает 11 мм (вертикальный диаметр обычно меньше на ~1 мм). В центре она всегда тоньше, чем на периферии. Этот показатель также коррелирует с возрастом: например, в 20–30 лет толщина роговицы соответственно равна 0,534 и 0,707 мм, а в 71–80 лет – 0,518 и 0,618 мм.
При закрытых веках температура роговицы у лимба равна 35,4°С, а в центре – 35,1°С (при открытых веках – 30°С). В связи с этим в ней возможен рост плесневых грибков с развитием специфического кератита.
Что касается питания роговицы, то оно осуществляется двумя путями: за счет диффузии из перилимбальной сосудистой сети, образованной передними ресничными артериями, и осмоса из влаги передней камеры и слезной жидкости.
Склера (sclera) – непрозрачная часть (5/6) наружной (фиброзной) оболочки глазного яблока толщиной 0,3–1 мм. Она наиболее тонкая (0,3–0,5 мм) в области экватора и в месте выхода из глаза зрительного нерва, здесь внутренние слои склеры образуют решетчатую пластинку, через которую проходят аксоны ганглиозных клеток сетчатки, образующие диск и стволовую часть зрительного нерва.
Зоны истончения склеры уязвимы для воздействия повышенного внутриглазного давления (развитие стафилом, экскавации диска зрительного нерва) и повреждающих факторов, прежде всего механических (субконъюнктивальные разрывы в типичных местах, обычно на участках между местами прикрепления экстраокулярных мышц). Вблизи роговицы толщина склеры составляет 0,6–0,8 мм.
В области лимба происходит слияние трех совершенно разных структур – роговицы, склеры и конъюнктивы глазного яблока. Вследствие этого данная зона может быть исходным пунктом для развития полиморфных патологических процессов – от воспалительных и аллергических до опухолевых (папиллома, меланома) и связанных с аномалиями развития (дермоид). Лимбальная зона богато васкуляризирована за счет передних ресничных артерий (ветви мышечных артерий), которые на расстоянии 2–3 мм от нее отдают веточки не только внутрь глаза, но и еще в трех направлениях: непосредственно к лимбу (образуют краевую сосудистую сеть), эписклере и прилежащей конъюнктиве. По окружности лимба расположено густое нервное сплетение, образованное длинными и короткими ресничными нервами. От него отходят ветви, входящие затем в роговицу.
В ткани склеры мало сосудов, она почти лишена чувствительных нервных окончаний и предрасположена к развитию патологических процессов, характерных для коллагенозов.
К поверхности склеры крепятся 6 глазодвигательных мышц. Кроме того, в ней имеются особые каналы (выпускники, эмиссарии). По одним из них к сосудистой оболочке проходят артерии и нервы, а по другим – выходят венозные стволы различного калибра.
На внутренней поверхности переднего края склеры расположен циркулярный желобок шириной до 0,75 мм. Задний край его несколько выступает кпереди в виде шпоры, к которой крепится ресничное тело (переднее кольцо прикрепления сосудистой оболочки). Передний край желобка граничит с десцеметовой оболочкой роговицы. На дне его у заднего края находится венозный синус склеры (шлеммов канал). Остальная часть склерального углубления занята трабекулярной сеточкой (reticulum trabeculare).
Сосудистая оболочка глаза (tunica vasculosa bulbi)
Сосудистая оболочка глаза состоит из трех тесно связанных между собой частей – радужки, ресничного тела и хориоидеи.Радужка (iris) – передняя часть сосудистой оболочки и в отличие от, двух других се отделов расположена не пристеночно, а во фронтальной; по отношению к лимбу плоскости; имеет форму диска с отверстием (зрачком) в центре.
По краю зрачка располагается кольцевидный сфинктер, который иннервируется глазодвигательным нервом. Радиально ориентированный дилататор иннервируется симпатическим нервом.
Толщина радужки 0,2–0,4 мм; она особенно гонкая в корневой зоне, т. е. на границе с ресничным телом. Именно здесь при тяжелых контузиях глазного яблока может произойти ее отрыв (iridodialys).
Ресничное (цилиарное) тело (corpus ciliare) – средняя часть сосудистой оболочки – находится за радужкой, поэтому недоступно непосредственному осмотру. На поверхность склеры ресничное тело проецируется в виде пояска шириной 6–7 мм, начинающегося у склеральной шпоры, т. е. на расстоянии 2 мм от лимба. Макроскопически в этом кольце можно выделить две части – плоскую (orbiculus ciliaris) шириной 4 мм, которая граничит с зубчатой линией (ora serrata) сетчатки, и ресничную (corona ciliaris) шириной 2–3 мм с 70–80 беловатыми ресничными отростками (processus ciliares). Каждая часть имеет вид валика или пластинки высотой около 0,8 мм, шириной и длиной до 2 мм.
Внутренняя поверхность ресничного тела связана с хрусталиком посредством так называемого ресничного пояска (zonula ciliaris), состоящего из множества очень тонких стекловидных волоконец (fibrae zonulares). Этот поясок выполняет роль связки, подвешивающей хрусталик. Он соединяет ресничную мышцу с хрусталиком в единый аккомодационный аппарат глаза.
Сосудистая сеть ресничного тела формируется за счет двух длинных задних ресничных артерий (ветви глазной артерии), которые проходят через склеру у заднего полюса глаза, а затем идут в супрахориоидальном пространстве по меридиану 3 и 9 часов; анастомозируют с разветвлениями передних и задних коротких ресничных артерий. Чувствительная иннервация ресничного тела та же, что и у радужки, двигательная (для разных порций аккомодационной мышцы) – от глазодвигательного и симпатического нервов.
Хориоидея (chorioidea), или собственно сосудистая оболочка, выстилает весь задний отдел склеры на протяжении от зубчатой линии до зрительного нерва, образуется задними короткими ресничными артериями (6–12), которые проходят через склеру у заднего полюса глаза.
Хориоидея имеет ряд анатомических особенностей: ■ лишена чувствительных нервных ■ окончаний, поэтому развивающиеся в ней патологические процессы не вызывают болевых ощущений ■ ее сосудистая сеть не анастомозирует с передними ресничными артериями, вследствие этого при хориоидитах передний отдел глаза остается интактным ■ обширное сосудистое ложе при небольшом числе отводящих сосудов (4 вортикозные вены) способствует замедлению кровотока и оседанию здесь возбудителей различных заболеваний ■ органично связана с сетчаткой, которая при заболеваниях хориоидеи, как правило, также вовлекается в патологический процесс ■ из–за наличия перихориоидального пространства достаточно легко отслаивается от склеры. Удерживается в нормальном положении в основном благодаря отходящим венозным сосудам, перфорирующим ее в области экватора. Стабилизирующую роль играют также сосуды и нервы, проникающие в хориоидею из этого же пространства.
Внутренняя (чувствительная) оболочка глаза [tunica interna (sensoria) bulbi]
Внутренняя оболочка глаза – сетчатка (retina) – выстилает изнутри всю поверхность сосудистой оболочки. В соответствии со структурой, а значит, и функцией в ней различают две части – оптическую (pars optica retinae) и реснично–радужковую (pars ciliaris et iridica retinae). Первая представляет собой высокодифференцированную нервную ткань с фоторецепторами, воспринимающими адекватные световые лучи с длиной волны от 380 до 770 нм. Эта часть сетчатки распространяется от диска зрительного нерва до плоской части ресничного тела, где заканчивается зубчатой линией. Далее в редуцированном до двух эпителиальных слоев виде, потеряв оптические свойства, она покрывает внутреннюю поверхность ресничного тела и радужки. Толщина сетчатки на разных участках неодинакова: у края диска зрительного нерва 0,4–0,5 мм, в области фовеолы желтого пятна 0,07–0,08 мм, у зубчатой линии 0,14 мм. К подлежащей сосудистой оболочке сетчатка крепится прочно лишь в нескольких зонах: вдоль зубчатой линии, вокруг диска зрительного нерва и по краю желтого пятна. На остальных участках соединение рыхлое, поэтому именно здесь она легко отслаивается от своего пигментного эпителия.Почти на всем протяжении оптическая часть сетчатки состоит из 10 слоев (см. рис. 15.1). Ее фоторецепторы, обращенные к пигментному эпителию, представлены колбочками (около 7 млн) и палочками (100–120 млн). Первые группируются в центральных отделах оболочки, вторые в центре отсутствуют, а их максимальная плотность отмечается в 10–13° от него. Далее к периферии количество палочек постепенно уменьшается. Основные элементы сетчатки находятся в устойчивом положении благодаря вертикально расположенным опорным клеткам Мюллера и межуточной ткани. Стабилизирующую функцию выполняют и пограничные мембраны сетчатки (membrana limitans interna et externa).
Анатомически и при офтальмоскопии в сетчатке четко выявляются два очень важных в функциональном отношении участка – диск зрительного нерва и желтое пятно, центр которого находится на расстоянии 3,5 мм от височного края диска. По мере приближения к желтому пятну строение сетчатки существенно меняется: сначала исчезает слой нервных волокон, затем – ганглиозных клеток, далее – внутренний плексиформный слой, слой внутренних ядер и наружный плексиформный. Фовеола желтого пятна представлена только слоем колбочек, поэтому обладает самой высокой разрешающей способностью (область центрального зрения, занимающая в пространстве предметов –1,2°).
Параметры фоторецепторов
Палочки: длина 0,06 мм, диаметр 2 мкм. Наружные членики содержат пигмент – родопсин, поглощающий часть спектра электромагнитного светового излучения в диапазоне зеленых лучей (максимум 510 нм).Колбочки: длина 0,035 мм, диаметр 6 мкм. В трех различных типах колбочек ("красных", "зеленых" и "синих") содержится зрительный пигмент с различными показателями поглощения света. У "красных" колбочек он (йодопсин) адсорбирует спектральные лучи с длиной волны –565 нм, у "зеленых" – 500 нм, у "синих" – 450 нм.
Пигменты колбочек и палочек "встроены" в мембраны – диски их наружных сегментов и являются интегральными белковыми субстанциями.
Палочки и колбочки обладают различной световой чувствительностью. Первые функционируют при яркости окружающей среды до 1 кд/м–2 (ночное, скотопическое зрение), вторые – свыше 10 кд/м–2 (дневное, фотопическое зрение). Когда яркость колеблется в пределах от 1 до 10 кд“м"2, на определенном уровне функционируют все фоторецепторы (сумеречное, мезопическое зрение)[1].
Диск зрительного нерва находится в носовой половине сетчатки (на расстоянии 4 мм от заднего полюса глаза). Он лишен фоторецепторов, поэтому в поле зрения соответственно месту его проекции имеется слепая зона.
Питание сетчатки осуществляется из двух источников: шесть внутренних слоев получают его из центральной артерии сетчатки (ветвь глазной), а нейроэпителий – из хориокапиллярного слоя собственно сосудистой оболочки.
Ветви центральных артерий и вены сетчатки проходят в слое нервных волокон и отчасти в слое ганглиозных клеток. Они образуют слоистую капиллярную сеть, которая отсутствует лишь в фовеоле желтого пятна (см. рис. 3.10).
Важной анатомической особенностью сетчатки является то, что аксоны се ганглиозных клеток па всем протяжении лишены миелиновой обкладки (один из факторов, определяющих прозрачность ткани). Кроме того, она, как и сосудистая оболочка, лишена чувствительных нервных окончаний.
Внутреннее ядро (полость) глаза
Полость глаза содержит светопроводящие и светопреломляющие среды: водянистую влагу, заполняющую его переднюю и заднюю камеры, хрусталик и стекловидное тело.Передняя камера глаза (camera anterior bulbi) представляет собой пространство, ограниченное задней поверхностью роговицы, передней поверхностью радужки и центральной частью передней капсулы хрусталика. Место, где роговица переходит в склеру, а радужка – в ресничное тело, называется углом передней камеры (angulus iridocornealis). В его наружной стенке находится дренажная (для водянистой влаги) система глаза, состоящая из трабекулярной сеточки, склерального венозного синуса (шлеммов канал) и коллекторных канальцев (выпускников). Через зрачок передняя камера свободно сообщается с задней. В этом месте она имеет наибольшую глубину (2,75–3,5 мм), которая затем постепенно Уменьшается по направлению к периферии (см. рис. 3.2).
Задняя камера глаза (camera posterior bulbi) находится за радужкой, которая является ее передней стенкой, и ограничена снаружи ресничным телом, сзади стекловидным телом. Внутреннюю стенку образует экватор хрусталика. Все пространство задней камеры пронизано связками ресничного пояска.
В норме обе камеры глаза заполнены водянистой влагой, которая по своему составу напоминает диализат плазмы крови. Водянистая влага содержит питательные вещества, в частности глюкозу, аскорбиновую кислоту и кислород, потребляемые хрусталиком и роговицей, и уносит из глаза отработанные продукты обмена – молочную кислоту, углекислый газ, отшелушившиеся пигментные и другие клетки .
Обе камеры глаза вмещают 1,23–1,32 см3 жидкости, что составляет 4% всего содержимого глаза. Минутный объем камерной влаги равен в среднем 2 мм3, суточный – 2,9 см3. Иными словами, полный обмен камерной влаги происходит в течение 10 ч.
Между притоком и оттоком внутриглазной жидкости существует равновесный баланс. Если по каким–либо причинам он нарушается, это приводит к изменению уровня внутриглазного давления, верхняя граница которого в норме не превышает 27 мм рт.ст. (при измерении тонометром Маклакова массой 10 г).
Основной движущей силой, обеспечивающей непрерывный ток жидкости из задней камеры в переднюю, а затем через угол передней камеры за пределы глаза, является разность давлений в полости глаза и венозном синусе склеры (около 10 мм рт.ст.), а также в указанном синусе и передних ресничных венах.
Хрусталик (lens) представляет собой прозрачное полутвердое бессосудистое тело в форме двояковыпуклой линзы, заключенной в прозрачную капсулу, диаметром 9–10 мм и толщиной (в зависимости от аккомодации) 3,6–5 мм. Радиус кривизны его передней поверхности в покое аккомодации равен 10 мм, задней – 6 мм (при максимальном напряжении аккомодации 5,33 и 5,33 мм соответственно), поэтому в первом случае преломляющая сила хрусталика составляет в среднем 19,11 дптр, во втором – 33,06 дптр. У новорожденных хрусталик почти шаровидный, имеет мягкую консистенцию и преломляющую силу до 35,0 дптр.
В глазу хрусталик находится сразу же за радужкой в углублении на передней поверхности стекловидного тела – в стекловидной ямке (fossa hyaloidea). В этом положении он удерживается многочисленными стекловидными волокнами, образующими в сумме подвешивающую связку (ресничный поясок).
Задняя поверхность хрусталика, так же как и передняя, омывается водянистой влагой, поскольку почти на всем протяжении отделена от стекловидного тела узкой щелью (ретродентальное пространство – spatium retrodentale). Однако по наружному краю стекловидной ямки это пространство ограничено нежной кольцевидной связкой Вигера, расположенной между хрусталиком и стекловидным телом. Питание хрусталика осуществляется путем обменных процессов с камерной влагой.
Стекловидная камера глаза (camera vitrea bulbi) занимает задний отдел его полости и заполнена стекловидным телом (corpus vitreum), которое спереди прилежит к хрусталику, образуя в этом месте небольшое углубление (fossa hyaloidea), а на остальном протяжении контактирует с сетчаткой. Стекловидное тело представляет собой прозрачную студенистую массу (типа геля) объемом 3,5–4 мл и массой примерно 4 г. Оно содержит в большом количестве гиалуроновую кислоту и воду (до 98%). Однако только 10% воды связано с компонентами стекловидного тела, поэтому обмен жидкости в нем происходит довольно активно и достигает, по некоторым данным, 250 мл в сутки.
Макроскопически выделяют собственно стекловидную строму (stroma vitreum), которую пронизывает стекловидный (клокетов) канал, и окружающую его снаружи гиалоидную мембрану (рис. 3.3).
Стекловидная строма состоит из достаточно рыхлого центрального вещества, в котором имеются оптически пустые зоны, заполненные жидкостью (humor vitreus), и коллагеновые фибриллы. Последние, уплотняясь, образуют несколько витреальных трактов и более плотный кортикальный слой.
Гиалоидная мембрана состоит из двух частей – передней и задней. Граница между ними проходит по зубчатой линии сетчатки. В свою очередь передняя пограничная мембрана имеет две анатомически обособленные части – захрусталиковую и зонулярную. Границей между ними служит круговая гиалоидокапсулярная связка Вигера. прочная только в детском возрасте.
С сетчаткой стекловидное тело плотно связано лишь в области своего так называемого переднего и заднего основания. Под первым подразумевают область, где стекловидное тело одновременно крепится к эпителию ресничного тела на расстоянии 1–2 мм кпереди от зубчатого края (ora serrata) сетчатки и на протяжении 2–3 мм кзади от нее. Заднее же основание стекловидного тела – это зона фиксации его вокруг диска зрительного нерва. Полагают, что стекловидное тело имеет связь с сетчаткой также в области макулы.
Стекловидный (клокетов) канал (canalis hyaloideus) стекловидного тела начинается воронкообразным расширением от краев диска зрительного нерва и проходит через его строму по направлению к задней капсуле хрусталика. Максимальная ширина канала 1–2 мм. В эмбриональном периоде в нем проходит артерия стекловидного тела, которая к моменту рождения ребенка запустевает.
 Рис. 3.3. Стекловидное тело глаза человека (сагиттальный срез) [по N. S. Jaffe, 1969].
Рис. 3.3. Стекловидное тело глаза человека (сагиттальный срез) [по N. S. Jaffe, 1969].
Как уже отмечалось, в стекловидном теле существует постоянный ток жидкости. Из задней камеры глаза жидкость, продуцируемая ресничным телом, через зонулярную щель попадает в передний отдел стекловидного тела. Далее жидкость, попавшая в стекловидное тело, движется к сетчатке и препапиллярному отверстию в гиалоидной мембране и оттекает из глаза как через структуры зрительного нерва, так и по пери васкулярным пространствам ретинальных сосудов.
Зрительный путь и путь зрачкового рефлекса
Анатомическая структура зрительного пути достаточно сложна и включает ряд нейронных звеньев. В пределах сетчатки каждого глаза – это слой палочек и колбочек (фоторецепторы – I нейрон), затем слой биполярных (И нейрон) и ганглиозных клеток с их длинными аксонами (111 нейрон). Все вместе они образуют периферическую часть зрительного анализатора. Проводящие пути представлены зрительными нервами, хиазмой и зрительными трактами. Последние оканчиваются в клетках наружного коленчатого тела, играющего роль первичного зрительного центра. От них берут начало уже волокна центрального нейрона зрительного пути (radiatio optica), которые достигают области area striata затылочной доли мозга. Здесь локализуется первичный кортикальный центр зрительного анализатора (рис. 3.4).Зрительный нерв (n.opticus) образован аксонами ганглиозных клеток сетчатки и заканчивается в хиазме. У взрослых людей его общая длина варьирует от 35 до 55 мм. Значительную часть нерва составляет глазничный отрезок (25–30 мм), который в горизонтальной плоскости имеет S–образный изгиб, благодаря чему не испытывает натяжений при движениях глазного яблока.
 Рис. 3.4. Зрительные и зрачковые пути (схема) [по С. Behr, 1931, с изменениями]. Объяснение в тексте.
Рис. 3.4. Зрительные и зрачковые пути (схема) [по С. Behr, 1931, с изменениями]. Объяснение в тексте.
На значительном протяжении (от выхода из глазного яблока до входа в зрительный канал – canalis opticus) нерв, подобно мозгу, имеет три оболочки: твердую, паутинную и мягкую (см. рис. 3.9). Вместе с ними толщина его составляет 4–4,5 мм, без них – 3–3,5 мм. У глазного яблока твердая мозговая оболочка срастается со склерой и теноновой капсулой, а у зрительного канала – с надкостницей. Внутричерепной отрезок нерва и хиазма, находящиеся в субарахноидальной хиазматической цистерне, одеты только в мягкую оболочку.
Подоболочечные пространства глазничной части нерва (субдуральное и субарахноидальное) соединяются с аналогичными пространствами головного мозга, но изолированы друг от друга. Они заполнены жидкостью сложного состава (внутриглазная, тканевая, цереброспинальная). Поскольку внутриглазное давление к норме в 2 раза выше внутричерепного (10–12 мм рт.ст.), направление ее тока совпадает с градиентом давления. Исключение составляют случаи, когда существенно повышается внутричерепное давление (например, при развитии опухоли мозга, кровоизлияниях в полость черепа) или, наоборот, значительно снижается тонус глаза.
Все нервные волокна, входящие в состав зрительного нерва, группируются в три основных пучка. Аксоны ганглиозных клеток, отходящие от центральной (макулярной) области сетчатки, составляют папилломакулярный пучок, который входит в височную половину диска зрительного нерва. Волокна от ганглиозных клеток носовой половины сетчатки идут по радиальным линиям в носовую половину диска. Аналогичные волокна, но от височной половины сетчатки, на пути к диску зрительного нерва сверху и снизу "обтекают" папилломакулярный пучок.
В глазничном отрезке зрительного нерва вблизи глазного яблока соотношения между нервными волокнами остаются такими же, как и в его диске. Далее папилломакулярный пучок перемещается в осевое положение, а волокна от височных квадрантов сетчатки – на всю соответствующую половину зрительного нерва. Таким образом, зрительный нерв четко разделен на правую и левую половины. Менее выражено его деление па верхнюю и нижнюю половины. Важной в клиническом смысле особенностью является то, что нерв лишен чувствительных нервных окончаний.
В полости черепа зрительные нервы соединяются над областью турецкого седла, образуя хиазму (chiasma opticum), которая покрыта мягкой мозговой оболочкой и имеет следующие размеры: длина 4–10 мм, ширина 9–11 мм, толщина 5 мм. Хиазма снизу граничит с диафрагмой турецкого седла (сохранившийся участок твердой мозговой оболочки), сверху (в заднем отделе) – с дном III желудочка мозга, по бокам – с внутренними сонными артериями, сзади – с воронкой гипофиза.
В области хиазмы волокна зрительных нервов частично перекрещиваются за счет порций, связанных с носовыми половинами сетчаток. Переходя на противоположную сторону, они соединяются с волокнами, идущими от височных половин сетчаток другого глаза, и образуют зрительные тракты. Здесь же частично перекрещиваются и папилломакулярные пучки.
Зрительные тракты (tractus opticus) начинаются у задней поверхности хиазмы и, обогнув с наружной стороны ножки мозга, оканчиваются в наружном коленчатом теле (corpus geniculatum laterale), задней части зрительного бугра (thalamus opticus) и переднем четверохолмии (corpus quadrigeminum anterius) соответствующей стороны. Однако только наружные коленчатые тела являются безусловным подкорковым зрительным центром. Остальные два образования выполняют другие функции.
В зрительных трактах, длина которых у взрослого человека достигает 30–40 мм, папилломакулярный пучок также занимает центральное положение, а перекрещенные и неперекрещенные волокна по–прежнему идут отдельными пучками. При этом первые из них расположены вентромедиально, а вторые – дорсолатерально.
Зрительная лучистость (волокна центрального нейрона) начинается от ганглиозных клеток пятого и шестого слоев наружного коленчатого тела. Сначала аксоны этих клеток образуют так называемое поле Вернике, а затем, пройдя через заднее бедро внутренней капсулы, веерообразно расходятся в белом веществе затылочной доли мозга. Центральный нейрон заканчивается в борозде птичьей шпоры (sulcus calcarinus). Эта область и олицетворяет сенсорный зрительный центр – 17–е корковое поле по Бродману.
Путь зрачкового рефлекса – светового и на установку глаз на близкое расстояние – довольно сложен (см. рис. 3.4). Афферентная часть рефлекторной дуги (а) первого из них начинается от колбочек и палочек сетчатки в виде автономных волокон, идущих в составе зрительного нерва. В хиазме они перекрещиваются точно так же, как и зрительные волокна, и переходят в зрительные тракты. Перед наружными коленчатыми телами пупилломоторные волокна оставляют их и после частичного перекреста продолжаются в brachium quadrigeminum, где оканчиваются у клеток (б) так называемой претектальной области (area pretectalis). Далее новые, межуточные нейроны после частичного перекреста направляются к соответствующим ядрам (Якубовича–Эдингера–Вестфаля) глазодвигательного нерва (в). Афферентные волокна от желтого пятна сетчатки каждого глаза представлены в обоих глазодвигательных ядрах (г).
Эфферентный путь иннервации сфинктера радужки начинается от уже упомянутых ядер и идет обособленным пучком в составе глазодвигательного нерва (n. oculomotorius) (д). В глазнице волокна сфинктера входят в его нижнюю ветвь, а затем через глазодвигательный корешок (radix oculomotoria) – в ресничный узел (е). Здесь заканчивается первый нейрон рассматриваемого пути и начинается второй. По выходе из ресничного узла волокна сфинктера в составе коротких ресничных нервов (nn. ciliares breves), пройдя через склеру, попадают в перихориоидальное пространство, где образуют нервное сплетение (ж). Его конечные разветвления проникают в радужку и входят в мышцу отдельными радиальными пучками, т. е. иннервируют ее секторально. Всего в сфинктере зрачка насчитывается 70–80 таких сегментов.
Эфферентный путь дилататора зрачка (m. dilatator pupillae), получающего симпатическую иннервацию, начинается от цилиоспинального центра Будге. Последний находится в передних рогах спинного мозга (з) между C7 и T2. Отсюда отходят соединительные ветви, которые через пограничный ствол симпатического нерва (л), а затем нижний и средний симпатические шейные ганглии (t1 и t2) достигают верхнего ганглия (t3) (уровень C2–C4). Здесь заканчивается первый нейрон пути и начинается второй, входящий в состав сплетения внутренней сонной артерии (м). В полости черепа волокна, иннервирующие дилататор зрачка, выходят из упомянутого сплетения, входят в тройничный (гассеров) узел (gangl. trigeminale), а затем покидают его в составе глазного нерва (n. ophthalmicus). Уже у вершины глазницы они переходят в носоресничный нерв (n. nasociliaris) и далее вместе с длинными ресничными нервами (nn. ciliares longi) проникают в глазное яблоко[2].
Регуляция функции дилататора зрачка происходит с помощью супрануклеарного гипоталамического центра, находящегося на уровне дна III желудочка мозга перед воронкой гипофиза. Посредством ретикулярной формации он связан с цилиоспинальным центром Будге.
Реакция зрачков на конвергенцию и аккомодацию имеет свои особенности, и рефлекторные дуги в этом случае отличаются от описанных выше.
При конвергенции стимулом к сужению зрачка служат проприоцептивные импульсы, идущие от сокращающихся внутренних прямых мышц глаза. Аккомодация же стимулируется расплывчатостью (расфокусировкой) изображений внешних объектов на сетчатке. Эфферентная часть дуги зрачкового рефлекса в обоих случаях одинакова.
Центр установки глаза на близкое расстояние находится, как полагают, в 18–м корковом поле по Бродману.
Глазница (orbita) и ее содержимое
Глазница является костным вместилищем для глазного яблока. Через ее полость, задний (ретробульбарный) отдел которого заполнен жировым телом (corpus adiposum orbitae), проходят зрительный нерв, двигательные и чувствительные нервы, глазодвигательные мышцы, мышца, поднимающая верхнее веко, фасциальные образования, кровеносные сосуды. Каждая глазница имеет форму усеченной четырехгранной пирамиды, обращенной вершиной в сторону черепа под углом 45° к сагиттальной плоскости. У взрослого человека глубина глазницы 4–5 см, горизонтальный поперечник у входа (aditus orbitae) около 4 см, вертикальный – 3,5 см (рис. 3.5). Три из четырех стенок глазницы (кроме наружной) граничат с околоносовыми пазухами. Это соседство нередко служит исходной причиной развития в ней тех или иных патологических процессов, чаще воспалительного характера. Возможно и прорастание опухолей, исходящих из решетчатой, лобной и верхнечелюстных пазух. Рис. 3.5. Глазница (правая).
Рис. 3.5. Глазница (правая).
Наружная, наиболее прочная и наименее уязвимая при заболеваниях и травмах, стенка глазницы образована скуловой, отчасти лобной костью и большим крылом клиновидной кости. Эта стенка отделяет содержимое глазницы от височной ямки.
Верхняя стенка глазницы сформирована в основном лобной костью, в толще которой, как правило, имеется пазуха (sinus frontalis), и отчасти (в заднем отделе) – малым крылом клиновидной кости; граничит с передней черепной ямкой, и этим обстоятельством определяется тяжесть возможных осложнений при се повреждениях. На внутренней поверхности глазничной части лобной кости, у ее нижнего края, имеется небольшой костный выступ (spina trochlearis), к которому крепится сухожильная петля. Через нее проходит сухожилие верхней косой мышцы, которая после этого резко меняет направление своего хода. В верхненаружной части лобной кости имеется ямка слезной железы (fossa glandulae lacrimalis).
Внутренняя стенка глазницы на большом протяжении образована очень тонкой костной пластинкой – lam. orbitalis (раруrасеа) решетчатой кости. Спереди к ней примыкают слезная кость с задним слезным гребнем и лобный отросток верхней челюсти с передним слезным гребнем, сзади – тело клиновидной кости, сверху – часть лобной кости, а снизу – часть верхней челюсти и небной кости. Между гребнями слезной кости и лобного отростка верхней челюсти имеется углубление – слезная ямка (fossa sacci lacrimalis) размером 7·13 мм, к которой находится слезный мешок (saccus lacrimalis). Внизу эта ямка переходит в носослезный канал(canalis nasolacrimalis), находящийся в стенке верхнечелюстной кости. Он содержит носослезный проток (ductus nasolacrimalis), который заканчивается на расстоянии 1,5–2 см кзади от переднего края нижней носовой раковины. Вследствие своей хрупкости медиальная стенка глазницы легко повреждается даже при тупых травмах с развитием эмфиземы век (чаще) и самой глазницы (реже). Кроме того, патологические процессы, возникающие в решетчатой пазухе, достаточно свободно распространяются в сторону глазницы, в результате чего развиваются воспалительный отек се мягких тканей (целлюлит), флегмона или неврит зрительного нерва.
Нижняя стенка глазницы является одновременно и верхней стенкой верхнечелюстной пазухи. Эта стенка образована главным образом глазничной поверхностью верхней челюсти, отчасти также скуловой костью и глазничным отростком небной кости. При травмах возможны переломы нижней стенки, которые иногда сопровождаются опущением глазного яблока и ограничением его подвижности кверху и кнаружи при ущемлении нижней косой мышцы. Начинается же нижняя стенка глазницы от костной стенки, чуть латеральное входа в носослезный капал. Воспалительные и опухолевые процессы, развивающиеся в верхнечелюстной пазухе, достаточно легко распространяются в сторону глазницы.
У вершины в стенках глазницы имеется несколько отверстий и щелей, через которые в ее полость проходит ряд крупных нервов и кровеносных сосудов. ■ Костный канал зрительного нерва (canalis opticus) длиной 5–6 мм. Начинается в глазнице круглым отверстием (foramen opticum) диаметром около 4 мм, соединяет ее полость со средней черепной ямкой. Через этот канал в глазницу входят зрительный нерв (n. opticus) и глазная артерия (a. ophthalmica). ■ Верхняя глазничная щель (fissura orbitalis superior). Образована телом клиновидной кости и ее крыльями, соединяет глазницу со средней черепной ямкой. Затянута топкой соединительнотканной пленкой, через которую в глазницу проходят три основные ветви глазного нерва (n. ophthalmicus[3]) – слезный, носоресничный и лобный нервы (nn. lacrimalis, nasociliaris et frontalis), а также стволы блокового, отводящего и глазодвигательного нервов (nn. trochlearis, abducens и oculomotorius). Через эту же щель ее покидает верхняя глазная вена (v. ophthalmica superior). При повреждениях этой области развивается характерный симптомокомплекс: полная офтальмоплегия, т. е. обездвиженность глазного яблока, опущение (птоз) верхнего века, мидриаз, снижение тактильной чувствительности роговицы и кожи век, расширение вен сетчатки и небольшого экзофтальма. Однако "синдром верхней глазничной щели" может быть выражен не полностью, когда повреждены не все, а лишь отдельные нервные стволы, проходящие через эту щель. ■ Нижняя глазничная щель (fissuга orbitalis inferior). Образована нижним краем большого крыла клиновидной кости и телом верхней челюсти, обеспечивает сообщение глазницы с крылонебной (в задней половине) и височной ямками. Эта щель также закрыта соединительнотканной перепонкой, в которую вплетаются волокна орбитальной мышцы (m. orbitalis), иннервируемой симпатическим нервом. Через нес глазницу покидает одна из двух ветвей нижней глазной вены (другая впадает в верхнюю глазную вену), анастомозируютая затем с крыловидным венозным сплетением (et plexus venosus pterygoideus), а входят нижнеглазничные нерв и артерия (n. a. infraorbitalis), скуловой нерв (n. zygomaticus) и глазничные ветви крылонебного узла (ganglion pterygopalatinum). ■ Круглое отверстие (foramen rotundum) находится в большом крыле клиновидной кости. Оно связывает среднюю черепную ямку с крылонебной. Через это отверстие проходит вторая ветвь тройничного нерва (n. maxillaris), от которой в крылонебной ямке отходит подглазничный нерв (n. infraorbiialis), а в нижневисочной – скуловой нерв (n. zygomaticus). Оба нерва затем проникают в полость глазницы (первый поднадкостнично) через нижнюю глазничную щель. ■ Решетчатые отверстия на медиальной стенке глазницы (foramen ethmoidale anterius et posterius), через которые проходят одноименные нервы (ветви носоресничного нерва), артерии и вены.
Кроме того, в большом крыле клиновидной кости имеется еще одно отверстие – овальное (foramen ovale), соединяющее среднюю черепную ямку с подвисочной. Через него проходит третья ветвь тройничного нерва (n. mandibularis), но она не принимает участия в иннервации органа зрения.
За глазным яблоком на расстоянии 18–20 мм от его заднего полюса находится ресничный узел (ganglion ciliare) размером 2·1 мм. Он расположен под наружной прямой мышцей, прилегая в этой зоне к поверхности зрительного нерва. Ресничный узел является периферическим нервным ганглием, клетки которого посредством трех корешков (radix nasociliaris, oculomoioria et sympathicus) связаны с волокнами соответствующих нервов.
Костные стенки глазницы покрыты тонкой, но прочной надкостницей (periorbita), которая плотно сращена с ними в области костных швов и зрительного канала. Отверстие последнего окружено сухожильным кольцом (annulus tendineus communis Zinni), от которого начинаются все глазодвигательные мышцы, за исключением нижней косой. Она берет начало от нижней костной стенки глазницы, вблизи входного отверстия носослезного канала.
Помимо надкостницы, к фасциям глазницы, согласно Международной анатомической номенклатуре, относятся влагалище глазного яблока, мышечные фасции, глазничная перегородка и жировое тело глазницы (corpus adiposum orbitae).
Влагалище глазного яблока (vagina bulbi, прежнее название – fascia bulbi s. Tenoni) покрывает почти все глазное яблоко, за исключением роговицы и места выхода из него зрительного нерва. Наибольшая плотность и толщина этой фасции отмечаются в области экватора глаза, где через нее проходят сухожилия глазодвигательных мышц на пути к местам прикрепления к поверхности склеры. По мере приближения к лимбу ткань влагалища истончается и в конце концов постепенно теряется в подконъюнктивальной ткани. В местах просечения экстраокулярными мышцами она отдает им достаточно плотное соединительнотканное покрытие. Из этой же зоны отходят и плотные тяжи (fasciae musculares), связывающие влагалище глаза с надкостницей стенок и краев глазницы. В целом эти тяжи образуют кольцевидную мембрану, которая параллельна экватору глаза и удерживает его в глазнице в стабильном положении.
Субвагинальное пространство глаза (прежнее название – spatium Tenoni) представляет собой систему щелей в рыхлой эписклеральной ткани. Оно обеспечивает свободное движение глазного яблока в определенном объеме. Это пространство нередко используют с хирургической и терапевтической целью (выполнение склероукрепляющих операций имплантационного тина, введение лекарственных средств путем инъекций).
Глазничная перегородка (septum orbitale) – хорошо выраженная структура фасциального типа, расположенная во фронтальной плоскости. Соединяет глазничные края хрящей век с костными краями глазницы. Вместе они образуют как бы ее пятую, подвижную, стенку, которая при сомкнутых веках полностью изолирует полость глазницы. Важно иметь в виду, что в области медиальной стенки глазницы эта перегородка, которую называют также тарзо–орбитальной фасцией, крепится к заднему слезному гребню слезной кости, вследствие чего слезный мешок, лежащий ближе к поверхности, частично находится в пресептальном пространстве, т. е. вне полости глазницы.
Полость глазницы заполнена жировым телом (corpus adiposiim orbitае), которое заключено в тонкий апоневроз и пронизано соединительнотканными перемычками, делящими его на мелкие сегменты. Благодаря пластичности жировая ткань не препятствует свободному перемещению проходящим через нее глазодвигательным мышцам (при их сокращении) и зрительному нерву (при движениях глазного яблока). От надкостницы жировое тело отделено щелевидным пространством.
Через глазницу в направлении от ее вершины к входу проходят различные кровеносные сосуды, двигательные, чувствительные и симпатические нервы, о чем уже частично упоминалось выше, а подробно изложено в соответствующем разделе этой главы. То же самое относится и к зрительному нерву.
Вспомогательные органы глаза (organa oculi accesoria)
К вспомогательным органам глаза относятся веки, конъюнктива, мышцы глазного яблока, слезный аппарат и уже описанные выше фасции глазницы.Веки (palpebrae)
Веки, верхние и нижние, – мобильные структурные образования, прикрывающие спереди глазные яблоки (рис. 3.6). Благодаря мигательным движениям они способствуют равномерному распределению слезной жидкости по их поверхности. Верхнее и нижнее веки у медиального и латерального углов соединены между собой посредством спаек (comissura palpebral is medialis et lateralis). Приблизительно за 5 мм до слияния внутренние края век меняют направление своего хода и образуют дугообразный изгиб. Очерченное ими пространство называется слезным озером (lacus lacrimalis). Здесь же находятся небольшое розоватого цвета возвышение – слезное мясцо (cariincula lacrimalis) и примыкающая к нему полулунная складка конъюнктивы (plica semilunaris conjunctivae).При открытых веках края их ограничивают пространство миндалевидной формы, называемое глазной щелью (rima palpebrarum). Длина ее по горизонтали равна 30 мм (у взрослого человека), а высота в центральном отделе колеблется от 10 до 14 мм.
 Рис. 3.6. Веки и передний сегмент глазного яблока (сагиттальный разрез).
Рис. 3.6. Веки и передний сегмент глазного яблока (сагиттальный разрез).
В пределах глазной щели видны почти вся роговица, за исключением верхнего сегмента, и окаймляющие ее участки склеры белого цвета. При сомкнутых веках глазная щель исчезает.
Каждое веко состоит из двух пластин: наружной (кожно–мышечной) и внутренней (тарзально–конъюнктивальной).
Кожа век нежная, легко собирается в складки и снабжена сальными и потовыми железами. Лежащая под нею клетчатка лишена жира и очень рыхлая, что способствует быстрому распространению в этом месте отеков и кровоизлияний. Обычно на кожной поверхности хорошо видны две орбитально–пальпебральные складки – верхняя и нижняя. Как правило, они совпадают с соответствующими краями хрящей.
Хрящи век (tarsus superior el inferior) имеют вид слегка выпуклых кнаружи горизонтальных пластин с округленными краями длиной около 20 мм, высотой соответственно 10–12 и 5–6 мм и толщиной 1 мм. Они состоят из очень плотной соединительной ткани. С помощью мощных связок (lig. palpebrale mediate et laterale) концы хрящей соединены с соответствующими стенками глазницы. В свою очередь и глазничные края хрящей прочно связаны с краями глазницы посредством фасциальной ткани (septum orbitale).
В толще хрящей расположены продолговатые альвеолярные мейбомиевы железы (glandulae larsales) – около 25 в верхнем хряще и 20 в нижнем. Они идут параллельными рядами и открываются выводными протоками вблизи заднего края век. Эти железы продуцируют липидный секрет, образующий наружный слой прероговичной слезной пленки.
Задняя поверхность век покрыта соединительной оболочкой (конъюнктивой), которая плотно сращена с хрящами, а за их пределами образует мобильные своды – глубокий верхний и более мелкий, легко доступный для осмотра нижний.
Свободные края век ограничены передними и задними гребнями (limbi palpebrales antcriores et posteriores), между которыми имеется пространство шириной около 2 мм. Передние гребни несут в себе корни многочисленных ресниц (расположены в 2–3 ряда), в волосяные фолликулы которых открываются сальные (Цейса) и видоизмененные потовые (Молля) железы. На задних же гребнях нижних и верхних век, в их медиальной части, имеются небольшие возвышения – слезные сосочки (papilli lacrimales). Они погружены в слезное озеро и снабжены точечными отверстиями (punctum lacrimale), ведущими в соответствующие слезные канальцы (canaliculi lacrimales).
Подвижность век обеспечивается действием двух антагонистических групп мышц – смыкающих и размыкающих их. Первая функция реализуется с помощью круговой мышцы глаза (m. orbicularis oculi), вторая – мышцы, поднимающей верхнее веко (m. levator palpebrae superioris) и нижней тарзальной мышцы (m. tarsalis inferior).
Круговая мышца глаза состоит из трех частей: глазничной (pars orbitalis), вековой (pare palpebralis) и слезной (pars lacrimalis) (рис. 3.7).
Глазничная часть мышцы представляет собой круговой жом, волокна которого начинаются и кренятся у медиальной связки век (lig. palpebrale mediale) и лобного отростка верхней челюсти. Сокращение мышцы приводит к плотному смыканию век.
Волокна вековой части круговой мышцы также начинаются от медиальной связки век. Затем ход этих волокон становится дугообразным и они доходят до наружного угла глазной щели, где крепятся к латеральной связке век (lig. palpebrale laterale). Сокращение этой группы волокон обеспечивает закрытие век и их мигательные движения.
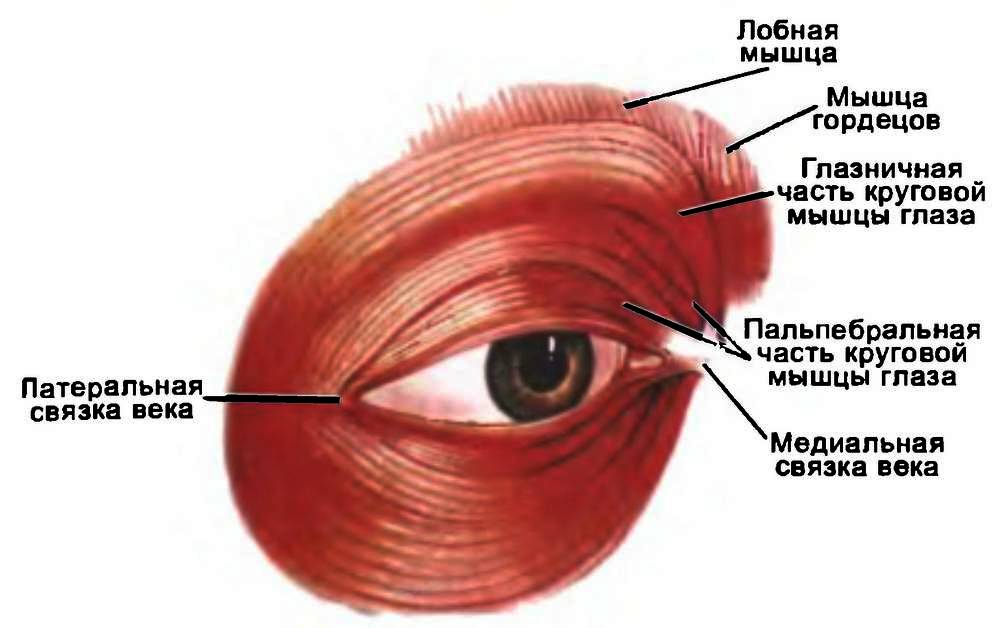 Рис. 3.7. Круговая мышца глаза.
Рис. 3.7. Круговая мышца глаза.
Слезная часть круговой мышцы века представлена глубоко расположенной порцией мышечных волокон, которые начинаются несколько кзади от заднего слезного гребня слезной кости. Затем они проходят позади слезного мешка и вплетаются в волокна вековой части круговой мышцы, идущие от переднего слезного гребня. В результате слезный мешок оказывается охваченным мышечной петлей, которая при сокращениях и расслаблениях во время мигательных движений век то расширяет, то суживает просвет слезного мешка. Благодаря этому происходят всасывание слезной жидкости из конъюнктивальной полости (через слезные точки) и продвижение ее по слезным путям в полость носа. Этому процессу способствуют и сокращения тех пучков "слезной" мышцы, которые окружают слезные канальцы.
Особо выделяют и те мышечные волокна круговой мышцы века, которые расположены между корнями ресниц вокруг протоков мейбомиевых желез (m. ciliaris Riolani). Сокращение этих волокон способствует выделению секрета из упомянутых желез и прижатию краев век к глазному яблоку.
Круговая мышца глаза иннервируется скуловыми и передневисочными ветвями лицевого нерва, которые лежат достаточно глубоко и входят в нее преимущественно с нижненаружней стороны. Это обстоятельство следует учитывать при необходимости произвести акинезию мышцы (обычно при выполнении полостных операций на глазном яблоке).
Мышца, поднимающая верхнее веко, начинается вблизи зрительного канала, затем идет под крышей глазницы и оканчивается тремя порциями – поверхностной, средней и глубокой. Первая из них, превращаясь в широкий апоневроз, проходит через глазничную перегородку, между волокнами вековой части круговой мышцы и оканчивается под кожей века. Средняя порция, состоящая из тонкого слоя гладких волокон (m. tarsalis superior, m. Mulleri), вплетается в верхний край хряща. Глубокая пластинка, подобно поверхностной, также заканчивается сухожильной растяжкой, которая достигает верхнего свода конъюнктивы и крепится к нему. Две порции леватора (поверхностная и глубокая) иннервируются глазодвигательным нервом, средняя – шейным симпатическим нервом.
Нижнее веко оттягивается вниз слабо развитой глазной мышцей (т. tarsalis inferior), соединяющей хрящ с нижним сводом конъюнктивы. В последний вплетаются также фасциальные отростки влагалища нижней прямой мышцы.
Веки богато снабжены сосудами за счет ветвей глазной артерии (a. ophthalmica), входящей в систему внутренней сонной артерии, а также анастомозов от лицевой и верхнечелюстной артерий (аа. facialis et maxillaris). Две последние артерии принадлежат уже наружной сонной артерии. Разветвляясь, все эти сосуды образуют артериальные дуги – две на верхнем веке и одну на нижнем.
Веки имеют также хорошо развитую лимфатическую сеть, которая расположена на двух уровнях – на передней и задней поверхностях хрящей. При этом лимфатические сосуды верхнего века впадают в предушные лимфатические узлы, а нижнего – в подчелюстные.
Чувствительная иннервация кожи лица осуществляется за счет трех ветвей тройничного нерва и веточек лицевого нерва.
Конъюнктива (tunica conjunctiva)
Конъюнктива – тонкая (0,05–0,1 мм) слизистая оболочка, которая покрывает всю заднюю поверхность век (tunica conjunctiva palpebrarum), а затем, образовав своды конъюнктивального мешка (fornix conjunctivae superior et inferior), переходит на переднюю поверхность глазного яблока (tunica conjunctiva bulbi) и оканчивается у лимба (см. рис. 3.6). Ее называют соединительной оболочкой, так как она соединяет веко и глаз.В конъюнктиве век выделяют две части – тарзальную, плотно сращенную с подлежащей тканью, и мобильную глазничную в виде переходной (к сводам) складки.
При закрытых веках между листками конъюнктивы образуется щелевидная полость, более глубокая вверху, напоминающая мешок. Когда веки открыты, объем его заметно уменьшается (на величину глазной щели). Значительно изменяются объем и конфигурация конъюнктивального мешка и при движениях глаза.
Конъюнктива хряща покрыта многослойным цилиндрическим эпителием и содержит у края век бокаловидные клетки, а около дистального конца хряща – крипты Генле. И те, и другие секретируют муцин. В норме сквозь конъюнктиву просвечивают мейбомиевы железы, образующие рисунок в виде вертикального частокола. Под эпителием находится ретикулярная ткань, прочно спаянная с хрящом. У свободного края века конъюнктива гладкая, но уже на расстоянии 2–3 мм от пего приобретает шероховатость, обусловленную наличием здесь сосочков.
Конъюнктива переходной складки гладкая и покрыта 5–6–слойным плоским эпителием с большим количеством бокаловидных слизистых клеток (выделяют муцин). Ее подэпителиальная рыхлая соединительная ткань, состоящая из эластических волокон, содержит плазматические клетки и лимфоциты, способные образовывать скопления в виде фолликулов или лимфом. Благодаря наличию хорошо развитой субконъюнктивальной ткани эта часть конъюнктивы весьма подвижна.
На границе между тарзальной и орбитальной частями конъюнктивы находятся дополнительные слезные железы Вольфринга (3 у верхнего края верхнего хряща и еще одна ниже нижнего хряща), а в области сводов – железки Краузе, количество которых составляет 6–8 на нижнем веке и 15–40 – на верхнем. По строению они аналогичны главной слезной железе, выводные протоки которой открываются в латеральной части верхнего конъюнктивального свода.
Конъюнктива глазного яблока покрыта многослойным плоским неороговевающим эпителием и рыхло соединена со склерой, поэтому может легко сметаться по се поверхности. Лимбальная часть конъюнктивы содержит островки цилиндрического эпителия с секретирующими клетками Бехера. В этой же зоне, радиально к лимбу (в виде пояска шириной 1–1,5 м), расположены клетки Манца, продуцирующие муцин.
Кровоснабжение конъюнктивы век осуществляется за счет сосудистых стволов, отходящих от артериальных дуг пальпебральных артерий (см. рис. 3.13). В конъюнктиве же глазного яблока содержатся два слоя сосудов – поверхностный и глубокий. Поверхностный образован ветвями, отходящими от артерий век, а также передними ресничными артериями (ветви мышечных артерий). Первые из них идут в направлении от сводов конъюнктивы к роговице, вторые – навстречу им. Глубокие (эписклеральные) сосуды конъюнктивы являются ветвями только передних ресничных артерий. Они направляются в сторону роговицы и образуют вокруг нее густую сеть. Основные же стволы передних ресничных артерий, не дойдя до лимба, уходят внутрь глаза и участвуют в кровоснабжении ресничного тела.
Вены конъюнктивы сопутствуют соответствующим артериям. Отток крови идет в основном по пальпебральной системе сосудов в лицевые вены. Конъюнктива имеет также богатую сеть лимфатических сосудов. Отток лимфы от слизистой оболочки верхнего века происходит в предушные лимфатические узлы, а от нижнего – в подчелюстные.
Чувствительная иннервация конъюнктивы обеспечивается слезным, подблоковым и подглазничным нервами (nn. lacrimalis, infratrochlearis et n. infraorbitalis).
Мышцы глазного яблока (musculus bulbi)
Мышечный аппарат каждого глаза состоит из трех пар антагонистически действующих глазодвигательных мышц: верхней и нижней прямых (mm. rectus oculi superior et inferior), внутренней и наружной прямых (mm. rectus oculi medialis et lataralis), верхней и нижней косых (mm. obliquus superior ct inferior) (cm. рис. 18).Все мышцы, за исключением нижней косой, начинаются, как и мышца, поднимающая верхнее веко, от сухожильного кольца, расположенного вокруг зрительного канала глазницы. Затем четыре прямые мышцы направляются, постепенно дивергируя, кпереди и после прободения теноновой капсулы вплетаются своими сухожилиями в склеру. Линии их прикрепления находятся на разном расстоянии от лимба: внутренней прямой – 5,5–5,75 мм, нижней – 6–6,5 мм, наружной – 6,9–7 мм, верхней – 7,7–8 мм.
Верхняя косая мышца от зрительного отверстия направляется к костно–сухожильному блоку, расположенному у верхневнутреннего угла глазницы и, перекинувшись через пего, идет кзади и кнаружи в виде компактного сухожилия; прикрепляется к склере в верхненаружном квадранте глазного яблока на расстоянии 16 мм от лимба.
Нижняя косая мышца начинается от нижней костной стенки глазницы несколько латеральнее места входа в носослезный канал, идет кзади и кнаружи между нижней стенкой глазницы и нижней прямой мышцей; прикрепляется к склере на расстоянии 16 мм от лимба (нижненаружный квадрант глазного яблока).
Внутренняя, верхняя и нижняя прямые мышцы, а также нижняя косая мышца иннервируются веточками глазодвигательного нерва (n. oculomotorius), наружная прямая – отводящего (n. abducens), верхняя косая – блокового (rt. trochlearis).
При сокращении той или иной мышцы глаз совершает движение вокруг оси, которая перпендикулярна ее плоскости. Последняя проходит вдоль мышечных волокон и пересекает точку вращения глаза. Это означает, что у большинства глазодвигательных мышц (за исключением наружной и внутренней прямых мышц) оси вращения имеют тот или иной угол наклона по отношению к исходным координантным осям. Вследствие этого при сокращении таких мышц глазное яблоко совершает сложное движение. Так, например, верхняя прямая мышца при среднем положении глаза поднимает его кверху, ротирует кнутри и несколько поворачивает к носу. Понятно, что амплитуда вертикальных движений глаза будет увеличиваться по мере уменьшения угла расхождения между сагиттальной и мышечной плоскостями, т. е. при повороте глаза кнаружи.
Все движения глазных яблок подразделяют на сочетанные (ассоциированные, конъюгированные) и конвергентные (фиксация разноудаленных объектов за счет конвергенции). Сочетанные движения – это те, которые направлены в одну сторону: вверх, вправо, влево и т. д. Эти движения совершаются мышцами–синергистами. Так, например, при взгляде вправо в правом глазу сокращается наружная, а в левом – внутренняя прямые мышцы. Конвергентные движения реализуются посредством действия внутренних прямых мышц каждого глаза. Разновидностью их являются фузионные движения. Будучи очень мелкими, они осуществляют особо точную фиксационную установку глаз, благодаря чему создаются условия для беспрепятственного слияния в корковом отделе анализатора двух сетчаточных изображений в один цельный образ.
Слезный аппарат (apparatus lacrimalis)
Продукция слезной жидкости осуществляется слезной железой (glandula lacrimalis) и мелкими добавочными железами Краузе и Вольфринга. Последние обеспечивают суточную потребность глаза в увлажняющей его жидкости. Главная же слезная железа активно функционирует лишь в условиях эмоциональных всплесков (положительных и отрицательных), а также в ответ на раздражение чувствительных нервных окончаний в слизистой оболочке глаза или носа (рефлекторное слезоотделение).Слезная железа лежит под верхненаружным краем орбиты в углублении лобной кости (fossa glandulae lacrimalis). Сухожилие мышцы, поднимающей верхнее веко, делит ее на большую глазничную и меньшую вековую части. Выводные протоки глазничной доли железы (в количестве 3–5) проходят между дольками вековой железы, принимая попутно ряд ее многочисленных мелких протоков, и открываются в своде конъюнктивы на расстоянии нескольких миллиметров от верхнего края хряща. Кроме того, вековая часть железы имеет и самостоятельные протоки, количество которых от 3 до 9. Поскольку она лежит сразу же под верхним сводом конъюнктивы, при вывороте верхнего века ее дольчатые контуры обычно хорошо видны.
Слезная железа иннервируется секреторными волокнами лицевого нерва (n. facialis), которые, проделав сложный путь, достигают ее в составе слезного нерва (n. lacrimalis), являющегося ветвью глазного нерва (n. ophthalmicus).
У детей слезная железа начинает функционировать к концу 2–го месяца жизни, поэтому до истечения этого срока при плаче глаза у них остаются сухими.
Слеза (lacrima) – прозрачная жидкость, со слабощелочной реакцией (pH 7,0–7,4) и сложным биохимическим составом, большую часть которой (98–99%) составляет вода. В норме вырабатывается небольшое количество слезы (от 0,5–0,6 до 1 мл в сутки). В се состав входит также секрет, выделяемый бокаловидными клетками конъюнктивы (Бехера), криптами Генле, железами Манца (все они продуцируют муцин), а также мейбомиевыми, и Цейса (продуцируют липиды). В связи с этим прекорнеальная пленка слезной жидкости состоит из трех слоев: тонкого муцинового (контактирует с роговичным эпителием), водянистого (по объему основного) и наружного липидного.
Эта пленка выполняет ряд важных функций: ■ защитную (удаление пылевых частиц, предупреждение повреждений мелкими инородными телами, бактерицидное действие) ■ оптическую (сглаживает микроскопические неровности поверхности роговицы, обеспечивает ее влажность, гладкость и зеркальность, преломляет световые лучи) ■ трофическую (участие вдыхании и питании роговицы).
Продуцируемая упомянутыми выше железами слезная жидкость скатывается по поверхности глазного яблока сверху вниз в капиллярную щель между задним гребнем нижнего века и глазным яблоком, где и образуется слезный ручеек (rivus lacrimalis), впадающий в слезное озеро (lacus lacrimalis). Продвижению слезной жидкости способствуют мигательные движения век. При смыкании они не только идут навстречу друг другу, но и смещаются кнутри (особенно нижнее веко) на 1–2 мм, в результате чего глазная щель укорачивается.
Слезоотводящие пути состоят из слезных канальцев, слезного мешка и носослезного протока (см. Рис. 8.1).
Слезные канальцы (canaliculi lacrimales) начинаются слезными точками (punctum lacrimale), которые находятся на вершине слезных сосочков обоих век и погружены в слезное озеро. Диаметр точек при открытых веках 0,25–0,5 мм. Они ведут в вертикальную часть канальцев (длина 1,5–2 мм). Затем ход их меняется почти на горизонтальный. Далее они, постепенно сближаясь, открываются в слезный мешок позади внутренней спайки век каждый в отдельности или слившись предварительно в общее устье. Длина этой части канальцев 7–9 мм, диаметр 0,6 мм. Стенки канальцев покрыты многослойным плоским эпителием, под которым находится слой эластических мышечных волокон.
Слезный мешок (saccus lacrimalis) расположен в костной, вытянутой по вертикали ямке между передним и задним коленами внутренней спайки век и охвачен мышечной петлей (m. Horneri). Купол его выступает над этой связкой и находится пресептально, т. е. вне полости глазницы. Изнутри мешок покрыт многослойным плоским эпителием, под которым находится слой аденоидной, а затем плотной волокнистой ткани.
Слезный мешок открывается в носослезный проток (ductus nasolacrimalis), который проходит сначала в костном канале (длина около 12 мм). В нижнем же отделе он имеет костную стенку только с латеральной стороны, в остальных отделах граничит со слизистой оболочкой носа и окружен густым венозным сплетением. Проток открывается под нижней носовой раковиной на расстоянии 3–3,5 см от наружного отверстия носа. Общая длина его 15 мм, диаметр 2–3 мм. У новорожденных выходное отверстие протока нередко закрыто слизистой пробкой или топкой пленкой, вследствие чего создаются условия для развития гнойного или серозно–гнойного дакриоцистита. Степка протока имеет такое же строение, как и стенка слезного мешка. У выходного отверстия протока слизистая оболочка образует складку, которая играет роль запирающего клапана.
В целом можно принять, что слезоотводящий путь состоит из небольших мягких трубочек различной длины и формы с изменяющимся диаметром, которые стыкуются под определенными углами. Они соединяют конъюнктивальную полость с носовой, куда и происходит постоянный отток слезной жидкости. Он обеспечивается за счет мигательных движений век, сифонного эффекта с капиллярным притяжением жидкости, заполняющей слезные пути, перистальтического изменения диаметра канальцев, присасывающей способности слезного мешка (вследствие чередования в нем положительного и отрицательного давления при мигании) и отрицательного давления, создающегося в полости носа при аспирационном движении воздуха.
Кровоснабжение глаза и его вспомогательных органов
Артериальная система органа зрения
Основную роль в питании органа зрения играет глазная артерия (а. ophthalmica) – одна из основных ветвей внутренней сонной артерии. Через зрительный канал глазная артерия проникает в полость глазницы и, находясь сначала под зрительным нервом, поднимается затем с наружной стороны вверх и пересекает его, образуя дугу. Рис. 3.8. Кровеносные сосуды левой глазницы (вид сверху) [из работы М Л. Краснова, 1952, с изменениями!
Рис. 3.8. Кровеносные сосуды левой глазницы (вид сверху) [из работы М Л. Краснова, 1952, с изменениями!
От нее и отходят все основные веточки глазной артерии (рис. 3.8). ■ Центральная артерия сетчатки (а. centralis retinae) – сосуд небольшого диаметра, идущий от начальной части дуги глазной артерии. На расстоянии 7–12 мм от заднего полюса глаза через твердую оболочку она входит снизу в глубь зрительного нерва и направляется в сторону его диска одиночным стволом, отдавая в обратном направлении тонкую горизонтальную веточку (рис. 3.9). Нередко, однако, наблюдаются случаи, когда глазничная часть нерва получает питание от небольшой сосудистой веточки, которую часто называют центральной артерией зрительного нерва (a. centralis nervi optici). Топография ее не постоянна: в одних случаях она отходит в различных вариантах от центральной артерии сетчатки, в других – непосредственно от глазной артерии В центре ствола нерва эта артерия после Т–образного деления занимает горизонтальное положение и посылает множественные капилляры в сторону сосудистой сети мягкой мозговой оболочки. Внутриканальцевая и околоканальцевая части зрительного нерва питаются за счет г. recurrens a.ophthalmica, r.recurrens a. hypophysialis sup.ant. и rr. intracanaliculares a.ophthalmica.
 Рис. 3.9. Кровоснабжение зрительного нерва и сетчатки (схема) [по Н. Remky, 1975].
Центральная артерия сетчатки выходит из стволовой части зрительного нерва, дихотомически делится вплоть до артериол 3–го порядка (рис. 3.10), формируя сосудистую сеть, которая питает мозговой слой сетчатки и внутриглазную часть диска зрительного нерва. Не столь уж редко на глазном дне при офтальмоскопии можно увидеть дополнительный источник питания макулярной зоны сетчатки в виде a. cilioretinalis. Однако она отходит уже не от глазной артерии, а от задней короткой ресничной или артериального круга Цинна–Галлера. Ее роль очень велика при нарушениях кровообращения в системе центральной артерии сетчатки.
■ Задние короткие ресничные артерии (aa.ciliares posteriores breves) – ветви (длиной 6–12 мм) глазной артерии, которые подходят к склере заднего полюса глаза и, перфорируя ее вокруг зрительного нерва, образуют интрасклеральный артериальный круг Цинна–Галлера. Они формируют также собственно сосудистую оболочку – хориоидею (рис. 3.11). Последняя посредством своей капиллярной пластинки питает нейроэпителиальный слой сетчатки (от слоя палочек и колбочек до наружного плексиформного включительно). Отдельные ветви задних коротких ресничных артерий проникают в ресничное тело, но существенной роли в его питании не играют. В целом же система задних коротких ресничных артерий не анастомозирует с какими–либо другими сосудистыми сплетениями глаза Именно по этой причине воспалительные процессы, развивающиеся в собственно сосудистой оболочке, не сопровождаются гиперемией глазного яблока.
■ Две задние длинные ресничные артерии (aa.ciliares posteriores longae) отходят от ствола глазной артерии и располагаются дистальнее задних коротких ресничных артерий. Перфорируют склеру на уровне боковых сторон зрительного нерва и, войдя в супрахориоидальное пространство на 3 и 9 часах, достигают ресничного тела, которое в основном и питают. Анастомозируют с передними ресничными артериями, которые являются ветвями мышечных артерий (аа. musculares) (рис. 3.12).
Рис. 3.9. Кровоснабжение зрительного нерва и сетчатки (схема) [по Н. Remky, 1975].
Центральная артерия сетчатки выходит из стволовой части зрительного нерва, дихотомически делится вплоть до артериол 3–го порядка (рис. 3.10), формируя сосудистую сеть, которая питает мозговой слой сетчатки и внутриглазную часть диска зрительного нерва. Не столь уж редко на глазном дне при офтальмоскопии можно увидеть дополнительный источник питания макулярной зоны сетчатки в виде a. cilioretinalis. Однако она отходит уже не от глазной артерии, а от задней короткой ресничной или артериального круга Цинна–Галлера. Ее роль очень велика при нарушениях кровообращения в системе центральной артерии сетчатки.
■ Задние короткие ресничные артерии (aa.ciliares posteriores breves) – ветви (длиной 6–12 мм) глазной артерии, которые подходят к склере заднего полюса глаза и, перфорируя ее вокруг зрительного нерва, образуют интрасклеральный артериальный круг Цинна–Галлера. Они формируют также собственно сосудистую оболочку – хориоидею (рис. 3.11). Последняя посредством своей капиллярной пластинки питает нейроэпителиальный слой сетчатки (от слоя палочек и колбочек до наружного плексиформного включительно). Отдельные ветви задних коротких ресничных артерий проникают в ресничное тело, но существенной роли в его питании не играют. В целом же система задних коротких ресничных артерий не анастомозирует с какими–либо другими сосудистыми сплетениями глаза Именно по этой причине воспалительные процессы, развивающиеся в собственно сосудистой оболочке, не сопровождаются гиперемией глазного яблока.
■ Две задние длинные ресничные артерии (aa.ciliares posteriores longae) отходят от ствола глазной артерии и располагаются дистальнее задних коротких ресничных артерий. Перфорируют склеру на уровне боковых сторон зрительного нерва и, войдя в супрахориоидальное пространство на 3 и 9 часах, достигают ресничного тела, которое в основном и питают. Анастомозируют с передними ресничными артериями, которые являются ветвями мышечных артерий (аа. musculares) (рис. 3.12).
 Рис. 3.10. Топография концевых ветвей центральных артерии и вены сетчатки глаза на схеме и фотографии глазного дна.
Рис. 3.10. Топография концевых ветвей центральных артерии и вены сетчатки глаза на схеме и фотографии глазного дна.
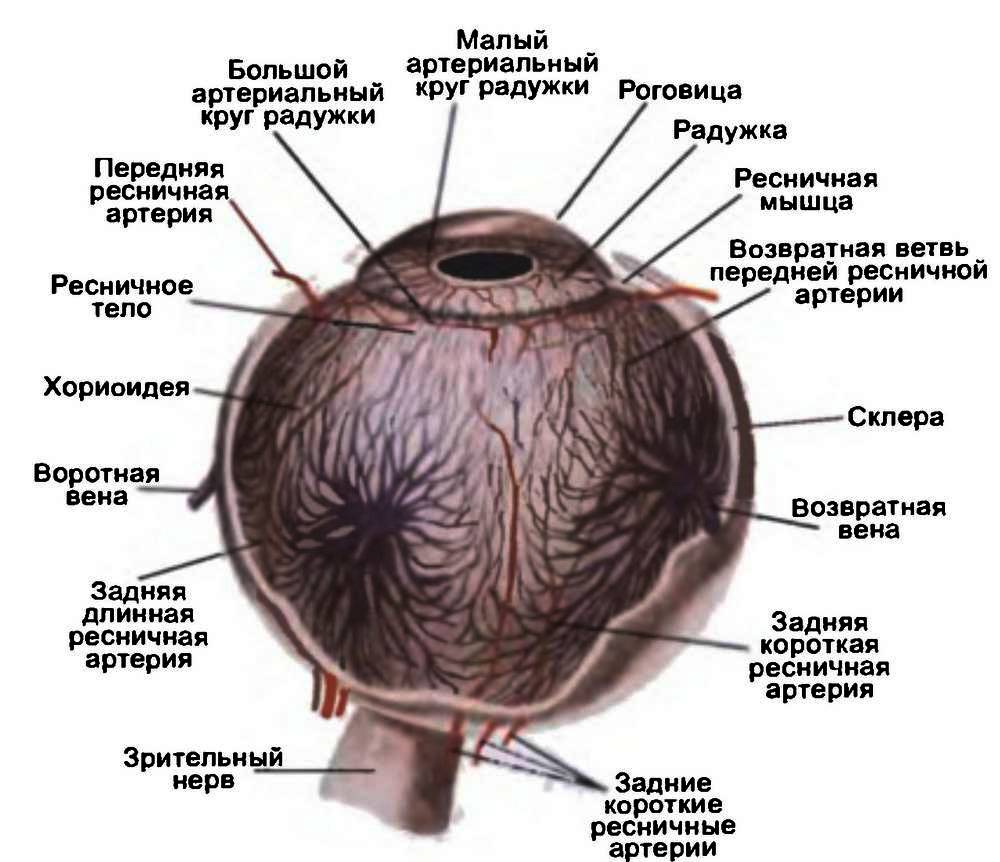 Рис. 3.11. Кровоснабжение сосудистого тракта глаза [по Spalteholz, 1923]
Рис. 3.11. Кровоснабжение сосудистого тракта глаза [по Spalteholz, 1923]
 Рис. 3.12. Сосудистая система глаза [по Spalteholz, 1923].
Рис. 3.12. Сосудистая система глаза [по Spalteholz, 1923].
Около корня радужки задние длинные ресничные артерии дихотомически делятся. Образовавшиеся ветви соединяются друг с другом и образуют большой артериальный круг радужки (circulus arteriosus iridis major). От него в радиальном направлении отходят новые веточки, формирующие в свою очередь уже на границе между зрачковым и ресничным поясами радужки малый артериальный круг (circulus arteriosus iridis minor).
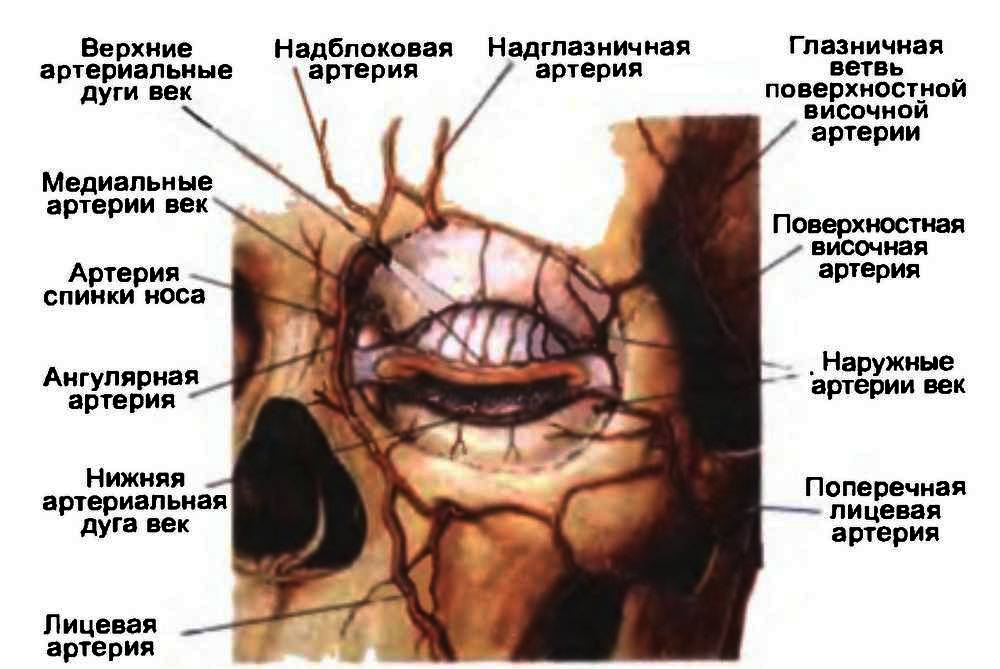 Рис. 3.13. Артериальное кровоснабжение век [по S. S. Dutton, 1994].
На склеру задние длинные ресничные артерии проецируются в зоне прохождения внутренней и наружной прямых мышц глаза. Эти ориентиры следует иметь в виду при планировании операций.
■ Мышечные артерии (aa.musculares) обычно представлены двумя более или менее крупными стволами – верхним (для мышцы, поднимающей верхнее веко, верхней прямой и верхней косой мышц) и нижним (для остальных глазодвигательных мышц). При этом артерии, питающие четыре прямые мышцы глаза, за пределами сухожильного прикрепления отдают к склере веточки, именуемые передними ресничными артериями (aa.ciliares anteriores), – по две от каждой мышечной ветви, за исключением наружной прямой мышцы, которая имеет одну веточку.
На расстоянии 3–4 мм от лимба передние ресничные артерии начинают делиться на мелкие веточки. Часть их направляется к лимбу роговицы и путем новых разветвлений образует двухслойную краевую петлистую сеть – поверхностную (plexus episcleralis) и глубокую (plexus scleralis). Другие веточки передних ресничных артерий перфорируют стенку глаза и вблизи корня радужки вместе с задними длинными ресничными артериями образуют большой артериальный круг радужки.
■ Медиальные артерии век (aa.palpebrales mediales) в виде двух ветвей (верхней и нижней) подходят к коже век в области их внутренней связки. Затем, располагаясь горизонтально, они широко анастомозируют с латеральными артериями век (aa.palpebrales laterales), отходящими от слезной артерии (a.lacrimalis). В результате образуются артериальные дуги век – верхнего (arcus palpebralis superior) и нижнего (arcus palpebralis inferior) (рис. 3.13). В их формировании участвуют также анастомозы от ряда других артерий: надглазничная (a.supraorbitalis) – ветвь глазной (a.ophthalmica), подглазничная (a.infraorbitalis) – ветвь верхнечелюстной (a.maxillaris), угловая (a.angularis) – ветвь лицевой (a.facialis), поверхностном височной (a.temporalis superficialis) – ветвь наружной сонной (a.carotis externa).
Обе дуги находятся в мышечном слое век на расстоянии 3 мм от ресничного края. Однако на верхнем веке часто имеется не одна, а две артериальные дуги. Вторая из них (периферическая) располагается над верхним краем хряща и соединяется с первой вертикальными анастомозами. Кроме того, от этих же дуг к задней поверхности хряща и конъюнктиве отходят мелкие перфорирующие артерии (aa.perforantes). Вместе с веточками медиальных и латеральных артерий век они образуют задние конъюнктивальные артерии, участвующие в кровоснабжении слизистой оболочки век и, частично, глазного яблока.
Питание конъюнктивы глазного яблока осуществляют передние и задние конъюнктивальные артерии. Первые отходят от передних ресничных артерий и направляются в сторону конъюнктивального свода, а вторые, будучи ветвями слезной и надглазничной артерий, идут им навстречу. Обе эти кровеносные системы связаны множеством анастомозов.
■ Слезная артерия (a.lacrimalis) отходит от начальной части дуги глазной артерии и располагается между наружной и верхней прямыми мышцами, отдавая им и слезной железе множественные веточки. Кроме того, она, как это указано выше, своими ветвями (aa.palpebrales laterales) принимает участие в образовании артериальных дуг век.
■ Надглазничная артерия (a. supraorbitalis), будучи достаточно крупным стволом глазной артерии, проходит в верхней части глазницы к одноименной вырезке в лобной кости. Здесь она вместе с латеральной ветвью надглазничного нерва (r.lateralis n.supraorbitalis) выходит под кожу, питая мышцы и .мягкие ткани верхнего века.
■ Надблоковая артерия (a. supratrochlearis) выходит из глазницы около блока вместе с одноименным нервом, перфорировав предварительно глазничную перегородку (septum orbitale).
■ Решетчатые артерии (aa.ethmoidales) также являются самостоятельными ветвями глазной артерии, однако роль их в питании тканей глазницы незначительная.
Из системы наружной сонной артерии в питании вспомогательных органов глаза принимают участие некоторые ветви лицевой и верхнечелюстной артерий.
■ Подглазничная артерия (a. infraorbitalis), являясь ветвью верхнечелюстной, проникает в глазницу через нижнюю глазничную щель. Располагаясь поднадкостнично, проходит по одноименному каналу на нижней стенке подглазничной борозды и выходит на лицевую поверхность верхнечелюстной кости. Участвует в питании тканей нижнего века. Мелкие веточки, отходящие от основного артериального ствола, участвуют в кровоснабжении нижней прямой и нижней косой мышц, слезной железы и слезного мешка.
■ Лицевая артерия (a.facialis) – достаточно крупный сосуд, располагающийся в медиальной части входа в глазницу. В верхнем отделе отдает большую ветвь – угловую артерию (a.angularis).
Рис. 3.13. Артериальное кровоснабжение век [по S. S. Dutton, 1994].
На склеру задние длинные ресничные артерии проецируются в зоне прохождения внутренней и наружной прямых мышц глаза. Эти ориентиры следует иметь в виду при планировании операций.
■ Мышечные артерии (aa.musculares) обычно представлены двумя более или менее крупными стволами – верхним (для мышцы, поднимающей верхнее веко, верхней прямой и верхней косой мышц) и нижним (для остальных глазодвигательных мышц). При этом артерии, питающие четыре прямые мышцы глаза, за пределами сухожильного прикрепления отдают к склере веточки, именуемые передними ресничными артериями (aa.ciliares anteriores), – по две от каждой мышечной ветви, за исключением наружной прямой мышцы, которая имеет одну веточку.
На расстоянии 3–4 мм от лимба передние ресничные артерии начинают делиться на мелкие веточки. Часть их направляется к лимбу роговицы и путем новых разветвлений образует двухслойную краевую петлистую сеть – поверхностную (plexus episcleralis) и глубокую (plexus scleralis). Другие веточки передних ресничных артерий перфорируют стенку глаза и вблизи корня радужки вместе с задними длинными ресничными артериями образуют большой артериальный круг радужки.
■ Медиальные артерии век (aa.palpebrales mediales) в виде двух ветвей (верхней и нижней) подходят к коже век в области их внутренней связки. Затем, располагаясь горизонтально, они широко анастомозируют с латеральными артериями век (aa.palpebrales laterales), отходящими от слезной артерии (a.lacrimalis). В результате образуются артериальные дуги век – верхнего (arcus palpebralis superior) и нижнего (arcus palpebralis inferior) (рис. 3.13). В их формировании участвуют также анастомозы от ряда других артерий: надглазничная (a.supraorbitalis) – ветвь глазной (a.ophthalmica), подглазничная (a.infraorbitalis) – ветвь верхнечелюстной (a.maxillaris), угловая (a.angularis) – ветвь лицевой (a.facialis), поверхностном височной (a.temporalis superficialis) – ветвь наружной сонной (a.carotis externa).
Обе дуги находятся в мышечном слое век на расстоянии 3 мм от ресничного края. Однако на верхнем веке часто имеется не одна, а две артериальные дуги. Вторая из них (периферическая) располагается над верхним краем хряща и соединяется с первой вертикальными анастомозами. Кроме того, от этих же дуг к задней поверхности хряща и конъюнктиве отходят мелкие перфорирующие артерии (aa.perforantes). Вместе с веточками медиальных и латеральных артерий век они образуют задние конъюнктивальные артерии, участвующие в кровоснабжении слизистой оболочки век и, частично, глазного яблока.
Питание конъюнктивы глазного яблока осуществляют передние и задние конъюнктивальные артерии. Первые отходят от передних ресничных артерий и направляются в сторону конъюнктивального свода, а вторые, будучи ветвями слезной и надглазничной артерий, идут им навстречу. Обе эти кровеносные системы связаны множеством анастомозов.
■ Слезная артерия (a.lacrimalis) отходит от начальной части дуги глазной артерии и располагается между наружной и верхней прямыми мышцами, отдавая им и слезной железе множественные веточки. Кроме того, она, как это указано выше, своими ветвями (aa.palpebrales laterales) принимает участие в образовании артериальных дуг век.
■ Надглазничная артерия (a. supraorbitalis), будучи достаточно крупным стволом глазной артерии, проходит в верхней части глазницы к одноименной вырезке в лобной кости. Здесь она вместе с латеральной ветвью надглазничного нерва (r.lateralis n.supraorbitalis) выходит под кожу, питая мышцы и .мягкие ткани верхнего века.
■ Надблоковая артерия (a. supratrochlearis) выходит из глазницы около блока вместе с одноименным нервом, перфорировав предварительно глазничную перегородку (septum orbitale).
■ Решетчатые артерии (aa.ethmoidales) также являются самостоятельными ветвями глазной артерии, однако роль их в питании тканей глазницы незначительная.
Из системы наружной сонной артерии в питании вспомогательных органов глаза принимают участие некоторые ветви лицевой и верхнечелюстной артерий.
■ Подглазничная артерия (a. infraorbitalis), являясь ветвью верхнечелюстной, проникает в глазницу через нижнюю глазничную щель. Располагаясь поднадкостнично, проходит по одноименному каналу на нижней стенке подглазничной борозды и выходит на лицевую поверхность верхнечелюстной кости. Участвует в питании тканей нижнего века. Мелкие веточки, отходящие от основного артериального ствола, участвуют в кровоснабжении нижней прямой и нижней косой мышц, слезной железы и слезного мешка.
■ Лицевая артерия (a.facialis) – достаточно крупный сосуд, располагающийся в медиальной части входа в глазницу. В верхнем отделе отдает большую ветвь – угловую артерию (a.angularis).
Венозная система органа зрения
Отток венозной крови непосредственно из глазного яблока происходит в основном по внутренней (ретинальной) и наружной (ресничной) сосудистым системам глаза. Первая представлена центральной веной сетчатки, вторая – четырьмя вортикозными венами (см. рис. 3.10 и 3.11). Рис. 3.14. Глубокие вены глазницы и лица [no R. Thiel, 1946].
Центральная вена сетчатки (v.centralis retinae) сопровождает соответствующую артерию и имеет такое же, как она, распределение. В стволе зрительного нерва соединяется с центральной артерией сетчатки в так называемый центральный соединительный тяж посредством отростков, отходящих от мягкой мозговой оболочки. Впадает либо непосредственно в пещеристый синус (sinus cavernosus), либо предварительно в верхнюю глазную вену (v.ophthalmica superior).
Рис. 3.14. Глубокие вены глазницы и лица [no R. Thiel, 1946].
Центральная вена сетчатки (v.centralis retinae) сопровождает соответствующую артерию и имеет такое же, как она, распределение. В стволе зрительного нерва соединяется с центральной артерией сетчатки в так называемый центральный соединительный тяж посредством отростков, отходящих от мягкой мозговой оболочки. Впадает либо непосредственно в пещеристый синус (sinus cavernosus), либо предварительно в верхнюю глазную вену (v.ophthalmica superior).
Вортикозные вены (vv.vorticosae) отводят кровь из хориоидеи, ресничных отростков и большей части мышц ресничного тела, а также радужки. Они просекают склеру в косом направлении в каждом из квадрантов глазного яблока на уровне его экватора. Верхняя пара вортикозных вен впадает в верхнюю глазную вену, нижняя – в нижнюю.
Отток венозной крови из вспомогательных органов глаза и глазницы происходит по сосудистой системе, которая имеет сложное строение и характеризуется рядом очень важных в клиническом отношении особенностей (рис. 3.14). Все вены этой системы лишены клапанов, вследствие чего отток по ним крови может происходить как в сторону пещеристого синуса, т. е. в полость черепа, так и в систему вен лица, которые связаны с венозными сплетениями височной области головы, крыловидного отростка, крылонебной ямки, мыщелкового отростка нижней челюсти. Кроме того, венозное вплетение глазницы анастомозирует с венами решетчатых пазух и носовой полости. Все эти особенности и обусловливают возможность опасного распространения гнойной инфекции с кожи лица (фурункулы, абсцессы, рожистое воспаление) или из околоносовых пазух в пещеристый синус.
Двигательная и чувствительная иннервация глаза и его вспомогательных органов
Двигательная иннервация органа зрения человека реализуется с помощью III, IV, VI и VII пар черепных нервов, чувствительная – посредством первой (n.ophthalmicus) и отчасти второй (n.maxillaris) ветвей тройничного нерва (V пара черепных нервов).Глазодвигательный нерв (n.oculomotorius, III пара черепных нервов) начинается от ядер, лежащих на дне сильвиева водопровода на уровне передних бугров четверохолмия. Эти ядра неоднородны и состоят из двух главных боковых (правого и левого), включающих по пять групп крупных клеток (nucl.oculomotorius), и добавочных мелкоклеточных (nucl.oculomotorius accessorius) – двух парных боковых (ядро Якубовича – Эдингера – Вестфаля) и одного непарного (ядро Перлиа), расположенного между ними (рис. 3.15). Протяженность ядер глазодвигательного нерва в переднезаднем направлении 5–6 мм.
От парных боковых крупноклеточных ядер (а–д) отходят волокна для трех прямых (верхней, внутренней и нижней) и нижней косой глазодвигательных мышц, а также для двух порций мышцы, поднимающей верхнее веко, причем волокна, иннервирующие внутреннюю и нижнюю прямые, а также нижнюю косую мышцы, сразу же перекрещиваются.
Волокна, отходящие от парных мелкоклеточных ядер, через ресничный узел иннервируют мышцу сфинктера зрачка (m. sphincter pupillae), а отходящие от непарного ядра – ресничную мышцу.
 Рис. 3.15. Иннервация наружных и внутренних мышц глаза [по R. Bing, В. Bruckner, 1959].
Рис. 3.15. Иннервация наружных и внутренних мышц глаза [по R. Bing, В. Bruckner, 1959].
Посредством волокон медиального продольного пучка ядра глазодвигательного нерва связаны с ядрами блокового и отводящего нервов, системой вестибулярных и слуховых ядер, ядром лицевого нерва и передними рогами спинного мозга. Благодаря этому обеспечиваются согласованные рефлекторные реакции глазного яблока, головы, туловища па всевозможные импульсы, в частности вестибулярные, слуховые и зрительные.
Через верхнюю глазничную щель глазодвигательный нерв проникает в глазницу, где в пределах мышечной воронки делится па две ветви – верхнюю и нижнюю. Верхняя топкая ветвь располагается между верхней прямой мышцей и мышцей, поднимающей верхнее веко, и иннервирует их. Нижняя, более крупная, ветвь проходит под зрительным нервом и делится на три веточки – наружную (от нееотходит корешок к ресничному узлу и волокна для нижней косой мышцы), среднюю и внутреннюю (иннервируют соответственно нижнюю и внутреннюю прямые мышцы). Корешок (radix oculomotoria) несет в себе волокна от добавочных ядер глазодвигательного нерва. Они иннервируют ресничную мышцу и сфинктер зрачка.
Блоковый нерв (n.trochlearis, IV пара черепных нервов) начинается от двигательного ядра (длина 1,5–2 мм), расположенного на дне сильвиева водопровода сразу же за ядром глазодвигательного нерва. Проникает в глазницу через верхнюю глазничную щель латеральнее мышечной воронки. Иннервирует верхнюю косую мышцу.
Отводящий нерв (n.abducens, VI пара черепных нервов) начинается от ядра, расположенного в варолиевом мосту на дне ромбовидной ямки. Покидает полость черепа через верхнюю глазничную щель, располагаясь внутри мышечной воронки между двумя ветвям и глазодвигательного нерва. Иннервирует наружную прямую мышцу глаза.
Лицевой нерв (n.facialis, n.intermediofacialis, VII пара черепных нервов) имеет смешанный состав, т. е. включает не только двигательные, но также чувствительные, вкусовые и секреторные волокна, которые принадлежат промежуточному нерву (n.intermedins Wrisbergi). Последний тесно прилежит к лицевому нерву на основании мозга с наружной стороны и является его задним корешком.
Двигательное ядро нерва (длина 2–6 мм) расположено в нижнем отделе варолиева моста на дне IV желудочка. Отходящие от него волокна выходят в виде корешка на основание мозга в мостомозжечковом углу. Затем лицевой нерв вместе с промежуточным входит в лицевой канал височной кости. Здесь они сливаются в общий ствол, который далее пронизывает околоушную слюнную железу и делится па две ветви, образующие околоушное сплетение – plexus parotideus. От него к мимическим мышцам отходят нервные стволы, иннервирующие в том числе круговую мышцу глаза.
Промежуточный нерв содержит секреторные волокна для слезной железы. Они отходят от слезного ядра, расположенного в стволовой части мозга и через узел коленца (gangl.geniculi) попадают в большой каменистый нерв (n.petrosus major).
Афферентный путь для основной и добавочных слезных желез начинается конъюнктивальными и носовыми ветвями тройничного нерва. Существуют и другие зоны рефлекторной стимуляции слезопродукции – сетчатка, передняя лобная доля мозга, базальный ганглий, таламус, гипоталамус и шейный симпатический ганглий.
Уровень поражения лицевого нерва можно определить по состоянию секреции слезной жидкости. Когда она не нарушена, очаг находится ниже gangl.geniculi и наоборот.
Тройничный нерв (n.trigeminus, V пара черепных нервов) является смешанным, т. е. содержит чувствительные, двигательные, парасимпатические и симпатические волокна.
 Рис. 3.16. Ресничный ганглий и его иннервационные связи (схема).
Рис. 3.16. Ресничный ганглий и его иннервационные связи (схема).
В нем выделяют ядра (три чувствительных – спинномозговое, мостовое, среднемозговое – и одно двигательное), чувствительный и двигательный корешки, а также тройничный узел (на чувствительном корешке).
Чувствительные нервные волокна начинаются от биполярных клеток мощного тройничного узла (gangl.trigeminale) шириной 14–29 мм и длиной 5–10 мм.
Аксоны тройничного узла образуют три главные ветви тройничного нерва. Каждая из них связана с определенными нервными узлами: глазной нерв (n.ophthalmicus) – с ресничным (gangl.ciliare), верхнечелюстной (n.maxillaris) – с крылонебным (gangl.pterygopalatinum) и нижнечелюстной (n.mandibularis) – с ушным (gangl.oticum), поднижнечелюстным (gangl. submandibulare) и подъязычный (gangl. sublinguale).
Первая ветвь тройничного нерва (n.ophthalmicus), будучи наиболее тонкой (2–3 мм), выходит из полости черепа через fissura orbitalis superior. При подходе к ней нерв делится на три основные ветви: n.nasociliaris, n.frontalis и n.lacrimalis.
N.nasociliaris, расположенный в пределах мышечной воронки глазницы, в свою очередь делится на длинные ресничные, решетчатые и носовые ветви и отдает, кроме того, корешок (radix nasociliaris) к ресничному узлу (gangl.ciliare).
Длинные ресничные нервы в виде 3–4 гонких стволов направляются к заднему полюсу глаза, перфорируют склеру в окружности зрительного нерва и по супрахориоидальному пространству направляются кпереди. Вместе с короткими ресничными нервами, отходящими от ресничного узла, они образуют густое нервное сплетение в области ресничного тела (plexus ciliaris) и по окружности роговицы. Веточки этих сплетений обеспечивают чувствительную и трофическую иннервацию соответствующих структур глаза и перилимбальной конъюнктивы. Остальная часть ее получает чувствительную иннервацию от пальпебральных ветвей тройничного нерва, что следует иметь в виду при планировании анестезии глазного яблока.
На пути к глазу к длинным ресничным нервам присоединяются симпатические нервные волокна из сплетения внутренней сонной артерии, которые иннервируют дилататор зрачка.
Короткие ресничные нервы (4–6) отходят от ресничного узла, клетки которого посредством чувствительного, двигательного и симпатического корешков связаны с волокнами соответствующих нервов. Он находится на расстоянии 18–20 мм за задним полюсом глаза под наружной прямой мышцей, прилегая в этой зоне к поверхности зрительного нерва (рис. 3.16).
Как и длинные ресничные нервы, короткие тоже подходят к заднему полюсу глаза, перфорируют склеру по окружности зрительного нерва и, увеличиваясь в числе (до 20–30), участвуют в иннервации тканей глаза, в первую очередь его сосудистой оболочки.
Длинные и короткие ресничные нервы являются источником чувствительной (роговица, радужка, ресничное тело), вазомоторной и трофической иннервации.
Конечной ветвью n. nasociliaris является подблоковый нерв (n.infratrochlearis), который иннервирует кожу в области корня носа, внутреннего угла век и соответствующие отделы конъюнктивы.
Лобный нерв (n.frontalis), будучи наиболее крупной ветвью глазного нерва, после входа в глазницу отдает две крупные ветви – надглазничный нерв (n.supraorbitalis) с медиальной и латеральной ветвями (r.medialis et lateralis) и надблоковый нерв. Первый из них, перфорировав тарзоорбитальную фасцию, проходит через носоглазничное отверстие (incisura supraorbitalis) лобной кости к коже лба, а второй выходит из глазницы у ее внутренней стенки и иннервирует небольшую зону кожи века над его внутренней связкой. В целом лобный нерв обеспечивает чувствительную иннервацию средней части верхнего века, включая конъюнктиву, и кожи лба.
Слезный нерв (n.lacrimalis), войдя в глазницу, идет кпереди над наружной прямой мышцей глаза и делится на две веточки – верхнюю (более крупную) и нижнюю. Верхняя ветвь, являясь продолжением основного нерва, отдает веточки к слезной железе и конъюнктиве. Часть их после прохождения железы перфорирует тарзоорбитальную фасцию и иннервирует кожу в области наружного угла глаза, включая участок верхнего века. Небольшая нижняя веточка слезного нерва анастомозирует со скуловисочной ветвью (r. zygomaticotemporalis) скулового нерва, несущей секреторные волокна для слезной железы.
Вторая ветвь тройничного нерва (n.maxillaris) принимает участие в чувствительной иннервации только вспомогательных органов глаза посредством двух своих ветвей – n.infraorbitalis и n.zygomaticus. Оба эти нерва отделяются от основного ствола в крылонебной ямке и проникают в полость глазницы через нижнюю глазничную щель.
Подглазничный нерв (n.infraorbitalis), войдя в глазницу, проходит по борозде ее нижней стенки и через подглазничный канал выходит на лицевую поверхность. Иннервирует центральную часть нижнего века (rr.palpebrales inferiores), кожу крыльев носа и слизистую оболочку его преддверия (rr.nasales interni et externi), а также слизистую оболочку верхней губы (rr.labiales superiores), верхней десны, луночковых углублений и, кроме того/верхний зубной ряд.
Скуловой нерв (n.zygomaticus) в полости глазницы делится на две веточки – n.zygomaticotemporalis и n.zygomaticofacialis. Пройдя через соответствующие каналы в скуловой кости, они иннервируют кожу боковой части лба и небольшой зоны скуловой области.
Глава 4. Основные функции органа зрения и методы их исследования
Что нужно для того, чтобы ясно видеть? Не глядеть сквозь самих себя.Орган зрения является для человека важнейшим из всех органов чувств. Он позволяет получить до 90% информации об окружающем мире. Зрительный анализатор строго адаптирован к восприятию доходящей до Земли через атмосферу видимой части спектра светового излучения с длиной волны 380–760 нм.
Зрение является сложным и до конца не изученным процессом. Схематично его можно представить следующим образом. Отраженные от окружающих нас предметов лучи света собираются оптической системой глаза на сетчатке. Фоторецепторы сетчатки – палочки и колбочки – трансформируют световую энергию в нервный импульс благодаря фотохимическому процессу разложения с последующим ресинтезом зрительного пигмента хромопротеида, состоящего из хромофора (ретиналя) – альдегида витамина А – и опсина. Зрительный пигмент, содержащийся в палочках, называют родопсином, в колбочках – йодопсином. Молекулы ретиналя находятся в дисках наружных сегментов фоторецепторов и под воздействием света подвергаются фотоизомеризации (цис– и трансизомеры), вследствие чего и рождается нервный импульс.
Палочковый аппарат является образованием, высокочувствительным к свету при пороговой и надпороговой освещенности – ночное (скотопическое: от греч. skotos – темнота и opsis – зрение), а также при слабой освещенности (0,1–0,3 лк) – сумеречное (мезопическое: от греч. mesos – средний, промежуточный) зрение (определяется полем зрения и темновой адаптацией). Колбочковый аппарат сетчатки глаза обеспечивает дневное, или фотопическое (от греч. photos – свет), зрение (определяется остротой зрения и цветовым зрением). В формировании зрительного образа участвуют рецепторные (периферические), проводящие и корковые отделы зрительного анализатора. В головном мозге в результате синтеза двух изображений создается идеальный образ всего видимого человеком. Подтверждением реальности зрительного образа служит возможность его распознавания по другим сигналам: речевым, слуховым, осязательным и др.
Основными функциями органа зрения являются центральное, периферическое, цветовое и бинокулярное зрение, а также светоощущение.
Центральное зрение
Центральным зрением следует считать центральный участок видимого пространства. Основное предназначение этой функции – служить восприятию мелких предметов или их деталей (например, отдельных букв при чтении страницы книги). Это зрение является наиболее высоким и характеризуется понятием "острота зрения".Острота зрения (Visus или Vis) – способность глаза различать две точки раздельно при минимальном расстоянии между ними, которая зависит от особенностей строения оптической системы и световоспринимающего аппарата глаза. Центральное зрение обеспечивают колбочки сетчатки, занимающие ее центральную ямку диаметром 0,3 мм в области желтого пятна. По мере удаления от центра острога зрения резко снижается. Это объясняется изменением плотности расположения нейроэлементов и особенностью передачи импульса. Импульс от каждой колбочки центральной ямки проходит по отдельным нервным волокнам через все отделы зрительного пути, что обеспечивает четкое восприятие каждой точки и мелких деталей предмета.
 Рис. 4.1. Угол зрения. Объяснение в тексте.
Рис. 4.1. Угол зрения. Объяснение в тексте.
Точки А и В (рис. 4.1) будут восприниматься раздельно при условии, если их изображения на сетчатке "b" и "a" будут разделены одной невозбужденной колбочкой V. Это создает минимальный световой промежуток между двумя отдельно лежащими точками.
Диаметр колбочки "с" определяет величину максимальной остроты зрения. Чем меньше диаметр колбочек, тем выше острота зрения. Изображения двух точек, если они попадут па две соседние колбочки, сольются и буду!' восприниматься в виде короткой линии.
С учетом размеров глазного яблока и диаметра колбочки 0,004 мм минимальные углы aOb и AOB равны 1°. Этот угол, позволяющий видеть две точки раздельно, в физиологической оптике называется углом зрения, иными словами, это угол, образованный точками рассматриваемого объекта (А и В) и узловой (О) точкой глаза.
Определение остроты зрения (визометрия). Для исследования остроты зрения используют специальные таблицы, содержащие буквы, цифры или значки различной величины, а для детей – рисунки (чашечка, елочка и др.). Их называют оптотипами (рис. 4.2).
В физиологической оптике существуют понятия минимально видимого, различимого и узнаваемого. Обследуемый должен видеть оптотип, различать его детали, узнавать представляемый знак иди букву. Оптотипы можно проецировать па экран или дисплей компьютера.
В основу создания оптотипов положено международное соглашение о величине их деталей, различаемых под углом зрения Г, тогда как весь оптотип соответствует углу зрения 5‘.
В нашей стране наиболее распространенным является метод определения остроты зрения по таблице Головина–Сивцева (рис. 4.3), помещенной в аппарат Рота. Нижний край таблицы должен находиться на расстоянии 120 см от уровня пола. Пациент сидит на расстоянии 5 м от экспонируемой таблицы. Сна ч ала определяют остроту зрения правого, затем – левого глаза. Второй глаз закрывают заслонкой.
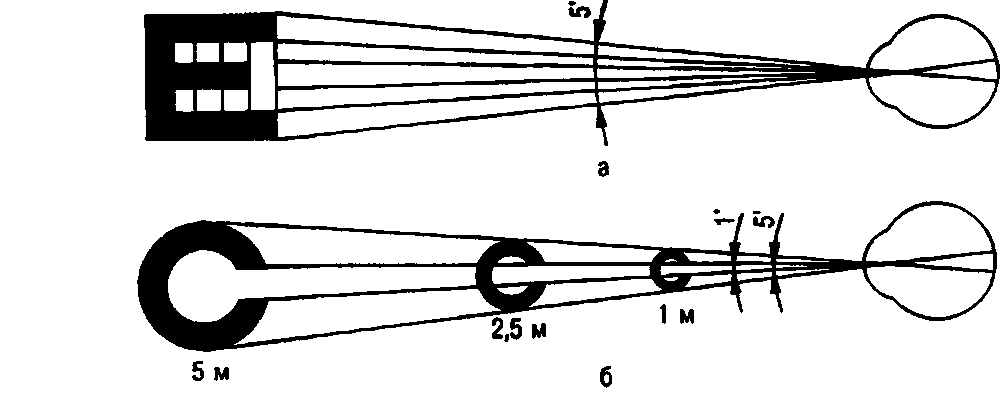 Таблица имеет 12 рядов букв или знаков, величина которых постепенно уменьшается от верхнего ряда к нижнему. В построении таблицы использована десятичная система: при прочтении каждой последующей строчки острота зрения увеличивается на 0,1– Справа от каждой строки указана острота зрения, которой соответствует распознавание букв в этом ряду. Слева против каждой строки указано то расстояние, с которого детали этих букв будут видны под углом зрения Г, а вся буква – под углом зрения 5'. Так, при нормальном зрении, принятом за 1,0, верхняя строка будет видна с расстояния 50 м, а десятая – с расстояния 5 м.
Таблица имеет 12 рядов букв или знаков, величина которых постепенно уменьшается от верхнего ряда к нижнему. В построении таблицы использована десятичная система: при прочтении каждой последующей строчки острота зрения увеличивается на 0,1– Справа от каждой строки указана острота зрения, которой соответствует распознавание букв в этом ряду. Слева против каждой строки указано то расстояние, с которого детали этих букв будут видны под углом зрения Г, а вся буква – под углом зрения 5'. Так, при нормальном зрении, принятом за 1,0, верхняя строка будет видна с расстояния 50 м, а десятая – с расстояния 5 м.

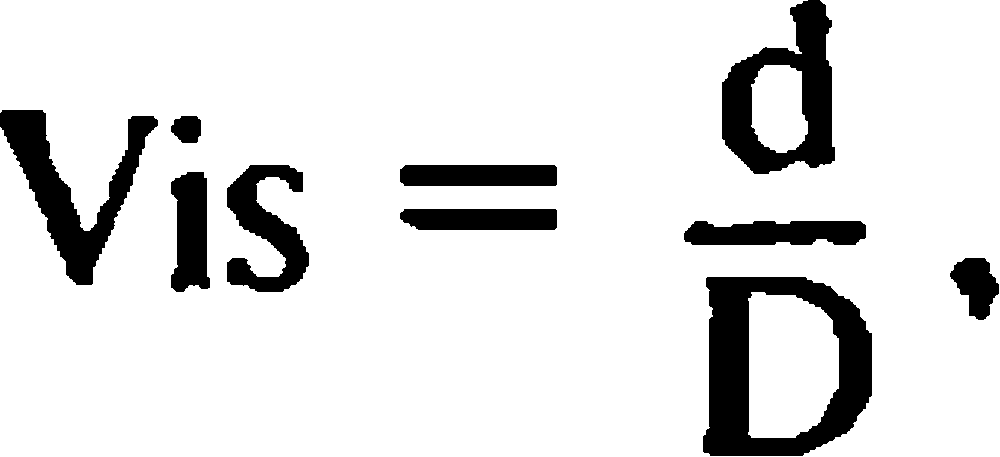
 Рис. 4.3. Таблицы для определения остроты зрения Головина – Сивцева.
Рис. 4.3. Таблицы для определения остроты зрения Головина – Сивцева.
Встречаются люди и с более высокой остротой зрения – 1,5; 2,0 и более. Они читают одиннадцатую или двенадцатую строку таблицы. Описан случай остроты зрения, равной 60,0. Обладатель такого зрения невооруженным глазом различал спутники Юпитера, которые с Земли видны под углом 1".
При остроте зрения ниже 0,1 обследуемого нужно приближать к таблице до момента, когда он увидит ее первую строку. Расчет остроты зрения следует производить по формуле Снеллепа:
Vis=d/D
где d – расстояние, с которого обследуемый распознает оптотип; D – расстояние, с которого данный оптотип виден при нормальной остроте зрения. Для первой строки D равно 50 м. Например, пациент видит первую строку таблицы на расстоянии 2 м. В этом случае
Поскольку толщина пальцев руки примерно соответствует ширине штрихов оптотипов первой строки таблицы, можно демонстрировать обследуемому раздвинутые пальцы (желательно на темном фоне) с различного расстояния и соответственно определять остроту зрения ниже 0,1 также по приведенной выше формуле. Если острота зрения ниже 0,01, но обследуемый считает пальцы на расстоянии 10 см (или 20, 30 см), тогда Vis равна счету пальцев на расстоянии 10 см (или 20, 30 см). Больной может быть не способен считать пальцы, но определяет движение руки у лица, это считается следующей градацией остроты зрения.
 Рис. 4.4. Оптотипы Поляка.
Рис. 4.4. Оптотипы Поляка.
Минимальной остротой зрения является светоощущение (Vis=1/оо) с правильной (proectia lucis certa) или неправильной (proectia lucis incerta) светопроекцией. Светопроекцию определяют путем направления в глаз с разных сторон луча света от офтальмоскопа. При отсутствии светоощущения острота зрения равна нулю (Vis=0) и глаз считается слепым.
Для определения остроты зрения ниже 0,1 применяют оптотипы, разработанные Б. Л. Поляком, в виде штриховых тестов или колец Ландольта, предназначенных для предъявления на определенном близком расстоянии с указанием соответствующей остроты зрения (рис. 4.4). Данные оптотипы специально созданы для военно–врачебной и медико–социальной экспертизы, проводимой при определении годности к военной службе или группы инвалидности.
Существует и объективный (не зависящий от показаний пациента) способ определения остроты зрения, основанный на оптокинетическом нистагме. С помощью специальных аппаратов обследуемому демонстрируют движущиеся объекты в виде полос или шахматной доски. Наименьшая величина объекта, вызвавшая непроизвольный нистагм (увиденный врачом), и соответствует остроте зрения исследуемого глаза.
В заключение следует отметить, что в течение жизни острота зрения изменяется, достигая максимума (нормальных величин) к 5–15 годам и затем постепенно снижаясь после 40–50 лет.
Периферическое зрение
Периферическое зрение является функцией палочкового и колбочкового аппарата всей оптически деятельной сетчатки и определяется полем зрения. Поле зрения – это видимое глазом (глазами) пространство при фиксированном взоре. Периферическое зрение помогает ориентироваться в пространстве.Поле зрения исследуют с помощью периметрии. Самый простой способ – контрольное (ориентировочное) исследование по Дондерсу. Обследуемый и врач располагаются лицом друг к другу на расстоянии 50–60 см, после чего врач закрывает правый глаз, а обследуемый – левый. При этом обследуемый открытым правым глазом смотрит в открытый левый глаз врача и наоборот. Поле зрения левого глаза врача служит контролем при определении поля зрения обследуемого. На срединном расстоянии между ними врач показывает пальцы, перемещая их в направлении от периферии к центру. При совпадении границ обнаружения демонстрируемых пальцев врачом и обследуемым поле зрения последнего считается неизмененным. При несовпадении отмечается сужение поля зрения правого глаза обследуемого по направлениям движения пальцев (кверху, книзу, с носовой или височной стороны, а также в радиусах между ними). После проверки поля зрения правого глаза определяют поле зрения левого глаза обследуемого при закрытом правом, при этом у врача закрыт левый глаз. Данный метод считается ориентировочным, так как не позволяет получить числового выражения степени сужения границ поля зрения. Метод может быть применен в тех случаях, когда нельзя провести исследование на приборах, в том числе у лежачих больных.
Наиболее простым прибором для исследования поля зрения является периметр Ферстера, представляющий собой дугу черного цвета (на подставке), которую можно смещать в различных меридианах. При проведении исследования на этом и других приборах необходимо соблюдать следующие условия. Голову обследуемого устанавливают на подставке таким образом, чтобы исследуемый глаз находился в центре дуги (полусферы), а второй глаз был закрыт повязкой. Кроме того, в течение всего исследования обследуемый должен фиксировать метку в центре прибора. Обязательна также адаптация пациента к условиям проведения исследования в течение 5–10 мин. Врач перемещает по дуге периметра Ферстера в различных меридианах исследования белую или цветные метки от периферии к центру, определяя таким образом границы их обнаружения, т. е. границы поля зрения.
Периметрию на широко вошедшем в практику универсальном проекционном периметре (ППУ) также проводят монокулярно. Правильность центровки глаза контролируют с помощью окуляра. Сначала проводят периметрию на белый цвет. При исследовании поля зрения на различные цвета включают светофильтр: красный (К), зеленый (ЗЛ), синий (С), желтый (Ж). Объект перемещают от периферии к центру вручную или автоматически после нажатия на клавишу "Движение объекта” на панели управления. Изменение меридиана исследования осуществляют поворотом проекционной системы периметра. Регистрацию величины поля зрения проводит врач на бланке–графике (отдельно для правого и левого глаза).
 Рис. 4.5. Нормальные границы моля зрения на белый и хроматические цвета.
Рис. 4.5. Нормальные границы моля зрения на белый и хроматические цвета.
Более сложными являются современные периметры, в том числе на компьютерной основе. На полусферическом или каком–либо другом экране в различных меридианах передвигаются или вспыхивают белые либо цветные метки. Соответствующий датчик фиксирует показатели испытуемого, обозначая границы поля зрения и участки выпадения в нем на специальном бланке или в виде компьютерной распечатки.
При определении границ поля зрения на белый цвет обычно используют круглую метку диаметром 3 мм. При низком зрении можно увеличить яркость освещения метки либо использовать метку большего диаметра. Периметрию па различные цвета проводят с меткой 5 мм. В связи с тем что периферическая часть поля зрения является ахроматичной, цветная метка поначалу воспринимается как белая или серая разной яркости и лишь при входе в хроматическую зону поля зрения она приобретает соответствующую окраску (синюю, зеленую, красную), и только после этого обследуемый должен регистрировать светящийся объект. Наиболее широкие границы имеет поле зрения на синий и желтый цвета, немного уже поле на красный цвет и самое узкое – на зеленый (рис. 4.5).
Нормальными границами поля зрения на белый цвет считают кверху 45–55°, кверху кнаружи 65°, кнаружи 90°, книзу 60–70°, книзу кнутри 45°, кнутри 55°, кверху кнутри 50°.
Изменения границ поля зрения могут происходить при различных поражениях сетчатки, хориоидеи и зрительных путей, при патологии головного мозга.
 Рис. 4.6. Концентрическое сужение поля зрения разной степени.
Рис. 4.6. Концентрическое сужение поля зрения разной степени.
Информативность периметрии увеличивается при использовании меток разных диаметра и яркости – так называемая квантитативная, или количественная, периметрия. Она позволяет определить начальные изменения при глаукоме, дистрофических поражениях сетчатки и других заболеваниях глаз. Для исследования сумеречного и ночного (скотопического) поля зрения применяют самую слабую яркость фона и низкую освещенность метки, чтобы оцепить функцию палочкового аппарата сетчатки.
В последние годы в практику входит визоконтрастопериметрия, представляющая собой способ оценки пространственного зрения с помощью черно–белых или цветных полос разной пространственной частоты, предъявляемых в виде таблиц или на дисплее компьютера. Нарушение восприятия разных пространственных частот (решеток) свидетельствует о наличии изменений на соответствующих участках сетчатки или поля зрения.
Концентрическое сужение поля зрения со всех сторон характерно для пигментной дистрофии сетчатки и поражения зрительного нерва. Поле зрения может уменьшиться вплоть до трубочного, когда остается только участок 5–10° в центре. Пациент еще может читать, но не может самостоятельно ориентироваться в пространстве (рис. 4.6).
Симметричные выпадения в полях зрения правого и левого глаза – симптом, свидетельствующий о наличии опухоли, кровоизлияния или очага воспаления в основании мозга, области гипофиза или зрительных трактов.
Гетеронимная битемпоральная гемианопсия – это симметричное половинчатое выпадение височных частей полей зрения обоих глаз. Оно возникает при поражении внутри хиазмы перекрещивающихся нервных волокон, идущих от носовых половин сетчатки правого и левого глаза (рис. 4.7).
Гетеронимная биназальная симметричная гемианопсия встречается редко, например при выраженном склерозе сонных артерий, одинаково сдавливающих хиазму с двух сторон.
Гомонимная гемианопсия – это половинчатое одноименное (право– или левостороннее) выпадение полей зрения в обоих глазах (рис. 4.8). Оно возникает при наличии патологии, затрагивающей один из зрительных трактов. Если поражается правый зрительный тракт, то возникает левосторонняя гомонимная гемианопсия, т. е. выпадают левые половины полей зрения обоих глаз. При поражении левого зрительного тракта развивается правосторонняя гемианопсия.

 Рис. 4.7. Гетеронимная гемианопсия. а – битемпоральная; б – биназальная.
Рис. 4.7. Гетеронимная гемианопсия. а – битемпоральная; б – биназальная.
В начальной стадии опухолевого или воспалительного процесса может быть сдавлена только часть зрительного тракта. В этом случае регистрируются симметричные гомонимные квадрантные гемианопсии, т. е. выпадает четверть поля зрения в каждом глазу, например пропадает левая верхняя четверть поля зрения как в нравом, так и в левом глазу (рис. 4.9). Когда опухоль мозга затрагивает корковые отделы зрительных путей, вертикальная линия гомонимных выпадений полей зрения не захватывает центральные отделы, она обходит точку фиксации, т. е. зону проекции желтого пятна. Это объясняется тем, что волокна от нейроэлементов центрального отдела сетчатки уходят в оба полушария головного мозга (рис. 4.10).
 Рис. 4.8. Гомонимная гемианопсия.
Рис. 4.8. Гомонимная гемианопсия.
 Рис. 4.9. Квадрантная гомонимная гемианопсия.
Рис. 4.9. Квадрантная гомонимная гемианопсия.
Патологические процессы в сетчатке и зрительном нерве могут вызывать изменения границ поля зрения различной формы. Для глаукомы, например, характерно сужение поля зрения с носовой стороны.
Локальные выпадения внутренних участков поля зрения, не связанных с его границами, называют скотомами. Их определяют с использованием объекта диаметром 1 мм также в различных меридианах, при этом особенно тщательно исследуют центральный и парацентральный отделы. Скотомы бывают абсолютными (полное выпадение зрительной функции) и относительными (понижение восприятия объекта в исследуемом участке поля зрения). Наличие скотом свидетельствует об очаговых поражениях сетчатки и зрительных путей. Скотома может быть положительной и отрицательной. Положительную скотому видит сам больной как темное или серое пятно перед глазом. Такое выпадение в поле зрения возникает при поражениях сетчатки и зрительного нерва. Отрицательную скотому сам больной не обнаруживает, ее выявляют при исследовании. Обычно наличие такой скотомы свидетельствует о поражении проводящих путей (рис. 4.11).
 Рис. 4.10. Гомонимная гемианопсия с сохранением центрального зрения.
Рис. 4.10. Гомонимная гемианопсия с сохранением центрального зрения.
Мерцательные скотомы – это внезапно появляющиеся кратковременные перемещающиеся выпадения в поле зрения. Даже в том случае, когда пациент закрывает глаза, он видит яркие, мерцающие зигзагообразные линии, уходящие на периферию. Этот симптом является признаком спазма сосудов головного мозга. Мерцательные скотомы могут повторяться с неопределенной периодичностью. При их появлении пациент должен немедленно принимать спазмолитические средства.
По месту расположения скотом в поле зрения выделяют периферические, центральные и парацентральные скотомы. На удалении 12–18° от центра в височной половине располагается слепое пятно. Это – физиологическая абсолютная скотома. Она соответствует проекции диска зрительного нерва. Увеличение слепого пятна имеет важное диагностическое значение.
Центральные и парацентральные скотомы выявляют при кампиметрии. Пациент фиксирует взглядом светлую точку в центре плоской черной доски и следит за появлением и исчезновением белой (или цветной) метки, которую врач переметает по доске, и отмечает границы дефектов поля зрения.
Центральные и парацентральные скотомы появляются при поражении папилломакулярного пучка зрительного нерва, сетчатки и хориоидеи. Центральная скотома может быть первым проявлением рассеянного склероза.
Цветоощущение
Цветовое зрение – способность глаза к восприятию цветов на основе чувствительности к различным диапазонам излучения видимого спектра. Это функция колбочкового аппарата сетчатки.Можно условно выделить три группы цветов в зависимости от длины волны излучения: длинноволновые – красный и оранжевый, средневолновые – желтый и зеленый, коротковолновые – голубой, синий, фиолетовый. Все многообразие цветовых оттенков (несколько десятков тысяч) можно получить при смешении трех основных цветов – красного, зеленого, синего. Все эти опенки способен различить глаз человека. Это свойство глаза имеет большое значение в жизни человека. Цветовые сигналы широко используют на транспорте, в промышленности и других отраслях народного хозяйства. Правильное восприятие цвета необходимо во всех медицинских специальностях, в настоящее время даже рентгенодиагностика стала не только черно–белой, но и цветной (рис. 4.12, 4.13).
Идея трехкомпонентности цветовосприятия впервые была высказана М. В. Ломоносовым еще в 1756 г. В 1802 г. Т. Юнг опубликовал работу, ставшую основой трехкомпонентной теории цветовосприятия. Существенный вклад в разработку этой теории внесли Г. Гельмгольц и его ученики. Согласно трехкомпонентной теории Юнга – Ломоносова – Гельмгольца, существует три типа колбочек. Каждому из них свойствен определенный пигмент, избирательно стимулируемый определенным монохроматическим излучением. Синие колбочки имеют максимум спектральной чувствительности в диапазоне 430–468 нм, у зеленых колбочек максимум поглощения находится на уровне 530 нм, а у красных – 560 нм.
В то же время цветоощущение есть результат воздействия света на все три типа колбочек. Излучение любой длины волны возбуждает все колбочки сетчатки, но в разной степени (рис. 4.14). При одинаковом раздражении всех трех групп колбочек возникает ощущение белого цвета. Существуют врожденные и приобретенные расстройства цветового зрения. Около 8% мужчин имеют врожденные дефекты цветовосприятия. У женщин эта патология встречается значительно реже (около 0,5%). Приобретенные изменения цветовосприятия отмечаются при заболеваниях сетчатки, зрительного нерва и центральной нервной системы.
В классификации врожденных расстройств цветового зрения Криса–Нагеля красный цвет считается первым и обозначают его "протос" (греч. protos – первый), затем идут зеленый – "дейтерос" (греч. deuteros – второй) и синий – "тритос" (греч. tritos – третий). Человек с нормальным цветовосприятием – нормальный трихромат.
Аномальное восприятие одного из трех цветов обозначают соответственно как прот–, дейтер– и тританомалию. Прот– и дейтераномалии подразделяют на три типа: тип С – незначительное снижение цветовосприятия, тип В – более глубокое нарушение и тип А – на грани утраты восприятия красного или зеленого цвета.
Полное невосприятие одного из трех цветов делает человека дихроматом и обозначается соответственно как прот–, дейтер– или тританопия (греч. an – отрицательная частица, ops, opos – зрение, глаз). Людей, имеющих такую патологию, называют прот–, дейтер– и тританопами. Невосприятие одного из основных цветов, например красного, изменяет восприятие других цветов, так как в их составе отсутствует доля красного.
 Рис. 4.14. Схема трехкомпонентности цветного зрения.
Рис. 4.14. Схема трехкомпонентности цветного зрения.
Крайне редко встречаются монохромоты, воспринимающие только один из трех основных цветов. Еще реже, при грубой патологии колбочкового аппарата, отмечается ахромазия – черно–белое восприятие мира. Врожденные нарушения цветовосприятия обычно не сопровождаются другими изменениями глаза, и обладатели этой аномалии узнают о ней случайно при медицинском обследовании. Такое обследование является обязательным для водителей всех видов транспорта, людей, работающих с движущимися механизмами, и при ряде профессий, когда требуется правильное различение цветов.
 Рис. 4.15. Дифференциально–диагностическая таблица из набора полихроматических таблиц Рабкина. Нормальные трихроматы различают в таблице цифру 9, протанопы и дейтеранопы – цифру 5.
Рис. 4.15. Дифференциально–диагностическая таблица из набора полихроматических таблиц Рабкина. Нормальные трихроматы различают в таблице цифру 9, протанопы и дейтеранопы – цифру 5.
Оценка цветоразличителыюй способности глаза. Исследование проводят на специальных приборах – аномалоскопах или с помощью полихроматических таблиц. Общепринятым считается метод, предложенный Е. Б. Рабкиным, основанный на использовании основных свойств цвета.
Цвет характеризуется тремя качествами: ■ цветовым тоном, который является основным признаком цвета и зависит от длины световой волны ■ насыщенностью, определяемой долей основного тона среди примесей другого цвета ■ яркостью, или светлотой, которая проявляется степенью близости к белому цвету (степень разведения белым цветом).
 Рис. 4.16. Дифференциально–диагностическая таблица Рабкина.
Нормальные трихроматы различают в таблице цифры I. 3, 6 (136), протанопы – 69, дейтеранопы – 68
Рис. 4.16. Дифференциально–диагностическая таблица Рабкина.
Нормальные трихроматы различают в таблице цифры I. 3, 6 (136), протанопы – 69, дейтеранопы – 68
Диагностические таблицы построены по принципу уравнения кружочков разного цвета по яркости и насыщенности. С их помощью обозначены геометрические фигуры и цифры ("ловушки"), которые видят и читают цветоаномалы. В то же время они не замечают цифру или фигурку, выведенную кружочками одного цвета. Следовательно, это и есть тот цвет, который не воспринимает обследуемый. Во время исследования пациент должен сидеть спиной к окну. Врач держит таблицу на уровне его глаз на расстоянии 0,5–1 м. Каждая таблица экспонируется 5 с. Дольше можно демонстрировать только наиболее сложные таблицы (рис. 4.15, 4.16).
При выявлении нарушений цветоощущения составляют карточку обследуемого, образец которой имеется в приложениях к таблицам Рабкина. Нормальный трихромат прочитает все 25 таблиц, аномальный трихромат типа С – более 12, дихромат – 7–9.
При массовых обследованиях, предъявляя наиболее трудные для распознавания таблицы из каждой группы, можно весьма быстро обследовать большие контингенты. Если обследуемые четко распознают названные тесты при троекратном повторе, то можно и без предъявления остальных сделать заключение о наличии нормальной трихромазии. В том случае, если хотя бы один из этих тестов не распознан, делают вывод о наличии цветослабости и для уточнения диагноза продолжают предъявление всех остальных таблиц.
Выявленные нарушения цветоощущения оценивают по таблице как цветослабость I, II или III степени соответственно на красный (протодефицит), зеленый (дейтеродефицит) и синий (тритодефицит) цвета либо цветослепоту – дихромазия (прот–, дейтер– или тританопия). С целью диагностики расстройств цветоощущения в клинической практике также используют пороговые таблицы, разработанные Е. Н. Юстовой и соавт. для определения порогов цветоразличения (цветосилы) зрительного анализатора. С помощью этих таблиц определяют способность уловить минимальные различия в тонах двух цветов, занимающих более или менее близкие позиции в цветовом треугольнике.
Бинокулярное зрение
Бинокулярное зрение – восприятие окружающих предметов двумя глазами (от лат. bi – два, oculus – глаз) – обеспечивается в корковом отделе зрительного анализатора благодаря сложнейшему физиологическому механизму зрения – фузии, т. е. слиянию зрительных образов, возникающих отдельно в каждом глазу (монокулярное изображение), в единое сочетанное зрительное восприятие.Единый образ предмета, воспринимаемого двумя глазами, возможен лишь в случае попадания его изображения на так называемые идентичные, или корреспондирующие, точки сетчатки, к которым относятся центральные ямки сетчатки обоих глаз, а также точки сетчатки, расположенные симметрично по отношению к центральным ямкам (рис. 4.17). В центральных ямках совмещаются отдельные точки, а па остальных участках сетчатки корреспондируют рецепторные поля, имеющие связь с одной ганглиозной клеткой. В случае проецирования изображения объекта па несимметричные, или так называемые диспаратные, точки сетчатки обоих глаз возникает двоение изображения – диплопия.
Бинокулярное зрение формируется постепенно и достигает полного развития к 7–15 годам. Оно возможно лишь при определенных условиях, причем нарушение любого из них может спать причиной расстройства бинокулярного зрения, вследствие чего характер зрения становится либо монокулярным (зрение одним глазом), либо одновременным, при котором в высших зрительных центрах воспринимаются импульсы то от одного, то от другого глаза. Монокулярное и одновременное зрение позволяет получить представление лишь о высоте, ширине и форме предмета без оценки взаиморасположения предметов в пространстве по глубине.
Основной качественной характеристикой бинокулярного зрения является глубинное стереоскопическое видение предмета, позволяющее определить его место в пространстве, радеть рельефно, глубинно и объемно. Образы внешнего мира воспринимаются трехмерными. При бинокулярном зрении расширяется поле зрения и повышается острота зрения (на 0,1–0,2 и более).
 Рис. 4.17. Корреспондирующие точки сетчатки (f, а, b) правого и левого глаза.
Рис. 4.17. Корреспондирующие точки сетчатки (f, а, b) правого и левого глаза.
При монокулярном зрении человек приспосабливается и ориентируется в пространстве, оценивая величину знакомых предметов. Чем дальше находится предмет, тем он кажется меньше. При повороте головы расположенные на разном расстоянии предметы смещаются относительно друг друга. При таком зрении труднее всего ориентироваться среди находящихся вблизи предметов, например трудно попасть концом нитки в ушко иголки, налить воду в стакан и т. п. Отсутствие бинокулярного зрения ограничивает профессиональную пригодность человека.
Для формирования нормального (устойчивого) бинокулярного зрения необходимы следующие условия: ■ Достаточная острота зрения обоих глаз (не менее 0,4), при которой формируется четкое изображение предметов на сетчатке. ■ Свободная подвижность обоих глазных яблок. Именно нормальный тонус всех двенадцати глазодвигательных мышц обеспечивает необходимую для существования бинокулярного зрения параллельную установку зрительных осей, когда лучи от рассматриваемых предметов проецируются на центральные области сетчатки. Такое положение глаз обеспечивает ортофорию (греч. optos – прямой, foros – несущий). В природе ортофория наблюдается достаточно редко, в 70–80% случаев встречается гетерофория (греч. geteros – другой), считающаяся проявлением скрытого косоглазия. Это состояние обоих глаз характеризуется тем, что в покос они могут принимать такое положение, при котором зрительная ось одного глаза отклоняется или кнутри (эзофория), или кнаружи (экзофория), или кверху (гиперфория), или книзу (гипофория). Причиной гетерофории считается неодинаковая сила действия глазодвигательных мышц, т. е. мышечный дисбаланс. Однако в отличие от явного косоглазия при гетерофории сохраняется бинокулярное зрение благодаря существованию фузионного рефлекса. В ответ на появление физиологического двоения из коры головного мозга поступает сигнал, мгновенно корригирующий тонус глазодвигательных мышц, и два изображения предмета сливаются в единый образ. Патология глазодвигательного аппарата является одной из основных причин утраты бинокулярного зрения. Степень гетерофории, выражаемая в призменных диоптриях, определяется величиной отклонения зрительной линии одного из глаз от точки фиксации. ■ Равные величины изображений в обоих глазах – изейкония. Следует отмстить, что при неравенстве величин изображений (анизейкония) 1,5–2,5% возникают неприятные субъективные ощущения в глазах (астенопические явления), а при анизейконии 4–5% и более бинокулярное зрение практически невозможно. Разные по величине изображения возникают при анизометропии – разной рефракции двух глаз. ■ Нормальная функциональная способность сетчатки, проводящих путей и высших зрительных центров. ■ Расположение двух глаз в одной фронтальной и горизонтальной плоскости. При смещении одного глаза во время травмы, а также в случае развития воспалительного или опухолевого процесса в орбите нарушается симметричность совмещения полей зрения, утрачивается стереоскопическое зрение.
Существует несколько простых способов определения бинокулярного зрения без использования приборов.
Первый заключается в надавливании пальцем на глазное яблоко в области век, когда глаз открыт. При этом появляется двоение, если у пациента имеется бинокулярное зрение. Это объясняется тем, что при смещении одного глаза изображение фиксируемого предмета переместится на несимметричные точки сетчатки.
Второй способ – опыт с карандашами, или так называемая проба с промахиванием, в ходе которой наличие или отсутствие бинокулярности выявляют с помощью двух обычных карандашей. Пациент держит один карандаш вертикально в вытянутой руке, врач – другой в том же положении. Наличие бинокулярного зрения у пациента подтверждается в том случае, если при быстром движении он попадает кончиком своего карандаша в кончик карандаша врача.
Третий способ – проба с "дырой в ладони". Одним глазом пациент смотрит вдаль через свернутую из бумаги трубочку, а перед вторым глазом помещает свою ладонь на уровне конца трубочки. При наличии бинокулярного зрения происходит наложение изображений и пациент видит в ладони отверстие, а в нем предметы, видимые вторым глазом.
Четвертый способ – проба с установочным движением. Для этого пациент сначала фиксирует взгляд обоими глазами на близко расположенном предмете, а затем один глаз закрывает ладонью, как бы "выключая" его из акта зрения. В большинстве случаев глаз отклоняется к носу или кнаружи. Когда глаз открывают, он, как правило, возвращается на исходную позицию, т. е. совершает установочное движение. Это свидетельствует о наличии у пациента бинокулярного зрения.
Для более точного определения характера зрения (монокулярное, одновременное, неустойчивое и устойчивое бинокулярное) в клинической практике широко используют аппаратные методы исследования, в частности общепринятую методику Белостоцкого–Фридмана с применением четырехточечного прибора "Цветотест ЦТ–1" (Россия). На его экране светятся четыре точки: белая, красная и две зеленые. Обследуемый смотрит через очки с красным стеклом перед правым глазом и зеленым перед левым. В зависимости от того, какие ответы выдает пациент, находясь на расстоянии 5 м, можно точноустановить наличие или отсутствие у него бинокулярного зрения, а также определить ведущий (правый или левый) глаз.
С целью определения стереоскопического зрения часто применяют "Fly"–стереотест (с изображением мухи) фирмы "Titmus Optical" (США). Для установления величины анизейконии используют фазоразделительный гаплоскоп. В ходе исследования пациенту предлагают объединить два полукруга в полный бесступенчатый круг, меняя величину одного из полукругов. За величину имеющейся у пациента анизейконии принимают процентное отношение величины полукруга для правого глаза к величине полукруга для левого глаза.
Аппаратные методы исследования стереоскопического зрения широко используют в детской практике при диагностике и лечении косоглазия.
Светоощущение
Светоощущенис является функцией палочкового аппарата сетчатки. Это способность глаза к восприятию света и различению степеней его яркости.Светоощущение считается наиболее чувствительной функцией органа зрения, изменения которой раньше, чем изменения других функций, выявляют при различных патологических процессах, и они, таким образом, служат ранними критериями Диагностики многих заболеваний (глаукома, поражения ЦНС, болезни печени, гиповитаминозы, авитаминозы и т. д.). Светоощущение является первой, самой древней функцией световоспринимающих клеток и органов. У человека при наступлении слепоты светоощущение в сравнении с другими функциями глаза исчезает в последнюю очередь.
Световосприятие (чувствительность глаза к свету) индивидуально и в каждом конкретном случае находится в прямой зависимости от состояния сетчатки и концентрации в ней светочувствительного вещества. Кроме того, оно определяется общим состоянием зрительно–нервного аппарата, в первую очередь уровнем возбудимости нервной ткани.
Принято различать абсолютную светочувствительность, характеризующуюся порогом раздражения, или, другими словами, порогом восприятия света, и различительную светочувствительность, характеризующуюся порогом различения, т. е. порогом восприятия предельной (минимальной) разницы яркости света между двумя освещенными объектами, что позволяет отличать их от окружающего фона. При этом и порог раздражения, и порог различения обратно пропорциональны степени светоощущения, т. е. чем меньше воспринимаемый глазом минимум света или улавливаемая разница в его яркости, тем выше световая чувствительность. Фоторецепторы сетчатки глаза человека возбуждаются уже при наличии 1 кванта света, но ощущение света возникает только при наличии 5–8 квантов света.
Следует уточнить, что, для того чтобы сетчатка была способна даже к самому малому световосприятию, длина волны световых лучей, исходящих от объекта, должна обязательно находиться в пределах видимого излучения и, кроме того, продолжительность и интенсивность раздражения, а также величина объекта должны быть доступны для их восприятия сетчаткой.
Способность глаза проявлять световую чувствительность при различной освещенности называется адаптацией. Именно эта функция органа зрения позволяет сохранять высокую светочувствительность и одновременно предохранять фоторецепторы сетчатки от перенапряжения.
Принято различать световую адаптацию, определяющую максимальное количество света, воспринимаемого глазом, и темновую, или так называемую абсолютную, адаптацию, определяющую соответственно минимум воспринимаемого глазом света. Длительность обоих видов адаптации глаза во многом зависит от уровня предшествующей освещенности. Когда глаз адаптируется к возросшей яркости света (световая адаптация), чувствительность фоторецепторов сетчатки особенно интенсивно снижается в первые секунды и достигает нормальных значений к концу 1–й минуты.
При переходе в условия пониженной освещенности зрительный анализатор нуждается в темновой адаптации. Световая чувствительность фоторецепторов относительно быстро увеличивается, через 20–30 мин процесс замедляется, и лишь спустя 50–60 мин адаптация достигает своего максимума.
Простым методом исследования световой чувствительности является проба Кравкова, основанная на феномене Пуркинье, который заключается в том, что в условиях пониженной освещенности происходит перемещение максимума яркости цветов от красной части спектра к синефиолетовой. Днем красный мак и синий василек кажутся одинаково яркими, а в сумерках мак становится почти черным, а василек воспринимается как светло–серое пятно.
Для проведения пробы Кравкова – Пуркинье на углы квадрата размером 20·20 см, сделанного из черного картона, наклеивают 4 квадратика размером 3·3 см из голубой, желтой, красной и зеленой бумаги. В затемненной комнате эти цветные квадратики показывают пациенту на расстоянии 40–50 см от его глаза. В норме через 30–40 с обследуемый различает желтый, а затем голубой квадраты. При нарушении светоощущения вместо желтого квадрата пациент видит светлое пятно, а голубой квадрат вообще не выявляет.
Более точное определение светочувствительности производят на регистрирующем полуавтоматическом адаптометре. Исследование выполняют в темноте, длительность его 50–60 мин. Сначала обследуемый максимально адаптируется к свету. В течение 10 мин он смотрит на освещенный экран, а затем погружается в полную темноту. Пациенту предъявляется слабо освещенный тест, яркость которого постепенно увеличивается. Когда обследуемый различит тест, он нажимает па кнопку. На бланке регистрирующего устройства ставится точка. Яркость теста изменяют сначала через 2–3 мин, а затем с интервалом 5 мин. По прошествии 60 мин исследование заканчивают. Соединив точки па регистрационном бланке, исследователь получает кривую световой чувствительности обследуемого.
Наиболее частыми расстройствами сумеречного зрения считаются симптоматическая и функциональная гемералопия (от греч. hemera – днем, aloos – слепой, ops – глаз). В народе это состояние получило название "куриная слепота" по образу и подобию зрения дневных птиц, не видящих в темноте.
Причиной симптоматической гемералопии являются поражения фоторецепторов сетчатки, нередко сопровождающие различные органические заболевания сосудистой оболочки, сетчатки и зрительного нерва (глаукома, невриты зрительного нерва и пигментные дегенерации сетчатки). Функциональная гемералопия считается характерным симптомом гиповитаминоза Айв большинстве случаев клинически проявляется развитием ксеротических бляшек на конъюнктиве у лимба. Эта форма заболевания хорошо поддается лечению витаминами А и группы В. Иногда гемералопии имеет характер врожденного семейно–наследственного заболевания неясной этиологии, при котором изменения на глазном дне отсутствуют.
Глава 5. Оптическая система и рефракция глаза
Страница здесь похожа на окно. Открывшему увидеть мир дано.Р. Гамзатов
Оптическая система глаза
Глаз человека представляет собой сложную оптическую систему, которая состоит из роговицы, влаги передней камеры, хрусталика и стекловидного тела. Преломляющая сила глаза зависит от величины радиусов кривизны передней поверхности роговицы, передней и задней поверхностей хрусталика, расстояний между ними и показателей преломления роговицы, хрусталика, водянистой влаги и стекловидного тела. Оптическую силу задней поверхности роговицы не учитывают, поскольку показатели преломления ткани роговицы и влаги передней камеры одинаковы (как известно, преломление лучей возможно лишь на границе сред с различными коэффициентами преломления).Условно можно считать, что преломляющие поверхности глаза сферичны и их оптические оси совпадают, т. е. глаз является центрированной системой. В действительности же в оптической системе глаза имеется много погрешностей. Так, роговица сферична только в центральной зоне, показатель преломления наружных слоев хрусталика меньше, чем внутренних, степень преломления лучей в двух взаимно перпендикулярных плоскостях неодинакова. Кроме того, оптические характеристики в разных глазах существенно различаются, причем точно определить их нелегко. Все это затрудняет вычисление оптических констант глаза.
Для оценки преломляющей способности любой оптической системы используют условную единицу – диоптрию (сокращенно – дптр). За 1 дптр примята сила линзы с главным фокусным расстоянием в 1 м. Диоптрия (D) – величина, обратная фокусному расстоянию (F):
 Следовательно, линза с фокусным расстоянием 0,5 м обладает преломляющей силой 2,0 дптр, 2 м – 0,5 дптр и т. д. Преломляющую силу выпуклых (собирающих) линз обозначают знаком "плюс", вогнутых (рассеивающих) – знаком "минус", а сами линзы называют соответственно положительными и отрицательными.
Следовательно, линза с фокусным расстоянием 0,5 м обладает преломляющей силой 2,0 дптр, 2 м – 0,5 дптр и т. д. Преломляющую силу выпуклых (собирающих) линз обозначают знаком "плюс", вогнутых (рассеивающих) – знаком "минус", а сами линзы называют соответственно положительными и отрицательными.
Существует простой прием, с помощью которого можно отличить положительную линзу от отрицательной. Для этого линзу нужно расположить на расстоянии нескольких сантиметров от глаза и передвигать ее, например, в горизонтальном направлении. При рассматривании какого–либо предмета через положительную линзу его изображение будет смещаться в сторону, противоположную движению линзы, а через отрицательную, наоборот, – в ту же сторону.
Для проведения расчетов, связанных с оптической системой глаза, предложены упрощенные схемы этой системы, основанные на средних величинах оптических констант, полученных при измерении большого количества глаз. На рис. 5.1 представлен схематический глаз, предложенный A. Gullstrand в 1909 г. Видно, что передняя и задняя главные плоскости пересекают оптическую ось глаза на расстоянии соответственно 1,47 и 1,75 мм от вершины роговицы. Условно можно считать, что эти плоскости расположены в одном месте – на расстоянии 1,6 мм от вершины роговицы.
 5.1. Схематический глаз, предложенный A. GuIIsmmd.
5.1. Схематический глаз, предложенный A. GuIIsmmd.
Переднее и заднее фокусные расстояния, если их отсчитывать от и до главных плоскостей, равны соответственно 16,78 и 22,42 мм. Чаще, однако, определяют передневершинное и задневершинное фокусные расстояния, т. е. положение главных фокусов относительно вершины роговицы. Эти расстояния равны соответственно 15,31 и 24,17 мм.
Предложены и более простые схемы оптической системы глаза, в которых имеется только одна преломляющая поверхность – передняя поверхность роговицы и одна среда – усредненная внутриглазная среда. Такой глаз называют редуцированным.
Наиболее удачным является схематический редуцированный глаз, предложенный В. К. Вербицким в 1928 г. Его основные характеристики: главная плоскость касается вершины роговицы; радиус кривизны последней 6,82 мм; длина передне–задней оси 23,4 мм; радиус кривизны сетчатки 10,2 мм; показатель преломления внутриглазной среды 1,4; общая преломляющая сила 58,82 дптр.
Как и другим оптическим системам, глазу свойственны различные аберрации (от лат. aberratio – отклонение) – дефекты оптической системы глаза, приводящие к снижению качества изображения объекта на сетчатке. Вследствие сферической аберрации лучи, исходящие из точечного источника света, собираются не в точке, а в некоторой зоне на оптической оси глаза. В результате этого на сетчатке образуется круг светорассеяния. Глубина этой зоны для "нормального" человеческого глаза колеблется от 0,5 до 1,0 дптр.
 Рис. 5.2. Хроматическая аберрация глаза.
F1 – фокус для сине–зеленых лучей; F2 – фокус для красных лучей (Н – гиперметропия, Em – эмметропия, М – миопия).
Рис. 5.2. Хроматическая аберрация глаза.
F1 – фокус для сине–зеленых лучей; F2 – фокус для красных лучей (Н – гиперметропия, Em – эмметропия, М – миопия).
В результате хроматической аберрации лучи коротковолновой части спектра (синезеленые) пересекаются в глазу на меньшем расстоянии от роговицы, чем лучи длинноволновой части спектра (красные). Интервал между фокусами этих лучей в глазу может достигать 1,0 дптр (рис. 5.2).
Практически во всех глазах имеется еще одна аберрация, обусловленная отсутствием идеальной сферичности преломляющих поверхностей роговицы и хрусталика. Асферичность роговицы, например, может быть устранена с помощью гипотетической пластинки, которая, будучи наложена на роговицу, превращает глаз в идеальную сферическую систему. Отсутствие же сферичности приводит к неравномерному распределению света на сетчатке: светящаяся точка образует на сетчатке сложное изображение, на котором могут выделяться участки максимальной освещенности. В последние годы активно изучается влияние указанной аберрации на максимальную остроту зрения даже в "нормальных" глазах с целью ее коррекции и достижения так называемого суперзрения (например, с помощью лазера).
Физическая и клиническая рефракция глаза
Как отмечалось выше, в физике рефракцией оптической системы называют ее преломляющую силу, выраженную в диоптриях. Физическая рефракция глаза человека, по данным разных исследователей, варьирует от 51,8 до 71,3 дптр.Однако для получения четкого изображения важна не только преломляющая сила оптической системы глаза сама по себе, но и ее способность фокусировать лучи на сетчатке. В связи с этим в офтальмологии используют понятие клиническая рефракция, под которой понимают соотношение между преломляющей силой и положением сетчатки или, что то же самое, между задним фокусным расстоянием оптической системы и длиной переднезадней оси глаза. Различают клиническую рефракцию двух видов – статическую и динамическую.
Статическая рефракция характеризует способ получения изображений на сетчатке в состоянии максимального расслабления аккомодации (подробнее эта функция, позволяющая менять преломляющую способность глаза, будет рассмотрена далее). Нетрудно заметить, что статическая рефракция – это условное понятие, отражающее лишь структурные особенности глаза как оптической камеры, формирующей изображение на сетчатке.
Для правильного решения многих вопросов, связанных со зрительной деятельностью в естественных условиях, необходимо иметь представление о функциональных особенностях оптической системы глаза. Судить о них позволяет динамическая рефракция, под которой понимают преломляющую силу оптической системы глаза относительно сетчатки при действующей аккомодации.
Статическая рефракция глаза. Эмметропия и аметропии
Статическая рефракция определяется положением заднего главного фокуса оптической системы глаза относительно сетчатки. При соразмерной клинической рефракции, или эмметропии (от греч. emmetros – соразмерный, opsis – зрение), этот фокус совпадает с сетчаткой, при несоразмерных видах клинической рефракции, или аметропиях (от греч. ametros – несоразмерный), – не совпадает. При близорукости (миопии) лучи фокусируются впереди сетчатки, а при дальнозоркости (гиперметропии) – позади нее (рис. 5.3).Теоретически несоразмерность клинической рефракции может быть обусловлена двумя основными причинами: несоответствием физической рефракции длине глаза и, наоборот, несоответствием длины глаза рефракции. В нервом случае аметропию обозначают как рефракционную, во втором – как осевую. Аметропии высокой степени, как правило, обусловлены значительными отклонениями величины переднезадней оси от "нормальных” размеров в сторону увеличении (при миопии) или уменьшения (при гиперметропии).
 Рис. 5.3. Положение дальнейшей точки ясного зрения (R) в глазу с эмметропической (Е), миопической (М) и гиперметропичсской (Н) рефракциями (F – задний главный фокус). Вид клинической рефракции в данном примере зависит только от длины глаза.
Рис. 5.3. Положение дальнейшей точки ясного зрения (R) в глазу с эмметропической (Е), миопической (М) и гиперметропичсской (Н) рефракциями (F – задний главный фокус). Вид клинической рефракции в данном примере зависит только от длины глаза.
 Рис. 5.4. Ход лучей при астигматизме и проекция фигур светорассеяния па оптической оси (случай сложного миопического астигматизма прямого типа).
Рис. 5.4. Ход лучей при астигматизме и проекция фигур светорассеяния па оптической оси (случай сложного миопического астигматизма прямого типа).
В общем аметропии следует рассматривать как результат дискорреляции между оптическим и анатомическим компонентами глаза. В такой дискорреляции в первую очередь "повинна" длина оси глаза, которая более изменчива, чем его преломляющая сила. Исходя из этого, можно говорить, что чем рефракция глаза слабее, тем он короче, чем рефракция сильнее, тем глаз длиннее, т. е. гиперметропический глаз короткий, а миопический – длинный.
В клинической практике о степени аметропии судят по силе линзы, которая ее корригирует и искусственно превращает глаз в эмметропический. Вследствие этого миопическую рефракцию, которую следует исправлять с помощью рассеивающей линзы, обычно обозначают знаком "минус", а гиперметропическую – знаком "плюс". В физическом смысле при миопии имеется относительный избыток, а при гиперметропии – недостаток преломляющей силы глаза.
При аметропиях в условиях максимального расслабления аккомодации изображение па сетчатке объекта, находящегося в бесконечности, бывает нечетким: каждая деталь изображения образует на сетчатке не точку, а круг, называемый кругом светорассеяния.
В том случае, если оптическая система глаза не сферичная, то такую рефракцию называют астигматизмом (от греч. astigmatism: а – отрицательная приставка, stigma – точка). При астигматизме имеется сочетание различных рефракций или разных степеней одной рефракции. В этом случае различают два главных взаимно перпендикулярных сечения, или меридиана: в одном из них преломляющая сила наибольшая, в другом – наименьшая. Общий астигматизм складывается из роговичного и хрусталикового, хотя, как правило, основной причиной астигматизма является нарушение сферичности роговицы.
Астигматизм называют правильным, если в каждом из главных меридианов преломляющая сила остается практически постоянной, а переход рефракции от одного главного меридиана к другому происходит плавно и напоминает синусоиду, наиболее выступающие точки которой и соответствуют главным меридианам. Правильный астигматизм обычно бывает врожденным, а неправильный чаще всего является следствием каких–либо заболеваний роговицы и, реже, хрусталика. Следует отметить, что в клинической практике очень редко наблюдаются случаи полного отсутствия астигматизма. Как правило, при детальном исследовании "хорошо видящих" глаз (например, с помощью рефракто– и офтальмометрии, которые будут описаны ниже) выявляют правильный астигматизм в пределах 0,5–0,75 дптр, который практически не влияет па остроту зрения, поэтому его называют физиологическим.
В тех случаях, когда клиническая рефракция обоих главных меридианов одинакова, говорят о сложном астигматизме. При смешанном астигматизме один из меридианов имеет гиперметропическую рефракцию, другой – миопическую. При простом астигматизме рефракция одного из меридианов эмметропическая.
Ход лучей при астигматизме наиболее удачно описывается коноидом Штурма (рис. 5.4). Форма фигуры светорассеяния зависит от места сечения коноида плоскостью, перпендикулярной оптической оси. В глазу такой "плоскостью" является сетчатка.
В зависимости от положения сетчатки относительно фокальных линий различают следующие виды астигматизма (рис. 5.5): ■ сложный гиперметропический (НН) – оба главных меридиана имеют гиперметропическую рефракцию разной величины, сетчатка находится спереди от фокальных линий ■ простой гиперметропический (Н) – один из главных меридианов имеет эмметропическую рефракцию, другой – гиперметропическую, сетчатка совпадает с передней фокальной линией ■ смешанный (МН) – один из главных меридианов имеет гиперметропическую рефракцию, другой – миопическую, сетчатка расположена между фокальными линиями ■ простой миопический (М) – один из главных меридианов имеет эмметропическую рефракцию, другой – миопическую, сетчатка совпадает с задней фокальной линией ■ сложный миопический (ММ) – оба главных меридиана имеют миопическую рефракцию разной величины, сетчатка расположена позади фокальных линий.


 Рис. 5.5. Положение сетчатки относительно фокальных линий коноида при различных видах астигматизма (НН, Н, МН, М, ММ – при сложном гиперметропическом, простом гиперметропическом, смешанном, простом и сложном миопическом астигматизме соответственно).
Рис. 5.5. Положение сетчатки относительно фокальных линий коноида при различных видах астигматизма (НН, Н, МН, М, ММ – при сложном гиперметропическом, простом гиперметропическом, смешанном, простом и сложном миопическом астигматизме соответственно).
Особенность зрения при астигматизме состоит в том, что в зависимости от рефракции и расположения главных меридианов пациент по–разному видит линии различной ориентации.
Главные меридианы астигматического глаза принято обозначать в соответствии с так называемой шкалой ТАБО – градусной полукруговой шкалой, отсчет по которой производят против часовой стрелки (аналогичную шкалу используют в специальных пробных оправах, предназначенных для проверки зрения и подбора очков).
В зависимости от положения главных меридианов различают три типа астигматизма глаза – прямой, обратный и с косыми осями. При прямом астигматизме направление меридиана, обладающего наибольшей преломляющей силой, ближе к вертикальному, а при обратном – к горизонтальному. Наконец, при астигматизме с косыми осями оба главных меридиана лежат в секторах, удаленных от указанных направлений.
О степени астигматизма судят по разности рефракции в двух главных меридианах. Принцип расчета степени астигматизма можно проиллюстрировать следующими примерами. Если главные меридианы имеют миопическую рефракцию, равную соответственно –4,0 и –1,0 дптр, "то степень астигматизма составит –4,0 1,0 = 3,0 дптр. В том случае, когда главные меридианы имеют гиперметропическую рефракцию +3,0 и +0.5 дптр, степень астигматизма будет равна: +3,0 – +0,5 = 2,5 дптр. Наконец, при смешанном астигматизме и рефракции главных меридианов ~3,5 и +1,0 дптр степень астигматизма будет равна: –3,5 – + 1,0 = 4,5 дптр.
Для сопоставления астигматизма со сферическими видами рефракции используют понятие "сферический эквивалент". Это средняя арифметическая рефракция двух главных меридианов астигматической системы. Так, в приведенных выше примерах данный показатель составит соответственно –2,5; +1,75 и –1,25 дптр.
Формирование оптической системы глаза
Рассмотрение органа зрения различных животных в экологическом аспекте свидетельствует о приспособительном характере рефракции, т. е. о гаком формировании глаза как оптической системы, которое обеспечивает данному виду животного оптимальную зрительную ориентировку в соответствии с особенностями его жизнедеятельности и среды обитания. По–видимому, не случайным, а исторически и экологически обусловленным является тот факт, что у человека отмечается преимущественно рефракция, близкая к эмметропии, наилучшим образом обеспечивающая отчетливое видение и далеко, и близко расположенных предметов в соответствии с многообразием его деятельности.Наблюдающееся у большинства взрослых людей закономерное приближение рефракции к эмметропии находит выражение в высокой обратной корреляции между анатомическим и оптическим компонентами глаза: в процессе его роста проявляется тенденция к сочетанию более значительной преломляющей силы оптического аппарата с более короткой переднезадней осью и, наоборот, более низкой преломляющей силы с более длинной осью. Следовательно, рост глаза – это регулируемый процесс. Под ростом глаза следует понимать не простое увеличение его размеров, а направленное формирование глазного яблока как сложной оптической системы под влиянием условий внешней среды и наследственного фактора с его видовой и индивидуальной характеристикой.
Таблица 5.1. Возрастная динамика некоторых анатомо–оптических показателей
| Показатель | Новорожденные | Возраст, годы | |||
|---|---|---|---|---|---|
| 1 | 3 | 5–7 | 14–15 | ||
| Рефракция роговицы, дитр | 48,4 | 45,9 | 42,9 , | 142,5 | 42,5 |
| Толщина роговицы, мм | 0,541 | – | 0,520 | 0,520 | 0,520 |
| Диаметр роговицы, мм | 10,25 | – | 11.3 | 11,5 | 11,7 |
| Длина переднезадней оси, мм | 16,8 | 19,0–20.1 | 21,0 | 22,1 | 23,2 |
Установлено, что у новорожденных глаза, как правило, имеют слабую рефракцию. По мере развития детей происходит усиление рефракции: степень гиперметропии уменьшается, слабая гиперметропия переходит в эмметропию и даже в миопию, эмметропические глаза в части случаев становятся близорукими.
В первые 3 гола жизни ребенка происходят интенсивный рост глаза, а также увеличение рефракции роговицы и длины переднезадней оси, которая к 5–7 годам достигает 22 мм, т. е. составляет примерно 95% от размера глаза взрослого человека. Рост глазного яблока продолжается до 14–15 лет. К этому возрасту длина оси глаза приближается к 23 мм, а преломляющая сила роговицы – к 43,0 дптр (табл. 5.1).
По мере роста глаза вариабельность его клинической рефракции уменьшается: она медленно усиливается, т. е. смещается в сторону эмметропии.
В первые годы жизни ребенка преобладающим видом рефракции является дальнозоркость. По мере увеличения возраста распространенность дальнозоркости уменьшается, аэмметропической рефракции и близорукости увеличивается. Частота близорукости особенно заметно повышается, начиная с 11 – 14 лет, достигая в возрасте 19–25 лет примерно 30%. На долю дальнозоркости и эмметропии в этом возрасте приходится примерно 30 и 40% соответственно.
Хотя количественные показатели распространенности отдельных видов рефракции глаз у детей, приводимые разными авторами, заметно варьируют, отмеченная выше общая закономерность изменения рефракции глаз по мере увеличения возраста сохраняется.
В настоящее время предпринимаются попытки установить средневозрастные нормы рефракции глаз у детей и использовать этот показатель для решения практических задач. Однако, как показывает анализ статистических данных, различия в величине рефракции у детей одного и того же возраста настолько значительные, что такие нормы могут быть лишь условными.
Аккомодация.
Динамическая рефракция глазаВ естественных условиях в соответствии с задачами зрительной деятельности постоянно изменяется преломляющая сила оптики глаза, т. е. действует не статическая, а динамическая рефракиия глаза. В основе таких изменений рефракции лежит механизм аккомодации.
 Рис. 5.6. Механизм аккомодации по Гельмгольцу. Состояние аппарата аккомодации в покое (а) и напряжении (б).
Рис. 5.6. Механизм аккомодации по Гельмгольцу. Состояние аппарата аккомодации в покое (а) и напряжении (б).
Динамическая рефракция и аккомодация глаза – это очень близкие, но не идентичные понятия: первое шире. Аккомодация представляет собой основной механизм динамической рефракции глаза. Упрощая, можно сказать, что бездействующая аккомодация плюс сетчатка – это статическая рефракция глаза, а действующая аккомодация плюс сетчатка – динамическая.
Аккомодация (от лат. accomodatio – приспособление) – приспособительная функция глаза, обеспечивающая возможность четкого различения предметов, расположенных на разных расстояниях от него.
Для объяснения механизма аккомодации предложены различные (порой взаимоисключающие) теории, каждая из которых предусматривает взаимодействие таких анатомических структур, как цилиарное тело, циннова связка и хрусталик. Наиболее признанной является теория Гельмгольца, суть которой сводится к следующему (рис. 5.6). При зрении вдаль цилиарная мышца расслаблена, а циннова связка, соединяющая внутреннюю поверхность цилиарного тела и экваториальную зону хрусталика, находится в натянутом состоянии и таким образом не дает возможности хрусталику принять более выпуклую форму. В процессе аккомодации происходит сокращение циркулярных волокон цилиарной мышцы, круг суживается, в результате чего циннова связка расслабляется, а хрусталик благодаря своей эластичности принимает более выпуклую форму. При этом увеличивается преломляющая способность хрусталика, что в свою очередь обеспечивает возможность четкой фокусировки на сетчатке изображений предметов, расположенных на достаточно близком расстоянии от глаза. Таким образом, аккомодация является основой динамической, т. е. меняющейся, рефракции глаза.
Вегетативная иннервация аппарата аккомодации представляет собой сложный целостный процесс, в котором гармонично участвуют парасимпатический и симпатический отделы нервной системы и который нельзя сводить к простому антагонизму действия этих систем. Основную роль в сократительной деятельности цилиарной мышцы играет парасимпатическая система. Симпатическая система выполняет главным образом трофическую функцию и оказывает некоторое тормозящее действие па сократительную способность цилиарной мышцы. Однако это вовсе не означает, что симпатический отдел нервной системы управляет аккомодацией для дали, а парасимпатический – аккомодацией для близи. Такая концепция упрощает истинную картину и создает ложное представление о существовании двух относительно изолированных аппаратов аккомодации. Между тем аккомодация – это единый механизм оптической установки глаза к объектам, находящимся на разном расстоянии, в котором всегда участвуют, взаимодействуя, и парасимпатический, и симпатический отделы вегетативной нервной системы. Учитывая изложенное выше, целесообразно различать положительную и отрицательную аккомодацию, или соответственно аккомодацию для близи и для дали, рассматривая и первую, и вторую как активный физиологический процесс.
Динамическую рефракцию можно рассматривать как функциональную систему, работа которой основана па принципе саморегуляции и назначение которой – обеспечивать четкое фокусирование изображений на сетчатке, несмотря на изменение расстояния от глаза до фиксируемого объекта. Если при определенном расстоянии до предмета кривизна хрусталика окажется недостаточной для получения четкой проекции изображения на сетчатке, то информация об этом но каналам обратной связи поступит в центр иннервации аккомодации. Оттуда к цилиарной мышце и хрусталику будет направлен сигнал на изменение его преломляющей силы. В результате соответствующей коррекции изображение предмета в глазу совпадет с плоскостью сетчатки. Как только это произойдет, будет устранена необходимость в дальнейшем регулирующем воздействии па цилиарную мышцу. Под влиянием каких–либо возмущений может измениться ее тонус, в результате чего изображение на сетчатке расфокусируется, при этом возникает сигнал об ошибке, за которым вновь последует корректирующее воздействие па хрусталик. Динамическая рефракция может выступать в роли как следящей (при перемещении фиксируемого объекта в переднезаднем направлении), так и стабилизирующей (при фиксации неподвижного объекта) системы. Установлено, что порог ощущения нечеткости изображения на сетчатке, который вызывает регулирующее воздействие па цилиарную мышцу, составляет 0,2 дптр.
При максимальном расслаблении аккомодации динамическая рефракция совпадает со статической и глаз устанавливается к дальнейшей точке ясного зрения. По мере усиления динамической рефракции вследствие увеличения напряжения аккомодации точка ясного видения все больше приближается к глазу. При максимальном усилении динамической рефракции глаз оказывается установленным к ближайшей точке ясного зрения. Расстояние между дальнейшей и ближайшей точками ясного зрения определяет ширину, или область, аккомодации (это линейная величина). При эмметропии и гиперметропии указанная область очень широка: она простирается от ближайшей точки ясного зрения до бесконечности. Эмметроп смотрит вдаль без напряжения аккомодации. Для того чтобы ясно видеть в этом диапазоне расстояний, аккомодация гиперметропического глаза должна увеличиться на величину, равную степени аметропии, уже при рассматривании предмета, находящегося в бесконечности. При миопии область аккомодации занимает небольшой участок вблизи глаза. Чем выше степень миопии, тем ближе к глазу дальнейшая точка ясного зрения и тем уже область аккомодации. При этом миопическому глазу, преломляющая сила оптики которого и без того велика, аккомодация помочь не может.
При отсутствии стимула к аккомодации (в темноте или безориентирном пространстве) сохраняется некоторый тонус цилиарной мышцы, за счет которого глаз устанавливается к точке, занимающей промежуточное положение между дальнейшей и ближайшей точками ясного зрения. Положение этих точек можно выразить в диоптриях, если известно их расстояние от глаза.
От разности между максимальной динамической и статической рефракцией зависит объем абсолютной (монокулярной) аккомодации. Следовательно, этот показатель (выражается в диоптриях) отражает способность цилиарной мышцы к максимальному сокращению и расслаблению.
Объем относительной аккомодации характеризует возможный диапазон изменений напряжения цилиарной мышцы при бинокулярной фиксации объекта, расположенного на конечном от глаз расстоянии. Обычно это 33 см – среднее рабочее расстояние для близи. Различают отрицательную и положительную части объема относительной аккомодации. О них судят соответственно по максимальной плюсовой или максимальной минусовой линзе, при использовании которой еще сохраняется ясность видения текста на этом расстоянии. Отрицательная часть объема относительной аккомодации – се израсходованная часть, положительная – неизрасходованная, это резерв, или запас, аккомодации.
Особое значение механизм аккомодации имеет у пациентов с гиперметропической рефракцией. Как отмечалось выше, несоразмерность этого вида аметропии обусловлена слабостью преломляющего аппарата из–за короткой оси глаза, вследствие чего задний главный фокус оптической системы такого глаза находится за сетчаткой (см. рис. 5.3). У лиц с гиперметропией аккомодация включена постоянно, т. е. при рассматривании как близко, так и далеко расположенных объектов. При этом общая величина гиперметропии складывается из скрытой (компенсированной напряжением аккомодации) и явной (требующей коррекции).
Методы исследования рефракции и аккомодации
Общепринято деление методов исследования рефракции и аккомодации на субъективные и объективные, хотя оно в известной мере условно. Результаты субъективного исследования основываются на ответах обследуемого (пациента). Как отмечают В. В. Волков и соавт. (1976), при этом для "...получения адекватных результатов необходимо, чтобы исследуемый мог и хотел давать правильные ответы". Результаты объективных исследований оценивает.непосредственно исследователь (врач), и их достоверность в известной степени зависит от его опыта и квалификации.Следует отметить, что истинная оценка статической рефракции требует выключения аккомодации, которое обозначают термином "циклоплегия". Добиться циклоплегии можно инстилляциями в конъюнктивальный мешок препаратов длительного (1% раствор атропина сульфата) или кратковременного (1% раствор гомотропина, 1% или 0,5% раствор мидриацила) действия. Такие препараты не совсем точно называют мидокториатиками, так как одновременно с расслаблением цилиарной мышцы они вызывают расширение (иногда нежелательное) зрачка, т. е. мидриаз. Как правило, циклоплегия нужна при исследовании рефракции у детей и подростков, хотя вопрос о необходимости выключения аккомодации следует решать индивидуально в каждом конкретном случае.
Методы исследования рефракции
Наиболее распространенным субъективным методом исследования рефракции является способ. основанный па определении максимальной остроты зрения с коррекцией. Офтальмологическое обследование пациента независимо от предполагаемого диагноза начинают именно с применения данного диагностического теста. При этом последовательно решают две задачи: определяют вид клинической рефракции и оценивают степень (величину) клинической рефракции.Под максимальной остротой зрения следует понимать тот уровень, которого достигают при правильной, полноценной коррекции аметропии. При адекватной коррекции аметропии максимальная острота зрения должна приближаться к так называемой нормальной и обозначаемой как полная, или соответствующая "единице". Следует помнить, что иногда из–за особенностей строения сетчатки "нормальная" острота зрения может быть больше 1,0 и составлять 1,25; 1,5 и даже 2,0.
Для проведения исследования необходимы так называемая очковая оправа, набор пробных линз и тест–объекты для оценки остроты зрения. Суть методики сводится к определению влияния пробных линз на остроту зрения, при этом оптическая сила той (или тех – при астигматизме) линзы, которая обеспечит максимальную остроту зрения, будет соответствовать клинической рефракции глаза.
Основные правила проведения исследования можно сформулировать следующим образом. ■ При остроте зрения, равной 1,0, можно предположить наличие эмметропической, гиперметропичсской (компенсированной напряжением аккомодации) и слабомиопической рефракции. Несмотря на то что в большинстве учебных пособий рекомендуется начинать исследование с приставления к глазу линзы силой +0,5 дптр, целесообразно сначала использовать линзу –0,5 дптр. При эмметропии и гиперметропии такая линза в условиях циклоплегии обусловит ухудшение зрения, а в естественных условиях острота зрения может остаться неизмененной из–за компенсации силы указанной линзы напряжением аккомодации. При слабой миопии независимо от состояния аккомодации может быть отмечено повышение остроты зрения. На следующем этапе исследования в пробную оправу нужно поместить линзу +0,5 дптр. При эмметропии в любом случае будет отмечено снижение остроты зрения, при гиперметропии в условиях выключенной аккомодации будет установлено его улучшение, а при сохранной аккомодации зрение может остаться неизмененным, так как линза компенсирует лишь часть скрытой гиперметропии. ■ При остроте зрения меньше 1,0 можно предположить наличие миопии, гиперметропии и астигматизма. Исследование следует начинать с приставления к глазу линзы –0,5 дптр. При миопии будет отмечена тенденция к повышению остроты зрения, а в других случаях зрение или ухудшится, или останется неизмененным. На следующем этапе применение линзы +0,5 дптр позволит выявить гиперметропическую рефракцию (зрение или остается неизмененным или, как правило, повышается). При отсутствии тенденции к изменению остроты зрения на фоне коррекции сферическими линзами можно предположить наличие астигматизма. Для уточнения диагноза необходимо применить специальные линзы из пробного набора – так называемые цилиндры, у которых лишь одно из сечений является оптически деятельным (оно расположено под углом 90° к обозначенной на астигматической линзе оси цилиндра). Необходимо отметить, что точное субъективное определение типа и особенно степени астигматизма довольно трудоемкий процесс (несмотря на то, что для этого предложены специальные тесты и методики). В таких случаях основой для установления диагноза должны служить результаты объективных исследований рефракции. ■ После установления вида клинической рефракции определяют степень аметропии, при этом, меняя линзы, добиваются максимальной остроты зрения. При определении величины (степени) аметропии придерживаются следующего основного правила: из нескольких линз, одинаково влияющих на остроту зрения, при миопической рефракции выбирают линзу с наименьшей абсолютной силой, а при гиперметропической – с наибольшей.
Следует отметить, что для определения максимальной остроты зрения может быть использована пробная контактная коррекция с помощью жесткой контактной линзы, исправляющей не только аметропии, по и аберрации передней поверхности роговицы. В поликлинических условиях вместо этого теста рекомендуется проводить пробу с диафрагмой. При этом в процессе субъективного исследования рефракции определяют острогу зрения с пробными очковыми линзами и диафрагмой диаметром 2,0 мм, которые одновременно помещают в пробную оправу. Однако описанный способ имеет ряд трудно устранимых недостатков. Во–первых, в ходе исследования приходится ориентироваться на уровень остроты зрения, снижение которого может быть обусловлено не только наличием аметропий, но и патологическими изменениями оптических сред и нейрорецепторного аппарата. Кроме того, метод неприменим при отсутствии контакта с пациентом (например, у детей раннего возраста), а также симуляции и аггравации. В этих случаях более информативны объективные методы исследования рефракции, в частности скиаскопия, обычная и автоматическая рефрактометрия, офтальмометрия.
Скиаскопия (от греч. scia – тень, scopeo – осматриваю) – способ объективного исследования клинической рефракции, основанный на наблюдении за движением теней, получаемых в области зрачка при освещении последнего с помощью различных методик.
Не вникая в суть физических явлений, на которых базируется скиаскопия, основное положение этой методики можно сформулировать следующим образом: движение тени не наблюдается, если дальнейшая точка ясного зрения совпадает с источником освещения зрачка, т. е. фактически с положением исследователя. Скиаскопию проводят по следующей методике.
Врач сидит напротив больного (обычно на расстоянии 0,67 или 1 м), освещает зрачок исследуемого глаза зеркалом офтальмоскопа и, поворачивая аппарат вокруг горизонтальной или вертикальной оси в одну и другую сторону, наблюдает за характером движения тени па фоне розового рефлекса с глазного дна в области зрачка. При скиаскопии с плоским зеркалом с расстояния 1 м в случае гиперметропии, эмметропии и миопии меньше –1,0 дптр тень движется в ту жесторону, что и зеркало, а при миопии больше – 1.0 дптр – в противоположную. В случае применения вогнутого зеркала соотношения обратные. Отсутствие движения светового пятна в области зрачка при скиаскопии с расстояния в 1 м при использовании и плоского, и вогнутого зеркала свидетельствует о том, что у обследуемого миопия – 1.0 дптр.
Таким способом определяют вид рефракции. Для установления ее степени обычно применяют метод нейтрализации движения тени. При миопии больше –1,0 дптр к исследуемому глазу приставляют отрицательные линзы, сначала слабые, а затем более сильные (по абсолютной величине) до тех пор, пока движение тени в области зрачка не прекратится. В случаях гиперметропии, эмметропии и миопии меньше –1,0 дптр аналогичную процедуру проводят с положительными линзами. При астигматизме делают то же по отдельности в двух главных меридианах.
Искомая величина рефракции может быть определена по следующей формуле:
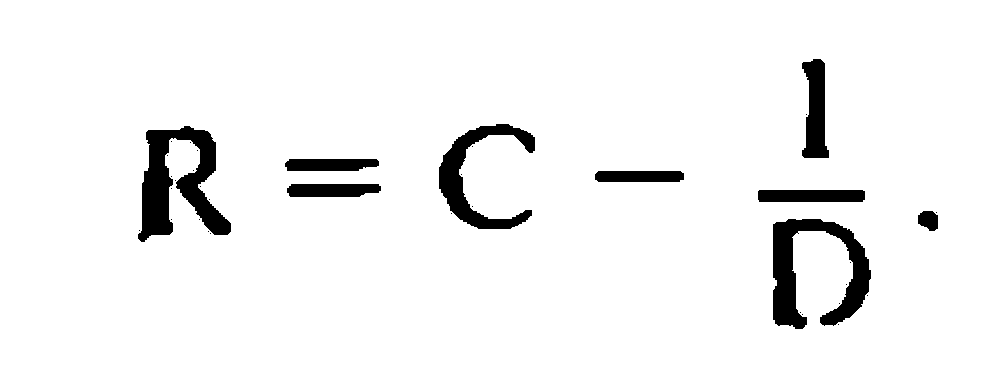 где R – рефракция исследуемого глаза (в диоптриях: миопия – со знаком гиперметропия – со знаком С – сила нейтрализующей линзы (в диоптриях); D – расстояние, с которого производят исследование (в метрах).
где R – рефракция исследуемого глаза (в диоптриях: миопия – со знаком гиперметропия – со знаком С – сила нейтрализующей линзы (в диоптриях); D – расстояние, с которого производят исследование (в метрах).
Некоторые практическое рекомендации по выполнению скиаскопии могут быть сформулированы следующим образом. ■ Рекомендуется по возможности использовать электроскиаскоп, т. е. устройство с вмонтированным источником света, а в случае его отсутствия – плоское офтальмоскопическое зеркало и лампу накаливания с прозрачным баллоном (меньше площадь источника света). При исследовании с помощью плоского зеркала (в сравнении с вогнутым) тень более выраженная и гомогенная, движения ее легче оценить, а для перемещения тени требуются меньшие повороты зеркала. ■ Для нейтрализации тени могут быть использованы как специальные скиаскопические линейки, так и линзы из набора, которые вставляют в пробную оправу. Преимущество последнего способа, несмотря на увеличение времени исследования, связано с точным соблюдением постоянного расстояния между линзами и вершиной роговицы, а также с возможностью применения цилиндрических линз для нейтрализации тени при астигматизме (методика цилиндроскиаскопии). Использование первого способа оправдано при обследовании детей, так как в этих случаях врач, как правило, вынужден сам держать скиаскопические линейки перед глазом пациента. ■ Проводить скиаскопию целесообразно с расстояния 67 см, которое легче сохранять в течение исследования, особенно при определении рефракции у детей младшего возраста. ■ При исследовании глаза в условиях циклоплегии обследуемый должен смотреть на отверстие зеркала, а в случаях сохранной аккомодации – мимо уха врача на стороне исследуемого глаза. ■ При применении скиаскопической линейки нужно стараться держать ее вертикально и на стандартном расстоянии от глаза (примерно 12 мм от вершины роговицы).
В случае отсутствия движения тени при смене ряда линз за показатель для расчетов нужно принимать среднеарифметическую величину силы этих линз.
При проведении скиаскопии в условиях медикаментозной циклоплегии, которая, как отмечалось, сопровождается расширением зрачка (мидокториаз), возможны следующие трудности. Тень может двигаться в разных направлениях, а нейтрализация тени обеспечиваться разными линзами на различных участках зрачка – так называемый симптом ножниц. Этот факт свидетельствует о неправильном астигматизме, чаще всего обусловленном несферической формой роговицы (например, при кератоконусе – дистрофии роговицы, сопровождающейся изменением ее формы). В данном случае диагноз уточняют с помощью офтальмометра (см. ниже). Если при этом установлена какая–либо закономерность в движении тени, например различный характер в центре и на периферии зрачка, то это движение следует нейтрализовать, ориентируясь на перемещение тени в центральной зоне.
Неустойчивый, меняющийся характер движения тени во время исследования, как правило, свидетельствует о недостаточности циклоплегии и возможном влиянии напряжения аккомодации на результаты скиаскопии.
Трудности могут возникнуть при скиаскопическом исследовании глаза с низкой остротой зрения и как следствие неустойчивой нецентральной фиксацией. В результате постоянного перемещения этого глаза во время исследования будет определяться рефракция не области желтого пятна, а других нецентральных участков сетчатки. В таких случаях ведущему глазу предъявляют для фиксации какой–либо предмет, передвигают его и с помощью содружественных движений устанавливают плохо видящий глаз в положение, при котором световой блок офтальмоскопа или скиаскопа расположится в центре роговицы.
Для уточнения рефракции при астигматизме можно использовать штрих–скиаскопию, или полосчатую скиаскопию. Исследование осуществляют с помощью специальных скиаскопов, имеющих источник света в виде полоски, которую можно ориентировать в разных направлениях. Установив световую полоску прибора в нужном положении (так, чтобы при переходе на зрачок оно не изменялось), проводят скиаскопию по общим правилам в каждом из найденных главных меридианов, добиваясь прекращения движения полосчатой тени.
Уточнить данные, полученные при скиаскопии, позволяет цилиндроскиаскопия. Вначале проводят обычную скиаскопию с линейками, ориентировочно определяют положение главных меридианов астигматического глаза и силу линз, при использовании которых прекращается движение тени в каждом из них. Пациенту надевают пробную оправу и в гнездо, располагающееся напротив исследуемого глаза, помещают сферическую и астигматическую линзы, которые должны обеспечить прекращение движения тени одновременно в обоих главных меридианах, и проводят в них скиаскопию. Прекращение движения тени в одном и другом направлениях свидетельствует о том, что скиаскопические показатели рефракции определены правильно. Если тень движется пе по направлению оси цилиндра или его деятельного сечения, а между ними (чаще примерно под углом 45° к ним), то, значит, ось цилиндра установлена неправильно. В этом случае поворачивают цилиндр, помешенный в оправу до тех пор, пока направление движения тени не совпадает с направлением оси.
Основным преимуществом скиаскопии является ее доступность, поскольку для проведения исследования не требуется сложного оборудования. Однако для выполнения скиаскопии необходимы определенные навыки, опыт и квалификация. Кроме того, в ряде случаев (например, при астигматизме с косыми осями) информативность методики может быть ограничена.
Более точные данные о клинической рефракции могут быть получены с помощью специальных приборов – рефрактометров. В упрощенном виде принцип работы этих приборов может быть представлен как регистрация отраженных от сетчатки световых сигналов, фокусировка которых зависит от вида и степени клинической рефракции.
В обычных рефрактометрах (Хартингера, Роденштока) настройку, установление требуемого положения и вида тест–марки прибора проводят вручную. В последние годы эти приборы в клинике практически не используют.
Более совершенными в плане объективизации исследования являются автоматические рефрактометры, в которых анализ отраженного от сетчатки инфракрасного пучка света проводится автоматически с помощью специального электронного блока. Особенности методики исследования рефракции на этих приборах подробно изложены в инструкции к каждому из них. Главное, что исследование рефракции на автоматических рефрактометрах, как правило, проводит средний медицинский персонал, а результаты выдаются в виде распечатки па специальном бланке по следующим основным параметрам: величина сферической аметропии, величина астигматизма, положение одного из главных меридианов. Несмотря па относительную дороговизну автоматических рефрактометров, в последние годы они посте пенно становятся неотьемлемой частью штатного оборудования кабинета офтальмолога.
Общий недостаток рефрактометров различного типа – так называемая приборная аккомодация – явление, из–за которого данные, получаемые при исследовании, могут иметь сдвиг в сторону миопической рефракции. Причина этого – импульс к напряжению аккомодации, обусловленный расположением оптической части прибора на небольшом расстоянии от исследуемого глаза. В ряде случаев для объективизации рефрактометрических данных требуется проведение циклоплегии. В последних моделях автоматических рефрактометров предусмотрены устройства, уменьшающие возможность возникновения приборной аккомодации.
Описанные выше методы предназначены для определения клинической рефракции глаза.
Офтальмометрия (по зарубежной терминологии – керагометрия) – объективный метод исследования только рефракции роговицы. Суть метода сводится к измерению зеркальных изображений, проецируемых на роговицу тест–марок прибора (офтальмометра), размеры которых при прочих равных условиях зависят от радиуса кривизны передней поверхности роговицы. В холе исследования определяют положение главных меридианов роговицы (в градусах), а также оптическую силу (в диоптриях) и радиус кривизны передней поверхности роговицы (в миллилитрах) в указанных меридианах. Следует отметить, что между последними показателями имеется четкая зависимость: чем меньше радиус кривизны роговицы, тем больше ее оптическая сила.
В некоторых моделях автоматических рефрактометров имеется блок, с помощью которого в ходе исследования параллельно с клинической рефракцией (т. е. общей рефракцией глаза), оценивается и рефракция роговицы.
Хотя на основании результатов офтальмометрии нельзя судить о клинической рефракции глаза в целом, однако в ряде ситуаций они могут иметь важное и даже основополагающее значение. ■ В диагностике астигматизма результаты офтальмометрии могут быть использованы в качестве отправной точки. В любом случае их необходимо уточнить по возможности с помощью рефрактометрии и обязательно путем субъективного исследования рефракции. Последнее обстоятельство связано с возможным влиянием на параметры общего астигматизма хрусталикового астигматизма. ■ Данные, полученные при офтальмометрии (в частности, о рефракции роговицы), наряду с длиной переднезадней оси используют в различных формулах, с помощью которых рассчитывают параметры рефракционных операций (например, радиальной кератотомии) и оптическую силу интраокулярных линз (ИОЛ), применяемых для коррекции аметропий различного генеза (например, гиперметропии, как правило, возникающей после удаления катаракты). ■ Точное определение радиуса кривизны передней поверхности роговицы необходимо при выборе такого важного параметра контактных линз, как базовый радиус их задней (обращенной к глазу) поверхности. Это измерение необходимо, условно говоря, для достижения конгруэнтности передней поверхности роговицы и задней поверхности контактной линзы. ■ Информативность офтальмометрии достаточно высока в случаях неправильного роговичного астигматизма, который обычно является приобретенным – формируется вследствие различных поражений роговицы (травматических, воспалительных, дистрофических и т. д.). При этом в ходе исследования могут быть выявлены значительное усиление или, наоборот, ослабление рефракции роговицы, нарушение взаимно перпендикулярного расположения ее главных меридианов, искажение формы зеркального изображения тест–марок на роговице.
С помощью офтальмометрии удается исследовать рефракцию роговицы только в центральной (диаметром 2,5–3 мм) зоне. Между тем даже при отсутствии астигматизма форма всей поверхности роговицы отличается от сферической и геометрически условно может быть представлена в виде параболоида вращения. В практическом отношении это означает, что даже в пределах одного меридиана радиус кривизны роговицы изменяется: постепенно увеличивается в направлении от центра к периферии роговицы, при этом соответственно уменьшается рефракция роговицы. Знание параметров роговицы в парацентральных и даже периферических участках необходимо в ряде клинических ситуаций: при выборе контактных линз и кераторефракционных операций (см. соответствующие разделы), определении степени влияния различных заболеваний роговицы на ее рефракционные свойства и т. д.
Методы исследования, предусматривающие оценку кривизны и рефракции всей поверхности роговицы, названы кератотопографическими, так как с их помощью можно получить представление о взаимоотношениях рефракции различных участков роговицы (условно топографии).
Ориентировочная оценка рефракции всей поверхности роговицы может быть проведена с помощью такого простого способа, как кератоскопия, в ходе которой с помощью несложного устройства (кератоскопа) на роговицу проецируется изображение концентрически расположенных окружностей. Кератоскоп представляет собой диск с подсвечивающимися чередующимися белыми и черными концентрическими окружностями. Если роговица имеет форму, близкую к сферичной, изображение формируется из правильно расположенных окружностей. При астигматизме эти изображения принимают форму овала (рис. 5.7, а), а при неправильном астигматизме нарушается их упорядоченное расположение (рис. 5.7, б). С помощью кератоскопа можно получить лишь качественную оценку сферичности роговицы.
Фотокератографическое исследование топографии роговины предусматривает математическую обработку фотокератограмм (картин зеркальных изображений окружностей). Кроме того, измерение рефракции различных участков роговицы может быть осуществлено и с помощью обычного офтальмометра, снабженного специальной насадкой для изменения фиксации взора пациента (так называемая фиксационная гопометрия).
Однако наиболее информативным методом исследования рефракции роговицы является компьютерный кератотопографический. Специальные приборы (кератотопографы) обеспечивают возможность проведения детального объективного анализа рефракции и кривизны на различных участках роговицы. В кератотопографах заложено несколько компьютерных программ для обработки результатов исследования. Предусмотрен также особенно наглядный вариант обработки данных с помощью так называемого цветового картирования: цвет и интенсивность окраски различных зон роговицы зависят от рефракции последних.
Важен вопрос о последовательности применения субъективных и объективных методов исследования рефракции. Очевидно, что при наличии автоматических рефрактометров объективная рефрактометрия может предшествовать субъективной оценке рефракции. Однако именно субъективные тесты должны иметь основополагающее значение не только при установлении заключительного диагноза, но и при выборе адекватного метода коррекции аметропии.
Методы исследования аккомодации
Как отмечалось выше, необходимо различать абсолютную и относительную аккомодацию. Абсолютная аккомодация – аккомодация одного (изолированного) глаза при выключении из акта зрения другого. Механизм относительной аккомодации предполагает аккомодацию одновременно двух глаз при фиксации общего объекта.Абсолютную аккомодацию характеризуют две точки на зрительной оси: дальнейшая точка ясного зрения PR (punctum remotum) и ближайшая точка ясного зрения РР (punctum proximum). PR – точка наилучшего зрения в пространстве, положение которой фактически зависит от клинической рефракции. РР – точка наилучшего зрения на близком расстоянии при максимальном напряжении аккомодации. Таким образом, объем абсолютной аккомодации может быть вычислен по формуле:
А=R – РР
где А – объем абсолютной аккомодации, R – клиническая рефракция, РР – ближайшая точка ясного зрения (все величины в диоптриях). Рефракцию точек, приближенных к глазу, принято обозначать со знаком так как эти точки условно соответствуют миопической рефракции. Например, при величине клинической рефракции, равной миопии – 1,0 дптр, и расположении ближайшей точки ясного зрения в 20 см от глаза объем абсолютной аккомодации составит:
А=–1,0–(–1/0,2)=–1,0–(–5,0)=6,0 (дптр).
Таблица 5.2. Примерные возрастные нормы запаса относительной аккомодации (А)
| Возраст, годы | А, дптр |
|---|---|
| 7–9 | 3 |
| 10–12 | 4 |
| 13–20 | 5 |
| 21–25 | 4 |
| 26–30 | 3 |
| 31–35 | 2 |
| 36–40 | 1 |
| 41–45 | 0 |
Определение величины относительной аккомодации проводят следующим образом. Пациента просят бинокулярно (т. с. двумя глазами) читать текст №4 таблицы для проверки остроты зрения вблизи. В пробную оправу последовательно (с интервалом 0,5 дптр) вставляют сначала положительные, а затем отрицательные линзы до тех пор, пока обследуемый еще может читать. При этом положительные линзы будут компенсировать уже затраченное напряжение аккомодации, а отрицательные, наоборот, вызывать это напряжение. Величины максимальной положительной и максимальной отрицательной линз укажут соответственно на отрицательную, г. с. израсходованную, и положительную, т. е. оставшуюся в запасе, части относительной аккомодации. Сумма этих показателей составит объем относительной аккомодации.
Для объективной оценки состояния аккомодационного аппарата глаза применяют эргографию. Суть метода заключается в определении работоспособности цилиарной мышцы при зрительной работе на близком расстоянии. Результаты исследования фиксируют в виде графической кривой. Предложено различать 4 типа эргографических кривых: 1–й характеризует нормальную работоспособность цилиарной мышцы, остальные – нарастающее снижение аккомодационной способности.
С практической точки зрения важное значение имеет величина запаса относительной аккомодации (табл. 5.2), т. е. показатель, который служит косвенным свидетельством потенциальных возможностей аппарата аккомодации. Имеются данные о том, что снижение этого показателя указывает на предрасположенность к возникновению миопии.
Для длительной спокойной работы на близком расстоянии необходимо, чтобы положительная часть относительной аккомодации была в 2 раза больше отрицательной.
Возрастные особенности аккомодации и рефракции
При рассмотрении возрастных особенностей оптического аппарата глаза следует выделять изменения, представляющие собой закономерные проявления возрастной инволюции глаза, и изменения, обусловленные заболеваниями глаза и общими болезнями, развивающимися в пожилом и старческом возрасте.К характерным проявлениям физиологического старения глаза можно отнести уменьшение объема аккомодации и связанные с этим увеличение "явной” гиперметропии и пресбиопию. Под пресбиопией понимают возрастное физиологическое ослабление аккомодационной способности, которое выражается в медленно прогрессирующем ухудшении некорригированного зрения при работе на близком расстоянии.
Для миопии характерна возможность увеличения (прогрессирования) в возрасте 10–30 лет. Из состояний, связанных с возрастными заболеваниями глаза, на первый план выступают изменения рефракции при начинающихся помутнениях хрусталика.
Возрастные изменения аккомодации
У пациентов дошкольного и школьного возраста на фойе гиперметропической рефракции и "слабости” аккомодационного аппарата может наблюдаться так называемый спазм аккомодации. При этом отсутствует полное расслабление аккомодации при зрении вдаль и происходит усиление клинической рефракции, т. е. возникает миопия, которую называют ложной. Дифференциальная диагностика с истинной близорукостью основана на проведении медикаментозной циклоплегии.Расстройства аккомодации у лиц пожилого возраста чаше всего обусловлены возрастными изменениями хрусталика: его размера, массы, цвета, формы и, главное, консистенции, которые связаны в основном с особенностями его роста и биохимическими сдвигами (см. соответствующий раздел).
Постепенным уменьшением эластичности хрусталика обусловлено возрастное физиологическое ослабление объема абсолютной аккомодации, установленное F. С. Donders в 1866 г. Согласно его данным (рис. 5.8), при эмметропии ближайшая точка ясного зрения с возрастом постепенно удаляется от глаза, что приводит к уменьшению объема аккомодации. В возрасте 65–70 лет ближайшая и дальнейшая точки ясного зрения совмещаются. Это означает, что аккомодационная способность глаза полностью утрачивается.
Ослабление аккомодации в старческом возрасте пытаются объяснить не только уплотнением хрусталика, но и другими причинами: дегенеративными изменениями цинновой связки и уменьшением сократительной способности цилиарной мышцы. Установлено, что с возрастом в цилиарной мышце действительно происходят изменения, способные привести к уменьшению ее силы. Отчетливые признаки инволюционной дистрофии цилиарной мышцы появляются уже в возрасте 35–40 лет. Суть дистрофических изменений в этой мышце, которые медленно нарастают, состоит в прекращении образования мышечных волокон, замещении их соединительной тканью и жировой дегенерации. Постепенно характер строения мышцы нарушается.
 Рис. 5.8. Возрастные изменения объема аккомодации по Donders.
По оси абсцисс – возраст, годы; по оси ординат – положение ближайшей точки ясного зрения (слева, дптр, справа, см). Р и r – ближайшая и дальнейшая точки ясного зрения соответстиснно.
Рис. 5.8. Возрастные изменения объема аккомодации по Donders.
По оси абсцисс – возраст, годы; по оси ординат – положение ближайшей точки ясного зрения (слева, дптр, справа, см). Р и r – ближайшая и дальнейшая точки ясного зрения соответстиснно.
Несмотря па эти существенные изменения цилиарной мышцы, ее сократительная способность благодаря приспособительно–компенсаторным механизмам в значительной мере сохраняется, хотя и ослабевает. Относительная недостаточность цилиарной мышцы усугубляется также тем, что вследствие уменьшения эластичности хрусталика для обеспечения той же степени его кривизны мышце приходится сильнее напрягаться. Не исключена возможность и вторичных атрофических изменений в цилиарной мышце из–за ее недостаточной активности в старческом возрасте.
Таким образом, ослабление сократительной способности цилиарной мышцы играет определенную роль в возрастном уменьшении объема аккомодации. Однако основными причинами этого, несомненно, являются уплотнение вещества хрусталика и уменьшение его эластичности.
В основе развития пресбиопии лежит процесс уменьшения объема аккомодации, который происходит на протяжении всей жизни. Пресбиопия проявляется только в пожилом возрасте, когда удаление ближайшей точки ясного зрения от глаза уже бывает значительным и эта точка приближается к среднему рабочему расстоянию (приблизительно 33 см).
Термин "пресбиопия" (от греч. prеsbys – старик, opsis – зрение) – "старческое зрение" – не отражает сути процесса и является более широким, собирательным понятием. Нельзя признать удачным и термин "старческая дальнозоркость", поскольку по механизму происхождения и клиническим проявлениям пресбиопия существенно отличается от гиперметропии.
У лиц с эмметропией пресбиопия обычно начинает проявляться в возрасте 40–45 лет. В этот период ближайшая точка ясного зрения отодвигается от глаз примерно па 23–31 см, т. с. приближается к среднему рабочему расстоянию (33 см). Для четкого распознавания объектов на этом расстоянии требуется напряжение аккомодации, приблизительно равное 3,0 дптр. Между тем в 45–летнем возрасте средняя величина объема аккомодации составляет всего 3,2 дптр (см. рис. 5.9). Следовательно, необходимо затратить почти весь сохраняющийся в этом возрасте объем аккомодации, что вызывает ее чрезмерное напряжение и быстрое утомление.
При гиперметропии пресбиопия наступает раньше, при миопии – позже. Это связано с тем, что у лиц с гиперметропией ближайшая точка ясного видения находится дальше от глаз и удаление ее за пределы среднего рабочего расстояния с возрастом происходит быстрее, чем у лиц с эмметропией. У лиц с миопией, наоборот, область аккомодации приближена к глазу, напрягать аккомодацию в процессе работы на близком расстоянии приходится только при близорукости менее 3,0 дптр, поэтому симптомы пресбиопии с большим или меньшим запозданием могут возникнуть лишь при миопии слабой степени. При некорригированной близорукости 3,0 дптр и более пресбиопия не проявляется.
Основной симптом некорригированной пресбиопии – затруднения при рассматривании мелких объектов на близком расстоянии. Распознавание последних несколько облетается, если их отодвинуть на некоторое расстояние от глаз. Однако при значительном удалении объектов зрительной работы их угловые размеры уменьшаются и распознавание вновь ухудшается. Наступающее при этом утомление цилиарной мышцы, обусловленное ее чрезмерным напряжением, может привести к зрительному утомлению.
Все, что вызывает хотя бы кратковременное удаление ближайшей точки ясного зрения от глаз и ухудшает различимость объектов зрительной работы, способствует более раннему проявлению пресбиопии и большей выраженности ее симптомов. В связи с этим при прочих равных условиях пресбиопия возникает раньше у лиц, бытовая или профессиональная деятельность которых связана с рассматриванием мелких объектов. Чем меньше контраст объектов с фоном, тем сильнее действует этот фактор. Затруднения при зрительной работе на близком расстоянии у лиц с пресбиопией возрастают при пониженной освещенности вследствие некоторого удаления от глаз ближайшей точки ясного зрения. По той же причине проявления пресбиопии усиливаются при ‘зрительном утомлении.
Отмечено также, что при начинающейся катаракте проявления пресбиопии могут возникать несколько позднее или ослабевают, если пресбиопия уже имеет место. С одной стороны, это объясняют некоторым увеличением объема аккомодации вследствие гидратации вещества хрусталика, что препятствует уменьшению его эластичности, с другой – некоторым сдвигом клинической рефракции в сторону миопии и приближением дальнейшей точки ясного зрения к глазу. Таким образом, улучшение зрения при пресбиопии может служить ранним признаком начинающейся катаракты. Принципы коррекции пресбиопии будут изложены ниже.
Возрастные изменения рефракции
Для того чтобы попять сущность возрастных изменений рефракции, необходимо учесть, что преломляющая сила оптического аппарата глаза относительно сетчатки в основном зависит от длины переднезадней оси и состояния аккомодационного аппарата.В общей тенденции возрастных изменений рефракции можно выделить две фазы: гиперметропизации глаза (ослабления статической рефракции) – в раннем детстве и в период от 30 до 60 лет и две фазы миопизации (усиления статической рефракции) – во втором и в третьем десятилетиях жизни и после 60 лет.
Прежде всего необходимо остановиться на закономерностях возрастных изменений гиперметропической и миопической рефракции. Наиболее чувствительны к таким изменениям аккомодации пациенты с гиперметропией. Как отмечалось выше, у гиперметропов механизм аккомодации включен постоянно, т. е. при рассматривании как близко, так и далеко расположенных объектов. Общая величина гиперметропии складывается из скрытой (компенсирован пой напряжением аккомодации) и явной (требующей коррекции). Соотношение этих составляющих изменяется вследствие возрастных нарушений в аккомодационном аппарате: с возрастом увеличивается выраженность явной гиперметропии. Иными словами, аметропия не увеличивается и не возникает (так субъективно могут оценивать эти изменения пациенты), а проявляется. При этом каких–либо сдвигов в параметрах основных анатомо–оптических элементов глаза (длина переднезадней оси, рефракция роговицы) не происходит.
Совершенно иной механизм возникновения миопии и такого очень часто наблюдаемого в клинической практике явления, как ее прогрессирование. Основным анатомическим субстратом этого процесса является постепенное увеличение длины переднезадней оси глаза.
Миопия может быть врожденной, проявляться у дошкольников, но чаще всего возникает в школьном возрасте, причем с каждым годом обучения в школе число учащихся с миопией увеличивается, а степень ее нередко повышается. Ко времени совершеннолетия примерно у ⅕ школьников из–за миопии в той или иной мере ограничен выбор профессии. Прогрессирование близорукости может привести к тяжелым необратимым изменениям в глазу и значительной потере зрения.
Э. С. Аветисов (1975) выделяет три основных звена в механизме развития миопии: ■ зрительная работа па близком расстоянии – ослабленная аккомодация ■ наследственная обусловленность ■ ослабленная склера – внутриглазное давление.
Первые два звена действуют уже на начальном этапе развития близорукости, причем степень участия каждого из них может быть различной. Третье звено обычно находится в потенциальном состоянии и проявляется в стадии развитой близорукости, обусловливая ее дальнейшее прогрессирование. Не исключено, что формирование миопической рефракции может начаться с указанного звена.
При ослабленной аккомодационной способности усиленная зрительная работа на близком расстоянии становится для глаз непосильной нагрузкой. В этих случаях организм вынужден изменить оптическую систему глаз таким образом, чтобы приспособить ее к работе на близком расстоянии без напряжения аккомодации. Это достигается главным образом за счет удлинения переднезадней оси глаза в период его роста и формирования рефракции. Неблагоприятные гигиенические условия для зрительной работы оказывают влияние па развитие миопии лишь в той мере, в какой они затрудняют аккомодацию и побуждают чрезмерно приближать глаза к объекту зрительной работы. При таком механизме развития близорукость обычно не превышает 3,0 дптр.
Слабость аккомодационного аппарата может быть следствием врожденной морфологической неполноценности либо недостаточной тренированности цилиарной мышцы или воздействия на нее общих нарушений и заболеваний организма. Причиной ослабления аккомодации служит также недостаточное снабжение цилиарной мышцы кровью. Снижение же ее работоспособности приводит к еще большему ухудшению гемодинамики глаза. Хорошо известно, что мышечная деятельность является мощным активатором кровообращения.
Возможен как аутосомно–доминантный, так и аутосомно–рецессивный тип наследования близорукости. Частота указанных типов наследования заметно варьирует. Второй тип особенно часто встречается в изолятах, характеризующихся высоким процентом родственных браков. При аутосомно–доминантном типе наследования близорукость возникает в более позднем возрасте, протекает более благоприятно и, как правило, не достигает высоких степеней. Для близорукости, наследуемой по аутосомно–рецессивному типу, характерны фенотипический полиморфизм, более раннее возникновение, большая склонность к прогрессированию и развитию осложнений, нередкое сочетание с рядом врожденных заболеваний глаз и более тяжелое течение в последующем поколении по сравнению с предыдущим.
При ослаблении склеры, обусловленном нарушением фибриллогенеза, которое может быть врожденным или возникает в результате общих заболеваний организма и эндокринных сдвигов, создаются условия для неадекватного ответа на стимул к росту глазного яблока, а также для его постепенного растяжения под влиянием внутриглазного давления. Само по себе внутриглазное давление (даже повышенное) при отсутствии слабости склеры не способно привести к растяжению глазного яблока, причем имеет значение не только, а может быть, и не столько статическое, сколько динамическое внутриглазное давление, т. е. "возмущения" жидкости глаза при движениях тела или головы. При ходьбе или выполнении каких–либо рабочих процессов, связанных со зрительным контролем, эти движения совершаются в основном в передне–заднем направлении. Поскольку в передней части глаза имеется преграда в виде "аккомодационного" кольца, внутриглазная жидкость при "возмущениях” оказывает воздействие главным образом на заднюю стопку глаза. Кроме того, как только задний полюс глаза принимает более выпуклую форму, в соответствии с законами гидродинамики он становится местом наименьшего сопротивления.
Чрезмерное удлинение глазного яблока оказывает негативное воздействие прежде всего на сосудистую оболочку и сетчатку. Эти ткани как более дифференцированные обладают меньшими пластическими возможностями, чем склера. Для их роста существует физиологический предел, за которым наступают изменения в виде растяжения этих оболочек и возникновения в них трофических нарушений, которые служат основой для развития осложнений, наблюдающихся при высоких степенях близорукости. Возникновению трофических нарушений способствует также сниженная гемодинамика глаза.
Выявлены некоторые особенности патогенеза врожденной миопии. В зависимости от происхождения различают три ее формы: ■ врожденная близорукость, развивающаяся вследствие дискорреляции между анатомическим и оптическим компонентами рефракции, являющейся результатом сочетания относительно длинной оси глаза с относительно сильной преломляющей способностью его оптических сред, главным образом хрусталика. При отсутствии слабости склеры такая близорукость обычно не прогрессирует: удлинение глаза в процессе роста сопровождается компенсаторным уменьшением преломляющей силы хрусталика ■ врожденная близорукость, обусловленная слабостью и повышенной растяжимостью склеры. Такая близорукость интенсивно прогрессирует и представляет собой одну из наиболее неблагоприятных в прогностическом отношении форм ■ врожденная близорукость при различных пороках развития глазного яблока. В таких случаях миопическая рефракция, обусловленная анатомооптической дискорреляцией, сочетается с различными патологическими изменениями и аномалиями развития глаза (косоглазие, нистагм, колобомы оболочек глаза, подвывих и частичное помутнение хрусталика, частичная атрофия зрительного нерва, дегенеративные изменения сетчатки и др.). При ослаблении склеры такая близорукость может прогрессировать.
Что касается сдвига рефракции в сторону миопии у лиц старше 60 лет, то его отмечают не все авторы. Остается открытым вопрос, является ли этот сдвиг закономерной возрастной тенденцией или он объясняется относительно большим числом среди обследованных лиц с начинающейся катарактой, при которой, как известно, отмечаются набухание хрусталика и увеличение его преломляющей способности.
Классификация аметропий
Для создания рабочей, т. е. имеющей практическую направленность, классификации аметропий необходимо выделение ряда признаков. Один из вариантов такой классификации имеет следующий вид.| Признак | Клинические проявления |
|---|---|
| Соответствие физической рефракции размерам глаза | Сильная рефракция (миопия) |
| Слабая рефракция (гиперметропия) | |
| Сферичность оптической системы глаза | Условно сферическая (без астигматизма) |
| Асферическая (с астигматизмом) | |
| Степень аметропии | Слабая (меньше 3,0 дптр) |
| Средняя (3,25–6,0 дптр) | |
| Высокая (более 6,0 дптр) | |
| Равенство или неравенство величин рефракции обоих глаз | Изометропическая |
| Анизометропическая | |
| Время формирования аметропии | Врожденная |
| Рано приобретенная (в дошкольном возрасте) | |
| Приобретенная в школьном возрасте | |
| Поздно приобретенная | |
| Особенности патогенеза | Первичная |
| Вторичная (индуцированная) | |
| Характер влияния на анатомо–функциональное состояние глаза | Осложненная |
| Неосложненная | |
| Стабильность рефракции | Стационарная |
| Прогрессируюшая |
Истинное прогрессирование аметропии характерно для миопической рефракции. Прогрессирование близорукости происходит вследствие растяжения склеральной оболочки и увеличения длины переднезадней оси. Для характеристики скорости прогрессирования миопии используют годичный градиент ее прогрессирования:
ГГ =[СЭ2–СЭ1]/Т (дптр/год)
где ГГ – годичный градиент прогрессирования; СЭ2 – сферический эквивалент рефракции глаза к концу наблюдения; СЭ1 – сферический эквивалент рефракции глаза в начале наблюдения; Т – период времени между наблюдениями (годы).
При годичном градиенте менее 1 дптр близорукость считают медленно прогрессирующей, при градиенте 1,0 дптр и более – быстропрогрессирующей (при этом необходимо решить вопрос о выполнении операции, стабилизирующей прогрессирование миопии, – склеропластики). В оценке динамики близорукости могут помочь повторные измерения длины оси глаза с помощью ультразвуковых методов.
Среди прогрессирующих вторичных (индуцированных) аметропий прежде всего необходимо выделить кератоконус. В течении заболевания выделяют четыре стадии, прогрессирование кератоконуса сопровождается усилением рефракции роговицы и неправильного астигматизма на фоне заметного снижения максимальной остроты зрения.
Принципы коррекции аметропий
Основная задача любой коррекции аметропий в конечном счете сводится к созданию условий для фокусировки изображения предметов на сетчатке. В зависимости от принципа действия методы коррекции аметропий условно можно разделить на две большие группы: методы, не изменяющие рефракцию основных преломляющих сред глаза, – очковые и контактные линзы, или так называемые традиционные средства коррекции; методы, изменяющие рефракцию основных преломляющих сред глаза, – хирургические.При миопии основная цель коррекции – уменьшение рефракции, при гиперметропии – ее усиление, а при астигматизме – неравномерное изменение оптической силы главных меридианов.
В ряде случаев при выборе метода коррекции аметропии приходится использовать термин "непереносимость“ коррекции. Этот термин собирательный: объединяет комплекс объективных и субъективных симптомов, при наличии которых применение того или иного метода коррекции ограничено.
Следует различать непосредственное влияние коррекции на остроту зрения и зрительную работоспособность – "тактический" эффект оптической коррекции, а также влияние па динамику рефракции и некоторые болезненные состояния глаза (астенопия, спазм аккомодаций, амблиопия, косоглазие) – стратегический эффект. Второй эффект в известной мере реализуется через первый.
Коррекция аметропий с помощью очковых линз
Несмотря на достижения в области контактной и хирургической коррекции зрения, очки остаются наиболее распространенным способом коррекции аметропий. К их основным достоинствам следует отнести доступность, практическое отсутствие осложнений, возможность моделирования и изменения силы коррекции, а также обратимость эффекта. Основной же недостаток очков обусловлен тем обстоятельством, что очковая линза располагается на определенном (около 12 мм) расстоянии от вершины роговицы и, таким образом, не составляет с глазом единой оптической системы. В связи с этим очковые линзы (особенно так называемых высоких рефракций) оказывают существенное влияние на величину ретинального, т. е. формирующегося на сетчатке, изображения предметов. Ослабляющие рефракцию рассеивающие (отрицательные) линзы их уменьшают, а усиливающие, собирающие (положительные), наоборот, увеличивают. Кроме того, очковые линзы высоких рефракций могут изменять поле зрения.В зависимости от оптического действия различают стигматические, или сферические (рис. 5.10), астигматические, или асферические (рис. 5.11), и призматические очковые линзы. В астигматических линзах (цилиндрах) выделяют ось и расположенное перпендикулярно оси оптически деятельное сечение. Преломление лучей происходит только в плоскости деятельного сечения. По числу оптических зон очковые линзы подразделяют на монофокальные и мультифокальные (две зоны и более).
 Рис. 5.10. Ход лучей через собирающую (а) и рассеивающую (б) линзы, применяемые для коррекции гиперметропии и миопии соответственно.
Рис. 5.10. Ход лучей через собирающую (а) и рассеивающую (б) линзы, применяемые для коррекции гиперметропии и миопии соответственно.

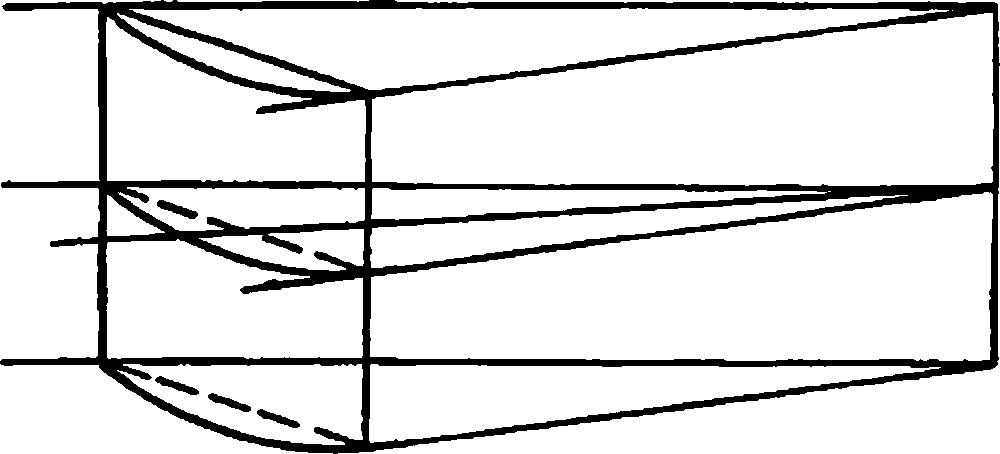 Рис. 5.11. Ход лучей через выпуклую цилиндрическую линзу. Объяснение в тексте.
Рис. 5.11. Ход лучей через выпуклую цилиндрическую линзу. Объяснение в тексте.
При обследовании пациента с целью назначения очков необходимо решить две тесно связанные между собой задачи: определить статическую рефракцию каждого глаза; выбрать адекватную оптическую коррекцию, которая зависит от состояния статической и динамической рефракции, возраста больного, монокулярной и бинокулярной переносимости очков, а также показаний к их назначению.
Целесообразно придерживаться следующего порядка обследования: ■ определение остроты зрения каждого глаза ■ уточнение вида и степени аметропии с помощью субъективного метода (предварительно возможно проведение автоматической рефрактометрии), основанного на определении максимальной остроты зрения с коррекцией (существенное повышение остроты зрения будет свидетельствовать о преимущественном влиянии рефракции па этот показатель) ■ у детей дошкольного возраста и пациентов с амблиопией проведение медикаментозной циклоплегии и определение рефракции с помощью объективных и субъективных методов в условиях выключенной аккомодации ■ уточнение максимальной остроты зрения с помощью пробной контактной коррекции или пробы с диафрагмой ■ подбор очков с учетом изложенных ниже общих правил назначения очковых линз при различных видах аметропий и переносимости их с учетом результатов пробного ношения очков в течение 15–30 мин (чтение, ходьба, перемещение взора с одного предмета на другой, движения головой и глазами); при этом учитывают качество бинокулярной переносимости очков как для дали, так и для близи.
Показаниями к назначению очков при дальнозоркости служат астенопические жалобы или снижение остроты зрения хотя бы одного глаза. В таких случаях, как правило, назначают постоянную оптическую коррекцию в зависимости от субъективной переносимости с тенденцией к максимальному исправлению аметропии. Если при астенопии такая коррекция не дает улучшения, то для зрительной работы на близком расстоянии выписывают более сильные (па 1,0–2,0 дптр) линзы. При дальнозоркости низкой степени и нормальной остроте зрения можно ограничиться назначением очков для работы только на близком расстоянии.
Детям раннего возраста (2–4 лет) при дальнозоркости более 3,5 дптр целесообразно выписывать очки для постоянного ношения на 1,0 дптр слабее, чем степень аметропии. В таких случаях смысл оптической коррекции заключается в устранении условий для возникновения аккомодационного косоглазия. Если к 6–7 голам у ребенка сохраняются устойчивое бинокулярное зрение и высокая острота зрения без коррекции, очки отменяют.
При близорукости слабой и средней степени для дали, как правило, рекомендуется "субмаксимальная" коррекция (корригированная острота зрения в пределах 0,7–0,8). В отдельных случаях с учетом профессиональной деятельности возможна полная коррекция. Правила оптической коррекции для близи определяются состоянием аккомодации. Если она ослаблена (уменьшение запаса относительной аккомодации, патологические типы эргографических кривых, зрительный дискомфорт при чтении в очках), назначают вторую пару очков для работы на близком расстоянии или бифокальные очки для постоянного ношения. Верхняя половина стекол в таких очках служит для зрения вдаль и полностью или почти полностью исправляет близорукость, нижняя половина стекол, предназначенная для работы на близком расстоянии, слабее верхней на 1,0; 2,0 или 3,0 дптр в зависимости от субъективных ощущений пациента и степени близорукости: чем она выше, тем обычно больше разница в силе линз, предназначенных для дали и для близи. Это так называемый пассивный способ оптической коррекции близорукости.
При миопии высокой степени назначают постоянную коррекцию. Силу линз для дали и для близи определяют в зависимости от субъективной переносимости коррекции. При ее непереносимости возможно решение вопроса о контактной или хирургической коррекции близорукости .
С целью повышения аккомодационной способности миопического глаза выполняют специальные упражнения для цилиарной мышцы. Если удается добиться стойкой нормализации этой способности, назначают полную или почти полную оптическую коррекцию и для работы па близком расстоянии (активный способ коррекции миопии). В этих случаях очки будут побуждать аккомодацию к активной деятельности.
При астигматизме всех видов показано постоянное ношение очков. Астигматический компонент коррекции назначают в зависимости от субъективной переносимости с тенденцией к полному исправлению астигматизма, сферический – в соответствии с общими правилами назначения очков при дальнозоркости и близорукости.
При анизометропии назначают постоянную оптическую коррекцию с учетом субъективно переносимой разницы между силой корригирующих линз для правого и левого глаза. Возможности очковой коррекции анизометропии ограничены из–за того, что величина изображения на сетчатке зависит от оптической силы очковых линз. Два изображения значительно различаются по величине и не сливаются в единый образ. При разнице в силе линз более 3,0 дптр отмечается анизейкония (от греч. anisos – неравный, eikon – изображение), которая оказывает существенное влияние на переносимость очков. В этих случаях имеются медицинские показания к применению контактных линз и выполнению рефракционных операций.
Призматические линзы обладают свойством отклонять лучи света к основанию призмы.
Основные показания к назначению таких линз могут быть объединены в три основные группы: ■ гетерофория (дисбаланс глазодвигательных мышц) с явлениями декомпенсации ■ двоение (диплопия) на фоне пареза глазодвигательных мышц ■ некоторые формы содружественного косоглазия (в комплексе с другими методами лечения).
Призматического эффекта можно добиться с помощью обычных призм из стекла, так называемых френелевских линз (которые путем прижимания фиксируют на задней поверхности обычной очковой линзы), бифокальных сферопризматических очков (БСПО) и за счет смещения центра линз в оправе.
Очковые призмы из стекла с оптической силой более 10,0 призменных диоптрий не изготавливают из–за их больших размеров и массы. Френелевские насадки на очки – тонкие пластинки из мягкого пластика –легки и удобны в применении. Смещение центра очковых линз на 1,0 см обеспечивает призматическое действие в 1,0 призменную диоптрию на каждую диоптрию оптической силы обычной очковой линзы. В положительной линзе основание призмы направлено в сторону смещения центра, а в отрицательной – в противоположную. БСПО, предложенные Е. В. и Ю. А. Утехиными, можно применять для разгрузки аккомодации и конвергенции. В нижней части ’’минусовых” очков для дали наклеен элемент для близи, состоящий из комбинации "плюсовой" сферы в 2,25 дптр и призмы силой 6,75 призменных диоптрий, основание которой обращено к носу.
Коррекция пресбиопии базируется на применении положительных (собирающих) линз при работе на близком расстоянии. По разным данным, возраст, в котором возникает необходимость в подборе "пресбиопических" очков, колеблется от 38 до 48 лет и зависит от вида и степени сопутствующей аметропии, рода трудовой деятельности и т. д. В конечном счете вопрос о целесообразности назначения первых пресбиопических очков решают индивидуально с учетом жалоб пациента. Как правило, первые симптомы пресбиопии – потребность в отодвигании объекта от глаза (в результате чего уменьшается степень напряжения аккомодации) и появление жалоб на астенопию к концу рабочего дня.
Предложены различные способы определения силы очковых линз, предназначенных для коррекции пресбиопии (в том числе предусматривающие исследование объема аккомодации). Однако в клинической практике наиболее распространен метод, при котором ориентируются на так называемые возрастные нормы: первые очки – +1,0 дптр назначают в возрасте 40–43 лет, в последующем увеличивают силу очков приблизительно на 0,5–0,75 дптр каждые 5–6 лет. Окончательное значение пресбиопической коррекции к 60 годам составляет +3,0 дптр, что обеспечивает возможность осуществления зрительной работы на расстоянии 33 см.
При сочетании пресбиопии с аметропией в расчет силы линз вносят поправку – прибавляют силу сферической линзы (с соответствующим знаком), которая корригирует аметропию. Цилиндрический компонент коррекции, как правило, остается без изменений. Таким образом, при гиперметропии и пресбиопии сферический компонент очков для дали увеличивают на величину пресбиопической коррекции, а при миопии, наоборот, уменьшают.
В конечном счете при назначении очков для коррекции пресбиопии решающее значение имеет проба на субъективную переносимость – чтение текста с пробными линзами в течение определенного времени.
Для того чтобы избежать применения нескольких пар очков при пресбиопии, сочетающейся с аметропией, целесообразно назначать бифокальные и даже мультифокальные очки, верхняя часть которых предназначена для зрения вдаль, а нижняя – для близи. Существует также способ, позволяющий в пределах субъективно переносимой разницы в силе линз один глаз скорригировать для зрения вдаль, а другой – для близи.
При сочетании пресбиопии с недостаточностью конвергенции целесообразно применять сферопризматические линзы. Призма, основание которой обращено к носу благодаря отклонению лучей в носовую сторону, способствует уменьшению степени конвергенции. Небольшого призматического эффекта можно добиться путем преднамеренного уменьшения расстояния между центрами положительных очковых линз по сравнению с межзрачковым расстоянием.
Контактная коррекция аметропий
Контактная коррекция зрения имеет многовековую историю. Этим вопросом интересовались еще Леонардо да Винчи и Рене Декарт. О применении контактных линз первыми сообщили A. Fick и Е. Kalt в 1888 г. Началом революции в контактной коррекции зрения можно считать конец 50–х годов, когда чешские ученые О. Wichterle и D. Lim синтезировали гидрофильный материал для изготовления мягких линз, и в 1966 г. началось их массовое производство. В нашей стране первая специализированная лаборатория была организована в МНИИГБ им. Гельмгольца в 1956 г.Контактные линзы являются средством оптической коррекции зрения. Они непосредственно соприкасаются с глазом и удерживаются силами капиллярного притяжения.
Между задней поверхностью линзы и передней поверхностью роговицы находится слой слезной жидкости. Коэффициент преломления материала, из которого изготовлена линза, практически не отличается от коэффициента преломления пленки слезной жидкости и роговицы. Слезная жидкость заполняет все деформации передней корнеальной поверхности, поэтому лучи света преломляются только на передней поверхности контактной линзы, которая нейтрализует все недостатки формы роговицы, и далее проходят практически в гомогенной оптической среде. Контактные линзы хорошо корригируют астигматизм, компенсируют оптические аберрации, мало изменяют положение кардинальных точек в оптической системе и оказывают незначительное влияние на величину изображения, не ограничивают поле зрения, обеспечивают хороший обзор, не видны окружающим.
Контактные линзы классифицируют в зависимости от материала, из которого они изготовлены. По этому критерию выделяют два класса линз: жесткие (ЖКЛ) и мягкие (MKЛ). Свойства материала, из которого изготавливают контактные линзы, во многом определяют их переносимость пациентами.
ЖКЛ могут быть газонепроницаемыми или газопроницаемыми. Газонепроницаемые ЖКЛ уже уходят в историю: их изготавливают из непроницаемого для кислорода полиметилметакрилата, требуются длительная адаптация к этим ЖКЛ, время их использования ограничено. Газопроницаемые ЖКЛ пациенты переносят значительно лучше.
По назначению МКЛ делят на оптические (их большинство), терапевтические и косметические.
По режиму ношения различают MKЛ дневного ношения (их носят в течение дня и на ночь снимают), гибкого ношения (пациент может иногда не снимать линзы 1–2 ночи), пролонгированного ношения (такие МКЛ можно носить, не снимая несколько дней) и непрерывного ношения (до 30 дней подряд).
Ионность материала и содержание в нем влаги (больше или меньше 50%) определяют комфортность ношения линзы и сроки ее замены. Очевидно, что линзы с высоким содержанием влаги комфортнее, но они менее прочные и больше склонны к накоплению отложений. Линзы с низким содержанием влаги прочнее и долговечнее, но менее физиологичны.
По частоте замены МКЛ делят на линзы однодневной замены (утром надел – вечером выбросил), линзы частой плановой замены (в течение 1 мес и чаще), планово–сменяемые линзы (замена через 1–6 мес) и традиционные линзы (замена через 6–12 мес). Линзы однодневной замены – самый "здоровый", но одновременно и наиболее дорогой вариант.
По оптическим свойствам контактные линзы могут быть сферическими (таких линз большинство, выпускают их варианты с любым сроком замены и режимом ношения), торическими (для коррекции астигматизма) и мультифокальными (для коррекции пресбиопии).
Показания и противопоказания к контактной коррекции зрения. Контактную коррекцию широко применяют при миопии. Известно, что пациенты с миопией высокой степени, особенно с анизометропией, плохо переносят полную очковую коррекцию, к тому же возникающие оптические аберрации не компенсируются очками. Контактные линзы хорошо переносятся при миопии практически любой степени и миопической анизометропии при любых различиях рефракции обоих глаз. Они способствуют восстановлению бинокулярного зрения, улучшают состояние аккомодационного аппарата глаза и обеспечивают высокую зрительную работоспособность, тогда как при ношении очков приходится довольствоваться лишь переносимой коррекцией (с разницей в оптической силе очковых линз не более 2,0 дптр).
Таким образом, миопия – это тот вид аметропии, при котором контактные линзы имеют абсолютные преимущества перед очками.
Относительными показаниями к контактной коррекции зрения можно считать гиперметропию и гиперметропическую анизометропию. Если минусовые очковые стекла уменьшают размер изображения на сетчатке, то плюсовые, наоборот, увеличивают, поэтому пациенты с гиперметропией хуже адаптируются к контактным линзам, которые, как известно, не изменяют размер изображения.
При астигматизме далеко не всегда удается достичь максимальной остроты зрения с помощью очковой коррекции. Контактные линзы удачно компенсируют корнеальные деформации. При использовании линз пациенты не предъявляют жалоб на астенопию. Торические МО и газопроницаемые ЖКЛ дают четкое высококонтрастное изображение.
Контактные линзы применяют также для коррекции афакии.
При кератоконусе средняя острота зрения больных при использовании контактных линз примерно в 2 раза выше, чем при очковой коррекции. К тому же у больных, которые носят контактные линзы, отмечается устойчивое бинокулярное зрение. Для коррекции зрения в начальных стадиях кератоконуса применяют газопроницаемые ЖКЛ. При выраженной деформации роговицы подбор контактных линз затруднен, а если и удается это сделать, то их переносимость снижена. В этом случае показана кератопластика.
Косметические маскирующие контактные линзы с успехом применяют при врожденных и посттравматических поражениях глаз. В случае колобом радужки или анирилии контактные линзы с окрашенной периферической зоной и прозрачным зрачком не только дают косметический эффект, но также уменьшают светорассеяние на сетчатке, устраняют светобоязнь и повышают остроту зрения.
Для коррекции пресбиопии применяют ЖКЛ, но в последние годы появились бифокальные и мультифокальные МКЛ.
Контактную коррекцию используют в лечении амблиопии. С этой целью назначают косметические контактные линзы с закрашенной (непрозрачной) зрачковой зоной или линзы высокой оптической силы для выключения лучше видящего глаза. При этом создаются условия для подключения амблиопичного глаза к зрительной работе.
Контактные линзы могут быть применены с лечебными целями при различных заболеваниях роговицы. Как показывает практика, МКЛ, насыщенные лекарственными препаратами, весьма эффективны в лечении заболеваний и травм глаз (при буллезной кератопатии, незаживающих язвах роговицы, синдроме сухого глаза для поддержания влажности роговицы, для реабилитации пациентов после кератопластики и ожогов глаза).
Однако имеются объективные медицинские противопоказания к контактной коррекции. Прежде всего это воспалительные заболевания переднего отрезка глаза. Ношение контактных линз обусловливает ухудшение состояния больных с паразитарными заболеваниями глаза (особенно при распространенном клещевом блефарите – демодекозе). С особой осторожностью следует назначать контактные линзы пациентам с сухостью глаза. В этом случае лучше применять высокогидрофильные МКЛ (с содержанием влаги больше 55%), а также использовать специальные увлажняющие капли при ношении линз.
Контактные линзы противопоказаны при непроходимости слезных путей и дакриоциститах.
При птеригиуме и пингвекуле подбор контактных линз затруднен из–за механических препятствий для их движения по роговице. В этих случаях рекомендуется предварительно выполнить хирургическое лечение.
Наконец, абсолютным общим противопоказанием к ношению контактных линз являются психические заболевания.
Основные принципы подбора контактных линз и их особенности. Основные критерии предпочтения ЖКЛ перед МКЛ – наличие выраженного астигматизма (боле 2,0 дптр), небольшая глазная щель, малый диаметр роговицы, непереносимость МКЛ. Следует подчеркнуть, что уход за ЖКЛ проще, они вызывают меньше осложнений, их можно использовать в течение более длительного периода времени.
Для выбора оптимальных параметров роговичных ЖКЛ необходимо определить общий диаметр линзы, диаметр оптической зоны, оптическую силу линзы и форму ее внутренней поверхности. При выборе общего диаметра ЖКЛ учитывают размеры глазной щели, положение и тонус век, степень выстояния глазного яблока, диаметр и форму роговицы. Общий диаметр ЖКЛ должен быть на 1,5–2 мм меньше горизонтального диаметра роговицы. Внутренняя поверхность роговичных ЖКЛ имеет три зоны: центральную, или оптическую, зону скольжения и краевую зону (рис. 5.12). Диаметр оптической зоны линзы должен быть больше ширины зрачка, определяемой при рассеянном свете, настолько, чтобы смещение линзы при моргании не приводило к заметному сдвигу оптической зоны линзы за пределы зрачка. Зона скольжения должна максимально соответствовать форме роговицы в этом месте и предназначена для удержания ЖКЛ на роговице за счет сил капиллярного притяжения. Чем меньше будет давление линзы на роговицу в зоне скольжения, тем выше переносимость линз. Форму края линзы определяют эмпирически. Она должна обеспечивать образование мениска слезной жидкости и не вызывать у пациента неприятных ощущений. Для удержания линзы на глазу за счет капиллярных сил зазор между линзой и роговицей должен быть достаточно малым, близким по толщине естественной слезной пленке.
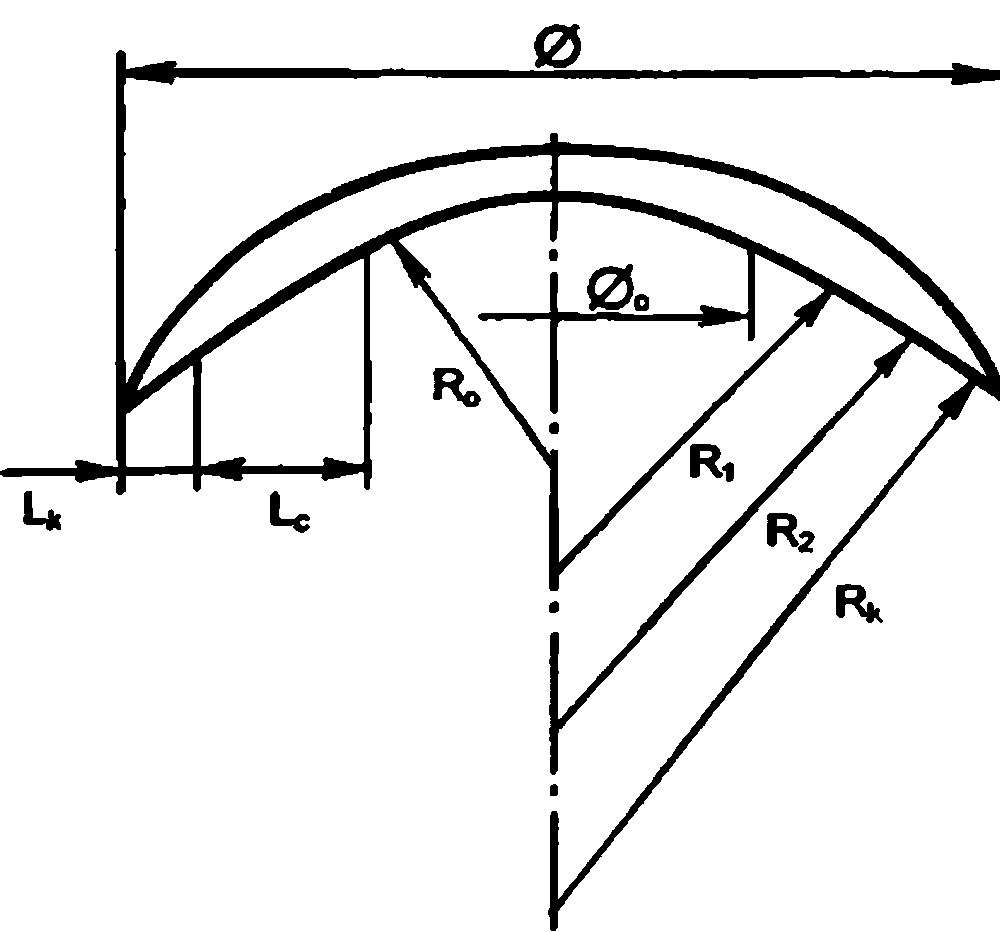 Рис. 5.12. Элементы конструкции внутренней поверхности жесткой роговичной контактной линзы.
0 – общий диаметр линзы; 0О – диаметр оптической зоны; R0 – радиус оптической зоны; R1 и R2 – радиусы зоны скольжения; Rk – радиус краевой зоны; Lk – ширина краевой зоны; LC – ширина зоны скольжения.
Рис. 5.12. Элементы конструкции внутренней поверхности жесткой роговичной контактной линзы.
0 – общий диаметр линзы; 0О – диаметр оптической зоны; R0 – радиус оптической зоны; R1 и R2 – радиусы зоны скольжения; Rk – радиус краевой зоны; Lk – ширина краевой зоны; LC – ширина зоны скольжения.
Оптическую силу контактной линзы определяют по результатам исследования клинической рефракции глаза: она равна сферическому компоненту рефракции + ½ величины цилиндрического компонента. Окончательно оптическую силу линзы устанавливают с помощью пробной линзы, оптическая сила которой наиболее близка к величине клинической рефракции. К пробной линзе приставляются разные очковые стекла из набора, чтобы получить максимальную остроту зрения. При коррекции миопии выбирают очковое стекло минимальной диоптрийной силы для получения наибольшей остроты зрения, а при коррекции гиперметропии и афакии – стекло максимальной диоптрийной силы.
Для вычисления рефракции контактной линзы к оптической силе пробной линзы прибавляют оптическую силу того очкового стекла, с которым у пациента наблюдалась максимальная острота зрения. Успех подбора контактных линз зависит от следующих факторов: соответствия внутренней поверхности линзы форме роговицы, центрации линзы и ее подвижности.
При подборе ЖКЛ стремятся к максимальному соответствию внутренней поверхности линзы форме роговицы с учетом сохранения определенной толщины слоя слезной жидкости между линзой и роговицей в различных зонах. Слезную жидкость подкрашивают 0,5% раствором флюоресцеина и с помощью щелевой лампы в свете синего светофильтра оценивают распределение флюоресцеина под пробной линзой и определяют необходимость внесения изменений в конструкцию индивидуально изготавливаемой линзы.
Чрезвычайно важным является исследование чувствительности роговицы, состояния слезных органов, продукции слезной жидкости, времени разрыва слезной пленки. Затем определяют размер глазной щели, тургор век и диаметр зрачка.
После обычного офтальмологического исследования приступают к выбору формы линзы и ее оптической силы. С помощью офтальмометра определяют радиус кривизны роговицы в главных меридианах и решают вопрос о выборе типа линзы.
Под местной анестезией (0,5% раствор дикаина) на глаз надевают ЖКЛ из пробного набора линз, оптическая сила которой и конструктивные параметры (общий диаметр, диаметр оптической зоны и форма внутренней поверхности) в наибольшей степени соответствуют параметрам корригируемого глаза. Оценивают положение линзы на глазу, ее подвижность, распределение флюоресцеина под линзой. Если конструкция выбранной из пробного набора линзы является оптимальной, изготавливают индивидуальную ЖКЛ.
Для окончательного подтверждения правильности подбора газопроницаемых ЖКЛ необходимо наблюдать за пациентом в течение 2–3 дней, ежедневно постепенно увеличивая время ношения линзы. В период адаптации возможна доработка линзы. По окончании испытательного периода изготовленную линзу выдают пациенту, проинструктировав его о правилах пользования и режиме ношения.
Сферические МКЛ благодаря своей эластичности эффективны только при отсутствии значительных изменений формы роговицы, поскольку в большей степени повторяют ее неправильную форму (например, при астигматизме свыше 2,0 дптр). Подбор МКЛ достаточно прост и основан на результатах офтальмометрии. Существуют специальные таблицы соответствия радиусов и рефракций роговицы, оптической силы очковых линз и МКЛ. Толщину МКЛ выбирают с учетом индивидуальных особенностей глаза. При умеренном астигматизме или сниженной продукции слезной жидкости назначают более толстые МКЛ (тонкие высокогидрофильные МО быстрее обезвоживаются и не корригируют астигматизм). После первичного подбора МКЛ оценивают положение линзы на глазу, ее подвижность и субъективные ощущения пациента.
Правильность положения линзы можно проверить с помощью "теста смещения", когда линзу сдвигают по роговице на ⅓–½ ее диаметра: при хорошей посадке линза должна медленно возвращаться в центральное положение.
Рекомендуемая продолжительность ношения МКЛ на период адаптации: в первые 3 дня – по 1–2 ч в день, в последующие 3 дня – до 3 ч вдень, со 2–й недели – в течение 4 дней по 4 ч в день, затем 3 дня по 5 ч в день, с 3–й недели ежедневно увеличивают время ношения МКЛ на 1 ч, доводя его до 12 ч в день.
Уход за контактными линзами. Уход за газопроницаемыми ЖКЛ относительно несложен. Их следует хранить в специальных контейнерах в водной среде. Поскольку многие линзы содержат силикон, для их обработки приходится применять специальные растворы, содержащие чистящие, дезинфицирующие и смазывающие вещества.
МКЛ, помимо дезинфекции, требуют специальных методов хранения и очистки от отложений. В настоящее время с этой целью используют перекисные системы и многофункциональные растворы.
Перекисные системы эффективны при очистке и дезинфекции линз, но необходимым условием их применения является нейтрализация действия перекиси. С этой целью используют раствор тиосульфата натрия.
Многофункциональные растворы решают сразу несколько задач: они очищают линзу от отложений, дезинфицируют и увлажняют ее, используются для хранения линзы. Современные многофункциональные растворы практически нетоксичны и не вызывают аллергии.
Общие принципы ухода за МКЛ примерно одинаковы: на ночь линзу помещают в контейнер с многофункциональным раствором, утром ее промывают, после чего она готова к использованию.
Проблем и неудобств, связанных с уходом за МКЛ, не возникает при использовании линз двух новых классов – однодневных и непрерывного (до 30 сут) ношения. Правда, и первые, и вторые весьма дороги, поэтому однодневные линзы часто назначают для периодического ношения (во время занятий спортом, командировок и т. п.). Линзы непрерывного ношения в неосложненных случаях действительно не требуют ухода. Добавим лишь, что это самый новый класс МКЛ и пока не накоплено достаточно клинических данных, которые бы подтверждали их полную безопасность.
Возможные осложнения при использовании контактных линз. Осложнения могут быть связаны с механическим повреждением роговицы, токсико–аллергическими реакциями, инфицированием. Основные причины развития осложнений – нарушение пациентом режима ношения линз и правил ухода за ними. Сами полимеры, из которых изготовлены линзы, нетоксичны и практически не вызывают аллергии. Аллергические реакции глаза при использовании контактных линз чаще вызываются компонентами, входящими в состав средств ухода за линзами. Недостаточно очищенная линза со следами белковых отложений также может стать источником токсико–аллергических осложнений.
Чаще других наблюдаются конъюнктивит, поверхностный кератит, стерильные инфильтраты в строме роговицы, точечные дефекты эпителия роговицы.
Большинство осложнений легко купируется. В некоторых случаях достаточно на время прекратить пользоваться линзами.
В случае длительного ношения линз возможны развитие изменений в заднем эпителии роговицы – клеточный полиморфизм, образование микрокист. При биомикроскопическом исследовании иногда выявляют неоваскуляризацию роговицы. Это свидетельствует о хронической гипоксии роговицы. В этих случаях следует рекомендовать пациенту временно отказаться от линз или использовать другой их тип.
Тяжелее последствия бактериальных и вирусных кератитов и кератоконъюнктивитов. Развитие тяжелых осложнений обычно связано с поздним обращением пациента к врачу.
Хирургическая коррекция аметропий
Изменяя оптическую силу двух главных оптических элементов глаза – роговицы и хрусталика, можно формировать клиническую рефракцию глаза и корригировать таким образом близорукость, дальнозоркость, астигматизм.Хирургическая коррекция аномалий рефракции глаза получила название "рефракционная хирургия".
В зависимости от локализации зоны оперативного вмешательства выделяют корнеальную, или роговичную, и хрусталиковую хирургию.
Роговица – наиболее доступная для воздействия биологическая линза в оптической системе глаза. При уменьшении или увеличении ее рефракции значительно изменяется рефракция глаза в целом. Кроме того, роговица – удобная для выполнения оперативного вмешательства структура глаза. Здоровая роговица не имеет сосудов, быстро эпителизируется, сохраняя прозрачность. Рефракционная хирургия роговицы не требует вскрытия глазного яблока и позволяет точно дозировать рефракционный эффект.
Первые рефракционные операции на прозрачной роговице провел колумбийский офтальмолог X. Барракер в 1949 г. В последние годы наблюдается стремительное увеличение количества выполняемых операций: ежегодно в мире проводят до 1,5 млн операций.
Цель операции при близорукости – "ослабить" слишком сильную преломляющую силу глаза, фокусирующего изображение перед сетчаткой. Этого достигают путем ослабления рефракции роговицы в центре с 40,0–43,0 до 32,0–40,0 дптр в зависимости от степени близорукости. Параметры операции (ее план) рассчитывают по специальным компьютерным программам. В компьютер вводят измеренные перед операцией анатомо–оптические параметры глаза и данные его рефракции. Эффективность рефракционной хирургии в значительной мере зависит от точности измерения анатомо–оптических параметров глаза, компьютерных расчетов плана операции и выполнения его хирургом, соблюдения всех требований рефракционной хирургии.
С целью коррекции близорукости применяют: ■ переднюю радиальную кератотомию ■ миопический кератомилез ■ введение внутрироговичных колец и линз.
Переднюю радиальную кератотомию, разработанную С. Н. Федоровым в 1974 г., используют для коррекции близорукости 0,5–6,0 дптр. Техника операции состоит в нанесении непроникающих глубоких (на 90% толщины) радиальных надрезов роговицы на периферии с помощью дозированного алмазного ножа (рис. 5.13). Ослабленная надрезами периферическая часть роговицы выбухает под действием внутриглазного давления, а центральный отдел уплощается (рис. 5.14).
Диаметр центральной оптической зоны роговицы, которая остается без надрезов (3,2–4 мм), количество надрезов (4–12) и их глубину выбирает хирург с помощью компьютерной программы в зависимости от параметров глаза и возраста пациента.
Для коррекции миопического астигматизма разработаны специальные операции, позволяющие уменьшить рефракцию роговицы до 4,0 дптр по меридиану, соответствующему оси астигматизма, с помощью дозированных надрезов, нанесенных перпендикулярно или параллельно сильно преломляющей оси, – тангенциальная (рис. 5.15) или продольная (рис. 5.16) кератотомия.
Методика выполнения миопического кератомилеза, разработанная X. Барракером в 1964 г., в настоящее время значительно изменилась. Специальные микрокератомы позволяют сделать точный срез поверхностных слоев роговицы на глубину 130–150 мк (при ее толщине 550 мк) и сформировать "крышечку”. После выполнения второго, более глубокого, среза иссеченные внутренние слои удаляют, а "крышечку" укладывают на место. Толщиной удаленной стромы роговицы "дозируют" степень уплощения центра роговицы и эффект операции. Миопический кератомилез применяют при близорукости свыше 6,0 дптр.
В настоящее время механическое иссечение стромы роговицы заменено на испарение ее с помощью эксимерного лазера, и такая операция носит название "Лазик".
Введение в периферические слои роговицы пластиковых колец и внутрироговичных линз малоэффективно, поэтому этот метод не получил широкого распространения в клинической практике.
Цель роговичной рефракционной хирургии дальнозоркости – "усилить" слабый оптический аппарат глаза, фокусирующий изображение за сетчаткой. Для достижения этой цели производят разработанную в 1981 г. С. Н. Федоровым операцию – термокератокоагуляцию роговицы.
 Рис. 5.15. Тангенциальная кератотомия.
а – обозначен сильно преломляющий меридиан, перпендикулярно к нему алмазным ножом проводят два тангенциальных надреза; б – уплощение роговицы (ослабление рефракции) в меридиане надрезов; в – состояние роговицы через 2 года после операции; острота зрения 1,0 без коррекции.
Рис. 5.15. Тангенциальная кератотомия.
а – обозначен сильно преломляющий меридиан, перпендикулярно к нему алмазным ножом проводят два тангенциальных надреза; б – уплощение роговицы (ослабление рефракции) в меридиане надрезов; в – состояние роговицы через 2 года после операции; острота зрения 1,0 без коррекции.
При дальнозоркости необходимо увеличить преломляющую силу роговицы с 40,0–43,0 до 42,0–50,0 дптр в зависимости от степени гиперметропии. Этого достигают путем воздействия на периферическую часть роговицы инфракрасной (тепловой) энергии, под действием которой коллаген стромы роговицы сжигается, кольцо периферической части роговицы сокращается, а центральная оптическая зона "выбухает", при этом рефракция роговицы усиливается (рис. 5.17). .
Термическое воздействие осуществляют с помощью специальной тонкой иглы (электрода), которая автоматически выдвигается на заданную глубину и в момент укола роговицы нагревается до 700–1.000°С, поэтому сокращение ткани происходит по всей толщине роговицы. Количество уколов и схему их расположения рассчитывают по специальной компьютерной программе в зависимости от параметров глаза пациента. Операция позволяет исправить дальнозоркость от 0,75–5,0 дптр и дальнозоркий астигматизм (при воздействии на один из главных меридианов астигматического глаза) до 4,0 дптр.
В настоящее время благодаря применению твердотельного лазера тепловая энергия заменена на лазерную, в результате чего снизилась травматичность операции.
Хрусталиковая рефракционая хирургия включает несколько методов воздействия на рефракцию глаза: ■ удаление прозрачного хрусталика – рефракционая ленсэктомия с введением искусственного хрусталика или без него ■ введение в глаз дополнительной отрицательной или положительной интраокулярной линзы.
Удаление прозрачного хрусталика с целью коррекции близорукости предложил Фукала еще в 1890 г., но она не получила распространения из–за тяжелых осложнений. В настоящее время благодаря применению современной микрохирургической техники риск развития осложнений снижен, но метод может быть использован при близорукости не выше 20,0 дптр.
С целью коррекции дальнозоркости высокой степени выполняют операцию замены прозрачного хрусталика на более сильную интраокулярную линзу в 30–48 дптр в зависимости от анатомических и оптических параметров глаза.
В настоящее время для коррекции аметропий высоких степеней используют методику введения в глаз дополнительной корригирующей линзы – "очки внутри глаза". Супертонкую эластичную линзу вводят в заднюю камеру глаза через минимальный разрез и помещают перед прозрачным хрусталиком, поэтому ее называют интраокулярной контактной линзой. Отрицательная интраокулярная линза позволяет корригировать близорукость до –20,0–25,0 дптр, положительная линза – дальнозоркость до +12,0–15,0 дптр.
 Рис. 5.17. Термокератокоагуляция. а – после термокератокоагуляции изменяется радиус кривизны роговицы, увеличивается ее оптическая сила (пунктирные линии); б – термическое воздействие: наносят по три точки на периферических концах радиусов, центральная зона диаметром 7 мм остается свободной; в – следы термического воздействия через 6 мес после операции.
Рис. 5.17. Термокератокоагуляция. а – после термокератокоагуляции изменяется радиус кривизны роговицы, увеличивается ее оптическая сила (пунктирные линии); б – термическое воздействие: наносят по три точки на периферических концах радиусов, центральная зона диаметром 7 мм остается свободной; в – следы термического воздействия через 6 мес после операции.
Современные методы рефракционной хирургии глаза весьма эффективны, обеспечивают качественное стабильное зрение и с успехом заменяют очки и контактные линзы.
Эксимерлазерная коррекция аномалий рефракции
Под воздействием излучения эксимерного лазера из собственного вещества роговицы формируется линза заданной оптической силы.S. Trokel и соавт. (1983) доказали возможность дозированного испарения роговицы с микронной точностью с помощью эксимерного лазера.
Приоритет в проведении эксимер–лазерных операций с целью коррекции аномалий рефракции в России принадлежит офтальмологической школе академика Святослава Федорова (1984), а за рубежом – Т. Seiler (Германия, 1985) и L’Esperance (США, 1987).
Лазерное излучение с длиной волны 193 нм разрывает межатомные и межмолекулярные связи в поверхностных слоях роговицы с точностью до десятых долей микрона. Клинически этот феномен проявляется в послойном испарении роговицы – фотоабляции (рис. 5.18).
Операции выполняют по индивидуальным программам, создаваемым на основе сложных математических расчетов. Построение и реализацию программы изменения рефракции роговицы осуществляют с помощью компьютера. Операция не оказывает негативного воздействия на другие структуры глаза – хрусталик, стекловидное тело, сетчатку.
 Рис. 5.18. Высокоскоростная фотография фотоабляции роговицы.
Рис. 5.18. Высокоскоростная фотография фотоабляции роговицы.
В состав каждой офтальмологической эксимерлазерной установки входят эксимерный лазер (источник ультрафиолетового излучения), формирующая оптическая система, цель которой – преобразовать структуру лазерного пучка и доставить его наповерхность роговицы; управляющий компьютер, операционный микроскоп, кресло хирурга и операционный стол для пациента.
В зависимости от типа формирующей системы, определяющей возможности и особенности технологии испарения роговицы, все установки делят на гомогенные (диафрагмирующие и масочные), сканирующие, полусканирующие и пространственные. Так, при использовании принципа лазерного диафрагмирования излучение попадает широким пучком на диафрагму или систему диафрагм, постепенно раскрывающихся или закрывающихся с каждым новым импульсом. При этом в центре роговицы испаряется более толстый слой ткани, чем по ее краям, в результате чего она становится менее выпуклой и рефракция уменьшается. В других установках излучение попадает на роговицу через специальную маску неравномерной толщины. Через более тонкий слой в центре испарение происходит быстрее, чем на периферии.
В сканирующих системах поверхность роговицы обрабатывают лазерным пучком небольшого диаметра – технология "летающего пятна", причем луч движется по такой траектории, чтобы на поверхности роговицы сформировалась линза заданной оптической силы.
К лазерам пространственного типа относится система "Профиль" (рис. 5.19), разработанная С. Н. Федоровым. Основная идея пространственного распределения лазерной энергии в системе "Профиль–500" заключается в том, что излучение попадает на роговицу широким пучком с гауссовым, т. е. параболическим, профилем распределения лазерной энергии. Вследствие этого за одну и ту же единицу времени в местах, на которые воздействовала энергия большей плотности, ткани испаряются на большую глубину, а в местах, где плотность энергии меньше, – на меньшую.
Основными рефракционными эксимерлазерными операциями являются фоторефроктивная кератэктомия (ФРК) и лазерный интрастромальный кератомилез ("Лазик").
Показаниями к выполнению рефракционных эксимерлазерных операций являются в первую очередь непереносимость контактной и очковой коррекции, близорукость, гиперметропия и астигматизм различной степени выраженности, а также профессиональные и социальные потребности пациентов не моложе 18 лет.
Противопоказаниями к проведению ФРК служат глаукома, состояния сетчатки, предшествующие отслойке, или отслойка, хронические увеиты, опухоли глаз, кератоконус, снижение чувствительности роговицы, синдром "сухого глаза", диабетическая ретинопатия, эктопия зрачка, выраженный аллергический статус, аутоиммунная патология и коллагенозы, тяжелые соматические и психические заболевания. При наличии катаракты выполнение ФРК нецелесообразно, так как сразу после экстракции катаракты рефракцию глаза можно откорригировать с помощью искусственного хрусталика.
ФРК проводят амбулаторно под местной анестезией. Техника выполнения операции на зарубежных установках включает два этапа: удаление эпителия и испарение стромы роговицы. На первом этапе выполняют скарификацию эпителия в центральной зоне роговицы механическим, химическим или лазерным способом. Продолжительность этого этапа операции зависит от типа лазера и может колебаться от 20 с до нескольких минут, после чего осуществляют испарение стромы роговицы.
В течение 1–х суток могут отмечаться болевой синдром, слезотечение, светобоязнь. С 1–го дня после операции пациенту назначают истилляции раствора антибиотика до полной эпителизации роговицы (48–72 ч). Затем проводят курс терапии кортикостероидами по схеме длительностью 1–2 мес. С целью профилактики стероидной гипертензии одновременно применяют β–блокаторы 1–2 раза вдень.
Описанная технология позволяет эффективно и безопасно корригировать близорукость до 6,0 дптр и астигматизм до 2,5–3,0 дптр. Технология выполнения ФРК с трансэпителиальным подходом (без предварительной скарификации эпителия) на отечественной установке "Профиль–500" позволяет одномоментно, без каких–либо дополнительных вмешательств корригировать близорукость до 16,0 дптр в сочетании со сложным миопическим астигматизмом до 5,0 дптр.
Больным с гиперметропией и гиперметропическим астигматизмом ФРК проводят реже, что объясняется необходимостью деэпителизации большой зоны роговицы и соответственно ее длительным заживлением (до 7–10 дней). При гиперметропии больше 4,0 дптр обычно выполняют операцию "Лазик".
Изменение рефракции зависит от толщины испаренной роговицы. Остаточная толщина роговицы в зоне истончения не должна быть меньше 250–300 мкм, чтобы не допустить послеоперационной деформации роговицы. Следовательно, предел возможностей метода определяется исходной толщиной роговицы.
К ранним послеоперационным осложнениям ФРК относят длительно (более 7 сут) не заживающую эрозию роговицы; послеоперационные кератиты (дистрофический, инфекционный); выраженную эпителиопатию, сопровождающуюся отеком и рецидивирующими эрозиями; грубые субэпителиальные помутнения в пределах всей зоны испарения роговицы.
Осложнения позднего послеоперационного периода включают субэпителиальные помутнения роговицы; гиперкоррекцию; миопизацию; неправильный астигматизм; синдром "сухого глаза”.
Формирование субэпителиальных помутнений обычно связано с большим объемом испарения роговицы при высоких степенях корригируемых аномалий рефракции. Как правило, благодаря проведению рассасывающей терапии удается добиться полного исчезновения или значительной регрессии помутнений. В случаях развития стойких необратимых помутнений роговицы может быть выполнена повторная ФРК.
Операция "Пазик" представляет собой комбинацию хирургического и лазерного воздействия. Она состоит из трех этапов: формирование микрокератомом поверхностного роговичного лоскута (клапана) на ножке; испарение лазером глубоких слоев роговицы под лоскутом; укладывание клапана на прежнее место (рис. 5.20).
Слабовыраженные болевые ощущения ("соринка" в глазу) отмечаются, как правило, в первые 3–4 ч после операции. Слезотечение обычно прекращается через 1,5––2 ч. Медикаментозная терапия сводится к проведению инстилляций антибиотиков и стероидов в течение 14 дней после вмешательства.
В случаях коррекции миопии путем выполнения операции "Лазик" максимальный рефракционный эффект определяется анатомическими особенностями роговицы пациента. Так, учитывая, что толщина клапана, как правило, равна 150––160 мкм, а остаточная толщина роговицы в центре после лазерной аблации не должна быть меньше 250–270 мкм, максимально возможная коррекция близорукости при операции "Лазик" в среднем не превышает 15,0–17,0 дптр.
"Лазик" считается операцией с Достаточно высоко предсказуемыми результатами при близорукости слабой и средней степени. Более чем в 80% случаев послеоперационный рефракционный результат находится в пределах 0,5 дптр от запланированного. Острота зрения 1,0 отмечается в среднем у 50% пациентов с миопией до 6,0 дптр, а острота зрения 0,5 и выше – у 90%. Стабилизация рефракционного результата, как правило, наступает через 3 мес после операции "Лазик”. При высоких степенях близорукости (более 10,0 дптр) в 10% случаев возникает необходимость в повторных операциях с целью до коррекции остаточной близорукости, которые обычно выполняют в сроки от 3 до 6 мес. При повторной операции роговичный клапан поднимают без проведения повторного среза микрокератомом.
При коррекции гиперметропии рефракционный результат в пределах 0,5 дптр от запланированного удается получить только у 60% больных. Остроты зрения 1,0 удается достичь лишь у 35–37% больных, острота зрения 0,5 и выше отмечается у 80%. Достигнутый эффект у 75% больных остается неизменным. Частота развития осложнений при выполнении операции "Лазик" колеблется в пределах от 1 до 5%, причем наиболее часто осложнения возникают на этапе формирования клапана роговицы.
Совершенно очевидно, что технический прогресс в ближайшем будущем приведет к появлению и широкому клиническому использованию в медицине, в частности офтальмологии, лазеров нового поколения, которые позволят бесконтактно и без вскрытия глазного яблока проводить рефракционные операции. Лазерная энергия, сфокусированная в одной точке, может разрушать межмолекулярные связи и испарять ткань роговицы на заданной глубине. Так, использование фемтосекундных систем уже в настоящее время дает возможность корректировать форму роговицы, не нарушая ее поверхности.
Эксимерлазерная рефракционная хирургия – одно из наиболее динамично развивающихся высокотехнологичных направлений в офтальмологии.
Глава 6. Методы исследования органа зрения
Пытливый взгляд нередко видел больше, чем видеть он желал.Важные сведения врач–офтальмолог получает, наблюдая за пациентом при его первом появлении в кабинете. В этот момент можно составить представление о зрительных функциях пациента, особенностях его телосложения и поведения. Необходимо отметить направление взгляда пациента, положение головы, особенности его передвижения в пространстве. Очень осторожно и неуверенно двигается человек, ослепший недавно, а пациент, утративший зрение в молодом возрасте, ориентируется в пространстве значительно увереннее и смелее.Г. Э. Лессинг
При светобоязни пациент отворачивается от яркого света, а при поражении световоспринимающего аппарата (сетчатка, зрительный нерв) вынужден держать глаза широко открытыми и искать взглядом источник света.
Указанные сведения, подкрепленные результатами грамотно проведенного внешнего и общего осмотра пациента, изучения жалоб и анамнеза, позволяют врачу–офтальмологу установить правильный диагноз.
Внешний (общий) осмотр. Изучение жалоб и анамнеза
При внешнем (общем) осмотре пациента отмечают особенности, которые прямо или косвенно связаны с изменениями органа зрения. Так, наличие на лице рубцов, образовавшихся после травм или операций, особенно в области век, наружного и внутреннего углов глазной щели, может свидетельствовать о произошедшем ранее повреждении глазного яблока.Наличие на коже лба и височной области пузырьковых высыпаний в сочетании с блефароспазмом чаще всего указывает на герпетическое поражение глазного яблока. Такое же сочетание может наблюдаться и при розацеакератите, при котором, кроме сильных болей, раздражения глазного яблока и поражения роговицы, отмечается поражение кожи лица – розовые угри.
Для того чтобы установить правильный диагноз, при общем осмотре важно также определить характерные внешние изменения в других областях, сочетающиеся с патологией органа зрения, такие, например, как асимметрия лица (при невралгии тройничного нерва в сочетании с нейропаралитическим кератитом), необычные пропорции тела (брахидактилия), башенный (оксицефалия) или ладьеобразный (скафоцефалия) череп, пучеглазие (тиреотоксикоз). После завершения этого этапа обследования переходят к выяснению жалоб пациента и сбору анамнеза.
Анализ жалоб пациента позволяет установить характер заболевания: возникло ли оно остро или развивалось постепенно. При этом среди жалоб, свойственных многим общим заболеваниям организма, важно выделить жалобы, свойственные только глазным заболеваниям.
Некоторые жалобы настолько характерны для того или иного заболевания глаз, что на их основании уже можно установить предположительный диагноз. Так, например, ощущение соринки, песка или инородного тела в глазу и тяжесть век указывают на патологию роговицы или хронический конъюнктивит, а склеивание век по утрам в сочетании с обильным отделяемым из конъюнктивальной полости и покраснением глаза без заметного снижения остроты зрения свидетельствует о наличии острого конъюнктивита, покраснение и зуд в области краев век – о наличии блефарита. При этом на основании некоторых жалоб легко определить локализацию процесса. Так, светобоязнь, блефароспазм и обильное слезотечение характерны для повреждений и заболеваний роговицы, а внезапно и безболезненно наступившая слепота – для повреждений и заболеваний световоспринимающего аппарата. Однако в подобных случаях жалоба сама по себе еще не позволяет определить характер заболевания, это только начальный ориентир.
Некоторые жалобы, например на затуманивание зрения, предъявляют больные с катарактой, глаукомой, заболеваниями сетчатки и зрительного нерва, гипертонической болезнью, диабетом, с новообразованиями головного мозга и т. д. При этом лишь целенаправленный расспрос (выяснение анамнеза и жалоб) позволяет врачу установить правильный диагноз. Так, постепенное снижение или потеря зрения характерны для медленно развивающихся патологических процессов (катаракта, открытоугольная глаукома, хориоретинит, атрофия зрительного нерва, аномалии рефракции), а внезапная утрата зрительных функций связана с расстройством кровообращения в сетчатке (спазм, эмболия, тромбоз, кровоизлияние), острыми воспалительными процессами (невриты зрительного нерва, центральные хориоидиты и хориоретиниты), тяжелыми травмами, отслойкой сетчатки и др. Резкое снижение остроты зрения с сильными болями в глазном яблоке характерно для острого приступа глаукомы или острого иридоциклита.
Сбор анамнеза целесообразно проводить поэтапно. Первоначально необходимо обратить внимание на начало заболевания, расспросить пациента о предполагаемой им причине возникновения и динамике заболевания, проведенном лечении и его эффективности. Нужно выяснить характер заболевания: внезапно начавшееся, острое или медленно развивающееся, хроническое, возникшее под воздействием неблагоприятных внешних факторов. Так, например, острый приступ глаукомы может возникнуть на фоне эмоциональной перегрузки, длительного пребывания в темной комнате, переутомления или переохлаждения. Хронические заболевания сосудистого тракта (ириты, иридоциклиты, хориоретиниты) могут быть связаны с переохлаждением и ослаблением иммунитета. Воспалительные инфильтраты и гнойные язвы роговицы возникают на фоне предшествующих травматических повреждений, переохлаждения, после перенесенных общих инфекционных заболеваний.
Если предполагается врожденная или наследственная патология, то выясняют семейный анамнез, это касается зонулярной катаракты, гидрофтальма, сифилитического кератита или, например, семейной атрофии зрительного нерва, семейной амавротической идиотии.
Необходимо расспросить пациента об условиях его труда и быта, так как некоторые заболевания органа зрения могут быть связаны с воздействием профессиональных вредностей: бруцеллез у работников сельского хозяйства, прогрессирующая миопия у пациентов, имеющих постоянную зрительную нагрузку при неблагоприятных условиях труда, электроофтальмия у электросварщиков и т. д.
Наружный осмотр глаза и его придатков
Наружный осмотр проводят при хорошем дневном или искусственном освещении и начинают с оценки формы головы, лица, состояния вспомогательных органов глаза. Прежде всего оценивают состояние глазной щели: она может быть сужена при светобоязни, сомкнута отечными веками, значительно расширена, укорочена в горизонтальном направлении (блефарофимоз), полностью не смыкаться (лагофтальм), иметь неправильную форму (выворот или заворот века, дакриоаденит), закрыта на участках сращения краев век (анкилоблефарон). Затем оценивают состояние век, при этом могут быть выявлены частичное или полное опущение верхнего века (птоз), дефект (колобома) свободного края века, рост ресниц в сторону глазного яблока (трихиаз), наличие вертикальной кожной складки у угла века (эпикантус), заворот или выворот ресничного края. При осмотре конъюнктивы могут определяться резкая гиперемия без геморрагий (бактериальные конъюнктивиты), гиперемия с геморрагиями и обильным отделяемым (вирусные конъюнктивиты). У больных с патологией слезных органов можно отметить слезостояние. При воспалении слезного мешка или канальцев обнаруживают слизистое, слизисто–гнойное или гнойное отделяемое, появление гнойных выделений из слезных точек при надавливании на область слезного мешка (дакриоцистит). Воспалительная припухлость наружной части верхнего века и S–образное искривление глазной щели свидетельствуют о дакриоадените. Далее оценивают состояние глазного яблока в целом: его отсутствие (анофтальм), западение (энофтальм), выстояние из глазницы (экзофтальм), отклонение в сторону от точки фиксации (косоглазие), увеличение (буфтальм) или уменьшение (микрофтальм), покраснение (воспалительные заболевания или офтальмогипертензия), желтоватая (гепатит) или голубоватая (синдром Ван–дер–Хуве либо синдром голубых склер) окраска, а также состояние орбиты: деформация костных стенок (последствия травмы), наличие припухлости и дополнительной ткани (опухоль, киста, гематома).Следует учитывать, что заболевания органа зрения характеризуются многообразием и своеобразием клинических проявлений. Для их распознавания необходим внимательный осмотр как здорового, так и больного глаза. Исследование проводят в определенной последовательности: вначале оценивают состояние вспомогательных органов глаза, затем осматривают его передний и задний отделы. При этом всегда начинают с осмотра и инструментального исследования здорового глаза.
Исследование орбиты и окружающих ее тканей начинают с осмотра. В первую очередь осматривают окружающие глазницу части лица. Особое внимание обращают на положение и подвижность глазного яблока, изменение которых может служить косвенным признаком патологического процесса в орбите (опухоль, киста, гематома, травматическая деформация).
При определении положения глазного яблока в орбите оценивают следующие факторы: степень его выстояния или западения (экзофтальмометрия), отклонение от средней линии (страбометрия), величину и легкость смещения в полость глазницы под воздействием дозированного давления (орбитотонометрия).
Экзофтальмометрия – оценка степени выстояния (западения) глазного яблока из костного кольца орбиты. Исследование проводят с помощью зеркального экзофтальмометра Гертеля (рис. 6.1), который представляет собой градуированную в миллиметрах горизонтальную пластинку, с каждой стороны которой имеется по 2 перекрещивающихся под углом 45° зеркала. Прибор плотно приставляют к наружным дугам обеих орбит. При этом в нижнем зеркале видна вершина роговицы, а в верхнем – цифра, указывающая расстояние, на которое изображение вершины роговицы отстоит от точки приложения. Обязательно учитывают исходный базис – расстояние между наружными краями орбиты, при котором производилось измерение, что необходимо для проведения экзофтальмометрии в динамике. В норме выстояние глазного яблока из глазницы составляет 14–19 мм, а асимметрия в положении парных глаз не должна превышать 1–2 мм.
 Рис. 6.1. Экзофтальмометрия.
Рис. 6.1. Экзофтальмометрия.
Необходимые замеры выстояния глазного яблока могут быть проведены и с помощью обычной миллиметровой линейки, которую приставляют строго перпендикулярно к наружному краю глазницы, при этом голова пациента повернута в профиль. Величину выстояния определяют по делению, которое находится на уровне вершины роговицы.
Орбитотонометрия – определение степени смещаемости глазного яблока в орбите или сжимаемости ретробульбарных тканей. Метод позволяет дифференцировать опухолевый и неопухолевый экзофтальм. Исследование проводят с помощью специального прибора – пьезометра, который состоит из перекладины с двумя упорами (для наружного угла орбиты и спинки носа), и собственно динамометра с набором сменных грузиков, устанавливаемого на глаз, покрытый контактной роговичной линзой (рис. 6.2). Орбитотонометрию выполняют в положении лежа после предварительной капельной анестезии глазного яблока раствором дикаина. Установив и зафиксировав прибор, приступают к измерению, последовательно увеличивая давление на глазное яблоко (50, 100, 150, 200 и 250 г). Величину смещения глазного яблока (в миллиметрах) определяют по формуле:
Vn=E0–En
где Vn – смещение глазного яблока при репонирующем усилии n; Е0 – исходное положение глазного яблока; Еn–положение глазного яблока после приложения репонирующего усилия n.
 Рис. 6.2. Орбитотонометрия. Объяснение в тексте.
Рис. 6.2. Орбитотонометрия. Объяснение в тексте.


 Рис. 6.3. Этапы выворота верхнего века. Объяснение в тексте.
Рис. 6.3. Этапы выворота верхнего века. Объяснение в тексте.
Нормальное глазное яблоко при увеличении давления на каждые 50 г репонирует приблизительно на 1,2 мм. При давлении 250 г оно смещается на 5–7 мм.
Страбометрия – измерение угла отклонения косящего глаза. Исследование проводят с использованием различных методов, как ориентировочных – по Гиршбергу и Лоуренсу, так и достаточно точных – по Головину (см. раздел "Глазодвигательный аппарат").
Исследование век проводят посредством обычного осмотра и пальпации, при этом обращают внимание на их форму, положение и направление роста ресниц, состояние ресничного края, кожи и хряща, подвижность век и ширину глазной щели. Ширина глазной щели в среднем равна 12 мм. Ее изменение может быть связано с разной величиной глазного яблока и его смещением вперед или назад, с опущением верхнего века.
Исследование соединительной оболочки (конъюнктивы). Конъюнктива, выстилающая нижнее веко, легко выворачивается при его оттягивании вниз. При этом пациент должен смотреть вверх. Попеременно оттягивают внутренний и наружный края, осматривают конъюнктиву века и нижнюю переходную складку.
Для выворачивания верхнего века требуется определенный навык. Его выворачивают пальцами рук, а для осмотра верхней переходной складки применяют стеклянную палочку или векоподъемник. При взгляде пациента вниз большим пальцем левой руки приподнимают верхнее веко. Большим и указательным пальцами правой руки захватывают ресничный край верхнего века, оттягивают его книзу и кпереди. При этом под кожей века очерчивается верхний край хряшевидной пластинки, на который надавливают большим пальцем левой руки или стеклянной палочкой (рис. 6.3, 6.4), а пальцами правой руки в этот момент заводят кверху нижний край века и перехватывают его большим пальцем левой руки, фиксируют за ресницы и прижимают к краю орбиты. Правая рука при этом остается свободной для манипуляций.

 Рис. 6.4. Выворот верхнего века с помощью стеклянной палочки. Объяснение в тексте.
Рис. 6.4. Выворот верхнего века с помощью стеклянной палочки. Объяснение в тексте.

 Рис. 6.5. Выворот верхнего века с помощью векоподъемника. Объяснение в тексте.
Рис. 6.5. Выворот верхнего века с помощью векоподъемника. Объяснение в тексте.
Для того чтобы осмотреть верхнюю переходную складку, где довольно часто локализуются различные инородные тела, вызывающие резкую болезненность и раздражение глазного яблока, следует через нижнее веко слегка надавить на глазное яблоко кверху. Еще лучше удается осмотр верхней переходной складки с помощью векоподъемника: его край ставят на кожу у верхнего края хряща слегка оттянутого книзу века и выворачивают его, натягивая на конец векоподъемника (рис. 6.5). После выворота века ресничный край удерживают большим пальцем левой руки у края орбиты.
Нормальная конъюнктива век бледно–розовая, гладкая, прозрачная, влажная. Через нее видны мейбомиевы железы и их протоки, располагающиеся в толще хрящевидной пластинки перпендикулярно краю века. В норме секрет в них не определяется. Он появляется, если сдавить край века между пальцем и стеклянной палочкой.
В прозрачной конъюнктиве хорошо видны сосуды.
Исследование слезных органов проводят путем осмотра и пальпации. При оттягивании верхнего века и быстром взгляде пациента кнутри осматривают пальпебральную часть слезной железы. Таким образом можно выявить опущение слезной железы, ее опухоль или воспалительную инфильтрацию. При пальпации можно определить болезненность, припухлость, уплотнение орбитальной части железы в области верхненаружного угла орбиты.
Состояние слезоотводящих путей определяют путем осмотра, который проводят одновременно с исследованием положения век. Оценивают наполнение слезного ручейка и озера, у внутреннего угла глаза положение и величину слезных точек, состояние кожи в области слезного мешка. Наличие гнойного содержимого в слезном мешке определяют, надавливая под внутренней спайкой век снизу вверх указательным пальцем правой руки. Одновременно левой рукой оттягивают нижнее веко, чтобы увидеть излившееся содержимое слезного мешка. В норме слезный мешок пуст. Содержимое слезного мешка выдавливается через слезные канальцы и слезные точки. В случаях нарушения продукции и отведения слезной жидкости проводят специальные функциональные пробы (см. главу 8).
Исследование переднего отдела глазного яблока вначале проводят путем обычного осмотра, а для более детального исследования используют боковое (фокальное) освещение.
Исследование при боковом (фокальном) освещении
Метод предназначен для выявления тонких изменений в переднем отделе глазного яблока.Исследование проводят в темной комнате с использованием настольной лампы, установленной слева и спереди от пациента на расстоянии 40–50 см на уровне его лица (рис. 6.6). Для осмотра используют офтальмологические лупы силой 13,0 или 20,0 дптр. Врач располагается напротив пациента, его ноги находятся слева от ног последнего. Затем врач берет лупу правой рукой, слегка поворачивает голову пациента в сторону источника света и направляет пучок света на глазное яблоко. Лупу необходимо поместить между источником света и глазом пациента с учетом ее фокусного расстояния (7–8 или 5–6 см) так, чтобы лучи света, проходя через стекло, фокусировались на определенном, подлежащем осмотру участке переднего отдела глазного яблока. Яркое освещение этого участка в контрасте с соседними дает возможность детально рассмотреть отдельные структуры. Метод называется боковым, потому что лупа располагается сбоку от глаза.
При исследовании склеры обращают внимание на ее цвет и состояние сосудистого рисунка. В норме склера белого цвета, видны лишь сосуды конъюнктивы, краевая петлистая сеть сосудов вокруг роговицы не просматривается.
Роговица прозрачная, блестящая, гладкая, зеркальная, сферичная. В норме собственных сосудов в роговице нет. Через роговицу просматривается передняя камера глаза, глубина которой лучше видна сбоку. Расстояние между световыми рефлексами на роговице и радужке определяет глубину передней камеры (в норме ее глубина в центре 3–3,5 мм). Влага, наполняющая переднюю камеру, в норме абсолютно прозрачная. При некоторых заболеваниях она может содержать гной, кровь, хлопья экссудата. Рассматривая радужку через роговицу, отмечают, нет ли изменений цвета и рисунка, наличия грубых включений пигмента, оценивают состояние пигментной каймы, ширину и подвижность зрачка. Цвет радужки зависит от количества в ней пигмента и бывает от светло–голубого до темно–коричневого. Изменение цвета радужки можно обнаружить при сравнении его с цветом радужки другого глаза. В случае отсутствия пигмента радужка прозрачная, она имеет красный цвет вследствие просвечивания сосудистой оболочки (альбиносы). Ажурный вид радужке придает ее трабекулярное и лакунарное строение. В ней отчетливо выделяются зрачковая и корневая (цилиарная) зоны. По зрачковому краю отмечается бурая кайма, являющаяся частью внутреннего пигментного листка радужки, вывернутого на ее переднюю поверхность. С возрастом эта кайма депигментируется.
 Рис. 6.6. Исследование при боковом (фокальном) освещении.
Рис. 6.6. Исследование при боковом (фокальном) освещении.
При боковом освещении зрачок определяется в виде черного круга. Исследование зрачка можно проводить с использованием трех методик: пупиллоскопии, пупиллометрии и пупиллографии, однако в клинической практике обычно применяют первые две.
Исследование с целью определения величины (ширины) зрачка обычно проводят в светлой комнате, при этом пациент смотрит вдаль поверх головы врача. Обращают внимание на форму и положение зрачка. В норме зрачок круглый, а при патологических состояниях может быть овальным, фестончатым, эксцентрично расположенным. Его размер меняется в зависимости от освещенности от 2,5 до 4 мм. При ярком освещении зрачок сокращается, а в темноте расширяется. Размер зрачка зависит от возраста пациента, его рефракции и аккомодации. Ширину зрачка можно измерить миллиметровой линейкой, а более точно – пупиллометром.
Важным свойством зрачка является его реакция на свет, различаю три вида реакции: прямую, содружественную, реакцию на конвергенцию и аккомодацию.
Для определения прямой реакции: сначала оба глаза прикрывают ладонями на 30–40 с, а затем по очереди открывают. При этом на открываемом глазу будет отмечаться сужение зрачка в ответ на попадание в глаз светового потока.
Содружественную реакцию проверяют так: в момент прикрывания открывания одного глаза наблюдаю за реакцией второго. Исследование проводят в затемненной комнате использованием света от офтальмоскопа или щелевой лампы. При прикрывании одного глаза зрачок в другом глазу будет расширяться, при открывании – суживаться.
Реакцию зрачка на конвергенцию и аккомодацию оценивают следующим образом. Пациент сначала смотрит вдаль, а затем перевода взгляд на какой–нибудь близки предмет (кончик карандаша, рукоятку офтальмоскопа и т. д.), находящийся на расстоянии 20–25 см с него. При этом зрачки обоих глаз суживаются.
Прозрачный хрусталик при исследовании с использованием метода бокового освещения не виден. Oтдельные участки помутнений определяются в том случае, если они располагаются в поверхностных слоя: При пол пом созревании катаракт зрачок становится белым.
Исследование в проходящем свете
Метод используют для осмотр оптически прозрачных сред глазного яблока (роговицы, влаги передне камеры, хрусталика, стекловидно! тела). Учитывая, что роговица и передняя камера Могут быть деталью осмотрены при боковом (фокальном) освещении, этот метод применяют в основном для исследования хрусталика и стекловидного тела. Рис. 6.7. Исследование в проходящем свете.
Рис. 6.7. Исследование в проходящем свете.
Источник света устанавливают (в затемненной комнате) сзади и слева от пациента. Врач с помощью зеркального офтальмоскопа, приставленного к его правому глазу, направляет отраженный пучок света в зрачок глаза пациента (рис. 6.7). Для более детального исследования необходимо предварительно расширить зрачок с помощью лекарственных средств. При попадании пучка света зрачок начинает светиться красным цветом, что обусловлено отражением лучей от сосудистой оболочки (рефлекс с глазного дна). Согласно закону сопряженных фокусов, часть отраженных лучей попадает в глаз врача через отверстие в офтальмоскопе.
В том случае, если на пути отраженных от глазного дна лучей встречаются фиксированные или плавающие помутнения, то на фоне равномерного красного свечения глазного дна появляются неподвижные или перемещающиеся темные образования различной формы. Если при боковом освещении помутнения в роговице и передней камере не определены, то образования, выявленные в проходящем свете, – это помутнения в хрусталике или в стекловидном теле. Помутнения, находящиеся в стекловидном теле, подвижны, они перемещаются даже при неподвижном глазном яблоке. Мутные участки в хрусталике фиксированы и перемещаются только при движениях глазного яблока. Для того чтобы определить глубину залегания помутнений в хрусталике, пациента просят посмотреть сначала вверх, затем вниз. Если помутнение находится в передних слоях, то в проходящем свете оно будет перемещаться в ту же сторону. Если же помутнение залегает в задних слоях, то оно будет смещаться в противоположную сторону (рис. 6.8).
 Рис. 6.8. Смещение помутнений в хрусталике при движениях глаза вверх и вниз. Объяснение в тексте.
Рис. 6.8. Смещение помутнений в хрусталике при движениях глаза вверх и вниз. Объяснение в тексте.
Офтальмоскопия
Офтальмоскопия – метод исследования сетчатки, зрительного нерва и сосудистой оболочки в лучах света, отраженного от глазного дна. В клинике используют два метода офтальмоскопии – в обратном и в прямом виде. Офтальмоскопию удобнее проводить при широком зрачке. Зрачок не расширяют при подозрении на глаукому, чтобы не вызвать приступ повышения внутриглазного давления, а также при атрофии сфинктера зрачка, так как в этом случае зрачок навсегда останется широким. Рис. 6.9. Офтальмоскопия в обратном виде.
Рис. 6.9. Офтальмоскопия в обратном виде.
Офтальмоскопия в обратном виде предназначена для быстрого осмотра всех отделов глазного дна. Ее проводят в затемненном помещении – смотровой комнате. Источник света устанавливают слева и несколько сзади от пациента (рис. 6.9). Врач располагается напротив пациента, держа в правой руке офтальмоскоп, приставленный к его правому глазу, и посылает световой пучок в исследуемый глаз. Офтальмологическую линзу силой +13,0 или +20,0 дптр, которую врач держит большим и указательным пальцами левой руки, он устанавливает перед исследуемым глазом на расстоянии, равном фокусному расстоянию линзы, – соответственно 7–8 или 5 см (рис. 6.10). Второй глаз пациента при этом остается открытым и смотрит в направлении мимо правого глаза врача. Лучи, отраженные от глазного дна пациента, попадают на линзу, преломляются на ее поверхности и образуют со стороны врача перед линзой, на ее фокусном расстоянии (соответственно 7–8 или 5 см), висящее в воздухе действительное, но увеличенное в 4–6 раз и перевернутое изображение исследуемых участков глазного дна. Все, что кажется лежащим вверху, на самом деле соответствует нижней части исследуемого участка, а то, что находится снаружи, соответствует внутренним участкам глазного дна.
 Рис. 6–10. Набор для обратной офтальмоскопии.
Рис. 6–10. Набор для обратной офтальмоскопии.
 Рис. 6.11. Ход лучей при офтальмоскопии в обратном виде.
Рис. 6.11. Ход лучей при офтальмоскопии в обратном виде.
Ход лучей при данном способе исследования представлен на рис. 6.11.
В последние годы при офтальмоскопии используют асферические линзы, что позволяет получить практически равномерное и высокоосвещенное изображение по всему нолю обзора. При этом размеры изображения зависят от оптической силы используемой линзы и рефракции исследуемого глаза: чем больше сила линзы, тем больше увеличение и меньше видимый участок глазного дна, а увеличение в случае использования одной и той же силы линзы при исследовании гиперметропического глаза будет больше, чем при исследовании миопического глаза (вследствие различной длины глазного яблока).
Офтальмоскопия в прямом виде позволяет непосредственно рассмотреть детали глазного дна, выявленные при офтальмоскопии в обратном виде. Этот метод можно сравнить с рассматриванием предметов через увеличительное стекло. Исследование выполняют с помощью моно– или бинокулярных электрических офтальмоскопов различных моделей и конструкций (рис. 6.12), позволяющих видеть глазное дно в прямом виде увеличенным в 13–16 раз. При этом врач придвигается как можно ближе к глазу пациента и осматривает глазное дно через зрачок (лучше на фоне медикаментозного мидриаза): правым глазом правый глаз пациента, а левым – левый.
При любом способе офтальмоскопии осмотр глазного дна проводят в определен ной последовательности: сначала осматривают диск зрительного нерва, далее – область желтого пятна (макулярную область), а затем – периферические отделы сетчатки.
При осмотре диска зрительного нерва в обратном виде пациент должен смотреть мимо правого уха врача, если исследуют правый глаз, и на левое ухо исследователя, если осматривают левый глаз. В норме диск зрительного нерва круглой или немного овальной формы, желтоваторозового цвета с четкими границами на уровне сетчатки (рис. 6.13). Из–за интенсивного кровоснабжения внутренняя половина диска зрительного нерва имеет более насыщенную окраску. В центре диска имеется углубление (физиологическая экскавация), это место перегиба волокон зрительного нерва от сетчатки к решетчатой пластинке.
Через центральную часть диска входит центральная артерия сетчатки и выходит центральная вена сетчатки. Центральная артерия сетчатки в области диска зрительного нерва делится на две ветви – верхнюю и нижнюю, каждая из которых в свою очередь делится на височную и носовую. Вены полностью повторяют ход артерий. Соотношение диаметра артерий и вен в соответствующих стволах 2:3. Вены всегда шире и темнее артерий. При офтальмоскопии вокруг артерии виден световой рефлекс.
Кнаружи от зрительного нерва, на расстоянии двух диаметров диска от него, располагается желтое пятно, или макулярная область (анатомическая область центрального зрения). Врач видит его при исследовании, когда пациент смотрит прямо в офтальмоскоп. Желтое пятно имеет вид горизонтально расположенного овала, немного более темного, чем сетчатка. У молодых людей этот участок сетчатки окаймлен световой полоской – макулярным рефлексом. Центральной ямке желтого пятна, имеющей еще более темную окраску, соответствует фовеальный рефлекс. Картина глазного дна у разных людей различается цветом и рисунком, что определяется насыщенностью эпителия сетчатки пигментом и содержанием меланина в сосудистой оболочке. При прямой офтальмоскопии отсутствуют световые блики отражений от сетчатки, что облегчает исследование. В головке офтальмоскопа имеется набор оптических линз, позволяющих четко фокусировать изображение.
Офтальмохромоскопия. Методика разработана профессором А. М. Водовозовым в 60–80–е годы. Исследование осуществляют с помощью специального электрического офтальмоскопа, в который помещены светофильтры, позволяющие осматривать глазное дно в пурпурном, синем, желтом, зеленом и оранжевом свете. Офтальмохромоскопия похожа на офтальмоскопию в прямом виде, она значительно расширяет возможности врача при установлении диагноза, позволяет увидеть самые начальные изменения в глазу, не различаемые при обычном освещении. Например, в бескрасном свете хорошо видна центральная область сетчатки, а в желто–зеленом четко вырисовываются мелкие кровоизлияния.
Биомикроскопия
Биомикроскопия – это прижизненная микроскопия тканей глаза, метод, позволяющий исследовать передний и задний отделы глазного яблока при различных освещении и величине изображения. Исследование проводят с помощью специального прибора – щелевой лампы, представляющей собой комбинацию осветительной системы и бинокулярного микроскопа (рис. 6.14). Благодаря использованию щелевой лампы можно увидеть детали строения тканей в живом глазу. Осветительная система включает щелевидную диафрагму, ширину которой можно регулировать, и фильтры различного цвета. Проходящий через щель пучок света образует световой срез оптических структур глазного яблока, который рассматривают через микроскоп щелевой лампы. Перемещая световую щель, врач исследует все структуры переднего отдела глаза.Голову пациента устанавливают на специальную подставку щелевой лампы с упором подбородка и лба. При этом осветитель и микроскоп перемещают на уровень глаз пациента. Световую щель поочередно фокусируют на той ткани глазного яблока, которая подлежит осмотру. Направляемый на полупрозрачные ткани световой пучок суживают и увеличивают силу света, чтобы получить тонкий световой срез. В оптическом срезе роговицы можно увидеть очаги помутнений, новообразованные сосуды, инфильтраты, оценить глубину их залегания, выявить различные мельчайшие отложения на ее задней поверхности. При исследовании краевой петлистой сосудистой сети и сосудов конъюнктивы можно наблюдать кровоток в них, перемещение форменных элементов крови.
При биомикроскопии удается отчетливо рассмотреть различные зоны хрусталика (передний и задний полюсы, корковое вещество, ядро), а при нарушении его прозрачности определить локализацию патологических изменений. За хрусталиком видны передние слои стекловидного тела.
Различают четыре способа биомикроскопии в зависимости от характера освещения: ■ в прямом фокусированном свете, когда световой пучок щелевой лампы фокусируют на исследуемом участке глазного яблока. При этом можно оценить степень прозрачности оптических сред и выявить участки помутнений ■ в отраженном свете. Так можно рассматривать роговицу в лучах, отраженных от радужки, при поиске инородных тел или выявлении зон отечности ■ в непрямом фокусированном свете, когда световой пучок фокусируют рядом с исследуемым участком, что позволяет лучше видеть изменения благодаря контрасту сильно и слабо освещенных зон ■ при непрямом диафаноскопическом просвечивании, когда образуются отсвечивающиеся (зеркальные) зоны на границе раздела оптических сред с различными показателями преломления света, что позволяет исследовать участки ткани рядом с местом выхода отраженного пучка света (исследование угла передней камеры).
При указанных видах освещения можно использовать также два приема: ■ проводить исследование в скользящем луче (когда рукояткой щелевой лампы световую полоску перемещают по поверхности влево–вправо), что позволяет уловить неровности рельефа (дефекты роговицы, новообразованные сосуды, инфильтраты) и определить глубину залегания этих изменений ■ выполнять исследование в зеркальном поле, что также помогает изучить рельеф поверхности и при этом еще выявить неровности и шероховатости.
Использование при биомикроскопии дополнительно асферических линз (типа линзы Груби) дает возможность проводить офтальмоскопию глазного дна (на фоне медикаментозного мидриаза), выявляя тонкие изменения стекловидного тела, сетчатки и сосудистой оболочки.
Современная конструкция и приспособлениящелевых ламп позволяют также дополнительно определить толщину роговицы и ее наружных параметров, оценить ее зеркальность и сферичность, а также измерить глубину передней камеры глазного яблока.
Важное достижение последних лет – ультразвуковая биомикроскопия, позволяющая исследовать цилиарное тело, заднюю поверхность и срез радужки, боковые отделы хрусталика, скрытые при обычной световой биомикроскопии за непрозрачной радужкой.
Гониоскопия
Гониоскопия – метод исследования угла передней камеры, скрытого за полупрозрачной частью роговицы (лимбом), которое выполняют с помощью гониоскопа и щелевой лампы.При проведении этого исследования голова пациента находится на подставке щелевой лампы, подбородок и лоб фиксированы, а врач, предварительно нанеся на контактную поверхность гониоскопа специальный гель и раскрыв одной рукой глазную щель исследуемого глаза пациента, свободной рукой устанавливает контактную поверхность гониоскопа на роговицу этого глаза. Одной рукой врач удерживает гониоскоп, а другой с помощью рукоятки щелевой лампы перемещает световую щель по грани гониоскопа. Зеркальная поверхность гониоскопа позволяет направить луч света в угол передней камеры глаза и получить отраженное изображение.
 Рис. 6.15. Модели гониоскопов.
а – трехзеркальная линза Гольдмана; б – гониоскоп Ван–Бойнингена; в – гониоскоп Краснова. Внизу – схема отражения светового луча от граней гониоскопа в угол передней камеры глаза.
Рис. 6.15. Модели гониоскопов.
а – трехзеркальная линза Гольдмана; б – гониоскоп Ван–Бойнингена; в – гониоскоп Краснова. Внизу – схема отражения светового луча от граней гониоскопа в угол передней камеры глаза.
В клинической практике наиболее часто используют гониоскопы Гольдмана (трехзеркальный конусовидный), Ван–Бойнингена (четырехзеркальный пирамидальный) и М. М. Краснова (однозеркальный) (рис. 6.15). Гониоскоп позволяет рассмотреть особенности структуры угла передней камеры: корень радужки, переднюю полоску цилиарного тела, склеральную шпору, к которой прикрепляется цилиарное тело, корнеосклеральную трабекулу, склеральный венозный синус (шлеммов канал), внутреннее пограничное кольцо роговицы.
Особенно важным является определение степени открытости угла передней камеры. В соответствии с существующей классификацией угол передней камеры может быть широким, средней ширины, узким и закрытым. При широком угле хорошо видны все составляющие его элементы, включая полоску цилиарного тела и корнеосклеральные трабекулы. При угле передней камеры средней ширины цилиарное тело не просматривается или определяется в виде узкой полоски. В том случае, если угол передней камеры узкий, не удается увидеть ни цилиарное тело, ни заднюю часть корнеосклеральных трабекул. При закрытом угле передней камеры корнеосклеральные трабекулы совсем не видны, а корень радужки прилежит к переднему пограничному кольцу Швальбе.
Гониоскопия позволяет обнаружить различные патологические изменения в угле передней камеры: гониосинехии, новообразованные сосуды, опухоли, инородные тела.
Исследование внутриглазного давления
Уровень внутриглазного давления (ВГД) может быть определен различными способами: ориентировочно (пальпаторно), с помощью тонометров аппланационного или импрессионного типа, а также бесконтактным способом. Рис. 6.16. Измерение внутриглазного давления с помощью аппланационного тонометра Маклакова.
Рис. 6.16. Измерение внутриглазного давления с помощью аппланационного тонометра Маклакова.
Ориентировочное (пальпаторное) исследование.
Его проводят при неподвижном положении головы и взгляде пациента вниз. При этом указательные пальцы обеих рук врач помещает на глазное яблоко через кожу верхнего века и поочередно надавливает на глаз. Возникающие тактильные ощущения (податливость разной степени) зависят от уровня внутриглазного давления: чем выше давление и плотнее глазное яблоко, тем меньше подвижность его стенки. Определяемое таким образом ВГД обозначают следующим образом: Тn – нормальное давление; Т+1 – умеренно повышенное (глаз слегка плотный); Т+2 – значительно повышенное (глаз очень плотный); Т+3 – резко повышенное (глаз твердый, как камень). При понижении ВГД также различают три степени его гипотонии: Т–1 – глаз несколько мягче, чем в норме; Т–2 – глаз мягкий; Т–3 – глаз очень мягкий.Данный метод исследования ВГД применяют только в тех случаях, когда нельзя провести его инструментальное измерение: при травмах и заболеваниях роговицы, после оперативных вмешательств со вскрытием глазного яблока. Во всех остальных случаях используют тонометрию.
Аппланационная тонометрия.
В нашей стране данное исследование выполняют по методике, предложенной А. Н. Маклаковым (1884), которая заключается в установке на поверхности роговицы пациента (после ее капельной анестезии) стандартного грузика массой 10 г. Грузик имеет вид полого металлического цилиндра высотой 4 мм, основание которого расширено и снабжено площадками из молочно–белого фарфора диаметром 1 см. Перед измерением ВГД эти площадки покрывают специальной краской (смесь колларгола и глицерина), а затем с помощью специальной держалки грузик опускают на роговицу широко раскрытого пальцами врача глаза пациента, лежащего на кушетке (рис. 6.16).Под действием давления грузика роговица сплющивается и в месте ее контакта с площадкой грузика краска смывается. На площадке грузика остается кружок, лишенный краски (рис. 6.17), соответствующий площади соприкосновения поверхности грузика и роговицы. Полученный отпечаток с площадки грузика переносят на предварительно смоченную спиртом бумагу. При этом чем меньше кружок, тем выше ВГД и наоборот.
 Рис. 6.17. Уплощение роговицы площадкой тонометра. Проекция зоны контакта с роговицей на площадке тонометра.
Р – внутриглазное давление; Р1 – масса груза; Т – область соприкосновения уплощенной роговицы с площадкой тонометра.
Рис. 6.17. Уплощение роговицы площадкой тонометра. Проекция зоны контакта с роговицей на площадке тонометра.
Р – внутриглазное давление; Р1 – масса груза; Т – область соприкосновения уплощенной роговицы с площадкой тонометра.
Для перевода линейных величин в миллиметры ртутного столба С. С. Головин (1895) составил таблицу на основе сложной формулы.
Позднее Б. Л. Поляк перенес эти данные на прозрачную измерительную линейку, с помощью которой сразу можно получить ответ в миллиметрах ртутного столба по той отметке, около которой вписывается отпечаток от грузика тонометра (рис. 6.18).
Внутриглазное давление, определенное таким способом, называется тонометрическим (Рт), поскольку под воздействием груза на глаз повышается офтальмотонус. В среднем при увеличении массы тонометра на 1 г ВГД повышается на 1 мм рт.ст., т. е. чем меньше масса тонометра, тем тонометрическое давление ближе к истинному (Р0). Нормальное ВГД при измерении с грузиком массой 10 г не превышает 28 мм рт.ст. с суточными колебаниями не более 5 мм рт.ст. В наборе имеются грузики массой 5; 7,5; 10 и 15 г. Последовательное измерение внутриглазного давления называется эластотонометрией.
Импрессионная тонометрия.
Данный метод, предложенный Шиотцом, основан на принципе вдавления роговицы стержнем постоянного сечения под воздействием грузика различной массы (5,5; 7,5 и 10 г). Величину получаемого вдавления роговицы определяют в линейных величинах. Она зависит от массы используемого грузика и уровня ВГД. Для перевода показаний измерения в миллиметры ртутного столба используют прилагаемые к прибору номограммы. Рис. 6.18. Измерительная линейка Поляка для грузиков 5; 7,5; 10 и 15 г.
Рис. 6.18. Измерительная линейка Поляка для грузиков 5; 7,5; 10 и 15 г.
Импрессионная тонометрия менее точна, чем аппланационная, но незаменима в тех случаях, когда роговица имеет неровную поверхность.
В настоящее время недостатки контактной аппланационной тонометрии полностью устранены благодаря применению современных бесконтактных офтальмологических тонометров различных конструкций. В них реализованы последние достижения в области механики, оптики и электроники. Суть исследования состоит в том, что с определенного расстояния в центр роговицы исследуемого глаза посылают дозированную по давлению и объему порцию сжатого воздуха. В результате его воздействия на роговицу возникает ее деформация и меняется интерференционная картина. По характеру этих изменений и определяют уровень ВГД. Подобные приборы позволяют измерять ВГД с высокой точностью, не прикасаясь к глазному яблоку.
Исследование гидродинамики глаза (топография).
Метод позволяет получать количественные характеристики продукции и оттока из глаза внутриглазной жидкости. Наиболее важными из них являются: коэффициент легкости оттока (С) камерной влаги (в норме не менее 0,14 (мм3•мин)/мм рт.ст.), минутный объем (F) водянистой влаги (около 2 мм3/мин) и истинное ВГД Р0 (до 20 мм рт.ст.).Для выполнения тонографии используют приборы различной сложности, вплоть до электронных. Однако она может быть проведена и в упрощенном варианте по Кальфа–Плюшко с использованием аппланационных тонометров. В этом случае ВГД первоначально измеряют с использованием последовательно грузиков массой 5; 10 и 15 г. Затем устанавливают грузик массой 15 г чистой площадкой на центр роговицы на 4 мин. После такой компрессии вновь измеряют ВГД, но используют грузики в обратной последовательности. Полученные кружки сплющивания измеряют линейкой Поляка и по установленным величинам строят две эластокривые. Все дальнейшие расчеты производят с помощью номограммы.
По результатам тонографии можно дифференцировать ретенционную (сокращение путей оттока жидкости) форму глаукомы от гиперсекреторной (увеличение продукции жидкости).
Исследование тактильной чувствительности роговицы
Роговица является высокочувствительной оболочкой глазного яблока. При различных патологических состояниях глаза ее чувствительность может значительно снижаться или полностью исчезать, поэтому ее определение может быть очень информативным показателем при установлении диагноза.Исследование выполняют различными способами. Некоторые методы позволяют получать ориентировочные данные, а другие – метрированные. Для ориентировочного определения уровня тактильной чувствительности роговицы используют увлажненный ватный фитилек, которым прикасаются к роговице сначала в центральном отделе, а затем в четырех точках на периферии при широко раскрытых глазах пациента. Отсутствие реакции на прикосновение фитилька указывает на грубые нарушения чувствительности. Более тонкие исследования чувствительности роговицы проводят с помощью специальных градуированных волосков (метод Фрея–Самойлова), альгезиметров [Радзиховский Б. Л., 1960, 1971; Добромыслов А. Н., 1973; Могутин Б. М., 1975] и кератоэстезиометров [Сомов Е. Е., 1968; Larson V. L., 1970].
В нашей стране в течение длительного периода времени использовали волосковый метод определения тактильной чувствительности роговицы. Он состоит в последовательном касании 13 точек роговицы тремя (с силой 0,3; 1 и 10 г на 1 мм3) или четырьмя (добавляют волосок с силой 3 г на 1 мм3) волосками. В норме волосок, давление которого составляет 0,3 г/мм3, ощущается в 7–8 точках, 1 г/мм3 – в 11–12 точках, а волосок, оказывающий давление 10 г/мм3, вызывает не только тактильные, но и болевые ощущения. Данный метод прост и доступен, но не лишен недостатков: невозможны стандартизация и стерилизация волосков, а также определение величины порогового восприятия. Альгезиметры, созданные Б. Л. Радзиховским и А. Н. Добромысловым, лишены большинства указанных недостатков, однако с их помощью также нельзя определить пороговую чувствительность роговицы, а положение пациента лежа не всегда удобно для исследования.
В техническом отношении самыми совершенными в настоящее время являются оптико–электронные эстезиометры.
Исследование гемодинамики глаза
Данное исследование имеет важное значение в диагностике различных местных и общих сосудистых патологических состояний. Для проведения исследования используют следующие основные методы: офтальмодинамометрию, офтальмоплетизмографию, офтальмосфигмографию, реоофтальмографию, ультразвуковую допплерографию.Офтальмодинамометрия (тоноскопия). Данный метод позволяет определять уровень кровяного давления в центральной артерии (ЦАС) и центральной вене (ЦВС) сетчатки с помощью специального прибора – пружинного офтальмодинамометра. В практическом отношении более важным является измерение систолического и диастолического давления в ЦАС и вычисление соотношения между этими показателями и давлением крови в плечевой артерии. Метод используют для диагностики церебральной формы гипертонической болезни, стеноза и тромбоза сонных артерий.
Исследование основано на следующем принципе: если искусственно повышать внутриглазное давление и при этом проводить офтальмоскопию, то первоначально можно наблюдать появление пульса в ЦАС, что соответствует моменту выравнивания внутриглазного и артериального давления (фаза диастолического давления). При дальнейшем повышении ВГД артериальный пульс исчезает (фаза систолического давления). Повышения ВГД достигают путем надавливания датчиком прибора на анестезированную склеру пациента. Показания прибора, выраженные в граммах, затем переводят в миллиметры ртутного столба по номограмме Байара – Мажито. В норме систолическое давление в глазничной артерии 65–70 мм рт. ст., диастолическое 45–50 мм рт. ст.
Для нормального питания сетчатки необходимо сохранение определенного соотношения между величиной кровяного давления в ее сосудах и уровнем ВГД.
Офтальмоплетизмография – метод записи и измерения колебаний объема глаза, возникающих в связи с сердечными сокращениями. Метод используют для диагностики окклюзий в системе сонных артерий, оценки состояния стенок внутриглазных сосудов при глаукоме, атеросклерозе, гипертонической болезни.
Офтальмосфигмография – метод исследования, позволяющий регистрировать и измерять пульсовые колебания внутриглазного давления в процессе четырехминутной тонографии по Гранту.
Реоофтальмография позволяет количественно оценить изменения объемной скорости кровотока в тканях глаза по показателю их сопротивления (импедансу) переменному электрическому току высокой частоты: с увеличением объемной скорости кровотока импеданс тканей уменьшается. С помощью данного метода можно определять динамику патологического процесса в сосудистом тракте глаза, степень эффективности терапевтического, лазерного и хирургического лечения, изучать механизмы развития заболеваний органа зрения.
Ультразвуковая допплерография позволяет определить линейную скорость и направление тока крови во внутренней сонной и глазничной артериях. Метод применяют с диагностической целью при травмах и заболеваниях глаз, обусловленных стенозирующими или окклюзионными процессами в указанных артериях.
Трансиллюминация и диафаносколия глазного яблока
Исследование внутриглазных структур можно проводить, не только посылая пучок света офтальмоскопом через зрачок, но и направляя свет в глаз через склеру – диасклеральное просвечивание (диафаноскопия). Просвечивание глаза через роговицу называется трансиллюминацией. Эти исследования можно выполнять с помощью диафаноскопов, работающих от ламп накаливания или волоконно–оптических световодов, которым отдают предпочтение, поскольку они не оказывают неблагоприятного термического воздействия на ткани глаза.Исследование проводят после тщательной анестезии глазного яблока в хорошо затемненном помещении. Ослабление или исчезновение свечения может отмечаться при наличии внутри глаза плотного образования (опухоль) в тот момент, когда осветитель находится над ним, или при массивном кровоизлиянии в стекловидное тело (гемофтальм; рис. 6.19). На участке, противоположном освещаемому участку склеры, при таком исследовании можно увидеть тень от пристеночно расположенного инородного тела, если оно не слишком малых размеров и хорошо задерживает свет.
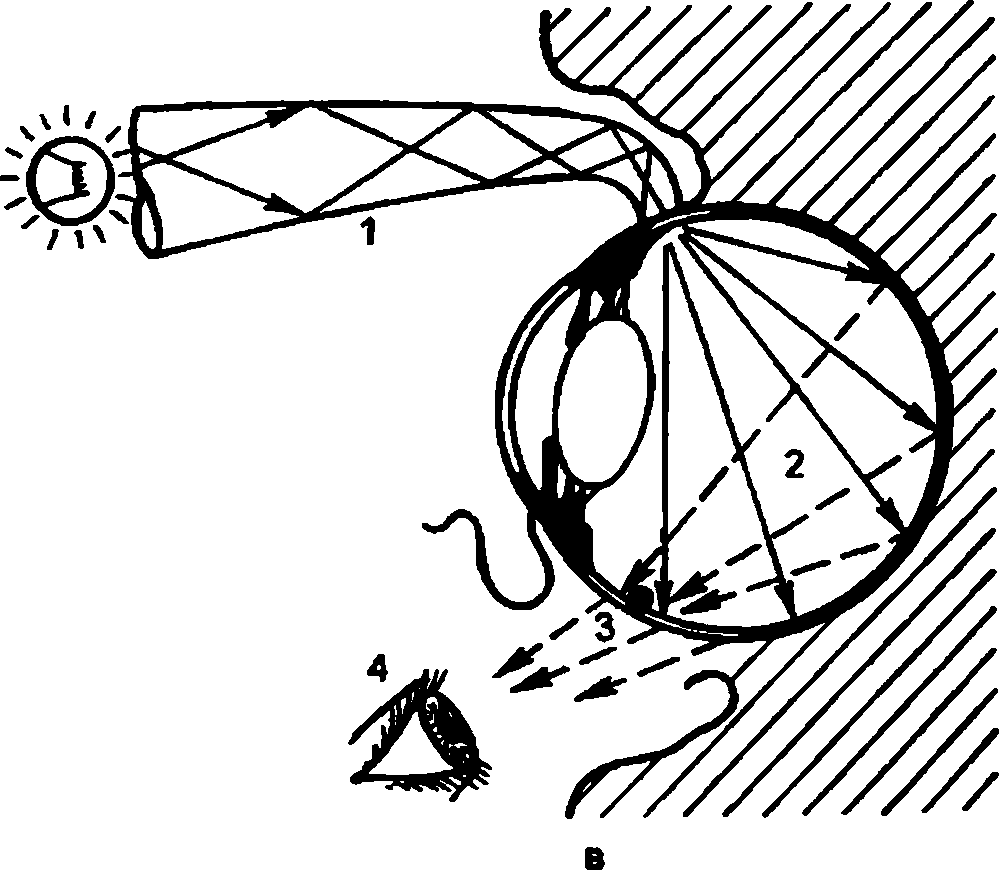

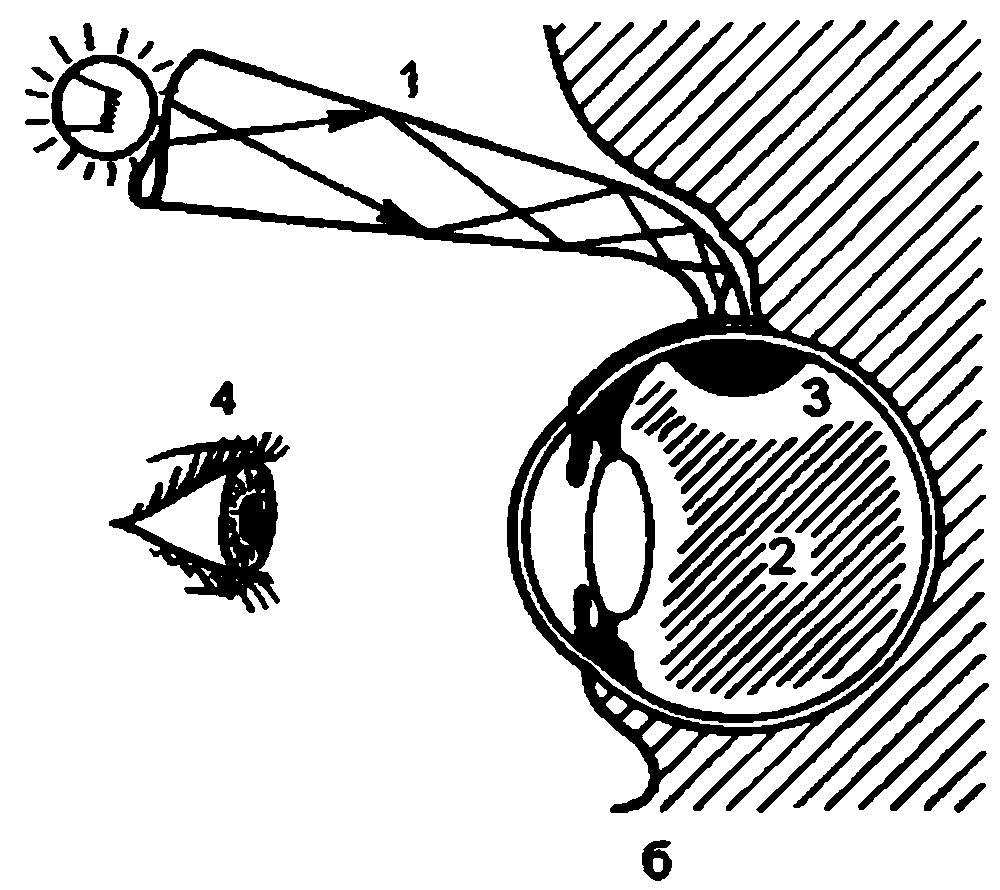 Рис. 6.19. Возможные варианты транссклерального просвечивания глазного яблока, а – нормальное свечение зрачка при расположении наконечника диафаноскопа нал здоровыми участками склеры: б – наконечник расположен в зоне опухоли, свечение зрачка отсутствует; в – появление на склере тени от инородного тела. 1 – наконечник диафаноскопа; 2 – глаз больного; 3 – тенеобразующие структуры; 4 – глаз врача.
Рис. 6.19. Возможные варианты транссклерального просвечивания глазного яблока, а – нормальное свечение зрачка при расположении наконечника диафаноскопа нал здоровыми участками склеры: б – наконечник расположен в зоне опухоли, свечение зрачка отсутствует; в – появление на склере тени от инородного тела. 1 – наконечник диафаноскопа; 2 – глаз больного; 3 – тенеобразующие структуры; 4 – глаз врача.
При трансиллюминации можно хорошо рассмотреть "поясок" цилиарного тела, а также постконтузионные субконъюнктивальные разрывы склеры.
Флюоресцентная ангиография сетчатки
Данный метод исследования сосудов сетчатки основан на объективной регистрации прохождения 5–10% раствора натриевой соли флюоресцеина по кровяному руслу путем серийного фотографирования. В основе метода лежит способность флюоресцеина давать яркое свечение при облучении поли– или монохроматическим светом.Флюоресцентная ангиография может быть проведена лишь при наличии прозрачных оптических сред глазного яблока. С целью контрастирования сосудов сетчатки стерильный апирогенный 5–10% раствор натриевой соли флюоресцеина вводят в локтевую вену. Для динамического наблюдения за прохождением флюоресцеина по сосудам сетчатки используют специальные приборы: ретинофоты и фундус–камеры различных моделей.
При прохождении красителя по сосудам сетчатки выделяют следующие стадии: хориоидальную, артериальную, раннюю и позднюю венозные. В норме продолжительность периода времени от введения красителя до его появления в артериях сетчатки составляет 8–13 с.
Результаты данного исследования имеют очень большое значение в дифференциальной диагностике при различных заболеваниях и травмах сетчатки и зрительного нерва.
Эхоофтальмография
Эхоофтальмофафия – ультразвуковой метод исследования структур глазного яблока, используемый в офтальмологии для диагностических целей. В основе метода лежит принцип ультразвуковой локации, заключающийся в способности ультразвука отражаться от поверхности раздела двух сред, имеющих различную плотность. Источником и одновременно приемником ультразвуковых колебаний служит пьезоэлектрическая пластина, размещенная в специальном зонде, который приставляют к глазному яблоку. Отраженные и воспринимаемые эхосигналы воспроизводятся на экране электроннолучевой трубки в виде вертикальных импульсов. Рис. 6.20. Эхоскопия глаза по А–методу с указанием зон формирования "эхопиков".
1 – эхосигнал от передней поверхности роговицы; 2, 3 – эхосигналы от передней и задней поверхностей хрусталика; 4 – эхосигнал от сетчатки и структур заднего полюса глазного яблока.
Рис. 6.20. Эхоскопия глаза по А–методу с указанием зон формирования "эхопиков".
1 – эхосигнал от передней поверхности роговицы; 2, 3 – эхосигналы от передней и задней поверхностей хрусталика; 4 – эхосигнал от сетчатки и структур заднего полюса глазного яблока.
Метод применяют для измерения нормальных анатомо–топографических взаимоотношений внутриглазных структур, для диагностики различных патологических состояний внутри глаза: отслойки сетчатки и сосудистой оболочки, опухолей и инородных тел. Ценность ультразвуковой локации особенно возрастает при наличии помутнений оптических сред глаза, когда применение основных методов исследования – офтальмоскопии и биомикроскопии – невозможно.
Для проведения исследования используют специальные приборы – эхоофтальмоскопы, причем одни из них работают в одномерном А–режиме (ЭХО–21, ЭОМ–24 и др.), а другие – в двухмерном В–режиме.
При работе в A–режиме (получения одномерного изображения) существует возможность измерения переднезадней оси глаза и получения эхосигналов от нормальных структур глазного яблока (рис. 6.20), а также выявления некоторых патологических образований внутри глаза (сгустки крови, инородные тела, опухоль).
Исследование в В–режиме имеет значительное преимущество, поскольку воссоздает наглядную двухмерную картину, т. е. изображение "сечения" глазного яблока, что значительно повышает точность и информативность исследования (рис. 6.21).
Энтоптометрия
Поскольку наиболее часто используемые в клинической практике методы оценки состояния органа зрения (визометрия, периметрия) не всегда дают возможность получить безошибочное и полное представление о функциональном состоянии сетчатки и всего зрительного анализатора, возникает потребность в использовании не более сложных, но более информативных функциональных офтальмологических тестов. К ним относятся энтоптические феномены (греч. ento – внутри, opto – вижу). Этим термином обозначают субъективные зрительные ощущения пациента, которые возникают вследствие воздействия на рецепторное поле сетчатки адекватных и неадекватных раздражителей, причем они могут иметь различную природу: механические, электрические, световые и т. д.Механофосфен – феномен в виде свечения в глазу при надавливании на глазное яблоко. Исследование проводят в темной комнате, изолированной от внешних звуковых и световых раздражителей, причем давление на глаз может быть оказано как с применением стеклянной офтальмологической палочки, так и путем нажатия пальцем через кожу век.
Давление на глазное яблоко осуществляют в четырех квадрантах на удалении 12–14 мм от лимба при взгляде пациента в сторону, противоположную от места расположения квадранта, в котором проводят стимуляцию. Результаты исследования считают положительными в том случае, если пациент видит темное пятно с ярким светящимся ободком с противоположной стороны от квадранта, где выполняют стимуляцию. Это свидетельствует о сохранности функции сетчатки именно в этом квадранте.
Аутоофтальмоскопия – метод, позволяющий оценить сохранность функционального состояния центральных отделов сетчатки даже при непрозрачных оптических средах глазного яблока. Результаты исследования считают положительными, если при ритмичных движениях наконечника диафаноскопа по поверхности склеры (после капельной анестезии) пациент отмечает появление картины "паутины", "веток дерева без листьев" или "растрескавшейся земли", что соответствует картине ветвления собственных сосудов сетчатки.
Световая полосчатая проба (примрозе) предназначена для оценки функциональной сохранности сетчатки при непрозрачных оптических средах (помутнение роговицы, катаракта). Исследование проводят путем освещения офтальмоскопом цилиндра Мэдокса, приставленного к исследуемому глазу пациента. При функциональной сохранности центральных отделов сетчатки обследуемый видит полоску света, направленную перпендикулярно длиннику призм цилиндра Мэдокса, независимо от его ориентации в пространстве.
Особенности исследования органа зрения у детей
При исследовании органа зрения у детей необходимо учитывать особенности нервной системы ребенка, его пониженное внимание, невозможность длительной фиксации взора на каком–то определенном объекте.Так, внешний (наружный) осмотр, особенно у детей в возрасте до 3 лет, лучше проводить вместе с медицинской сестрой, которая при необходимости фиксирует и прижимает ручки и ножки ребенка.
Выворот век осуществляют путем нажатия, оттягивания и смещения их навстречу друг другу.
Осмотр переднего отдела глазного яблока проводят с помощью векоподъемников после предварительной капельной анестезии раствором дикаина или новокаина. При этом соблюдают ту же последовательность осмотра, что и при обследовании взрослых пациентов.
Исследование заднего отдела глазного яблока у пациентов самого младшего возраста удобно проводить с использованием электрического офтальмоскопа.
Процессу исследования остроты и поля зрения необходимо придавать характер игры, особенно у детей в возрасте 3–4 лет.
Границы поля зрения в этом возрасте целесообразно определять с помощью ориентировочного метода, но вместо пальцев руки ребенку лучше показывать игрушки разного цвета.
Исследование с использованием приборов становится достаточно надежным примерно с 5 лет, хотя в каждом конкретном случае необходимо учитывать характерологические особенности ребенка.
Проводя исследование поля зрения у детей, необходимо помнить, что его внутренние границы у них шире, чем у взрослых.
Тонометрию у маленьких и беспокойных детей выполняют под масочным наркозом, с осторожностью фиксируя глаз в нужном положении микрохирургическим пинцетом (за сухожилие верхней прямой мышцы).
При этом концы инструмента не должны деформировать глазное яблоко, иначе уменьшается точность исследования. В связи с этим офтальмолог вынужден контролировать полученные при тонометрии данные, проводя пальпаторное исследование тонуса глазного яблока в области экватора.
Глава 7. Патология век
Вспухшее веко поднялось, подернутый дымкой страдания глаз уставился... Другой глаз остался закрытым.Веки (palpebrae) – часть придаточного аппарата глаза, сложноорганизованные подвижные структуры, спереди покрытые кожей, а сзади – конъюнктивой.М. А. Булгаков. "Мастер и Маргарита"
Веки защищают переднюю поверхность глазного яблока от высыхания и неблагоприятного воздействия окружающей среды, поддерживая таким образом влажность и зеркальный блеск роговицы и постоянное увлажнение конъюнктивы. Спонтанное моргание, происходящее приблизительно 15 раз в минуту, обеспечивает равномерное распределение слезы и секрета желез век на передней поверхности роговицы, а также помогает отведению слезной жидкости. Веки регулируют количество проникающего в глаза света. Рефлекторное смыкание век возникает в ответ на воздействие механических (инородные тела, касание ресниц), зрительных (ослепляющие вспышки) или звуковых (внезапный громкий звук) раздражителей. Рефлекторное движение глаза кверху (феномен Белла) при смыкании век обеспечивает защиту роговицы от попадания инородных тел и высыхания во время сна. Анатомия век – см. главу 3.
Врожденные аномалии век
Криптофтальм – полная потеря дифференцировки век. Это исключительно редкая патология, к развитию которой приводит заболевание матери в период закладки век (Н месяц беременности). При криптофтальме кожа ото лба до щеки непрерывна, спаяна с роговицей, глазное яблоко недоразвито. Криптофтальм сочетается с такими врожденными аномалиями, как расщелина губы и неба, атрезия гортани, мозговые грыжи.Колобома века – полнослойный сегментарный дефект века с основанием у его края, чаще образующийся в медиальной части верхнего века.
Врожденная колобома век (рис. 7.1) – редкая патология, следствие неполного сращения зачатков верхнечелюстных отростков. Дефект может быть изолированным, но может сочетаться с колобомой радужки и сосудистой оболочки, часто его выявляют одновременно с другими аномалиями: дермоидными кистами, микрофтальмом, мандибулофациальным дизостозом и окулоаурикуловертебральной дисплазией. Колобома века при отсутствии постоянного полноценного увлажнения роговицы может привести к ее поражению. Дефект века устраняют путем прямой фиксации краев или с помощью кожного лоскута. В случае отсутствия роговичных осложнений возможно проведение отсроченной (на несколько лет) реконструкции века. При локализации обширной колобомы нижнего века в области внутреннего угла глазной щели особенно велик риск развития кератопатии, в связи с чем требуется ранняя и значительно более сложная реконструкция. Прогноз хирургического лечения хороший.
Анкилоблефарон – частичное или полное сращение краев верхнего и нижнего век, чаще в наружном углу глазной щели, приводящее к ее горизонтальному укорочению. Очень редко наблюдающаяся патология; возможно аутосомно–доминантное наследование. Анкилоблефарон может сочетаться с деформациями черепа, колобомами сосудистой оболочки, симблефароном, эпикантусом, анофтальмом. Хирургическое разделение век необходимо произвести в самые ранние сроки. Приобретенный анкилоблефарон (рис. 7.2) может быть посттравматическим.
Эпикантус – полулунные вертикальные складки кожи между верхним и нижним веками, частично закрывающие внутрений угол глазной щели и изменяющие ее конфигурацию. Эпикантус определяется у большинства детей до 6 мес, у взрослых является характерным признаком представителей монголоидной расы. В норме эпикантус наблюдается у детей с плоской переносицей, по мере ее развития большая часть складок постепенно уменьшается с ростом ребенка и редко сохраняется к 7 годам. Двусторонний эпикантус – часто отмечающийся признак различных хромосомных нарушений (синдром Дауна). Складка может закрывать внутренний угол глаза, вследствие чего создается ложное впечатление о наличии сходящегося косоглазия.
Хирургическое лечение эффективно, его проводят с косметической целью.
Наиболее часто встречающаяся врожденная патология: птоз верхнего века, заворот и выворот век – рассмотрена в следующем разделе.
Деформации век и аномалии положения
Птоз верхнего века (син. блефароптоз) – аномально низкое положение века по отношению к глазному яблоку. Данная патология может быть врожденной и приобретенной.Врожденный птоз – заболевание с аутосомно–доминантным типом наследования, при котором развивается изолированная дистрофия мышцы, поднимающей верхнее веко (миогенный), или имеется аплазия ядра глазодвигательного нерва (нейрогенный). Различают врожденный птоз с нормальной функцией верхней прямой мышцы глаза (самый частый тип врожденного птоза) и птоз со слабостью этой мышцы. Птоз часто односторонний, но может проявляться на двух глазах. При частичном птозе ребенок приподнимает веки, используя лобные мышцы, и запрокидывает голову (поза "звездочета”). Верхняя пальпебральная борозда обычно выражена слабо или отсутствует. При взгляде прямо верхнее веко опушено, а при взгляде вниз расположено выше противоположного.
Пальпебромандибулярный синдром (синдром Гунна) – редко наблюдающийся врожденный, как правило, односторонний птоз, связанный с синкинетической ретракцией опущенного верхнего века при стимуляции крыловидной мышцы на стороне птоза (рис. 7.3, а). Непроизвольное поднимание опущенного верхнего века происходит при жевании, открывании рта или зевоте (рис. 7.3, б), а отведение нижней челюсти в сторону, противоположную птозу, также может сопровождаться ретракцией верхнего века (рис. 7.3, в). При этом синдроме мышца, поднимающая верхнее веко, получает иннервацию от моторных веточек тройничного нерва. Патологическая синкинезия этого вида обусловлена поражениями ствола мозга, нередко осложняется амблиопией или косоглазием.
Блефарофимоз – редко встречающаяся аномалия развития, обусловленная укорочением и сужением глазной щели, двусторонним птозом, с аутосомно–доминантным типом наследования. Для него характерны слабая функция мышцы, поднимающей верхнее веко, эпикантус и выворот нижнего века.
Приобретенный птоз наблюдается значительно чаще, чем врожденный. В зависимости от происхождения различают нейрогенный, миогенный, апоневротический и механический приобретенный птоз.
Нейрогенный птоз при параличе глазодвигательного нерва обычно односторонний и полный, наиболее часто вызывается диабетической нейропатией и интракраниальными аневризмами, опухолями, травмами и воспалением. При полном параличе глазодвигательного нерва определяются патология экстраокулярных мышц и клинические проявления внутренней офтальмоплегии: потеря аккомодации и зрачковых рефлексов, мидриаз. Так, аневризма внутренней сонной артерии внутри кавернозного синуса может привести к полной наружной офтальмоплегии с анестезией области иннервации глаза и инфраорбитальной веточки тройничного нерва.
Птоз может быть вызван с защитной целью при лечении язв роговицы, которые не заживают из–за незакрывающейся глазной щели при лагофтальме. Эффект химической денервации ботулотоксином мышцы, поднимающей верхнее веко, временный (около 3 мес), и обычно его достаточно для купирования роговичного процесса. Этот способ лечения является альтернативой блефарорафии (сшивание век).
Птоз при синдроме Горнера (обычно приобретенный, но может быть и врожденным) вызван нарушением симпатической иннервации гладкой мышцы Мюллера. Для этого синдрома характерны некоторое сужение глазной щели вследствие опущения верхнего века на 1–2 мм и небольшого поднятия нижнего века, миоз, нарушение потоотделения на соответствующей половине лица или век.
Миогенный птоз возникает при миастении, часто двусторонний, может быть асимметричным. Выраженность птоза меняется день ото дня, он провоцируется при нагрузке и может сочетаться с двоением. Эндорфиновый тест временно устраняет мышечную слабость, корригирует птоз, подтверждает диагноз миастении.
Апоневротический птоз – очень часто встречающийся тип возрастного птоза; характеризуется тем, что сухожилие мышцы, поднимающей верхнее веко, частично отрывается от тарзальной (хрящеподобной) пластинки. Апоневротический птоз может быть посттравматическим; считается, что в большом числе случаев послеоперационный птоз имеет такой механизм развития.
Механический птоз возникает при горизонтальном укорочении века опухолевого или рубцового происхождения, а также при отсутствии глазного яблока.
У детей дошкольного возраста птоз приводит к стойкому снижению зрения. Раннее хирургическое лечение выраженного птоза может предотвратить развитие амблиопии. При плохой подвижности верхнего века (0–5 мм) целесообразно его подвешивание к лобной мышце. При наличии умеренно выраженной экскурсии века (6–10 мм) птоз корригируют путем резекции мышцы, поднимающей верхнее веко. При сочетании врожденного птоза с нарушением функции верхней прямой мышцы резекцию сухожилия леватора производят в большем объеме. Высокая экскурсия века (более 10 мм) позволяет выполнить резекцию (дупликатуру) апоневроза леватора или мышцы Мюллера.
Лечение приобретенной патологии зависит от этиологии и величины птоза, а также от подвижности века. Предложено большое количество методик, но принципы лечения остаются неизменными. При нейрогенном птозе у взрослых требуется раннее консервативное лечение. Во всех остальных случаях целесообразно хирургическое лечение.
При опущении века на 1–3 мм и его хорошей подвижности трансконъюнктивально выполняют резекцию мышцы Мюллера.
В случае умеренно выраженного птоза (3–4 мм) и хорошей или удовлетворительной подвижности века показаны операции на мышце, поднимающей верхнее веко (пластика сухожилия, рефиксация, резекция или дупликатура).
При минимальной подвижности века осуществляют его подвешивание к лобной мышце, что обеспечивает механический подъем века при поднимании брови. Косметический и функциональный результаты данной операции хуже, чем эффект вмешательств на леваторах верхнего века, но у данной категории больных альтернативы подвешиванию нет.
Для механического поднятия века возможно использование особых дужек, фиксирующихся к оправам очков, применение специальных контактных линз. Обычно эти устройства плохо переносятся, поэтому их очень редко используют.
При хорошей подвижности века эффект хирургического лечения высокий, стабильный.
Заворот века (син. энтропион) – заболевание, при котором край века и ресницы повернуты к глазному яблоку. Это приводит к постоянному раздражению глаза, образованию эрозии и язв роговицы, инъекции конъюнктивальных сосудов, слезотечению. Различают следующие формы заворота век: врожденный, возрастной, спастический, рубцовый.
Врожденный заворот века чаще наблюдается у представителей монголоидной расы и является следствием утолщения кожи и гипертрофии волокон круговой мышцы глаза у ресничного края. Лечение врожденного заворота состоит в дозированной полулунной резекции кожи и круговой мышцы глаза, а в случае необходимости резекция может быть дополнена наложением выворачивающих швов. Врожденный заворот часто исчезает в течение первых месяцев жизни ребенка.
Возрастной заворот возникает вследствие растяжения связок век, атонии ретрактора нижнего века, нестабильности тарзальной пластинки. Возрастной заворот корригируют путем горизонтального укорочения наружной связки век, пластики ретрактора, резекции кожно–мышечного лоскута, а также сочетания этих методик. Прогноз хороший.
Спастический заворот характеризуется возрастным растяжением структур нижнего века, которое при возрастном энофтальме приводит к нестабильности нижнего века. Волокна круговой мышцы глаза постепенно смещаются по направлению к краю века, происходит их гипертрофия. Возникновение такого заворота века провоцируется блефароспазмом. При спастическом завороте века оправдано сочетание горизонтального укорочения его наружной связки, а в случае необходимости операцию дополняют пластикой ретрактора нижнего века и удалением кожного лоскута нижнего века. В отличие от возрастного заворота спастический чаще рецидивирует.
Рубцовый заворот часто является исходом сморщивания тарзальной пластинки после ожогов, повреждений, радиационного поражения, операций, инфекций (трахома), а также аллергических и токсических реакций (пемфигоид–пузырчатка, синдром Стивенса–Джонсона, синдром Лайелла). Постоянная травматизация глазного яблока ресницами вызывает постоянное слезотечение и раздражение конъюнктивы, приводящее к усилению блефароспазма. Для предотвращения травматизации роговицы на время, предшествующее операции, веко оттягивают книзу пластырем. При рубцовом завороте требуется пластика кожно–мышечной пластины века, нередко в сочетании с пластикой конъюнктивы трансплантатом собственной слизистой оболочки полости рта. Прогноз хороший.
 Рис. 7.4. Операция горизонтального укорочения нижнего века с целью коррекции выраженного возрастного выворота века.
Рис. 7.4. Операция горизонтального укорочения нижнего века с целью коррекции выраженного возрастного выворота века.
Выворот края века (син. эктропион) – заболевание, при котором веко отходит от глаза, вследствие чего обнажается пальпебральная и бульбарная конъюнктива. Практически всегда происходит выворот нижнего века. Даже при незначительной степени выворота нижнего века смещается нижняя слезная точка, что приводит к слезотечению. Эпителий пальпебральной части конъюнктивы нижнего века начинает ороговевать. Веко провисает, выворот нижней слезной точки приводит к слезостоянию и тягостному для пациентов постоянному слезотечению, развитию хронического блефарита и конъюнктивита. Выраженный лагофтальм может способствовать образованию язвы роговицы.
Различают следующие формы выворота края века: врожденный, возрастной, паралитический, рубцовый.
Врожденный выворот, особенно изолированный, – наиболее редко наблюдающаяся форма; обусловлен укорочением наружной – кожно–мышечиой – пластинки века. При невысокой степени дезадаптации века, как правило, нет необходимости хирургической коррекции.
Возрастной выворот – наиболее часто встречающаяся форма; вызывается чрезмерным растяжением связок век, что приводит к провисанию века. Лечение хирургическое – горизонтальное укорочение нижнего века (рис. 7.4). При изолированном вывороте нижней слезной точки амбулаторно производят вертикальное укорочение конъюнктивы и наложение швов, репонирующих нижнюю слезную точку.
Паралитический выворот наблюдается при параличе лицевого нерва, может произойти после денервации волокон круговой мышцы глаза (ботулотоксин). Лечение заключается в постоянном увлажнении глаза; на период лечения веки заклеивают. При длительно сохраняющейся патологии (более 6 мес) производят горизонтальное укорочение наружной связки века, при необходимости выполняют блефарорафию.
Рубцовый выворот развивается вследствие ожога, после травм и операций, при инфекциях кожи. В момент термического ожога плотное зажмуривание может предотвратить повреждение краев век. Лечение рубцового эктропиона сложное, как правило, длительное. В самые ранние сроки после появления выворота целесообразно произвести блефарорафии, а в отсроченный период может потребоваться свободная кожная пластика. Часто возникает необходимость в местном применении протеолитических ферментов, проведении физиотерапии. Прогноз при выполнении соответствующего вмешательства хороший, эффект, как правило, стабильный, но в тяжелых случаях возможны рецидивы.
Блефарохалазис – редкое заболевание, вызываемое повторяющимися отеками век, приводящими к нависанию атрофичной кожной складки. Заболевание начинается в период полового созревания с возникновения отеков, выраженность которых с годами уменьшается. Отеки приводят к истончению кожи наподобие папиросной бумаги. На верхнем веке формируется кожная складка, которая свисает на глазную щель, обусловливая косметический дефект и ограничение поля зрения сверху. Лечение заключается в удалении избыточной кожи, в случае необходимости выполняют пластику сухожилия мышцы, поднимающей верхнее веко.
Заболевания края век
Блефарит
Блефарит – двустороннее воспаление краев век, почти всегда имеющее хроническое течение и являющееся одним из наиболее часто встречающихся глазных заболеваний.В зависимости от этиологии выделяют инфекционные, воспалительные и невоспалительные блефариты. Инфекционный блефарит чаще бывает бактериальным (Staphylococcus aureus, S. epidermidis, Streptococcus pneumoniae, Haemophilus influenzae, Moraxella lacunata), возможно поражение вирусами (вирус простого герпеса, вирус опоясывающего герпеса, контагиозный моллюск), патогенными грибами (Pityrosporum ovale и Р. orbiculare), членистоногими (клещи – Demodex folliculorum humanis и D. brevis, вши – Phthirus pubis). Неинфекционный блефарит возникает при себорее, розовых угрях, экземе. Блефариты значительно чаще диагностируют у пожилых людей и при иммунодефиците различной этиологии (ВИЧ, иммуносупрессивнаяхимиотерапия).
По характеру течения блефарит может быть острым и хроническим.
Факторами, провоцирующими хроническое течение воспаления, служат аномалии рефракции (неадекватная коррекция при гиперметропии и астигматизме), синдром "сухого глаза", хронический конъюнктивит, заболевания желудочно–кишечного тракта (гастрит, колит и др.), эндокринной системы (сахарный диабет), а также воздействие аллергенов (включая лекарственные препараты), пыли, сухого воздуха, дыма.
В зависимости от локализации процесса выделяют патологию передней (передний краевой блефарит) и задней (задний краевой блефарит) пластины век. Передний краевой блефарит – местное проявление патологии кожи (себорея, розовые угри), сопровождается стафилококковой или иной инфекцией с формированием интрафолликулярных абсцессов. Задний краевой блефарит возникает как следствие дисфункции мейбомиевых желез.
Выделяют следующие основные клинические формы блефаритов: чешуйчатый, язвенный, задний (краевой), демодекозный.
Чешуйчатый (себорейный) блефарит имеет типичную симптоматику: появление большого количества мелких чешуек на коже края века и ресницах (наподобие перхоти). Пациент предъявляет жалобы на жжение, зуд, тяжесть век, быструю утомляемость глаз. Края век обычно гиперемированы, утолщены (рис. 7.5). Признаками прогрессирования воспалительного процесса являются сглаженность переднего и заднего ребер свободного края века и нарушение адаптации нижнего века к глазному яблоку. Чешуйчатый блефарит часто сочетается с хроническим конъюнктивитом и в ряде случаев сопровождается краевым кератитом. Заболевание обычно двустороннее, поэтому при длительно существующей односторонней патологии необходимо исключить опухолевое поражение века.
При чешуйчатом блефарите требуются ежедневные, аппликации с щелочными растворами для размягчения чешуек с последующей очисткой краев век смесью спирта с эфиром или раствором бриллиантового зеленого. Эту процедуру проводят слегка влажным ватным тампоном так, чтобы спирт не попал в конъюнктивальную полость. Кроме того, 1–2 раза в день на края век наносят глазную 0,5% гидрокортизоновую мазь (курс до 2–3 нед). В конъюнктивальную полость закапывают 0,25% раствор цинка сульфата.
Язвенный (стафилококковый) блефарит проявляется образованием гнойных корок, склеиванием ресниц, изъязвлением кожи краев век. При этой форме блефарита вовлечение в патологический процесс волосяных фолликулов (фолликулит) вызывает укорочение и ломкость ресниц, рубцевание края века, что в ряде случаев приводит к неправильному росту, поседению или потере ресниц. В тяжелых случаях проводят бактериологическое исследование мазка с поверхности язвы.
При язвенном блефарите очистку краев век осуществляют так же, как при чешуйчатой форме заболевания. Кроме того, при бактериальной инфекции 2–3 раза в день на края век накладывают мази, под действием которых корочки размягчаются, после чего их легче удалить; можно делать аппликации марлевых полосок, смоченных раствором антибиотика (0,3% раствор гентамицина), до 3 раз в день в течение 4 дней. Мазь с антибиотиком (тетрациклиновая, эритромициновая) выбирают в соответствии с результатами бактериологического исследования, часто применяют глазные мази, содержащие антибиотики и кортикостероиды ("Декса–Гентамицин", "Макситрол”). Возможно местное применение 0,25% раствора цинка сульфата, 0,3% раствора ципромеда.
Задний (краевой) блефарит, или дисфункция мейбомиевых желез, характеризуется местной или диффузной воспалительной реакцией: покраснением и утолщением краев век, образованием телеангиэктазий у закупоренных отверстий мейбомиевых желез, их гипо– или гиперсекрецией, скоплением желтовато–серого пенистого секрета в наружных уголках глазной щели и у заднего ребра свободного края век, гиперемией пальпебральной конъюнктивы, нарушением прекорнеальной пленки. При сдавливании края века между пальцем и стеклянной палочкой из мейбомиевых желез выходит пенистый секрет.
При дисфункции мейбомиевых желез требуется ежедневная обработка краев век по описанной ранее методике, использование спирта с эфиром, применение теплых щелочных примочек (2% раствор гидрокарбоната натрия) на 10 мин. Массаж век проводят стеклянной палочкой после однократного закапывания 0,5% раствора дикаина. Целесообразно смазывание краев век мазью "Декса–Гентамицин" или "Макситрол", а при упорном течении глазной 0,5% гидрокортизоновой мазью (до 2 нед).
Демодекозный блефарит характеризуется покраснением и утолщением краев век, наличием чешуек, корочек, белых муфт на ресницах. Клещ поселяется в просветах мейбомиевых желез, ресничных фолликул ах. Основная жалоба больных – зуд в области век. При подозрении на демодекозную природу блефарита с диагностической целью удаляют по пять ресниц с каждого века и укладывают их на предметное стекло. Диагноз демодекозного блефарита подтверждается при обнаружении личинок вокруг корня ресницы и шести или более подвижных клещей. Выявление меньшего количества особей свидетельствует только о носительстве (в норме среди здоровых лиц оно достигает 80%).
После чистки краев век смесью спирта с эфиром проводят массаж век, а затем на ночь свободные края век обильно смазывают нейтральными мазями (вазелин, видисикгель), а при сопутствующей бактериальной флоре используют комбинированные мази, содержащие антибиотик и кортикостероид ("Декса–Гентамицин", "Макситрол”) коротким курсом. Внутрь принимают противовоспалительные и десенсибилизирующие препараты, можно назначить трихопол.
Лечение блефарита обычно длительное, улучшение происходит очень медленно (требуется устранение причины развития заболевания). Проводят коррекцию аномалий рефракции, устранение неблагоприятных эндогенных и экзогенных факторов (фокальная инфекция, пыль, пары химических веществ), обследование и лечение у гастроэнтеролога, эндокринолога, дерматолога и аллерголога.
При постоянном лечении прогноз благоприятный, хотя клиническое течение заболевания затяжное, могут возникать частые рецидивы. Наиболее трудно добиться излечения стафилококкового блефарита, который может приводить к появлению ячменей, халазионов, деформаций краев век, трихиаза, хронического конъюнктивита и кератита.
Трихиаз
Трихиаз – неправильный рост ресниц передней пластины века, сопровождающийся раздражением роговицы и конъюнктивы, вторичным инфицированием.Трихиаз бывает врожденным и приобретенным. Он может развиться как следствие блефарита, а может быть вызван щелочным ожогом, рубцовым пемфигоидом, трахомой или опухолью. Клинически проявляется слезотечением, ощущением инородного тела, поверхностным точечным кератитом.
Для защиты роговицы можно использовать мягкие контактные линзы. После обычной эпиляции ресницы вырастают вновь в полную величину через 10 нед. При ограниченных поражениях для разрушения нескольких неправильно растущих ресниц применяют электролиз волосяных луковиц, а при обширных проводят пластику края века. Прогноз благоприятный, но зависит от этиологии процесса. Возможно рецидивирование.
Отек век
Отек век – часто встречающееся в клинической практике состояние аномально увеличенного содержания жидкости в подкожной клетчатке век.Развитию отека века способствуют высокая растяжимость кожи, чрезвычайно рыхлая структура подкожной жировой клетчатки, ее способность накапливать жидкость, богатое кровоснабжение век. Системная патология (заболевания сердца, почек, щитовидной железы) и местные факторы: травма, укус насекомого (рис. 7.6), нарушение лимфооттока, затек черепно–мозговой жидкости, приводят к появлению отека век.
Отек век может быть воспалительным и невоспалительным (пассивным).
Воспалительный отек век развивается при следующих заболеваниях: воспалении самих век (ячмень, блефарит, целлюлит, абсцесс, контактный дерматит, укус насекомого), конъюнктивы (острый гнойный, мембранозный и псевдомембранозный конъюнктивит), слезного мешка (острый дакриоцистит, флегмона слезного мешка), слезной железы, орбиты (абсцесс, псевдотумор), глазного яблока (острый иридоциклит, эндофтальмит). Реактивные отеки отмечаются при воспалениях околоносовых пазух.
Воспалительный отек клинически проявляется выраженным покраснением кожи, повышением местной температуры, болезненностью при пальпации, обычно бывает односторонним. В ряде случаев отмечаются увеличение и болезненность лимфатических узлов.
Плотный отек век возникает при повторяющихся обострениях рожистого воспаления, клинически проявляется большей плотностью тканей.
При невоспалительном отеке кожа век бледная, "холодная", пальпация века безболезненная. Отек, как правило, двусторонний, более выражен по утрам, часто сочетается с отеком ног и асцитом.
Аллергический (ангионевротический) отек обычно односторонний, значительно выраженный, появляется внезапно, не сопровождается болями и быстро исчезает. Развитию отека часто предшествуют головная боль, чувство разбитости, повышенная утомляемость. Причиной его развития является аллергическая реакция сенсибилизированного организма на какой–либо раздражитель, как специфический (лекарственный препарат, молоко, цитрусовые, шоколад, пыльца цветов), так и неспецифический (охлаждение). Значительное расширение капилляров обусловливает их повышенную проницаемость.
Лечение заключается в устранении причины возникновения отека или контакта с раздражителем.
Прогноз зависит от причины возникновения отека.
Невоспапительный (пассивный) отек век развивается вследствие воздействия локальных (травма головы, ангионевротический отек) и общих (сердечная или почечная недостаточность, гипопротеинемия, выраженная анемия) факторов.
Гнойные воспаления век
Пресептальный целлюлит
Пресептальный целлюлит – разлитое воспаление тканей века (флегмона века). При этом заболевании воспаление затрагивает только ткани века, расположенные кпереди от глазничной перегородки, и не распространяется на структуры орбиты. Целлюлит чаще развивается у детей до 3 лет, перенесших воспаление верхних дыхательных путей или средний отит; возбудителем заболевания обычно является Haemophilus influenzae. У взрослых целлюлит развивается как осложнение ячменя (рис. 7.7), при абсцессе века, распространении инфекции с тканей лица, из орбиты, околоносовых пазух, а также после ранений, операций, укусов насекомых и животных; обычно вызывается Staphylococcus aureus или смешанной флорой.Объективно определяются покраснение кожи и плотный отек всего века, при пальпации отмечается болезненность. Зрение и зрачковые реакции не нарушаются. Обычно заболевание протекает с высокой температурой, головной болью, отмечается болезненность регионарных лимфатических узлов. Появление экзофтальма, смешения и ограничения подвижности глазного яблока, двоения, хемоза, нарушения зрения, тяжелое состояние пациента свидетельствует о распространении воспаления на ткани орбиты (орбитальный целлюлит). При локализации процесса в области медиального угла глазной щели возможно развитие тромбоза кавернозного синуса, менингоэнцефалита, а также сепсиса со смертельным исходом.
Дифференциальную диагностику проводят с аллергическим отеком век, тяжелым блефароконъюнктивитом, дакриоаденитом, травмой, блефарохалазисом, тиреоидной офтальмопатией.
Лечение консервативное. Применяют антибиотики внутрь и внутримышечно (клафоран). При появлении флюктуации абсцесс века вскрывают.
В случае отсутствия осложнений прогноз хороший. В связи с грубым рубцеванием в отсроченный период может потребоваться пластика век.
Абсцесс века
Абсцесс века – ограниченный болезненный очаг инфильтративно–гнойного воспаления. Часто развивается после незначительных повреждений кожи, укусов насекомых, при воспалениях околоносовых пазух, после выдавливания ячменя. Клинически абсцесс (рис. 7.8) характеризуется разлитой гиперемией кожи и плотным отеком, птозом века, хемозом, припухлостью и болезненностью регионарных лимфатических узлов. В дальнейшем кожа века истончается, появляется флюктуация. В большинстве случаев температура тела не повышается, изменений в крови при клиническом анализе не выявляют. Возможно самопроизвольное вскрытие абсцесса. У ослабленных людей развитие сепсиса, гнойное метастазирование могут привести к смертельному исходу. При локализации абсцесса в медиальной части века возможно развитие орбитального целлюлита или тромбоза кавернозного синуса.Дифференциальную диагностику проводят с пресептальным целлюлитом и поднадкостничным абсцессом (смещение глазного яблока). Диагноз подтверждают результаты рентгеновской компьютерной томографии.
Лечение такое же, как при целлюлите. Местно – сухое тепло, физиотерапия, дезинфицирующие капли в конъюнктивальный мешок. При необходимости лечение проводят совместно с ЛОРспециалистом. Антибиотики принимают внутрь и вводят внутривенно. Вскрытие абсцесса производят при появлении флюктуации или получении томографически подтвержденных данных о наличии абсцесса.
Прогноз, как.правило, хороший.
Заболевания желез век
Ячмень
Ячмень – острое болезненное гнойное воспаление мейбомиевых желез или других желез края века. Часто вызывается Staphylococcus aureus. Наружный ячмень – острое бактериальное воспаление сальных или потовых желез с формированием локального абсцесса. Внутренний ячмень, или мейбомит, возникает при гнойном воспалении мейбомиевых желез. Ячмень часто возникает на фоне диабета, хронических желудочно–кишечных заболеваний и сочетается с вульгарными угрями, гиповитаминозом и иммунодефицитом.В начале заболевания при зажмуривании появляется ощущение дискомфорта у свободного края века, пальпация этого участка болезненна. С появлением инфильтрата у края века нарастает отек. Интенсивность боли обычно соответствует степени выраженности отека. Ко 2–3–му дню появляется гнойная "головка" в области болезненного воспаленного ресничного края века. На 4–й день "головка" вскрывается с выделением некротического "стержня" и гноя. После самопроизвольного вскрытия к концу недели симптомы (отек, гиперемия) быстро исчезают.
Наружный ячмень располагается на крае века, где находятся потовые железы век. Внутренний ячмень можно увидеть только при вывороте века. Вокруг ячменя конъюнктива воспалена, отечна. Возможны увеличение и болезненность околоушных лимфатических узлов. Выдавливание ячменя очень опасно, так как может привести к развитию орбитального целлюлита, тромбоза вен орбиты, тромбоза кавернозного синуса и гнойного менингита (очень редко).
Ячмень дифференцируют с халазионом (при пальпации плотный) и дакриоаденитом (другая локализация очага воспаления).
Лечение консервативное: капли и мази с антибиотиками, сухое тепло. Применение "влажного тепла" недопустимо, так как оно провоцирует появление новых абсцессов. При рецидивирующем характере заболевания назначают общеукрепляющую терапию, биодобавку "Пивные дрожжи", целесообразно обследование у эндокринолога, гастроэнтеролога, дерматолога.
Прогноз хороший.
Халазион
Халазион – безболезненное округлое образование плотноэластической консистенции в тарзальной пластинке века, не спаянное с кожей.
 Рис. 7.9. Операция удаления халазиона.
а – разрез со стороны конъюнктивы; б – Удаление содержимого ложечкой.
Рис. 7.9. Операция удаления халазиона.
а – разрез со стороны конъюнктивы; б – Удаление содержимого ложечкой.
Халазион (рис. 7.9) – хроническое гранулематозное воспаление, вызванное закупоркой выводного протока мейбомиевой железы. Вначале Р^тенционная киста медленно увеличивается, а затем формируется плотная капсула. Халазион обычно не вызывает болезненных ощущений, но представляет собой косметический недостаток. Возможно одновременное возникновение нескольких халазионов на верхних и нижних веках.
От ячменя халазион отличается большей плотностью. Кожа над ним легко смещается, цвет ее не изменен. При рецидивирующих быстрорастущих халазионах требуется дифференциальная диагностика с аденокарциномой мейбомиевой железы. Медленное (в течение нескольких месяцев) увеличение образования, его спаянность с тарзальной пластинкой, интактная кожа дают основание без затруднений установить диагноз халазиона.
При лечении халазиона в начальной стадии применяют местные инъекции кеналога, дексаметазона или протеолитических ферментов, однако радикальным является хирургическое лечение. Разрез пальпебральной конъюнктивы производят перпендикулярно краю века (рис. 7.10, а), халазион удаляют в капсуле. В случае вскрытия капсулы ее содержимое удаляют острой ложечкой (рис. 7.10, б). Обязательно выполняют полное иссечение капсулы и ее гистологическое исследование (с целью исключения аденокарциномы).
Прогноз хороший. Возможно образование новых халазионов.
Заболевания, сопровождающиеся нарушением функций круговой мышцы глаза
Лагофтальм
Лагофтальм – неполное смыкание глазной щели. Причины его возникновения – поражение лицевого нерва, ретракция, рубцие век, экзофтальм, симблефарон. Поражение лицевого нерва может быть врожденным, идиопатическим (паралич Белла), развиться как следствие охлаждения, заболевания уха, травмы, операции, опухоли, менингита, ВИЧ–инфекции и других заболеваний.Объективно глазная щель на стороне поражения заметно шире, нижнее веко опущено и отстает от глазного яблока. Вследствие выворота нижнего века и слезной точки появляется слезотечение. Из–за несмыкания век глаз открыт во время сна. Постоянный или временный лагофтальм приводит к развитию сухости глаза, возникают дистрофии роговицы, кератиты, язвы роговицы (рис. 7.11).
Лечение зависит от причины возникновения лагофтальма. При параличе лицевого нерва проводят лечение у невролога под постоянным наблюдением офтальмолога. Местное лечение на начальном этапе направлено на увлажнение роговицы (искусственная слеза, 20% раствор сульфацил–натрия, облепиховое масло, мази с антибиотиками, особенно на ночь) и уменьшение слезотечения (веко временно подтягивают пластырем). Латеральное и медиальное сшивание век производят в процессе лечения как при временном, так и при стойком лагофтальме, чтобы избежать поражения роговицы. С целью функциональной реабилитации вводят золотые имплантаты в верхнее веко, а также осуществляют горизонтальное укорочение нижнего века, чтобы подтянуть его к глазному яблоку.
Прогноз, как правило, благоприятный, но при наличии язвы роговицы он значительно ухудшается.
Эссенциальный блефароспазм
Эссенциальный блефароспазм – идиопатическое прогрессирующее заболе ван ие, со провожд ающееся непроизвольными тоническими спастическими сокращениями круговых мышц век обоих глаз продолжительностью от нескольких секунд до нескольких минут и с годами приводящее к полному закрытию век. Причина развития заболевания неизвестна, предполагается центральный генез поражения. Заболевание обычно возникает у лиц старше 50 лет, часто сопряжено с болезнью Паркинсона. Женщины заболевают в 3 раза чаще.Спазмы практически всегда двусторонние, обычно начинаются с легких подергиваний, с течением времени могут перейти в контрактуры и спазмы мышц верхней части лица. В тяжелых случаях заболевание может прогрессировать до тех пор, пока пациент не становится практически слепым. Провоцирующими факторами являются стрессы, яркий свет, зрительная нагрузка.
Дифференциальную диагностику проводят с гемифациальным спазмом, для уточнения диагноза требуется проведение МРТ или МРТ–ангиографии. Невралгия тройничного нерва, экстрапирамидальные заболевания (энцефалит, рассеянный склероз), психогенные состояния также могут сопровождаться блефароспазмом. Дифференцируют от рефлекторного блефароспазма, возникающего при стимуляции ветвей тройничного нерва (язва роговицы, инородное тело в роговице, иридоциклит).
Лечение может быть консервативным и хирургическим. Медикаментозные способы лечения эссенциального блефароспазма, как правило, малоэффективны. Методом выбора являются местные инъекции токсина ботулизма (тип А), который вызывает временный паралич круговой мышцы глаза. Хирургическое лечение (миоэктомия) проводят при непереносимости ботулотоксина или неэффективности лечения этим препаратом.
Эссенциальный блефароспазм в целом плохо поддается лечению, рецидив заболевания после инъекции ботулотоксина возникает через 3–4 мес, в связи с чем требуется проведение повторных курсов инъекций.
Глава 8. Слезные органы
Ты плачешь – светятся слезойРесницы синих глаз.Фиалка, полная росой,Роняет свой алмаз.
Строение и функции слезных органов
Слезные органы являются частью придаточного аппарата глаза, защищающего глаза от внешних влияний и предохраняющего конъюнктиву и роговицу от высыхания. Слезные органы продуцируют и отводят слезную жидкость в полость носа; они состоят из слезной железы, добавочных мелких слезных железок и слезоотводящих путей (рис. 8.1).Слезная жидкость, вырабатываемая слезными железами, имеет большое значение для нормальной функции глаза, так как увлажняет роговицу и конъюнктиву. Идеальная гладкость и прозрачность роговицы, правильное преломление лучей света у ее передней поверхности обусловлены наряду с другими факторами наличием тонкого слоя слезной жидкости, покрывающей переднюю поверхность роговицы. Слезная жидкость способствуют также очищению конъюнктивальной полости от микроорганизмов и инородных тел, предотвращают высыхание поверхности, обеспечивают ее питание.
 Рис. 8.1. Топография слезных органов.
Рис. 8.1. Топография слезных органов.
Орбитальная часть слезной железы закладывается у эмбриона в возрасте 8 нед. К моменту рождения слезная жидкость почти не выделяется, так как слезная железа еще недостаточно развита. У 90% детей лишь ко 2–му месяцу жизни начинается активное слезоотделение. Слезоотводящий аппарат формируется с 6–й недели эмбриональной жизни. Из глазничного угла носослезной борозды в соединительную ткань погружается эпителиальный тяж, который постепенно отшнуровывается от нервоначального эпителиального покрова лица. К 10–й неделе этот тяж достигает эпителия нижнего носового хода и на 11–й неделе превращается в выстланный эпителием канал, который сначала заканчивается слепо и через 5 мес открывается в носовую полость. Около 35% детей рождаются с закрытым мембраной выходным отверстием носослезного прбтока. Если в первые недели жизни ребенка эта мембрана не рассасывается, может развиться дакриоцистит новорожденных, требующий манипуляций для создания проходимости слезы по каналу в нос.
Слезная железа состоит из 2 частей: верхней, или глазничной (орбитальной), части и нижней, или вековой (пальпебральной), части. Они разделены широким сухожилием мышцы, поднимающей верхнее веко. Глазничная часть слезной железы расположена в ямке слезной железы лобной кости на латерально–верхней стенке глазницы. Сагиттальный размер ее 10–12 мм, фронтальный – 20–25 мм, толщина – 5 мм. В норме орбитальная часть железы недоступна наружному осмотру. Она имеет 3–5 выводных канальцев, проходящих между дольками вековой части, открывающимися в верхнем своде конъюнктивы сбоку на расстоянии 4–5 мм от верхнего края тарзальной пластинки верхнего хряща века. Вековая часть слезной железы значительно меньше глазничной, расположена ниже ее под верхним сводом конъюнктивы с темпоральной стороны. Размер вековой части 9–11·7–8 мм, толщина – 1–2 мм. Ряд выводных канальцев этой части слезной железы впадает в выводные канальцы орбитальной части, а 3–9 канальцев открываются самостоятельно. Множественные выводные канальцы слезной железы создают подобие своеобразного "душа", из отверстий которого слеза поступает в конъюнктивальную полость.
Слезная железа принадлежит к сложнотрубчатым серозным железам; структура ее подобна околоушной железе. Выводные канальцы большего калибра выстланы двухслойным цилиндрическим эпителием, а меньшего калибра – однослойным кубическим эпителием. Помимо основной слезной железы, имеются мелкие добавочные трубчатые слезные железки: в своде конъюнктивы – конъюнктивальные железы Краузе и у верхнего края хряща век, в орбитальной части конъюнктивы – железы Вальдейера. В верхнем своде конъюнктивы насчитывается 8–30 добавочных железок, в нижнем – 2–4. Слезную железу удерживают собственные связки, прикрепляющиеся к надкостнице верхней стенки орбиты. Железу укрепляют также связка Локвуда, подвешивающая глазное яблоко, и мышца, поднимающая верхнее веко. Снабжается кровью слезная железа от слезной артерии – ветви глазничной артерии. Отток крови происходит через слезную вену. Слезная железа иннервируется веточками первой и второй ветви тройничного нерва, ветвями лицевого нерва и симпатическими волокнами от верхнего шейного узла. Основная роль в регуляции секреции слезной железы принадлежит парасимпатическим волокнам, входящим в состав лицевого нерва. Центр рефлекторного слезоотделения находится в продолговатом мозге. Кроме того, имеется еще ряд вегетативных центров, раздражение которых усиливает слезоотделение.
Слезоотводящие пути начинаются слезным ручьем. Это капиллярная щель между задним ребром нижнего века и глазным яблоком. По ручью слеза стекает к слезному озеру, расположенному у медиального узла глазной щели. На дне слезного озера имеется небольшое возвышение – слезное мясцо. В слезное озеро погружены нижняя и верхняя слезные точки. Они находятся на вершинах слезных сосочков и в норме имеют диаметр 0,25 мм. От точек берут начало нижний и верхний слезные канальцы, которые сначала идут соответственно вверх и вниз на протяжении 1,5 мм, а затем, загибаясь под прямым углом, направляются к носу и впадают в слезный мешок, чаще (до 65%) общим устьем. На месте их впадения в мешок сверху образуется пазуха – синус Майера; имеются складки слизистой оболочки: снизу – клапан Гушке, сверху – клапан Розенмюллера. Длина слезных канальцев – 6–10 мм, просвет – 0,6 мм.
Слезный мешок располагается позади внутренней связки век в слезной ямке, образованной лобным отростком верхней челюсти и слезной костью. Окруженный рыхлой клетчаткой и фасциальным футляром мешок на ⅔ подымается над внутренней связкой век своим сводом, а внизу переходит в носослезный проток. Длина слезного мешка 10–12 мм, ширина – 2–3 мм. Стенки мешка состоят из эластических и вплетающихся в них мышечных волокон вековой части круговой мышцы глаза – мышцы Горнера, сокращение которой способствует присасыванию слезы.
Носослезный проток, верхняя часть которого заключена в костный носослезный канал, проходит в латеральной стенке носа. Слизистая оболочка слезного мешка и носослезного протока нежная, имеет характер аденоидной ткани, выстлана цилиндрическим, местами мерцательным эпителием. В нижних отделах носослезного протока слизистая оболочка окружена густой венозной сетью по типу кавернозной ткани. Носослезный проток длиннее костного носослезного канала. У выхода в нос имеется складка слизистой оболочки – слезный клапан Гаснера. Открывается носослезный проток под передним концом нижней носовой раковины на расстоянии 30–35 мм от входа в полость носа в виде широкого или шелевидного отверстия. Иногда носослезный проток проходит в виде узкого канальца в слизистой оболочке носа и открывается в стороне от отверстия костного носослезного канала. Два последних варианта строения носослезного протока могут стать причиной риногенных нарушений слезоотведения. Длина носослезного протока – от 10 до 24 мм, ширина – 3–4 мм.
Во время бодрствования человека за 16 ч добавочными слезными железками выделяется 0,5–1 мл слезы, т. е. столько, сколько требуется для увлажнения и очистки поверхности глаза; орбитальная и вековая части железы включаются в работу только при раздражении глаза, полости носа, при плаче и т. п. При сильном плаче может выделиться до 2 чайных ложек слез.
В основе нормального слезоотведения лежат следующие факторы: ■ капиллярное засасывание жидкости в слезные точки и слезные канальцы ■ сокращение и расслабление круговой мышцы глаза и мышцы Горнера, создающих отрицательное капиллярное давление в слезоотводящей трубке ■ наличие складок слизистой оболочки слезоотводящих путей, играющих роль гидравлических клапанов.
Слезная жидкость прозрачная или слегка опалесцирующая, со слабощелочной реакцией и средней относительной плотностью 1,008. Она содержит 97,8% воды, остальную часть составляют белок, мочевина, сахар, натрий, калий, хлор, эпителиальные клетки, слизь, жир, бактериостатический фермент лизоцим.
Методы исследования
Вековая часть слезной железы доступна осмотру. Ее исследуют с помощью пальпации и путем осмотра при вывернутом верхнем веке.Функциональные исследования слезоотводящих путей включают канальцевую пробу, которую выполняют для проверки присасывающей функции слезных точек, канальцев и мешка, и носовую пробу – для определения степени проходимости всей слезоотводящей системы. В норме 1 капля 3% колларгола, введенная в конъюнктивальную полость, быстро всасывается (до 5 мин – положительная канальцевая проба) и оказывается в нижнем носовом ходе (до 10 мин – положительная носовая проба), о чем свидетельствует окрашивание введенной в нижний носовой ход ватки, намотанной на зонд. Пассивную проходимость слезоотводящих путей определяют зондированием слезных канальцев и мешка зондом Боумена № 1 и промыванием их через верхнюю или нижнюю слезные точки при помощи канюли и шприца. Голову обследуемого наклоняют немного вперед. В норме жидкость (раствор фурацилина 1:5.000, изотонический раствор натрия хлорида и т. д.) вытекает из соответствующей половины носа.
Дакриоцисторентгенография позволяет получить наиболее ценную информацию об уровне и степени нарушения проходимости слезоотводящих путей (рис. 8.2). Для этого через канюлю, проведенную через слезный каналец и слезный мешок, медленно вводят теплый масляный контрастирующий раствор, обычно 0,5 мл йодолипола. Сразу же после введения выполняют два рентгеновских снимка в окципитофронтальной и битемпоральной проекциях.
 Рис. 8.2. Дакриоцисторентгенограмма, окципитофронталъная проекция. Справа – нормальные слезоотводящие пути, слева – непроходимость носослезного протока. Дакриоцистит.
Рис. 8.2. Дакриоцисторентгенограмма, окципитофронталъная проекция. Справа – нормальные слезоотводящие пути, слева – непроходимость носослезного протока. Дакриоцистит.
Ринологическое исследование дает возможность выявить разнообразные патологические изменения и анатомические особенности строения полости носа и его придаточных пазух, а также выбрать оптимальный вариант последующего лечения.
Заболевания и травмы слезных органов
Патология слезных органов может быть следствием аномалий развития, повреждения, заболеваний и опухолевых разрастаний как слезопродуцирующего, так и слезоотводящего аппарата.Заболевания слезоотводящих путей – одно из частых страданий придаточного аппарата глаза. Диапазон жалоб – от легкого периодического слезотечения до постоянного непрекpащающегося выделения гноя из слезного мешка и флегмоны окружающей его клетчатки, осложняющемся долго не заживающей фистуле.
Слезостояние является косметическим недостатком. а при гнойном воспалении слезоотводящих путей представляет угрозу для самого глаза, в частности, для роговины с последующим нарушением зрения. Наиболее тяжелое и распространенное хроническое воспаление слезного мешка – дакриоцистит – встречается к основном в возрасте 30–60 лет, у женщин – в 8–10 раз чаше.
Патология слезопродуцирующего аппарата
Пороки развития слезной железы проявляются ее недостаточным развитием, отсутствием и смещением.Отсутствие или недостаточное развитие слезной железы приводит к тяжелым и часто необратимым изменениям в переднем отрезке глаза – ксерозу и потере зрения. Лечение – хирургическая пересадка в наружным отдел конъюнктивальной полости протока околоушной железы (стенонов проток). Это возможно потому, что биохимический состав слюны и слезы сходен. Смешение слезной железы происходит при ослаблении поддерживающих железу связок. Лечение оперативное – укрепление слезной железы в своем ложе. Прогноз благоприятный.
Повреждения слезной железы редки, наблюдаются обычно при повреждениях машины, верхнего века. Хирургическое вмешательство требуется лишь при значительном разрушении железы, выпадении ее в рану.
Острое воспаление слезной железы бывает редко, чаще с одной стороны. Возникает как осложнение общей инфекции – гриппа, ОРЗ, ангины, эпидемического паротита и т. д. Характеризуется режим припуханием, болезненностью и гиперемией наружном части верхнего иска, повышенной температуре тела, головной болью, общим недомоганием. Отмечаются гиперемия и отек конъюнктивы глазного яблока. Глаз может быть смещен, подвижность ею ограничена. Часто наблюдаются увеличение и болезненность околоушных лимфатических узлов.
Лечение: антибиотики. сульфаниламилы, десенсибилизирующие средства, анальгетики, жаропонидающие препараты, сухое тепло, УВЧ–терапия. При абсцедировании гнойник вскрывают и очаг дренируют.
Новообразования слезной железы встречаются редко. Из доброкачественных чаше обнаруживают смешанные опухоли. Они проявляются односторонним постепенным безболезненным увеличением железы, небольшим смешением глаза кнутри и книзу. Расстройства зрения редки. Смешанные опухоли в 4–10% случаев перерождаются в злокачественные. В этом случае опухоль прорастает окружаюшие ткани. фиксирует глазное яблоко, вызывает сильную боль; нарушается зрение, возникают отдаленные метастазы. Лучевое и хирургическое лечение не всегда оказывается успешным, поэтому прогноз всегда серьезен.
Гиперфункция слезных желез проявляется слезотечением при нормальном состоянии слсзоотводяшего аппарата вследствие различных рефлекторных раздражении. Повышенное слезоотделение (слезотечение, или эпифора) может быть вызвано ярким светом, ветром, холодом и т. д. (например, раздражение слизистой оболочки носа, конъюнктивы), но может быть вызвано воспалительной реакцией самой железы При постоянном слезотечении необходим осмотр отоларинголога для выявления и лечения специфической патологии в полости носа и его придаточных пазухах. Если слезотечение стойкое и не поддается консервативному лечению, го иногда проводят инъекции спирта в слезную железу, нектрокоагуляцию или частичную аденотомию, блокаду крылонебного узла.
Гипофункция слезной железы (синдром Шегрена) является заболеванием с более тяжелыми последствиями.
Относится к коллагенозамм. Характеризуется гипофункцией слезных, – ионных и потовых желез. Чаще встречается у женщин в климактерическом возрасте, протекает с обострениями и ремиссиями. Клинически проявляется как сухой кератоконъюнктивит. Патология обычно билатеральная. Больных беспокоят зуд, ощущение инородного тела в глазу, светобоязнь, сухость в глотке. Конъюнктива век гиперемирована с сосочковой гипертрофией и тягучим "нитчатым" секретом. Роговица в нижнем отделе матовая, шершавая.
Лечение должно быть комплексным у врача–ревматолога и окулиста. Используют в основном кортикостероиды и цитостатики. Местное лечение сухого кератоконъюнктивита – кортикостероиды, гель "Актовегина", заменители слезы – 0,25% лизоцим, капли "Витасик", "Гелевые слезы” (США). Предложена блокировка слезных канальцев для удержания слезы в конъюнктивальной полости с помощью пробок Геррика и т. д.
Патология слезоотеодящего аппарата
Сужение нижней слезной точки – одна из частых причин упорного слезотечения. О сужении слезной точки можно говорить при ее диаметре меньше 0,1 мм. Если не удается расширить диаметр слезной точки позорным введением конических зондов. то возможна операция – увеличение ее просвета иссечением небольшого треугольного или квадратною лоскута из задней стенки начальной части канальца (рис. 8.3). Рис. 8.3. Активация нижней слезной точки.
Рис. 8.3. Активация нижней слезной точки.
Выворот нижней слезной точки бывает врожденным или приобретенным. может возникнуть при хроническом блефароконъюнктивите, старческой атонии век и т. д. Слезная точка не погружена в слезное озеро, а повернута кнаружи. В легких случаях выворот можно устранить за счет иссечения лоскутов слизистой оболочки конъюнктивы под нижней слезной точкой с последующим наложением стягивающих швов (рис. 8.4). В тяжелых случаях проводят пластические операции, одновременно устраняющие выворот нижнего века.
Непроходимость слезных канальцев развивается чаще вследствие воспаления слизистой оболочки век и канальцев при конъюнктивитах. Небольшие по протяженности (1–1,5 мм) облитерации можно устранить зондированием с последующим введением с помощью зонда Алексеева в просвет канальца на несколько недель бужирующих нитей и трубочек.
При неустранимом нарушении функции нижнего слезного канальца показана операция – активация верхнего слезного канальца. Суть операции заключается в том, что, начиная от верхней слезной точки, иссекают полоску внутренней стенки канальца до внутреннего угла глазной щели. При этом слеза из слезного озера будет сразу попадать во вскрытый верхний слезный каналец, что позволит предупредить слезостояние.
 Рис. 8.4. Устранение выворота нижней слезной точки по Шарц. а – наложение швов на края раны; б – завязывание среднего шва на валике.
Рис. 8.4. Устранение выворота нижней слезной точки по Шарц. а – наложение швов на края раны; б – завязывание среднего шва на валике.
Воспаление канальца (дакриоканаликулит) чаще возникает вторично на фоне воспалительных процессов глаз, конъюнктивы. Кожа в области канальцев воспаляется. Отмечаются выраженное слезотечение, слизистогнойное отделяемое из слезных точек. Для грибковых каналикулитов характерно сильное расширение канальца, заполненного гноем и грибковыми конкрементами. Лечение каналикулитов консервативное в зависимости от вызвавших причин. Грибковые каналикулиты лечат расщеплением канальца и удалением конкрементов с последующим смазыванием стенок вскрытого канальца настойкой йода и назначением нистатина.
Повреждения слезных канальцев возможны при травме внутренней части век. Необходима своевременная хирургическая обработка, иначе возникнет не только косметический дефект, но и слезотечение. Во время первичной хирургической обработки раны сопоставляют края поврежденного нижнего слезного канальца, для чего проводят зонд Алексеева через нижнюю слезную точку и каналец, устье слезных канальцев, верхний слезный каналец и выводят его конец из верхней слезной точки (рис. 8.5, а). После введения в ушко зонда силиконового капилляра зонд извлекают обратным движением и его место в слезоотводящих путях занимает капилляр. Кососрезанные концы капилляра фиксируют одним швом – образуется кольцевая лигатура. На мягкие ткани в месте их разрыва накладывают кожные швы (рис. 8.5, б). Кожные швы снимают через 10–15 дней, кольцевую лигатуру удаляют через несколько недель.
Врожденный дакриоцистит. Основная его причина состоит в том, что к моменту рождения не открывается (вследствие аномалии развития) носовое устье носослезного протока, которое в таких случаях заканчивается слепым мешком. Через несколько дней после рождения появляется незначительное слизисто–гнойное отделяемое из конъюнктивального мешка. У детей заболевания слезоотводящих путей часто бывают причиной хронических конъюнктивитов, флегмоны слезного мешка и орбиты, поражения роговицы, септикопиемии и т. д. Неизлеченные дакриоциститы постепенно приводят к необратимым анатомическим изменениям слезных путей, которые со временем исключают успех консервативного лечения.
 Рис. 8.5. Устранение повреждений нижнего слезного канальца.
в – через верхнюю слезную точку зондом Алексеева вводят силиконовый капилляр; б – фиксация капилляра в виде кольцевой лигатуры. Швы на кожу.
Рис. 8.5. Устранение повреждений нижнего слезного канальца.
в – через верхнюю слезную точку зондом Алексеева вводят силиконовый капилляр; б – фиксация капилляра в виде кольцевой лигатуры. Швы на кожу.
Лечение рекомендуется начинать с энергичного массажа слезного мешка снаружи у внутреннего угла глазной щели сверху вниз. От толчкообразного надавливания на содержимое слезного мешка разрывается мембрана, закрывающая выход из носослезного протока, и восстанавливается проходимость слезоотводящих путей. При отсутствии положительного эффекта переходят к эндоназальному ретроградному зондированию, которое надо начинать с двухмесячного возраста. Без анестезии под контролем зрения хирургический пуговчатый зонд, изогнутый на конце под прямым углом, вводят по дну носа до половины длины нижнего носового хода (рис. 8.6). При выведении пуговчатого зонда плотно прижимают к своду нижнего носового хода отогнутый конец зонда и перфорируют препятствие в устье носослезного протока, затем зонд извлекают. После зондирования промывают слезные пути раствором антибиотика. Это ускоряет процесс восстановления нормального слезоотведения. При отсутствии эффекта повторные зондирования проводят с интервалом 5–7 дней. Трехкратное зондирование оправдано до 6–месячного возраста. Отсутствие эффекта от ретроградного зондирования заставляет переходить к лечению зондированием снаружи зондом Боумена № 0 или № 1. После расширения слезной точки коническим зондом вводят горизонтально зонд Боумена по канальцу в мешок, затем переводят его в вертикальное положение и продвигают вниз по носослезному протоку, перфорируя в нижней его частинерассосавшуюся к моменту рождения мембрану. При отсутствии эффекта и от этого лечения детям старше 2 лет производят дакриоцисториностомию (см. ниже).
Острый гнойный дакриоцистит, или флегмона слезного мешка, – это гнойное воспаление слезного мешка и окружающей его клетчатки. Заболевание может развиться и без предшествующего хронического воспаления слезоотводящих путей при проникновении инфекции из воспалительного очага на слизистой оболочке носа или в околоносовых пазухах.
При флегмоне слезного мешка в области внутреннего угла глазной щели и на соответствующей стороне носа или щеки появляются краснота кожи и плотная резко болезненная припухлость. Веки становятся отечными, глазная щель сужается или глаз закрывается полностью. Распространение воспалительного процесса на окружающую мешок клетчатку сопровождается бурной общей реакцией организма (повышение температуры, нарушение общего состояния, слабость и т. п.). В разгар воспаления назначают антибиотики, сульфаниламиды, обезболивающие и жаропонижающие препараты. Постепенно инфильтрат становится мягче, формируется абсцесс. Флюктуирующий абсцесс вскрывают и гнойную полость дренируют. Абсцесс может вскрыться самостоятельно, после чего воспалительные явления постепенно стихают. Иногда на месте вскрывшегося гнойника остается незаживающий свищ, из которого выделяются гной и слеза. После перенесенного острого дакриоцистита появляется тенденция к повторным вспышкам флегмонозного воспаления. Чтобы этого не допустить, в спокойном периоде выполняют радикальную операцию – дакриоцисгориностомию (см. ниже).

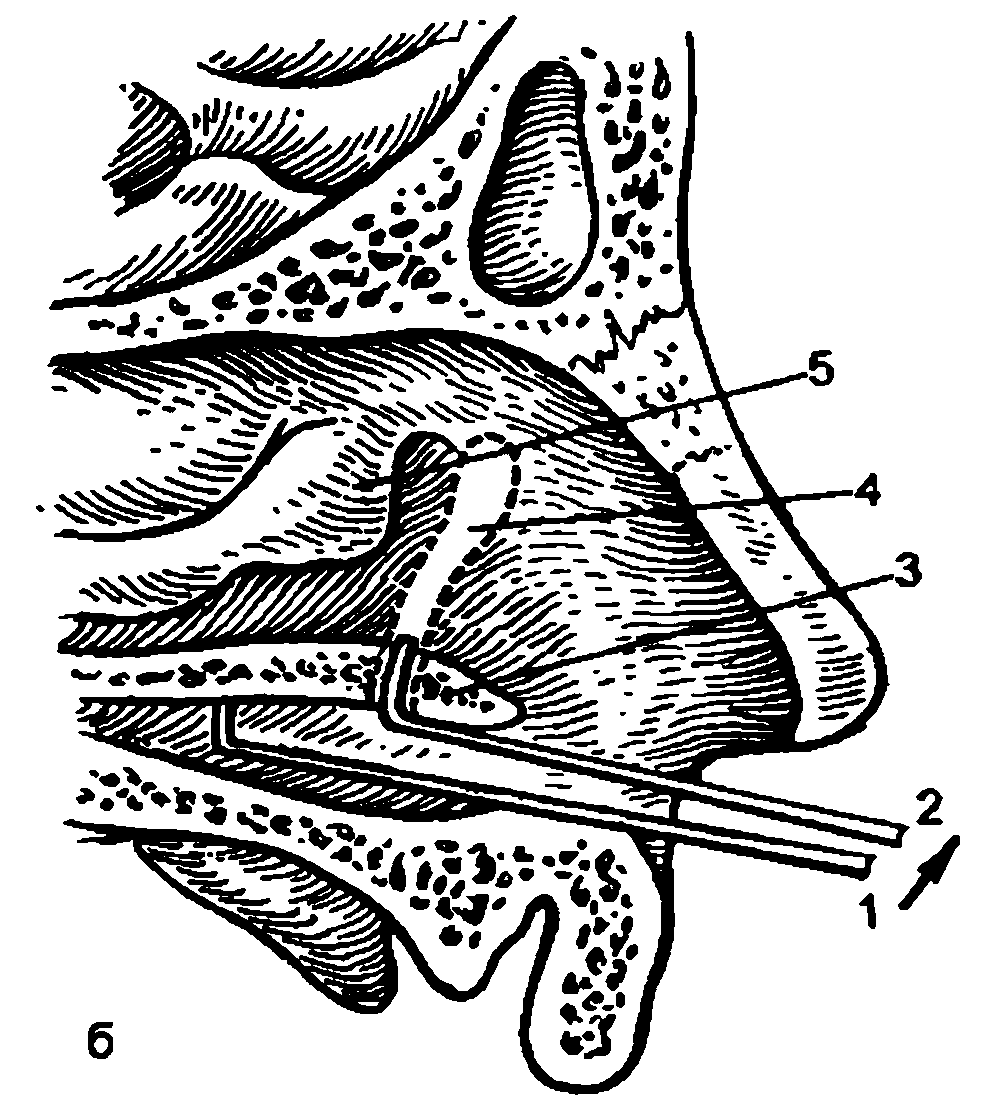 Рис. 8.6. Эндоназальное зондирование при врожденных дакриоциститах.
а – положение и фиксация ребенка для ретроградного зондирования; б – методика ретроградного зондирования носослезного протока: 1 – пуговчатый зонд в нижнем носовом ходе; 2 – зонд в устье носослезного протока; 3 – основание нижней носовой раковины; 4 – слезный мешок и проток; 5 – средняя носовая раковина.
Рис. 8.6. Эндоназальное зондирование при врожденных дакриоциститах.
а – положение и фиксация ребенка для ретроградного зондирования; б – методика ретроградного зондирования носослезного протока: 1 – пуговчатый зонд в нижнем носовом ходе; 2 – зонд в устье носослезного протока; 3 – основание нижней носовой раковины; 4 – слезный мешок и проток; 5 – средняя носовая раковина.
Хронический гнойный дакриоцистит. Хроническое воспаление слезного мешка (дакриоцистит) развивается чаще вследствие нарушения проходимости носослезного протока. Задержка слезы в мешке приводит к появлению в нем микроорганизмов, чаще стафилококков и пневмококков. Образуется гнойный экссудат. Больные жалуются на слезотечение и гнойное отделяемое. Конъюнктива век, полулунная складка слезное мясцо гиперемированы. Отмечается припухлость области слезного мешка, при надавливании некоторую из слезных точек выделяется слизисто–гнойная или гнойная жидкость. Постоянное слезотечение и гнойные выделения из слезноп мешка в конъюнктивальную полостс являются не только болезнью "дис комфорта", но и фактором сниженш трудоспособности. Они ограничивают возможность выполнения ряда профессий (токари, ювелиры, хирурги, водители транспорта, люди, работающие с компьютерами, артисты, спортсмены и т. д.).
Заболеванию подвержены чаще лица среднего возраста. У женщин дакриоцистит встречается чаще, чем у мужчин. Слезотечение резко усиливается на открытом воздухе, особенно при морозе и ветре, ярком свете.
Дакриоциститы нередко приводят к тяжелым осложнениям и инвалидности. Даже малейший дефект эпителия в роговице при попадании соринки может стать входными воротами для кокковой флоры из застойного содержимого слезного мешка. Возникает ползучая язва роговицы, приводящая к стойкому нарушению зрения. Тяжелые осложнения могут возникнуть и в том случае, если гнойный дакриоцистит остается нераспознанным перед полостной операцией на глазном яблоке.
В этиопатогенезе дакриоцистита играют роль многие факторы: профессиональные вредности, резкие колебания температуры окружающего воздуха, заболевания носа и придаточных пазух, травмы, снижение иммунитета, вирулентность микрофлоры, диабет и т. д. Закупорка носослезного протока чаше всего возникает в результате воспаления его слизистой оболочки при ринитах. Иногда причиной нарушения проходимости носослезного протока бывает его повреждение при травме, нередко хирургической (при пункции гайморовой пазухи, гайморотомии). Однако большинство авторов считают основной причиной развития дакриоциститов наличие патологических процессов в полости носа и его придаточных пазухах.
В настоящее время хроническое воспаление слезного мешка лечат в основном хирургическим путем: выполняют радикальную операцию – дакриоцисториностомию, с помощью которой восстанавливают слезоотведение в нос. Суть операции состоит в создании соустья между слезным мешком и полостью носа. Операцию выполняют с наружным или внутриносовым доступом.
Принцип наружной операции был предложен в 1904 г. ринологом Тоти, позднее она совершенствовалась.


 Рис. 8.7. Этапы наружной дакриоцисториностомии.
а – рассечение слизистой оболочки носа и стенки слезного мешка: 1 – слезный мешок; 2 – слизистая оболочка носа; б – наложение швов на задние лоскуты слизистой оболочки носа и слезного мешка; в – наложение швов на передние лоскуты слизистой оболочки носа и слезного мешка.
Рис. 8.7. Этапы наружной дакриоцисториностомии.
а – рассечение слизистой оболочки носа и стенки слезного мешка: 1 – слезный мешок; 2 – слизистая оболочка носа; б – наложение швов на задние лоскуты слизистой оболочки носа и слезного мешка; в – наложение швов на передние лоскуты слизистой оболочки носа и слезного мешка.
Дюпюи–Дютан и другие авторы производят дакриоцисториностомию под местной инфильтрационной анестезией. Выполняют разрез мягких тканей до кости длиной 2.5 см, отступив от места прикрепления внутренней связки век в сторону носа 2–3 мм. Распатором раздвигают мягкие ткани, разрезают надкостницу, отслаивают ее вместе со слезным мешком от кости боковой стенки носа и слезной ямки до носослезного канала и отодвигают кнаружи. Формируют костное окно размером 1.5·2 см при помощи механической, электрической или ультразвуковой фрезы. Разрезают в продольном направлении слизистую оболочку носа в костном "окне" и стенку слезного мешка (рис. 8.7, а), накладывают кетгуговые швы сначала на задние лоскуты слизистой оболочки носа и мешка, затем – на передние (рис. 8.7, б–в). Перед наложением передних швов в область соустья вводят дренаж в сторону полости носа. Края кожи сшивают шелковыми нитями. Накладывают асептическую давящую повязку. В нос вводят марлевый тампон. Первую перевязку производят через 2 дня. Швы снимают через 6–7 дней.
Эндоназалъная дакриоцисториностомия по Весту с модификациями также выполняется под местной анестезией.
Для правильного ориентирования в положении слезного мешка медиальную стенку слезного мешка и слезную косточку прокалывают зондом, введенным через нижний слезный каналец. Конец зонда, который будет виден в носу, соответствует задненижнему углу слезной ямки (рис. 8.8). На боковой стенке носа, впереди средней носовой раковины, выкраивают соответственно проекции слезной ямки лоскут слизистой оболочки носа размером 1·1,5 см и удаляют его. В месте проекции слезного мешка удаляют костный фрагмент, площадь которого 1x1,5 см. Выпяченную зондом, введенным через слезный каналец, стенку слезного мешка рассекают в виде буквы "с" в пределах костного окна и используют для пластики соустья. При этом открывается выход для содержимого слезного мешка в полость носа.

 Рис. 8.8. Этапы внутриносовой дакриоцисториностомии.
а – вид сбоку со стороны полости носа; б: 1 – резекция лоскута в месте проекции слезного мешка; 2 – откидывание временного лоскута слизистой оболочки с боковой стенки носа для облегчения обзора; 3 – образование костного окна; 4 – формирование соустья слезного мешка с полостью носа.
Рис. 8.8. Этапы внутриносовой дакриоцисториностомии.
а – вид сбоку со стороны полости носа; б: 1 – резекция лоскута в месте проекции слезного мешка; 2 – откидывание временного лоскута слизистой оболочки с боковой стенки носа для облегчения обзора; 3 – образование костного окна; 4 – формирование соустья слезного мешка с полостью носа.
 Рис. 8.9. Этапы внутриносовой лакориностомии.
1 – лакостома и интубационная трубка (вид со стороны полости носа); 2 – интубационная трубка из силикона.
Рис. 8.9. Этапы внутриносовой лакориностомии.
1 – лакостома и интубационная трубка (вид со стороны полости носа); 2 – интубационная трубка из силикона.
Оба способа (наружный и внутриносовой) обеспечивают высокий процент излечения (95–98%). Они имеют как показания, так и ограничения.
Внутриносовые операции на слезном мешке отмечаются небольшой травматичностью, идеальной косметичностью, меньшим нарушением физиологии системы слезоотведения. Одномоментно с основной операцией можно устранить анатомические и патологические риногенные факторы. Такие операции успешно проводят в любой стадии флегмонозного дакриоцистита.
В последние годы разработаны эндоскопические методы лечения: эндоканаликулярная лазерная и внутриносовая хирургия с применением операционных микроскопов и мониторов.
При комбинированных нарушениях проходимости слезных канальцев и носослезного протока разработаны операции с наружным и внутриносовым подходом – каналикулориностомия с введением на длительный срок в слезоотводящие пути интубационных материалов – трубок, нитей и т. д.
При полном разрушении или облитерации слезоотводящих путей выполняют лакориностомию – создание нового слезоотводящего пути из слезного озера в полость носа с помощью лакопротеза из силикона или пластмассы (рис. 8.9), который вводят на длительный срок. После эпителизации стенок лакостомы протез удаляют.
Глава 9. Конъюнктива
Болезнь не может приспосабливаться к знаниям врача.Парацельс
Строение и функции конъюнктивы
Соединительная оболочка глаза, или конъюнктива, – это слизистая оболочка, которая выстилает веки с задней стороны и переходит на глазное яблоко вплоть до роговицы и, таким образом, соединяет веко с глазным яблоком. При закрытой глазной щели соединительная оболочка образует замкнутую полость – конъюнктивальный мешок, представляющий собой узкое щелевидное пространство между веками и глазным яблоком.Слизистую оболочку, покрывающую заднюю поверхность век, называют конъюнктивой век, а покрывающую склеру – конъюнктивой глазного яблока или склеры. Часть конъюнктивы век, которая, образуя своды, переходит на склеру, именуют конъюнктивой переходных складок или сводом. Соответственно различают верхний и нижний конъюнктивальные своды. У внутреннего угла глаза, в области рудимента третьего века, конъюнктива образует вертикальную полулунную складку и слезное мясцо.
В конъюнктиве выделяют два слоя – эпителиальный и субэпителиальный. Конъюнктива век плотно сращена с хрящевой пластинкой. Эпителий конъюнктивы многослойный, цилиндрический с большим количеством бокаловидных клеток. Конъюнктива век гладкая, блестящая, бледно–розовая, сквозь нее просвечивают проходящие в толще хряща желтоватые столбики мейбомиевых желез. Даже при нормальном состоянии слизистой оболочки у наружного и внутреннего углов век покрывающая их конъюнктива выглядит слегка гиперемированной и бархатистой из–за наличия мелких сосочков.
Конъюнктива переходных складок соединена с подлежащей тканью рыхло и образует складки, позволяющие глазному яблоку свободно двигаться. Конъюнктива сводов покрыта многослойным плоским эпителием с небольшим количеством бокаловидных клеток. Субэпителиальный слой представлен рыхлой соединительной тканью с включениями аденовидных элементов и скоплений лимфоидных клеток в виде фолликулов. В конъюнктиве имеется большое число дополнительных слезных желез Краузе.
Конъюнктива склеры нежная, рыхло соединена с эписклеральной тканью. Многослойный плоский эпителий конъюнктивы склеры плавно переходит на роговицу.
Конъюнктива граничит с кожей краев век, а с другой стороны – с роговичным эпителием. Болезни кожи и роговицы могут распространяться на конъюнктиву, а заболевания конъюнктивы – на кожу век (блефароконъюнктивит) и роговицу (кератоконъюнктивит). Через слезную точку и слезный каналец конъюнктива также связана со слизистой оболочкой слезного мешка и носа.
Конъюнктива обильно снабжается кровью из артериальных ветвей век, а также из передних цилиарных сосудов. Любое воспаление и раздражение слизистой оболочки сопровождается яркой гиперемией сосудов конъюнктивы век и сводов, интенсивность которой уменьшается по направлению к лимбу.
Благодаря густой сети нервных окончаний первой и второй ветвей тройничного нерва конъюнктива выполняет роль покровного чувствительного эпителия.
Основная физиологическая функция конъюнктивы – защита глаза: при попадании инородного тела появляется раздражение глаза, усиливается секреция слезной жидкости, учащаются мигательные движения, в результате чего инородное тело механически удаляется из конъюнктивальной полости. Секрет конъюнктивального мешка постоянно смачивает поверхность глазного яблока, уменьшает трение при его движениях, способствует сохранению прозрачности увлажненной роговицы. Этот секрет богат защитными элементами: иммуноглобулинами, лизоцимом, лактоферрином. Защитная роль конъюнктивы обеспечивается и благодаря обилию в ней лимфоцитов, плазматических клеток, нейтрофилов, тучных клеток и наличию иммуноглобулинов всех пяти классов.
Заболевания конъюнктивы
Среди заболеваний конъюнктивы основное место занимают воспалительные болезни.Конъюнктивит – это воспалительная реакция конъюнктивы на различные воздействия, характеризующаяся гиперемией и отеком слизистой оболочки; отеком и зудом век, отделяемым с конъюнктивы, образованием на ней фолликулов или сосочков; иногда сопровождается поражением роговицы с нарушением зрения.
Гиперемия конъюнктивы – тревожный сигнал, общий для многих глазных болезней (острый ирит, приступ глаукомы, язва или травма роговицы, склерит, эписклерит), поэтому при установлении диагноза конъюнктивита необходимо исключить другие заболевания, сопровождающиеся покраснением глаза.
Принципиальные различия имеют следующие три группы заболеваний конъюнктивы: ■ инфекционные конъюнктивиты (бактериальные, вирусные, хламидийные) ■ аллергические конъюнктивиты (поллинозные, весенний катар, лекарственная аллергия, хронический аллергический конъюнктивит, крупнопапиллярный конъюнктивит) ■ дистрофические заболевания конъюнктивы (сухой кератоконъюнктивит, пингвекула, птеригиум).
Инфекционные конъюнктивиты
Бактериальные конъюнктивиты
Любой из широко распространенных возбудителей гнойной инфекции может вызвать воспаление конъюнктивы. Кокки, прежде всего стафилококки, являются наиболее частой причиной развития конъюнктивальной инфекции, но протекает она более благоприятно. Наиболее опасными возбудителями являются синегнойная палочка и гонококк, вызывающие тяжелый острый конъюнктивит, при котором нередко поражается и роговица (рис. 9.1).Острые и хронические конъюнктивиты, вызываемые стафилококком.
Острые конъюнктивиты чаще возникают у детей, реже – у пожилых людей, еще реже – у людей среднего возраста. Обычно возбудитель попадает в глаз с рук. Сначала поражается один глаз, через 2–3 дня – другой.Клинические проявления острого конъюнктивита таковы. Утром больной с трудом открывает глаза, так как веки склеиваются. При раздражении конъюнктивы увеличивается количество слизи. Характер отделяемого может быстро изменяться от слизистого до слизисто–гнойного и гнойного. Отделяемое стекает через край века, засыхает на ресницах. При наружном осмотре выявляют гиперемию конъюнктивы век, переходных складок и склеры. Слизистая оболочка набухает, теряет прозрачность, стирается рисунок мейбомиевых желез. Выраженность поверхностной конъюнктивальной инфекции сосудов уменьшается по направлению к роговице. Больного беспокоят отделяемое на веках, зуд, жжение и светобоязнь.
Хронический конъюнктивит развивается медленно, протекает с периодами улучшения состояния. Больных беспокоят светобоязнь, легкое раздражение и быстрая утомляемость глаз. Конъюнктива умеренно гиперемирована, разрыхлена, по краю век засохшее отделяемое (корочки). Конъюнктивит может быть связан с заболеванием носоглотки, отитом, синуситом. У взрослых конъюнктивит часто возникает при хроническом блефарите, синдроме сухого глаза, поражении слезоотводящих путей.
Для выявления бактериальной инфекции при конъюнктивитах новорожденных и острых конъюнктивитах используют микроскопическое исследование мазков и посевов отделяемого с конъюнктивы. Выделенную микрофлору исследуют на патогенность и чувствительность к антибиотикам.
В лечении основное место занимает местная антибактериальная терапия: закапывают сульфацил–натрий, витабакт, фуциталмик, 3–4 раза в день или закладывают глазную мазь: тетрациклиновую, эритромициновую, флоксала, 2–3 раза в день. При остром течении назначают глазные капли тобрекс, окацин, флоксал до 4–6 раз в сутки. При отеке и выраженном раздражении конъюнктивы добавляют инстилляции антиаллергических или противовоспалительных капель (аломид, лекролин или наклоф) 2 раза в сутки.
При остром конъюнктивите нельзя завязывать и заклеивать глаз, так как под повязкой создаются благоприятные условия для размножения бактерий, повышается угроза развития воспаления роговицы.
Острый конъюнктивит, вызываемый синегнойной палочкой. Заболевание начинается остро: отмечаются большое или умеренное количество гнойного отделяемого и отек век, конъюнктива век резко гиперемирована, ярко–красного цвета, отечная, разрыхленная. Без лечения конъюнктивальная инфекция может легко распространиться на роговицу и обусловить образование быстропрогрессирующей язвы.
Лечение: инстилляции антибактериальных глазных капель (тобрекс, окацин, флоксал или гентамицин) в первые 2 дня по 6–8 раз в сутки, затем до 3–4. Наиболее эффективно сочетание двух антибиотиков, например тобрекс+окацин или гентамицин+полимиксин. При распространении инфекции на роговицу парабульбарно вводят тобрамицин, гентамицин или цефтазидим и системно применяют таваник в таблетках или гентамицин, тобрамицин в виде инъекций. При выраженном отеке век и конъюнктивы дополнительно инсталлируют антиаллергические и противовоспалительные капли (сперсаллерг, аллергофтал или наклоф) 2 раза в день. При поражении роговицы необходимы средства метаболической терапии – капли (тауфон, витасик, карнозин) или гели (корнерегель, солкосерил).
Острый конъюнктивит, вызываемый гонококком.
Венерическое заболевание. передающееся половым путем (прямой генитально–глазной контакт или передача гениталии – рука – глаз). Гиперактивный гнойный конъюнктивит характеризуется быстрым прогрессированием. Веки отечны, отделяемое обильное, гнойное, конъюнктива резко гиперемирована, ярко–красная, раздраженная, собирается в выпячивающиеся складки, нередко отмечается отек конъюнктивы склеры (хемоз). Кератит развивается в 15–40% случаев, сначала поверхностный, затем образуется язва роговицы, которая может привести к перфорации уже через 1–2 дня.При острых конъюнктивитах, предположительно вызванных синегнойной палочкой или гонококком, лечение начинают немедленно, не ожидая лабораторного подтверждения, так как задержка на 1–2 дня может привести к развитию язвы роговицы и гибели глаза.
Лечение: при гонококковом конъюнктивите, подтвержденном лабораторно или предполагаемом на основании клинических проявлений и анамнеза заболевания, вначале проводят антибактериальную терапию: промывание глаза раствором борной кислоты, инстилляции глазных капель (окацин, флоксал или пенициллин) 6–8 раз в сутки. Проводят системное лечение: хинолоновый антибиотик по 1 таблетке 2 раза в сутки или пенициллин внутримышечно. Дополнительно назначают инстилляции антиаллергических или противовоспалительных средств (сперсаллерг, аллергофтал или наклоф) 2 раза в сутки. При явлениях кератита также закапывают витасик, карнозин или тауфон 2 раза в день.
Особую опасность представляет гонококковый конъюнктивит у новорожденных (гонобленнорея). Заражение происходит во время прохождения плода через родовые пути матери, больной гонореей. Конъюнктивит обычно развивается на 2–5–й день после рождения. Отечные плотные синюшно–багровые веки почти невозможно открыть для осмотра глаза. При надавливании из глазной щели изливается кровянисто–гнойное отделяемое. Конъюнктива резко гиперемировананная, разрыхленная, легко кровоточит. Исключительная опасность гонобленнореи заключается в поражении роговицы вплоть до гибели глаза. Местное лечение такое же, как и у взрослых, а системное – введение антибактериальных препаратов в дозах соответственно возрасту.
Дифтерийный конъюнктивит.
Дифтерия конъюнктивы, вызываемая дифтерийной палочкой, характеризуется появлением на конъюнктиве век трудно снимаемых сероватых пленок. Веки плотные, отечные. Из глазной щели выделяется мутная жидкость с хлопьями. Пленки плотно спаяны с подлежащей тканью. Их отделение сопровождается кровотечением, а после некротизации пораженных участков образуются рубцы. Больного изолируют в инфекционном отделении и проводят лечение по схеме терапии дифтерии.Вирусные конъюнктивиты
Вирусные конъюнктивиты встречаются часто и протекают в виде эпидемических вспышек и эпизодических заболеваний.Эпидемический кератоконъюнктивит.
Аденовирусы (уже известно более 50 их серотипов) вызывают две клинические формы поражения глаз: эпидемический кератоконъюнктивит, протекающий более тяжело и сопровождающийся поражением роговицы, и аденовирусный конъюнктивит, или фарингоконъюнктивальную лихорадку.Эпидемический кератоконъюнктивит – это госпитальная инфекция, более 70% больных заражаются в медицинских учреждениях. Источником инфекции является больной кератоконьюнктивитом. Инфекция распространяется контактным путем, реже – воздушно–капельным. Факторами передачи возбудителя являются инфицированные руки медперсонала, глазные капли многократного использования, инструменты, приборы, глазные протезы, контактные линзы.
Длительность инкубационного периода заболевания 3–14, чаще 4–7 дней. Продолжительность заразного периода 14 дней.
Начало заболевания острое, обычно поражаются оба глаза: сначала один, через 1–5 дней второй. Больные жалуются на резь, ощущение инородного тела в глазу, слезотечение. Веки отечны, конъюнктива век умеренно или значительно гиперемирована, нижняя переходная складка инфильтрировананая, складчатая, в большинстве случаев выявляют мелкие фолликулы и точечные кровоизлияния.
Через 5–9 дней от начала заболевания развивается II стадия болезни, сопровождающаяся появлением характерных точечных инфильтратов под эпителием роговицы. При образовании большого числа инфильтратов в центральной зоне роговицы зрение снижается.
Региональная аденопатия – увеличение и болезненность околоушных лимфатических узлов – появляется на 1–2–й день заболевания почти у всех больных. Поражение респираторного тракта отмечается у 5–25% больных. Длительность эпидемического кератоконъюнктивита до 3–4 нед. Как показали исследования, проведенные в последние годы, тяжелым последствием аденовирусной инфекции является развитие синдрома сухого глаза в связи с нарушением продукции слезной жидкости.
Лабораторная диагностика острых вирусных конъюнктивитов (аденовирусных, герпесвирусных) включает метод определения флюоресцирующих антител в соскобах конъюнктивы, полимеразную цепную реакцию и, реже, метод выделения вируса.
Лечение сопряжено с трудностями, так как не существует лекарственных средств селективного воздействия на аденовирусы. Используют препараты широкого противовирусного действия: интерфероны (локферон, офтальмоферон и др.) или индукторы интерферона, проводят инстилляции 6–8 раз в сутки, а на 2–й неделе уменьшая их количество до 3–4 раз в сутки. В остром периоде дополнительно закапывают антиаллергический препарат аллергофтал или сперсаллерг 2–3 раза в сутки и принимают антигистаминные препараты внутрь в течение 5–10 дней. В случаях подострого течения применяют капли ал о мид или лекролин 2 раза в сутки. При тенденции к образованию пленок и в период роговичных высыпаний назначают кортикостероиды (дексапос, максидекс или офтан–дексаметазон) 2 раза в сутки. При роговичных поражениях применяют тауфон, карнозин, витасик или корнерегель 2 раза в сутки. В случаях недостатка слезной жидкости в течение длительного периода времени применяют слезозамещающие препараты: слезу натуральную 3–4 раза в сутки, офтагель или видисикгель 2 раза в сутки.
Профилактика внутрибольничной аденовирусной инфекции включает необходимые противоэпидемические мероприятия и меры санитарно–гигиенического режима: ■ осмотр глаз каждого больного в день госпитализации для предупрежнения заноса инфекции в стационар ■ раннее выявление случаев развития заболеваний в стационаре ■ изоляция больных при единичных случаях возникновения заболевания и карантин при вспышках, противоэпидемические мероприятия ■ санитарно–просветительная работа
Аденовирусный конъюнктивит.
Заболевание протекает легче, чем эпидемический кератоконъюнктивит, и редко вызывает вспышки госпитальной инфекции. Заболевание обычно возникает в детских коллективах. Передача возбудителя происходит воздушно–капельным путем, реже – контактным. Продолжительность инкубационного периода 3–10 дней.Симптомы заболевания сходны с начальными клиническими проявлениями эпидемического кератоконъюнктивита, но их интенсивность значительно ниже: отделяемое скудное, конъюнктива гиперемирована и инфильтрирована умеренно, фолликулов немного, они мелкие, иногда отмечаются точечные кровоизлияния. У ½ больных обнаруживают региональную аденопатию околоушных лимфатических узлов. На роговице могут появляться точечные эпителиальные инфильтраты, но они исчезают бесследно, не влияя на остроту зрения.
Для аденовирусного конъюнктивита характерна общая симптоматика: поражение респираторного тракта с повышением температуры тела и головной болью. Системное поражение может предшествовать заболеванию глаз. Длительность аденовирусного конъюнктивита – 2 нед.
Лечение включает инстилляции интерферонов и противоаллергических глазных капель, а при недостаточности слезной жидкости – искусственной слезы или офтагеля.
Профилактика внутрибольничного распространения инфекции такая же, как при эпидемическом кератоконъюнктивите.
Эпидемический геморрагический конъюнктивит (ЭГК).
ЭГК, или острый геморрагический конъюнктивит, описан сравнительно недавно. Первая пандемия ЭГК началась в 1969 г. в Западной Африке, а затем охватила страны Северной Африки, Ближнего Востока и Азии. Первая вспышка ЭГК в Москве наблюдалась в 1971 г. Эпидемические вспышки в мире возникали в 1981–1984 и 1991–1992 гг. Заболевание требует пристального внимания, так как вспышки ЭГК в мире повторяются с определенной периодичностью.Возбудителем ЭГК является энтеровирус–70. ЭГК характеризуется необычным для вирусного заболевания коротким инкубационным периодом – 12–48 ч. Основной путь распространения инфекции – контактный. Отмечается высокая контагиозность ЭГК, эпидемия протекает "по взрывному типу”. В глазных стационарах при отсутствии противоэпидемических мероприятий может быть поражено 80–90% пациентов.
Клинико–эпидемиологические особенности ЭГК настолько характерны, что на их основании заболевание легко отличить от других офтальмоинфекций. Начало острое, сначала поражается один глаз, через 8–24 ч – второй. Вследствие сильной боли и светобоязни больной обращается за помощью уже в первый день. Отделяемое с конъюнктивы слизистое или слизисто–гнойное, конъюнктива резко гиперемирована, особенно характерны подконъюнктивальные кровоизлияния: от точечных петехий до обширных геморрагий, захватывающих почти всю конъюнктиву склеры (рис. 9.2). Изменения роговицы незначительные – точечные эпителиальные инфильтраты, исчезающие бесследно.
Лечение заключается в применении противовирусных глазных капель (интерферон, индукторы интерферона) в сочетании с противовоспалительными средствами (сначала противоаллергические, а со 2–й недели кортикостероиды). Продолжительность лечения 9–14 дней. Выздоровление обычно без последствий.
Герпесвирусный конъюнктивит.
Хотя герпетические поражения глаз относятся к числу высокораспространенных заболеваний, а герпетические кератиты признаны в мире самым распространенным поражением роговицы, герпесвирусные конъюнктивиты чаще всего являются компонентом первичной инфекции вирусом герпеса в раннем детстве.Первичный герпетический конъюнктивит чаще имеет фолликулярный характер, вследствие чего его трудно отличить от аденовирусного. Для герпетического конъюнктивита характерны следующие признаки: поражен один глаз, в патологический процесс часто вовлекаются края век, кожа и роговица.
Рецидив герпеса может протекать как фолликулярный или везикулярно–язвенный конъюнктивит, но обычно развивается как поверхностный или глубокий кератит (стромальный, язвенный, кератоувеит).
Лечение противовирусное. Предпочтение следует отдавать селективным противогерпетическим средствам. Назначают глазную мазь зовиракс, которую закладывают 5 раз в первые дни и 3–4 раза в последующие или капли интерферона либо индуктора интерферона (инстилляции 6–8 раз в сутки). Внутрь принимают валтрекс по 1 таблетке 2 раза в сутки в течение 5 дней или зовиракс по 1 таблетке 5 раз в сутки в течение 5 дней. Дополнительная терапия: при умеренно выраженной аллергии – антиаллергические капли аломид или лекролин (2 раза в сутки), при выраженной – аллергофтал или сперсаллерг (2 раза в сутки). В случае поражения роговицы дополнительно инстиллируют капли витасик, карнозин, тауфон или корнерегель 2 раза в сутки, при рецидивирующем течении проводят иммунотерапию: ликопид по 1 таблетке 2 раза в сутки в течение 10 дней. Иммунотерапия ликопидом способствует повышению эффективности специфического лечения различных форм офтальмогерпеса и значительному снижению частоты рецидивов.
Хламидийные заболевания глаз
Хламидии (Chlamydia trachomatis) – самостоятельный вид микроорганизмов; они являются внутриклеточными бактериями с уникальным циклом развития, проявляющими свойства вирусов и бактерий. Разные серотипы хламидии вызывают три различных конъюнктивальных заболевания: трахому (серотипы А–С), хламидийный конъюнктивит взрослых и новорожденных (серотипы D–К) и венерический лимфогранулематоз (серотипы L1, L2, L3).Трахома.
Трахома – хронический инфекционный кератоконъюнктивит, характеризующийся появлением фолликулов с последующим их рубцеванием и сосочков на конъюнктиве, воспалением роговицы (паннусом), а в поздних стадиях – деформацией век. Возникновение и распространение трахомы связано с низким уровнем санитарной культуры и гигиены. В экономически развитых странах трахома практически не встречается. Огромная работа по разработке и проведению научно–организационных и лечебно–профилактических мероприятий привела к ликвидации трахомы в нашей стране. Вместе с тем, по оценке ВОЗ, трахома остается главной причиной слепоты в мире. Считается, что активной трахомой поражено до 150 млн человек, главным образом в странах Африки, Ближнего Востока, Азии. Заражение трахомой европейцев, посещающих эти регионы, возможно и сегодня.Трахома возникает в результате заноса возбудителей инфекции на конъюнктиву глаза. Инкубационный период 7–14 дней. Поражение обычно двустороннее.
В клиническом течении трахомы различают 4 стадии. В I стадии наблюдаются острое нарастание воспалительных реакций, диффузная инфильтрация, отек конъюнктивы с развитием в ней единичных фолликулов, которые имеют вид мутных серых зерен, расположенных беспорядочно и глубоко. Характерно образование фолликулов на конъюнктиве верхних хрящей (рис. 9.3). Во II стадии на фоне усиления инфильтрации и развития фолликулов начинается их распад, образуются рубцы, выражено поражение роговицы. В III стадии преобладают процессы рубцевания при наличии фолликулов и инфильтрации. Именно образование рубцов на конъюнктиве позволяет отличить трахому от хламидийного конъюнктивита и других фолликулярных конъюнктивитов. В IV стадии происходит разлитое рубцевание пораженной слизистой оболочки при отсутствии воспалительных явлений в конъюнктиве и роговице (рис. 9.4).
При тяжелой форме и длительном течении трахомы может возникнуть паннус роговицы – распространяющаяся на верхний сегмент роговицы инфильтрация с врастающими в нее сосудами (рис. 9.5). Паннус является характерным признаком трахомы и имеет важное значение в дифференциальной диагностике. В период рубцевания на месте паннуса возникает интенсивное помутнение роговицы в верхней половине с понижением зрения.
При трахоме могут возникать различные осложнения со стороны глаза и придаточного аппарата. Присоединение бактериальных возбудителей отягощает воспалительный процесс и затрудняет диагностику. Тяжелым осложнением является воспаление слезной железы, слезных канальцев и слезного мешка. Образующиеся гнойные язвы при трахоме, обусловленные сопутствующей инфекцией, трудно заживают и могут приводить к перфорации роговицы с развитием воспаления в полости глаза, в связи с чем существует угроза гибели глаза.
В процессе рубцевания возникают тяжелые последствия трахомы: укорочение конъюнктивальных сводов, образование сращений века с глазным яблоком (симблефарои), перерождение слезных и мейбомиевых желез, вызывающее ксероз роговицы. Рубцевание обусловливает искривление хряща, заворот век, неправильное положение ресниц (трихиаз). При этом ресницы касаются роговицы, что приводит к повреждению ее поверхности и способствует развитию язвы роговицы. Сужение слезоотводящих путей и воспаление слезного мешка (дакриоцистит) могут сопровождаться упорным слезотечением.
Лабораторная диагностика включает цитологическое исследование соскобов с конъюнктивы с целью обнаружения внутриклеточных включений, выделение возбудителей, определение антител в сыворотке крови.
Основное место в лечении занимают антибиотики (мазь тетрациклина или эритромицина), которые применяют по двум основным схемам: 1 – 2 раза в день при массовом лечении или 4 раза в день при индивидуальной терапии соответственно в течение от нескольких месяцев до нескольких недель. Экспрессию фолликулов специальными пинцетами для повышения эффективности терапии в настоящее время практически не используют. Трихиаз и заворот век устраняют хирургическим путем. Прогноз при своевременном лечении благоприятный. Возможны рецидивы, поэтому после завершения курса лечения больной должен находиться под наблюдением в течение длительного периода времени.
Хламидийные конъюнктивиты.
Различают хламидийные конъюнктивиты (паратрахома) взрослых и новорожденных. Значительно реже наблюдаются эпидемический хламидийный конъюнктивит у детей, хламидийный увеит, хламидийный конъюнктивит при синдроме Рейтера.Хламидийный конъюнктивит взрослых
Хламидийный конъюнктивит взрослых – инфекционный подострый или хронический инфекционный конъюнктивит, вызываемый С. trachomatis и передающийся половым путем. Распространенность хламидийных конъюнктивитов в развитых странах медленно, но неуклонно растет; они составляют 10–30% выявленных конъюнктивитов. Заражение обычно происходит в возрасте 20–30 лет. Женщины болеют в 2–3 раза чаще. Конъюнктивиты связаны главным образом с урогенитальной хламидийной инфекцией, которая может протекать бессимптомно.Заболевание характеризуется воспалительной реакцией конъюнктивы с образованием многочисленных фолликулов, не склонных к рубцеванию. Чаще поражается один глаз, двусторонний процесс наблюдается примерно у ⅓ больных. Инкубационный период 5–14 дней. Конъюнктивит чаще (у 65% больных) протекает в острой форме, реже (у 35%) – в хронической.
Клиническая картина: выраженный отек век и сужение глазной щели, выраженная гиперемия, отек и инфильтрация конъюнктивы век и переходных складок. Особенно характерны крупные рыхлые фолликулы, располагающиеся в нижней переходной складке и в дальнейшем сливающиеся в виде 2–3 валиков. Отделяемое вначале слизисто–гнойное, в небольшом количестве, с развитием заболевания оно становится гнойным и обильным. Более чем у половины заболевших исследование со щелевой лампой позволяет обнаружить поражение верхнего лимба в виде отечности, инфильтрации и васкуляризации. Нередко, особенно в остром периоде, отмечается поражение роговицы в виде поверхностных мелкоточечных инфильтратов, не окрашивающихся флюоресцеипом. С 3–5–го дня заболевания на стороне поражения возникает региональная предушная аденопатия, как правило, безболезненная. Нередко с этой же стороны отмечаются явления евстахиита: шум и боль в ухе, унижение слуха.
Лечение: глазные капли окацин 6 раз в день или глазная мазь тетрациклиновая, эритромициновая, флоксаловая 5 раз в день, со 2–й недели капли 4 раза, мазь 3 раза, внутрь – антибиотик таваник по 1 таблетке в день в течение 5–10 дней. Дополнительная терапия включает инстилляции антиаллергических капель: в остром периоде – аллергофтала или сперсаллерга 2 раза в сутки, в хроническом – аломида или лекролина 2 раза в сутки, внутрь – антигистаминные препараты в течение 5 дней. Со 2–й недели назначают глазные капли дексапос или максидекс 1 раз в сутки.
Эпидемический хламидийный конъюнктивит.
Заболевание протекает более доброкачественно, чем паратрахома, и возникает в виде вспышек у посетителей бань, бассейнов и детей 3–5 лет в организованных коллективах (детских домах и домах ребенка). Заболевание может начинаться остро, подостро или протекать как хронический процесс.Обычно поражается один глаз: обнаруживают гиперемию, отек, инфильтрацию конъюнктивы, папиллярную гипертрофию, фолликулы в нижнем своде. Роговица редко вовлекается в патологический процесс; выявляют точечные эрозии, субэпител иальные точечные инфильтраты. Часто обнаруживают небольшую предушную аденопатию.
Все конъюнктивальные явления и без лечения могут претерпевать обратное развитие через 3–4 нед. Лечение местное: тетрациклиновая, эритромициновая или флоксаловая мазь 4 раза в день или глазные капли окацин либо флоксал 6 раз в день.
Хламидийный конъюнктивит (паратрахома) новорожденных.
Заболевание связано с урогенитальной хламидийной инфекцией: его выявляют у 20–50% детей, родившихся от инфицированных хламидиями матерей. Частота хламидийного конъюнктивита достигает 40% всех конъюнктивитов новорожденных.Большое значение имеет профилактическая обработка глаз у новорожденных, которая, однако, затруднена вследствие отсутствия высокоэффективных, надежных средств, так как традиционно используемый раствор нитрата серебра не предупреждает развитие хламидийного конъюнктивита. Более того, его инстилляции часто вызывают раздражение конъюнктивы, т. е. способствуют возникновению токсического конъюнктивита.
Клинически хламидийный конъюнктивит новорожденных протекает, как острый папиллярный и подострый инфильтративный конъюнктивит.
Заболевание начинается остро на 5–10–й день после родов с появления обильного жидкого гнойного отделяемого, которое из–за примеси крови может иметь бурый оттенок. Резко выражен отек век, конъюнктива гиперемирована, отечна, с гиперплазией сосочков, могут образовываться псевдомембраны. Воспалительные явления уменьшаются через 1–2 нед. Если активное воспаление продолжается более 4 нед, появляются фолликулы, преимущественно на нижних веках. Примерно у 70% новорожденных заболевание развивается на одном глазу. Конъюнктивит может сопровождаться предушной аденопатией, отитом, назофарингитом и даже хламидийной пневмонией.
Лечение: тетрацикл и новая или эритромициновая мазь 4 раза в день.
ВОЗ (1986) дает следующие рекомендации по обработке глаз для профилактики конъюнктивитов новорожденных: в зонах повышенного риска заражения гонококковой инфекцией (большинство развивающихся стран) назначают инстилляции 1% раствора нитрата серебра, можно также закладывать за веко 1% тетрацикл иновую мазь. В зонах малого риска заражения гонококковой инфекции, но высокой распространенности хламидиозов (большинство индустриально развитых стран) практикуют закладывание 1% тетрациклиновой или 0,5% эритромициновой мази.
В профилактике конъюнктивитов новорожденных центральное место занимает своевременное лечение урогенитальной инфекции у беременных.
Аллергические конъюнктивиты
Аллергические конъюнктивиты – это воспалительная реакция конъюнктивы на воздействие аллергенов, характеризующаяся гиперемией и отеком слизистой оболочки век, отеком и зудом век, образованием фолликулов или сосочков на конъюнктиве; иногда сопровождается поражением роговицы с нарушением зрения.Аллергические конъюнктивиты занимают важное место в группе заболеваний, объединенных общим названием "синдром красного глаза”: ими поражено примерно 15% населения.
В силу анатомического расположения глаз они часто подвергаются воздействию различных аллергенов. Повышенная чувствительность часто проявляется в воспалительной реакции конъюнктивы (аллергический конъюнктивит), но поражаться могут любые отделы глаза, и тогда развиваются аллергический дерматит и отек кожи век,аллергический блефарит, конъюнктивит, кератит, ирит, иридоциклит, ретинит, неврит зрительного нерва.
Глаза могут быть местом развития аллергической реакции при многих системных иммунологических расстройствах, причем поражение глаз нередко бывает наиболее драматичным проявлением болезни. Аллергическая реакция играет важную роль в клинической картине инфекционных заболеваний глаз.
Аллергические конъюнктивиты часто сочетаются с такими системными аллергическими заболеваниями, как бронхиальная астма, аллергические риниты, атопические дерматиты.
Реакции гиперчувствительности (синоним аллергии) классифицируют на немедленные (развиваются в пределах 30 мин от момента воздействия аллергена) и замедленные (развиваются спустя 24–48 ч или позже после воздействия). Такое разделение аллергических реакций имеет практическое значение в построении фармакотерапии. Немедленные реакции вызывает "дружный" выброс в ткани на определенном участке (местный процесс) биологически активных медиаторов из гранул тучных клеток слизистых оболочек и базофилов крови, что называют активацией или дегрануляцией тучных клеток и базофилов.
В некоторых случаях типичная картина заболевания или четкая связь его с воздействиями внешнего аллергенного фактора не оставляет сомнения в диагнозе. В большинстве же случаев диагностика аллергических заболеваний глаз сопряжена с большими трудностями и требует применения специфических аллергологических методов исследования.
Аллергологический анамнез – наиболее важный диагностический фактор. Он должен отражать данные о наследственной аллергической огягощенности, особенностях течения заболевания, совокупность воздействий, способных вызвать аллергическую реакцию, периодичность и сезонность обострений, наличие аллергических реакций, помимо глазных. Важное диагностическое значение имеют естественно возникающие или специально проводимые элиминационная и экспозиционная пробы. Первая заключается в "выключении" предполагаемого аллергена, вторая – в повторном воздействии им после стихания клинических явлений. Тщательно собранный анамнез позволяет предположить виновный" аллергизируюший агент более чем у 70% пациентов.
Кожные аллергические пробы, применяемые в офтальмологической практике (аппликационная, прик–тест, скарификационная, скарификационно–аппликационная), малотравматичны и в то же время достаточно достоверны.
Провокационные аллергические пробы (конъюнктивальная, назальная и подъязычная) применяют только в исключительных случаях и с большой осторожностью.
Лабораторная аллергодиагностика высокоспецифична и возможна в остром периоде заболевания без опасения причинить вред больному.
Важное диагностическое значение имеет выявление эозинофилов в соскобе с конъюнктивы.
Основные принципы терапии: ■ элиминация, т. е. исключение, "виновного" аллергена, если это возможно, – самый эффективный и безопасный метод предупреждения и лечения аллергических конъюнктивитов ■ лекарственная симптоматическая терапия: местная, с применением глазных препаратов, и общая – антигистаминные препараты внутрь при тяжелых поражениях занимает главное место в лечении аллергических конъюнктивитов ■ специфическую иммунотерапию проводят в лечебных учреждениях при недостаточной эффективности лекарственной терапии и невозможности исключить "виновный" аллерген.
Для противоаллергической терапии используют две группы глазных капель: первая – тормозящие дегрануляцию тучных клеток: кромоны – 2% раствор лекролина, 2% раствор лекролина без консерванта, 4% раствор кузикрома и 0,1% раствор лодоксамида (аломид), вторая – антигистаминные: антазолин + тетризолин (сперсаллерг) и антазолин + нафазолин (аллергофтал). Дополнительно применяют кортикостероидные препараты: 0,1% раствор дексаметазона (дексапос, максидекс, офтан–дексаметазон) и 1% или 2,5% раствор гидрокортизона–ПОС, а также нестероидные противовоспалительные препараты – 1% раствор диклофенака (наклоф).
Наиболее часто встречаются следующие клинические формы аллергических конъюнктивитов, характеризующиеся своими особенностями в выборе лечения: поллинозные конъюнктивиты, весенний кератоконъюнктивит, лекарственная аллергия, хронический аллергический конъюнктивит, крупнопапиллярный конъюнктивит.
Поллинозные конъюнктивиты.
Это сезонные аллергические заболевания глаз, вызываемые пыльцой в период цветения трав, злаковых, деревьев. Время обострения тесно связано с календарем опыления растений в каждом климатическом регионе. Поллинозный конъюнктивит может начинаться остро: нестерпимый зуд век, жжение под веками, светобоязнь, слезотечение, отек и гиперемия конъюнктивы. Отек конъюнктивы может быть настолько выраженным, что роговица "утопает" в окружающей хемотичной конъюнктиве. В таких случаях появляются краевые инфильтраты в роговице, чаше в области глазной щели. Полупрозрачные очаговые поверхностные инфильтраты, расположенные вдоль лимба, могут сливаться и изъязвляться, образуя поверхностные эрозии роговицы. Более часто поллинозный конъюнктивит протекает хронически с умеренным жжением под веками, незначительным отделяемым, периодически возникающим зудом век, легкой гиперемией конъюнктивы, могут обнаруживаться мелкие фолликулы или сосочки на слизистой оболочке.Лечение при хроническом течении: аломид или лекролин 2 раза в день в течение 2–3 нед, при остром течении – аллергофтал или сперсаллерг 2–3 раза в день. Дополнительная терапия при тяжелом течении: антигистаминные препараты внутрь в течение 10 дней. При блефарите накладывают мазь гидрокортизона–ПОС на веки. При упорном рецидивирующем течении проводят специфическую иммунотерапию под наблюдением врача–аллерголога.
Весенний кератоконъюнктивт (весенний катар).
Заболевание обычно возникает у детей в возрасте 3–7 лет, чаще у мальчиков, имеет преимущественно хроническое упорное, изнуряющее течение. Клинические проявления и распространенность весеннего катара варьируют на разных территориях. Наиболее характерным клиническим признаком являются сосочковые разрастания на конъюнктиве хряща верхнего века (конъюнктивальная форма), обычнс мелкие, уплощенные, но могут быть крупными, деформирующими веке (рис. 9.6). Реже сосочковые разрастания располагаются вдоль лимбе (лимбальная форма). Иногда встречается смешанная форма. Нередко поражается роговица: эпителиопатия, эрозия или язва роговицы, кератит, гиперкератоз.Лечение: при легком течении производят инстилляции аломида или лекролина 3 раза в день в течение 3–4 нед. При тяжелом течении применяют сперсаллерг или аллергофтал 2 раза в день. При лечении весеннего катара необходимо сочетание антиаллергических капель с кортикостероидами: инстилляции глазных капель дексапоса, максидекса или офтан–дексаметазона 2–3 раза в день в течение 3–4 нед. Дополнительно назначают антигистаминные препараты (диазолин, супрастин или кларитин) внутрь на 10 дней. При язве роговицы применяют репаративные средства (глазные капли витасик тауфон или гели солкосерил, корнерегель) 2 раза в день до улучшени) состояния роговицы. При длительном, упорном течении весеннего катара проводят курс лечения гистоглобулином (4–10 инъекций).
Лекарственный аллергический конъюнктивит.
Заболевание может возникнуть остро после первого применения любого лекарства, но обычно развивается хронически при дли тельном лечении препаратом, при чем возможна аллергическая реакцш как на основное лекарство, так и т консервант глазных капель. Острая реакция возникает в течение 1 ч после введения препарата (острый лекарственный конъюнктивит, анафилактический шок, острая крапивница, отек Квинке, системный капилляротоксикоз и др.). Подострая реакция развивается в течение суток (рис. 9.7). Затяжная реакция проявляется в течение нескольких дней и недель, обычно при длительном местном применении лекарственных средств. Глазные реакции последнего типа встречаются наиболее часто (у больных 90%) и имеют хронический характер. Практически любое лекарственное средство может вызвать аллергическую реакцию глаза. Один и тот же препарат у разных больных может вызвать неодинаковые проявления. Вместе с тем различные препараты могут вызвать схожую клиническую картину лекарственной аллергии.Характерными признаками острого аллергического воспаления является гиперемия, отек век и конъюнктивы, слезотечение, иногда кровоизлияния; хроническому воспалению свойственны зуд век, гиперемия слизистой оболочки, умеренное отделяемое, образование фолликулов. При лекарственной аллергии наиболее часто поражаются конъюнктива, роговица, кожа век, значительно реже – сосудистая оболочка, сетчатка, зрительный нерв.
Главным в лечении лекарственной аллергии является отмена "виновного" препарата или переход на тот же препарат без консерванта.
После отмены "виновного” препарата при остром течении применяют глазные капли аллергофтал или сперсаллерг 2–3 раза в день, при хроническом – аломид, лекролин или лекролин без консерванта 2 раза в день. При тяжелом и затяжном течении может возникнуть потребность в приеме антигистаминных препаратов внутрь.
Хронический аллергический конъюнктивит.
Аллергические конъюнктивиты чаще протекают хронически: умеренное жжение глаз, незначительное отделяемое, периодически возникающий зуд век. Следует иметь в виду, что нередко многочисленные жалобы на неприятные ощущения сочетаются с незначительными клиническими проявлениями, что затрудняет диагностику.Среди причин упорного течения могут быть повышенная чувствительность к пыльце, промышленным вредностям, пищевым продуктам, средствам бытовой химии, домашней пыли, перхоти и шерсти животных, сухим кормам для рыб, лекарственным препаратам, косметическим средствам, контактным линзам.
Наиболее важным влечении является исключение факторов риска развития аллергии, если удается их установить. Местное лечение включает инстилляции глазных капель лекролина или аломида 2 раза в день в течение 3–4 нед. При явлениях блефарита назначают глазную мазь гидрокортизона–ПОС 2 раза в день на веки и инстилляции искусственной слезы (слеза натуральная) 2 раза в день.
Аллергический конъюнктивит при ношении контактных линз.
Считается, что у большинства пациентов, носящих контактные линзы, когда–нибудь обязательно возникнет аллергическая реакция конъюнктивы: раздражение глаз, светобоязнь, слезотечение, жжение под веками, зуд, дискомфорт при вставлении линзы. При осмотре можно обнаружить мелкие фолликулы, мелкие или крупные сосочки на конъюнктиве верхних век, гиперемию слизистой оболочки, отек и точечные эрозии роговицы.Лечение: необходимо отказаться от ношения контактных линз. Назначают инстилляцию глазных капель лекролина или аломида 2 раза в сутки. При острой реакции применяют аллергофтал или сперсаллерг 2 раза в сутки.
Крупнопапиллярные конъюнктивиты (КПК).
Заболевание представляет собой воспалительную реакцию конъюнктивы верхнего века, в течение длительного периода находящегося в контакте с инородным телом. Возникновение КПК возможно при следующих условиях: ношение контактных линз (жестких и мягких), использование глазных протезов, наличие швов после экстракции катаракты или кератопластики, стягивающих склеральных пломб.Больные предъявляют жалобы на зуд и слизистое отделяемое. В тяжелых случаях может появиться птоз. Крупные (гигантские – диаметром 1 мм и более) сосочки группируются по всей поверхности конъюнктивы верхних век.
Хотя клиническая картина КПК очень схожа с проявлениями конъюнктивальной формы весеннего катара, между ними имеются существенные различия. Прежде всего КПК развивается в любом возрасте и обязательно при наличии оставшихся швов или ношении контактных линз. Жалобы на зуд и отделяемое при КПК выражены меньше, лимб и роговица обычно не вовлекаются в процесс. Наконец, все симптомы КПК быстро исчезают после удаления инородного тела. У больных с КПК не обязательно имеются аллергические заболевания в анамнезе и не отмечаются сезонные обострения.
В лечении основное значение имеет удаление инородного тела. До полного исчезновения симптомов закапывают аломид или лекролин 2 раза в день. Ношение новых контактных линз возможно только после полного исчезновения воспалительных явлений. Для профилактики КПК необходим систематический уход за контактными линзами и протезами.
Профилактика аллергического конъюнктивита.
С целью предотвращения заболевания необходимо принять определенные меры. ■ Элиминация причинных факторов. Важно уменьшить, а если возможно, исключить контакты с такими факторами риска развития аллергии, как домашняя пыль, тараканы, домашние животные, сухой корм для рыб, средства бытовой химии, косметические средства. Следует помнить, что у больных, страдающих аллергией, глазные капли и мази (особенно антибиотики и противовирусные средства) могут вызвать не только аллергический конъюнктивит, но и общую реакцию в виде крапивницы и дерматита. ■ В том случае, если предполагается, что человек попадет в такие условия, когда невозможно исключить контакт с факторами, вызывающими аллергию, к которым он чувствителен, следует начинать закапывать лекролин или аломид по одной капле 1–2 раза в день за 2 нед до контакта. ■ Если пациент уже попал в такие условия, закапывают аллергофтал или сперсаллерг, которые дают немедленный эффект, сохраняющийся в течение 12 ч. ■ При часто возникающих рецидивах проводят специфическую иммунотерапию в период ремиссии конъюнктивита.Дистрофические заболевания конъюнктивы
В эту группу конъюнктивальных поражений включены несколько заболеваний различного происхождения: сухой кератоконъюнктивит, пингвекула, крыловидная плева.Синдром сухого глаза (сухой кератоконъюнктивит) – это поражение конъюнктивы и роговицы, возникающее в связи с выраженным уменьшением продукции слезной жидкости и нарушением стабильности слезной пленки.
Слезная пленка состоит из трех слоев. Поверхностный, липидный, слой, продуцируемый мейбомиевыми железами, препятствует испарению жидкости, поддерживая тем самым стабильность слезного мениска. Средний, водный, слой, составляющий 90% толщины слезной пленки, формируется за счет основных и добавочных слезных желез. Третий слой, непосредственно покрывающий эпителий роговицы, – это тонкая муциновая пленка, продуцируемая бокаловидными клетками конъюнктивы. Каждый слой слезной пленки может быть поражён при различных заболеваниях, гормональных расстройствах, лекарственных воздействий, что и приводит к развитию сухого кератоконъюнктивита.
Синдром сухого глаза относится к числу широко распространенных заболеваний, особенно часто возникает у лиц старше 70 лет.
Больные жалуются на ощущение инородного тела под веками, жжение, резь, сухость в глазу, отмечают светобоязнь, плохую переносимость ветра, дыма. Все явления ухудшаются к вечеру. Раздражение глаз вызывают инстилляции любых глазных капель. Объективно отмечаются расширенные сосуды конъюнктивы склеры, тенденция к образованию складок слизистой оболочки, хлопьевидные включения в слезной жидкости, тускнеет поверхность роговицы. Выделяют следующие клинические формы роговичных поражений, соответствующие тяжести заболевания: эпителиопатия (едва заметные или точечные дефекты эпителия роговицы, выявляемые при окраске флюоресцеином или бенгальским розовым), эрозия роговицы (более обширные дефекты эпителия), нитчатый кератит (эпителиальные лоскуты, скрученные в виде нитей и одним концом фиксированные к роговице), язва роговицы.
При диагностике синдрома сухого глаза учитывают характерные жалобы больного, результаты биомикроскопического исследования краев век, конъюнктивы и роговицы, а также специальных тестов. ■ Проба для оценки стабильности слезной пленки (проба по Норну). При взгляде вниз при оттянутом верхнем веке закапывают 0,1–0,2% раствор флюоресцеина на область лимба на 12 часах. После включения щелевой лампы пациент не должен мигать. Наблюдая за окрашенной поверхностью слезной пленки, определяют время разрыва пленки (черное пятно). Диагностическое значение имеет время разрыва слезной пленки менее 10 с. ■ Проба Ширмера со стандартной полоской фильтровальной бумаги, одним концом введенной за нижнее веко. Через 5 мин полоску извлекают и измеряют длину увлажненной части: ее величина менее 10 мм свидетельствует о небольшом уменьшении продукции слезной жидкости, а менее 5 мм – о значительном. ■ Проба с 1% раствором бенгальского розового особенно информативна, так как позволяет выявить погибшие (окрашенные) клетки эпителия, покрывающего роговицу и конъюнктиву.
Диагностика синдрома сухого глаза сопряжена с большими трудностями и основывается только на результатах комплексной оценки жалоб больного и клинической картины, а также результатах функциональных проб.
Лечение остается трудной задачей и предполагает постепенный индивидуальный подбор лекарственных средств. Глазные капли, содержащие консервант, переносятся больными хуже и могут вызвать аллергическую реакцию, поэтому предпочтение следует отдавать глазным каплям без консерванта. Главное место занимают средства слезозаместительной терапии. Капли слезы натуральной применяют 3–8 раз вдень, а гелевые композиции офтагель или видисик–гель – 2–4 раза в день. При явлениях аллергического раздражения конъюнктивы добавляют аломид, лекролин или лекролин без консерванта (2 раза в день в течение 2–3 нед). При поражении роговицы применяют капли витасик, карнозин, тауфон или гель солкосерила либо корнерегель.
Пингвекула (жировик) – это слегка возвышающееся над конъюнктивой эластичное образование неправильной формы, располагающееся в нескольких миллиметрах от лимба в пределах глазной щели с носовой или височной стороны. Обычно возникает у пожилых людей симметрично на обоих глазах. Пингвекула не вызывает болезненных ощущений, хотя привлекает внимание пациента. Лечение не требуется, за исключением редких случаев, когда пингвекула воспаляется. В этом случае применяют противовоспалительные глазные капли (дексапос, максидекс, офтан–дексаметазон или гидрокортизон–ПОС), а при сочетании пингвекулы с легкой вторичной бактериальной инфекцией применяют комплексные препараты (дексагентамицин или макситрол).
Крыловидная плева (птеригиум) – плоская поверхностная васкуляризированная складка конъюнктивы треугольной формы, нарастающая на роговицу. Факторы раздражения, ветер, пыль, перепады температуры могут стимулировать рост птеригиума, что приводит к нарушению зрения. Птеригиум медленно продвигается к центру роговицы, плотно соединяется с боуменовой оболочкой и поверхностными слоями стромы. Для задержки роста птеригиума и предупреждения рецидива применяют противовоспалительные и противоаллергические средства (капли аломид, лекролин, дексапос, максидекс, офтан–дексаметазон, гидрокортизон–ПОС или наклоф). Хирургическое лечение нужно проводить в период, когда пленка еще не закрыла центральную часть роговицы. При иссечении рецидивирующего птеригиума производят краевую послойную кератопластику.
Глава 10. Склера
О том, что не сказано,Люди не знают.Народная мудрость
Строение и функции склеры
Склера – наружная, или фиброзная, капсула глаза белого цвета или слегка голубоватая, имеющая форму полого шара.Она не прозрачная и по внешнему виду напоминает сухожилие. Спереди склера граничит с роговицей. Задняя часть наружной капсулы истончена и продырявлена (наподобие решета), через имеющиеся в ней отверстия в мозг уходят пучки зрительных волокон.
Вокруг диска зрительного нерва склера имеет наибольшую толщину – 1–1,2 мм. Кпереди она истончена, и в области экватора толщина склеры достигает 0,3–0,4 мм.
Склера образована из прочной, эластичной соединительной ткани, которая складывается в плотные, переплетающиеся в разных направлениях пучки и пластинки. Такая структура склеры обусловливает ее упругость и большое сопротивление.
Поверхностный эписклеральный слой рыхлый и сливается с еще более рыхлым подконъюнктивальным слоем.
Склеру в нескольких местах пронизывают многочисленные сосуды и нервы, идущие к роговице и сосудистому тракту глаза. Собственных сосудов в склере мало.
Изнутри к склере прилежит сосудистая оболочка глаза.
Склера выполняет функцию наружного каркаса глаза. Она служит опорой для внутренних оболочек.
Заболевания склеры
Строение склеры определяет ее инертность по отношению к действию различных неблагоприятных факторов. Различают две формы воспаления склеры – поверхностную (эписклерит) и глубокую (склерит).Эписклерит – преходящее ограниченное воспаление поверхностного слоя склеры вблизи лимба. Заболевание чаще возникает у лиц среднего возраста, у ⅓ из них развивается одновременно на обоих глазах или сначала на одном, затем на втором глазу.
Клинически эписклерит характеризуется образованием плоских узелков округлой формы вблизи лимба. Узелки покрыты не спаянной с ними гиперемированной конъюнктивой с фиолетовым оттенком, обычно в области открытой глазной щели. Эписклерит не сопровождается выраженным покраснением глаза или болью. На участке воспаления эписклеральные сосуды вытянуты радиально от лимба кзади. Число подконъюнктивальных узелков колеблется от одного до нескольких. Они образуются постепенно вокруг всей роговицы. Эписклерит может сочетаться с розацеа–кератитом или розацеа–дерматитом.
В большинстве случаев эписклерит проходит без лечения. При рецидивирующем течении и появлении болей местно применяют кортикостероиды (глазные капли дексапос, максидекс, офтан–дексаметазон, глазная мазь гидрокортизон–ПОС) или нестероидные противовоспалительные средства в виде капель (наклоф) 3–4 раза в день. При упорном течении назначают нестероидные противовоспалительные средства внутрь.
Склерит – тяжелое воспаление глубоких слоев склеры, сопровождающееся выраженной болью, при котором существует опасность разрушения наружной капсулы глаза в зоне воспаления. Обычно заболевание развивается на фоне общей иммунной патологии у лиц среднего возраста, чаще у женщин. В половине случаев склерит двусторонний.
Начало заболевания постепенное, в течение нескольких дней. Боль может распространяться в другие отделы головы. Глазное яблоко болезненное при прикосновении. Пораженные участки имеют темно–красную окраску с фиолетовым оттенком, нередко окружают всю роговицу (рис. 10.1). Конъюнктива спаяна с пораженным участком склеры, сосуды перекрещиваются в разных направлениях. Иногда выявляют отек склеры.
Склериты классифицируют по анатомическому принципу – передние и задние. Среди передних склеритов различают следующие клинические формы: диффузный, узелковый и более редкий – некротизируюший. Некротизирующий склерит чаще протекает с воспалительной реакцией, реже – без воспаления (перфорирующая склеромаляция).
Некротизирующий склерит без воспаления чаще развивается при длительно существующем ревматоидном артрите, протекает безболезненно. Склера постепенно истончается, проминирует кнаружи, образуется стафилома склеры, через которую просматривается прилегающая темная сосудистая оболочка (рис. 10.2). При малейшей травме легко может наступить разрыв склеры.
Задний склерит наблюдается редко. Больные жалуются на боль в глазу. У них обнаруживают напряженность глаза, иногда ограничение его подвижности, могут развиться экссудативная отслойка сетчатки, отек диска зрительного нерва. Эхография и томография помогают выявить истончение склеры в заднем отделе глаза. Задний склерит обычно возникает при общих заболеваниях организма (ревматизм, туберкулез, сифилис, опоясывающий герпес) и часто осложняется кератитом, катарактой, иридоциклитом, повышением внутриглазного давления.
При лечении местно применяют кортикостероиды (капли дексапос, максидекс, офтан–дексаметазон или мазь гидрокортизон–ПОС), нестероидные противовоспалительные средства в виде капель (наклоф), циклоспорин (циклолип). Нестероидные противовоспалительные средства (индометацин, диклофенак) принимают также внутрь.
При некротизирующем склерите, рассматриваемом как глазное проявление системных заболеваний, необходима иммуносупрессивная терапия (кортикостероиды, циклоспорин, циклофосфамид).
Склерокератит (склерозирующий кератит) характеризуется рецидивирующими атаками склерита с поражением прилегающей части роговицы и возможным вовлечением в патологический процесс радужки и цилиарного тела. В случаях возникновения рецидивов в течение многих лет поражается и центральная часть роговицы. Заболевание имеет хроническое течение (см. главу 11).
Рецидивирующий склерокератит может развиваться при ревматоидных артритах, сифилисе, туберкулезе, подагре.
Местное лечение такое же, как и при других склеритах. Его проводят на фоне специфического общего лечения.
Глава 11. Роговица
Очи – врата солнца.Пифагор
Строение и функции роговицы
Роговица (cornea) – это передний прозрачный отдел наружной капсулы глазного яблока и вместе с тем главная преломляющая среда в оптической системе глаза.Роговица занимает 1/6 площади наружной капсулы глаза, имеет форму выпукло–вогнутой линзы. В центре ее толщина 450–600 мкм, а на периферии – 650–750 мкм. За счет этого радиус кривизны наружной поверхности больше радиуса кривизны внутренней поверхности и составляет в среднем 7,7 мм. Горизонтальный диаметр (11 мм) больше вертикального (10 мм). Полупрозрачная линия перехода роговицы в склеру имеет ширину около 1 мм и называется лимбом. Внутренняя часть зоны лимба прозрачная. Эта особенность делает роговицу похожей на часовое стекло, вставленное в непрозрачную оправку.
К 10–12 годам жизни форма роговицы, ее размеры и оптическая сила достигают параметров, характерных для взрослого человека. В пожилом возрасте по периферии концентрично лимбу из отложения солей и липидов иногда формируется непрозрачное кольцо – старческая дуга (arcus senilis).
В тонком строении роговицы различают 5 слоев, выполняющих определенные функции (рис. 11.1). На поперечном срезе видно, что 9/10 толщины роговицы занимает ее собственное вещество – строма. Спереди и сзади оно покрыто эластичными мембранами, на которых располагается соответственно передний и задний эпителий.
Неороговевающий передний эпителий состоит из нескольких рядов клеток. Самый внутренний из них – слой высоких призматических базальных клеток с крупными ядрами называют герминативным, т. е. зародышевым. Благодаря быстрому размножению этих клеток обновляется эпителий, происходит закрытие дефектов на поверхности роговицы. Два наружных слоя эпителия состоят из резко уплощенных клеток, в которых даже ядра располагаются параллельно поверхности и имеют плоскую наружную грань. Этим обеспечивается идеальная гладкость роговицы. Между покровными и базальными клетками имеется 2–3 слоя многоотростчатых клеток, скрепляющих всю структуру эпителия. Зеркальную гладкость и блеск роговице придает слезная жидкость. Благодаря мигательным движениям век она смешивается с секретом мейбомиевых желез и образовавшаяся эмульсия тонким слоем покрывает эпителий роговицы в виде прекорнеальной пленки, которая выравнивает оптическую поверхность и предохраняет ее от высыхания.
Покровный эпителий роговицы обладает способностью к быстрой регенерации, защищая роговицу от неблагоприятных воздействий внешней среды (пыль, ветер, перепады температуры, взвешенные и газообразные токсичные вещества, термические, химические и механические травмы). Обширные посттравматические неинфицированные эрозии в здоровой роговице закрываются за 2–3 дня. Эпителизацию небольшого дефекта клеток можно увидеть даже в трупном глазу в первые часы после смерти, если изолированный глаз поместить в условия термостата.
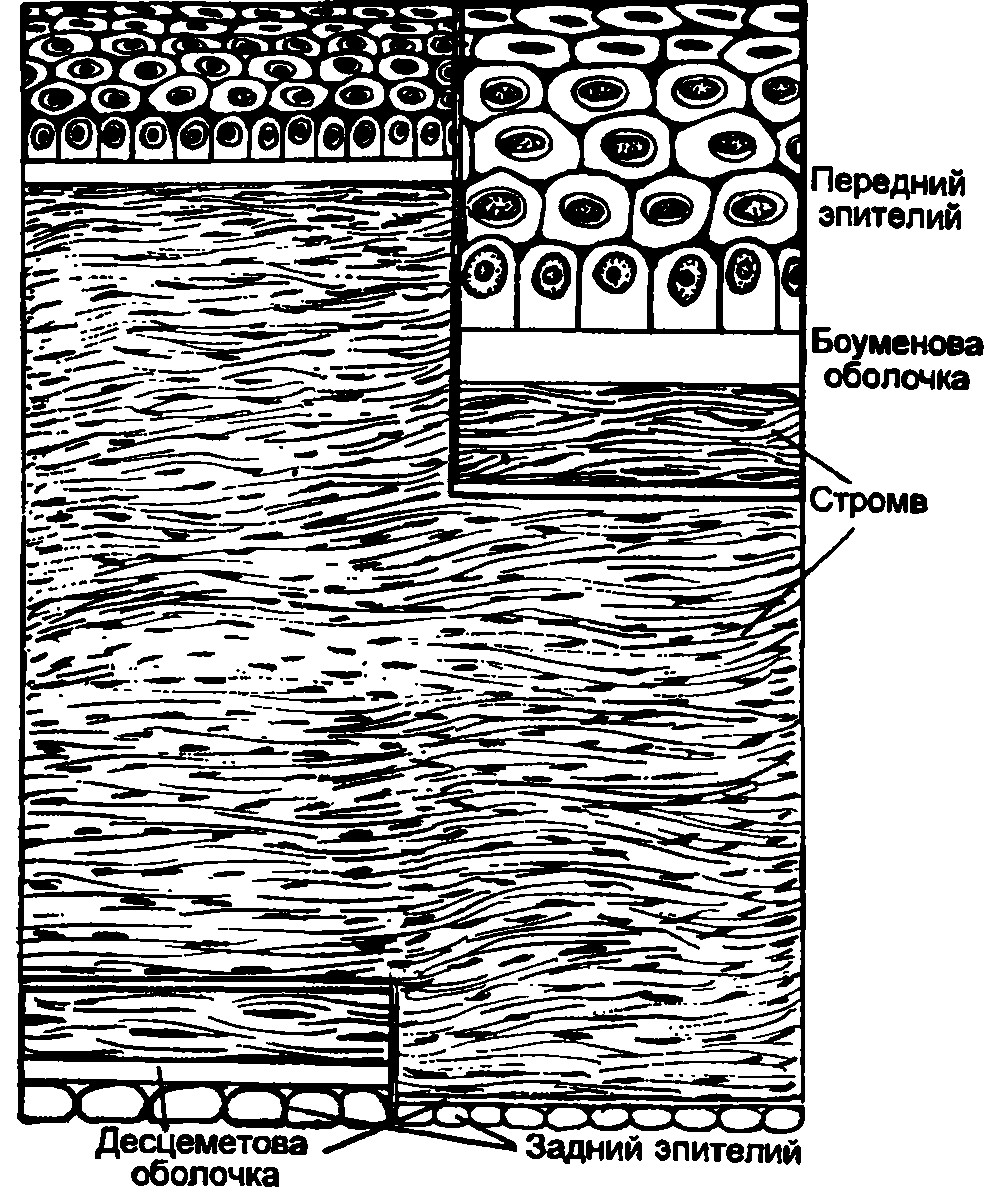 Рис. 11.1. Строение роговицы (схема).
Рис. 11.1. Строение роговицы (схема).
Под эпителием располагается тонкая (8–10 мкм) бесструктурная передняя пограничная мембрана – боуменова оболочка. Это гиалинизированная верхняя часть стромы. На периферии эта оболочка заканчивается, не доходя 1 мм до лимба. Прочная мембрана при ударах удерживает форму роговицы, но она не устойчива к действию микробных токсинов.
Самый толстый слой роговицы – строма. Она представлена тончайшими пластинами, построенными из коллагеновых волокон. Пластины располагаются параллельно друг другу и поверхности роговицы, однако в каждой пластине обнаруживается свое направление хода коллагеновых фибрилл. Такая структура обеспечивает прочность роговицы. Каждый офтальмохирург знает, что сделать прокол в роговице не очень острым лезвием достаточно трудно или даже невозможно. Вместе с тем инородные тела, отлетающие с большой скоростью, пробивают ее насквозь. Между роговичными пластинами имеется система сообщающихся щелей, в которых располагаются кератоциты (роговичные тельца), представляющие собой многоотростчатые плоские клетки – фиброциты, составляющие тонкий синцитий. Они принимают участие в заживлении ран. Кроме таких фиксированных клеток, в роговице присутствуют блуждающие клетки – лейкоциты, количество которых быстро увеличивается в очаге воспаления. Роговичные пластины скреплены между собой склеивающим веществом, содержащим сернистую соль сульфогиалуроновой кислоты. Мукоидный цемент имеет одинаковый коэффициент преломления с волокнами роговичных пластин. Это важный фактор, обеспечивающий прозрачность роговицы.
Изнутри к строме прилежит эластичная задняя пограничная пластинка (десцеметова оболочка), имеющая тонкие фибриллы из вещества, подобного коллагену. Около лимба десцеметова оболочка утолщается, а затем разделяется на волокна, покрывающие изнутри трабекулярный аппарат радужно–роговичного угла. Десцеметова оболочка непрочно связана со стромой и при резком снижении внутриглазного давления образует складки. При сквозном пересечении роговицы эластичная задняя пограничная пластинка сокращается и отходит от краев разреза. При сопоставлении раневых поверхностей края десцеметовой оболочки не соприкасаются, поэтому восстановление целости мембраны задерживается на несколько месяцев. От этого зависит прочность роговичного рубца в целом. При ожогах и гнойных язвах все вещество роговицы может быстро разрушаться и только десцеметова мембрана долго выдерживает действие химических агентов и протеолитических ферментов. Если на фоне язвенного дефекта осталась только десцеметова оболочка, то под действием внутриглазного давления она выпячивается вперед в виде пузырька (десцеметоцеле).
Самый внутренний слой роговицы – задний эпителий (раньше его называли эндотелий или десцеметов эпителий). Это однорядный слой плоских шестигранных клеток, прикрепляющихся к базальной мембране с помощью цитоплазматических выростов. Тонкие отростки позволяют клеткам растягиваться и сокращаться при перепадах внутриглазного давления, оставаясь на своих местах. При этом тела клеток не теряют контакт друг с другом. На крайней периферии задний эпителий вместе с десцеметовой оболочкой покрывает корнеосклеральные трабекулы фильтрационной зоны глаза. Существует мнение, что это клетки глиального происхождения. Они не обмениваются, поэтому их можно назвать долгожителями. Количество клеток с возрастом уменьшается. Клетки заднего эпителия роговицы человека в обычных условиях не способны к полноценной регенерации. Замещение дефектов происходит путем смыкания соседних клеток, при этом они растягиваются, увеличиваются в размерах. Такой процесс замещения не может быть бесконечным. В норме у человека в возрасте 40–60 лет в 1 мм2 заднего эпителия роговицы содержится от 2200 до 3200 клеток. Когда количество их уменьшается до 500–700 на 1 мм2, развивается отечная дистрофия роговицы. В последние годы появились сообщения о том, что в особых условиях (развитие внутриглазных опухолей, грубое нарушение питания тканей) можно обнаружить истинное деление единичных клеток заднего эпителия роговицы на периферии.
Монослой клеток заднего эпителия роговицы выполняет роль насоса двоиного действия, обеспечивающего поступление питательных веществ в строму роговицы и вывод продуктов обмена, отличается избирательной проницаемостью для разных ингредиентов. Задний эпителий защищает роговицу от избыточного пропитывания внутриглазной жидкостью.
Появление даже небольших промежутков между клетками приводит к отеку роговицы и снижению ее прозрачности. Многие особенности строения и физиологии клеток заднего эпителия стали известны в последние годы в связи с появлением метода прижизненной зеркальной биомикроскопии (рис. 11.2).
В роговице нет кровеносных сосудов, поэтому обменные процессы в ней замедлены. Они осуществляются за счет влаги передней камеры глаза, слезной жидкости и сосудов перикорнеальной петлистой сети, расположенной вокруг роговицы. Эта сеть образована из ветвей конъюнктивальных, цилиарных и эписклеральных сосудов, поэтому роговица реагирует на воспалительные процессы, в конъюнктиве, склере, радужке и цилиарном теле. Тонкая сеть капиллярных сосудов по окружности лимба заходит в роговицу всего на 1 мм.
Отсутствие сосудов в роговице восполняется обильной иннервацией, которая представлена трофическими, чувствительными и вегетативными нервными волокнами.
Процессы обмена в роговице регулируются трофическими нервами, отходящими от тройничного и лицевого нервов.
Высокая чувствительность роговицы обеспечивается системой длинных цилиарных нервов (от глазничной ветви тройничного нерва), образующих вокруг роговицы перилимбальное нервное сплетение. Входя в роговицу, они терают миелиновую оболочку и становятся невидимыми. В роговице формируется три яруса нервных сплетений – в строме, под базальной (боуменовой) мембраной и субэпителиально. Чем ближе к поверхности роговицы, тем тоньше становятся нервные окончания и более густым их переплетение. Практически каждая клетка переднего эпителия роговицы обеспечена отдельным нервным окончанием. Этим объясняются высокая тактильная чувствительность роговицы и резко выраженный болевой синдром при обнажении чувствительных окончаний (эрозии эпителия). Высокая чувствительность роговицы лежит в основе ее защитной функции: при легком дотрагивании до поверхности роговицы и даже при дуновении ветра возникает безусловный корнеальный рефлекс – закрываются веки, глазное яблоко поворачивается кверху, отводя роговицу от опасности, появляется слезная жидкость, смывающая пылевые частицы. Афферентную часть дуги корнеального рефлекса несет тройничный нерв, эфферентную – лицевой нерв. Потеря корнеального рефлекса происходит при тяжелых мозговых поражениях (шок, кома). Исчезновение корнеального рефлекса является показателем глубины наркоза. Рефлекс пропадает при некоторых поражениях роговицы и верхних шейных отделов спинного мозга.

 Рис. 11.2. Клетки заднего эпителия роговицы.
а – высокая плотность клеток; б – низкая плотность.
Рис. 11.2. Клетки заднего эпителия роговицы.
а – высокая плотность клеток; б – низкая плотность.
Быстрая прямая реакция сосудов краевой петлистой сети на любое раздражение роговицы возникает благодаря волокнам симпатических и парасимпатических нервов, присутствующих в перилимбальном нервном сплетении. Они делятся на 2 окончания, одно из которых проходит к стенкам сосуда, а другое проникает в роговицу и контактирует с разветвленной сетью тройничного нерва.
В норме роговица прозрачная. Это свойство обусловлено особым строением роговицы и отсутствием сосудов. Выпукло–вогнутая форма прозрачной роговицы обеспечивает ее оптические свойства. Сила преломления световых лучей индивидуальна для каждого глаза и находится в пределах от 37 до 48 дптр, чаше всего составляя 42–43 дптр. Центральная оптическая зона роговицы почти сферична. К периферии роговица уплощается неравномерно в разных меридианах.
Функции роговицы: ■ как наружная капсула глаза выполняет опорную и защитную функцию благодаря прочности, высокой чувствительности и способности к быстрой регенерации переднего эпителия ■ как оптическая среда выполняет функцию светопроведения и светопреломления благодаря прозрачности и характерной форме.
Аномалии развития роговицы
Аномалии развития роговицы выражаются изменением ее величины и формы.Мегалокорнеа – гигантская роговица (диаметр более 11 мм) – иногда является семейно–наследственной аномалией. При этом другая патология отсутствует.
Большая роговица может быть не только врожденной, но и приобретенной патологией. В этом случае роговица увеличивается в размере вторично при наличии некомпенсированной глаукомы в молодом возрасте.
Микрокорнеа – малая роговица (диаметр 5–9 мм) – может быть как односторонней, так и двусторонней аномалией. Глазное яблоко в таких случаях тоже уменьшено в размере (микрофтальм), хотя и отмечаются случаи малой роговицы в глазах нормального размера. При необычно малой или большой роговице имеет предрасположенность к развитию глаукомы. В качестве приобретенной патологии уменьшение размера роговицы сопутствует субатрофии глазного яблока. В этих случаях роговица становится непрозрачной.
Эмбриотоксон – кольцевидное помутнение роговицы, расположенное кониентрично лимбу. Оно очень похоже на старческую дугу. Лечение не требуется.
Плоская роговица может сочетаться с микрокорнеа, рефракция ее снижена (28–29 дптр), имеется предрасположенность к повышению внутриглазного давления из–за сужения угла передней камеры.
Кератоконус, или коническая роговица, – это генетически обусловленная патология роговицы, внешним проявлением которой является изменение ее формы. Роговица истончается в центре, вытягивается в виде конуса. Это происходит по причине недоразвития мезенхимной ткани роговицы и склеры. Вся наружная капсула глаза теряет обычную упругость. Заболевание начинается в возрасте 10–18 лет, а иногда и раньше. Появляется неправильный астигматизм, который не поддается коррекции. Пациент часто меняет очки из–за того, что меняются степень и оси астигматизма. Изменение оси астигматизма иногда можно отметить даже при перемене положения головы.
Процесс чаще двусторонний, но развивается не всегда одинаково и одновременно на обоих глазах. Наблюдение за однояйцевыми близнецами с кератоконусом показало, что у них в одном и том же возрасте появились симптомы заболевания и зафиксированы одинаковые данные рефракции глаза, роговицы, а также степень и ось астигматизма. Спустя несколько лет у обоих близнецов в парных глазах тоже одновременно сформировался кератоконус.
Слабость эластического каркаса роговицы отмечается главным образом в центральном отделе. Вершина конической роговицы всегда опущена книзу и не соответствует проекции зрачка (рис. 11.3). С этим связано появление неправильного астигматизма. При внимательном осмотре в свете щелевой лампы можно увидеть едва заметные почти параллельные друг другу тонкие полоски, локализованные в центральном отделе десцеметовой оболочки – трещины эластической мембраны. Появление данного симптома можно считать первым достоверным признаком кератоконуса. Толщина роговицы в центре постепенно уменьшается, увеличивается глубина передней камеры, оптическая сила достигает 56–62 дптр. При исследовании методом кератотопографии выявляют характерные симптомы изменений оптических свойств роговицы – смещение оптического центра книзу, наличие неправильного астигматизма, большие различия в силе преломления между противолежащими отделами роговицы.
При появлении больших трещин в десцеметовой оболочке внезапно возникает состояние так называемого острого кератоконуса (рис. 11.4). Строма роговицы пропитывается внутриглазной жидкостью, мутнеет, прозрачными остаются только самые периферические отделы. В острой стадии кератоконуса центральный отдел роговицы значительно утолщен, иногда при биомикроскопии можно видеть щели и полости, заполненные жидкостью. Острота зрения резко снижается. Отек в центре роговицы постепенно рассасывается, иногда даже без лечения. Такой процесс всегда завершается формированием более или менее грубого рубца в центральном отделе и истончением роговицы.
 Рис. 11.5. Кератоглобус хронический (а) и острый (б).
Рис. 11.5. Кератоглобус хронический (а) и острый (б).
В начальных стадиях кератоконуса контактная коррекция зрения весьма эффективна. Однако при прогрессирующем истончении и выпячивании роговицы контактная линза не удерживается на вершине конуса.
Радикальным методом лечения кератоконуса является сквозная субтотальная кератопластика с иссечением всей измененной роговицы (см. рис. 11.3). У большинства пациентов (до 95–98%) после операции отмечается высокая острота зрения – от 0,6 до 1,0. Высокий процент прозрачного приживления трансплантата роговицы объясняется рядом факторов. При кератоконусе в роговице нет воспаления, нет сосудов, как правило, отсутствует другая патология глаза.
Показание к операции определяется не степенью растяжения роговицы, а состоянием функции глаза.
Кератоглобус – шаровидная роговица. Причиной заболевания, так же как и при кератоконусе, являетсягенетически обусловленная слабость эластических свойств роговицы. В отличие от кератоконуса растягиваются не центральные, а периферические отделы роговицы, поэтому она увеличивается в размерах, выбухает и принимает форму шара. Глубина передней камеры увеличивается и может достигать 8–10 мм. Внезапное появление отека всей роговицы называют острым кератоглобусом, или водянкой роговицы (рис. 11.5).
Кератоглобус проявляется в детском возрасте, может сочетаться с другими изменениями в глазу и общей патологией, например с синдромом синих склер (Ван–дер–Хуве), включающим тугоухость и ломкость костей.
По мере прогрессирования процесса постепенно увеличиваются кривизна роговицы и общая длина глазного яблока, усиливается рефракция глаза, повышается степень близорукости и астигматизма. В начальных стадиях эффективна очковая и контактная коррекция остроты зрения.
При значительном растяжении роговицы и наличии неправильного астигматизма не удается подобрать удовлетворительную коррекцию, поэтому решают вопрос о хирургическом лечении. Сквозную субтотальную кератопластику при кератоглобусе выполнить значительно сложнее, чем при кератоконусе, из–за резкого истончения периферического отдела роговицы, где производят фиксацию донорского трансплантата. Операция дает хороший результат, если родители помогут ребенку в послеоперационном периоде в течение года соблюдать осторожность при движении, избегать случайных травм.
Заболевания роговицы
В связи с тем что роговица является частью наружной капсулы глаза, она подвергается воздействию всех неблагоприятных факторов внешней среды. Особенностями строения, анастомозирования и иннервации краевой петлистой сети сосудов вокруг роговицы объясняется ее быстрая ответная реакция на развитие патологического процесса в склере, конъюнктиве, радужке и цилиарном теле. В конъюнктивальной полости, сообщающейся через слезные пути с полостью носа, всегда содержится микрофлора. Достаточно малейшей травмы эпителия роговицы, чтобы открылись входные ворота для инфекции.Роговица легко вовлекается в патологический процесс и медленно выходит из него, так как она не имеет сосудов. Все обменные процессы в роговице замедлены.
Среди разнообразных видов патологии роговицы основное место занимают воспалительные заболевания (кератиты) и дистрофии. Кроме того, роговица подвергается травмам и ожогам. Опухоли роговицы развиваются редко (см. главы 20, 23).
Согласно данным статистики, из всех больных, приходящих на амбулаторный прием, у каждого четвертого имеется заболевание роговицы. Социальное значение болезней роговицы объясняется не только высокой частотой развития, но и длительностью лечения, частыми рецидивами, а также снижением остроты зрения. Болезни роговицы являются одной из главных причин слепоты и слабовидения.
Для диагностики патологии роговицы используют метод наружного осмотра, бокового освещения. Максимальную информацию о локализации очага воспаления, глубине его залегания, характере инфильтрации и реакции наружных тканей можно получить при исследовании светового среза роговицы при биомикроскопии с достаточным увеличением. Важное значение имеет исследование чувствительности роговицы. Причина поражения роговицы может быть внутри организма. Ее нужно установить, и тогда лечение, направленное на устранение причины заболевания, в сочетании с местной терапией будет максимально эффективным.
Воспалительные заболевания роговицы – кератиты
Особенностями строения роговицы и отсутствием сосудов объясняется наличие общих субъективных и объективных симптомов при развитии в ней воспалительных процессов разной этиологии как экзогенного, так и эндогенного происхождения. В ответ на любое раздражение роговицы появляется характерная триада субъективных симптомов – светобоязнь, слезотечение и блефароспазм, к которым часто присоединяется ощущение инородного тела под веком. Все это обозначается как роговичный синдром, являющийся важным защитным механизмом глаза, в котором благодаря сложной иннервации участвуют веки и слезная железа. Рис. 11.6. Разновидности инъекции сосудов переднего отрезка глаза и неоваскуляризации роговицы.
а – виды инъекции сосудов переднего отрезка глаза; б – виды неоваскуляризации роговицы.
Рис. 11.6. Разновидности инъекции сосудов переднего отрезка глаза и неоваскуляризации роговицы.
а – виды инъекции сосудов переднего отрезка глаза; б – виды неоваскуляризации роговицы.
В том случае, если раздражение роговицы вызвано попавшей соринкой, то слезная жидкость смывает инородное тело, очищает рану и дезинфицирует ее благодаря лизоциму, содержащемуся в этой жидкости. После удаления инородного тела прекращается слезотечение, уменьшается светобоязнь, но может оставаться ощущение инородного тела, если есть дефект эпителия. Любая шероховатость поверхности роговицы ощущается как инородное тело под веком.
Жалобы на боли в глазу появляются при эрозировании поверхности роговицы. Они могут иррадиировать по всей половине головы.
К объективным симптомам кератита относятся покраснение глаза (перикорнеальная инъекция сосудов), воспалительная инфильтрация (очаговая или диффузная), изменение всех свойств роговицы в зоне воспаления и врастание . новообразованных сосудов.
Перикорнеальная инъекция сосудов – ранний и постоянный симптом воспаления роговицы, обусловленный раздражением глубоких сосудов краевой петлистой сети. Она проявляется в виде розово–синюшного венчика вокруг роговицы. Покраснение всегда диффузное. Отдельные сосуды не просматриваются даже при биомикроскопии. В зависимости от величины очага воспаления перикорнеальная инъекция сосудов может окружать роговицу со всех сторон или проявляться только в секторе поражения роговицы. В тяжелых случаях она приобретает сине–фиолетовую окраску (рис. 11.6).
К перикорнеальной инъекции может присоединиться раздражение конъюнктивальных сосудов, тогда возникает смешанная гиперемия сосудов глазного яблока.
Первая стадия воспалительного процесса в роговице начинается с клеточной инфильтрации и чаше имеет очаговый характер. Инфильтраты могут располагаться на любом участке и на разной глубине. Они могут иметь правильные округлые очертания в виде точек, монеток, форму диска или веточки дерева либо любую другую форму. В острой фазе воспаления границы очага всегда нечеткие из–за отека окружающих тканей. Цвет инфильтрата зависит от его клеточного состава. При малой инфильтрации лейкоцитами очаг имеет серый цвет. В тех случаях, когда гнойная инфильтрация усиливается, очаг приобретает желтоватый оттенок или желтую окраску (рис. 11.7).
В норме роговица гладкая, блестящая, прозрачная, сферичная и высокочувствительная. В зоне очага воспаления изменяются все свойства роговицы: поверхность становится неровной, шереховатой вследствие вздутия и слущивания эпителия, пропадает зеркальный блеск, нарушается прозрачность. В процессе рубцевания крупных дефектов роговицы утрачивается сферичность поверхности. Чувствительность роговицы может снижаться, вплоть до полного отсутствия. Повышение чувствительности отмечается редко, в основном при токсико–аллергических заболеваниях. Изменение чувствительности роговицы может отмечаться не только в больном, но и в парном глазу.
Через несколько дней от начала воспаления в сторону инфильтрата врастают сосуды. На первом этапе они играют положительную роль, так как способствуют заживлению роговицы, однако впоследствии, несмотря на то что сосуды частично запустевают, они приводят к значительному снижению остроты зрения. При поверхностно расположенных инфильтратах ярко–красные сосуды конъюнктивы переходят границу лимба, древовидно ветвятся и направляются к инфильтрату под покровом эпителия (см. рис. 11.6, б). При биомикроскопии в них виден ток крови. Это – поверхностная неовакуляризация. Воспалительные процессы, глубоко проникающие в ткани роговицы, сопровождаются врастанием склеральных и эписклеральных сосудов. Это – глубокая неоваскуляризация роговицы. Она имеет характерные признаки. Глубокие сосуды проходят в средних и глубоких слоях стромы, с трудом пробираются между роговичными пластинами, не ветвятся, имеют вид щеточки или параллельно идущих ниточек. Яркость окраски и рисунка сосудов затушевывается толстым слоем отечных роговичных пластин, расположенных над ними.
В некоторых случаях врастают поверхностные и глубокие сосуды – смешанная неоваскуляризация роговицы.
Вторая стадия воспалительного процесса в роговице – некроз тканей в центральной части инфильтрата, эрозирование и изъязвление поверхности. Течение процесса в этой стадии зависит от его этиологии, патогенности возбудителя, общего состояния организма, проводимого лечения и других факторов. В патогенезе кератитов важное значение имеет состояние общего и местного иммунитета. В одних случаях язва роговицы может ограничиваться зоной первичного поражения, в других – быстро распространяется в глубину и ширину и за несколько часов может расплавить всю роговицу. Дно язвы может быть чистым или покрыто гнойным экссудатом, края язвы – ровными или набухшими, инфильтрированными. Наличие одного подрытого края с нависающим козырьком свидетельствует о прогрессировании процесса в данном направлении.
По мере отторжения некротических масс очищаются дно и края язвы, наступает период регрессии, воспалительный процесс переходит в третью стадию: усиливается неоваскуляризация роговицы, края язвы сглаживаются, дно начинает выполняться белесой рубцовой тканью. Появление зеркального блеска свидетельствует о начале процесса эпителизации. Если нет уверенности в том, что эпителизация завершилась, на роговицу наносят каплю колларгола или флюоресцеина: дефекты эпителия приобретут коричневый или оранжевый цвет (рис. 11.8). Когда дефект полностью покрывается эпителием, лечебный режим постепенно сокращают.
Исходы кератитов неодинаковы. Существенное значение имеет глубина распространения воспалительного процесса. Поверхностные эрозии и инфильтраты, не доходящие до боуменовой оболочки, заживают, не оставляя следа. После заживления более глубоких инфильтратов образуются дефекты в виде фасеток разной величины и глубины. Дно их закрывается соединительнотканным рубцом разной степени плотности и глубины залегания. От локализации рубца зависит острота зрения. Любое помутнение в периферическом отделе роговицы не оказывает влияния на остроту зрения и является лишь косметическим дефектом. Центрально расположенные рубцы всегда вызывают снижение зрения. Различают три вида помутнений: облачко, пятно и бельмо.
Облачко (nubecula) – тонкое полупрозрачное ограниченное помутнение сероватого цвета, не видимое невооруженным глазом. Однако при расположении облачка точно по центру роговицы зрение незначительно Ухудшается (рис. 11.9, а).
Пятно (macula) – более плотное ограниченное помутнение беловатого цвета. Его видно при наружном осмотре. Такое помутнение приводит к значительному снижению остроты зрения (рис. II.9, б).
Бельмо (leucoma) – плотный толстый непрозрачный рубец роговицы белого цвета. Он вызывает резкое снижение остроты зрения вплоть до полной утраты предметного зрения в зависимости от размеров бельма и соотношения его с площадью зрачка (рис. 11.9, в).
Глубокие язвы способны расплавить роговицу вплоть до внутренней эластической мембраны. Она остается прозрачной, но под действием внутриглазного давления выбухает вперед в виде пузырька (descemetocele; рис. 11.10). Такая грыжа десцеметовой оболочки не только является помехой для зрения, но и несет угрозу перфорации роговицы. Прободение язвы обычно завершается образованием грубого бельма, сращенного с радужкой (leucoma corneае adherens). При истечении внутриглазной жидкости радужка смещается к прободному отверстию и тампонирует его. Передняя камера при этом сокращается или отсутствует. Сращения радужки с роговицей называют передними синехиями. Впоследствии они могут послужить причиной развития вторичной глаукомы. Если произошло ущемление радужки в перфорационном отверстии, она может мешать формированию плотного рубца, в результате чего образуется фистула роговой оболочки (рис. 11.11).
Под действием повышенного внутриглазного давления истонченные бельма, спаянные с радужной, могут растягиваться, образуя выпячивания над поверхностью роговицы (рис. 11.12) – стафиломы (staphyloma comeae).
Последствия кератитов становятся еще более тяжелыми, если воспалительный процесс переходит на склеру, радужку и цилиарное тело.
Классификация кератитов. Известно большое количество этиологических факторов возникновения кератитов.. Выделяют две основные группы кератитов – экзогенные и эндогенные.
К экзогенным относят: ■ бактериальные, в том числе посттравматические и связанные с заболеваниями придатков глаза (конъюнктивы, век и слезных органов) ■ вирусные (аденовирусный эпидемический кератоконъюнктивит, трахоматозный паннус; см. главу 9) ■ грибковые (актиномикоз, аспергиллез).
В группу эндогенных кератитов относят: ■ инфекционные, вызванные специфическими инфекциями (сифилис, туберкулез, бруцеллез, малярия, лепра и др.) ■ вирусные (герпетические, эпидемический кератоконъюнктивит, коревые, оспенные) ■ нейрогенные (нейропаралитический, рецидивирующая эрозия роговицы) ■ авитаминозные и гиповитаминозные ■ невыясненной этиологии (розацеа–кератит, рецидивирующая эрозия, нитчатый кератит).
Диагностика кератита в большинстве случаев не вызывает затруднений. Роговица доступна осмотру, поэтому не требуются сложные исследования, к тому же при кератите имеются характерные субъективные и объективные симптомы. Значительно сложнее определить этиологию процесса. С этой целью используют специальные лабораторные методы, чтобы подтвердить или исключить причину воспалительного процесса, установленную на основании особенностей клинического течения кератита.
Перикорнеальная инъекция сосудов в сочетании с роговичным синдромом всегда указывает на наличие воспаления в переднем отрезке глаза. Необходимо провести дифференциальную диагностику между кератитом и иридоциклитом. Если в роговице нет помутнений, она гладкая, блестящая, сферичная и не нарушена ее чувствительность, кератит исключают. Труднее разобраться, если в этом глазу уже был кератит. Старое помутнение отличается от свежего очага воспаления тем, что оно имеет четкие границы, не выбухает, а, наоборот, может быть тоньше окружающих участков роговицы, имеет гладкую, блестящую поверхность, пронизано вялыми, полузапустевишми сосудами, отсутствует перикорнеальная инъекция сосудов.
Важным дифференциально–диагностическим симптомом кератита является снижение чувствительности в здоровых участках роговицы и в парном глазу. Это свидетельствует о наличии герпетического или нейрогенного кератита. Для кератитов, вызванных различными экзогенными факторами, характерно острое начало с обязательным поражением поверхностных слоев роговицы, некрозом инфильтрата, образованием эрозий и язв роговицы разной глубины и протяженности, поэтому экзогенные кератиты в некоторых классификациях называют поверхностными. В отличие от экзогенных эндогенные воспаления роговицы характеризуются более вялым и длительным течением. Инфильтрация может быть разлитой или локальной, располагается преимущественно в глубоких слоях. Поверхностные слои не изъязвляются. Такие кератиты называют глубокими.
При поверхностных кератитах с открытой, эрозированной поверхностью всегда требуется экстренная цомощь.
Экзогенные (поверхностные) кератиты
Бактериальный кератиты
Бактериальный кератиты обычно проявляются в виде ползучей язвы. Чаще всего ее вызывает пневмококк, иногда – стрептококки и стафилококки, содержащиеся в застойном содержимом слезного мешка и конъюнктивальной полости. Непосредственным провоцирующим фактором обычно бывает травма – внедрение инородного тела, случайные царапины веткой дерева, листом бумаги, выпавшей ресницей. Часто небольшие повреждения остаются незамеченными. Для внедрения кокковой флоры достаточно минимальных входных ворот.Болезнь начинается остро: появляются слезотечение, светобоязнь, больной не может самостоятельно открыть глаз, беспокоят сильные боли в глазу. При осмотре выявляют перикорнеальную инъекцию сосудов, желтоватый инфильтрат в роговице. После его распада образуется язва, склонная к распространению. В то время как один ее край эпителизируется, другой остается инфильтрированным, подрытым в виде кармана (рис. 11.13). За несколько дней язва может занять значительную площадь роговицы. В воспалительный процесс быстро вовлекаются радужка и цилиарное тело, усиливаются боль в глазу и перикорнеальная инъекция, появляются симптомы, характерные для иридоциклита. Ползучая язва часто сопровождается образованием гипопиона – осадка гноя в передней камере с ровной горизонтальной линией (рис. 11.14). Наличие фибрина во влаге передней камеры приводит к склеиванию радужки с хрусталиком. Воспалительный процесс "ползет" не только по поверхности, но и вглубь вплоть до десцеметовой оболочки, которая дольше всего противостоит литическому действию микробных ферментов. Нередко образуется десцеметоцеле, а затем и перфорация роговицы. Возбудитель ползучей язвы проникает в переднюю камеру, существенно осложняя течение воспалительного процесса. В ослабленном организме и при недостаточном лечении микробы проникают в задний отдел глаза, вызывая очаговое или разлитое гнойное воспаление в стекловидном теле (эндофтальмит) или расплавление всех оболочек глаза (панофтальмит, см. главу 23). При появлении очагов инфекции в стекловидном теле показано срочное удаление гнойного содержимого из полости глаза (витрэктомия) с промыванием ее антибиотиками, что позволяет сохранить глаз как косметический орган, а иногда и остаточное зрение.
В тех случаях, когда после перфорации роговицы воспалительный процесс стихает, начинает формироваться грубое бельмо роговицы, обычно сращенное с радужкой.
При ползучей язве долго отсутствуют врастающие сосуды. С появлением неоваскуляризации процесс рубцевания идет быстрее.
Профилактику экзогенного кератита необходимо проводить при любой, даже незначительной травме роговицы: попала соринка, ресница, случайная легкая царапина. Для того чтобы эрозия роговицы не стала входными воротами для инфекции, достаточно закапать в глаз любые антибактериальные глазные капли 2–3 раза в день, а на ночь положить за веко глазную мазь с антибиотиками. Так же следует поступить, оказывая первую помощь пациенту, у которого выявлен поверхностный кератит, только инстилляции антибактериальных капель нужно проводить каждый час, до тех пор, пока больной не попадет на прием к специалисту. Если диагноз кератита поставлен на приеме у врача–окулиста, сначала берут мазок содержимого конъюнктивальной полости или соскоб с поверхности роговичной язвы, чтобы выявить возбудителя заболевания и определить его чувствительность к антибактериальным препаратам, затем назначают лечение, направленное на подавление инфекции и воспалительной инфильтрации, улучшение трофики роговицы. Для подавления инфекции используют антибиотики: левомицетин, неомицин, канамицин (капли и мазь), ципромед, окацин. Выбор противомикробных препаратов и их сочетание зависят от вида возбудителя и его чувствительности к лекарственным средствам.
В тяжелых случаях сульфаниламидные препараты и антибиотики вводят под конъюнктиву или парабульбарно, соблюдая рекомендованные дозировки.
С целью профилактики иридоциклита назначают инстилляции мидокториатиков. Частота их закапывания индивидуальна и зависит от выраженности воспалительной инфильтрации и реакции зрачка.
Стероидные препараты назначают местно в период рассасывания воспалительных инфильтратов после того, как эпителизируется поверхность язвы. В это время эффективны препараты, содержащие антибиотик широкого спектра действия и глюкокортикоид (гаразон). Наряду с этими препаратами применяют ингибиторы протеолиза, иммунокорректоры, ^йтигистаминные и витаминные препараты местно и внутрь, а также средства, улучшающие трофику и процесс эпителизации роговицы (баларпан, тауфон, солкосерил, актовегин, карнозин, этаден и др.).
Бактериальные кератиты чаще всего заканчиваются формированием более или менее плотного бельма в роговице. При центральном расположении помутнения проводят восстановительное хирургическое лечение не ранее чем через год после стихания воспалительного процесса.
Краевые кератиты возникают при воспалительных заболеваниях век, конъюнктивы и мейбомиевых желез. Непосредственным толчком к развитию воспаления в роговице может быть микротравма или разрушающее действие токсинов конъюнктивального секрета. Существует предположение, что краевые инфильтраты и язвы возникают из–за нарушения питания роговицы (особенно у пожилых людей) вследствие сдавления краевой петлистой сети валиком отечной конъюнктивы глазного яблока.
При затянувшихся конъюнктивитах по краю роговицы сначала появляются едва заметные серые точки, которые быстро превращаются в узелки. При своевременном лечении они быстро рассасываются, не оставляя следа. В других случаях узелки сливаются в сплошной краевой полулунный инфильтрат, склонный к изъязвлению. Краевые язвы характеризуются обильной неоваскуляризацией от сосудов краевой петлистой сети, но, несмотря на это, они долго не заживают. После рубцевания иногда остаются довольно грубые помутнения, но они не оказывают влияния на функции глаза.
Лечение должно быть направлено на устранение причины заболевания, в остальном оно такое же, как при других язвах роговицы.
Грибковые кератиты
Грибковые кератиты развиваются редко, их вызывают плесневые, лучистые и дрожжевые грибы. Заражение происходит после незначительных повреждений роговицы, чаще в сельской местности. Возможен перенос грибов из кожных очагов в глаз. Первые симптомы появляются быстро – уже на 2–3–й день после травмы. Воспалительный очаг чаще локализуется в поверхностных слоях.В глубокие слои грибы могут проникнуть вместе с ранящим предметом. Если инородное тело в течение длительного периода времени остается в роговице, может развиться ползучая язва со всеми свойственными ей симптомами и последствиями.
В клинической картине грибковых поражений роговицы отмечаются характерные особенности. Уже на основании внешнего вида инфильтрата можно предположить грибковую природу заболевания. Субъективные симптомы и перикорнеальная инъекция сосудов выражены слабо при наличии довольно большого очага поражения в роговице. Характерна белая или желтоватая окраска очага воспаления, имеющего четкие границы. Поверхность его сухая, зона инфильтрации похожа на солевой инкрустат, иногда она бугристая или творожистая, как будто состоит из крупинок и слегка выступает над поверхностью роговицы. Очаг обычно окружен ограничительным валиком инфильтрации. Клиническая картина может быть как бы застывшей в течение нескольких дней или даже 1–2 нед. Однако изменения постепенно нарастают. Валик инфильтрации вокруг очага начинает разрушаться, ткань роговицы некротизируется. В это время весь белый сухого вида очаг может отделиться самостоятельно или легко снимается скребцом. Под ним открывается углубление, которое медленно эпителизируется, а впоследствии замещается бельмом. Для грибковых кератитов характерно отсутствие неоваскуляризации. Ползучие язвы грибковой природы обычно сочетаются с гипопионом. Возможны и перфорации роговицы с образованием грубого бельма, сращенного с радужкой, хотя это нехарактерно для грибкового кератита. В материале, полученном из очага воспаления, при микроскопическом исследовании обнаруживают плотное переплетение нитей плесневого или друзы лучистого гриба.
Несмотря на то что в типичных случаях клиническая картина грибкового кератита имеет довольно заметные особенности, достоверная этиологическая диагностика не всегда бывает простой, так как наряду с характерными наблюдаются и другие проявления грибкового кератита. Кроме того, фибы могут осложнить течение бактериального кератита в некротической стадии воспаления. Они хорошо размножаются в тканях, в которых слабо выражены окислительные процессы. В связи с этим при всех торпидно протекающих кератитах необходимо провести исследование некротического материала на наличие грибов. При подозрении на грибковый кератит стероиды не применяют, так как они активизируют рост грибов.Творожистый центральный участок в очаге воспаления удаляют скребцом, очищают дно и края острой ложечкой, затем тушируют 5% спиртовым раствором йода. Удаленный материал подвергают исследованию.
При лечении грибковых кератитов назначают внутрь интраконазол или кетоконазол, нистатин или другие препараты, к которым чувствителен конкретный вид грибов. Местно используют инстилляции амфотерицина, нистатина, сульфадимизина и актинолизата (при актиномикозе). Интраконазол назначают по 200 мг внутрь 1 раз в сутки в течение 21 дня. С целью предотвращения развития побочной инфекции применяют сульфаниламиды в каплях, глазные мази с антибиотиками. При длительном упорном течении грибковых кератитов с расположением очага воспаления в центральном отделе роговицы показана лечебная послойная кератопластика.
Эндогенные (глубокие) кератиты
Паренхиматозный кератит при врожденном сифилисе расценивают как позднее проявление общего заболевания. Кератит обычно развивается в возрасте от 6 до 20 лет, но известны случаи возникновения типичного паренхиматозного кератита и в раннем детстве, и в зрелом возрасте. В течение длительного периода времени глубокий стромальный кератит считали проявлением туберкулеза, и только с появлением методов серологической диагностики было установлено, что причина заболевания – врожденный сифилис. Почти у всех больных паренхиматозным кератитом (80–100%) реакция Вассермана положительная. В настоящее время полную триаду симптомов врожденного сифилиса (паренхиматозный кератит, изменение передних зубов и глухота) обнаруживают редко, но всегда, кроме болезни глаз, выявляют какие–либо другие проявления основного заболевания: изменение костей черепа, носа, дряблость и складчатость кожи лица, гуммозные остеомиелиты, воспаления коленных суставов.Что касается патогенеза этого заболевания, он также достаточно сложен. Известно, что основным звеном патогенеза сифилитического воспаления является васкулит, а в роговице нет сосудов. В настоящее время точно установлено, что паренхиматозный кератит у плода и новорожденного вызывают спирохеты, проникшие в роговицу в период внутриутробного развития, когда в пей имелись сосуды. Другой патогенез у позднего врожденного стромального кератита, развивающегося уже при отсутствии сосудов: это анафилактическая реакция роговицы.
В конце периода внутриутробного развития, когда редуцируются сосуда, происходит сенсибилизация ткани роговицы к продуктам распада спирохет. Вследствие этого в первые два десятилетия жизни при активизации врожденного сифилиса, когда в крови повышена концентрация продуктов распада спирохет, любой провоцирующий фактор (травма, простудные заболевания) приводит к развитию анафилактической реакции в роговице. Существуют и другие данные, свидетельствующие о том, что сифилитический кератит вызывается особой формой фильтрующихся спирохет.
Воспалительный процесс начинается с появления малозаметных точечных очагов в периферическом отделе роговицы, чаще в верхнем секторе. Субъективные симптомы и перикорнеальная инъекция сосудов выражены слабо. Количество инфильтратов постепенно увеличивается, они могут занимать всю роговицу. При наружном осмотре роговица кажется диффузно мутной, наподобие матового стекла. При биомикроскопии видно, что инфильтраты залегают глубоко, имеют неодинаковую форму (точки, пятна, полоски); располагаясь в разных слоях, они накладываются друг на друга, вследствие чего создается впечатление диффузной мути. Поверхностные слои, как правило, не повреждаются, дефекты эпителия не образуются. Оптический срез роговицы может быть утолщен почти в 2 раза.
Выделяют 3 стадии течения воспалительного процесса. Продолжительность периода начальной инфильтрации 3–4 нед. Он сменяется стадией неоваскуляризации и распространения патологического процесса по плошади роговицы. К первым инфильтратам подходят глубокие сосуды, способствующие рассасыванию помутнений, а рядом с ними появляются новые очаги воспаления, к которым тоже через 3–4 нед подходят щеточки глубоких сосудов. Таким образом процесс медленно распространяется от периферии к центру. Около лимба помутнения рассасываются, но увеличивается количество сосудов, идущих к новым очагам в центре. К концу этого периода вся роговица пронизана густой сетью глубоких сосудов. При этом может возникнуть и поверхностная неоваскуляризация.
Во II стадии заболевания обычно появляются симптомы иридоциклита, усиливается перикорнеальная инъекция сосудов, стушевывается рисунок радужки, сокращается зрачок, появляются преципитаты, которые трудно рассмотреть за тенью инфильтратов роговицы.
Прогрессирование заболевания продолжается 2–3 мес, затем наступает 111 стадия – период регрессии, длительность которого 1–2 года. В течение этого периода, начиная с периферии, роговица становится прозрачной, запустевает и исчезает часть сосудов, однако острота зрения долго не восстанавливается, так как центральный отдел очищается в последнюю очередь.
После перенесенного паренхиматозного кератита в строме роговицы на всю жизнь остаются следы запустевших и отдельные полузапустевшие сосуды, очаги атрофии в радужке и хориоидее. У большинства пациентов острота зрения восстанавливается до 0,4–1,0, они могут читать и работать.
При выявлении у ребенка паренхиматозного кератита необходима консультация венеролога не только ребенку, но и членам его семьи.
Паренхиматозный кератит при приобретенном сифилисе. Заболевание развивается крайне редко, бывает односторонним со слабовыраженными симптомами. Васкуляризация роговицы и ирит обычно отсутствуют. Восстановительный процесс может стихнуть, не оставив следов. Дифференциальную диагностику проводят с диффузным туберкулезным кератитом.
Гуммозный кератит – это очаговая форма воспаления, редко наблюдающаяся при приобретенном сифилисе. Гумма всегда располагается в глубоких слоях. Процесс осложняется иритом или иридоциклитом. При распаде очага может образоваться язва роговицы. Эту форму кератита необходимо дифференцировать от глубокого очагового туберкулезного кератита.
Лечение проводят совместно венеролог и офтальмолог, так как основным заболеванием и причиной возникновения кератита является сифилис. Специфическое лечение не предотвращает развития паренхиматозного кератита на втором глазу, однако существенно снижает частоту рецидивов. Больным назначают пенициллин, бициллин, новарсенол, миарсенол, бийохинол, осарсол, препараты йода по имеющимся схемам, десенсибилизирующие и витаминные препараты.
Местное лечение направлено на рассасывание инфильтратов в роговице, профилактику иридоциклита и случайных эрозий роговицы. Для предотвращения развития иридоциклита назначают инстилляции мидриатиков 1 раз в день или через день под контролем расширения зрачка. При возникновении ирита количество инстилляций увеличивают до 4–6 раз в день (1% раствор атропина сульфата). Если образовались спайки и зрачок не расширяется, используют электрофорез с атропином, капли и турунды с адреналином (1:1.000). Хороший лечебный эффект дают кортикостероиды (дексазон, дексаметазон) в виде подконъюнктивальных инъекций и инстилляций. В связи с тем что лечение проводят в течение длительного периода времени (1–2 года), необходимо чередовать препараты в пределах одной группы лекарств и периодически отменять их. Введение мидриатиков также необходимо прекращать на несколько дней. Если зрачок самостоятельно не сокращается, применяют миотики. Как только зрачок сузился, его снова расширяют. Такую процедуру называют гимнастикой радужки. Она предотвращает сращение обездвиженного широкого зрачка с хрусталиком.
В период регрессии назначают капли и мази, улучшающие трофику и предотвращающие образование эрозий роговицы.
Туберкулезные кератиты.
Туберкулезные кератиты могут развиваться в результате гематогенного метастазирования микобактерий туберкулеза или как туберкулезно–аллергическое заболевание.Гематогенные туберкулезные кератиты проявляются в трех формах – как диффузный, очаговый или склерозирующий кератит. Клиническая картина при этих формах воспаления имеет отличительные особенности.
Диффузный кератит характеризуется глубоким расположением инфильтрации в глубоких слоях роговицы. По внешним проявлениям он иногда может напоминать сифилитический паренхиматозный кератит, однако при биомикроскопии определяют симптомы, характерные для туберкулезного кератита. Среди диффузной инфильтрации стромы отмечаются отдельные, не сливающиеся друг с другом довольно крупные желтоватые очаги. Воспалительный процесс захватывает не всю роговицу: в центре или на периферии остаются непораженные участки. Новообразованные сосуды появляются поздно, через 2–4 мес. Они проходят в глубоких слоях, но, кроме этих сосудов, почти всегда имеется поверхностная неоваскуляризация. Поражается один глаз. Течение заболевания длительное, с периодическими обострениями. Воспаление заканчивается образованием грубого васкуляризированного бельма, для ликвидации которого требуется хирургическое лечение (рис. П. 15).
Глубокий инфильтрат роговицы – это очаговый туберкулезный воспалительный процесс. Один или несколько очагов залегают в самых глубоких слоях роговицы, вблизи десцеметовой оболочки, вследствие чего она может собираться в складки. Васкуляризация незначительная. Новообразованные сосуды врастают в виде дорожки к очагу воспаления и имеют необычный для глубоких сосудов вид – они ветвятся. Течение заболевания длительное, могут возникать рецидивы. Очаговый и диффузный гематогенный туберкулезный кератит почти всегда осложняется иридоциклитом. Заживление очагового кератита сопровождается образованием бельма.
Склерозирующий туберкулезный кератит развивается одновременно с воспалением склеры. Вначале около лимба появляются мелкие очаги инфильтрации в глубоких слоях стромы. Субъективные симптомы воспаления и неоваскуляризация выражены слабо. По мере рассасывания очагов первой волны ближе к центру роговицы появляются новые очаги. Воспалительный процесс сохраняется в течение нескольких лет. Он может развиваться по кругу со всех сторон или только с одной стороны. После заживления очагов никогда не происходит полного просветления роговицы. Создается впечатление, что склера наползает на роговицу. В связи со значительной длительностью заболевания и хроническим раздражением сосудов и нервных окончаний краевой петлистой сети роговицы, анастомозирующих с сосудами большого артериального круга радужки, склерозирующий кератит всегда сопровождается иритом или иридоциклитом, нередко осложняется вторичной глаукомой. Склерозирующий кератит может возникать не только при туберкулезе, но также при сифилисе, ревматизме и подагре.
Этиологическая диагностика любого туберкулезного метастатического кератита сложна. Даже выявление очагового туберкулезного процесса в легких не является доказательством туберкулезной природы заболевания глаз, так как одновременное развитие очагового метастатического воспаления глаза и легких отмечается редко. Положительные туберкулиновые пробы Пирке и Манту свидетельствуют об инфицированное™ организма, но это не значит, что кератит тоже имеет туберкулезную этиологию. Причина развития воспаления в глазу может быть другой. С уверенностью утверждать, что кератит имеет туберкулезную природу можно только в том случае, если в ответ на подкожное введение малых доз туберкулина через 72 ч появляется очаговая ответная реакция в глазу (в роговице, радужке или хориоидее). Такая диагностика не совсем безопасна, но при отсутствии других способов установления этиологии кератита она очень важна. Только этиологическая терапия может способствовать уменьшению продолжительности лечения и предупредить рецидивы заболевания. Чем быстрее прекратится воспалительный процесс в глазу, тем меньше осложнений возникнет в ходе заболевания и больше надежды на сохранение зрения.
Туберкулезно–аллергические (фликтенулезные, скрофуяезные) кератиты – часто встречающаяся форма туберкулезных поражений роговицы у детей и взрослых. Большинство больных – дети и подростки.
Характерным признаком туберкулезно–аллергического кератита являются мелкие (милиарные) или более крупные одиночные (солитарные) узелковые высыпания на роговице, называемые фликтенами, что в переводе означает "пузырек”. В настоящее время известно, что фликтены в морфологическом отношении являются очагами инфильтрации роговицы лимфоцитами, плазматическими и эпителиоидными клетками. Количество и глубина залегания фликтен могут быть различными. Сероватые полупрозрачные возвышения сначала возникают у лимба, затем появляются новые узелки как на периферии, так и в центре роговицы.
Фликтенулезные кератиты развиваются на фоне туберкулеза легких или лимфатических узлов. Возникновение специфических фликтен у лимба является подтверждением диагноза туберкулеза. При морфологическом исследовании во фликтенах не обнаруживают микобактерии туберкулеза. Воспалительный процесс является аллергической реакцией на циркулирующие в крови продукты распада микобактерий туберкулеза. Общее ослабление организма, авитаминоз, гельминтозы могут выполнять роль факторов, способствующих развитию воспаления.
Триада субъективных роговичных симптомов (светобоязнь, слезотечение, блефароспазм) резко выражена. Дети прячутся в темном углу, ложатся лицом в подушку, без капельной анестезии не могут открыть глаза. Судорожное сжимание век и постоянное слезотечение вызывают отек и мацерацию кожи век и носа. Такая клиническая картина характерна для скрофулезного кератита.
При объективном исследовании выявляют яркую перикорнеальную или смешанную инъекцию сосудов. К фликтенам всегда подходят веточки новообразованных поверхностных сосудов. Под влиянием активного специфического и противоаллергического лечения фликтены могут рассосаться, оставив легкое помутнение в роговице, пронизанное полузапустевшими сосудами.
Заболевание начинается остро, затем обычно принимает затяжное течение, характеризуется частым рецидивированием. Повторные атаки протекают более вяло и длительно. Очаги инфильтрации распадаются и превращаются в язвы. При наличии обильной неоваскуляризации дефекты эпителизируются довольно быстро – за 3–7 дней. В результате остаются глубокие ямки – фасетки, которые очень медленно выполняются соединительной тканью.
В осложненных случаях некроз стромы роговицы может достигать самых глубоких слоев. Известны случаи перфорации роговицы с выпадением радужки. У ослабленных людей распадающиеся фликтены могут сливаться, в результате чего образуются обширные зоны некроза. Присоединение грибковой или кокковой инфекции может привести к гибели глаза.
В последние годы благодаря появлению стероидных препаратов затяжные формы заболевания наблюдаются редко. Аллергическое туберкулезное воспаление роговицы может проявляться в виде атипичных форм – фасцикулярного кератита щли фликтенулезного паннуса.
Фасцикулярный кератит (пучковидный кератит, "странствующая" фликтена) начинается с появления у лимба одной фликтены в сочетании с выраженной пери корнеальной инъекцией сосудов и триадой субъективных симптомов. После врастания новообразованных сосудов воспалительная инфильтрация постепенно рассасывается у периферического края и усиливается в центральной части. Фликтена медленно перемещается к центру, за ней тянется пучок новообразованных сосудов. Рыхлый приподнятый, прогрессирующий край инфильтрата не подвергается глубокому изъязвлению, однако течение воспалительного процесса длительное, часто рецидивирующее. Продвижение инфильтрата может продолжаться до тех пор, пока "странствующая" фликтена не достигнет противоположного края роговицы.
Фликтенулезный паннус образуется при врастании большого количества поверхностных сосудов в роговицу. Они тянутся к узелкам воспаления и густо пронизывают всю поверхность роговицы, вследствие чего она становится темно–красной. В отличие от трахоматозного паннуса сосуды врастают со всех сторон, а не только сверху. Как и фликтенулезный кератит, паннус характеризуется частым рецидивированием и формированием грубого васкуляризированного бельма.
Лечение: выбор режима общей терапии туберкулеза осуществляет фтизиатр. Он определяет рациональную схему сочетания препаратов I и II рядов, длительность курса лечения, срок проведения повторного курса с учетом иммунного статуса пациента, режим питания и необходимость климатотерапии.
Цель местного лечения – подавление воспалительного процесса в глазу, предотвращение образования задних синехий, улучшение метаболизма в ткани роговицы. В виде инстилляций назначают 3% раствор тубазида, 5% раствор салюзида, стрептомицин–хлоркальциевый комплекс (50.000 ЕД в 1 мл дистиллированной воды), гидрокортизон или дексаметазон. Для профилактики или лечения ирита и иридоциклита применяют мидриатики. Кратность инстилляций определяют в зависимости отстадии воспалительного процесса. На ночь за веко закладывают 5–10% мазь ПАСК или витаминные мази, 20% гель актовегин. Под конъюнктиву вводят дексазон, чередуя его с 5% раствором салюзида, через день или с другой частотой в разные периоды лечения. В стадии рубцевания уменьшают дозы противовоспалительных препаратов, проводят физиотерапию, применяют витаминные препараты, ферменты (трипсин, фибринолизин) для рассасывания спаек.
При лечении туберкулезно–аллергических кератитов большое значение имеют десенсибилизирующая терапия, диета с ограничением потребления углеводов и поваренной соли, климатолечение.
Герпетические кератиты.
Частота развития герпетических поражений глаза неуклонно повышается. Герпес является причиной развития кератита у 50% взрослых больных и 70–80% у детей. Распространение герпеса в последние годы связывают с широким использованием стероидных препаратов, а также с увеличением числа эпидемий гриппа, которые провоцируют вспышки вирусных поражений глаз.Различают первичные и послепервичные герпетические воспалительные процессы в роговице.
Первичными называют кератиты, развивающиеся при первой встрече организма с вирусом. когда в крови еще нет специфических антител. В первом полугодии жизни ребенок защищен от инфекции антителами. полученными от матери, поэтому инфицирование происходит в период от бмес до 5 лет.
Первичный герпетический кератит начинается остро, течет тяжело и длительно, нередко на фоне гриппа или других простудных заболеваний. Увеличиваются околоушные лимфатические железы; развивается конъюнктивит, а затем в роговице появляются беловатые очаги инфильтрации или пузырьки, склонные к изъязвлению. Резко выражен роговичный синдром (светобоязнь, слезотечение, блефароспазм), разви вается обильная неоваскуляризация роговицы, в патологический процесс могут вовлекаться радужка и цилиарное тело. Воспалительный процесс завершается образованием грубого бельма роговицы. Для первичного герпеса характерно рецидивированпе воспаления по краю сформировавшегося рубца роговицы.
Поаепервичным герпетическим кератитом называют воспаление роговицы у ранее инфицированного человека, у которого определяется слабый титр антигенов, когда нарушается равновесие между поселившимися в организме вирусами и уровнем антител.
Охлаждение, стрессы, ультрафиолетовое облучение, воспалительные процессы приводят к снижению сопротивляемости организма. Септические очаги могут обнаруживаться и в других органах. Послепервичные кератиты имеют подострое течение, в патогенетическом плане представляют собой проявление хронической инфекционной болезни. Обычно они не сопровождаются конъюнктивитом. При снижении чувствительности роговицы светобоязнь и слезотечение выражены слабо, неоваскуляризация незначительная. Отмечается склонность к возникновению рецидивов.
По характеру клинических проявлений выделяют поверхностные и глубокие формы герпетического кератита.
Поверхностные формы герпетического кератита включают пузырьковый (везикулезный) герпес роговицы, древовидный, ландкартообразный и краевой кератиты. В клинической практике чаше всего приходится иметь дело с везикулезным и древовидным кератитом.
Везикулезный герпес роговицы начинается с появления резко выраженных светобоязни, слезотечения, блефароспазма, ощущения инородного тела в глазу, которые обусловлены образованием на поверхности роговицы мелких пузырьков в виде приподнятого эпителия. Пузырьки быстро лопаются, оставляя после себя эрозированную поверхность. Заживление дефектов идет медленно, нередко они инфицируются кокковой флорой, что значительно осложняет течение заболевания. На месте эрозий возникают инфильтраты, они могут приобретать гнойный характер. При неосложненном течении после закрытия дефектов в роговице остаются нежные рубчики в виде об' лачка, влияние которых на функцию глаза зависит от места их локализации.
Древовидный кератит начинается, как и везикулезный, с появления пузырьковых высыпаний. Они соединяются и образуют причудливый рисунок в виде веточки дерева в центре роговицы. При внимательном осмотре на щелевой лампе можно увидеть на конце каждого ответвления утолщение, или пузырек. Это характерный признак герпетического кератита, позволяющий отличить его от другой, редко встречающейся древовидной патологии в роговице. Характерный рисунок воспалительной инфильтрации объясняется распространением вируса по ходу веточек субэпителиальных нервов роговицы. Заболевание вызывается не только вирусом простого герпеса, но и вирусом ветряной оспы (рис. 11.16).
Древовидный кератит сопровождается выраженным роговичным синдромом и невралгической болью в глазу. Перикорнеальная инъекция сосудов вначале локальная, затем может распространиться по окружности всей роговицы. Чувствительность роговицы на непораженных участках снижена. После слущивания эпителия образуются язвы. Острое начало заболевания сменяется вялым, упорным течением на протяжении 3–5 нед. Воспалительная инфильтрация нередко захватывает не только эпителиальный слой, но и переходит в поверхностные отделы стромы. Новообразованные сосуды появляются поздно, только в период эпителизации. У каждого третьего пациента возникает рецидив заболевания, которое может осложниться иридоциклитом.
Ландкартообразный герпетический кератит – это следствие перехода древовидного воспаления в широкую поверхностную язву с неровными краями; заболевание часто расценивают как осложнение стероидной терапии.
Краевой герпетический кератит по клинической картине и течению схож с бактериальным краевым кератитом. Этиологическая диагностика базируется на результатах лабораторных исследований.
Глубокие (стромальные) формы герпетических кератитов отличаются от поверхностных распространением воспалительного процесса в глубоких слоях роговицы и вовлечением в него радужки и цилиарного тела. В некоторых случаях, наоборот, вначале появляется герпетический иридоциклит, а затем в патологический процесс вовлекается роговица. Инфекция проникает в строму со стороны заднего эпителия роговицы. Этому способствуют массивные воспалительные преципитаты, надолго приклеивающиеся к задней поверхности, парализующие обменную функцию в центральном и нижнем отделах роговицы. Воспалительный процесс охватывает весь передний отдел глаза (кератоиридоциклит), характеризуется тяжелым и длительным течением, склонностью к рецидивам. При частых рецидивах возникает опасность поражения второго глаза.
К глубоким герпетическим поражениям роговицы относятся метагерпетический, дисковидный и диффузный стромальный кератиты.
Метагерпетический кератит начинается как поверхностное древовидное воспаление, которое быстро переходит в глубокие слои стромы. В фазе распада инфильтратов образуется обширная глубокая язва с неправильными очертаниями. На фоне незаживающего основного очага может появиться новая инфильтрация вблизи язвы или по ее краю. Обнаружение древовидных очертаний в зоне воспалительной инфильтрации вокруг язвы подтверждает герпетическую природу воспаления. Новообразованные сосуды в роговице появляются поздно – спустя 2–3 нед. Общая продолжительность заболевания 2–3 мес, иногда больше (рис. 11.17). Открытая язвенная поверхность роговицы может вторично инфицироваться кокковой флорой, появляется гнойный налет, гипопион, усиливается преципитация. Присоединение кокковой инфекции больше характерно для рецидивов заболевания.
Дисковидный герпетический кератит развивается в центре роговицы в виде крупного бело–серого очага инфильтрации в глубоких слоях. Роговица может быть утолщена в 2–3 раза. Поверхность ее обычно не изъязвляется. Дисковидный кератит всегда сочетается с иридоциклитом. Вследствие значительного помутнения роговицы в центре и отечности ее периферических отделов трудно увидеть преципитаты и гиперемию радужки, оценить состояние зрачка.
Роговичная триада симптомов и перикорнеальная инъекция сосудов выражены слабо. Воспалительный процесс течет вяло в течение нескольких месяцев без появления новообразованных сосудов. Чувствительность роговицы резко снижена. Нередко снижается чувствительность роговицы и во втором, здоровом, глазу. Когда отечность роговицы уменьшается, можно увидеть складки десцеметовой оболочки. Заболевание заканчивается образованием грубого бельма (рис. 11.18), в котором в течение длительного времени сохраняются небольшие очаги воспаления при клинически спокойном состоянии роговицы. Их можно обнаружить при гистологическом исследовании мутной роговицы, удаленной во время кератопластики. При охлаждении, простудных заболеваниях такие очаги могут дать начало рецидиву заболевания.
Дисковидная форма поражения роговицы не является строго специфичной для вируса герпеса, поэтому дифференциальную диагностику необходимо проводить с инфекциями, вызываемыми аденовирусом, вирусом осповакцины, грибами, а также со специфическими бактериальными инфекциями (сифилис, туберкулез).
Глубокий диффузный герпетический кератит (интерстициальный кератоиридоциклит) по клиническим проявлениям схож с дисковидным кератоиридоциклитом, отличаясь от него в основном тем, что воспалительная инфильтрация не имеет четких округлых границ. Глубокое диффузное поражение стромы роговицы может развиваться на фоне старых рубцов как рецидив герпетического кератоувеита, и тогда наблюдается атипичная картина поражения роговицы.
Диагностика герпетического кератита основывается главным образом на типичной клинической картине заболевания. Часть характерных признаков выявляют уже в начале заболевания, например пузырьковые, древовидные высыпания, снижение чувствительности, связь с простудой и герпетическими очагами воспаления на других частях тела. Некоторые особенности клинической картины проявляются слишком поздно: отсутствие неоваскуляризации в течение длительного периода времени, затяжное течение воспалительного процесса, склонность к рецидивам. В связи с этим при атипичном течении кератита используют лабораторные методы диагностики. Для исследования берут соскоб эпителия конъюнктивы и роговицы, а также слезную жидкость. Наиболее информативной и быстрой в исполнении является методика обнаружения флюоресцирующих антител. Внутрикожную пробу с противогерпетической вакциной выполняют только при первичной встрече с вирусом. Очаговая аллергическая проба с противогерпетической вакциной является важным методом этиологической диагностики в атипичных случаях. Эта провокационная проба считается положительной, если в ответ на внутрикожное введение вакцины в слабых разведениях возникает обострение воспалительного процесса, усиливаются боль и перикорнеальная инъекция сосудов, появляются свежие преципитаты. Диагностические пробы проводят с осторожностью по строгим показаниям.
Лечение герпетического кератита комплексное и длительное. Оно направлено на подавление жизнедеятельности вируса, улучшение трофических процессов в роговице, ускорение эпителизации дефектов, повышение местного и общего иммунитета.
Противовирусное лечение включает химиотерапию, неспецифическую и специфическую иммунотерапию. В разных стадиях заболевания используют соответствующие комбинации препаратов. В начале заболевания ежедневно производят частые закапывания керецида, дезоксирибонуклеазы, закладывают мази с теброфеном, флореналем, бонафтоном, оксолином, зовиракс 3–4 раза в день. Каждые 5–10 дней препараты меняют. Ацикловир принимают внутрь в течение 10 дней. Если заболевание глаза сочетается с герпетическим воспалением другой локализации, то продолжительность курса лечения увеличивают до 1–2 мес. В случае развития тяжелых осложнений проводят внутривенные вливания ацикловира каждые 8 ч в течение 3–5 дней. Это высокоактивный препарат, но имеет узкий спектр действия, поэтому его используют против вирусов простого и опоясывающего герпеса.
Одновременно с химиопрепаратами применяют средства неспецифического противовирусного действия – интерферон в каплях и субконъюнктивально, а также препараты, стимулирующие выработку эндогенного интерферона (интерфероногены), препятствующие размножению вируса в клетке, – полудан (курсовая доза – 2.000 ЕД), пирогенал в апирогенных дозах, продигиозан (3–5 внутримышечных инъекций). При снижении иммунитета, хроническом и рецидивирующем течении заболевания назначают иммуностимуляторы – левамизол, тималин. Для специфической иммунотерапии используют человеческий иммуноглобулин и противогерпетическую вакцину.
Для лечения различных форм кератитов разработаны оптимальные комбинации противовирусных средств и схемы их применения.
Для очистки язвенных поверхностей от некротических масс применяют криозонд или лазеркоагуляцию. При длительно не заживающих герпетических кератитах производят пересадку роговицы с лечебной целью.
В тех случаях, когда присоединяется бактериальная флора, дополнительно назначают сульфаниламидные препараты, антибиотики, нестероидные противовоспалительные средства в виде капель и мазей. Для профилактики и лечения сопутствующих иритов и иридоциклитов используют мидриатики.
Помимо основного противовирусного лечения, назначают витамины и препараты, улучшающие трофику роговицы, а также при необходимости противоаллергические средства.
Кортикостероидные препараты используют с большой осторожностью только в стадии регрессии при глубоких стромальных кератитах, под постоянным контролем состояния эпителия роговицы и внутриглазного давления, так как они могут осложнять течение герпетического кератита, а в межприступном периоде способствуют возникновению рецидивов в связи с выраженным иммунодепрессивным действием.
После окончания противовоспалительного и симптоматического лечения кератита, когда глаз полностью успокоится, требуется восстановительное лечение – пересадка роговицы с оптической целью.
Нейропаралитический кератит. Заболевание развивается после пересечения первой ветви тройничного нерва, иногда после инъекций в область гасСерова узла или после его экстирпации. При некоторых инфекционных заболеваниях блокируется проводимость первой ветви тройничного нерва. Вместе с нарушением тактильной чувствительности происходит изменение трофических процессов. Заболевание роговицы может появляться не сразу, а спустя какое–то время.
Клиническая картина нейропаралитического кератита имеет особенности. Течение заболевания вначале бессимптомное, и его часто обнаруживают случайно. Чувствительность роговицы отсутствует, поэтому нет характерного субъективного роговичного синдрома: светобоязни, слезотечения и блефароспазма, ощущения инородного тела, несмотря на шероховатость поверхности роговицы. Парализованы все механизмы оповещения о начале патологического процесса. Отсутствует и перикорнеальная инъекция сосудов. Вначале появляются изменения в центральном отделе роговицы: отечность поверхностных слоев, вздутость эпителия, который постепенно слущивается, образуются эрозии, которые быстро сливаются в обширный дефект (рис. 11.19). Дно и края такого дефекта в течение длительного времени остаются чистыми. Если присоединяется кокковая флора, возникает мутная серовато–белая или желтоватая инфильтрация, формируется гнойная язва роговицы.
Течение нейротрофических кератитов вялое и длительное.
Лечение симптоматическое. Прежде всего необходимо обеспечить защиту пораженной роговицы от высыхания и попадания пыли с помощью полугерметических очков. Назначают препараты, улучшающие трофику роговицы и процессы регенерации, а также защищающие ее от вторжения инфекции. Инстилляции лекарственных препаратов сочетают с закладыванием мазей и гелей за веко. Они дольше удерживают препарат на поверхности роговицы и в то же время прикрывают обнаженную поверхность, облегчают эпителизацию. При наличии показаний, согласно рекомендациям невропатолога, проводят физиопроцедуры, стимулирующие функцию симпатических шейных узлов.
В тех случаях, когда возникает угроза перфорации роговицы, прибегают к хирургической защите глаза – сшиванию век, при этом у внутреннего угла глаза оставляют щель для закапывания лекарственных препаратов.
Кератиты при гипо– и авитаминозах обусловлены нарушением общих обменных процессов в организме. Они возникают вследствие поступления недостаточного количества витаминов или плохого усвоения отдельных групп витаминов. Поражение роговицы чаще всего отмечается при недостатке группы витаминов А, В„ В2, С, РР, Е. Заболевания роговицы развиваются на фоне тяжелой общей патологии организма, которая является следствием авитаминоза или, наоборот, затрудняет всасывание витаминов. Обычно заболевают оба глаза. Выраженность изменений в роговице зависит от степени недостаточности витамина в организме при гиповитаминозах, а в крайне тяжелых случаях (авитаминозы) – от длительности заболевания и содержания других витаминов.
Авитаминоз А вызывает изменения эпителиального слоя конъюнктивы и роговицы. В начальной стадии снижается чувствительность роговицы и медленно нарастают дистрофические изменения, исчезает нормальный блеск и влажность поверхности. Она становится тусклой, возникают облачковидные помутнения (рис. 11.20, а). Это стадия прексероза, которая сменяется эпителиальным ксерозом, т. е. ороговением эпителия. Вначале на конъюнктиве глазного яблока и роговице в пределах открытой глазной щели появляются ксеротические сухие бляшки, похожие на мелкие капли застывшего сала. Поверхностные сухие клетки слущиваются, при этом возникают неприятные ощущения. В этой стадии при рациональном питании и лечении еще возможно выздоровление с незначительной потерей функции глаза. Третья стадия авитаминоза А – кератомаляция. Вся роговица становится мутной. Изменения быстро переходят от поверхностных слоев к глубоким. Одновременно с распространением помутнения начинается процесс распада роговицы. В уголках глаз обильное отделяемое. Лечение, начатое в этой стадии, заканчивается грубым рубцеванием дефектов. Без лечения наступает прободение роговицы (рис. 11.20, б). В связи с отсутствием чувствительности роговицы распад ткани идет безболезненно.
Лечение: полноценное питание с включением продуктов животного и растительного происхождения, богатых витаминами А и каротином, масляный раствор ретинола ацетата внутрь или внутримышечно в суточной дозе 100.000 ME и поливитаминный комплекс.
Местно: инстилляции сульфаниламидных препаратов 3–4 раза в день для профилактики инфицирования эрозированной поверхности; витаминные капли (цитраль и рибофлавин в чередовании), препараты, способствующие регенерации эпителия (ретинол, актовегин, баларпан, рыбий жир), кроме того, обязательны мази, содержащие витамины.
Авитаминоз В, в роговице проявляется на фоне общих изменений в организме: полиневриты, потеря мышечного тонуса, дисфункция желудочно–кишечного тракта. Возникают помутнения в центральном отделе роговицы, отек эпителия, затем развивается дисковидный кератит с упорным длительным течением и тяжелым исходом. Поверхностные слои роговицы инфицируются, некротизируются, возможно ее прободение. Уже в стадии развития дисковидного кератита в патологический процесс вовлекаются радужка и цилиарное тело, а затем и хориоидея.
Лечение: рациональное питание с включением блюд из бобовых, злаковых, печени, почек. Тиамина бромид и поливитамины назначают в лечебных дозах.
Местное лечение зависит от стадии заболевания. Общий подход такой же, как при авитаминозе А.
Авитаминоз В2 может вызвать поверхностный кератит с изъязвлением, но возможна и стромальная форма воспаления. Кератиты при авитаминозе В2 характеризуются врастанием большого количества поверхностных сосудов. Рациональное лечение в стадии ранних проявлений приводит к выздоровлению. Заболевание роговицы протекает на фоне себорейного дерматита, ангулярного стоматита, глоссита и других проявлений авитаминоза В2.
Лечение: полноценное питание с обязательным ежедневным включением в рацион молока, мяса, бобовых; назначают препараты рибофлавина и поливитамины в лечебных дозах соответственно возрасту.
Местное лечение симптоматическое. Применяют 0,02% раствор рибофлавина в каплях. Общий принцип местного лечения такой же, как при авитаминозе А. Для подавления роста новообразованных сосудов проводят субконъюнктивальные инъекции стероидных препаратов (дексазон 0,5 мл 1 раз в день) курсами по 7–10 дней.
Авитаминозы B6, B12, РР, Е всегда отражаются на состоянии роговицы, проявляются нарушением эпителизации, преимущественно в центральном отделе, вслед за этим роговица пропитывается слезной жидкостью, изменяется ее прозрачность, появляются инфильтраты, затем эрозии и изъязвления. В разные сроки прорастают новообразованные сосуды. Кератит возникает на фоне общих изменений в организме, характерных для данного гипо– или авитаминоза. Именно выявление связи с конкретной общей патологией позволяет установить правильный диагноз и назначить общее этиологическое лечение, без которого местная терапия неэффективна.
Кератиты невыясненной этиологии.
Розацеа–кератит (keratitis rosaсеа) – часто рецидивирующее заболевание. Возникает у пациентов с розовыми угрями (acne rasacea) на лице. Этиология кожного заболевания неизвестна. Высказано предположение, что это – следствие пиридоксиновой недостаточности (гиповитаминоз В6). Розовые угри обычно сочетаются с пониженной кислотностью желудочного сока.Розацеа–кератит начинается с появления одного или нескольких узелков инфильтрации. Поверхность их эрозируется, затем инфильтрат некротизируется. К образовавшейся язве подходят поверхностные новообразованные сосуды. Ярко выражены перикорнеальная инъекция сосудов и триада роговичных симптомов. Через 3–4 нед может наступить эпителизация дефекта. Глаз успокаивается, но не надолго. Вместе с новой атакой розовых угрей на лице появляется новый узелок (или узелки) инфильтрации в роговице с образованием более глубокой язвы и врастанием новых сосудов. В период рубцевания формируется васкуляризированное бельмо с ярко–белыми известковыми включениями (рис. 11.21). Последующие рецидивы становятся более частыми. Заживает язва в одном глазу, а через несколько дней открывается в другом. Иногда пациенты не успевают выйти на работу, как появляется воспаление в другом глазу.
Частое рецидивирование приводит к инвалидности. Наслаивающиеся рубцы истончают и деформируют роговицу, нередко образуются фистулы. Острота зрения снижается с каждым новым обострением.
Лечение общего заболевания назначает дерматолог. Местное лечение кератита проводят по обшей схеме. В период рецидивирования закапывают мидриатики с целью профилактики иридоциклита. В осложненных случаях показана сквозная кератопластика.
Рецидивирующая эрозия роговицы встречается редко. Она может проявляться в разлитой или локальной форме. Жалобы больного весьма характерны: утром открыл глаза и почувствовал острую режущую боль, беспокоит ощущение соринки в глазу, течет слеза. При биомикроскопии выявляют ограниченный (1–2 мм) дефект эпителия и легкую отечность вокруг эрозии. В других случаях вся центральная зона роговицы отечна, имеется несколько участков десквамации эпителия.
Важную роль в патогенезе рецидивирующей эрозии играет патология боуменовой мембраны. Эпителий не удерживается на ее поверхности. Отслоившийся участок эпителия вздувается в виде пузырька и приклеивается к слизистой оболочке неподвижных век ночью. Как только веки открываются, эпителий отрывается. Под прикрытием мазевых препаратов эпителизация может наступить довольно быстро – через 3–7 дней, но затем через неопределенные интервалы времени эрозии образуются вновь. Дефекты могут заживать, не оставляя следа, однако после повторных эрозий образуются тонкие полупрозрачные рубцы. Этиология данного заболевания неизвестна. Получены данные, свидетельствующие о том, что изменения в боуменовой мембране может вызывать вирус герпеса. Существует также предположение, что основную роль в развитии заболевания может играть травма. Нельзя исключить и влияние наследственных факторов. По–видимому, данное заболевание является полиэтилогичным, а предшествующая травма и простуда играют роль пускового фактора.
Лечение направлено на профилактику инфицирования эрозированной поверхности и улучшение эпителизации. Инстилляции анестетиков нецелесообразны, так как они способствуют слущиванию эпителия. Обязательно назначают мази, содержащие витамины, и препараты, улучшающие трофические процессы (в чередовании). Мазь защищает раневую поверхность и обнаженные нервные окончания от высыхания и раздражения, уменьшая тем самым болевые ощущения. Мазевая основа в течение длительного периода времени сохраняет в конъюнктивальной полости и на роговице содержащиеся в мази дезинфицирующие, витаминные и улучшающие трофику препараты. Она является своеобразной повязкой, оберегающей молодой эпителий от смещений при мигательных движениях век, предотвращает склеивание его с конъюнктивой век. Последнее закладывание мази ежедневно производят непосредственно перед сном.
Нитчатый кератит (сухой кератоконъюнктивит) также относится к заболеваниям роговицы невыясненной этиологии и является одним из симптомов общего заболевания организма, называемого синдромом Съегрена. Он выражается в сухости всех слизистых оболочек, снижении или отсутствии секреции слезных и слюнных желез (см. главы 9 и 22).
Дистрофии роговицы
Дистрофии (дегенерации, кератопатии) роговицы – хронические заболевания, в основе которых лежит нарушение общих или местных обменных процессов.Природа дистрофий роговицы может быть различной: семейно–наследственные факторы, аутоиммунные, биохимические, нейротрофические изменения, травма, последствия воспалительных процессов и др. Начальное звено поражения может оставаться неизвестным. Выделяют первичные и вторичные дистрофии роговицы.
Первичные дистрофии обычно двусторонние. Среди них основное место занимают семейно–наследственные дегенерации. Заболевание начинается в детском или юношеском возрасте, очень медленно прогрессирует, вследствие чего в течение длительного периода времени может оставаться незамеченным. Чувствительность роговицы постепенно снижается, отсутствуют признаки раздражения глаза и воспалительные изменения. При биомикроскопическом исследовании сначала выявляют очень нежные помутнения в центральном отделе роговицы, имеющие вид мелких узелков, пятен или полосок. Патологические включения в роговице чаще всего располагаются в поверхностных слоях стромы, иногда субэпителиально. Передний и задний эпителий, а также эластические мембраны роговицы не изменяются. Периферические отделы роговицы могут оставаться прозрачными, новообразованных сосудов нет. К 30–40 годам снижение зрения становится заметным, начинает изменяться эпителий роговицы. Периодическое слущивание эпителия вызывает болевые ощущения, светобоязнь, блефароспазм.
Различные виды наследственных дистрофий роговицы отличаются друг от дуга в основном формой и расположением очаговых изменений в роговице. Известны узелковые, пятнистые, решетчатые и смешанные дистрофии (рис. 11.22). Наследственный характер этих заболеваний установлен в начале прошлого века.
В России эта патология встречается редко (реже, чем в других европейских странах).
Лечение семейно–наследственных дистрофий симптоматическое. Назначают витаминные капли и мази, препараты, улучшающие трофику роговицы: баларпан, тауфон, адгелон, эмоксипин, этаден, ретинол, гель солкосерила, актовегин; внутрь принимают поливитамины. Консервативное лечение не останавливает прогрессирование заболевания. При значительном снижении зрения проводят послойную или сквозную кератопластику. Лучший оптический результат дает сквозная пересадка роговицы. Семейно–наследственная дистрофия – единственный вид патологии роговицы, который возобновляется в донорском трансплантате. Спустя 5–7 лет после операции в прозрачном трансплантате по периферии появляются единичные узелки или полосочки нежных помутнений, такие же, какие были в собственной роговице. Количество их медленно увеличивается, постепенно ухудшается зрение. Через JO–15 лет приходится производить повторную пересадку роговицы, которая в большинстве случаев хорошо приживает, обеспечивая высокую остроту зрения.
Отечная дистрофия роговицы (синонимы: эпителиально–эндотелиальная, эндотелиально–эпителиальная, буллезная, глубокая дистрофия) может быть как первичной, так и вторичной. Долгое время причина этого заболевания оставалась неизвестной. В настоящее время ни у кого не вызывает сомнений тот факт, что первичная отечная дистрофия роговицы возникает при несостоятельности барьерной функции однорядного слоя клеток заднего эпителия, вызванной дистрофическими изменениями в клетках, либо критически малым их количеством (менее 500–700 клеток в 1 мм2).
Зеркальная биомикроскопия позволяет выявить тонкие начальные изменения, когда роговица еще прозрачна и нет отека. Их можно диагностировать и при обычной биомикроскопии, если внимательно осмотреть заднюю поверхность роговицы в тонком световом срезе. В норме клетки заднего эпителия роговицы не видны, поскольку они очень малы. Когда количество клеток значительно уменьшается, оставшиеся клетки уплощаются и растягиваются, чтобы закрыть всю заднюю поверхность роговицы. Размеры клеток увеличиваются в 2–3 раза, поэтому их уже можно увидеть при биомикроскопии. Задняя поверхность роговицы становится похожей на запотевшее стекло. Этот феномен называют капельной роговицей (cornea guttata). В настоящее время нет способов радикально изменить это состояние, однако ранняя диагностика предвестников надвигающейся болезни позволяет правильно спланировать лечение сопутствующей патологии, например выбрать метод экстракции катаракты, наиболее щадящий заднюю поверхность роговицы, отказаться от введения искусственного хрусталика (или найти нужную модель) и, что очень важно, поручить выполнение операции самому опытному хирургу. Исключив или уменьшив травму клеток заднего эпителия роговицы, удается отодвинуть на несколько месяцев или лет развитие отечной дистрофии.
Наличие симптома капельной роговицы еще не означает начала заболевания (роговица прозрачна и неутолщена), но является свидетельством того, что функциональные возможности клеток заднего эпителия роговицы близки к предельным. Достаточно потери небольшого количества клеток, чтобы образовались незакрывающиеся дефекты. Этому могут способствовать инфекционные заболевания, контузии, травмы, особенно полостные операции.
В тех случаях, когда между клетками заднего эпителия роговицы появляются щели, внутриглазная жидкость начинает пропитывать строму роговицы. Отек постепенно распространяется от задних слоев на всю роговицу. Толщина ее в центре может увеличиться почти в 2 раза. При этом значительно снижается острота зрения из–за того, что жидкость раздвигает роговичные пластины, в результате чего нарушается их строгая упорядоченность. Позднее отечная дистрофия распространяется и на передний эпителий роговицы. Он становится шероховатым, вздувается в виде пузырьков различного размера, которые легко отслаиваются от боуменовой мембраны, лопаются, обнажая нервные окончания. Появляется выраженный роговичный синдром: боль, ощущение инородного тела, светобоязнь, слезотечение, блефароспазм. Следовательно, дистрофия переднего эпителия является завершающей стадией отечной дистрофии роговицы, которая всегда начинается с задних слоев.
Состояние слоя клеток заднего эпителия роговицы обычно одинаковое в обоих глазах. Однако отечная дистрофия роговицы развивается сначала в том глазу, который подвергался травме (бытовой или хирургической).
Лечение отечной дистрофии роговицы вначале симптоматическое. Назначают противоотечные препараты в инстилляциях (глюкозу, глицерин), а также витаминные капли и средства, улучшающие трофику роговицы (баларпан, глекомен, карнозин, тауфон). Когда отечность достигает эпителия роговицы, обязательно добавляют антибактериальные средства в виде капель и мазей, а также масляный раствор токоферола, гель солкосерила, актовегина, витаминные мази, улучшающие регенерацию эпителия. Мазевые препараты и лечебные контактные линзы служат своеобразной повязкой для роговицы, защищают открытые нервные окончания от внешних раздражений, снимают болевые ощущения.
Хороший лечебный эффект дает низкоэнергетическая лазерная стимуляция роговицы расфокусированным лучом гелий–неонового лазера.
Консервативное лечение обеспечивает только временный положительный эффект, поэтому его периодически повторяют по мере ухудшения состояния роговицы.
Радикальным способом лечения является сквозная субтотальная кератопластика. Донорский трансплантат в 70–80% случаев остается прозрачным, обеспечивает возможность улучшения остроты зрения и оказывает лечебное воздействие на оставшийся отечный ободок собственной роговицы, который может быть полупрозрачным, но поверхность его становится гладкой, отек проходит. Уже через 1–2 мес роговицы донора и реципиента имеют одинаковую толщину.
Длительно существующая отечная дистрофия роговицы, как правило, сочетается с дистрофическими изменениями в сетчатке, поэтому даже при идеальной прозрачности донорского трансплантата нельзя рассчитывать на максимально высокую остроту зрения: она бывает в пределах 0,4–0,6.
Вторичная отечная дистрофия роговицы возникает как осложнение глазных полостных операций, травм или ожогов.
Клинические проявления первичной и вторичной отечной дистрофии роговицы очень схожи, но имеются и существенные отличия. Обычно заболевает один глаз. Всегда прослеживается первопричина возникшего отека – бытовая, производственная или хирургическая травма. Главное отличие состоит в том, что отек роговицы возникает на ограниченном участке соответственно месту контакта с травмирующим агентом, а вокруг этого участка находятся здоровые клетки заднего эпителия роговицы, способные к замещению дефекта.
Через дефект в слое клеток заднего эпителия в строму роговицы проникает внутриглазная жидкость. Локальный отек постепенно доходит до поверхностных слоев и переднего эпителия. В тех случаях, когда патологический очаг находится не в центре роговицы, острота зрения может снижаться незначительно. При появлении буллезной дистрофии переднего эпителия возникает раздражение глазного яблока в секторе патологического очага, боль, светобоязнь, слезотечение и блефароспазм.
Лечение такое же, как и при первичной дистрофии роговицы. Отек начинает уменьшаться через 7–10 дней, когда заживает рана роговицы. При вторичной форме дистрофии возможны полное заживление очага поражения и исчезновение отека. Для этого требуется разный период времени – от одного до нескольких месяцев в зависимости от плотности клеток и площади повреждения заднего эпителия, а также от скорости заживления общей раны роговицы.
В том случае, если инородное тело, например опорный элемент искусственного хрусталика, периодически касается задней поверхности роговицы, то отек увеличивается, усиливаются болевые ощущения, несмотря на любые лечебные меры (рис. 11.23). В этом случае нужно либо зафиксировать хрусталик (подшить к радужке), либо удалить, если его конструкция несовершенна.
Фиксированный (постоянный) контакт опорного элемента хрусталика не вызывает отечной дистрофии роговицы и не требует его устранения, если для этого нет других причин. При фиксированном контакте, когда опора хрусталика заключена в рубце роговицы и радужки, больше не возникают новые повреждения заднего эпителия роговицы в отличие от ситуации с периодически повторяющимися контактами.
Вторичная отечная дистрофия роговицы может возникнуть в глазу с искусственным хрусталиком, где нет контакта тела линзы или ее опорных частей с роговицей (рис. 11.24). В этом случае удаление хрусталика не дает лечебного эффекта, а, наоборот, будет дополнительной травмой для больной роговицы. Не следует "наказывать” хрусталик, если он 'не виноват” в возникновении отека роговицы. В этом случае причину вторичной отечной дистрофии нужно искать в травматичности самой операции.
Под воздействием приведенных выше лечебных мероприятий может наступить выздоровление, однако на месте отека всегда остается более или менее плотное помутнение. В тяжелых случаях, когда отечная дистрофия захватывает всю роговицу или ее центр и консервативная терапия долго не дает положительного результата, производят сквозную субтотальную кератопластику, но не ранее чем через 1 год после операции или травмы глаза. Чем меньше утолщена роговица, тем больше надежды на благоприятный исход операции (рис. 11.24, б).
Лентовидная дистрофия (дегенерация) роговицы – это медленно нарастающее поверхностное помутнение в слепых или слабовидящих глазах.
Лентовидная дистрофия развивается спустя несколько лет после тяжелых иридоциклитов, хориоидитов в глазах, ослепших вследствие глаукомы или тяжелых травм. Помутнения возникают на фоне измененной чувствительности роговицы, уменьшения подвижности глазного яблока и снижения обменных процессов в глазу. При нарастающей атрофии мышечного аппарата появляются непроизвольные движения глазного яблока (нистагм). Помутнения располагаются поверхностно в области боуменовой оболочки и переднего эпителия. Строма роговицы и задние слои остаются прозрачными. Изменения начинаются на периферии роговицы у внутреннего и наружного краев и, медленно нарастая, перемещаются к центру в пределах открытой глазной щели в виде горизонтально расположенной ленты. Сверху, где роговица прикрыта веком, она всегда остается прозрачной. Помутнения распределяются неравномерно, могут быть островки прозрачной поверхности роговицы, но с течением времени они тоже закрываются (рис. 11.25). Для лентовидной дегенерации характерно отложение известковых солей, поэтому поверхность роговицы становится сухой и шероховатой. При большой давности таких изменений тонкие пластинки ороговевшего эпителия, пропитанного солями, могут самостоятельно отторгаться. Возвышающиеся солевые выросты травмируют слизистую оболочку века, поэтому их необходимо удалить.
Грубые помутнения и солевые отложения в роговице образуются на фоне выраженных общих трофических изменений в слепом глазу, которые могут приводить к субатрофии глазного яблока. Известны случаи, когда известковые отложения формировались не только в роговице, но и по ходу сосудистого тракта глаза. Происходит окостенение хориоидеи.
Такие глаза подлежат удалению с последующим косметическим протезированием. В глазах с остаточным зрением производят поверхностную кератэктомию (срезание мутных слоев) в пределах оптической зоны роговицы (4–5 мм). Обнаженная поверхность покрывается эпителием, нарастающим с неповрежденного верхнего отдела роговицы, и может в течение нескольких лет оставаться прозрачной, если больной регулярно закапывает капли, поддерживающие трофику роговицы, и закладывает мази, препятствующие ороговению эпителия.
Лентовидная дистрофия роговицы у детей, сочетающаяся с фибринозно–пластическим иридоциклитом и катарактой, характерна для болезни Стилла (синдром Стилла). Кроме триады глазных симптомов, отмечаются полиартрит, увеличение печени, селезенки, лимфатических желез. После курса противовоспалительного лечения по поводу иридоциклита производят экстракцию катаракты. Когда помутнения в роговице начинают закрывать центральную зону, принимают решение о выполнении кератэктомии. Лечение основного заболевания проводит терапевт.
Краевая дистрофия (дегенерация) роговицы обычно возникает на двух глазах, развивается медленно, иногда в течение многих лет. Роговица истончается около лимба, образуется серповидный дефект (рис. 11.26). Неоваскуляризация отсутствует или выражена незначительно. При выраженном истончении роговицы нарушается ее сферичность, снижается острота зрения, появляются участки эктазии, в связи с чем появляется угроза возникновения перфораций. Обычное медикаментозное лечение дает лишь временный эффект. Радикальным методом лечения является краевая послойная пересадка роговицы.
Хирургическое лечение патологии роговицы
В хирургии роговицы можно выделить несколько разделов в зависимости от цели операции, глубины иссечения ткани, а также от вида пластического материала, используемого для замены измененной роговицы.Кератэктомия – удаление небольших поверхностно расположенных помутнений в центральном отделе роговицы хирургическим путем или с помощью эксимерного лазера (рис. 11.27). Дефект самостоятельно закрывается эпителием в течение нескольких часов. Кератэктомию выполняют нечасто из–за того, что редко встречаются поверхностные помутнения, расположенные точно по центру. Чаще всего офтальмологам приходится иметь дело с более грубыми и обширными помутнениями роговицы.
Кератопластика (пересадка роговицы) – основной раздел в хирургии роговицы. Операции имеют разную целевую установку. Главная цель операции – оптическая, т. е. восстановление утраченного зрения. Однако бывают ситуации, когда оптическая цель сразу не может быть достигнута, например при тяжелых ожогах, глубоких язвах, длительно не заживающих кератитах. Прогноз прозрачного приживления трансплантата у таких больныхсомнительный. В этих случаях кератопластика может быть произведена с лечебной целью, т. е. для иссечения некротической ткани и спасения глаза как органа. На втором этапе выполняют оптическую кератопластику на спокойной роговице, когда нет инфекции, обильной васкуляризации и трансплантат не будет окружен распадающейся тканью роговицы. Эти два вида кератопластики, разные по целевой установке, мало чем отличаются друг от друга в плане собственно хирургической техники. Поэтому в клинической практике нередки случаи, когда после лечебной кератопластики трансплантат приживает прозрачно и у больного одновременно отмечаются и лечебный, и оптический результат.
Мелиоративной называют пересадку роговицы, выполненную с целью улучшения почвы, как подготовительный этап последующей оптической кератопластики. С тектонической целью производят операцию при фистулах и других дефектах роговицы. Можно считать, что мелиоративная и тектоническая операции – это разновидности лечебной пересадки роговицы.
Косметическую кератопл асти ку производят на слепых глазах, когда вернуть зрение невозможно, но больного смущает яркое белое пятно на роговице. В этом случае бельмо иссекают трепаном соответствующего диаметра и замещают образовавшийся дефект прозрачной роговицей. Если на периферии остаются белые участки, не захваченные в зону трепанации, то их маскируют тушью или сажей с помощью метода татуировки.
Рефракционную кератопластику выполняют на здоровых глазах с целью изменения оптики глаза, если пациент не хочет носить очки и контактные линзы. Операции направлены на изменение формы всей прозрачной роговицы или только профиля ее поверхности (см. главу 5).
На основании принципиальных различий в технике операции выделяют послойную и сквозную пересадку роговицы.
Послойную кератопластику выполняют в тех случаях, когда помутнения не затрагивают глубокие слои роговицы. Операцию производят под местной анестезией. Поверхностную часть мутной роговицы срезают с учетом глубины расположения помутнений и их поверхностных границ (рис. 11.28). Образовавшийся дефект замещают прозрачной роговицей такой же толщины и формы. Трансплантат укрепляют узловыми швами или одним непрерывным швом. При оптической послойной кератопластике используют центрально расположенные круглые трансплантаты. Лечебные послойные пересадки разного вида могут быть произведены как в центре, так и на периферии роговицы в пределах зоны ее поражения. Трансплантат может иметь круглую и иную форму.
 Рис. 11.28. Послойная кератопластика, а – схема операции; б – вид глаза после кератопластики.
Рис. 11.28. Послойная кератопластика, а – схема операции; б – вид глаза после кератопластики.
В качестве донорского материала используют главным образом роговицу трупного глаза человека. Для лечебной послойной пересадки роговицы пригоден материал, консервированный различными способами (замораживание, высушивание, хранение в формалине, мёде, различных бальзамах, сыворотке крови, γ–глобулине и т. д.). При мутном приживлении трансплантата может быть выполнена повторная операция.
Сквозную кератопластику чаще всего производят с оптической целью, хотя она может быть и лечебной, и косметической. Суть операции заключается в сквозном иссечении центральной части мутной роговицы больного и замещении дефекта прозрачным трансплантатом из донорского глаза (рис. 11.29). Выкраивание роговицы реципиента и донора производят круглым трубчатым ножом–трепаном. В хирургическом наборе имеются трепаны с режущей коронкой разного диаметра от 2 до 11 мм.
В историческом аспекте хорошие результаты сквозной кератопластики были впервые получены при использовании трансплантатов небольшого диаметра (2–4 мм) (рис. 11.30, а). Такая операция получила название частичной сквозной кератопластики и была связана с именами Цирма (1905), Эльшнига (1908) и В. П. Филатова (1912).
Пересадка роговицы большого диаметра (более 5 мм) называется субгпошальной сквозной кератопластикой (рис. 11.30, б). Прозрачное приживление большого трансплантата впервые удалось получить Н. А. Пучковской (1950–1954) – ученице В. П. Филатова. Массовая успешная замена больших дисков роговицы стала возможна только после появления микрохирургической техники операции и тончайшего атравматичного шовного материала [Копаева В. Г., 1973; Каспаров А. А., 1976]. Возникло новое направление в глазной хирургии – реконструкция переднего и заднего отрезков глаза на основе свободного операционного доступа, открывающегося при широкой трепанации роговицы. В этих случаях кератопластику производят в сочетании с другими вмешательствами (рис. 11.31), такими как рассечение спаек и восстановление передней камеры глаза, пластика радужки и репозиция зрачка, удаление катаракты, введение искусственного хрусталика, витрэктомия, удаление люксированного хрусталика и инородных тел и др.
При осуществлении сквозной субтотальной кератопластики требуются хорошая анестезиологическая подготовка пациента и крайне осторожное выполнение манипуляций хирургом. Незначительное напряжение мышц и даже неровное дыхание пациента могут привести к выпадению хрусталика в рану и другим осложнениям, поэтому у детей и неспокойных взрослых операцию производят под общей анестезией.
Сквозная кератопластика, при которой диаметр пересаженной роговицы равен диаметру роговицы реципиента, называется тотальной. С оптической целью эту операцию практически не используют.
Биологический результат кератопластики оценивают по состоянию пересаженного трансплантата: прозрачный, полупрозрачный и мутный. Функциональный исход операции зависит не только от степени прозрачности трансплантата, но и от сохранности зрительно–нервного аппарата глаза. Нередко при наличии прозрачного трансплантата острота зрения бывает низкой из–за возникновения послеоперационного астигматизма. В связи с этим важное значение приобретает соблюдение мер интраоперационной профилактики астигматизма.
Наилучшие результаты можно получить при выполнении операций на спокойных глазах, не имеющих большого количества сосудов. Наиболее низкие функциональные показатели после операции отмечаются при всех видах ожогов, длительно не заживающих язвах и обильно васкуляризированных бельмах.
Кератопластика – часть большой общебиологической проблемы пересадки органов и тканей. Следует отметить, что роговица является исключением среди других тканей, подлежащих трансплантации. Она не имеет сосудов и отделена от сосудистого тракта глаза внутриглазной жидкостью, чем и объясняется относительная иммунная обособленность роговицы, позволяющая успешно выполнять кератопластику без строгого подбора донора и реципиента.
Требования к донорскому материалу при сквозной кератопластике существенно выше, чем при послойной. Это объясняется тем, что сквозной трансплантат содержит все слои роговицы. Среди них есть слой очень чувствительный к изменяющимся условиям жизни. Это – внутренний однорядный слой клеток заднего эпителия роговицы, имеющий особое, глиальное, происхождение. Эти клетки всегда погибают первыми, они не способны к полноценной регенерации. После операции все структуры донорской роговицы постепенно замещаются тканями роговицы реципиента, кроме клеток заднего эпителия, которые продолжают жить, обеспечивая жизнь всего трансплантата, поэтому сквозную кератопластику иногда называют искусством пересадки однорядного слоя клеток заднего эпителия. Именно этим объясняются высокие требования к качеству донорского материала для сквозной кератопластики и максимальная осторожность по отношению к задней поверхности роговицы при всех манипуляциях во время операции. Для сквозной кератопластики используют трупную роговицу, сохраняемую в течение не более 1 сут после смерти донора без консервации. Пересаживают также роговицу, консервированную в специальных средах, в том числе с применением низких и сверхнизких температур.
В крупных городах организованы специальные службы глазных банков, которые осуществляют забор, консервацию и контроль за хранением донорского материала в соответствии с требованиями существующего законодательства. Методы консервации роговиц постоянно совершенствуются. Донорский материал обязательно исследуют на наличие СПИДа, гепатита и других инфекций; проводят биомикроскопию донорского глаза, чтобы исключить патологические изменения в роговице, выявить последствия оперативных вмешательств в переднем отделе глаза.
Кератопротезирование. В тех случаях, когда пересадка роговицы не может дать прозрачного приживления, производят кератопротезирование – замену мутной роговицы биологически инертным пластическим материалом. Существует 2 типа кератопротезов – несквозные, применяемые при буллезной отечной роговице, и сквозные, используемые при ожоговых бельмах. Эти кератопротезы имеют разную конструкцию.
Сквозные кератопротезы (рис. 11.32) предназначены для лечения грубых васкуляризированных ожоговых бельм при поражении обоих глаз, когда сохранна функция сетчатки, но нет надежды на прозрачное приживление роговичного трансплантата. Операцию выполняют в два этапа. Сначала бельмо расслаивают на две пластинки (рис. 11.33, I, а) и в образованный карман помещают опорную металлическую часть протеза, изогнутую соответственно кривизне роговицы (рис. 11.33, I, б). Опорная пластинка имеет 2 больших отверстия по краям. В пределах этих отверстий расслоенная роговица срастается и фиксирует кератопротез (рис. 11.33, I, в). В центре опорной пластики находится круглое отверстие для размещения оптической части протеза. На первом этапе операции оно закрыто временным вкладышем (заглушкой).
Второй этап операции выполняют через 2–3 мес. К этому времени опорная пластинка протеза уже прочно закрепилась в слоях бельма (рис. 11.33, I, г). Над центральным отверстием кератопротеза производят трепанацию мутных слоев роговицы диаметром 2,5 мм (рис. 11.33, И, а). Временную заглушку вывинчивают специальным ключом. Иссекают внутренние слои роговицы и на место временного вкладыша ввинчивают оптический цилиндр (рис. 11.33, II, б). Оптическую силу кератопротеза рассчитывают индивидуально для каждого глаза. В среднем она равна 40,0 дптр. Если в оперированном глазу отсутствует хрусталик, то кератопротез возмешает всю оптическую силу глаза, т. е. 60,0 дптр. Внутренняя и наружная части оптического цилиндра выступают над поверхностями роговицы, что позволяет избежать его зарастания (рис. 11.33, И, в, г).
После операции больные должны находиться под наблюдением врача, так как у них могут возникнуть осложнения. Заращение оптического цилиндра по передней или задней поверхности устраняют хирургическим путем. Оптический цилиндр может быть заменен в случае несоответствия оптики либо недостаточного его выстояния над передней или задней поверхностью. При использовании двухэтапной техники операции фильтрация влаги передней камеры наблюдается редко. Наиболее частым и тревожным осложнением является обнажение опорных частей кератопротеза вследствие асептического некроза поверхностных слоев роговицы. Для укрепления протеза используют донорскую роговицу и склеру, аутохрящ ушной раковины, слизистую оболочку губы и другие ткани. Для того чтобы избежать этих осложнений, продолжают совершенствовать модели кератопротезов и технику операции.
 Рис. 11.33. Введение сквозного кератопротеза модели Федорова–Зуева.
1 – первый этап операции: а, б, в – введение опорной части кератопротеза; г – глаз через 2 мес после первого этапа операции; II – второй этап операции: а, б, в – введение оптической части кератопротеза; г – глаз через 14 мес после второго этапа операции; острота зрения 0%8. Объяснение в тексте.
Рис. 11.33. Введение сквозного кератопротеза модели Федорова–Зуева.
1 – первый этап операции: а, б, в – введение опорной части кератопротеза; г – глаз через 2 мес после первого этапа операции; II – второй этап операции: а, б, в – введение оптической части кератопротеза; г – глаз через 14 мес после второго этапа операции; острота зрения 0%8. Объяснение в тексте.
Несквозное кератопротезирование производят при буллезной дистрофии роговицы. Операция заключается в том, что в слои роговицы вводят прозрачную пластинку с отверстиями по периферии. Она закрывает передние слои роговицы от избыточного пропитывания влагой передней камеры. В результате операции уменьшаются общая отечность роговицы и буллезность эпителия, что в свою очередь избавляет пациента от болевого синдрома. Однако следует отметить, что операция лишь незначительно улучшает остроту зрения и только на короткий срок – до 1 – 2 лет. Задние слои роговицы остаются отечными, а передние постепенно уплотняются и мутнеют. В связи с этим в настоящее время благодаря совершенствованию техники сквозной субтотальной кератопластики при отечной дистрофии роговицы предпочтительнее пересадка роговицы.
Глава 12. Хрусталик
Огромный пляж из голых галек –На все глядящий без пелен –И зоркий, как глазной хрусталик,Незастекленный небосклон.Б. Пастернак
Строение хрусталика
Хрусталик является частью светопроводящей и светопреломляющей системы глаза. Это – прозрачная, двояковыпуклая биологическая линза, обеспечивающая динамичность оптики глаза благодаря механизму аккомодации.В процессе эмбрионального развития хрусталик формируется на 3–4–й неделе жизни зародыша из эктодермы, покрывающей стенку глазного бокала. Эктодерма втягивается в полость глазного бокала, и из нее формируется зачаток хрусталика в виде пузырька. Из удлиняющихся эпителиальных клеток внутри пузырька образуются хрусталиковые волокна.
Хрусталик имеет форму двояковыпуклой линзы. Передняя и задняя сферичные поверхности хрусталика имеют разный радиус кривизны (рис. 12.1). Передняя поверхность более плоская. Радиус ее кривизны (R = 10 мм) больше, чем радиус кривизны задней поверхности (R = 6 мм). Центры передней и задней поверхностей хрусталика называют соответственно передним и задним полюсами, а соединяющую их линию – осью хрусталика, длина которой составляет 3,5–4,5 мм. Линия перехода передней поверхности в заднюю – это экватор. Диаметр хрусталика 9–10 мм.
 Рис. 12.1. Строение хрусталика и расположение поддерживающей его цинновой связки.
Рис. 12.1. Строение хрусталика и расположение поддерживающей его цинновой связки.
Хрусталик покрыт тонкой бесструктурной прозрачной капсулой. Часть капсулы, выстилающая переднюю поверхность хрусталика, имеет название "передняя капсула" ("передняя сумка") хрусталика. Ее толщина II–18 мкм. Изнутри передняя капсула покрыта однослойным эпителием, а задняя его не имеет, она почти в 2 раза тоньше передней. Эпителий передней капсулы играет важную роль в метаболизме хрусталика, характеризуется высокой активностью окислительных ферментов по сравнению с центральным отделом линзы. Эпителиальные клетки активно размножаются. У экватора они удлиняются, формируя зону роста хрусталика. Вытягивающиеся клетки превращаются в хрусталиковые волокна. Молодые лентовидные клетки оттесняют старые волокна к центру. Этот процесс непрерывно протекает на протяжении всей жизни. Центрально расположенные волокна теряют ядра, обезвоживаются и сокращаются. Плотно наслаиваясь друг на друга, они формируют ядро хрусталика (nucleus lentis). Размер и плотность ядра с годами увеличиваются. Это не отражается на степени прозрачности хрусталика, однако вследствие снижения общей эластичности постепенно уменьшается объем аккомодации (см. раздел "Аккомодация"). К 40–45 годам жизни уже имеется достаточно плотное ядро. Такой механизм роста хрусталика обеспечивает стабильность его наружных размеров. Замкнутая капсула хрусталика не позволяет погибшим клеткам слущиваться наружу. Как и все эпителиальные образования, хрусталик в течение всей жизни растет, но размер его не увеличивается.
Молодые волокна, постоянно образующиеся на периферии хрусталика, формируют вокруг ядра эластичное вещество – кору хрусталика (cortex lentis). Волокна коры окружены специфическим веществом, имеющим одинаковый с ними коэффициент преломления света. Оно обеспечивает их подвижность при сокращении и расслаблении, когда хрусталик меняет форму и оптическую силу в процессе аккомодации.
Хрусталик имеет слоистую структуру – напоминает луковицу. Все волокна, отходящие в одной плоскости от зоны роста по окружности экватора, сходятся в центре и образуют трехконечную звезду, которая видна при биомикроскопии, особенно при появлении помутнений.
Из описания строения хрусталика видно, что он является эпителиальным образованием: в нем нет ни нервов, ни кровеносных и лимфатических сосудов.
Артерия стекловидного тела (a. hyaloidea), которая в раннем эмбриональном периоде участвует в формировании хрусталика, впоследствии редуцируется. К 7–8–му месяцу рассасывается капсула сосудистого сплетения вокруг хрусталика.
Хрусталик со всех сторон окружен внутриглазной жидкостью. Питательные вещества поступают через капсулу путем диффузии и активного транспорта. Энергетические потребности бессосудистого эпителиального образования в 10–20 раз ниже, чем потребности других органов и тканей. Они удовлетворяются посредством анаэробного гликолиза.
По сравнению с другими структурами глаза хрусталик содержит наибольшее количество белков (35–40%). Это – растворимые α– и β–кристаллины и нерастворимый альбуминоид. Белки хрусталика органоспецифичные. При иммунизации к этому белку может возникнуть анафилактическая реакция. В хрусталике есть углеводы и их производные, восстановители глютатиона, цистеина, аскорбиновой кислоты и др. В отличие от других тканей в хрусталике мало воды (до 60–65%), причем с возрастом ее количество уменьшается. Содержание белка, воды, витаминов и электролитов в хрусталике значительно отличается от тех пропорций, которые выявляются во внутриглазной жидкости, стекловидном теле и плазме крови. Хрусталик плавает в воде, но, несмотря на это, является дегидрированным образованием, что объясняется особенностями водно–электролитного транспорта. В линзе высокий уровень ионов калия и низкий уровень ионов натрия: концентрация ионов калия в 25 раз выше, чем в водянистой влаге глаза и стекловидном теле, а концентрация аминокислот в 20 раз выше.
Капсула хрусталика обладает свойством избирательной проницаемости, поэтому химический состав прозрачного хрусталика поддерживается на определенном уровне. Изменение состава внутриглазной жидкости отражается на состоянии прозрачности хрусталика.
У взрослого человека хрусталик имеет легкий желтоватый оттенок, интенсивность которого с возрастом может усиливаться. Это не отражается на остроте зрения, однако может повлиять на восприятие синего и фиолетового цвета.
Хрусталик располагается в полости глаза во фронтальной плоскости между радужкой и стекловидным телом, разделяя глазное яблоко на передний и задний отделы. Спереди хрусталик служит опорой для зрачковой части радужки. Его задняя поверхность располагается в углублении стекловидного тела, от которого хрусталик отделяет узкая капиллярная щель, расширяющаяся при скоплении в ней экссудата.
Хрусталик сохраняет свое положение в глазу при помощи волокон круговой поддерживающей связки ресничного тела (цинновой связки). Тонкие (толщиной 20–22 мкм) паутинные нити отходят радиальными пучками от эпителия цилиарных отростков, частично перекрещиваются и вплетаются в капсулу хрусталика на передней и задней поверхностях, обеспечивая воздействие на капсулу хрусталика при работе мышечного аппарата ресничного (цилиарного) тела.
Функции хрусталика
Хрусталик выполняет в глазу ряд очень важных функций. Прежде всего он является средой, через которую световые лучи беспрепятственно проходят к сетчатке. Это – функция светопроведения. Она обеспечивается основным свойством хрусталика – его прозрачностью.Главная функция хрусталика – светопреломление. По степени преломления световых лучей он занимает второе место после роговицы. Оптическая сила этой живой биологической линзы в пределах 19,0 дптр.
Взаимодействуя с цилиарным телом, хрусталик обеспечивает функцию аккомодации. Он способен плавно изменять оптическую силу. Саморегулирующийся механизм фокусировки изображения (см. раздел "Аккомодация*’) возможен благодаря эластичности хрусталика. Этим обеспечивается динамичность рефракции.
Хрусталик делит глазное яблоко на два неравнозначных отдела – меньший передний и больший задний. Это – перегородка или разделительный барьер между ними. Барьер защищает нежные структуры переднего отдела глаза от давления большой массы стекловидного тела. В том случае, когда глаз лишается хрусталика, стекловидное тело перемещается кпереди. Изменяются анатомические взаимоотношения, а вслед за ними и функции. Затрудняются условия гидродинамики глаза за счет сужения (сдавления) угла передней камеры глаза и блокады области зрачка. Возникают условия к развитию вторичной глаукомы. При удалении хрусталика вместе с капсулой возникают изменения и в заднем отделе глаза вследствие вакуумного эффекта. Стекловидное тело, получившее некоторую свободу перемещения, отходит от заднего полюса и ударяется о стенки глаза при движениях глазного яблока. В этом причина возникновения тяжелой патологии сетчатки, такой как отек, отслойка, кровоизлияния, разрывы.
Хрусталик является преградой для проникновения микробов из передней камеры в полость стекловидного тела – защитный барьер.
Аномалии развития хрусталика
Пороки развития хрусталика могут иметь разные проявления. Любые изменения формы, размеров и локализации хрусталика вызывают выраженные нарушения его функции.Врожденная афакия – отсутствие хрусталика – встречается редко и, как правило, сочетается с другими пороками развития глаза.
Микрофакия – маленький хрусталик. Обычно эта патология сочетается с изменением формы хрусталика – сферофакией (шаровидный хрусталик) или нарушением гидродинамики глаза. Клинически это проявляется высокой близорукостью с неполной коррекцией зрения. Маленький круглый хрусталик, подвешенный на длинных слабых нитях круговой связки, имеет значительно большую, чем в норме, подвижность. Он может вставиться в просвет зрачка и вызвать зрачковый блок с резким повышением внутриглазного давления и болевым синдромом. Чтобы освободить хрусталик, нужно медикаментозным путем расширить зрачок.
Микрофакия в сочетании с подвывихом хрусталика является одним из проявлений синдрома Марфана, наследственного порока развития всей соединительной ткани. Эктопия хрусталика, изменение его формы вызваны гипоплазией поддерживающих его связок. С возрастом отрыв цинновой связки увеличивается. В этом месте стекловидное тело выпячивается в виде грыжи. Экватор хрусталика становится видимым в области зрачка. Возможен и полный вывих хрусталика. Помимо глазной патологии, для синдрома Марфана характерны поражение опорно–двигательного аппарата и внутренних органов (рис. 12.2).
Нельзя не обратить внимания на особенности внешнего вида больного: высокий рост, непропорционально длинные конечности, тонкие, длинные пальцы рук (арахнодактилия), слабо развитые мышцы и подкожная жировая клетчатка, искривление позвоночника. Длинные и тонкие ребра образуют грудную клетку необычной формы. Помимо этого, выявляют пороки развития сердечно–сосудистой системы, вегетативнососудистые расстройства, дисфункцию коркового вещества надпочечников, нарушение суточного ритма выведения глюкокортикоидов с мочой.
Микросферофакия с подвывихом или полным вывихом хрусталика отмечается и при синдроме Марчезани – системном наследственном поражении мезенхимальной ткани. Больные с этим синдромом в отличие от больных с синдромом Марфана имеют совершенно иной внешний вид: низкий рост, короткие руки, которыми им трудно обхватить собственную голову, короткие и толстые пальцы (брахидактилия), гипертрофированные мышцы, асимметричный сдавленный череп.
Колобома хрусталика – дефект ткани линзы по средней линии в нижнем отделе. Данная патология наблюдается крайне редко и обычно сочетается с колобомой радужки, цилиарного тела и хориоидеи. Такие дефекты образуются вследствие неполного закрытия зародышевой щели при формировании вторичного глазного бокала.
Лентиконус – конусовидное выпячивание одной из поверхностей хрусталика. Другая разновидность патологии поверхности линзы – лентиглобус: передняя или задняя поверхность хрусталика имеет шаровидную форму. Каждая из этих аномалий развития обычно отмечается на одном глазу, может сочетаться с помутнениями в хрусталике. Клинически лентиконус и лентиглобус проявляются усилением рефракции глаза, т. е. развитием миопии высокой степени и труднокорригируемого астигматизма.
При аномалиях развития хрусталика, не сопровождающихся глаукомой или катарактой, специального лечения не требуется. В тех случаях, когда вследствие врожденной патологии хрусталика возникает некорригируемая очками аномалия рефракции, измененный хрусталик удаляют и заменяют его искусственным (см. раздел "Афакия").
Патология хрусталика
Особенности строения и функций хрусталика, отсутствие нервов, кровеносных и лимфатических сосудов определяют своеобразие его патологии. В хрусталике не бывает воспалительных и опухолевых процессов. Основные проявления патологии хрусталика – нарушение его прозрачности и потеря правильного места расположения в глазу.Катаракта
Любое помутнение хрусталика и его капсулы называется катарактой.В зависимости от количества и локализации помутнений в хрусталике различают полярные (передние и задние), веретенообразные, зонулярные (слоистые), ядерные, кортикальные и полные катаракты (рис. 12.3). Характерный рисунок расположения помутнений в хрусталике может быть свидетельством врожденной или приобретенной катаракты.
Врожденная катаракта
Врожденные помутнения хрусталика возникают при воздействии токсичных веществ на эмбрион или плод в период формирования хрусталика. Чаще всего это вирусные заболевания матери в период беременности, такие как грипп, корь, краснуха, а также токсоплазмоз. Большое значение имеют эндокринные расстройства у женщины во время беременности и недостаточность функции паращитовидных желез, приводящая к гипокальциемии и нарушению развития плода.Врожденные катаракты могут быть наследственными с доминантным типом передачи. В таких случаях заболевание чаще всего бывает двусторонним, нередко сочетается с пороками развития глаза или других органов.
При осмотре хрусталика можно выявить определенные признаки, характеризующие врожденные катаракты, чаще всего полярные или слоистые помутнения, которые имеют либо ровные округлые очертания, либо симметричный рисунок, иногда это может быть подобие снежинки или картины звездного неба.
Небольшие врожденные помутнения в периферических отделах хрусталика и на задней капсуле можно обнаружить и в здоровых глазах. Это следы прикрепления сосудистых петель эмбриональной артерии стекловидного тела. Такие помутнения не прогрессируют и не мешают зрению.
 Рис. 12.3. Локализация помутнений при различных видах катаракт.
Рис. 12.3. Локализация помутнений при различных видах катаракт.
Передняя полярная катаракта – это помутнение хрусталика в виде круглого пятна белого или серого цвета, которое располагается под капсулой у переднего полюса. Оно образуется в результате нарушения процесса эмбрионального развития эпителия.
Задняя полярная катаракта по форме и цвету очень похожа на переднюю полярную катаракту, но располагается у заднего полюса хрусталика под капсулой. Участок помутнения может быть сращен с капсулой. Задняя полярная катаракта представляет собой остаток редуцированной эмбриональной артерии стекловидного тела.
В одном глазу могут отмечаться помутнения и у переднего, и у заднего полюса. В таком случае говорят о переднезадней полярной катаракте. Для врожденных полярных катаракт характерны правильные округлые очертания. Размеры таких катаракт небольшие (1–2 мм). Иногда полярные катаракты имеют тонкий лучистый венчик. В проходящем свете полярная катаракта видна как черное пятно на розовом фоне.
Веретенообразная катаракта занимает самый центр хрусталика. Помутнение располагается строго по переднезадней оси в виде тонкой серой ленты, по форме напоминающей веретено. Оно состоит из трех звеньев, трех утолщений. Это цепочка соединенных между собой точечных помутнений под передней и задней капсулами хрусталика, а также в области его ядра.
Полярные и веретенообразные катаракты обычно не прогрессируют. Пациенты с раннего детства приспосабливаются смотреть через прозрачные участки хрусталика, нередко имеют полное или достаточно высокое зрение. При данной патологии лечение не требуется.
Слоистая (зонулярная) катаракта встречается чаще других врожденных катаракт. Помутнения располагаются строго в одном или нескольких слоях вокруг ядра хрусталика. Прозрачные и мутные слои чередуются. Обычно первый мутный слой располагается на границе эмбрионального и "взрослого" ядер. Это хорошо видно на световом срезе при биомикроскопии. В проходяшем свете такая катаракта видна как темный диск с ровными краями на фоне розового рефлекса. При широком зрачке в ряде случаев определяются еще и локальные помутнения в виде коротких спиц, которые расположены в более поверхностных слоях по отношению к мутному диску и имеют радиальное направление. Они как будто сидят верхом на экваторе мутного диска, поэтому их называют “наездниками". Только в 5% случаев слоистые катаракты бывают односторонними.
Двустороннее поражение хрусталиков, четкие границы прозрачных и мутных слоев вокруг ядра, симметричное расположение периферических спицеобразных помутнений с относительной упорядоченностью рисунка свидетельствуют о врожденной патологии. Слоистые катаракты могут развиться и в постнатальном периоде у детей с врожденной или приобретен ной недостаточностью функции паращитовидных желез. У детей с симптомами тетании обычно выявляют слоистую катаракту.
Степень снижения зрения определяется плотностью помутнений в центре хрусталика. Решение вопроса о хирургическом лечении зависит главным образом от остроты зрения.
Тотальная катаракта встречается редко и всегда бывает двусторонней. Все вещество хрусталика превращается в мутную мягкую массу вследствие грубого нарушения эмбрионального развития хрусталика. Такие катаракты постепенно рассасываются, оставляя после себя сращенные друг с другом сморщенные мутные капсулы. Полное рассасывание вещества хрусталика может произойти еще до рождения ребенка. Тотальные катаракты приводят к значительному снижению зрения. При таких катарактах требуется хирургическое лечение в первые месяцы жизни, так как слепота на оба глаза в раннем возрасте является угрозой развития глубокой, необратимой амблиопии – атрофии зрительного анализатора вследствие его бездействия.
Приобретенная катаракта
Катаракта – наиболее часто наблюдающееся заболевание глаз. Эта патология возникает главным образом у пожилых людей, хотя катаракты могут развиваться в любом возрасте вследствие разных причин. Помутнение хрусталика – это типовая ответная реакция его бессосудистого вещества на воздействие любого неблагоприятного фактора, а также изменение состава внутриглазной жидкости, окружающей хрусталик.При микроскопическом исследовании мутного хрусталика выявляют набухание и распад волокон, которые теряют связь с капсулой и сокращаются, между ними образуются вакуоли и щели, заполненные белковой жидкостью. Клетки эпителия набухают, теряют правильные очертания. нарушается их способность воспринимать красители. Ядра клеток уплотняются, интенсивно окрашиваются. Капсула хрусталика изменяется незначительно, что при выполнении операции позволяет сохранить капсульный мешок и использовать его для фиксации искусственного хрусталика.
В зависимости от этиологического фактора выделяют несколько видов катаракт. Для простоты изложения материала разделим их на две группы: возрастные и осложненные. Возрастные катаракты можно рассматривать как проявление процессов возрастной инволюции. Осложненные катаракты возникают при воздействии неблагоприятных факторов внутренней или внешней среды. Определенную роль в развитии катаракты играют иммунные факторы (см. главу 24).
Возрастная катаракта.
Раньше ее называли старческой. Известно, что возрастные изменения в разных органах и тканях протекают не у всех одинаково. Возрастную (старческую) катаракту можно обнаружить не только у стариков, но также у пожилых людей и даже людей активного зрелого возраста. Обычно она бывает двусторонней, однако помутнения не всегда появляются одновременно в обоих глазах.В зависимости от локализации помутнений различают корковую и ядериую катаракты. Корковая катаракта встречается почти в 10 раз чаще, чем ядерная. Рассмотрим сначала развитие корковой формы.
В процессе развития любая катаракта проходит четыре стадии созревания: начальная, незрелая, зрелая и перезрелая.
Ранними признаками начальной корковой катаракты могут служить вакуоли, расположенные субкапсулярно, и водяные щели, образующиеся в корковом слое хрусталика. В световом срезе щелевой лампы они видны как оптические пустоты. При появлении участков помутнения эти щели заполняются продуктами распада волокон и сливаются с общим фоном помутнений. Обычно первые очаги помутнения возникают на периферических участках коры хрусталика и пациенты не замечают развивающейся катаракты до тех пор, пока не возникнут помутнения в центре, вызывающие снижение зрения.
Изменения постепенно нарастают как в переднем, так и в заднем корковых слоях. Прозрачные и мутнеющие части хрусталика неодинаково преломляют свет, в связи с этим больные могут предъявлять жалобы на диплопию или полиопию: вместо одного предмета они видят 2–3 или больше. Возможны и другие жалобы. В начальной стадии развития катаракты при наличии ограниченных мелких помутнений в центре коры хрусталика пациентов беспокоит появление летающих мушек, которые перемешаются в ту сторону, куда смотрит больной. Длительность течения начальной катаракты может быть разной – от 1–2 до 10 лет и более.
Стадия незрелой катаракты характеризуется обводнением вещества хрусталика, прогрессированием помутнений, постепенным снижением остроты зрения. Биомикроскопическая картина представлена помутнениями хрусталика разной интенсивности, перемежающимися с прозрачными участками. При обычном наружном осмотре зрачок еще может быть черным или едва сероватым за счет того, что поверхностные субкапсулярные слои еще прозрачные. При боковом освещении образуется полулунная "тень" от радужки с той стороны, откуда падает свет (рис. 12.4, а).
Набухание хрусталика может привести к тяжелому осложнению – факогенной глаукоме, которую называют также факоморфической. В связи с увеличением объема хрусталика суживается угол передней камеры глаза, затрудняется отток внутриглазной жидкости, повышается внутриглазное давление. В этом случае необходимо удалить набухший хрусталик на фоне гипотензивной терапии. Операция обеспечивает нормализацию внутриглазного давления и восстановление остроты зрения.
Зрелая катаракта характеризуется полным помутнением и небольшим уплотнением вещества хрусталика. При биомикроскопии ядро и задние кортикальные слои не просматриваются. При наружном осмотре зрачок ярко–серого или молочно–белого цвета. Хрусталик кажется вставленным в просвет зрачка. "Тень" от радужки отсутствует (рис. 12.4, б).
При полном помутнении коры хрусталика утрачивается предметное зрение, но сохраняются светоощущение и способность определять местонахождение источника света (если сохранна сетчатка). Пациент может различать цвета. Эти важные показатели являются основанием для благоприятного прогноза относительно возвращения полноценного зрения после удаления катаракты. Если же глаз с катарактой не различает свет и тьму, то это свидетельство полной слепоты, обусловленной грубой патологией в зрительно–нервном аппарате. В этом случае удаление катаракты не приведет к восстановлению зрения.
Перезрелая катаракта встречается крайне редко. Ее называют также молочной или морганиевой катарактой по имени ученого, который впервые описал эту фазу развития катаракты (G. В. Morgagni). Она характеризуется полным распадом и разжижением мутного коркового вещества хрусталика. Ядро теряет опору и опускается вниз. Капсула хрусталика становится похожа на мешочек с мутной жидкостью, на дне которого лежит ядро. В литературе можно найти описание дальнейших изменений клинического состояния хрусталика в том случае, если операция не была произведена. После рассасывания мутной жидкости на какой–то промежуток времени зрение улучшается, а затем ядро размягчается, рассасывается и остается только сморщенная сумка хрусталика. При этом пациент проходит через многие годы слепоты.
При перезрелой катаракте существует опасность развития тяжелых осложнений. При рассасывании большого количества белковых масс возникает выраженная фагоцитарная реакция. Макрофаги и белковые молекулы забивают естественные пути оттока жидкости, в результате чего развивается факогенная (факолитическая) глаукома.
Перезрелая молочная катаракта может осложниться разрывом капсулы хрусталика и выходом белкового детрита в полость глаза. Вслед за этим развивается факолитический иридоциклит.
При развитии отмеченных осложнений перезрелой катаракты необходимо срочно произвести удаление хрусталика.
Ядерная катаракта встречается редко: она составляет не более 8–10% от общего количества возрастных катаракт. Помутнение появляется во внутренней части эмбрионального ядра и медленно распространяется по всему ядру. Вначале оно бывает гомогенным и неинтенсивным, поэтому его расценивают как возрастное уплотнение или склерозирование хрусталика. Ядро может приобретать желтоватую, бурую и даже черную окраску. Интенсивность помутнений и окраски ядра нарастает медленно, постепенно снижается зрение. Незрелая ядерная катаракта не набухает, тонкие корковые слои остаются прозрачными (рис. 12.5). Уплотненное крупное ядро сильнее преломляет световые лучи, что клинически проявляется развитием близорукости, которая может достигать 8,0–9,0 и даже 12,0 дптр. При чтении пациенты перестают пользоваться пресбиопическими очками. В близоруких глазах катаракта обычно развивается по ядерному типу, и в этих случаях также происходит усиление рефракции, т. е. увеличение степени близорукости. Ядерная катаракта на протяжении нескольких лет и даже десятилетий остается незрелой. В редких случаях, когда происходит ее полное созревание, можно говорить о катаракте смешанного типа – ядерно–корковой.
Осложненная катаракта возникает при воздействии различных неблагоприятных факторов внутренней и внешней среды.
В отличие от корковых и ядерных возрастных катаракт для осложненных характерно развитие помутнений под задней капсулой хрусталика и в периферических отделах задней коры. Преимущественное расположение помутнений в заднем отделе хрусталика можно объяснить худшими условиями для питания и обмена веществ. При осложненных катарактах помутнения сначала появляются у заднего полюса в виде едва заметного облачка, интенсивность и размеры которого медленно увеличиваются до тех пор, пока помутнение не займет всю поверхность задней капсулы. Такие катаракты называют задними чашеобразными. Ядро и большая часть коры хрусталика остаются прозрачными, однако, несмотря на это, острота зрения значительно снижается из–за высокой плотности тонкого слоя помутнений.
Осложненная катаракта, обусловленная влиянием неблагоприятных внутренних факторов. Отрицательное воздействие на весьма уязвимые процессы обмена в хрусталике могут оказывать изменения, происходящие в других тканях глаза, или общая патология организма. Тяжелые рецидивирующие воспалительные заболевания глаза, а также дистрофические процессы сопровождаются изменением состава внутриглазной жидкости, которое в свою очередь приводит к нарушению обменных процессов в хрусталике и развитию помутнений. Как осложнение основного глазного заболевания катаракта развивается при рецидивирующих иридоциклитах и хориоретинитах различной этиологии, дисфункции радужки и цилиарного тела (синдром Фукса), далекозашедшей и терминальной глаукоме, отслойке и пигментной дегенерации сетчатки.
Примером сочетания катаракты с общей патологией организма может служить кахектическая катаракта, возникающая в связи с общим глубоким истощением организма при голодании, после перенесенных инфекционных заболеваний (тиф, малярия, оспа и др.), в результате хронической анемии. Катаракта может возникнуть на почве эндокринной патологии (тетания, миотоническая дистрофия; адипозогенитальная дистрофия), при болезни Дауна и некоторых кожных заболеваниях (экзема, склеродермия, нейродермиты, атрофическая пойкилодермия).
В современной клинической практике чаще всего приходится наблюдать диабетическую катаракту. Она развивается при тяжелом течении болезни в любом возрасте, чаще бывает двусторонней и характеризуется необычными начальными проявлениями. Субкапсулярно в переднем и заднем отделах хрусталика формируются помутнения в виде мелких, равномерно расположенных хлопьев, между которыми местами видны вакуоли и тонкие водяные щели. Необычность начальной диабетической катаракты заключается не только в локализации помутнений, но и главным образом в способности к обратному развитию при адекватном лечении диабета. У пожилых людей с выраженным склерозом ядра хрусталика диабетические заднекапсулярные помутнения могут сочетаться с возрастной ядерной катарактой.
Начальные проявления осложненной катаракты,возникающей при нарушении обменных процессов в организме на почве эндокринных, кожных и других заболеваний, также характеризуются способностью к рассасыванию при рациональном лечении общего заболевания.
Осложненная катаракта вызванная воздействием внешних факторов. Хрусталик очень чувствителен ко всем неблагоприятным факторам внешней среды, будь то механическое, химическое, термическое или лучевое воздействие (рис. 12.6, а). Он может изменяться даже в тех случаях, когда нет прямого повреждения. Достаточно того, что поражаются соседние с ним части глаза, поскольку это всегда отражается на качестве продукции и скорости обмена внутриглазной жидкости.
Посттравматические изменения в хрусталике могут проявляться не только помутнением, но и смещением хрусталика (вывихом или подвывихом) в результате полного или частичного отрыва цинновой связки (рис. 12.6, б). После тупой травмы на хрусталике может остаться круглый пигментный отпечаток зрачкового края радужки – так называемая катаракта или кольцо Фоссиуса. Пигмент рассасывается в течение нескольких недель. Совсем иные последствия отмечаются в том случае, если после контузии возникает истинное помутнение вещества хрусталика, например розеточная, или лучистая, катаракта. Со временем помутнения в центре розетки усиливаются и зрение неуклонно снижается.
При разрыве капсулы водянистая влага, содержащая протеолитические ферменты, пропитывает вещество хрусталика, в результате чего он набухает и мутнеет. Постепенно происходят распад и рассасывание хрусталиковых волокон, после чего остается сморщенная хрусталиковая сумка.
Последствия ожогов и проникающих ранений хрусталика, а также экстренные меры помощи описаны в главе 23.
Лучевая катаракта.
Хрусталик способен поглощать лучи с очень малой длиной волны в невидимой, инфракрасной, части спектра. Именно при воздействии этих лучей существует опасность развития катаракты. В хрусталике оставляют следы рентгеновские и радиевые лучи, а также протоны, нейтроны и другие элементы расщепления ядра. Воздействие на глаз ультразвука и тока СВЧ также может привести к развитию катаракты. Лучи видимой зоны спектра (длина волны от 300 до 700 нм) проходят через хрусталик, не повреждая его.Профессиональная лучевая катаракта может развиваться у рабочих горячих цехов. Большое значение имеют стаж работы, длительность непрерывного контакта с излучением и выполнение правил техники безопасности.
Необходимо соблюдать осторожность при проведении лучевой терапии в области головы, особенно при облучении глазницы. Для защиты глаз используют специальные приспособления. После взрыва атомной бомбы у жителей японских городов Хиросима и Нагасаки выявляли характерные лучевые катаракты. Из всех тканей глаза хрусталик оказался наиболее восприимчивым к жесткому ионизирующему ихаучению. У детей и молодых людей он более чувствителен, чем у стариков. Объективные данные свидетельствуют о том, что катарактогенное воздействие нейтронного излучения в десятки раз сильнее, чем другие виды излучения.
Биомикроскопическая картина при лучевой катаракте, так же как и при других осложненных катарактах, характеризуется помутнениями в виде диска неправильной формы, располагающимися под задней капсулой хрусталика. Начальный период развития катаракты может быть длительным, иногда он составляет несколько месяцев и даже лет в зависимости от дозы облучения и индивидуальной чувствительности. Обратного развития лучевых катаракт не происходит.
Катаракта при отравлениях.
В литературе описаны тяжелые случаи отравления спорыньей с расстройством психики, судорогами и тяжелой глазной патологией – мидриазом, нарушением глазодвигательной функции и осложненной катарактой, которую обнаруживали спустя несколько месяцев.Токсическое воздействие на хрусталик оказывают нафталин, таллий, динитрофенол, тринитротолуол и нитрокраски. Они могут попадать в организм разными путями – через дыхательные пути, желудок и кожу. Экспериментальную катаракту у животных получают при добавлении в корм нафталина или таллия.
Осложненную катаракту могут вызвать не только токсичные вещества, но также избыток некоторых лекарств, например сульфаниламидов, и обычных ингредиентов пищи. Так, катаракта может развиться при кормлении животных галактозой, лактозой и ксилозой. Помутнения хрусталика, обнаруженные у больных галактоземией и галактозурией, – это не случайность, а следствие того, что галактоза не усваивается и накапливается в организме. Веских доказательств роли дефицита витаминов в возникновении осложненной катаракты не получено.
Токсические катаракты в начальном периоде развития могут рассосаться, если прекратилось поступление активнодействующего вещества в организм. Длительное воздействие катарактогенных агентов вызывает необратимые помутнения. В этих случаях требуется хирургическое лечение.
Лечение катаракты
В начальной стадии развития катаракты осуществляют консервативное лечение для предотвращения быстрого помутнения всего вещества хрусталика. С этой целью назначают закапывания препаратов, улучшающих обменные процессы. Эти препараты содержат цистеин, аскорбиновую кислоту, глутамин и другие ингредиенты. Результаты лечения не всегда убедительны. Редкие формы начальных катаракт могут рассосаться, если своевременно будет проведена рациональная терапия того заболевания, которое явилось причиной образования помутнений в хрусталике.Хирургическое удаление мутного хрусталика называется экстракцией катаракты.
Операцию по поводу катаракты делали еще 2500 лет до нашей эры, о чем свидетельствуют памятники Египта и Ассирии. Тогда использовали прием "издaвлeния", или "реклинации", хрусталика в полость стекловидного тела: иглой прокалывали роговицу, толчкообразно нажимали на хрусталик, отрывали цинновы связки и опрокидывали его в стекловидное тело. Только у половины больных операции были успешными, у остальных наступала слепота вследствие развития воспаления и Других осложнений.
Первую операцию извлечения хрусталика при катаракте выполнил Французский врач Ж. Давиель в 1745 г. С тех пор методика операции постоянно изменяется и совершенствуется.
Показанием к операции является, снижение остроты зрения, приводящее к ограничению трудоспособности и дискомфорту в обычной жизни. Степень зрелости катаракты не имеет значения при определении показаний к ее удалению. Так, например, при чашеобразной катаракте ядро и кортикальные массы могут быть полностью прозрачными, однако тонкий слой плотных помутнений, локализующихся под задней капсулой в центральном отделе, резко снижает остроту зрения. При двусторонней катаракте сначала оперируют тот глаз, который имеет худшее зрение.
Перед операцией обязательно проводят исследование обоих глаз и оценку общего состояния организма. Врачу и пациенту всегда важен прогноз результатов операции в плане предупреждения возможных осложнений, а также относительно функции глаза после операции. Для того чтобы составить представление о сохранности зрительно–нервного анализатора глаза, определяют его способность локализовать направление света (проекцию света), исследуют поле зрения и биоэлектрические потенциалы. Операцию удаления катаракты проводят и при выявленных нарушениях, рассчитывая восстановить хотя бы остаточное зрение. Хирургическое лечение абсолютно бесперспективно только при полной слепоте, когда глаз не ощущает света. В том случае, если обнаруживают признаки воспаления в переднем и заднем отрезках глаза, а также в его придатках, обязательно проводят противовоспалительную терапию до операции.
В процессе обследования может быть выявлена диагностированная ранее глаукома. Это требует от врача особого внимания, так как при удалении катаракты из глаукомного глаза существенно возрастает опасность развития самого тяжелого осложнения – экспульсивной геморрагии, последствием которой может быть необратимая слепота. При глаукоме врач принимает решение о выполнении предварительной антиглаукоматозной операции или комбинированного вмешательства экстракции катаракты и антиглаукоматозной операции. Экстракция катаракты при оперированной, компенсированной глаукоме более безопасна, так как в ходе операции менее вероятны внезапные резкие перепады внутриглазного давления.
При определении тактики хирургического лечения врач учитывает и любые другие особенности глаза, выявленные в процессе обследования.
Общее обследование пациента преследует цель выявить возможные очаги инфекции, прежде всего в органах и тканях, расположенных рядом с глазом. До операции должны быть санированы очаги воспаления любой локализации. Особое внимание следует обратить на состояние зубов, носоглотки и околоносовых пазух.
Анализы крови и мочи, ЭКГ и рентгеновское исследование легких помогают выявить заболевания, для устранения которых требуется экстренное или плановое лечение.
При клинически спокойном состоянии глаза и его придатков исследование микрофлоры содержимого конъюнктивального мешка не производят.
В современных условиях непосредственная предоперационная подготовка больного существенно упрощается, в связи с тем что все микрохирургические манипуляции малотравматичны, при их выполнении обеспечивается надежная герметизация полости глаза и пациенты после операции не нуждаются в строгом постельном режиме. Операция может быть выполнена амбулаторно.
Экстракцию катаракты производят с использованием микрохирургической техники. Это значит, что хирург осуществляет все манипуляции под микроскопом, применяет тончайшие микрохирургические инструменты и шовный материал, обеспечен удобным креслом. Подвижность головы пациента ограничена специальным изголовьем операционного стола, имеющим форму полукруглого столика, на котором лежат инструменты, на него опираются руки хирурга. Совокупность этих условий позволяет хирургу выполнять точные манипуляции без тремора пальцев рук и случайных отклонений головы пациента.
Хрусталик можно удалить из глаза целиком в сумке – интракапсулярная экстракция катаракты. Хирурги обычно используют метод криоэкстракции, предложенный в 1961 г. польским ученым Крвавичем (рис. 12.7). Операционный доступ – сверху через дугообразный корнеосклеральный разрез по лимбу. Разрез большой – немного меньше полуокружности роговицы. Он соответствует диаметру удаляемого хрусталика (9–10 мм). Специальным инструментом – ирисретрактором захватывают верхний край зрачка и подтягивают радужку и зрачок кверху, при этом у края разреза обнажается хрусталик. Охлажденный наконечник криоэкстрактора прикладывают к передней поверхности хрусталика. Через 5–7 с хрусталик примораживается к наконечнику и легко удаляется из глаза. Для герметизации раны накладывают 8–10 узловых швов или один непрерывный шов. В настоящее время применение этого простого способа ограничено из–за того, что в послеоперационном периоде, даже в отдаленные сроки, возникают тяжелые осложнения в заднем отделе глаза. Это объясняется тем, что после интракапсулярной экстракции катаракты вся масса стекловидного тела продвигается кпереди и частично занимает место удаленной линзы. Мягкая, податливая радужка не может сдержать перемещение стекловидного тела, в результате чего появляется гиперемия сосудов сетчатки ex vacuo (вакуумный эффект). Вслед за этим могут возникать кровоизлияния в сетчатку, отек ее центрального отдела, участки отслоения сетчатки.
В настоящее время основным способом удаления мутного хрусталика является экстракапсулярная экстракция катаракты. Суть операции заключается в следующем: вскрывают переднюю капсулу хрусталика, удаляют ядро и кортикальные массы, а задняя капсула вместе с узким ободком передней капсулы остаются на месте и выполняют свою обычную функцию – отделяют передней отдел глаза от заднего. Они служат преградой для перемещения стекловидного тела кпереди. В связи с этим после экстракапсулярной экстракции катаракты возникает существенно меньше осложнений в заднем отделе глаза, он легче выдерживает различные нагрузки при беге, толчках, подъеме тяжестей. Кроме того, сохранившаяся сумка хрусталика является идеальным местом для искусственной оптики.
Существуют разные варианты выполнения экстракапсулярной экстракции катаракты. Их можно разделить на две группы – мануальная и энергетическая хирургия катаракты.
Мануальная техника предполагает использование разных хирургических доступов: дугового корнеосклерального разреза в области лимба, склерального или роговичного подхода. В последнем случае разрез производят острым алмазным ножом концентрично лимбу, отступя от лимба 1 – 1,5 мм. Хирургический доступ при экстракапсулярной экстракции катаракты почти вдвое короче, чем при интракапсулярной, так как он ориентирован только на выведение ядра хрусталика, диаметр которого у пожилого человека равен 5–6 мм. Для того чтобы подойти к ядру хрусталика, нужно осторожно вскрыть переднюю капсулу. Использование специальных приемов позволяет легко вывести ядро. Кортикальные массы удаляют с помощью ирригационно–аспирационных устройств. В полость глаза вводят сбалансированный изотонический раствор натрия хлорида, поддерживающий постоянство величины передней камеры глаза. Одновременно через тонкую канюлю отсасывают мягкие хрусталиковые массы.
В последнее время хирурги стремятся уменьшить операционный разрез до 3–4 мм, чтобы сделать операцию более безопасной. В этом случае приходится разрезать ядро хрусталика пополам в полости глаза двумя крючками, движущимися от противоположных точек экватора навстречу друг другу. Обе половинки ядра выводят поочередно. Операцию заканчивают введением искусственной оптической линзы нужной диоптрийности (рис. 12.8). Ее помещают в освободившуюся сумку естественного хрусталика. Разрез герметизируют тонкими швами с погружением узелков в разрез. Опытные хирурги выполняют эту операцию за 10–20 мин.
В настоящее время традиционная мануальная хирургия катаракты все больше вытесняется современными методами с использованием энергии ультразвука или лазера для разрушения хрусталика в полости глаза. Это так называемая энергетическая хирургия, или хирургия малых разрезов. Она привлекает хирургов существенным снижением частоты развития осложнений в ходе операции, а также отсутствием послеоперационного астигматизма.
Техника ультразвуковой факоэмульсификации катаракты была предложена в 1967 г. американским Ученым C.D. Kelman. Широкое использование этого метода началось в 80–90–е годы.
Для выполнения ультразвуковой факоэмульсификации катаракты созданы специальные приборы. Через разрез у лимба длиной 3,0–3.5 мм в глаз вводят наконечник, несущий ультразвуковую энергию. Специальными приемами хирург разделяет ядро на четыре фрагмента и поочередно разрушает их. Через тот же наконечник в глаз поступает изотонический раствор натрия хлорида, происходит вымывание хрусталиковых масс и отведение их по специальному каналу (рис. 12.9, а).
При определении показаний к проведению ультразвуковой факоэмульсификации катаракты учитывают возраст пациента и степень твердости ядра хрусталика. Особенностью этой операции является необходимость нажима на хрусталик ультразвуковым наконечником или крючками, разделяющими ядро на части. Такая процедура может быть опасной у пациентов пожилого возраста. Из–за слабости цинновых связок может произойти вывих хрусталика. От степени твердости ядра зависит продолжительность дробления катаракты и время работы ультразвука. Не рекомендуется использовать ультразвуковую энергию более 3.5 мин в связи с опасностью неблагоприятного воздействия на соседние ткани глаза. В связи с этим самые твердые желтые, бурые и черные катаракты не показаны для операции методом факоэмульсификации.
В 1995 г. группой отечественных офтальмологов (В. Г. Копаева, Ю. В. Андреев) под руководством академика С. Н. Федорова впервые в мире была разработана технология разрушения и эвакуации катаракты любой степени твердости с помощью лазерной энергии и оригинальной вакуумной установки. Известные другие лазерные системы позволяют эффективно разрушать только мягкие и средней твердости катаракты. Операцию выполняют бимануально через два прокола у лимба. На первом этапе расширяют зрачок и вскрывают переднюю капсулу хрусталика в виде круга диаметром 5–7 мм. Затем в глаз вводятся лазерный (диаметром 0,7 мм) и отдельно ирригационно–аспирационный (1,7 мм) наконечники (рис. 12.9, б). Они едва касаются поверхности хрусталика в центре. Хирург наблюдает, как в течение нескольких секунд "растаивает" ядро хрусталика и формируется глубокая чаша, стенки которой распадаются на фрагменты. При их разрушении снижают уровень энергии. Мягкие кортикальные массы аспирируют без использования лазера. Разрушение мягких и средней твердости катаракт происходит за короткий период времени – от нескольких секунд до 2–3 мин, для удаления плотных и очень плотных хрусталиков требуется от 4 до 6–7 мин.
Лазерная экстракция катаракты (ЛЭК) расширяет возрастные показания, поскольку в процессе операции не происходит нажима на хрусталик, нет необходимости в механической фрагментации ядра. Лазерный наконечник не нагревается в процессе работы, поэтому не нужно вводить большое количество изотонического раствора натрия хлорида. У пациентов моложе 40 лет часто не требуется включение лазерной энергии, так как мощная вакуумная система прибора справляется с отсасыванием мягкого вещества хрусталика. В процессе операции раневые отверстия плотно тампонированы наконечниками. Для того чтобы не расширять разрез при введении искусственного хрусталика, целесообразно использовать складывающиеся мягкие интраокулярные линзы. После операции швы не накладывают. Есть все основания считать, что в будущем лазерная экстракция катаракты будет широко применяться в клинической практике.
Экстракцию катаракты называют жемчужиной глазной хирургии. Это – самая распространенная глазная операция. Она приносит глубокое удовлетворение хирургу и пациенту. Часто больные на ощупь приходят к врачу, а после операции сразу становятся зрячими. Операция позволяет вернуть ту остроту зрения, которая была в данном глазу до развития катаракты.
Вывих и подвывих хрусталика
Вывихом называют полный отрыв хрусталика от поддерживающей связки и смещение его в переднюю или заднюю камеру глаза (см. рис. 12.6, б). При этом происходит резкое снижение остроты зрения, так как из оптической системы глаза выпала линза силой 19,0 дптр. Вывихнутый хрусталик подлежит удалению.Подвывих хрусталика – это частичный отрыв цинновой связки, который может иметь разную протяженность по окружности.
Врожденные вывихи и подвывихи хрусталика описаны выше. Приобретенное смещение биологической линзы происходит в результате тупых травм или грубых сотрясений. Клинические проявления подвывиха хрусталика зависят от величины образовавшегося дефекта. Минимальные повреждения могут остаться незамеченными, если не повреждена передняя пограничная мембрана стекловидного тела и хрусталик остался прозрачным.
Основной симптом подвывиха хрусталика – дрожание радужки (иридодонез). Нежная ткань радужки опирается на хрусталик у переднего полюса, поэтому дрожание подвывихнутой линзы передается радужке. Иногда этот симптом можно увидеть, не применяя специальных методов исследования. В других случаях приходится внимательно наблюдать за радужкой при боковом освещении или в свете щелевой лампы, чтобы уловить легкую волну движений при небольших смещениях глазного яблока. При резких отведениях глаза вправо и влево легкие колебания радужки выявить не удается. Следует отметить, что иридодонез не всегда присутствует даже при заметных подвывихах линзы. Это происходит в тех случаях, когда вместе с надрывом цинновой связки в том же секторе появляется дефект в передней пограничной мембране стекловидного тела. При этом возникает ущемленная грыжа стекловидного тела, которая тампонирует образовавшееся отверстие, уменьшает подвижность хрусталика. В таких случаях подвывих линзы можно распознать по двум другим симптомам, выявляемым при биомикроскопии: это неравномерная глубина передней и задней камер глаза из–за более выраженного давления или перемещения стекловидного тела кпереди в зоне ослабления опоры хрусталика. При ущемленной и фиксированной спайками грыже стекловидного тела увеличивается задняя камера в данном секторе и одновременно изменяется глубина передней камеры глаза, чаще всего она становится меньше. В обычных условиях задняя камера не доступна осмотру, поэтому о глубине ее периферических отделов судят по косвенному признаку – разному расстоянию от края зрачка до хрусталика справа и слева или сверху и снизу.
При неосложненном подвывихе хрусталика острота зрения существенно не снижается и лечения не требуется. Однако со временем развиваются осложнения. Подвывихнутая линза может помутнеть, или она становится причиной развития вторичной глаукомы. В таких случаях встает вопрос об ее удалении. Своевременная диагностика подвывиха линзы позволяет правильно выбрать хирургическую тактику, оценить возможность укрепления капсулы и размещения в ней искусственного хрусталика.
Афакия и артифакия
Афакия – это отсутствие хрусталика. Глаз без хрусталика называется афакичным.Врожденная афакия наблюдается редко. Обычно хрусталик удаляют хирургическим путем в связи с его помутнением или вывихом. Известны случаи выпадения хрусталика при проникающих ранениях.
При исследовании афакичного глаза обращают на себя внимание глубокая передняя камера и дрожание радужки (иридодонез). Если в глазу сохранилась задняя капсула хрусталика, то она сдерживает толчки стекловидного тела при движениях глаза и дрожание радужки выражено слабее. При биомикроскопии световой срез выявляет место расположения капсулы, а также степень ее прозрачности. В случае отсутствия хрусталиковой сумки стекловидное тело, удерживаемое только передней пограничной мембраной, прижимается и слегка проминирует в область зрачка. Такое состояние называют грыжей стекловидного тела. При разрыве мембраны в переднюю камеру выходят волокна стекловидного тела. Это – осложненная грыжа.
Коррекция афакии. После удаления хрусталика резко изменяется рефракция глаза. Возникает гиперметропия высокой степени.
Преломляющая сила утраченного хрусталика должна быть компенсирована оптическими средствами – очками, контактной линзой или искусственным хрусталиком.
Очковую и контактную коррекцию афакии в настоящее время используют редко. Для коррекции афакии эмметропичного глаза потребуется очковое стекло силой +10,0 дптр, что существенно меньше, чем сила преломления удаленного хрусталика, которая в среднем равна 19,0 дптр. Такая разница объясняется прежде всего тем, что очковая линза занимает другое место в сложной оптической системе глаза. Кроме того, стеклянная линза окружена воздухом, в то время как хрусталик – жидкостью, с которой имеет почти одинаковый коэффициент преломления света. Для гиперметропа силу стекла нужно увеличить на необходимое количество диоптрий, у миопа, наоборот, оно будет тоньше, меньшей оптической силы. Если до операции миопия была близка к 19,0 дптр, то после операции слишком сильная оптика близоруких глаз нейтрализуется удалением хрусталика и пациент будет обходиться без очков для дали.
Афакичный глаз не способен к аккомодации, поэтому для работы на близком расстоянии назначают очки на 3,0 дптр сильнее, чем для дали. Очковую коррекцию нельзя использовать при монокулярной афакии. Линза +10,0 дптр является сильным увеличительным стеклом. Если она поставлена перед одним глазом, то в этом случае изображения в двух глазах будут слишком разные по величине, они не сольются в единый образ. При монокулярной афакии возможна контактная (см. раздел "Рефракция глаза") или интраокулярная коррекция.
Интраокулярная коррекция афакии – это хирургическая операция, суть которой состоит в том, что помутневший или вывихнувшийся естественный хрусталик заменяют искусственной линзой соответствующей силы. Расчет диоптрийной силы новой оптики глаза выполняет врач, используя специальные таблицы, номограммы или компьютерную программу. Для рассчета требуются следующие параметры: сила преломления роговицы, глубина передней камеры глаза, толщина хрусталика и длина глазного яблока. Общую рефракцию глаза планируют с учетом пожелания пациентов. Для тех из них, кто водит машину и ведет активную жизнь, чаще всего задают эмметропию. Можно запланировать миопическую рефракцию низкой степени, если второй глаз близорукий, а также для тех пациентов, которые большую часть рабочего дня проводят за письменным столом, хотят писать и читать или выполнять другую точную работу без очков.
Наличие искусственного хрусталика в глазу обозначают термином "артифакия". Глаз с искусственным хрусталиком называют артифакичным.
Интраокулярная коррекция афакии имеет ряд преимуществ перед очковой. Она более физиологична, устраняет зависимость пациентов от очков, не дает сужения поля зрения, периферических скотом, искажения предметов. На сетчатке формируется изображение нормальной величины.
 Рис. 12.10. Конструкции различных моделей интраокулярных линз и способы их фиксации в глазу.
Рис. 12.10. Конструкции различных моделей интраокулярных линз и способы их фиксации в глазу.
В настоящее время существует множество конструкций ИОЛ (рис. 12.10). По принципу крепления в глазу выделяют три основных типа искусственных хрусталиков: ■ переднекамерные линзы помещаются в передней камере глаза и находят опору в углу передней камеры. Они контактируют с очень чувствительными тканями глаза – радужкой и роговицей. Эти линзы провоцируют образование синехий в углу передней камеры глаза, чем и объясняется их редкое использование в настоящее время ■ зрачковые линзы (пупиллярные) называют также ирис–клипс–линзами (ИКЛ). Их вставляют в зрачок по принципу клипсы, удерживаются эти линзы передними и задними опорными (гаптическими) элементами. Первый хрусталик такого типа – линза Федорова–Захарова – имеет 3 задние дужки и 3 передние антеннки. В 60–70–е годы XX в., когда применяли в основном интракапсулярную экстракцию катаракты, линзу Федорова–Захарова широко использовали во всем мире. Главным ее недостатком является возможность вывиха опорных элементов или всей линзы ■ заднекамерные линзы (3KJ1) размещают в сумке хрусталика после удаления ядра и кортикальных масс при экстракапсулярной экстракции катаракты. Они занимают место естественной линзы в общей сложной оптической системе глаза, поэтому обеспечивают наиболее высокое качество зрения. 3KЛ лучше других укрепляют разделительный барьер между передним и задним отделами глаза, предупреждают развитие многих тяжелых послеоперационных осложнений, таких как вторичная глаукома, отслойка сетчатки и др. Они контактируют только с капсулой хрусталика, не имеющей нервов и сосудов, не способной к воспалительной реакции. Этот тип линз в настоящее время является предпочтительным. Среди 3KJ1 можно выделить заднекапсулярные, которые крепят непосредственно на капсулу. Их используют в тех случаях, когда после ранее перенесенной травмы не сохранилась прозрачная сумка хрусталика, а осталась лишь уплотненная мутная задняя капсула, сросшаяся с остатками передней.
ИОЛ изготавливают из жесткого (полиметилметакрилат, лейкосапфир и др.) и мягкого (силикон, гидрогель, полиуретанметакрилат, сополимер коллагена и др.) материала. Они могут быть мультифокальными или выполненными в виде призмы.
В один глаз можно ввести сразу два искусственных хрусталика. Если по каким–либо причинам оптика артифакичного глаза оказалась несовместимой с оптикой другого глаза, то ее дополняют еще одним искусственным хрусталиком необходимой диоптрийности.
Технология изготовления ИОЛ постоянно совершенствуется, изменяются конструкции линз, как того требует современная хирургия катаракты.
Коррекция афакии может быть выполнена и другими хирургическими способами, основанными на усилении преломляющей способности роговицы (см. главу 5).
Вторичная, пленчатая катаракта и фиброз задней капсулы хрусталика
Вторичная катаракта возникает в афакичном глазу после экстракапсулярной экстракции катаракты. Это разрастание субкапсулярного эпителия хрусталика, оставшегося в экваториальной зоне хрусталиковой сумки.При отсутствии ядра хрусталика клетки не стеснены, поэтому растут свободно, не вытягиваются. Они раздуваются в виде мелких прозрачных шариков разной величины и выстилают заднюю капсулу. При биомикроскопии эти клетки похожи на мыльные пузырьки или зерна икры (рис. I2.ll, а). Их называют шарами Адамюка–Эльшнига по именам ученых, впервые описавших вторичную катаракту. В начальной стадии развития вторичной катаракты субъективные симптомы отсутствуют. Острота зрения снижается, когда эпителиальные разрастания достигают центральной зоны.
Вторичная катаракта подлежит хирургическому лечению: производят дисцизию (рассечение) задней капсулы хрусталика, на которой размешаются шары Адамюка–Эльшнига. Дисцизию выполняют линейным разрезом в пределах зрачковой зоны.
Операция может быть осуществлена и с помощью луча лазера. В этом случае вторичная катаракта разрушается также в пределах зрачка. Формируется круглое отверстие диаметром 2–2,5 мм. Если этого окажется недостаточно для обеспечения высокой остроты зрения, то отверстие может быть увеличено (рис. 12.11, б). В артифакичных глазах вторичная катаракта развивается реже, чем в афакичных.
Пленчатая катаракта формируется в результате самопроизвольного рассасывания хрусталика после травмы, остаются только сросшиеся передняя и задняя капсулы хрусталика в виде толстой мутной пленки (рис. 12.12).
Пленчатые катаракты рассекают в центральной зоне лучом лазера или специальным ножом. В образовавшемся отверстии при наличии показаний может быть укреплен искусственный хрусталик специальной конструкции.
Фиброзом задней капсулы хрусталика принято обозначать уплотнение и помутнение задней капсулы после экстракапсулярной экстракции катаракты.
В редких случаях помутнение задней капсулы может быть обнаружено на операционном столе после удаления ядра хрусталика. Чаще всего помутнение развивается спустя 1–2 мес после операции из–за того, что задняя капсула была недостаточно очищена и остались невидимые тончайшие участки прозрачных масс хрусталика, которые впоследствии мутнеют. Такой фиброз задней капсулы считают осложнением экстракции катаракты. После операции всегда происходит сокращение и уплотнение задней капсулы как проявление физиологического фиброза, но при этом она остается прозрачной.
Рассечение помутневшей капсулы производят в тех случаях, когда резко снижена острота зрения. Иногда сохраняется достаточно высокое зрение даже при наличии значительных помутнений на задней капсуле хрусталика. Все зависит от локализации этих помутнений. Если в самом центре остался хотя бы небольшой просвет, этого может быть достаточно для прохождения световых лучей. В связи с этим вопрос о рассечении капсулы хирург решает только после оценки функции глаза.
Глава 13. Стекловидное тело
Глаз называют окном души.Леонардо да Вити
Строение и функции стекловидного тела
Стекловидным телом называют прозрачное, бесцветное, гелеобразное вещество, заполняющее полость глазного яблока. Спереди стекловидное тело ограничено хрусталиком, зонулярной связкой и цилиарными отростками, а сзади и по периферии – сетчаткой.Стекловидное тело – самое объемное образование глаза, составляющее 55% его внутреннего содержимого. У взрослого человека масса стекловидного тела 4 г, объем 3,5–4 мл.
Стекловидное тело имеет шарообразную форму, несколько сплющенную в сагиттальном направлении. Его задняя поверхность прилежит к сетчатке, к которой оно фиксировано лишь у диска зрительного нерва и в области зубчатой линии у плоской части цилиарного тела. Этот участок в форме пояса шириной 2–2,5 мм называют основанием стекловидного тела.
В стекловидном теле различают собственно стекловидное тело, пограничную мембрану и стекловидный (клокетов) канал, представляющий собой трубку диаметром 1–2 мм, идущую от диска зрительного нерва к задней поверхности хрусталика, не достигая его задней коры. В эмбриональном периоде жизни человека через этот канал проходит артерия стекловидного тела, исчезающая ко времени рождения (см. рис. 3.3).
Благодаря применению современных прижизненных методов исследования стекловидного тела удалось установить, что оно имеет фибриллярную структуру и что межфибриллярные промежутки заполнены жидким, вязким, аморфным содержимым. Тот факт, что обнаженное стекловидное тело не растекается и сохраняет свою форму даже при наложении на него груза, свидетельствует о наличии у него собственной наружной оболочки, или мембраны. Ряд авторов считают ее тончайшей, прозрачной самостоятельной оболочкой. Однако более популярна точка зрения, согласно которой это более плотный слой стекловидного тела, образовавшийся в результате сгущения его наружных слоев и конденсации фибрилл.
По химической природе стекловидное тело представляет собой гидрофильный гель органического происхождения, 98,8% которого составляет вода и 1,12% – сухой остаток, содержащий белки, аминокислоты, мочевину, креатинин, сахар, калий, магний, натрий, фосфаты, хлориды, сульфаты, холестерин и др. При этом белки, составляющие 3,6% сухого остатка, представлены витрохином и муцином, обеспечивающими вязкость стекловидного тела, в десятки раз превышающую вязкость воды.
В норме стекловидное тело не обладает фибринолитической активностью. Однако экспериментально установлено, что в случаях возникновения интравитреального кровоизлияния значительно возрастает тромбопластическая активность стекловидного тела, направленная на остановку кровотечения. В связи с наличием у стекловидного тела антифибринолитических свойств фибрин длительное время не рассасывается, что способствует клеточной пролиферации и формированию соединительнотканных помутнений.
Стекловидное тело обладает свойствами коллоидных растворов, и его рассматривают как структурную, но малодифференцированную соединительную ткань. Сосудов и нервов в стекловидном веществе нет. Жизнедеятельность и постоянство его среды обеспечиваются осмосом и диффузией питательных веществ из внутриглазной жидкости через стекловидную мембрану, обладающую направленной проницаемостью.
Биомикроскопически структура стекловидного тела представлена в виде нежно–серых лент различной формы и размеров с вкраплением точечных и булавовидных беловатых образований. При движении глаза эти структуры "колышутся". Между лентами располагаются бесцветные, прозрачные участки. С возрастом в стекловидном теле появляются плавающие помутнения и вакуоли. Стекловидное тело не регенерирует и при частичной потере замещается внутриглазной жидкостью.
Наличие в стекловидном теле постоянного тока жидкости подтверждено результатами радиографических исследований: установлено передвижение индифферентных красок или радионуклидных изотопов, введенных экстраокулярно, в витреальных массах. Продуцируемая цилиарным телом жидкость поступает в основание стекловидного тела, откуда движется по путям оттока кпереди – в переднюю камеру и кзади – в периваскулярные пространства зрительного нерва. В первом случае жидкость смешивается с камерной влагой и отводится вместе с нею, во втором из заднего отдела стекловидного тела, граничащего с оптической частью сетчатки, жидкость оттекает по пери васкулярным пространствам сосудов сетчатки. Знание особенностей циркуляции внутриглазной жидкости позволяет представить характер распределения лекарственных всшсств в полости глаза.
Стекловидное тело обладает низкой бактерицидной активностью. Лейкоциты и антитела обнаруживаются в нем спустя некоторое время после инфицирования. По мнению ряда авторов, антигенные свойства стекловидного тела не отличаются от таковых белков крови.
Основными функциями стекловидного тела являются поддержание формы и тонуса глазного яблока; проведение света; участие во внутриглазном обмене веществ; обеспечение контакта сетчатки с сосудистой оболочкой.
Патологические процессы в стекловидном теле
Они проявляются в нарушении его прозрачности, которое приводит к снижению зрения различной степени, вплоть до его потери.Помутнения стекловидного тела могут возникать вследствие нарушения обменных процессов при сахарном диабете, гипертонической болезни, атеросклерозе, а также при воспалительных заболеваниях сосудистого тракта и травмах. Интенсивность помутнений варьирует от незначительных, типа "летающих мушек”, до грубых, плотных помутнений, иногда фиксированных к сетчатке.
"Летающие мушки” – это нежные помутнения в стекловидном теле (его измененные и склеенные волокна), которые при ярком освещении отбрасывают тень на сетчатку и воспринимаются глазом как плавающие перед ним темные образования различной величины и формы (волнистые линии, пятнышки). Они наиболее четко видны при взгляде на равномерно освещенную белую поверхность (снег, светлое небо, белая стена и т. д.) и перемещаются при движении глазного яблока. Феномен "летающих мушек", как правило, обусловлен начальными деструктивными процессами в стекловидном геле и нередко возникает при близорукости и в пожилом возрасте. При объективных исследованиях (биомикроскопия, офтальмоскопия) помутнения обычно не обнаруживают. Местного лечения не требуется, проводят лечение основного заболевания.
При нарастающей деструкции стекловидного тела, т. е. его разжижении (переходе из состояния геля в золь), в нем выявляют помутнения в виде хлопьев, полос, лент, полупрозрачных пленок и т. д., смещающихся при движении глазного яблока. Они характерны для нитчатой деструкции стекловидного тела, часто наблюдаемой при высокой близорукости, тяжелом течении гипертонической болезни, выраженном атеросклерозе в пожилом возрасте. Зернистая деструкция стекловидного тела, проявляющаяся в образовании взвеси серовато–коричневатых мельчайших зерен (скопление пигментных клеток и лимфоцитов, мигрирующих из окружающих тканей), наблюдается при отслойке сетчатки, воспалительных процессах в сосудистом тракте, внутриглазных опухолях, травмах. Процесс прогрессирования нитчатой и зернистой деструкции стекловидного тела может приостановиться в случае успешного лечения основного заболевания.
В пожилом возрасте и при сахарном диабете часто отмечается деструкция стекловидного тела с включениями кристаллов холестерина, тирозина и др., плавающих при движении глазного яблока в виде "серебряного" или "золотого дождя". Глубокие деструктивные процессы обычно развиваются при близорукости высокой степени, общих нарушениях обменных процессов, а также в результате травмы.
Отслойка стекловидного тела возникает при наличии дистрофических изменений. Различают переднюю и заднюю отслойку стекловидного тела.
Передняя отслойка часто наблюдается в пожилом возрасте, реже – при травмах и воспалительных процессах в сосудистом тракте. Ее можно обнаружить при биомикроскопии. В этом случае пространство между хрусталиком и стекловидным телом кажется оптически пустым.
Задняя отслойка стекловидного тела часто возникает при близорукости и нередко предшествует отслойке сетчатки. Задняя отслойка может иметь разные высоту, форму и протяженность, быть полной или частичной. Наиболее частым вариантом является полная задняя отслойка стекловидного тела, выявляемая на всем протяжении заднего полюса глаза с более или менее выраженным смещением к центру. В этих случаях стекловидное тело отрывается от диска зрительного нерва и при биомикроскопии и офтальмоскопии впереди диска зрительного нерва выявляется серое овальное кольцо, при этом субвитреальное пространство заполнено жидкостью. Частичная отслойка встречается реже и либо бывает временной, либо постепенно увеличивается и переходит в полную.
Наиболее тяжелым проявлением дистрофического процесса в стекловидном теле считается его сморщивание (уменьшение в объеме), нередко выявляемое при хронических воспалительных процессах в сетчатке и сосудистой оболочке, после проникающих ранений глаза, а также травматичных внутриглазных операций, сопровождающихся выпадением стекловидного тела.
При воспалительных процессах в сосудистом тракте и сетчатке (иридоциклит, хориоретинит) в стекловидном теле появляются помутнения, состоящие из клеточных и фиброзных элементов – экссудаты. Механизм их образования состоит в следующем: клеточные включения (лейкоциты, лимфоциты, гшазмоциты) откладываются на задней поверхности хрусталика и в ретролентальном пространстве, где в свете щелевой лампы они имеют вид блестящих мелких точек. Затем эти включения в большом количестве появляются в переднем и заднем отделах стекловидного тела. Позднее, когда в нем образуются пустоты, клетки скапливаются в них, откладываясь на стенках наподобие преципитатов. В этих случаях глазное дно видно как в тумане из–за большого количества серозного экссудата.
Исход экссудативного процесса различен. В одних случаях экссудаты полностью или частично рассасываются, в других клеточные элементы и белковый экссудат распространяются по всему стекловидному телу. Прибиомикроскопии и офтальмоскопии они имеют вид хлопьевидных плавающих помутнений различных формы и величины.
Наиболее тяжелым и прогностически неблагоприятным патологическим состоянием стекловидного тела является эндофтальмит, характеризующийся значительной выраженностью воспалительных изменений в нем и возможностью распространения их на окружающие структуры глаза. В этих случаях из–за диффузного помутнения стекловидного тела световой рефлекс от глазного дна отсутствует, зрачок становится серым или желтым.
Интравитреальные кровоизлияния возникают обычно при изменениях в стенках сосудов сетчатки и сосудистого тракта. Они разрываются при травмах и во время внутриглазных операций, а также в результате воспалительных или дегенеративных процессов (гипертоническая болезнь, атеросклероз, сахарный диабет). Среди причин возникновения кровоизлияний в стекловидное тело лидирующую позицию занимают травматические повреждения органа зрения, сопровождающиеся кровоизлияниями более чем в 75% случаев.
Первыми признаками интравитреального кровоизлияния являются ослабление или отсутствие рефлекса с глазного дна, снижение зрения различной степени, вплоть до его полной потери. В этих случаях стекловидное тело кажется красноватым, а за хрусталиком нередко видна кровь.
Разлитые и массивные кровоизлияния в стекловидном теле обозначаются термином "гемофтальм". Для установления степени заполнения полости глаза кровью проводят диасклеральное просвечивание с помощью диафаноскопа. Свечение склеры свидетельствует о локальных кровоизлияниях в стекловидном теле. Отсутствие свечения при максимальной интенсивности светового пучка указывает на массивное кровоизлияние, или гемофтальм.
Исход кровоизлияний, а также формирование витреальных помутнений того или иного типа зависят от характера и тяжести травмы, объема излившейся крови, ее локализации, реактивности организма, длительности течения патологического процесса и фибринолитической активности стекловидного тела. Однако независимо от факторов, влияющих на исход гемофтальма, данное патологическое состояние характеризуется взаимосвязанными процессами, основными из которых являются гемолиз, диффузия крови, фибробластная пролиферация и фагоцитоз.
Гемолиз и диффузия крови по срокам соответствуют середине 1–й – окончанию 2–й недели после кровоизлияния. Кровь располагается в виде тяжей и лент по ходу волокнистых структур стекловидного тела. В ходе гемолиза целых эритроцитов становится меньше, определяются лишь их "тени” и фибрин. К 7–14–му дню в травмированном глазу формируются бесклеточные пленчатые образования, состоящие из фибрина и лизированных эритроцитов, ориентированных по ходу волокнистых структур стекловидного тела. Особенностью этой стадии течения гемофтальма является акустическая неинформативность, так как длина акустической волны соразмерна величине лизированных элементов крови, поэтому стекловидное тело на сонограммах выглядит акустически однородным. Позднее в течение 2–3 нед формируются более грубые помутнения вследствие фибробластной пролиферации.
Лечение. Консервативное лечение, которое, как правило, проводят в ранние сроки, должно быть направлено на рассасывание кровоизлияния и предупреждение его рецидивов. С этой целью целесообразно использовать ангиопротекторы и викасол.
Через 1–2 сут после кровоизлияния показано комплексное лечение, основным компонентом которого является рассасывающая терапия. В этих случаях применяют гепарин (0,1–0,2 мл – до 750 ЕД) в сочетании с дексазоном (0,3 мл) в виде подконъюнктивальных инъекций.
Основным патогенетически ориентированным методом лечения в ранние сроки является терапия фибринолитическими средствами для повышения фибринолитической активности стекловидного тела и рассасывания кровоизлияния. С этой целью используют стрептодеказу (иммобилизованную стрептокиназу), которая переводит неактивный плазминоген в активный фермент, способный расщеплять фибрин. Препарат обладает пролонгированным действием, его вводят ретробульбарно или субконъюнктивально в дозе 0,1–0,3 мл (15.000–45.000 ФЕ), как правило, 1 раз в сутки в течение 2–5 дней. С учетом того, что стрептодеказа является антигенным препаратом, до ее назначения под конъюнктиву вводят 0,3 мл 0,1% раствора дексазона. Подконъюнктивальное введение фибринолитических средств рекомендуется при наличии гифемы и кровоизлияний в передней трети стекловидного тела.
При локализации витреальных кровоизлияний в средней и/или задней трети стекловидного тела целесообразно введение стрептодеказы ретробульбарно.
При гемофтальме значительно активизируются процессы перекисного окисления липидов, в результате чего накапливаются гидроперекиси и гидроперекисные радикалы, которые оказывают повреждающее действие на липидный слой клеточных и мембранных образований. Для снижения активности процессов перекислого окисления рекомендуется использовать антиоксиданты (эмоксипин и тауфон).
Кровоизлияния в стекловидное тело могут сопровождаться повышением внутриглазного давления до 35–40 мм рт.ст. в результате временной блокады путей оттока продуктами распада крови. Повышение внутриглазного давления купируют с помощью гипотензивной терапии.
Хирургическое лечение травматического гемофтальма. Результаты многочисленных исследований свидетельствуют о том, что в основе патологических изменений стекловидного тела при травматических гемофтальмах лежат глубокие нарушения цикла обменных процессов в стекловидном теле и окружающих его тканях, которые сопровождаются нарушением кислотно–основного состояния, накоплением промежуточных продуктов обмена веществ, что в свою очередь оказывает неблагоприятное влияние на дальнейшее течение обменных реакций. Образуется так называемый порочный круг, в связи с чем удаление стекловидного тела – витрэктомия – приобретает патогенетическую направленность. В ходе витрэктомии стекловидное тело рассекают на мелкие части, удаляют, из полости глазного яблока и одновременно замешают сбалансированным солевым раствором.
Витрэктомия может быть выполнена со вскрытием глазного яблока (открытая витрэктомия) и с помошью специальных инструментов (волоконные осветители, наконечники ирригационно–аспирационных и режущих систем), которые вводят в глаз через один–два прокола (закрытая витрэктомия).
Процесс витрэктомии состоит в захвате с помощью вакуума (подсасывание) небольшой порции стекловидного тела аспирационной иглой витреотома с последующим отсечением этой порции. Затем всасывают и отсекают следующую порцию и таким образом поэтапно удаляют ("отщипывают") ткань патологически измененного стекловидного тела. Скорость его иссечения и аспирации зависит от силы вакуума, частоты движений ножа витреотома и состояния стекловидного тела.
После удаления передней части стекловидного тела витреотом направляют к заднему полюсу глаза. По мере удаления мутного стекловидного тела все ярче проявляется розовый рефлекс с глазного дна. После того как закончено удаление стекловидного тела в оптической зоне и становится видимым задний полюс глаза, приступают к удалению его периферической части. В случае необходимости удаляют почти все стекловидное тело. Труднее всего удалить основание из–за его прочной фиксации в зоне зубчатой линии и плоской части ресничного тела. В этих случаях имеется реальная угроза повреждения хрусталика. Наличие остатков помутнений по периферии обычно не вызывает нарушения зрительных функций после операци.
Из осложнений, которые могут возникнуть во время операции, следует отметить интравитреальные кровотечения, которые останавливают путем искусственного повышения внутриглазного давления при усиленной подаче замещающей жидкости.
С целью профилактики рецидива кровоизлияния в полость стекловидного тела больным в предоперационном периоде назначают антигеморрагические препараты (продектин, дицинон, аскорутин, хлористый кальций и т. д.).
Многочисленные клинические наблюдения и анализ функциональных результатов показывают, что при использовании современных витреотомов и методик проведения витрэктомии она практически безопасна, а риск развития осложнений гораздо ниже, чем при длительном нахождении большого количества крови в стекловидном теле. Кроме того, раннее восстановление прозрачности стекловидного тела позволяет уже на начальных этапах поражения выявить изменения сетчатки, в случае необходимости провести коагуляцию этих патологических очагов с помощью энергии лазерного излучения и предотвратить тем самым появление новых порций крови.
Глава 14. Сосудистая оболочка глаза
Космос отражается в зрачке каждого глаза.Н. К. Рерих
Существует глаз невидимый – ум, и глаз видимый – зрачок.Сосудистая оболочка глаза (tunica vasculosa bulbi) располагается между наружной капсулой глаза и сетчаткой, поэтому ее называют средней оболочкой, сосудистым или увеальным трактом глаза. Она состоит из трех частей: радужки, ресничного тела и собственно сосудистой оболочки (хориоидея).В. Гюго
Все сложные функции глаза осущестачяются с участием сосудистого тракта. Вместе с тем сосудистый тракт глаза выполняет роль посредника между обменными процессами, происходящими во всем организме и в глазу. Разветаченная сеть широких тонкостенных сосудов с богатой иннервацией осуществляет передачу общих нейро1уморальных воздействий. Передний и задний отделы сосудистого тракта имеют разные источники кровоснабжения. Этим объясняется возможность их раздельного вовлечения в патологический процесс.
Передний отдел сосудистой оболочки глаза – радужка и ресничное тело
Строение и функции радужки
Радужка (iris) – передняя часть сосудистого тракта. Она определяет цвет глаза, является световой и разделительной диафрагмой (рис. 14.1).В отличие от других частей сосудистого тракта радужка не соприкасается с наружной оболочкой глаза. Радужка отходит от склеры чуть позади лимба и располагается свободно во фронтальной плоскости в переднем отрезке глаза. Пространство между роговицей и радужкой называется передней камерой глаза. Глубина ее в центре 3–3,5 мм.
Кзади от радужки, между нею и хрусталиком, располагается задняя камера глаза в виде узкой щели. Обе камеры заполнены внутриглазной жидкостью и сообщаются через зрачок.
Радужка видна через роговицу. Диаметр радужки около 12 мм, ее вертикальный и горизонтальный размеры могут различаться на 0,5–0,7 мм. Периферическую часть радужки, называемую корнем, можно увидеть только с помощью специального метода – гониоскопии. В центре радужка имеет круглое отверстие – зрачок (pupilla).
Радужка состоит из двух листков. Передний листок радужки имеет мезодермальное происхождение. Его наружный пограничный слой покрыт эпителием, являющимся продолжением заднего эпителия роговицы. Основу этого листка составляет строма радужки, представленная кровеносными сосудами. При биомикроскопии на поверхности радужки можно видеть кружевной рисунок переплетения сосудов, образующих своеобразный рельеф, индивидуальный для каждого человека (рис. 14.2). Все сосуды имеют соединительнотканный покров. Возвышающиеся детали кружевного рисунка радужки называют трабекулами, а углубления между ними – лакунами (или криптами). Цвет радужки также индивидуален: от голубого, серого, желтовато–зеленого у блондинов до темно–коричневого и почти черного у брюнетов. Различия в цвете объясняются разным количеством многоотростчатых пигментных клеток меланобластов в строме радужки. У темнокожих людей количество этих клеток столь велико, что поверхность радужки похожа не на кружево, а на густотканый ковер. Такая радужка свойственна обитателям южных и крайних северных широт как фактор защиты от слепящего светового потока.
 Рис. 14–1. Строение радужки и цилиарного тела.
Рис. 14–1. Строение радужки и цилиарного тела.
 Рис. 14.2. Варианты строения переднего поверхностного листка радужки.
Рис. 14.2. Варианты строения переднего поверхностного листка радужки.
Концентрично зрачку на поверхности радужки проходит зубчатая линия, образованная переплетением сосудов. Она делит радужку на зрачковый и цилиарный (ресничный) края. В цилиарном поясе выделяются возвышения в виде неровных круговых контракционных борозд, по которым складывается радужка при расширении зрачка. Радужка наиболее тонкая на крайней периферии у начала корня, поэтому именно здесь возможен отрыв радужки при контузионной травме (рис. 14.3).
Задний листок радужки имеет эктодермальное происхождение, это пигментно–мышечное образование. Эмбриологически он является продолжением недифференцированной части сетчатки. Плотный пигментный слой защищает глаз от избыточного светового потока. У края зрачка пигментный листок выворачивается кпереди и образует пигментную кайму. Две мышцы разнонаправленного действия осуществляют сужение и расширение зрачка, обеспечивая дозированное поступление света в полость глаза. Сфинктер, сужйвающий зрачок, располагается по кругу у самого края зрачка. Дилататор находится между сфинктером и корнем радужки. Гладкомышечные клетки дилататора располагаются радиально в один слой.
Богатая иннервация радужки осуществляется вегетативной нервной системой. Дилататор иннервируется симпатическим нервом, а сфинктер – за счет парасимпатических волокон ресничного узла – глазодвигательным нервом. Тройничный нерв обеспечивает чувствительную иннервацию радужки.
Кровоснабжение радужки осуществляется из передних и двух задних Длинных цилиарных артерий, которые на периферии образуют большой артериальный круг. Артериальные ветви направляются в сторону зрачка, образуя дугообразные а настомозы. Так формируется извитая сеть сосудов цилиарного пояса радужки. От нее отходят радиальные веточки, образующие капиллярную сеть по зрачковому краю. Вены радужки собирают кровь из капиллярного русла и направляются от центра к корню радужки. Строение кровеносной сети таково, что даже при максимальном расширении зрачка сосуды не перегибаются под острым углом и не происходит нарушения кровообращения.
Исследования показали, что радужка может быть источником информации о состоянии внутренних органов, каждый из которых имеет свою зону представительства в радужке. По состоянию этих зон проводят скрининговую иридодиагностику патологии внутренних органов. Световая стимуляция этих зон лежит в основе иридотерагши.
Функции радужки: ■ экранирование глаза от избыточного потока света ■ рефлекторное дозирование количества света в зависимости от степени освещенности сетчатки (световая диафрагма) ■ разделительная диафрагма: радужка вместе с хрусталиком выполняют функцию иридохрусталиковой диафрагмы, разделяющей передний и задний отделы глаза, удерживающей стекловидное тело от смещения вперед ■ сократительная функция радужки играет положительную роль в механизме оттока внутриглазной жидкости и аккомодации ■ трофическая и терморегуляторная.
Зрачок. Норма и патология зрачковых реакций
У детей первого года жизни зрачок узкий (2 мм), слабо реагирует на свет, плохо расширяется. В зрячем глазу величина зрачка постоянно меняется от 2 до 8 мм под влиянием изменений освещенности. В комнатных условиях при умеренном освещении диаметр зрачка около 3 мм, причем у молодых людей зрачки шире, а с возрастом становятся уже.Под влиянием тонуса двух мышц радужки изменяется величина зрачка: сфинктер осуществляет сокращение зрачка (миоз), а дилататор обеспечивает его расширение (мидриаз). Постоянные движения зрачка – экскурсии – дозируют поступление света в глаз.
Изменение диаметра зрачкового отверстия происходит рефлекторно: ■ в ответ на раздражение сетчатки светом ■ при установке на ясное видение предмета на разном расстоянии (аккомодация) ■ при схождении (конвергенции) и расхождении (дивергенции) зрительных осей ■ как реакция на другие раздражения.
Рефлекторное расширение зрачка может произойти в ответ на резкий звуковой сигнал, раздражение вестибулярного аппарата во время вращения, при неприятных ощущениях в носоглотке. Описаны наблюдения, подтверждающие расширение зрачка при большом физическом напряжении, даже при сильном рукопожатии, при надавливании на отдельные участки в области шеи, а также в ответ на болевой раздражитель в любой части тела. Максимальный мидриаз (до 7–9 мм) может наблюдаться при болевом шоке, а также при психическом перенапряжении (испуг, гнев, оргазм). Реакцию расширения или сужения зрачка можно выработать в качестве условного рефлекса на слова темно или светло.
Рефлексом от тройничного нерва (тригеминопупиллярный рефлекс) объясняется быстро сменяющееся расширение и сужение зрачка при дотрагивании до конъюнктивы, роговицы, кожи век и периорбитальной области.
Рефлекторная дуга зрачковой реакции на яркий свет представлена четырьмя звеньями. Она начинается от фоторецепторов сетчатки (I), получивших световое раздражение.. Сигнал передается по зрительному нерву и зрительному тракту в переднее двухолмие мозга (II). Здесь заканчивается эфферентная часть дуги зрачкового рефлекса. Отсюда импульс на сужение зрачка пойдет через ресничный узел (III), расположенный в цилиарном теле глаза, к нервным окончаниям сфинктера зрачка (IV). Через 0,7–0,8 с произойдет сокращение зрачка. Весь рефлекторный путь занимает около 1 с. Импульс на расширение зрачка идет от спинального центра через верхний шейный симпатический ганглий к дилататору зрачка (см. рис. 3.4).
Медикаментозное расширение зрачка происходит под воздействием препаратов, относящихся к группе мидриатиков (адреналин, фенилэфрин, атропин и др.). Наиболее стойко расширяет зрачок 1% раствор сульфата атропина. После однократного закапывания в здоровом глазу мидриаз может сохраняться до 1 нед. Мидриатики кратковременного действия (тропикамид, мидриацил) расширяют зрачок на 1–2 ч. Сужение зрачка происходит при закапывании миотиков (пилокарпин, карбахол, ацетилхолин и др.). У разных людей выраженность реакции на миотики и мидриатики неодинакова и зависит от соотношения тонуса симпатической и парасимпатической нервной системы, а также состояния мышечного аппарата радужки.
Изменение реакций зрачка и его формы может быть обусловлено заболеванием глаза (иридоциклит, травма, глаукома), а также возникает при различных поражениях периферических, промежуточных и центральных звеньев иннервации мышц радужки, при травмах, опухолях, сосудистых заболеваниях мозга, верхнего шейного узла, нервных стволов в глазнице, контролирующих зрачковые реакции.
После контузии глазного яблока может возникнуть посттравматический мидриаз как следствие паралича сфинктера или спазма дилататора. Патологический мидриаз развивается при различных заболеваниях органов грудной и брюшной полости (сердечно–легочная патология, холецистит, аппендицит и др.) в связи с раздражением периферического симпатического пугшлломоторного пути.
Параличи и парезы периферических звеньев симпатической нервной системы вызывают миоз в сочетании с сужением глазной щели и энофтальмом (триада Горнера).
При истерии, эпилепсии, тиреотоксикозе, а иногда и у здоровых людей отмечаются "прыгающие зрачки". Ширина зрачков изменяется независимо от влияния каких–либо видимых факторов через неопределенные промежутки времени и несогласованно в двух глазах. При этом другая глазная патология может отсутствовать.
Изменение зрачковых реакций является одним из симптомов многих общесоматических синдромов.
В том случае, если реакция зрачков на свет, аккомодацию и конвергенцию отсутствует, то это паралитическая неподвижность зрачка вследствие патологии парасимпатических нервов.
Методы исследования зрачковых реакций описаны в главе 6.
Строение и функции ресничного тела
Ресничное, или цилиарное, тело (corpus ciliare) – это средняя утолщенная часть сосудистого тракта глаза, осуществляющая продукцию внутриглазной жидкости. Ресничное тело дает опору хрусталику и обеспечивает механизм аккомодации, кроме того, это тепловой коллектор глаза. Рис. 14.4. Внутренняя поверхность цилиарного тела.
1 – ресничный венец; 2 – плоская часть; 3 – зубчатая линия.
Рис. 14.4. Внутренняя поверхность цилиарного тела.
1 – ресничный венец; 2 – плоская часть; 3 – зубчатая линия.
В обычных условиях ресничное тело, располагающееся под склерой посередине между радужкой и хориоидеей, не доступно осмотру: оно скрыто за радужкой (см. рис. 14.1). Область расположения цилиарного тела проецируется на склере в виде кольца шириной 6–7 мм вокруг роговицы. С наружной стороны это кольцо немного шире, чем с носовой.
Ресничное тело имеет достаточно сложное строение. Если разрезать глаз по экватору и посмотреть изнутри на передний отрезок, то будет хорошо видна внутренняя поверхность цилиарного тела в виде двух круглых поясков темного цвета (рис. 14.4). В центре, окружая хрусталик, возвышается складчатый ресничный венец шириной 2 мм (corona ciliaris). Вокруг него располагается цилиарное кольцо, или плоская часть цилиарного тела, шириной 4 мм. Оно уходит к экватору и заканчивается зубчатой линией. Проекция этой линии на склере находится в области прикрепления прямых мышц глаза.
Кольцо ресничной короны состоит из 70–80 крупных отростков, ориентированных радиально в сторону хрусталика. Макроскопически они похожи на реснички (cilia), отсюда и название этой части сосудистого тракта – "цилиарное, или ресничное, тело". Вершины отростков светлее общего фона, высота менее 1 мм. Между ними имеются бугорки мелких отростков. Пространство между экватором хрусталика и отростчатой частью ресничного тела составляет всего 0,5–0,8 мм. Оно занято связкой, поддерживающей хрусталик, которую называют ресничным пояском, или цинновой связкой. Она является опорой для хрусталика и состоит из тончайших нитей, идущих от передней и задней капсул хрусталика в области экватора и прикрепляющихся к отросткам ресничного тела. Однако главные ресничные отростки являются только частью зоны крепления ресничного пояска, в то время как основная сеть волокон проходит между отростками и фиксируется на всем протяжении цилиарного тела, включая его плоскую часть.
Тонкое строение ресничного тела обычно изучают на меридиональном срезе, на котором виден переход радужки в цилиарное тело, имеющее форму треугольника. Широкое основание этого треугольника располагается спереди и представляет собой отростчатую часть цилиарного тела, а узкая вершина является его плоской частью, которая переходит в задний отдел сосудистого тракта. Как и в радужке, в цилиарном теле выделяют наружный сосудисто–мышечный слой, имеющий мезодермалыюе происхождение, и внутренний ретинальный, или нейроэктодермальный, слой.
Наружный мезодермальный слой состоит из четырех частей: ■ супрахориоидеи. Это капиллярное пространство между склерой и хори оидеей. Оно может расширяться вследствие скопления крови или отечной жидкости при глазной патологии ■ аккомодационной, или цилиарной, мышцы. Она занимает значительный объем и придает цилиарному телу характерную треугольную форму ■ сосудистого слоя с цилиарными отростками ■ эластичной мембраны Бруха.
Внутренний ретинальный слой является продолжением оптически не деятельной сетчатки, редуцированной до двух слоев эпителия – наружного пигментного и внутреннего беспигментного, покрытого пограничной мембраной.
Для понимания функций цилиарного тела особое значение имеет строение мышечной и сосудистой частей наружного мезодермального слоя.
Аккомодационная мышца располагается в передненаружной части ресничного тела. Она включает три основные порции гладкомышечных волокон: меридиональные, радиальные и циркулярные. Меридиональные волокна (мышца Брюкке) примыкают к склере и прикрепляются к ней у внутреней части лимба. При сокращении мышцы происходит перемещение цилиарного тела вперед. Радиальные волокна (мышца Иванова) веером отходят от склеральной шпоры к цилиарным отросткам, доходя до плоской части цилиарного тела. Тонкие пучки циркулярных мышечных волокон (мышца Мюллера) расположены в верхней части мышечного треугольника, образуют замкнутое кольцо и при сокращении действуют как сфинктер.
Механизм сокращения и расслабления мышечного аппарата лежит в основе аккомодационной функции ресничного тела. При сокращении всех порций разнонаправленных мышц возникает эффект общего уменьшения длины аккомодационной мышцы по меридиану (подтягивается кпереди) и увеличения ее ширины в направлении к хрусталику. Ресничный поясок суживается вокруг хрусталика и приближается к нему. Циннова связка расслабляется. Хрусталик благодаря своей эластичности стремится изменить дисковидную форму на шаровидную, что приводит к увеличению его рефракции.
Сосудистая часть ресничного тела располагается кнутри от мышечного слоя и формируется из большого артериального круга радужки, находящегося у ее корня. Она представлена густым переплетением сосудов. Кровь несет не только питательные вещества, но и тепло. В открытом для внешнего охлаждения переднем отрезке глазного яблока ресничное тело и радужка являются тепловым коллектором.
Ресничные отростки заполнены сосудами. Это необычно широкие капилляры: если через капилляры сетчатки эритроциты проходят, только изменив свою форму, то в просвете капилляров ресничных отростков умещается до 4–5 эритроцитов. Сосуды располагаются непосредственно под эпителиальным слоем. Такое строение средней части сосудистого тракта глаза обеспечивает функцию секреции внутриглазной жидкости, представляющей собой ультрафильтрат плазмы крови. Внутриглазная жидкость создает необходимые условия для функционирования всех внутриглазных тканей, обеспечивает питанием бессосудистые образования (роговицу, хрусталик, стекловидное тело), сохраняет их тепловой режим, поддерживает тонус глаза. При значительном снижении секреторной функции ресничного тела уменьшается внутриглазное давление и наступает атрофия глазного яблока.
Описанная выше уникальная структура сосудистой сети ресничного тела таит в себе и негативные свойства. В широких извитых сосудах кровоток замедлен, в результате чего создаются условия для оседания возбудителей инфекции. Вследствие этого при любых инфекционных заболеваниях в организме возможно развитие воспаления в радужке и ресничном теле.
Ресничное тело иннервируется ветвями глазодвигательного нерва (парасимпатические нервные волокна), веточками тройничного нерва и симпатическими волокнами из сплетения внутренней сонной артерии. Воспалительные явления в цилиарном теле сопровождаются сильными болями вследствие богатой иннервации ветвями тройничного нерва. На наружной поверхности ресничного тела имеется сплетение нервных волокон – ресничный узел, от которого отходят ветви к радужке, роговице и цилиарной мышце. Анатомической особенностью иннервации цилиарной мышцы является индивидуальное снабжение каждой гладкомышечной клетки отдельным нервным окончанием. Этого нет ни в одной другой мышце человеческого организма. Целесообразность такой богатой иннервации объясняется главным образом необходимостью обеспечить выполнение сложных центрально регулируемых функций.
Функции ресничного тела: ■ опора для хрусталика ■ участие в акте аккомодации ■ продукция внутриглазной жидкости ■ тепловой коллектор переднего отрезка глаза.
Аномалии развития переднего отдела сосудистого тракта
На самых ранних стадиях развития органа зрения могут сформироваться пороки развития радужки, обусловленные незаращением переднего конца щели глазного бокала, что проявляется дефектом радужки – врожденной колобомой радужки. Этот дефект может сочетаться с колобомой цилиарного тела и собственно сосудистой оболочки глаза.Щель глазного бокала в большинстве случаев закрывается снизу, поэтому колобома радужки чаще образуется в нижних отделах. Функция сфинктера радужки остается сохранной. Колобома радужки может быть устранена хирургическим путем: на края дефекта накладывают два тонких узловых шва. Операция приводит к повышению остроты зрения и одновременно позволяет ликвидировать косметический дефект.
При врожденных колобомах радужки и ресничного тела может нарушаться фиксация хрусталика из–за отсутствия участка связочного аппарата. С годами возникает хрусталиковый астигматизм. Нарушается также акт аккомодации.
Поликория – наличие нескольких зрачков в радужке. Истинной поликорией называется такое состояние, когда в радужке имеется более одного зрачка с сохранной реакцией на свет. Ложная поликория – это зрачок в виде песочных часов вследствие того, что остатки эмбриональной зрачковой мембраны соединяют диаметрально расположенные края зрачка.
Врожденная аниридия – отсутствие радужки (рис. 14.5). При тщательном осмотре иногда обнаруживают небольшие фрагменты корня радужки. Данная патология может сочетаться с другими пороками развития – микрофтальмом, подвывихом хрусталика, нистагмом. Она сопровождается амблиопией, гиперметропией, иногда вторичной глаукомой. Аниридия может быть и приобретенной: в результате сильного удара радужка может полностью оторваться у корня (рис. 14.6).
Аниридия всегда сопровождается снижением остроты зрения. Больные вынуждены экранировать глаз от избыточного потока света веками. В последние годы этот дефект с успехом устраняют с помощью искусственной радужки, изготовленной из окрашенного гидрогеля, в центре которой имеется отверстие диаметром 3 мм, имитирующее зрачок. При односторонней аниридии цвет искусственной радужки подбирают по цвету здорового глаза.
Введение протеза радужки – это тяжелая полостная операция. Для подшивания протеза необходим транссклеральный хирургический подход в диаметрально расположенных участках лимба. Если аниридия сочетается с катарактой, то ее удаляют и вводят протез, замещающий одновременно радужку и хрусталик.
Заболевания радужки и ресничного тела
Воспалительные заболевания – иридоциклиты
Воспалительный процесс в переднем отделе сосудистого тракта может начаться с радужки (ирит) или с ресничного тела (циклит). В связи с общностью кровоснабжения и иннервации этих отделов заболевание переходит с радужки на ресничное тело и наоборот – развивается иридоциклит.Отмеченные выше особенности строения радужки и ресничного тела объясняют высокую частоту воспалительных заболеваний переднего отрезка глаза. Они могут быть разной природы: бактериальные, вирусные, грибковые, паразитарные.
Густая сеть широких сосудов увеального тракта с замедленным кровотоком является практически отстойником для микроорганизмов, токсинов и иммунных комплексов. Любая инфекция, развившаяся в организме может вызвать иридоциклит. Наиболее тяжелым течением отмечаются воспалительные процессы вирусной и грибковой природы. Часто причиной воспаления является фокальная инфекция в зубах, миндалинах, околоносовых пазухах, желчном пузыре и др.
Эндогенные иридоциклиты. По этиопатогенетическому признаку их разделяют на инфекционные, инфекционно–аллергические, аллергические неинфекционные, аутоиммунные и развивающиеся при других патологических состояниях организма, в том числе при нарушениях обмена.
Инфекционно–аллергические иридоциклиты возникают на фоне хронической сенсибилизации организма к внутренней бактериальной инфекции или бактериальным токсинам. Чаще инфекционно–аллергические иридоциклиты развиваются у больных с нарушениями обмена веществ при ожирении, диабете, почечной и печеночной недостаточности, вегетососудистой дистонии.
Аллергические неинфекционные иридоциклиты могут возникать при лекарственной и пищевой аллергии после гемотрансфузий, введения сывороток и вакцин.
Аутоиммунное воспаление развивается на фоне системных заболеваний организма: ревматизма, ревматоидного артрита, детского хронического полиартрита (болезнь Стилла) и др.
Иридоциклиты могут проявляться как симптомы сложной синдромной патологии: офтальмостоматогенитальной – болезни Бехчета, офтальмоуретросиновиальной – болезни Рейтера, нейродерматоувеита – болезни Фогта – Коянаги – Харады и др.
Экзогенные иридоциклиты. Из экзогенных воздействий причинами развития иридоциклитов могут послужить контузии, ожоги, травмы, которые нередко сопровождаются внедрением инфекции.
По клинической картине воспаления различают серозные, экссудативные, фибринозные, гнойные и геморрагические иридоциклиты, по характеру течения – острые и хронические, по морфологической картине – очаговые (гранулематозные) и диффузные (негранулематозные) формы воспаления. Очаговая картина воспаления характерна для гематогенного метастатического внедрения инфекции.
Морфологический субстракт основного очага воспаления при гранулематозном иридоциклите представлен большим количеством лейкоцитов, имеются также мононуклеарные фагоциты, эпителиоидные, гигантские клетки и зона некроза. Из такого очага можно выделить патогенную флору.
Инфекционно–аллергические и токсико–аллергические иридоциклиты протекают в форме диффузного воспаления. При этом первичное поражение глаза может находиться за пределами сосудистого тракта и располагаться в сетчатке или зрительном нерве, откуда процесс распространяется в передний отдел сосудистого тракта. В тех случаях, когда токсико–аллергическое поражение сосудистого тракта является первичным, оно никогда не имеет характера настоящей воспалительной гранулемы, а возникает внезапно, развивается быстро как гиперергическое воспаление.
Основные проявления – нарушение микроциркуляции с образованием фибриноидного набухания сосудистой стенки. В очаге гиперергической реакции отмечаются отек, фибринозная экссудация радужки и ресничного тела, плазматическая лимфоидная или полинуклеарная инфильтрация.
Острые иридоциклиты. Заболевание начинается внезапно. Первыми субъективными симптомами являются резкая боль в глазу, иррадиируюшая в соответствующую половину головы, и боль, возникающая при дотрагивании до глазного яблока в зоне проекции цилиарного тела. Мучительный болевой синдром обусловлен обильной чувствительной иннервацией. Ночью боли усиливаются вследствие застоя крови и сдавления нервных окончаний, кроме того, в ночное время увеличивается влияние парасимпатической нервной системы. Если заболевание начинается с ирита, то боль определяется только при дотрагивании до глазного яблока. После присоединения циклита боль значительно усиливается. Больной жалуется также на светобоязнь, слезотечение, затруднения при открывании глаз. Эта роговичная триада симптомов (светобоязнь, слезотечение, блефароспазм) появляется из–за того, что полнокровие сосудов в бассейне большого артериального круга радужки передается сосудам краевой петлистой сети вокруг роговицы, так как они имеют анастомозы.
При объективном осмотре обращают внимание на легкий отек век. Он увеличивается из–за светобоязни и блефароспазма. Одним из основных и очень характерных признаков воспаления радужки и цилиарного тела (а также роговицы) является перикорнеальная инъекция сосудов. Она видна уже при наружном осмотре в виде кольца розово–синюшного цвета вокруг лимба: через тонкий слой склеры просвечивают гиперемированные сосуды краевой петлистой сети роговицы. При затяжных воспалительных процессах этот венчик приобретает фиолетовый оттенок. Радужка отечна, утолщена, из–за увеличения кровенаполнения радиально идущих сосудов они становятся более прямыми и длинными, поэтому зрачок суживается, становится малоподвижным. При сравнении со здоровым глазом можно заметить изменение цвета полнокровной радужки. Воспаленные растянутые стенки сосудов пропускают форменные элементы крови, при разрушении которых радужка приобретает оттенки зеленого цвета.
В воспаленных отростках ресничного тела увеличивается порозность тонкостеных капилляров. Изменяется состав продуцируемой жидкости: в ней появляются белок, форменные элементы крови, слущенные эпителиальные клетки. При слабовыраженном нарушении проницаемости сосудов в экссудате преобладает альбумии, при зрачительных изменениях через стенки капилляров проходят крупные белковые молекулы – глобулин и фибрин. В световом срезе щелевой лампы влага передней камеры опалесцирует из–за отражения света взвесью плавающих белковых хлопьев. При серозном воспалении они очень мелкие, едва различимые, при экссудативном взвесь густая. Фибринозный процесс характеризуется менее острым течением и продукцией клейкого белкового вещества. Легко образуются сращения радужки с передней поверхностью хрусталика. Этому способствует ограниченная подвижность узкого зрачка и плотный контакт утолщенной радужки с хрусталиком. Может сформироваться полное сращение зрачка по кругу, а вслед за этим фибринозный экссудат закрывает и просвет зрачка. В этом случае внутриглазная жидкость, продуцируемая в задней камере глаза, не имеет выхода в переднюю камеру, в результате чего возникает бомбаж радужки – выбухание ее кпереди и резкое повышение внутриглазного давления (рис. 14.7). Спайки зрачкового края радужки с хрусталиком называют задними синехиями. Они образуются не только при фибринозно–пластическом иридоциклите, однако при других формах воспаления они редко бывают круговыми. Если образовалось локальное эпителиальное сращение, то оно отрывается при расширении зрачка. Застарелые, грубые стромальные синехии уже не отрываются и изменяют форму зрачка. Реакция зрачка на неизмененных участках может быть нормальной.
 Рис. 14.8. Преципитаты на задней поверхности роговицы.
Рис. 14.8. Преципитаты на задней поверхности роговицы.
При гнойном воспалении экссудат имеет желтовато–зеленый оттенок. Он может расслаиваться вследствие оседания лейкоцитов и белковых фракций, образуя на дне передней камеры осадок с горизонтальным уровнем – гипопион. Если во влагу передней камеры попадает кровь, то форменные элементы крови также оседают на дно передней камеры, образуя гифему.
При любой форме воспалительной реакции белковая взвесь из внутриглазной жидкости оседает на всех тканях глаза, oбoзнaчaя симптомы иридоциклита. Если клеточные элементы и мельчайшие крошки пигмента, склеенные фибрином, оседают на задней поверхности роговицы, то они называются преципитатами (рис. 14.8). Это один из характерных симптомов иридоциклита. Преципитаты могут быть бесцветными, но иногда они имеют желтоватый или серый оттенок. В начальной фазе болезни они имеют округлую форму и четкие границы, в период рассасывания – приобретают неровные, как бы обтаявшие края. Преципитаты обычно располагаются в нижней половине роговицы, причем более крупные оседают ниже, чем мелкие. Экссудативные наложения на поверхности радужки стушевывают ее рисунок, лакуны становятся менее глубокими. Белковая взвесь оседает и на поверхности хрусталика и на волокнах стекловидного тела, в результате чего может существенно снижаться острота зрения. Количество наложений зависит от этиологии и степени выраженности воспалительного процесса. Любая, даже мелкая, взвесь в стекловидном теле трудно рассасывается. При фибринозно–пластическом иридоциклите мелкие хлопья экссудата склеивают волокна стекловидного тела в грубые шварты, которые снижают остроту зрения, если располагаются в центральном отделе. Периферически расположенные шварты иногда приводят к образованию отслойки сетчатки.
 Внутриглазное давление в начальной стадии заболевания может увеличиваться вследствие гиперпродукции внутриглазной жидкости в условиях возросшего кровенаполнения сосудов ресничных отростков и снижения скорости оттока более вязкой жидкости. После затяжного воспалительного процесса гипертензия нередко сменяется гипотензией из–за частичного склеивания и атрофии ресничных отростков. Это [розный симптом, так как в условиях гипотонии замедляются обменные процессы в тканях глаза, снижаются функции глаза, в результате чего возникает угроза субатрофии глазного яблока.
Внутриглазное давление в начальной стадии заболевания может увеличиваться вследствие гиперпродукции внутриглазной жидкости в условиях возросшего кровенаполнения сосудов ресничных отростков и снижения скорости оттока более вязкой жидкости. После затяжного воспалительного процесса гипертензия нередко сменяется гипотензией из–за частичного склеивания и атрофии ресничных отростков. Это [розный симптом, так как в условиях гипотонии замедляются обменные процессы в тканях глаза, снижаются функции глаза, в результате чего возникает угроза субатрофии глазного яблока.
При своевременно начатом правильном лечении иридоциклит может быть купирован за 10–15 дней, однако в упорных случаях лечение бывает более длительным – до 6 нед. В большинстве случаев в глазу не остается следов заболевания: рассасываются преципитаты, нормализуется внутриглазное давление, восстанавливается острота зрения.
Острый иридоциклит нужно дифференцировать от острого приступа глаукомы (табл. 14.1).
Таблица 14.1. Дифференциальная диагностика острого ирндоциклита и острого приступа глаукомы
| Симптом | Острый иридоциклит | Острый приступ глаукомы |
|---|---|---|
| Внутриглазное давление | Чаще нормальное (иногда повышено или понижено) | Всегда высокое |
| Боли | Локализуются преимущественно в глазу | Иррадиируют в висок и зубы |
| Инъекция сосудов | Перикорнеальная | Застойная |
| Состояние роговицы | Прозрачная с гладкой поверхностью, имеются преципитаты | Отечная с шероховатой поверхностью, преципитатов нет |
| Глубина передней камеры | Нормальная | Мелкая |
| Состояние радужки | Вялая, отечная. Рисунок нечеткий | Не изменена |
| Состояние зрачка | Узкий | Широкий |
Ревматический иридоциклит протекает в острой форме, характеризуется периодически возникающими рецидивами, сопровождает суставные атаки ревматизма. Могут поражаться оба глаза одновременно или поочередно.
В клинической картине обращают на себя внимание яркая перикорнеальная инъекция сосудов, большое количество мелких светлых преципитатов на задней поверхности роговицы, опалесценция влаги передней камеры, радужка вялая, отечная, зрачок сужен. Легко образуются поверхностные эпителиальные задние синехии. Характер экссудата серозный, выделяется небольшое количество фибрина, поэтому не образуется прочных сращений зрачка. Синехии легко разрываются. Продолжительность воспалительного процесса 3–6 нед. Исход обычно благоприятный. Однако после частых рецидивов постепенно увеличивается выраженность признаков атрофии радужки, становится вялой реакция зрачка, образуются сначала краевые, а затем и плоскостные сращения радужки с хрусталиком, увеличивается количество утолщенных волокон в стекловидном теле, снижается острота зрения.
Хронические иридоциклиты. Туберкулезный иридоциклит характеризуется рецидивирующим течением.
К обострениям обычно приводит активизация основного заболевания. Воспалительный пронес начинается вяло. Болевой синдром и гиперемия глазного яблока выражены слабо. Первыми субъективными симптомами являются снижение остроты зрения и появление плавающих "мушек" перед глазами. При осмотре отмечаются множественные крупные "сальные" преципитаты на задней поверхности роговицы, новообразованные сосуды радужки, опалесценция влаги передней камеры, помутнения в стекловидном теле. Для туберкулезного иридоциклита характерно появление желтовато–серых или розовых воспалительных бугорков (гранулем) по зрачковому краю радужки, к которым подходят новообразованные сосуды. Это метастатические очаги инфекции – истинные туберкулы. Микобактерии туберкулеза могут быть занесены как в первичной, так и в послепервичной стадии туберкулеза. Бугорки в радужке могут существовать несколько месяцев и даже несколько лет, размер и количество их постепенно увеличиваются. Процесс может переходить на склеру и роговицу.
Помимо истинных туберкулезных инфильтратов, по краю зрачка периодически появляются и быстро исчезают "летучие" мелкие пушки, напоминающие хлопья ваты, располагающиеся поверхностно. Это своеобразные преципитаты, оседающие на самом краю вялого малоподвижного зрачка. Для хронических иридоциклитов характерно образование грубых синехий. При неблагоприятном течении заболевания происходят полное сращение и заращение зрачка. Синехии могут быть плоскостными. Они приводят к полной обездвиженности и атрофии радужки. Новообразованные сосуды в таких случаях переходят с радужки на поверхность заращенного зрачка. В настоящее время такая форма заболевания встречается редко.
Диффузная форма туберкулезного иридоциклита протекает без образования бугорков в виде упорного, часто обостряющегося пластического процесса с характерными "сальными” преципитатами и пушками, располагающимися по краю зрачка.
Точная этиологическая диагностика туберкулезного иридоциклита затруднена. Активный туберкулез легких крайне редко сочетается с метастатическим туберкулезом глаз. Диагностику должны проводить совместно фтизиатр и офтальмолог с учетом результатов кожных туберкулиновых проб, состояния иммунитета, характера течения общего заболевания и особенностей глазной симптоматики.
Бруцеллезный иридоциклит обычно протекает в форме хронического воспаления без сильных болей, со слабой перикорнеальной инъекцией сосудов и выраженными аллергическими реакциями. В клинической картине присутствуют все симптомы иридоциклита, однако вначале они развиваются незаметно и пациент обращается к врачу только тогда, когда обнаруживает ухудшение зрения в пораженном глазу. К тому времени уже имеется сращение зрачка с хрусталиком. Заболевание может быть двусторонним. Рецидивы возникают в течение нескольких лет.
Для установления правильного диагноза очень важны анамнестические данные о контакте с животными и продуктами животноводства в прошлом или в настоящее время, указания на перенесенные в прошлом артриты, орхиты, спондилиты. Основное значение имеют результаты лабораторных исследований – положительные реакции Райта, Хаддлсона. При латентных формах заболевания рекомендуется выполнять пробу Кумбса.
Герпетический иридоциклит – одно из наиболее тяжелых воспалительных заболеваний радужки и ресничного тела. Оно не имеет характерной клинической картины, что в ряде случаев затрудняет диагностику. Процесс может начаться остро с возникновения сильных болей, выраженной светобоязни, яркой перикорнеальной инъекции сосудов, а затем течение становится вялым и упорным. Экссудативная реакция чаше серозного типа, но может быть и фибринозной. Для иридоциклитов герпетической природы характерны большое количество крупных сливающихся друг с другом преципитатов, отечность радужки и роговицы, появление гифем, снижение чувствительности роговицы. Прогноз значительно ухудшается при переходе воспалительного процесса на роговицу – возникает кератоиридоциклит (увеокератит). Продолжительность такого воспалительного процесса, захватывающего весь передний отдел глаза, уже не ограничивается несколькими неделями, иногда он затягивается на многие месяцы. При неэффективности консервативных мер проводят хирургическое лечение – иссечение расплавляющейся роговицы, содержащей большое количество вирусов, и лечебную пересадку донорского трансплантата.
Основные принципы лечения иридоциклитов. В зависимости от этиологии воспалительного процесса проводят общее и местное лечение.
При первом осмотре пациента не всегда удается определить причину возникновения иридоциклита. Этиология процесса может быть установлена в последующие дни, а иногда она остается неизвестной, однако больной нуждается в экстренной помощи: промедление с назначением лечения даже на 1–2 ч может серьезно осложнить ситуацию. Передняя и задняя камеры глаза имеют небольшой объем, и 1–2 капли экссудата или гноя могут заполнить их, парализовать обмен жидкости в глазу, склеить зрачок и хрусталик.
При воспалении радужки и ресничного тела любой природы первая помощь направлена на максимальное расширение зрачка, что позволяет решить сразу несколько задач. Во–первых, при расширении зрачка сжимаются сосуды радужки, следовательно, уменьшается образование экссудата и одновременно парализуется аккомодация, зрачок становится неподвижным, тем самым обеспечивается покой пораженному органу. Во–вторых, зрачок отводится от наиболее выпуклой центральной части хрусталика, что предотвращает образование задних синехий и обеспечивает возможность разрыва уже имеющихся сращений. В–третьих, широкий зрачок открывает выход в переднюю камеру для экссудата, скопившегося в задней камере, тем самым предотвращается склеивание отростков цилиарного тела, а также распространение экссудата в задний отрезок глаза.
Для расширения зрачка закапывают 1% раствор атропина сульфата 3–6 раз в день. При воспалении продолжительность действия мидокториатиков во много раз меньше, чем в здоровом глазу. Если при первом осмотре уже обнаруживают синехии, то к атропину добавляют другие мидриатики, например раствор адреналина 1:1.000, раствор мидриацила. Для усиления эффекта за веко закладывают узкую полоску ваты, пропитанную мидриатиками. В отдельных случаях можно положить за веко кристаллик сухого атропина. Нестероидные противовоспалительные препараты в виде капель (наклоф, диклоф, индометацин) усиливают действие мидриатиков. Количество комбинируемых мидриатиков и закапываний в каждом конкретном случае определяют индивидуально.
Следующая мера скорой помощи – субконъюнктивальная инъекция стероидных препаратов (0,5 мл дексаметазона). При гнойном воспалении под конъюнктиву и внутримышечно вводят антибиотик широкого спектра действия. Для устранения болей назначают анальгетики, крылонебно–орбитальные новокаиновые блокады.
После уточнения этиологии иридоциклита проводят санацию выявленных очагов инфекции, разрабатывают схему общего лечения, назначая средства, воздействующие на источник инфекции или токсикоаллергического влияния. Проводят коррекцию иммунного статуса. По мере необходимости используют анальгетики и антигистаминные средства.
При местном лечении необходима ежедневная коррекция проводимой терапии в зависимости от реакции глаза. Если посредством обычных инстилляций не удается разорвать задние синехии, то дополнительно назначают ферментную терапию (трипсин, лидазу, лекозим) в виде парабульбарных, субконъюнктивальных инъекций или электрофореза. Возможно применение медицинских пиявок в височной области со стороны пораженного глаза. Выраженный обезболивающий и противовоспалительный эффект дает курс крылонебно–орбитальных блокад со стероидными, ферментными препаратами и анальгетиками.
При обильной экссудативной реакции могут образовываться задние синехии даже при расширении зрачка. В этом случае необходимо своевременно отменить мидриатики и кратковременно назначить миотики. Как только спайки оторвались и зрачок сузился, снова назначают мидриатики ("гимнастика зрачка"). После достижения достаточного мидокториаза (6–7 мм) и разрыва синехий атропин заменяют мидриатиками короткого действия, которые не повышают внутриглазного давления при длительном применении и не дают побочных реакций (сухость во рту, психотические реакции у пожилых людей). Для того чтобы исключить побочное воздействие препарата на организм пациента, целесообразно при закапывании атропина на 1 мин прижать пальцем область нижней слезной точки и слезного мешка, тогда препарат не проникнет через слезные пути в носоглотку и желудочно–кишечный тракт.
На стадии успокоения глаза можно использовать магнитотерапию, гелий–неоновый лазер, электро– и фонофорез с лекарственными препаратами для более быстрого рассасывания оставшегося экссудата и синехий.
Лечение хронических иридоциклитов длительное. Тактику проведения специфической этиологической терапии и общеукрепляющего лечения вырабатывают совместно с терапевтом или фтизиатром. Местные мероприятия при туберкулезных иридоциклитах проводятся так же, как и при заболеваниях другой этиологии. Они направлены на ликвидацию очага воспаления, рассасывание экссудата и предотвращение заращения зрачка. При полном сращении и заращении зрачка сначала пытаются разорвать спайки, используя консервативные средства (мидриатики и физиотерапевтические воздействия). Если это не дает результата, то спайки разделяют хирургическим путем. Для того чтобы восстановить сообщение между передней и задней камерами глаза, используют лазерное импульсное излучение, с помощью которого в радужке делают отверстие (колобома). Лазерную иридэктомию обычно производят в верхней прикорневой зоне, так как эта часть радужки прикрыта веком и новообразованное отверстие не будет давать лишнего засвета.
Дистрофические процессы в радужке и ресничном теле
Дистрофические процессы в радужке и ресничном теле развиваются редко. Одним из таких заболеваний является дистрофия Фукса, или гетерохромный синдром Фукса. Обычно он возникает в одном глазу и включает три обязательных симптома – белковые преципитаты на роговице, изменение цвета радужки и помутнение хрусталика. По мере развития процесса присоединяются другие симптомы – анизокория (разная ширина зрачков) и вторичная глаукома. Друзья и родственники больного первые обнаруживают у него признаки болезни: замечают разницу в окраске радужки правого и левого глаза, затем обращают внимание на разную ширину зрачков. Сам пациент в возрасте 20–40 лет предъявляет жалобы на снижение остроты зрения, когда возникает помутнение хрусталика.Все симптомы заболевания обусловлены прогрессирующей атрофией стромы радужки и ресничного тела. Истонченный наружный слой радужки становится светлее, а лакуны – шире, чем на парном глазу. Через них начинает просвечивать пигментный листок радужки. К этой стадии заболевания пораженный глаз уже становится темнее, чем здоровый. Дистрофический процесс в отростках ресничного тела приводит к изменению стенок капилляров и качества продуцируемой жидкости. Во влаге передней камеры появляется белок, оседающий мелкими хлопьями на задней поверхности роговицы. Высыпания преципитатов могут исчезать на какой–то период времени, а затем появляться вновь. Несмотря на длительное, в течение нескольких лет, существование симптома преципитации, при синдроме Фукса не образуются задние синехии. Изменение состава внутриглазной жидкости приводит к помутнению хрусталика. Развивается вторичная глаукома.
Раньше синдром Фукса считали воспалением радужки и цилиарного тела из–за наличия преципитатов – одного из основных симптомов циклита. Однако в описанной клинической картине заболевания отсутствуют четыре из пяти общеклинических признаков воспаления, известных со времен Цельса и Галена: гиперемия, отек, боль, повышение температуры тела, присутствует только пятый симптом – нарушение функции.
В настоящее время синдром Фукса рассматривают как нейровегетативную патологию, обусловленную нарушением иннервации на уровне спинного мозга и шейного симпатического нерва, которая проявляется как дисфункция ресничного тела и радужки.
Лечение направлено на улучшение трофических процессов; оно малоэффективно. Когда помутнения в хрусталике приводят к снижению остроты зрения, осуществляют удаление осложненной катаракты. При развитии вторичной глаукомы также показано хирургическое лечение.
Задний отдел сосудистой оболочки глаза – хориоидея
Строение и функции хориоидеи
Хориоидея (от лат. chorioidea) – собственно сосудистая оболочка, задняя часть сосудистого тракта глаза, располагающаяся от зубчатой линии до зрительного нерва.Толщина собственно сосудистой оболочки на заднем полюсе глаза 0,22–0,3 мм и уменьшается по направлению к зубчатой линии до 0,1–0,15 мм. Сосуды хориоидеи являются ветвями задних коротких цилиарных артерий (орбитальные ветви глазничной артерии), задних длинных цилиарных артерий, направляющихся от зубчатой линии к экватору, и передних цилиарных артерий, которые, являясь продолжением мышечных артерий, посылают ветви к передней части сосудистой оболочки, где анастомозируют с ветвями коротких задних цилиарных артерий.
Задние короткие цилиарные артерии перфорируют склеру и проникают в супрахориоидальное вокруг диска зрительного нерва пространство, располагающееся между склерой и хориоидеей. Они распадаются на большое количество ветвей, которые и образуют собственно сосудистую оболочку. Вокруг диска зрительного нерва формируется сосудистое кольцо Цинна–Галлера. В отдельных случаях имеется дополнительная веточка к области макулы (a. cilioretinalis), видимая на диске зрительного нерва или на сетчатке, которая играет важную роль в случае возникновения эмболии центральной артерии сетчатки.
В сосудистой оболочке различают четыре пластинки: надсосудистую, сосудистую, сосудисто–капиллярную и базальный комплекс.
Надсосудистая пластинка толщиной 30 мкм представляет собой самый наружный слой сосудистой оболочки, прилежащий к склере. Она образована рыхлой волокнистой соединительной тканью, содержит большое количество пигментных клеток. При патологических состояниях пространство между тонкими волокнами этого слоя может заполняться жидкостью или кровью. Одним из таких состояний является гипотония глаза, которая часто сопровождается транссудацией жидкости в супрахориоидальное пространство.
Сосудистая пластинка состоит из переплетающихся артерий и вен, между которыми располагаются рыхлая волокнистая соединительная ткань, пигментные клетки, отдельные пучки гладких миоцитов. Снаружи находится слой крупных сосудов (слой Галлера), за ним лежит слой средних сосудов (слой Заттлера). Сосуды анастомозируют между собой, образуя густое сплетение.
Сосудисто–капиллярная пластинка, или слой хориокапилляров, представляет собой систему переплетенных капилляров, образованную сосудами относительно большого диаметра с отверстиями в стенках для прохождения жидкости, ионов и маленьких молекул протеина. Капилляры этого слоя характеризуются неравномерным калибром и способностью пропускать одновременно до 5 эритроцитов. Между капиллярами располагаются уплощенные фибробласты.
Базальный комплекс, или мембрана Бруха, – очень тонкая пластинка (толщина 1–4 мкм), располагающаяся между сосудистой оболочкой и пигментным эпителием сетчатки. В этой пластинке различают три слоя: наружный коллагеновый слой с зоной тонких эластических волокон; внутренний волокнистый (фиброзный) коллагеновый слой и кутикулярный слой, который является базальной мембраной пигментного эпителия сетчатки.
С возрастом мембрана Бруха постепенно утолщается, в ней откладываются липиды, снижается ее проницаемость для жидкостей. У пожилых людей часто обнаруживают фокальные сегменты кальцификации.
Собственно сосудистая оболочка обладает самой высокой способностью к пропусканию жидкости (перфузией), а ее венозная кровь содержит большое количество кислорода.
Функции собственно сосудистой оболочки: ■ осуществляет питание пигментного эпителия сетчатки, фоторецепторов и наружного плексиформного слоя сетчатки ■ поставляет сетчатке вещества, способствующие осуществлению фотохимических превращений зрительного пигмента ■ участвует в поддержании внутриглазного давления и температуры глазного яблока ■ является фильтром для тепловой энергии, возникающей при абсорбции света.
Аномалии развития хориоидеи
Аномалии развития могут быть обусловлены мугацией генов, хромосомными аномалиями в нескольких поколениях, а также быть следствием воздействия различных факторов окружающей среды на организм матери и плода.Колобома хориоидеи представляет собой ее дефект. Эта аномалия возникает как следствие первичного дефекта нейроэктодермы. Через дефект в собственно сосудистой оболочке видна склера, поэтому офтальмоскопически колобома хориоидеи выглядит как белая четко очерченная овальная область. В этой зоне сетчатка недоразвита или полностью отсутствует. Наличие абсолютной скотомы – характерный признак этой аномалии. Колобома чаще возникает спорадически, иногда причиной ее возникновения служит аугосомно–доминантная форма наследования с неполной пенетрантностью гена. Колобома может быть изолированной, иногда она сочетается с микрофтальмом или является одним из симптомов синдрома Пато (трисомия по 13–й хромосоме).
Заболевания хориоидеи
Дистрофии
Дистрофические процессы в хориоидее могут иметь наследственную природу или вторичный характер, например быть последствием перенесенных воспалительных процессов. По локализации они могут быть генерализованными, очаговыми, например располагаться в макулярной области сетчатки. При дистрофии хориоидеи в патологический процесс всегда вовлекаются сетчатка, особенно пигментный эпителий.В основе патогенеза наследственной дистрофии хориоидеи лежат генетически детерминированная абиотрофия (отсутствие сосудистых слоев) и вторичные по отношению к ним изменения фоторецепторов и пигментного эпителия.
Основным офтальмоскопическим признаком этого заболевания является атрофия хориоидеи, сопровождающаяся изменением пигментного эпителия сетчатки со скоплением пигментных гранул, и наличием металлического рефлекса. В начальной сталии атрофии хориокапиллярного слоя крупные и средние сосуды кажутся неизмененными, однако при этом уже отмечается дисфункция фоторецепторов сетчатки, обусловленная нарушением питания ее наружных слоев. По мере прогрессирования процесса сосуды склерозируются и приобретают желтовато–белый цвет. В конечной стадии заболевания сетчатка и хориоидея атрофичны, сосуды исчезают и па фоне склеры видно лишь небольшое количество крупных сосудов хориоидеи. Все признаки дистрофического процесса хорошо видны при флюоресцентной ангиографии (ФАГ).
Атрофия хориоидеи является общим признаком многих наследственных дистрофий сетчатки и пигментного эпителия.
Существуют различные формы генерализованных дистрофий хориоидеи.
Хориоидеремия – наследственная дистрофия хориоидеи. Уже в ранних стадиях наряду с признаками атрофии в хориоидее отмечаются изменения в фоторецепторах, главным образом в палочках на средней периферии сетчатки.
По мере прогрессирования процесса снижается ночное зрение, выявляется концентрическое сужение полей зрения, ЭРГ субнормальная. Центральное зрение сохраняется до поздней сталии заболевания.
Офтальмоскопически у больных мужчин выявляют широкий диапазон изменений – от атрофии хориокапилляров и незначительных изменений в пигментном эпителии сетчатки до полного отсутствия хориоидеи и наружных слоев сетчатки (рис. 14.9). В первой или во второй декаде жизни изменения выражаются в появлении патологического рефлекса при офтальмоскопии, образовании монетовидных очагов атрофии хориоидеи и пигментного эпителия сетчатки, скоплении пигмента в виде гранул или костных телец.
 Рис. 14.9. Хориоидеремия
Рис. 14.9. Хориоидеремия
Диагноз может быть установлен на основании данных семейного анамнеза, результатов обследования больных и членов их семей, исследования ЭРГ и поля зрения.
Дольчатая атрофия хориоидеи (атрофия гирате) – заболевание, наследуемое по аутосомно–рецессивному типу, с характерной клинической картиной атрофии хориоидеи и пигментного эпителия. Уже в начале заболевания поле зрения сужено, ночное зрение и острота зрения снижены, ЭРГ отсутствует. Выраженность дегенеративных изменений на глазном дне не коррелирует с остротой зрения.
Характерным офтальмоскопическим признаком является демаркационная линия, отделяющая зону относительно нормального хориокапиллярного слоя. Наличие изменений подтверждают результаты ФАГ Процесс начинается на средней периферии и распространяется как к периферии, так и центру глазного дна.
Патогномоничпым признаком этого заболевания является увеличение содержания аминоорнитиновой кислоты в плазме крови в 10–20 раз.
Применение витамина В6 в лечении данного заболевания патогенетически обосновано, так как он снижает уровень орпитина в плазме. Однако большинство пациентов не реагируют па введение витамина В6, поэтому основным методом лечения является диета с уменьшенным содержанием белков (в частности, аргинина). В последнее время предпринимаются попытки проведения в эксперименте генной терапии.
Воспалительные заболевания
Термин "хориоидит" объединяет большую группу заболеваний воспалительного генеза, развивающихся в собственно сосудистой оболочке глаза. Изолированный хориоидит наблюдается редко, так как в патологический процесс, как правило, рано вовлекаются сетчатка и зрительный нерв, в результате чего развивается хориоретинит, иейроретинохориоидит или пейроувеит. Возникновение воспалительных заболеваний хориоидеи обусловливают бактериальные, вирусные, паразитарные, грибковые, токсические, лучевые, аллергические агенты. Хориоидиты могут быть проявленим ряда системных заболеваний, а также некоторых иммунопатологических состояний. Наиболее часто развитие хориоидитов вызывают такие инфекции, как токсоплазмоз, туберкулез, гистоплазмоз, токсокароз, кандидоз, сифилис, а также вирусные инфекции (преимущественно группы герпеса), которые могут обусловить клиническую картину острого нейроретинохориоидита или вызвать тяжелые распространенные хориоретиниты в условиях иммуносупрессии (при СПИДе, пересадке органов и др.). Анатомическая структура хориоидеи создает благоприятные условия для развития воспалительного процесса, так как сосудистая сеть хориоидеи является местом прохождения и депонирования большого числа инфекционных агентов, токсичных продуктов и антигенов.До настоящего времени значение инфекционного фактора в патогенезе хориоидигов окончательно не определено и является предметом для дискуссии в литературе, хотя его роль при вирусной инфекции и у больных с подавленным иммунитетом очевидна. Большое значение придаютгенетическим факторам (генетический контроль иммунного ответа) и локальным клеточным реакциям (см. главу 24). Одним из основных звеньев патогенеза хориоидита являются аутоиммунные реакции на различные антигены, в том числе собственные (ретинальный S–антиген), возникающие в связи с повреждением тканей глаза, например при персистенции вируса или депонировании иммунных комплексов.
К факторам риска развития хориоидитов относятся травма, переохлаждение, ослабление организма и др.
Хориоидиты могут быть эндогенными, т. е. вызываться вирусами, бактериями или простейшими и паразитами, циркулирующими в крови, и экзогенными, возникающими при травматическом иридоциклите и заболеваниях роговицы.
По локализации процесса хориоидиты подразделяют на центральные (инфильтрат располагается в макулярной области), перипапиллярные (очаг воспаления локализуется возле или вокруг диска зрительного нерва), экваториальные (в зоне экватора) и периферические (на периферии глазного дна у зубчатой линии).
 Рис. 14.10. Хориоидит. а – острый хориоидит, сероватый очаг с нече моз, очаг атрофии хориоидеи с гиперпигмента
Рис. 14.10. Хориоидит. а – острый хориоидит, сероватый очаг с нече моз, очаг атрофии хориоидеи с гиперпигмента
В зависимости от распространенности процесса хориоидиты могут быть очаговыми (фокальными), многофокусными диссеминированными (мультифокальными) и диффузными.
Жалобы на вспышки, мерцания и летающие "мушки" перед глазами, затуманивание и снижение зрения, плавающие помутнения, искажение предметов, снижение сумеречного зрения возникают при локализации процесса в заднем отделе глаза, вовлечении в патологический процесс сетчатки и стекловидного тела. При периферическом расположении очага воспаления жалобы часто отсутствуют, в связи с чем заболевание выявляют случайно при офтальмоскопии.
При офтальмоскопии выявляют хориоретинальные инфильтраты, параваскулярные экссудаты, которым соответствуют скотомы в поле зрения. При активном воспалении на глазном дне видны сероватые или желтоватые очаги с нечеткими контурами, проминирующие в стекловидное тело, сосуды сетчатки проходят над ними, не прерываясь (рис. 14.10, а). Очаги воспаления могут быть различными по величине и форме, чаще округлые, размер их равен 0,5–1,5 диаметра диска зрительного нерва. Редко наблюдаются более мелкие или очень крупные очаги. В этот период возможны кровоизлияния в хориоидею, сетчатку и стекловидное тело. При прогрессировании процесса отмечается помутнение сетчатки над хориоидальным очагом, небольшие сосуды сетчатки в зоне отека становятся невидимыми. В отдельных случаях развивается помутнение в задних отделах стекловидного тела в связи с инфильтрацией его клеточными элементами и образованием мембран. Пол влиянием лечения хориоретинальный очаг уплощается. становится прозрачным, приобретает более четкие контуры. Когда воспалительный процесс стихает, на границе очага появляется пигментация в виде мелких точек (рис. 14.10,6). На месте очага исчезают мелкие и средние сосуды хориоидеи, которая истончается, и через нее просвечивает склера. При офтальмоскопии виден белый очаг или очаги с крупными сосудами хориоидеи и пигментными глыбками. Четкие границы и пигментация очага свидетельствуют о переходе воспаления в стадию атрофии хориоидеи и пигментного эпителия сетчатки.
При расположении очага воспаления возле диска зрительного нерва возможно распространение воспалительного процесса на зрительный нерв. В таких случаях в поле зрения появляется характерная скотома, сливающаяся с физиологической. При офтальмоскопии определяется стушеванность границ зрительного нерва. Развивается перипапиллярный хориоретинит, называемый околососочковым нейроретинитом, юкстапапиллярным ретинохориоидитом Йенсена или циркумпапиллярным ретинитом.
Хориоидит может осложняться вторичной дистрофией и экссудативной отслойкой сетчатки, невритом с переходом во вторичную атрофию зрительного нерва, обширными кровоизлияниями в стекловидное тело с последующим швартообразованием. Кровоизлияния в хориоидею и сетчатку могут приводить к образованию грубых соединительнотканных рубцов и формированию неоваскулярных мембран, что сопровождается значительным снижением остроты зрения.
При очаговом процессе во всех слоях собственно сосудистой оболочки обнаруживают ограниченный инфильтрат вокруг расширенных сосудов, состоящий из лимфоидных элементов. При диффузном хориоидите воспалительный инфильтрат состоит из лимфоцитов, эпителиоидных и гигантских клеток, сдавливающих сосудистое сплетение. При вовлечении в патологический процесс сетчатки отмечаются деструкция слоя пигментного эпителия, отек и кровоизлияния. По мере развития процесса клеточные элементы инфильтрата замещаются фибробластами и волокнами соединительной ткани, в результате чего образуется рубцовая ткань. В новообразованном рубце сохраняются остатки измененных крупных сосудов хориоидеи, по периферии рубца отмечается пролиферация пигментного эпителия сетчатки.
Диагноз устанавливают на основании результатов прямой и обратной офтальмоскопии, ФАГ, иммунологического и биохимического исследований, регистрации ЭРГ и ЭОГ и др. В 30% случаев этиологию определить не удается.
Дифференциальную диагностику проводят с наружным экссудативным ретинитом, невусом и меланомой хориоидеи в начальной стадии. Для экссудативного ретинита в отличие от хориоидита характерны сосудистые изменения в сетчатке, микро– и макроаневризмы, артериальные шунты, выявляемые при офтальмоскопии и ФАГ. Невус хориоидеи при офтальмоскопии определяется как плоский участок аспидного или серо–аспидного цвета с четкими границами, сетчатка над ним не изменена, острота зрения не снижена. Меланома хориоидеи имеет характерную клиническую и функциональную симптоматику (см. главу 20). Диагноз уточняют с помощью электрофизиологических (регистрация ЭРГ, ЭОГ), ультразвукового и радиоизотопного исследований.
Лечение должно быть индивидуальным, его интенсивность и длительность определяются инфекционным агентом, тяжестью и локализацией процесса, выраженностью иммунологических реакций. В связи с этим препараты, используемые для лечения хориоидитов, делят на этиотропные, противовоспалительные (неспецифические), иммунокорригирующие, симптоматические, воздействующие на сложные регенеративные и биохимические процессы в структурах глаза, мембранопротекторы и др. Системное применение препаратов сочетается с местным (парабульбарные и ретробульбарные инъекции), в случае необходимости проводят хирургическое лечение.
Этиотропное лечение предусматривает применение противовирусных, антибактериальных и противопаразитарных препаратов, однако антибиотики широкого спектра действия используют при лечении хориоидитов только после определения чувствительности к ним инфекционных агентов. В активной фазе заболевания антибиотики широкого спектра из группы аминогликозидов, цефалоспоринов и другие применяют в виде парабульбарных, внутривенных и внутримышечных инъекций и принимают внутрь. Антибактериальные специфические препараты используют при хориоидитах, возникших на фоне туберкулеза, сифилиса, токсоплазмоза, бруцеллеза и др. При хориоидитах вирусной природы рекомендуются противовирусные препараты.
Иммунотропная терапия часто является основным методом лечения эндогенных хориоидитов. При этом в зависимости от иммунологического статуса больного и клинической картины заболевания применяют либо иммуносупрессоры, либо иммуностимуляторы.
Не менее важна пассивная иммунотерапия. В связи с этим возможно применение глобулинов. Вакцины также можно использовать, но с большой осторожностью, с учетом индивидуального статуса больного, во избежание обострений патологического процесса. В качестве иммунокорригирующей терапии используют индукторы интерферона (интерфероногены) и интерфероны.
На фоне применения этиотропных препаратов ведущее место в лечении воспалительных процессов занимают кортикостероиды, несмотря на возможность их побочного действия. В острой стадии процесса воспаление подавляют путем локального или системного применения кортикостероидов. В ряде случаев их раннее использование улучшает прогноз.
Гипосенсибилизацию осуществляют с целью снижения чувствительности сенсибилизированных тканей глаза при туберкулезных, токсоплазмозных, вирусных, стафилококковых и стрептококковых хориоидитах. В качестве неспецифической и гипосенсибилизирующей терапии применяют антигистаминные препараты (тавегил, супрастин, кларитин, телфаст и др.). При активном воспалении используют иммуносупрессоры (меркаптопурин, фторурацил, циклофосфан и др.), иногда в сочетании с кортикостероидами.
При лечении хориоидита применяют также циклоспорин А и препараты вилочковой железы, играющие важную роль в становлении иммунной системы.
Физиотерапевтические и физические методы воздействия (электрофорез лекарственных препаратов, лазеркоагуляция, криокоагуляция) также используют в различных стадиях заболевания. Для рассасывания экссудатов и кровоизлияний в хориоидее, сетчатке и стекловидном теле используют ферменты (трипсин, фибринолизин, лидазу, папаин, лекозим, флогэнзим, вобензим и др.), которые вводят внутримышечно, ретробульбарно, с помощью электрофореза и принимают внутрь. Возможна транссклеральная криокоагуляция хориоидеи и лазеркоагуляция сетчатки. На всех этапах показана витаминотерапия (витамины С, B1, В6, В12).
Прогноз зависит от этиологии хориоидита, распространенности и локализации процесса. Полная слепота наблюдается редко, преимущественно при развитии осложнений, атрофии зрительного нерва, экссудативной отслойке сетчатки, при которой в случае неэффективности медикаментозной терапии показано хирургическое лечение.
Токсоплазмозный хориоретинит чаще связан с внутриутробным инфицированием. Клинические проявления поражения глаза не всегда выявляют к моменту рождения и в раннем возрасте. Для врожденного токсоплазмоза, как и для других врожденных инфекций, характерно сочетание поражения глаз с другими системными нарушениями, чаще всего с поражением ЦНС. У инфицированных новорожденных могут отмечаться повышение температуры тела, лимфаденопатия, энцефалит, гепатоспленомегалия, пневмония, внутричерепные кальиификаты.
Клиническая картина токсоплазмоза зависит от возраста и иммунного статуса пациента, а также от активности глазной инфекции. Токсоплазмоз проявляется как хориоретинит. При неактивном токсоплазмозе обнаруживают старые крупные атрофические или рубцовые хориоретинальные очаги с гипертрофией пигментного эпителия, чаще одиночные, расположенные в области заднего полюса глаза (см. рис. 14.10, б). Появление зоны активного воспаления в виде белых очагов наблюдается в любой области глазного дна, как правило, но краю старых изменений. В острый период воспаления очаги имеют нечеткие границы, размер их варьирует и может быть равен нескольким диаметрам диска зрительного нерва. При больших очагах поражения возможно проминировапие их в стекловидное тело. Сосуды в очаге могут закрываться. При активном воспалении возможны экссудативная отслойка сетчатки и вторичная хориоидальная нсоваскуляризация с субретинальным кровоизлиянием, видимая при офтальмоскопии как утолщение тканей серовато–желтоватого цвета на уровне пигментного эпителия.
Изменения в стекловидном теле, инфильтрация его слоев клеточной взвесью и формирование мембран наблюдаются при распространении процесса на внутренние слои сетчатки и разрушении гиалоидной мембраны. При этом отмечаются поражение зрительного нерва и кистевидный отек макулы.
Диагностика основана на выявлении характерных признаков врожденного токсоплазмоза и типичной локализации крупных одиночных очагов в области заднего полюса с формированием новых зон воспаления по краю старых рубцов.
Серологическое исследование включает определение специфических антител в токсоплазме с помощью реакции связывания комплемента и флюоресцирующих антител. Наиболее информативно и широко используется в последние годы исследование с проведением иммуноферментного анализа, позволяющего выявлять антитела разных классов.
Не при всех формах токсоплазмоза необходимо лечение. Небольшие периферические очаги могут быть бессимптомными и самоизлечиваться за период от 3 нед до 6 мес. При выраженных симптомах воспаления в заднем полюсе глаза, а также при реактивации процесса лечение должно быть направлено на уничтожение микроорганизмов. Показано проведение местной неспецифической противовоспалительной терапии (кортикостероиды) в сочетании с системным применением специфических средств.
К препаратам, наиболее широко используемым в лечении токсоплазмоза, относятся фонсидор, пириметамин, дараприм, тиндурин, хлоридин и сульфадиазин. Лечение проводят сульфаниламидными препаратами в комбинации с фолиевой кислотой под контролем состава крови в связи с возможностью развития лейкопении и тромбоцитопении. Возможно применение пириметамина и сульфадиазина в сочетании с кортикостероидами под конъюнктиву. Клиндамицин и далацин как блокаторы синтеза протеинов при лечении токсоплазмоза также используют в сочетании с описанными выше препаратами.
Синдром глазного гистоплазмоза – заболевание, вызываемое грибом Histoplasnia capsulatum, который сушсствует в двух формах: у человека – в дрожжевой, в загрязненной почве – в виде плесени. Чаше встречается в эндемичных зонах (США – штаты Миссисипи, Флорида, Техас; Центральная Америка, Центральная Африка и др.). Заражение происходит при вдыхании спор в легкие. В патологический процесс могут вовлекаться различные органы, и тогда говорят о системном гистоплазмозс.
Характерными офтальмоскопическими признаками являются хориоретинальные очажки атрофии, кистовидные изменения в макуле, перипапиллярные рубцы, хориоидальная неоваскуляризация, линеарные полосы на средней периферии, отсутствие клинических признаков активного воспалительного процесса.
Кожный тест на гистоплазмоз положительный. В то же время встречаются фенотинические формы гистоплазмоза, ири которых кожная проба часто отрицательная. В таких случаях диагностика становится затруднительной. Существует мнение, что для образования атрофических очагов и формирования субретинальной неоваскулярной мембраны необходима генетическая предрасположенность. Хориоидальная неоваскуляризация как осложнение чаше возникает у пациентов с атрофическими очагами в макулярной области, которая имеет Ивет от красного до серого, представляется утолщенной, с кольцом гиперпигмептации, являющейся, как считают, компенсаторным ответом пигментного эпителия. При этом отмечается значительное снижение остроты зрения. Офтальмоскопически часто выявляют геморрагическую отслойку нейроэпителия и пигментного эпителия в макулярной области. Наличие неоваскуляризаЦии подтверждают результаты ангиографии.
Лечение: при неоваскуляризации хориоилеи ноказана криптоновая лазерфотокоагуляция, однако значительный субфовеальный рост сосудов осложняет лечение, так как фотокоагуляция этой зоны приводит к необратимому снижению зрения.
Мультифокальный хориоидит и панувеит. Клиническая картина мультифокального хориоидита и панувеита схожа с описанными выше проявлениями синдрома глазного гистоплазмоза. Она также включает хориоретинальные очажки атрофии, перипапиллярные рубцы, хориоидальную неоваскуляризаиию, линеарные полосы на периферии. Однако основное отличие состоит в том, что при мультифокальном хориоидите и панувеите отмечаются повторяющиеся признаки воспалительного процесса и возникновение все новых очагов хориоретинальной атрофии, более многочисленных и меньшей величины, а также появление очагов воспаления в передней и задней частях стекловидного тела, воспалительных изменений в передней камере. Диск зрительного нерва отечен. В острой фазе заболевания возможно возникновение локальной экссудативной отслойки сетчатки. У пациентов с длительно протекающим заболеванием на глазном дне могут быть выявлены воспалительные очаги в различных стадиях развития.
Острота зрения снижена. При периметрии отмечают расширение слепого пятна, отдельные скотомы в иоле зрения. В процессе лечения возможно улучшение полей зрения.
Этиология не установлена, хотя не исключена инфекционная и аутоиммунная природа заболевания.
В острой фазе и при развитии осложнений заболевания возможно лечение кортикостероидами. Отмечены случаи самоизлечения даже при наличии хориоидальной неоваскуляризации.
Туберкулезный хориоидитразвивается в молодом возрасте на фоне первичного туберкулеза. Причиной заболевания являются микобактерии, инфицирующие многие органы.
При туберкулезном поражении хориоидеи чаще наблюдается милиарный и многофокусный хориоидит. Хориоидальные туберкулы желтоватого или серовато–белого цвета. После лечения сохраняются один или множество хориоретинальных рубцов с четкими краями, гиперфлюоресцирующие при ФАГ. Для туберкулезно–метастатического гранулематозного хориоретинита характерно тяжелое течение с кровоизлияниями в сетчатку и инфильтрацией стекловидного тела. Туберкулезноаллергические хориоретиниты при отсутствии микобактерий туберкулеза в глазу протекают как негранулематозное воспаление. Они не имеют клинических особенностей, часто развиваются у детей и подростков в период виража туберкулиновых проб.
Дифференциальную диагностику проводят с другими гранулематозными инфекциями: саркоидозом, бруцеллезом, лепрой, токсоплазмозом, сифилисом, грибковым поражением. При туберкулезном хориоидите характер гистологических изменений зависит от стадии туберкулезного процесса. При первичном туберкулезе воспаление в хориоидее протекает с диффузной лимфоидной инфильтрацией, наличием эпителиоидных и гигантских клеток. При вторичном туберкулезе преобладает продуктивный тип воспаления, характеризующийся формированием типичных туберкулезных гранулем с казеозным некрозом.
Диагностика основана на выявлении внеглазных очагов туберкулеза, положительных результатах туберкулиновых проб и очаговых реакциях глаз на введение туберкулина.
Специфическое системное лечение включает стандратную противотуберкулезную терапию и антимикобактериальные препараты (изониазид, рифампицин, пиразинамид, этамбутол и др.). Возможно использование кортикостероидов в зависимости от иммунологического статуса больного и течения процесса. При туберкулезно–аллергических хориоретинитах проводят местную и общую неспецифическую противовоспалительную и десенсибилизирующую терапию.
Токсокарозный хориоидит вызывается личиночной формой Toxocara canis – гельминта из группы аскарид.
Офтальмотоксокароз может быть проявлением общего заболевания при массивной инвазии организма личинками или единственным клиническим проявлением гельминтоза.
Очаг гранулематозного воспаления формируется вокруг личинки на месте ее проникновения в глаз. При попадании в глаз через сосуды диска зрительного нерва личинка, как правило, оседает в парамакулярной зоне. После ликвидации воспаления в области заднего полюса глаза формируется гранулема. В младшем детском возрасте процесс протекает более остро с массивной воспалительной реакцией стекловидного тела, по клиническим проявлениям напоминая ретинобластому или эндофтальмит. У детей более старшего возраста, подростков и у взрослых процесс протекает более доброкачественно с формированием плотного проминирующего очага в парапапиллярной области. При попадании личинки в глаз по системе передних цилиарных артерий образуется периферическая гранулема. В этом случае процесс может протекать практически бессимптомно.
В острой фазе токсокарозного увеита очаг выглядит как мутный, белесоватый, сильно проминирующий фокус с перифокальным воспалением и экссудатом в стекловидном теле. Впоследствии очаг уплотняется, границы его становятся четкими, поверхность – блестящей. Иногда в нем определяется темный центр как свидетельство наличия остатков личинок. Очаг нередко связан фиброзным тяжем с ДЗН.
Диагностика основана на типичной офтальмоскопической картине и выявлении инфицирования токсокарозом с помощью иммуноферментного анализа.
Лечение чаще симптоматическое, так как противопаразитарные препараты оказывают слабое влияние на личиночные формы гельминтов. Кроме того, процесс воспаления нередко начинается после гибели и разложения личинок вследствие их токсического действия на окружающие ткани. Дополнительными средствами лечения являются отграничивающая лазеркоагуляция и хирургическое удаление гранулемы вместе с прилежащей рубцовой тканью.
Кандидозный хориоидит вызывается грибами Candida albicans. В последние годы частота развития заболевания увеличивается в связи с широким применением антибиотиков и препаратов–иммуносупрессоров.
Больные предъявляют жалобы на снижение зрения и плавающие помутнения перед глазом. Офтальмоскопически процесс напоминает токсоплазмоз. На глазном дне выявляют проминирующие желто–белые очаги с нечеткими границами разных размеров – от небольших, типа комочков ваты, до очагов размером в несколько диаметров диска зрительного нерва. Первично поражается сетчатка, по мере прогрессирования процесс распространяется на стекловидное тело и хориоилею.
Диагностика основана на характерном анамнезе (длительный прием больших доз антибиотиков или стероидных препаратов) и результатах исследования крови в период кандидемии.
Лечение – локальное и системное применение противогрибковых препаратов (амфотерицип В, орунгал, рифамин и др.), которые вводят в стекловидное тело. При тяжелых процессах выполняют витрэктомию – удаление стекловидного тела.
Сифилитический хориоретинит может развиться как при врожденном, так и при приобретенном сифилисе.
Врожденные изменения сетчатки – множественные мелкие пигментированные и беспигментные очажки, придающие глазному дну вид соли с перцем, или множественные более крупные атрофические очаги в хориоидее, чаще на периферии глазного дна. Реже наблюдаются перипапиллярные атрофические изменения сетчатки и хориоидеи в сочетании с ее периферическими дистрофическими изменениями.
При приобретенном сифилисе заболевания сетчатки и сосудистой оболочки развиваются во втором и третьем периодах болезни и протекают в виде очагового или диффузного хориоретинита. Клинически сифилитический хориоретинит трудно отличить от процессов другой этиологии. Для диагностики необходимо использовать серологические реакции и учитывать характерные изменения в других органах.
Дифференциальную диагностику при врожденном сифилисе следует проводить с вторичными дистрофиями другого происхождения (например, краснушной ретинопатией), а также наследственными дистрофиями сетчатки. При дифференциальной диагностике с наследственными дистрофиями сетчатки важен семейный анамнез и исследование ЭРГ: при пигментном ретините она не регистрируется, при хориоретините нормальная либо субнормальная.
Диагностика основывается на результатах серологического исследования, которое проводят с целью выявления специфического инфицирования.
Лечение сифилитических поражений глаз осуществляют совместно с венерологом.
Хориоретиниты при ВИЧ–инфекции протекают в виде суперинфекции на фоне выраженных нарушений иммунитета. Наиболее часто непосредственной причиной поражения глаз являются цитомегаловирусы. Характерными признаками хориоретинита при ВИЧ–инфекции являются значительная распространенность поражения, некротический характер воспаления, геморрагический синдром.
Диагностика основывается на характерных клинических признаках и выявлении ВИЧ. Прогноз в отношении зрения неблагоприятный. При лечении используют противовирусные и иммунотропные препараты.
Глава 15. Сетчатка
Видеть и чувствовать – это быть, размышлять – это жить.В. Шекспир
Анатомия и нейрофизиология сетчатки
Сетчатка, или внутренняя, чувствительная оболочка глаза (tunica interna sensoria bulbi, retina), – периферическая часть зрительного анализатора. Нейроны сетчатки являются сенсорной частью зрительной системы, которая воспринимает световые и цветовые сигналы.Сетчатка выстилает внутреннюю полость глазного яблока. Функционально выделяют большую (⅔) заднюю часть сетчатки – зрительную (оптическую) и меньшую (слепую) – ресничную, покрывающую ресничное тело и заднюю поверхность радужки до зрачкового края. Оптическая часть сетчатки представляет собой тонкую прозрачную клеточную структуру, имеющую сложное строение, которая прикреплена к подлежащим тканям только у зубчатой линии и около диска зрительного нерва. Остальная поверхность сетчатки прилежит к сосудистой оболочке свободно и удерживается давлением стекловидного тела и тонкими связями пигментного эпителия, что имеет значение при развитии отслойки сетчатки.
В сетчатке различают наружную пигментную часть и внутреннюю светочувствительную нервную часть. В срезе сетчатки выделяют три радиально расположенных нейрона: наружный – фоторецепторный, средний – ассоциативный, внутренний – ганглионарный (рис. 15.1). Между ними располагаются плексиформные слои сетчатки, состоящие из аксонов и дендритов соответствующих фоторецепторов и нейронов второго и третьего порядков, к которым относятся биполярные и ганглиозные клетки. Кроме того, в сетчатке имеются амакриновые и горизонтальные клетки, называемые интернейронами (всего 10 слоев).
Первый слой пигментного эпителия прилежит к мембране Бруха хориоидеи. Пигментные клетки окружают фоторецепторы пальцевидными выпячиваниями, которые отделяют их друг от друга и увеличивают площадь контакта. На свету включения пигмента перемещаются из тела клетки в ее отростки, предотвращая светорассеивание между соседними палочками или колбочками. Клетки пигментного слоя фагоцитируют отторгающиеся наружные сегменты фоторецепторов, осуществляют транспорт метаболитов, солей, кислорода, питательных веществ из сосудистой оболочки к фоторецепторам и обратно. Они регулируют электролитный баланс, частично определяют биоэлектрическую активность сетчатки и антиоксидантную защиту, способствуют плотному прилеганию сетчатки к хориоидее, активно "откачивают” жидкость из субретинального пространства, участвуют в процессе рубцевания в очаге воспаления.
Второй слой образован наружными сегментами фоторецепторов, палочек и колбочек. Палочки и колбочки являются специализированными высокодифференцированными цилиндрическими клетками; в них выделяют наружный и внутренний сегменты и сложное пресинаптическое окончание, к которому подходят дендриты биполярных и горизонтальных клеток. В строении палочек и колбочек имеются различия: в наружном сегменте палочек содержится зрительный пигмент – родопсин, в колбочках – иодопсин, наружный сегмент палочек представляет собой тонкий палочкоподобный цилиндр, в то время как колбочки имеют коническое окончание, которое короче и толще, чем у палочек.
 Рис. 15.1. Строение сетчатки.
К – колбочки; П – папочки; Г – горизонтальная клетка; Б – биполярные клетки; М – клетка Мюллера; Л – амакриновая клетка.
Рис. 15.1. Строение сетчатки.
К – колбочки; П – папочки; Г – горизонтальная клетка; Б – биполярные клетки; М – клетка Мюллера; Л – амакриновая клетка.
В наружном сегменте фоторецептора происходят первичные фотофизические и ферментативные процессы трансформации энергии света в физиологическое возбуждение. Колбочки и палочки отличаются по своим функциям: колбочки обеспечивают цветоощущение и центральное зрение, палочки отвечают за сумеречное зрение. Периферическое зрение в условиях яркого освещения обеспечивают колбочки, а в темноте – палочки и колбочки.
Третий слой – наружная пограничная мембрана – представляет собой полосу межклеточных сцеплений. Она названа окончатой мембраной Верхофа, так как наружные сегменты палочек и колбочек проходят через нее в субретинальное пространство (пространство между слоем колбочек и палочек и пигментным эпителием сетчатки), где они окружены веществом, богатым мукополисахаридами.
Четвертый слой – наружный ядерный – образован ядрами фоторецепторов.
Пятый слой – наружный плексиформный, или сетчатый (от лат. plexus – сплетение), – занимает промежуточную позицию между наружным и внутренним ядерными слоями.
Шестой слой – внутренний ядерный – образуют ядра нейронов второго порядка (биполярные клетки), а также ядра амакриновых, горизонтальных и мюллеровских клеток.
Седьмой слой – внутренний плексиформный – отделяет внутренний ядерный слой от слоя ганглиозных клеток и состоит из клубка сложно разветвляющихся и переплетающихся отростков нейронов. Он отграничивает сосудистую внутреннюю часть сетчатки от бессосудистой наружной, зависящей от хориоидальной циркуляции кислорода и питательных веществ.
Восьмой слой образован ганглиозными клетками сетчатки (нейроны второго порядка), толщина его заметно уменьшается по мере удаления от центральной ямки к периферии. Вокруг ямки этот слой состоит из 5 рядов ганглиозных клеток или более. На данном участке каждый фоторецептор имеет прямую связь с биполярной и ганглиозной клеткой.
Девятый слой состоит из аксонов ганглиозных клеток, образующих зрительный нерв.
Десятый слой – внутренняя пограничная мембрана – покрывает поверхность сетчатки изнутри. Он является основной мембраной, образованной основаниями отростков нейроглиальных клеток Мюллера.
Мюллеровские клетки – высокоспециализированные гигантские клетки, проходящие через все слои сетчатки, которые выполняют опорную и изолирующую функцию, осуществляют активный транспорт метаболитов на разных уровнях сетчатки, участвуют в генерации биоэлектрических токов. Эти клетки полностью заполняют щели между нейронами сетчатки и служат для разделения их рецептивных поверхностей. Межклеточные пространства в сетчатке очень малы, местами отсутствуют.
Палочковый путь проведения импульса содержит палочковые фоторецепторы, биполярные и ганглиозные клетки, а также несколько видов амакри новых клеток, являющихся промежуточными нейронами. Фоторецепторы передают зрительную информацию к биполярным клеткам, которые являются нейронами второго порядка. При этом палочки контактируют только с биполярными клетками одной категории, которые деполяризуются под действием света (уменьшается разность биоэлектрических потенциалов между содержимым клетки и окружающей средой).
Колбочковый путь отличается от палочкового тем, что уже в наружном плексиформном слое колбочки имеют более обширные связи и синапсы связывают их с колбочковыми биполярами различных типов. Одни из них деполяризуются подобно палочковым биполярам и формируют колбочковый световой путь с инвертирующими синапсами, другие гиперполяризуются, образуя темновой путь.
Колбочки макулярной области имеют связь со световыми и тем новы ми нейронами второго и третьего порядка (биполярными и ганглиозными клетками), формируя таким образом светотемновые (on–off) каналы контрастной чувствительности. По мере удаления от центрального отдела сетчатки увеличивается количество фоторецепторов, соединенных с одной биполярной клеткой, и количество биполярных клеток, соединенных с одной ганглиозной. Так образуется рецептивное поле нейрона, обеспечивающее суммарное восприятие нескольких точек в пространстве.
В передаче возбуждения в цепи ретинальных нейронов важную функциональную роль играют эндогенные трансмиттеры, главными из которых являются глутамат, аспартат, специфичный для палочек, и ацетилхолин, известный как трансмиттер холинергических амакриновых клеток.
Основной, глутаматовый, путь возбуждения идет от фоторецепторов к ганглиозным клеткам через биполяры, а тормозной путь – от ГАМК (γ–аминомасляная кислота) и глицинергических амакриновых клеток к ганглиозным. Два класса трансмиттеров – возбуждающие и тормозящие, названные ацетилхолином и ГАМК соответственно, содержатся в амакриновых клетках одного типа.
В амакриновых клетках внутреннего плексиформного слоя содержится нейроактивная субстанция сетчатки – допамин. Допамин и мелатонин, синтезируемый в фоторецепторах, играют реципрокную роль в ускорении процессов их обновления, а также в адаптивных процессах в темноте и на свету в наружных слоях сетчатки. Таким образом, нейроактивные вещества, обнаруженные в сетчатке (ацетилхолин, глутамат, ГАМК, глицин, допамин, серотонин), являются трансмиттерами, от тонкого нейрохимического баланса которых зависит функция сетчатки. Возникновение дисбаланса между мелатонином и допамином может быть одним из факторов, приводящих к развитию дистрофического процесса в сетчатке, пигментного ретинита, ретинопатий лекарственного происхождения.
Функции сетчатки – преобразование светового раздражения в нервное возбуждение и первичная обработка сигнала.
Под воздействием света в сетчатке происходят фотохимические превращения зрительных пигментов, за которым следуют блокирование светозависимых каналов Na+ – Са2+, деполяризация плазматической мембраны фоторецепторов и генерация рецепторного потенциала. Все эти сложные превращения от сигнала о поглощении света до возникновения разности потенциалов на плазматической мембране носят название "фототрансдукция". Рецепторный потенциал распространяется вдоль аксона и, достигнув синаптической терминали, вызывает выделение нейромедиатора, который запускает цепь биоэлектрической активности всех нейронов сетчатки, осуществляющих первоначальную обработку зрительной информации. По зрительному нерву информация о внешнем мире передается в подкорковые и корковые зрительные центры мозга.
Специальные методы исследования сетчатки, пигментного эпителия и хориоидеи
В диагностике и дифференциальной диагностике заболеваний сетчатки большое распространение получили электрофизиологические методы исследования, к которым относятся электроретинография, электроокулография и регистрация зрительных вызванных потенциалов коры головного мозга.Электроретинография – метод регистрации суммарной биоэлектрической активности всех нейронов сетчатки (рис. 15.2): негативная α–волна – фоторецепторов и позитивная b–волна – гипер– и деполяризующихся биполяров и мюллеровских клеток. Электроретинограмма (ЭРГ) возникает при воздействии на сетчатку световыми стимулами различного размера, формы, длины волны, интенсивности, длительности, частоты следования в различных условиях световой и темновой адаптации. Рис. 15.2. Виды ЭРГ, используемые для диагностики заболеваний сетчатки.
Практическая ценность электроретинографии определяется тем, что она является очень чувствительным методом оценки функционального состояния сетчатки, который позволяет определить как самые незначительные биохимические нарушения, так и грубые дистрофические и атрофические процессы. Электроретинография помогает изучать механизмы развития патологических процессов в сетчатке, облегчает раннюю дифференциальную и топическую диагностику заболеваний сетчатки, ее используют для контроля за динамикой патологического процесса и эффективностью лечения.
ЭРГ может быть зарегистрирована от всей площади сетчатки и от локальной области различной величины. Локальная ЭРГ, зарегистрированная от макулярной области, позволяет оценить функции колбочковой системы макулярной области. ЭРГ, вызываемую реверсивным шахматным стимулом, используют для характеристики нейрона второго порядка.
Выделение функций фотопиуеской (колбочковой) и скотопической (палочковой) систем основано на различии физиологических свойств колбочек и палочек сетчатки, поэтому используют соответствующие условия, в которых доминирует каждая из этих систем. Колбочки более чувствительны к ярким красным стимулам, предъявляемым в фотопических условиях освещения после предварительной световой адаптации, подавляющей палочковую активность, к частоте мельканий свыше 20 Гц, палочки – к слабым ахроматическим или синим стимулам в условиях темновой адаптации, к частоте мельканий до 20 Гц.
Различная степень вовлечения в патологический процесс палочковой и/или колбочковой систем сетчатки является одним из характерных признаков любого заболевания сетчатки наследственного, сосудистого, воспалительного, токсического, травматического и иного генеза, что и определяет характер электрофизиологической симптоматики.
В основе принятой в электроретинографии классификации ЭРГ лежат амплитудные характеристики основных α– и b–волн ЭРГ, а также их временные параметры. Различают следующие виды ЭРГ: нормальную, супернормальную, субнормальную (плюс– и минус–негативную), угасшую, или нерегистрируемую (отсутствующую). Каждый из типов ЭРГ отражает локализацию процесса, стадию его развития и патогенез.
Супернормальная ЭРГ характеризуется увеличением α– и b–волн, что отмечается при первых признаках гипоксии, медикаментозных интоксикациях, симпатической офтальмии и пр. Супернормальная биоэлектрическая реакция при травматическом перерыве зрительного нерва и его атрофии обусловлена нарушением проведения возбуждения по ретиноталамическим центробежным тормозящим волокнам. В ряде случаев трудно объяснить природу супернормальной ЭРГ.
Субнормальная ЭРГ – это наиболее часто выявляемый вид патологической ЭРГ, которая характеризуется снижением α– и b–волн. Ее регистрируют при дистрофических заболеваниях сетчатки и хориоидеи, отслойке сетчатки, увеитах с вовлечением в процесс 1–го и 2–го нейронов сетчатки, хронической сосудистой недостаточности с нарушением микроциркуляции, некоторых формах ретиношизиса (Х–хромосомный, сцепленный с полом, сиццром Вагнера) и т. д.
Негативная ЭРГ характеризуется увеличением или сохранностью α–волны и небольшим или значительным снижением b–волны. Негативную ЭРГ можно наблюдать при патологических процессах, при которых изменения локализуются в дистальных отделах сетчатки. Минус–негативная ЭРГ встречается при ишемических тромбозах центральной вены сетчатки, лекарственных интоксикациях, прогрессирующей миопии и врожденной стационарной ночной слепоте, болезни Огуши, X–хромосомном ювенильном ретиношизисе, металлозах сетчатки и других видах патологии.
Угасшая, или нерегистрируемая (отсутствующая) ЭРГ является электрофизиологическим симптомом тяжелых необратимых изменений в сетчатке при ее тотальной отслойке, развитом металлозе, воспалительных процессах в оболочках глаза, окклюзии центральной артерии сетчатки, а также патогномоничным признаком пигментного ретинита и амавроза Лебера. Отсутствие ЭРГ отмечено при грубых необратимых изменениях нейронов, которые могут наблюдаться при дистрофических, сосудистых и травматических поражениях сетчатки. ЭРГ этого типа регистрируют в терминальной стадии диабетической ретинопатии, когда грубый пролиферативный процесс распространяется на дистальные отделы сетчатки, и при витреоретинальной дистрофии Фавре – Гольдмана и Вагнера.
Электроокулография – регистрация постоянного потенциала глаза с помощью накожных электродов, накладываемых на область наружного и внутреннего края нижнего века. Данный метод позволяет выявить патологические изменения пигментного эпителия сетчатки и фоторецепторов. Метод основан на том, что глаз представляет собой диполь: роговица имеет положительный заряд, пигментный эпителий – отрицательный, а имеющийся постоянный потенциал меняется при движении глаза в различных условиях адаптации.
Необходимыми условиями для нормальных световых и темновых колебаний постоянного потенциала является нормальное функционирование фоторецепторов и пигментного эпителия, контакт между этими слоями, а также адекватное кровоснабжение хориоидеи.
На ЭОГ отмечают следующие показатели: ■ базовый потенциал – постоянный потенциал, измеренный у пациента, длительно находящегося в условиях неизменной освещенности ■ потенциал светового подъема: при резком изменении световых условий от умеренного освещения к яркому свету происходит характерное увеличение базового потенциала сетчатки (световой подъем) ■ потенциал темнового спада: резкий переход от умеренной освещенности к темноте приводит к возникновению серии затухающих колебаний базового потенциала (темновое падение), достигающего минимума на 10–12–й минуте темновой адаптации.
Для клинических целей рассчитывают отношение потенциала светового пика к потенциалу темнового спада. Полученный результат умножают на 100 и получают так называемый коэффициент Ардена (КА), который считают нормальным, если он превышает 185%. С целью оценки патологических состояний сетчатки КА подразделяют на субнормальный (135–185%), анормальный (110–135%), погасший (100–110%), извращенный (ниже 100%).
Электроокулографию используют в диагностике различных заболеваний сетчатки дистрофической, воспалительной и токсической природы, при циркуляторных нарушениях и другой патологии, при которой в патологический процесс вовлекаются фоторецепторы и хориоидея.
Зрительные вызванные потенциалы (ЗВП) регистрируют для диагностики поражения зрительных путей, оценивая их состояние от периферических (сетчатка) до центральных отделов (первичные и вторичные зрительные центры). Метод регистрации ЗВП на вспышку света и реверсивный паттерн широко применяют в клинике для диагностики заболеваний зрительных путей и патологии зрительного нерва, при отеке, воспалении, атрофии, компрессионных повреждениях травматического и опухолевого генеза, локализации патологического процесса в хиазме, зрительном тракте и коре головного мозга, амблиопии и заболеваниях сетчатки.
ЗВП отражают в основном электрическую активность макулярной области, что связано с ее бблыпим представительством по сравнению с периферией в шпорной борозде. В качестве стимулов обычно используют диффузные вспышки света и пространственно–структурированные стимулы в виде шахматных паттернов и решеток с прямоугольным профилем освещенности. Виды ЗВП зависят от характера стимула: ЗВП на вспышку света называется вспышечным, на паттерн–стимул – паттерн–ЗВП. При регистрации этой формы ЗВП стимулы предъявляют либо в режиме включения–выключения, когда средняя освещенность паттерна и сменяющего его гомогенного поля постоянна, либо в режиме реверсии, когда в постоянно присутствующем на экране монитора изображении шахматного поля белые квадраты сменяются черными, а черные – белыми. ЗВП на вспышку позволяют получить ориентировочную информацию о состоянии зрительного нерва и зрительного пути выше хиазмы.
ЗВП дополняют результаты электроретинографии и являются единственным источником информации о зрительной системе в тех случаях, когда ЭРГ невозможно зарегистрировать по тем или иным причинам.
Критериями клинически значимых отклонений при оценке ЗВП являются отсутствие ответа или значительное снижение амплитуды, удлинение латентности всех пиков, значительные различия в амплитуде и латентности при стимуляции правого и левого. У новорожденных или неконтактных больных нормальные ЗВП еще не доказывают наличие сознания и восприятие зрительных образов, а могут лишь свидетельствовать о сохранности светочувствительности.
Важную роль в дифференциальной диагностике заболеваний сетчатки и хориоидеи играют также флюоресцентная ангиография, ультразвуковые исследования, сканирующая лазерная офтальмоскопия, оптическая когерентная томография.
Аномалии развития сетчатки
Аномалии развития оболочек глаза выявляют сразу после рождения. Возникновение аномалий обусловливают мутация генов, хромосомные аномалии, воздействие экзогенных и эндогенных токсических факторов во внутриутробном периоде развития. Большую роль в возникновении аномалий играют инфекционные заболевания матери в период беременности и такие факторы окружающей среды, как лекарственные препараты, токсины, радиация и др., которые воздействуют на зародыш. Наиболее грубые изменения наблюдаются при воздействии вредных факторов на плод в первом триместре беременности. Из наиболее часто встречающихся инфекций отмечена краснуха, токсоплазмоз, сифилис, цитомегаловирусная инфекция, простой герпес и СПИД. К лекарственным средствам и веществам, являющимся причиной развития аномалий и врожденных заболеваний сетчатки, относят талидомид, кокаин, этанол (эмбриональный алкогольный синдром).К аномалиям развития сетчатки относят колобому сетчатки, аплазию, дисплазию и гипоплазию сетчатки, альбинизм, врожденную гиперплазию пигментного эпителия, миелиновые нервные волокна, врожденные сосудистые аномалии, факоматозы.
Колобома сетчатки – отсутствие сетчатки на ограниченном участке. Обычно она ассоциируется с колобомой радужки и хориоидеи. Колобома сетчатки может располагаться в центре или на периферии в нижней половине глазного яблока. Ее возникновение связано с неполным закрытием эмбриональной щели. Офтальмоскопически колобома выглядит как ограниченная область белого цвета овальной или круглой формы с ровными краями, расположенная близко или прилежащая к диску зрительного нерва. Там, где отсутствует сетчатка и хориоидея, обнажена склера. Колобома может сочетаться с микрофтальмом, аномалиями скелета и другими дефектами.
Дисплазия (от греч. dis – нарушение, plasis – развитие) – аномалия развития сетчатки в ходе эмбриогенеза, выражающаяся в нарушении нормального соотношения клеточных элементов. К этой форме относят неприлегание сетчатки – редко наблюдающаяся аномалия, причина развития которой заключается в недостаточной инвагинации оптического везикула. Дисплазия сетчатки является характерным признаком трисомии 13 и синдрома Вокера – Варбурга, сочетается с другими пороками развития глаза, мозжечка, мышечной ткани.
Альбинизм – генетически детерминированное нарушение формирования зрительной системы, ассоциированное с изменением синтеза меланина.
Для больных с альбинизмом характерны нистагм, различные нарушения рефракции в сочетании с астигматизмом, снижение зрения, слабая пигментация глазного дна (рис. 15.3), дисплазия макулярной области и нарушение перекреста зрительного нерва. Описанным аномалиям соответствуют нарушения цветового зрения и яркостной чувствительности, а также супернормальная ЭРГ и межполушарная асимметрия ЗВП. Тирозиназонегативный альбинизм обусловлен отсутствием синтеза фермента тирозиназы и пигмента меланина. У таких пациентов белые волосы и кожа, они не способны к загару. Радужка у них светлая, легко просвечиваемая, рефлекс с глазного дна ярко–розовый и виден на расстоянии. Другая форма этого заболевания – тирозиназопозитивный альбинизм, при котором, наоборот, сохраняется способность к синтезу меланина, но отсутствует его нормальное накопление. Кожа этих пациентов малопигментирована, но способна к загару, волосы светлые или с желтым оттенком, нарушения зрения выражены в меньшей степени.
Лечения альбинизма в настоящее время не существует. Оптимальный подход к оказанию помощи этим пациентам – очковая коррекция с применением светофильтров для защиты глаз от повреждающего действия яркого света.
Врожденная гиперплазия пигментного эпителия сетчатки проявляется очаговой гиперпигментацией. Сгруппированные пигментные пятна напоминают медвежий след. Очаги гиперпигментации могут быть единичными и множественными. Сетчатка вокруг них не изменена. Очаги пигментации редко увеличиваются и подвергаются малигнизации.
Миелиновые нервные волокна относят к аномалиям развития (рис. 15.4). В одних руководствах их описывают как аномалии развития сетчатки, в других – зрительного нерва.
В норме миелиновое покрытие волокон зрительного нерва обычно заканчивается на заднем крае решетчатой пластинки. Иногда оно распространяется дальше диска зрительного нерва и переходит на нервные волокна нейронов сетчатки второго порядка. Офтальмоскопически миелиновые нервные волокна выглядят как белые блестящие радиально расположенные полосы, идущие от диска зрительного нерва к периферии. Эти волокна могут быть не связаны с диском зрительного нерва. Обычно при их наличии не возникает никаких симптомов, но иногда в поле зрения могут возникать скотомы.
Врожденные сосудистые аномалии проявляются в виде гроздьевидной ангиомы, капиллярной гемангиомы Гиппеля–Линдау, болезни Коатса, ретинопатии недоношенных, кавернозной гемангиомы сетчатки, просовидных (милиарных) аневризм сетчатки Лебера, парафовеальных телеангиэктазий, капиллярной гемангиомы сетчатки и др.
Гроздьевидная ангиома – односторонняя аномалия, характерными офтальмоскопическими признаками которой являются значительное расширение и извитость артерий, вен и артериовенозных шунтов. Сочетание ее с церебральной сосудистой патологией носит название "синдром Вабурна–Мазона", при котором снижено центральное зрение. Как правило, болезнь не прогрессирует. Лечение не проводят.
Болезнь Коатса – врожденные аномалии сосудов, включающие телеангиэктазии сетчатки, микро– и макроаневризмы, которые приводят к экссудации, а со временем – к отслойке сетчатки (рис. 15.5). Некоторые авторы относят болезнь Коатса к сосудистым заболеваниям сетчатки. Болезнь имеет также название "наружный геморрагический ретинит". Болезнь Коатса – одностороннее заболевание, проявляется в раннем детском возрасте, чаще (90%) у мальчиков.
Отложения твердого экссудата ярко–желтого цвета обнаруживают в субретинальном пространстве в заднем полюсе глаза. В поздних стадиях заболевания развиваются катаракта, неоваскулярная глаукома, субатрофия глазного яблока. Формы средней тяжести представлены только телеагиэктазиями.
Дифференцируют от опухолевых и других процессов, которые могут маскироваться отслоенной сетчаткой и экссудатом, а также от ретинопатии недоношенных.
Целью лечения является облитерация аномальных сосудов для предотвращения экссудации: проводят лазерфотокоагуляцию и криотерапию.
При распространенной экссудативной отслойке сетчатки целесообразно хирургическое лечение.
Факоматозы относят к врожденным порокам развития. Они имеют характерные системные и глазные проявления: наличие гемангиомоподобных образований, гамартом или узлов. Факоматозы включают нейрофиброматоз Реклингаузена, туберозный склероз, болезнь Гиппеля–Линдау, характеризующиеся аутосомно–доминантным типом наследования, а также спорадически выявляемый синдром Стерджа–Вебера–Краббе. Причиной заболевания является мутация гена – супрессора опухоли, который идентифицирован при всех доминантных видах заболевания.
Нейрофиброматоз Реклингаузена (НФ–1) характеризуется наличием опухоли шванновских клеток, которая часто проявляется на коже как множественная фиброма (mollus–cum). Ген, ответственный за развитие НФ–1, локализуется в 17–й хромосоме в локусе 17qll.2. Диффузная нейрофиброматозная инфильтрация является причиной развития деформирующей нейроматозной слоновости. Диагностическим критерием служит наличие на коже более 6 пятен цвета кофе с молоком (величиной более 1,5 см).
Глазные проявления НФ–1 многочисленны и включают в разных сочетаниях плексиформную нейрофиброму век и глазницы, S–образную глазную щель, врожденную глаукому (если верхнее веко имеет нейрофиброматозную ткань), меланоцитарные гамартомы на радужке (узелки Лита), гамартомную инфильтрацию сосудистой оболочки глазного яблока с корпускулоподобными тельцами, глиому зрительного нерва, астроцитарную гамартому сетчатки, утолщение и проминирование роговичных нервов, конъюнктивальную нейрофиброму, пульсирующий экзофтальм, буфтальм.
Гамартома – опухоль, развивающаяся из эмбриональной ткани, дифференцировка которой задержалась по сравнению с дифференцировкой органа–носителя. Клетки, образующие гамартому, имеют нормальную структуру, но плотность клеточных популяций и их соотношение аномальны. Меланоцитарные гамартомы (узелки Пиша) развиваются до кожных проявлений, наблюдаются на радужке у всех взрослых больных и являются диагностическим критерием.
Плексиформная нейрофиброма представляет собой клубок переплетенных гипертрофированных нервов, которые выглядят бугристыми в связи с пролиферацией шванновских клеток и эндоневральных фибробластов в муциновом межклеточном веществе.
Частыми осложнениями НФ–1 являются такие сосудистые нарушения, как сужение просвета сосудов и их окклюзия. В дальнейшем развивается периваскулярная фиброглиальная пролиферация. Характерными признаками ишемии сетчатки при НФ–1 являются периферические аваскулярные зоны, артериовенозные шунты, преретинальные фиброглиальные мембраны, атрофия диска зрительного нерва.
Опухоли, приводящие к деформации окружающих тканей и функциональным нарушениям, подлежат удалению.
Нейрофиброматоз 2–го типа (НФ–2) – редко наблюдаемое заболевание. Характерный симптом – двусторонняя шваннома восьмой пары (слуховой нерв) черепных нервов. Глазные проявления включают комбинированные гамартомы сетчатки и пигментного эпителия, глиому или менингиому зрительного нерва.
Болезнь Гиппеля – Ландау – наследственное заболевание с локализацией гена в хромосоме 3р25. Часто изменения обнаруживают случайно при обследовании детей по поводу косоглазия или диспансерном осмотре. Ангиомы сетчатки имеют вид черешни с большими извитыми питающими и дренирующими сосудами (рис. 15.6). Эти образования называют гемангиобластомами сетчатки, поскольку гистологически они сходны с гемангиобластомами, которые развиваются в мозжечке. В сетчатке гемангиобластомы имеют эндофитный или экзофитный рост, в процесс могут быть вовлечены диск зрительного нерва и зрительный нерв; часто гемангиобластомы сочетаются с макулопатиями. В патологический процесс вовлекаются другие органы. Наряду с ангиоматозом сетчатки выявляют кистоз почек или почечную карциному, феохромоцитому и др.
Вследствие нарушения проницаемости стенок капилляров в них может накапливаться суб– и интраретинальный экссудат, содержащий липиды. В поздних стадиях болезни развивается экссудативная отслойка сетчатки. В артериовенозной фазе ФАГ отмечается накопление контрастного вещества в ангиоме, в поздней фазе определяется повышенная проницаемость флюоресцеина, обусловленная неполноценностью сосудов опухоли.
Лечение: криотерапия, лазерная коагуляция, хирургическое удаление опухоли.
Туберозный склероз (болезнь Бурневилля) – редко наблюдаемое заболевание с аутосомно–доминантным типом наследования, обусловленное двумя генами, локализующимися в 9–й и 16–й хромосомах. Классической триадой туберозного склероза являются эпилепсия, умственная отсталость и поражение кожи лица (ангиофибромы). На глазном дне возле диска зрительного нерва выявляют беловатые опухолевидные образования, напоминающие тутовую ягоду. Астроцитомы, образующиеся на диске зрительного нерва, называют гигантскими друзами зрительного нерва. Они могут быть ошибочно приняты за ретинобластому.
Лечение проводят, как правило, в неврологической клинике. При нарастании неврологической симптоматики больные умирают рано.
Болезни сетчатки
Болезни сетчатки очень разнообразны. Они обусловлены воздействием различных факторов, приводящих к патологоанатомическим и патологофизиологическим изменениям, что в свою очередь определяет нарушения зрительных функций и наличие характерных симптомов. Среди заболеваний сетчатки выделяют наследственные и врожденные дистрофии, болезни, обусловленные инфекциями, паразитами и аллергическими агентами, сосудистыми нарушениями и опухолями. Несмотря на разнообразие заболеваний сетчатки, патологоанатомические и патофизиологические проявления могут быть сходными при разных нозологических формах.К патологическим процессам, наблюдаемым в сетчатке, относят дистрофии, которые могут быть генетически детерминированными или вторичными, воспаление и отек, ишемию и некроз, кровоизлияния, отложение твердых или мягких экссудатов и липидов, ретиношизис и отслойку сетчатки, фиброз, пролиферацию и образование неоваскулярных мембран, гиперплазию и гипоплазию пигментного эпителия, опухоли, ангиоидные полосы. Все эти процессы можно выявить при офтальмоскопии глазного дна.
Наследственные генерализованные дистрофии
Фоторецепторные дистрофии сетчатки различаются типом наследования, характером нарушения зрительных функций и картиной глазного дна в зависимости от первичной локализации патологического процесса в различных структурах: мембране Бруха, пигментном эпителии сетчатки, в комплексе пигментный эпителий – фоторецепторы, фоторецепторах и внутренних слоях сетчатки. Дистрофии сетчатки как центральной, так и периферической локализации могут быть следствием мутации гена родопсина и перифирина. При этом симптомом, объединяющим эти заболевания, является стационарная ночная слепота.К настоящему времени известно И хромосомных районов, которые содержат гены, мутации которых являются причиной развития пигментного ретинита, и для каждого генетического типа пигментного ретинита характерны аллельная и неаллельная разновидности.
Пигментный ретинит (пигментное перерождение сетчатки, тапеторетинальная дегенерация) – заболевание, характеризующееся поражением пигментного эпителия и фоторецепторов с разными типами наследования: аутосомно–доминантным, аутосомно–рецессивным или сцепленным с полом. Возникает в результате образования дефектов генетического кода, следствием чего является аномальный состав специфических белков. Течение заболевания при разных типах наследования имеет некоторые особенности. Ген родопсина – первый идентифицированный ген, мутации которого являются причиной развития пигментного ретинита с аутосомно–доминантным типом наследования.
 Рис. 15.7. Пигментный ретинит.
а – глазное дно больной пигментным ретинитом; б – ЭРГ у членов семьи больной: 1 – нормальная у здорового мужа, 2 – субнормальная у сына – носителя патологического гена, 3 – нерегистрируемая у больной.
Рис. 15.7. Пигментный ретинит.
а – глазное дно больной пигментным ретинитом; б – ЭРГ у членов семьи больной: 1 – нормальная у здорового мужа, 2 – субнормальная у сына – носителя патологического гена, 3 – нерегистрируемая у больной.
Заболевание проявляется в раннем детском возрасте и характеризуется триадой симптомов: типичнымипигментными очагами (рис. 15.7,а) на средней периферии глазного дна и по ходу венул (их называют костными тельцами), восковидной бледностью диска зрительного нерва, сужением артериол.
У больных с пигментным ретинитом со временем могут развиться пигментные изменения в макулярной области в связи с дегенерацией фоторецепторов, что сопровождается снижением остроты зрения, задней отслойкой стекловидного тела и отложением в нем нежного пигмента. Возможно возникновение макулярного отека, обусловленного проникновением жидкости из хориоидеи через пигментный эпителий, а по мере развития процесса – преретинального макулярного фиброза. У больных с пигментным ретинитом с большей частотой, чем в общей популяции, встречаются друзы диска зрительного нерва, задняя субкапсулярная катаракта, открытоугольная глаукома, кератоконус и миопия. Хориоидея долго остается интактной и вовлекается в процесс только в поздних стадиях заболевания.
В связи с поражением палочковой системы возникает ночная слепота, или никталопия. Темновая адаптация нарушена уже в начальной стадии заболевания, порог световой чувствительности повышен как в палочковой, так и в колбочковой части.
Функциональные методы исследования позволяют выявить прогрессирующие изменения в фоторецепторах. При периметрии на средней периферии (30–50°) обнаруживают кольцевые полные и неполные скотомы, которые расширяются к периферии и центру. В поздней стадии заболевания поле зрения концентрически суживается до 10°, сохраняется лишь центральное трубчатое зрение.
Отсутствие или резкое снижение общей ЭРГ является патогномоничным признаком пигментного ретинита (рис. 15.7,6).
Локальная ЭРГ долго остается нормальной, а изменения наступают при вовлечении в патологический процесс колбочковой системы макулярной области. У носителей патологического гена отмечаются редуцированная ЭРГ и удлиненный латентный период b–волны ЭРГ, несмотря на нормальное глазное дно.
Атипичные формы пигментного ретинита. К другим формам пигментного ретинита относятся пигментный инвертированный ретинит (центральная форма), пигментный ретинит без пигмента, белоточечный пигментный ретинит и псевдопигментный ретинит. Каждая из этих форм имеет характерную офтальмоскопическую картину и электроретинографическую симптоматику.
Пигментный инвертированный ретинит (центральная форма). В отличие от типичной формы пигментного ретинита заболевание начинается в макулярной области и поражения колбочковой системы более значительны, чем палочковой. В первую очередь снижается центральное и цветовое зрение, появляется фотофобия (светобоязнь). В макулярной области отмечаются характерные пигментные изменения, которые могут сочетаться с дистрофическими изменениями на периферии. В таких случаях одним из основных симптомов является отсутствие дневного зрения. В поле зрения центральная скотома, на ЭРГ значительно редуцированы колбочковые компоненты по сравнению с палочковыми.
Пигментный ретинит без пигмента. Название связано с отсутствием характерных для пигментного ретинита пигментных отложений в виде костных телец при наличии симптомов, сходных с проявлениями пигментного ретинита, и нерегистрируемой ЭРГ.
Белоточечный пигментный ретинит. Характерным офтальмоскопическим признаком являются множественные белые точечные пятна по всему глазному дну с сопутствующими пигментными изменениями ("ткань, изъеденная молью”) или без них. Функциональные симптомы сходны с проявлениями пигментного ретинита. Заболевание необходимо дифференцировать от стационарной врожденной ночной слепоты и белоточечного глазного дна (fundus albipunctatus).
Псевдопигментный ретинит – ненаследственное заболевание. Причиной его возникновения могут быть воспалительные процессы в сетчатке и хориоидее, побочное действие лекарственных препаратов (тиоридазин, меллирил, хлороквин, дефероксамин, клофазамин и др.), состояние после травмы, отслойки сетчатки и т. д. На глазном дне выявляют изменения, сходные с таковыми при пигментном ретините. Основным отличительным симптомом является нормальная или незначительно сниженная ЭРГ. При этой форме никогда не бывает нерегистрируемой или резко сниженной ЭРГ.
В настоящее время патогенетически обоснованного лечения пигментного ретинита не существует. Заместительная или стимулирующая терапия неэффективна. Больным с пигментным ретинитом рекомендуют носить темные защитные очки для предотвращения повреждающего действия света, подбор максимальной очковой коррекции остроты зрения, назначают симптоматическое лечение: при макулярном отеке – системное и местное использование диуретиков (ингибиторов карбоангидразы), например диакарба, диамокса (ацетазоламид); при наличии помутнений хрусталика хирургическое лечение катаракты для улучшения остроты зрения, при наличии неоваскуляризации для профилактики осложнений проводят фотокоагуляцию сосудов, назначают сосудистые препараты. Больные, их родственники и дети должны проходить генетическое консультирование, исследование других органов и систем для исключения синдромных поражений и других болезней.
Идентификация патологического гена и его мутаций является основой понимания патогенеза заболевания, прогнозирования течения процесса и поиска путей рациональной терапии.
В настоящее время в эксперименте предпринимаются попытки трансплантации клеток пигментного эпителия и нейрональных клеток сетчатки от недельного зародыша. Новый многообещающий подход к лечению пигментного ретинита связан с генной терапией, основанной на субретинальном введении аденовируса, с содержанием внутри капсулы здоровых мини–хромосом. Ученые предполагают, что вирусы, проникая в клетки пигментного эпителия, способствуют замещению мутированных генов.
Генерализованная наследственная дистрофия сетчатки, связанная с системными заболеваниями и нарушениями метаболизма. Существует множество системных расстройств, которые сочетаются с атипичными формами пигментного ретинита. К настоящему времени известно около 100 заболеваний с различными глазными нарушениями, обусловленных нарушением метаболизма липидов, углеводов, протеинов. Недостаточность внутриклеточных энзимов приводит к мутациям генов, что определяет различную генетическую патологию, в том числе исчезновение или дистрофию фоторецепторных клеток.
К специфическим системным заболеваниям, сочетающимся с пигментным ретинитом, относят нарушения метаболизма углеводов (мукополисахароидозы), липидов (муколипидозы, фукозидоз, сероидные липофусцинозы), липопротеинов и протеинов, поражения центральной нервной системы, синдромы Ушера, Лоренса–Муна–Барде–Бидля и др.
Врожденный амавроз Лебера – наиболее тяжелое проявление пигментного ретинита (генерализованная форма), наблюдающаяся с рождения. Основные симптомы: отсутствие центрального зрения, нерегистрируемая или резко субнормальная ЭРГ, нистагм. Диагностика врожденного амавроза Лебера очень сложна, поскольку выявляемые у больных симптомы: косоглазие, кератоконус, гиперметропия высокой степени, неврологические и нейромышечные нарушения, снижение слуха, умственная отсталость, могут быть и при других системных заболеваниях.
Чаще отмечается аутосомно–рецессивный тип передачи заболевания, и его еще недавно связывали с двумя различными генами, в том числе с мутацией гена родопсина. В настоящее время амавроз Лебера рассматривают как гетерогенную группу нарушений, при которых поражаются палочки и колбочки.
При этом заболевании дети либо рождаются слепыми, либо теряют зрение в возрасте около 10 лет. В течение первых 3–4 мес жизни большинство родителей отмечают у них отсутствие фиксации предметов и реакции на свет, типичные глазные симптомы, характерные для детей, рожденных слепыми: блуждающий взор и нистагм, которые отмечаются уже в первые месяцы жизни. У младенцев глазное дно может выглядеть нормальным, однако со временем патологические изменения обязательно появляются. Глазные симптомы включают различные пигментные изменения в заднем полюсе глаза от гиперпигментированных до непигментированных очагов по типу соль с перцем, миграцию пигмента в сетчатке и пигментные скопления, атрофию пигментного эпителия и капилляров хориоидеи, реже – множественные неравномерно расположенные желтовато–белые пятна на периферии и средней периферии сетчатки. Пигментные отложения в виде костных телец на периферии глазного дна обнаруживают почти у всех больных с амаврозом Лебера в возрасте 8–10 лет, однако эти отложения могут быть очень мелкими, напоминают сыпь при краснухе. Диск зрительного нерва, как правило, бледный, сосуды сетчатки сужены. Изменения на глазном дне обычно прогрессируют, но в отличие от типичного пигментного ретинита функциональные изменения (острота зрения, поле зрения, ЭРГ) обычно остаются такими же, как при первоначальном осмотре. Со временем, после 15 лет, у больных с амаврозом Лебера может развиться кератоконус.
При микроскопическом исследовании выявляют субретинальные включения, состоящие из отторгнутых наружных сегментов фоторецепторов и макрофагов, на участках, соответствующих офтальмоскопически видимым белым пятнам. Наружные сегменты палочек отсутствуют, сохраняется небольшое количество измененных колбочек, другие клеточные элементы представляют собой недифференцированные фоторецепторы и эмбриональные клетки пигментного эпителия.
Причиной заболевания является отсутствие дифференциации клеток пигментного эпителия и фоторецепторов.
Дифференциальную диагностику проводят с доминантной атрофией зрительного нерва, при которой прогноз относительно зрения значительно лучше, а также с подобными изменениями при краснухе и врожденном сифилисе.
Основным симптомом врожденного амавроза Лебера, на котором основана дифференциальная диагностика, является либо нерегистрируемая, либо резко субнормальная ЭРГ, в то время как при атрофии зрительного нерва, сифилисе и краснухе ЭРГ либо нормальная, либо субнормальная. При врожденном амаврозе Лебера возможны различные распространенные неврологические и нейродегенеративные нарушения, церебральная атрофия, отмечаются задержка умственного развития, болезни почек. Однако интеллектуальное развитие детей с врожденным амаврозом Лебера может быть нормальным.
Фоторецепторные дисфункции. Дисфункции палочковой системы. Врожденная стационарная ночная слепота. Врожденная стационарная ночная слепота, или никталопия (отсутствие ночного зрения), – непрогрессирующее заболевание, причиной которого является дисфункция палочковой системы. При гистологическом исследовании структурных изменений в фоторецепторах не выявляют. Результаты электрофизиологических исследований подтверждают наличие первичного дефекта в наружном плексиформном (синаптическом) слое, так как нормальный палочковый сигнал не достигает биполярных клеток. Выделяют различные типы стационарной ночной слепоты, которые дифференцируются по ЭРГ.
Врожденная стационарная ночная слепота с нормальным глазным дном характеризуется разными типами наследования: аутосомно–доминантным, аутосомно–рецессивным и сцепленным с Х–хромосомой.
Врожденная стационарная ночная слепота с изменением глазного дна. К этой форме заболевания относится болезнь Огуши – заболевание с аутосомно–рецессивным типом наследования, которое отличается от стационарной врожденной ночной слепоты изменениями на глазном дне, проявляющимися желтоватым металлическим блеском, более выраженным в заднем полюсе. Макулярная область и сосуды на этом фоне выглядят рельефно. После 3 ч темновой адаптации глазное дно становится нормальным (феномен Мицуо). После световой адаптации глазное дно вновь медленно приобретает металлический блеск. При исследовании темновой адаптации выявляют заметное удлинение палочкового порога при нормальной колбочковой адаптации. Концентрация и кинетика родопсина в норме.
Белоточечное глазное дно (fundus albipunctatus) сравнивают со звездным небом ночью, поскольку на средней периферии глазногодна и в макулярной области регулярно расположены мириады беловатых мелких нежных пятнышек (рис. 15.8). Заболевание с аутосомно–рецессивным типом наследования. На ФАГ выявляют фокальные области гиперфлюоресценции не связанные с белыми пятнами, которые на ангиограммах не видны.
В отличие от других форм стационарной ночной слепоты при белоточечном глазном дне отмечено замедление регенерации зрительного пигмента как в палочках, так и в колбочках. Амплитуда фотопических и скотопических α– и b–волн ЭРГ снижена при стандартных условиях регистрации. После нескольких часов темновой адаптации скотопический ответ ЭРГ медленно возвращается к норме.
Дисфункции колбочковой системы (синдром колбочковой дисфункции) проявляются нарушением цветовосприятия или полной ахромазией (невосприятием цветового спектра; см. главу 4).
Наследственные периферические дистрофии сетчатки
При этих формах дистрофии поражается оптически недеятельная часть сетчатки около зубчатой линии. В патологический процесс часто вовлекаются не только сетчатка и хориоидея, но и стекловидное тело, в связи с чем они получили название "периферические витреохориоретинальные дистрофии".Х–хромосомный ювенильный ретиношизис относится к наследственным витреоретинальным дегенерациям, сцепленным с полом. Зрение снижается в первой декаде жизни. Болеют мужчины. Ген RS1, ответственный за развитие Х–хромосомного ретиношизиса, локализуется на коротком плече 22–й хромосомы.
Расслоение сетчатки – основной клинический признак заболевания (см. рис. 15.15). Оно возникает в слое нервных волокон сетчатки. Предполагают, что ретиношизис является результатом нарушения функции опорных мюллеровских клеток. Ретиношизис сопровождается дистрофическими изменениями сетчатки, представленными участками золотисто–серебристого цвета; белые древовидные структуры образуются аномальными сосудами, проницаемость стенок которых повышена. На периферии часто формируются гигантские кисты сетчатки, окруженные пигментом. Эта форма заболевания, называемая буллезной, обычно наблюдается у детей раннего возраста и сочетается с косоглазием и нистагмом. Кисты сетчатки могут самопроизвольно спадаться. При прогрессировании ретиношизиса развиваются глиальная пролиферация, неоваскуляризаЦия сетчатки, возможны множественные аркоподобные разрывы, гемофтальм или кровоизлияния в полость кист. В стекловидном теле определяются фиброзные тяжи, аваскулярные или васкулярные мембраны и вакуоли. Вследствие сращения тяжей с сетчаткой возникает натяжение (тракция), что приводит к возникновению тракционных разрывов сетчатки и ее отслойке. В макулярной области наблюдаются звездоподобные складки или радиальные линии в виде звезды ("спицы в колесе"). Острота зрения значительно снижена.
Ведущую роль в диагностике играют офтальмоскопическая картина заболевания и ЭРГ, которая резко субнормальна.
Лечение: лазерная коагуляция сетчатки и хирургическое лечение. При отслойке сетчатки производят витрэктомию, интравитреальную тампонаду перфторуглеродами или силиконовым маслом, экстрасклеральное пломбирование.
Болезнь Гольдмана – Фавре – прогрессирующая витреоретинальная дистрофия с аутосомно–рецессивным типом наследования, которая характеризуется сочетанием пигментного ретинита с костными тельцами, ретиношизисом (центральным и периферическим) и изменениями в стекловидном теле (дегенерация с формированием мембран). Нередко наблюдается осложненная катаракта. Частым осложнением является отслойка сетчатки.
Функциональные симптомы соответствуют клиническим проявлениям заболевания. Плохое сумеречное зрение и ночная слепота отмечаются уже в возрасте 5–10 лет. Острота зрения снижена, наблюдаются кольцевые скотомы или концентрическое сужение поля зрения. Темновая адаптация нарушена. Одним из основных симптомов является нерегистрируемая или резко субнормальная ЭРГ. Эффективных методов лечения в настоящее время нет. Назначают препараты, улучшающие микроциркуляцию и обменные процессы в сетчатке. При отслойке сетчатки производят хирургическое лечение.
Болезнь Вагнера также относится к витреоретинальным дистрофиям с аутосомно–доминантным типом наследования. Ген, ответственный за развитие болезни Вагнера, локализуется на длинном плече 5–й хромосомы. Основные клинические симптомы заболевания – наличие миопии, часто высокой степени, и преретинальных мембран при "оптически пустом" стекловидном теле в сочетании с ретиношизисом, дистрофией сетчатки и пигментного эпителия. Уже в возрасте 10–20 лет выявляют помутнения хрусталика, которые быстро прогрессируют; часто наблюдаются вторичная глаукома и отслойка сетчатки.
Диагноз устанавливают на основании семейного анамнеза, результатов биомикро– и офтальмоскопии, периметрии, электроретинографии и флюоресцентной ангиографии. При периметрии выявляют концентрическое сужение поля зрения, реже – кольцевидную скотому. ЭРГ резко субнормальная.
Наследственные центральные дистрофии сетчатки
Центральные (макулярные) дистрофии – это заболевания, локализованные в центральном отделе сетчатки, характеризующиеся прогрессирующим течением, типичной офтальмоскопической картиной и сходной функциональной симптоматикой: снижение центрального зрения, нарушение цветового зрения, снижение колбочковых компонентов ЭРГК наследственным наиболее распространенным макулярным дистрофиям с изменениями в пигментном эпителии сетчатки и фоторецепторах относят болезнь Штаргардта, желтопятнистое глазное дно, вителлиформную дистрофию Беста. Другая форма макулярных дистрофий характеризуется изменениями в мембране Бруха и пигментном эпителии сетчатки: доминантные друзы мембраны Бруха, дистрофия Сорсби, макулярная дегенерация, связанная с возрастом, и др. Далее представлены наиболее часто наблюдаемые наследственные дистрофии макулярной области.
Болезнь Штаргардта и желтопятнистое глазное дно (желтопятнистая дистрофия). Болезнь Штаргардта – дистрофия макулярной области сетчатки, которая начинается в пигментном эпителии и проявляется двусторонним снижением остроты зрения в возрасте 10–20 лет. Заболевание описано К. Штаргардтом еще в начале XX в. как наследственное заболевание макулярной области с полиморфной офтальмоскопической картиной: "битая бронза", "бычий глаз", атрофия хориоидеи и др.
Путем позиционного клонирования определен основной локус гена для болезни Штаргардта, экспрессирующегося в фоторецепторах, который был назван ABCR. При аутосомно–доминантном типе наследования болезни Штаргардта установлена локализация мутированных генов в хромосомах 13q и 6q14.
Результаты генетических исследований, проведенных в последние годы, свидетельствуют о том, что, несмотря на различия в клинической картине, пигментный ретинит, болезнь Штаргардта, желтопятнистое глазное дно и макулярная дегенерация, связанная с возрастом, являются аллельными нарушениями локуса ABCR.
Феномен "бычий глаз" офтальмоскопически виден как темный центр, окруженный широким кольцом гипопигментации, за которым обычно следует кольцо гиперпигментации (рис. 15.9, а). На ФАГ при типичном феномене "бычьего глаза" на нормальном фоне выявляются зоны отсутствия флюоресценции или гипофлюоресценции с видимыми хориокапилл ярами. Гистологически отмечаются увеличение количества пигмента в центральной зоне глазного дна, атрофия прилежащего пигментного эпителия сетчатки и комбинация атрофии и гипертрофии пигментного эпителия. Отсутствие флюоресценции в макулярной области объясняется накоплением в пигментном эпителии сетчатки липофусцина, который является экраном для флюоресцеина. Липофусцин, кроме того, ослабляет окислительную функцию лизосом и увеличивает pH клеток пигментного эпителия сетчатки, что приводит к потере их мембранной целости.
Встречается редкая форма желтопятнистой дистрофии без изменений в макулярной области. В этом случае между макулой и экватором видны множественные желтоватые пятна различной формы: округлые, овальные, удлиненные, которые могут сливаться или располагаться отдельно друг от друга (рис. 15.9,6). Со временем цвет, форма и размеры этих пятен могут изменяться; изменяется и картина на ФАГ: участки с гиперфлюоресценцией становятся гипофлюоресцирующими, что соответствует атрофии пигментного эпителия сетчатки.
У всех больных с болезнью Штаргардта выявляют относительные или абсолютные центральные скотомы разной величины в зависимости от распространения процесса. При желтопятнистой дистрофии поле зрения может быть в норме при отсутствии изменений в макулярной области.

 Рис. 15.9. Болезнь Штаргардта. а – глазное дно типа бычий глаз; б – желто–пятнистое глазное дно; в – ЭРГ при болезни Штаргардта: 1 – общая нормальная, 2 – локальная субнормальная.
Рис. 15.9. Болезнь Штаргардта. а – глазное дно типа бычий глаз; б – желто–пятнистое глазное дно; в – ЭРГ при болезни Штаргардта: 1 – общая нормальная, 2 – локальная субнормальная.
У большинства пациентов отмечается изменение цветового зрения по типу дейтеранопии, красно–зеленой дисхромазии или более выраженные. При желтопятнистой дистрофии цветовое зрение может быть нормальным.
Пространственная контрастная чувствительность при дистрофии Штаргардта значительно изменена во всем диапазоне частот со значительным снижением в области средних и полным ее отсутствием в области высоких пространственных частот – "паттерн колбочковой дистрофии". Контрастная чувствительность отсутствует в центральной области сетчатки в пределах 6–10°.
В начальных стадиях дистрофии Штаргардта и желтопятнистой дистрофии ЭРГ и ЭОГ остаются в пределах нормы, в развитых стадиях снижаются колбочковые компоненты ЭРГ и становятся субнормальными показатели ЭОГ. Локальная ЭРГ – субнормальна уже в ранних стадиях заболевания и становится нерегистрируемой по мере прогрессирования болезни (рис. 15.9, в).
Дифференциальную диагностику болезни Штаргардта следует проводить с доминантной прогрессирующей фовеальной дистрофией, колбочковой, колбочко–палочковой и палочко–колбочковой дистрофией, ювенильным ретиношизисом, вителлиформной макулярной дистрофией, приобретенными лекарственными дистрофиями (например, при хлороквиновой ретинопатии), при тяжелом токсикозе беременности.
Патогенетически обоснованного лечения не существует. Рекомендуется ношение солнцезащитных очков для предотвращения повреждающего действия света.
Желточная (вителлиформная) макулярная дистрофия Беста. Болезнь Беста – редко наблюдаемая двусторонняя дистрофия сетчатки в макулярной области, имеющая вид круглого желтоватого очага, похожего на свежий яичный желток, диаметром от 0,3 до 3 диаметров диска зрительного нерва (рис. 15.10).
Ген, ответственный за развитие болезни Беста, локализуется на длинном плече 11–й хромосомы (11q13). Тип наследования болезни Беста – аутосомно–доминантный.
В гистологических исследованиях установлено, что между клетками пигментного эпителия и нейроэпителия кумулируются гранулы вещества, подобного липофусцину, в субретинальном пространсгве и в хориоидее – макрофаги, нарушается структура мембраны Бруха, во внутренних сегментах фоторецепторов накапливаются кислые мукополисахариды. Со временем развивается дегенерация наружных сегментов фоторецепторов.
Течение заболевания обычно бессимптомное, его выявляют случайно при осмотре детей в возрасте 5–15 лет. Изредка пациенты предъявляют жалобы на затуманивание зрения, затруднения при чтении текстов с мелким шрифтом, метаморфопсии. Острота зрения варьирует в зависимости от стадии болезни от 0,02 до 1,0. Изменения в большинстве случаев асимметричные, двусторонние.
В зависимости от офтальмоскопических проявлений выделяют четыре стадии заболевания, хотя развитие макулярных изменений не всегда проходит через все стадии. Стадия 1 – минимальные нарушения пигментации в виде мелких желтых очажков в макуле; стадия II – классическая вигеллиформная киста в макуле; стадия III – разрыв кисты и различные фазы резорбции ее содержимого; стадия IV – формирование фиброглиального рубца с субретинальной неоваскуляризацией или без нее. Снижение остроты зрения обычно отмечается в III стадии заболевания, когда кисты разрываются. В результате резорбции и смещения содержимого кисты формируется картина "псевдогипопиона". Возможны субретинальные кровоизлияния и формирование субретинальной неоваскулярной мембраны, очень редки разрывы и отслойка сетчатки, с возрастом – развитие хориоидального склероза.
Диагноз устанавливают на основании результатов офтальмоскопии, флюоресцентной ангиографии, электроретинографии и электроокулографии. Помощь в диагностике может оказать обследование других членов семьи.
На ФАГ в I стадии заболевания отмечается локальная гиперфлюоресценция в зонах атрофии пигментного эпителия, во II стадии – отсутствие флюоресценции в области кисты. После разрыва кисты определяются гиперфлюоресценция в ее верхней половине и "блок" флюоресценции в нижней. После резорбции содержимого кисты в макуле выявляют окончатые дефекты.
Патогномоничный признак болезни Беста – патологическая ЭОГ. Общая и локальная ЭРГ не изменяются. В III–IV стадиях болезни выявляют центральную скотому в поле зрения.
Патогенетически обоснованного лечения не существует. В случае формирования субретинальной неоваскулярной мембраны может быть проведена лазерная фотокоагуляция.
Желточная вителлиформная макулодистрофия взрослых. В отличие от болезни Беста фовеолярные изменения развиваются в зрелом возрасте, имеют меньшие размеры и не прогрессируют. ЭОГ, как правило, не изменена.
Инволюционная макулярная дистрофия сетчатки (синонимы: возрастная, сенильная, центральная хориоретинальная дистрофия, макулярная дистрофия, связанная с возрастом; англ. Age–related macular dystrophy – АМД) является основной причиной снижения зрения у людей старше 50 лет. Это генетически обусловленное заболевание с первичной локализацией патологического процесса в пигментном эпителии сетчатки, мембране Бруха и хориокапиллярах макулярной области.
Офтальмоскопически выделяют следующие признаки: друзы (узелковые утолщения базальной мембраны пигментного эпителия сетчатки), пигментную (географическую) эпителиальную атрофию или гиперпигментацию, отслойку пигментного эпителия, субретинальные экссудаты (желтая экссудативная отслойка), кровоизлияния, фиброваскулярные рубцы, хориоидальную неоваскулярную мембрану, кровоизлияния в стекловидное тело (рис. 15.11).
По патоанатомическим признакам выделены три основные формы дистрофии: доминантные друзы мембраны Бруха, неэкссудативная и экссудативная формы.
К клиническим симптомам относятся постепенное снижение центрального зрения, метаморфопсии, центральная скотома. Друзы являются ранним клиническим проявлением заболевания. Нарушения зрительных функций появляются с развитием макулярной дистрофии. Острота зрения коррелирует с изменениями локальной ЭРГ, в то время как общая ЭРГ остается нормальной (рис. 15.12). Наиболее часто наблюдается сухая, или атрофическая, форма, которая характеризуется атрофией пигментного эпителия. Реже отмечается экссудативная, "влажная'', форма, для которой характерно быстрое ухудшение остроты зрения, связанное с развитием неоваскулярных мембран, фиброваскулярных рубцов и кровоизлияний в сетчатку и стекловидное тело. Отслойка пигментного эпителия часто сочетается с неоваскулярной мембраной и является признаком экссудативной формы возрастной центральной дистрофии сетчатки.
 Рис. 15.12. Локальная ЭРГ при разных стадиях макулярной дегенерации, связанной с возрастом.
1 – нормальная, 2 – субнормальная. 3 – нерегистрируемая.
Рис. 15.12. Локальная ЭРГ при разных стадиях макулярной дегенерации, связанной с возрастом.
1 – нормальная, 2 – субнормальная. 3 – нерегистрируемая.
Доминантные друзы мембраны Бруха – двустороннее заболевание с аутосомно–доминантным типом исследования, протекающее бессимптомно. Друзы располагаются в макулярной области перипапиллярно, редко – на периферии глазного дна. Они имеют разные форму, размер и цвет (от желтого до белого), могут быть окружены пигментом.
На ФАГ отмечаются типичные множественные фокальные области ограниченной мелкоточечной поздней гиперфлюоресценции. До сих пор остается невыясненным вопрос, всегда ли друзы предшествуют возрастной, макулярной дистрофии или могут являться самостоятельным заболеванием.
При неэкссудативной форме заболевания обнаруживают друзы в макулярной области и различные проявления патологии пигментного эпителия сетчатки.
Географическая атрофия пигментного эпителия представлена отдельными большими депигментированными зонами, через которые видны крупные хориоидальные сосуды, образующие подковообразное кольцо вокруг фовеальной области, где до последней стадии сохраняется ксантофильный пигмент. Риск образования неоваскулярной мембраны невелик. Географическая атрофия может развиваться на фоне средних и больших друз с нечеткими границами, исчезающего, разрушающегося или отслоенного пигментного эпителия сетчатки; отмечается минерализация друз, которые в этом случае напоминают блестящие ярко–желтые включения.
Негеографическая атрофия не имеет четких границ, выглядит как мелкоточечная гипопигментация в сочетании с гиперпигментацией пигментного эпителия.
Очаговая гиперпигментация может быть самостоятельной патологией или сочетаться с друзами либо прилегающими областями атрофии пигментного эпителия и его отслойки при неоваскуляризации хориоидеи (образование неоваскулярной мембраны). Разрывы пигментного эпителия являются осложнением отслойки сетчатки и обусловлены возникающим натяжением тканей.
Экссудативная форма макулярной дегенерации, связанной с возрастом, проявляется экссудативной отслойкой сенсорной сетчатки с субретинальными геморрагиями и экссудацией липидов, грязно–серым или желтым отеком макулы (цистоидный макулярный отек), образованием складок хориоидеи, отслойкой пигментного эпителия, субретинальным фиброзом. Субретинальный экссудат обычно непрозрачный из–за высокой концентрации протеинов, липидов, продуктов крови, наличия фибрина. Утолщение и серозная отслойка пигментного эпителия сетчатки возникают вследствие образования неоваскуляризации под пигментным эпителием. „
Хориоидальная неоваскуляризация представляет собой прорастание кровеносных сосудов через мембрану Бруха в пигментный эпителий. Под нейро– и пигментный эпителий просачиваются кровь, липиды и плазма. Они стимулируют фиброз, который разрушаЬт пигментный эпителий и наружные слои сетчатки. Предполагают, что перекисное окисление липидов в пигментном эпителии способно индуцировать внутриглазную неоваскуляризацию вследствие освобождения цитокинов и других факторов роста. ФАГ помогает в диагностике хориоидальной неоваскуляризации.
Лечение направлено на замедление патологического процесса. С этой целью прежде всего используют антиоксиданты. Клинические наблюдения показывают, что применение α– и p–каротина, криптоксантина, селена и других препаратов, обладающих антиоксидантными свойствами, замедляет течение центральной хориоретинальной дистрофии. Аналогично действие витаминов Е и С. Поскольку цинк, вовлеченный во многие энзиматические процессы метаболизма протеинов и нуклеиновых кислот, содержится в большом количестве в комплексе пигментный эпителий сетчатки – хориоидея, предполагают, что прием цинксодержащих препаратов также должен замедлять развитие макулярной дистрофии. Рекомендуется диета, богатая фруктами и овощами.
Для предотвращения деструктивных процессов в сетчатке необходимо применение оптических и фармакологических средств защиты и профилактики, поэтому больным с макулярной дистрофией, связанной с возрастом, рекомендуется назначать, помимо антиоксидантов, сосудистые препараты и липотропные средства, ношение светозащитных очков.
При экссудативной форме заболевания проводят лазерную фотокоагуляцию, ориентируясь на результаты ФАГ–диагностики.
С помощью хирургических методов удаляют хориоидальные неоваскулярные мембраны и субретинальные кровоизлияния. В настоящее время разрабатывают операции по трансплантации пигментного эпителия и фоторецепторного слоя сетчатки. У пациентов с субфовеальной хориоидальной неоваскуляризацией получены положительные результаты фотодинамической терапии. Заболевание хроническое, протекает медленно и приводит к снижению остроты зрения.
Сосудистые заболевания сетчатки
Сосудистые заболевания сетчатки часто связаны с системными заболеваниями (см. главу 21), среди которых большую роль играют сердечнососудистые заболевания, артериальная гипертензия, стеноз сонных артерий, диабет; изменения состава крови, повышение ее вязкости. Офтальмолог часто наблюдает ретинопатию при синдроме артериальной гипертензии и диабете, которые широко распространены во всех странах мира.Ретинопатия при артериальной гипертензии. Артериальная гипертензия (АГ) может привести к различным изменениям на глазном дне, патофизиология и степень выраженности которых зависят от стадии заболевания (см. главу 21).
Клинически при АГ выделяют два типа нарушений на глазном дне: ■ васкулярные, представленные очаговыми интраретинальными, периартериолярными транссудатами, хлопкоподобными очагами, изменениями артериол и вен сетчатки, интраретинальными микрососудистыми нарушениями ■ экстраваскулярные – отек сетчатки и макулы, геморрагии, твердый экссудат, потеря нервных волокон.
Ретинопатия при АГ может быть острой или находиться в стадии ремиссии в зависимости от характера течения основного заболевания. Очаговый некроз стенок сосудов является причиной кровоизлияний в слое нервных волокон, окклюзии поверхностных капилляров, образования хлопковидных пятен, которые локализуются в слое нервных волокон, развития глубокого отека сетчатки и экссудации в наружных плексиформных слоях. В острой стадии артериолы значительно сужаются, может возникнуть отек диска зрительного нерва. При флюоресцентной ангиографии выявляют нарушения кровообращения в хориоидее, предшествующие изменениям в сетчатке.
При диагностике, помимо офтальмоскопии, которую необходимо проводить не реже 1 раза в год, применяют электроретинографию для выявления нарушений биоэлектрической активности сетчатки, по степени изменения которой судят о степени ишемизации сетчатки; периметрию, при которой могут быть обнаружены ограниченные дефекты в полях зрения.
Лечение должно включать гипотензивную терапию, направленную на стабилизацию артериального давления, которую проводят под контролем биохимических и реологических свойств крови, а также анализа коагулограммы.
Диабетическая ретинопатия является основной причиной слепоты при сахарном диабете (см. главу 21).
Воспалительные заболевания сетчатки – ретиниты
Инфекционные и воспалительные заболевания сетчатки редко бывают изолированными: они, как правило, служат проявлением системного заболевания. В воспалительный процесс вовлекаются хориоидея и пигментный эпителий сетчатки, в результате чего формируется характерная офтальмоскопическая картина хориоретинита (см. главы 14, 21), при этом часто трудно определить, где первично возникает воспалительный процесс – в сетчатке или хориоидее. Заболевания вызываются микробами, простейшими, паразитами или вирусами. Процесс может быть распространенным, диссеминированным (например, сифилитический ретинит), локализоваться в центральных отделах сетчатки (центральный серозный хориоретинит) или возле диска зрительного нерва (юкстапапиллярный хориоретинит Иенсена). Локализация воспалительного процесса вокруг сосудов характерна для перифлебита вен сетчатки и болезни Илза.Различные этиологические факторы, вызывающие воспалительные изменения в заднем полюсе глазного дна, обусловливают мультифокальное вовлечение сетчатки и хориоидеи в патологический процесс. Часто основную роль в диагностике играет офтальмоскопическая картина глазного дна (см. рис. 14.9), так как не существует специфических диагностических лабораторных тестов для выявления причины заболевания.
Выделяют острые и хронические воспалительные процессы в сетчатке. Для установления диагноза очень важны анамнестические данные. Гистологически разделение воспалительного процесса на острое и хроническое основывается на типе воспалительных клеток, обнаруженных в тканях или экссудате. Острое воспаление характеризуется наличием полиморфно–ядерных лимфоцитов. Лимфоциты и плазматические клетки выявляют при хроническом негранулематозном воспалении, а их присутствие свидетельствует о вовлечении в патологический процесс иммунной системы. Активация макрофагов или эпителиоидных гистиоцитов и гигантских воспалительных клеток является признаком хронического гранулематозного воспаления, поэтому иммунологические исследования часто являются основными не только при установлении диагноза, но и при выборе тактики лечения.
Симптом белых пятен. Воспалительные мультифокальные изменения в сетчатке и хориоидее появляются при многих инфекционных заболеваниях.
Множественные быстропроходящие белые пятна. Этиологический фактор не установлен. У некоторых пациентов пятна возникают после вирусной инфекции, введения вакцины гепатита В.
Синдром характеризуется типичными клинической картиной, функциональными изменениями и формой течения. Основное отличие от синдромов мультифокального хориоидита и гистоплазмоза состоит в том, что воспалительные очаги быстро появляются, исчезают в течение нескольких недель и не переходят в атрофическую стадию.
Обычно болеют женщины молодого и среднего возраста. Заболевание начинается на одном глазу с внезапной потери зрения, появления фотопсии, изменения темпоральных границ поля зрения и слепого пятна. ЭРГ и ЭОГ патологические.
Офтальмоскопическая картина: множество нежных, малозаметных беловато–желтоватых пятен разного размера обнаруживают в заднем полюсе в глубоких слоях сетчатки, преимущественно назально от зрительного нерва, диск зрительного нерва отечен, сосуды окружены муфтами. В ранней фазе ангиограммы отмечаются слабая гиперфлюоресценция белых пятен, просачивание красителя и позднее окрашивание пигментного эпителия сетчатки. В стекловидном теле находят воспалительные клетки. С развитием процесса в макулярной области отмечается слабая гранулярная пигментация.
Лечение заболевания, как привило, не проводят.
Острая мультифокальная плакоидная эпителиопатия. Характерные признаки заболевания – внезапная потеря зрения, наличие множественных рассеянных скотом в поле зрения и больших очагов поражения кремового цвета на уровне пигментного эпителия в заднем полюсе глаза (рис. 15.13). Острая мультифокальная плакоидная пигментная эпителиопатия возникает после таких продромальных состояний, как повышение температуры тела, недомогание, боли в мышцах, наблюдающихся при гриппе, респираторной вирусной или аденовирусной инфекции. Отмечено сочетание мультифокальной плакоидной пигментной эпителиопатии с патологией центральной нервной системы (менингоэнцефалиты, церебральные васкулиты и инфаркты), тиреоидитом, васкулитом почек, узловатой эритемой.
Клиническая картина заболевания представлена множественными беловато–желтыми пятнами на уровне пигментного эпителия сетчатки. Они исчезают при купировании общего воспалительного процесса.
Острый очаговый ретинальный некроз. Заболевание возникает в любом возрасте. Характерные симптомы – боль и снижение зрения. В клинической картине отмечаются белые некротические очаги в сетчатке и васкулит, к которым затем присоединяется оптический неврит. Острое поражение сетчатки возникает, как правило, при системной вирусной инфекции, например при энцефалите, опоясывающем герпесе, ветряной оспе. Некроз начинается на периферии сетчатки, быстро прогрессирует и распространяется к заднему полюсу глаза, сопровождаясь окклюзией и некрозом сосудов сетчатки. В большинстве случаев возникает отслойка сетчатки с многочисленными разрывами. Важную роль в развитии заболевания играют иммунопатологические механизмы.
Лечение системное и местное – противовирусное, противовоспалительное, антитромботическое, хирургическое.
Центральная серозная хориоретинопатия – заболевание, проявляющееся серозной отслойкой нейроэпителия сетчатки и/или пигментного эпителия. Установлено, что серозная отслойка может быть идиопатической, а также обусловленной воспалительными и ишемическими процессами.
Пусковым механизмом в развитии заболевания может быть стресс, а возникновение заболевания обусловлено повышенной проницаемостью мембраны Бруха. При этом в патогенезе заболевания важное значение придают нарушению скорости кровотока и гидростатического давления в хориокапиллярах, а также увеличению проницаемости стенок сосудов хориоидеи. Доказательств наследственного характера заболевания нет. Центральная серозная хориоретинопатия широко распространена во всем мире. Среди заболевших преобладают мужчины в третьей – четвертой декаде жизни. Прогноз благоприятный, но часто отмечаются рецидивы.
Больные предъявляют жалобы на внезапное затуманивание зрения, появление темного пятна перед глазом, уменьшение (микропсия) или увеличение (макропсия) предметов, извращение их формы (метаморфопсия) в одном глазу, нарушение цветового зрения, аккомодации. Начальные симптомы могут быть не замечены пациентом до проявления болезни в другом глазу. В 40–50% случаев процесс двусторонний. Относительная сохранность остроты зрения при наличии отслойкипигментного эпителия может объясняться наличием неотслоенного нейроэпителия сетчатки.
В ранней стадии заболевания в центральном отделе появляется очаг приподнятой мутной сетчатки размером от 0,5 до 5 диаметров диска зрительного нерва. По краю очага перегибающиеся сосуды создают ободок светового рефлекса.
Через несколько недель проминенция очага уменьшается, исчезает помутнение сетчатки. На месте очага остаются мелкие желтовато–белые пятна, называемые преципитатами. Острота зрения повышается, но сохраняется относительная скотома в поле зрения. Позднее острота зрения восстанавливается, исчезают субъективные и объективные симптомы заболевания, однако нередко процесс рецидивирует. После повторной атаки заболевания в макулярной области остаются участки неравномерной пигментации.
Диагноз подтверждают результаты флюоресцентной ангиографии: выявляют один или несколько дефектов в пигментном эпителии, через которые краситель проходит в субэпителиальное и субретинальное пространство.
В большинстве случаев происходит самоизлечение через несколько недель или месяцев. С учетом предполагаемой этиологии процесса проводят дегидратационную и противовоспалительную терапию, назначают стероиды; выполняют также лазерную фото коагуляцию для закрытия дефектов в пигментном эпителии.
Болезнь Илза (ювенильная ангиопатия) – гетерогенное заболевание, которое может быть отнесено как к сосудистым, так и к воспалительным (периваскулит, васкулит, перифлебит). Характерные признаки – рецидивирующие кровоизлияния в стекловидное тело и неоваскуляризация сетчатки на периферии без каких–либо типичных клинических признаков. Неоваскуляризация обычно отмечается на границе между нормальной сетчаткой и ишемической зоной с плохим кровоснабжением. Чаще болеют мужчины в возрасте 15–45 лет.
Офтальмоскопически: многие вены сетчатки расширены, извиты и окутаны муфтами экссудата, радом много новообразованных сосудов. Муфты распространяются по ходу вен до артериовенозного перекреста. Возможны точечные и пламевилные кровоизлияния в сетчатку из аневризм капилляров, а также распространенные преретинальные кровоизлияния.
Заболевание обычно сохраняется в течение многих лет, постепенно затухая. Клинически выделяют три подтипа перифлебита: экссудативную форму с муфтами, отеком сетчатки, преретинальным экссудатом; геморрагическую форму с множественными кровоизлияниями в сетчатку и стекловидное тело; пролиферативную форму с новообразованными сосудами в сетчатке и прорастанием сосудов в стекловидное тело, тяжами и мембранами в стекловидном теле, вторичной тракционной отслойкой сетчатки.
Прогноз относительно зрения плохой. К осложнениям относятся кровоизлияния в стекловидное тело, катаракта, папиллит, вторичная глаукома, тракционная и регматогенная отслойка сетчатки, рубеоз радужки.
Лечение системное и хирургическое в зависимости от клинических проявлений болезни. Системно используют кортикостероиды, но положительный эффект от их применения нестабилен. Лазер– и фотокоагуляцию проводят с целью уменьшения и предотвращения неоваскуляризации в стекловидное тело, тракции (натяжение фиброзными тяжами) и отслойки сетчатки. Витрэктомию выполняют при наличии массивных кровоизлияний в стекловидном теле и витреоретинальных тяжей.
Юкстапапиллярный хориоретинит Йенсена – воспалительный хориоретинальный очаг с вовлечением в патологический процесс всех, в том числе поверхностных, слоев сетчатки, локализованный возле диска зрительного нерва. Наряду с типичной локализацией характерным симптомом является сегментарный дефект в поле зрения, распространяющийся от диска зрительного нерва к периферии. Заболевание чаще возникает в третьей декаде жизни, и в большинстве случаев причиной его развития является токсоплазмоз. На другом глазу может быть характерный для врожденного токсоплазмоза атрофический очаг в макулярной области.
При офтальмоскопии в острой стадии наблюдается прилежащий к диску зрительного нерва овальный серо–белый проминирующий фокус воспаления, размер которого равен диаметру диска. Стекловидное тело диффузно опалесцирует. Проходящие сквозь очаг воспаления или над его поверхностью артерии имеют различный калибр и изменения стенок.
Отслойка сетчатки
Отслойка сетчатки представляет собой отделение слоя палочек и колбочек, т. е. нейроэпителия, от пигментного эпителия сетчатки, обусловленное скоплением жидкости между ними. При этом нарушается питание наружных слоев сетчатки, что приводит к быстрой потере зрения.Возможность отслоения сетчатки обусловлена особенностями ее строения. Важную роль играют дистрофические изменения сетчатки и тракционные воздействия со стороны стекловидного тела.
Различают дистрофическую, травматическую и вторичную отслойку сетчатки.
Дистрофическая, называемая также первичной, идиопатической, регматогенной (от греч. rhegma – разрыв), возникает в связи с разрывом сетчатки, через который под нее проникает жидкость из стекловидного тела.
Травматическая развивается вследствие прямой травмы глазного яблока – контузии или проникающего ранения.
Вторичная является следствием различных заболеваний глаза: новообразований хориоидеи и сетчатки, увеитов и ретинитов, цистицеркоза, сосудистых поражений, кровоизлияний, диабетической и почечной ретинопатии, тромбозов центральной вены сетчатки и ее ветвей, ретинопатии недоношенных и при серповидно–клеточной анемии, ангиоматоза Гиппеля – Линдау, ретинита Коатса и др.
Особенности патогенеза и клиники травматической и вторичной ОС представлены в соответствующих разделах учебника (см. главы 20, 23).
Основным патогенетическим фактором в развитии дистрофической и травматической отслойки сетчатки является разрыв сетчатки или отрыв ее от зубчатой линии.
Причины формирования разрывов сетчатки окончательно не установлены. Однако в патогенезе разрывов и отслойки сетчатки, несомненно, имеют значение дистрофические изменения сетчатки и хориоидеи, тракционные воздействия со стороны стекловидного тела и ослабление связей между фоторецепторным слоем сетчатки и пигментным эпителием.
Среди периферических витреохориоретинальных дистрофий условно можно выделить наиболее часто встречающиеся формы (рис. 15.14).
В соответствии с локализацией следует различать экваториальные, параоральные (у зубчатой линии) и смешанные формы периферических витреохориоретинальных дистрофий, которые выявляют в 4–12% глаз в общей популяции. Наиболее опасной в плане возникновения разрывов и отслойки сетчатки считается решетчатая дистрофия.
Решетчатая дистрофия сетчатки располагается обычно экваториально или кпереди от экватора глаза. Ее характерным признаком является сеть переплетающихся белых линий (облитерированных сосудов сетчатки), между которыми выявляют участки истончений, разрывы сетчатки и витреоретинальные сращения. При прогрессировании решетчатой дистрофии могут формироваться не только дырчатые, но и клапанные, а также большие атипичные разрывы по всей длине области поражения ("гигантские" разрывы). Излюбленная локализация – верхненаружный квадрант глазного дна, однако встречаются и круговые варианты решетчатой дистрофии.
Разрывы сетчатки. Дырчатые разрывы чаще всего сочетаются с решетчатой и кистовидной дистрофией, а разрывы с крышечкой и клапанные, как правило, обусловлены витреоретинальной тракцией, задней отслойкой стекловидного тела, его ретракцией и кровоизлияниями и являются второй после решетчатой дистрофии причиной возникновения отслойки сетчатки.
Патологическая гиперпигментация имеет вид множественных пигментированных фокусов различных величины и формы. Она нередко сопутствует решетчатой дистрофии и сочетается с витреоретинальными сращениями.
Кистовидная дистрофия сетчатки локализуется на крайней периферии глазного дна, возникает в молодом возрасте, прогрессируя к старости. Микрокисты могут сливаться, формируя более крупные кисты сетчатки, возможны разрывы как внутренних, так и наружных стенок кист. Офтальмоскопически кисты выглядят как множественные круглые или овальные ярко–красные прозрачные образования.
Ретиношизис. – расслоение сетчатки – возникает как следствие пороков ее развития или дистрофических процессов. К врожденным формам ретиношизиса относятся врожденные кисты сетчатки, Х–хромосомный ювенильный ретиношизис, при котором более чем у половины больных, помимо периферических изменений, отмечается патология сетчатки в макулярной области, приводящая к снижению зрения. При плоском ретиношизисе сетчатка приобретает серовато–беловатый цвет, чаще всего в нижненаружных отделах глазного дна. Прогрессируя, ретиношизис может трансформироваться в гигантские кисты сетчатки, появляются разрывы в стенках ретиношизиса. Дистрофический ретиношизис чаще всего возникает при миопии, а также в пожилом и старческом возрасте.
Хориоретинальная атрофия имеет вид атрофических фокусов с пигментированной каймой. Увеличиваясь в размерах, атрофические очаги могут сливаться, захватывая всю нижнюю периферию глазного дна, нередко распространяясь по всей его окружности. Заболевание развивается в пожилом возрасте на обоих глазах и редко приводит к отслойке сетчатки.
Смешанные формы обусловлены сочетанием перечисленных выше видов дистрофий.
В клинической практике периферические витреохориоидальные дистрофии часто не диагностируют, так как они не вызывают нарушения зрительных функций. Для того чтобы выявить эти изменения нужно исследовать периферию глазного дна в условиях медикаментозного расширения зрачка. С этой целью проводят бинокулярную офтальмоскопию, биомикроскопию с помощью положительных линз и трехзеркальной линзы Гольдмана, при необходимости в сочетании с поддавливанием склеры (склерокомпрессия). Своевременное обнаружение измененных участков, в связи с наличием которых существует угроза разрывов, позволяет провести успешную световую или хирургическую профилактику отслойки сетчатки.
К факторам риска возникновения отслойки сетчатки относятся периферические витреохориоретинальные дистрофии, уже имеющаяся отслойка сетчатки на одном глазу, осложненная миопия, афакия, врожденная патология и травмы органа зрения (прямые и контузионные), работа, связанная с чрезмерным физическим напряжением и подъемом больших тяжестей, наличие отслойки или дистрофий в сетчатке у родственников I степени родства.
Клиническая картина при отслойке сетчатки складывается из субъективных и объективных симптомов.
Жалобы больного сводятся к внезапному появлению скотом, т. е. выпадений в поле зрения (обозначаемых пациентом, как "завеса”, "пелена" перед глазом), которые прогрессивно увеличиваются и приводят к еще большему снижению остроты зрения. Этим субъективным симптомам могут предшествовать ощущения "вспышек и молний” (фотопсии), искривления предметов (метаморфопсии), плавающие помутнения.
При выяснении анамнеза следует обратить внимание на наличие отслойки сетчатки у членов семьи больного, миопии, травм, физических напряжений.
Помимо обычного офтальмологического исследования, у больного, у которого заподозрена отслойка сетчатки, должны быть проведены периметрия, биомикроскопия стекловидного тела и сетчатки, непрямая (лучше бинокулярная) офтальмоскопия. При затруднениях в диагностике и выборе оптимального метода лечения полезна оценка энтоптических феноменов, склерокомпрессия, использование ультразвукового и электрофизиологического исследований.
Характерные для отслойки сетчатки выпадения в поле зрения и степень снижения остроты зрения зависят от локализации и распространенности отслойки и вовлечения в патологический процесс макулярной области. Выпадение в поле зрения возникает на стороне, противоположной расположению отслойки. Механофосфен в зоне поражения отсутствует, ЭРГ либо не регистрируется, либо резко субнормальна.

 Рис. 15.15. Отслойка сетчатки, а – регматогенная отслойка сетчатки с разрывами; б – ретинальная карта с использованием международного цветового кода.
Рис. 15.15. Отслойка сетчатки, а – регматогенная отслойка сетчатки с разрывами; б – ретинальная карта с использованием международного цветового кода.
У половины больных выявляют относительное (по сравнению с парным глазом) снижение внутриглазного давления.
Биомикроскопия позволяет уточнить характер витреоретинальных взаимоотношений, определить наличие деструкции стекловидного тела, пигментных гранул, шварт, кровоизлияний, отслойки стекловидного тела.
Офтальмоскопически отслойка сетчатки проявляется исчезновением на том или ином протяжении глазного дна нормального красного рефлекса, который в зоне отслойки становится серовато–беловатым, а сосуды сетчатки – более темными и извитыми, чем обычно (рис. 15.15,а). В зависимости от распространенности, высоты и давности отслойки сетчатки она то более, то менее выступает в стекловидное тело, сохраняя в ранние сроки почти полную прозрачность. При небольшой высоте отслойки (так называемая плоская отслойка) судить о ее наличии можно лишь по изменению хода сосудов и меньшей четкости рисунка хориоидеи, а также по снижению биоэлектрической активности сетчатки. При высокой и пузыревидной отслойке сетчатки диагноз не вызывает сомнений, поскольку виден колышащийся беловато–сероватый пузырь. При длительном существовании отслоенной сетчатки и нарастании процессов витреоретинальной пролиферации в сетчатке возникают грубые складки, звездчатые рубцы. Отслоенная сетчатка становится неподвижной, ригидной. В конечном счете она приобретает воронкообразную форму и сохраняет связь с подлежащими оболочками только вокруг диска зрительного нерва и у зубчатой линии.
Разрывы и отрывы сетчатки имеют красный цвет и разную форму. Различают разрывы дырчатые, клапанные, с крышечкой, атипичные. Разрывы могут быть одиночными и множественными, центральными и парацеитральными, экваториальными и параоральными (расположены вблизи зубчатой линии). Вид, локализация и размер разрыва во многом определяют топографию и скорость распространения отслойки сетчатки. При расположении разрывов в верхней половине глазного дна отслойка, как правило, прогрессирует значительно стремительнее, чем при нижних разрывах и отрывах. Наиболее часто разрывы локализуются в верхненаружном квадранте глазного дна. Врач, обнаружив один разрыв в сетчатке, обязательно должен продолжить поиски, последовательно осматривая центральные и парацентральные, а затем экваториальные и параоральные отделы глазного дна по меридианам, так как выявление и блокада всех разрывов сетчатки определяет как выбор оптимального метода вмешательства, так и его эффективность. Необходимо также выявить витреоретинальные сращения.
Все выявленные изменения заносят в специальную карту глазного дна, принятую Международным обществом ретинологов (рис. 15.15,6).
Профилактика отслойки сетчатки сводится к раннему выявлению периферических дистрофий сетчатки, своевременному проведению профилактических вмешательств, рациональному трудоустройству больных и динамическому наблюдению за ними. Чаще всего для профилактики отслойки используют лазерную фотокоагуляцию и криопексию. Особое внимание необходимо уделять пациентам из групп повышенного риска возникновения ОС, в которых следует расширять показания к профилактическим вмешательствам.
Хирургическое лечение отслойки сетчатки имеет цель блокировать разрывы сетчатки и устранить витреоретинальные сращения, оттягивающие сетчатку в полость стекловидного тела.
Все используемые с этой целью методы оперативных вмешательств можно условно разделить на три группы.
Гипер– или гипотермические (фотокоагуляция, диатермокоагуляция, криопексия), локальные транспупиллярные или транссклеральные воздействия, призванные вызвать слипчивое воспаление в зоне разрывов сетчатки и прочно фиксировать сетчатку.
Склеропластические операции (временное баллонное или постоянное локальное, циркулярное или комбинированное пломбирование склеры в зоне проекции разрывов сетчатки силиконовыми или биологическими имплантатами), направленные на восстановление контакта сетчатки с подлежащими оболочками. Пломба, наложенная снаружи на склеру, вдавливает ее внутрь и приближает наружную капсулу глаза и хориоидею к отслоенной и укороченной сетчатке.
Интравитреальные вмешательства – это операции, выполняемые внутри полости глаза. Прежде всего производят витрэктомию – иссечение измененного стекловидного тела и витреоретинальных шварт. Для того чтобы придавить сетчатку к подлежащим оболочкам глаза, вводят расширяющиеся газы, перфторорганические соединения или силиконовое масло. Ретинотомия – это рассечение укороченной и сократившейся отслоенной сетчатки с последующим расправлением ее и фиксацией краев с помощью крио– или эндолазерной коагуляции. В отдельных случаях используют микроскопические ретинальные гвозди и магниты. Операции выполняют с эндоскопическим освещением при помощи специальных манипуляторов.
Обязательным условием успеха операций по поводу отслойки сетчатки является их своевременность, так как длительное существование отслойки приводит к гибели зрительно–нервных элементов сетчатки. В таких случаях даже при полном анатомическом прилегании сетчатки не происходит восстановления или повышения зрительных функций. Необходим также постоянный тщательный офтальмоскопический контроль за надежной блокадой всех разрывов сетчатки в ходе операции. При отсутствии контакта сетчатки с подлежащими оболочками в зоне разрывов показана наружная или внутренняя эвакуация субретинальной жидкости и комбинация как эписклеральных, так и эндовитреальных приемов.
При выполнении операции на современном техническом уровне удается добиться прилегания сетчатки у 92–97% больных. В раннем послеоперационном периоде показано проведение местной и общей противовоспалительной терапии с применением нестероидных и стероидных препаратов, системной энзимотерапии при наличии кровоизлияний. В последующем целесообразно проведение повторных курсов лечения, включающих препараты, нормализующие гемодинамику и микроциркуляцию глаза. Больные, оперированные по поводу отслойки сетчатки, должны находиться под диспансерным наблюдением офтальмолога и избегать физических перегрузок.
Ретинопатия недоношенных
Ретинопатия недоношенных, или вазопролиферативная ретинопатия (прежнее название ретролентальная фиброплазия) – заболевание сетчатки глубоко недоношенных детей, у которых к моменту рождения не полностью развита сосудистая сеть (васкуляризация) сетчатки. Нормальная васкуляризация сетчатки начинается на 4–м месяце гестационного периода и заканчивается к 9–му месяцу. Заболевание возникает либо как ответ на пролонгированное воздействие больших концентраций кислорода, используемых при выхаживании недоношенных детей, либо как результат глубокой недоношенности при низкой массе тела. Наблюдаются различные формы неоваскуляризации. Патологические преретинальные новообразованные сосуды могут регрессировать, если в сетчатке происходит нормальное развитие сосудов сетчатки, могут и прогрессировать, приводя к тракциям, экссудативной или регматогенной отслойке сетчатки. Заболевание обычно начинается в первые 3–6 нед жизни, но не позднее 10–й недели. Рубцовые стадии полностью развиваются к 3–5–му месяцу.Изменения глазного дна при этой патологии начинаются с пролиферации сосудов, затем образуются фиброваскулярные мембраны, появляются кровоизлияния, экссудаты, отслойка сетчатки (рис. 15.16). В ранних стадиях ретинопатии недоношенных возможны спонтанный регресс заболевания и остановка процесса на любой стадии.
Острота зрения значительно снижена (до светоощущения), электроретинограмма отсутствует при наличии отслойки. Диагноз устанавливают на основании данных анамнеза, результатов офтальмоскопии, ультразвукового исследования, электроретинографии и регистрации ЗВП.
Дифференциальную диагностику в зависимости от клинических симптомов проводят с ретинобластомой, кровоизлияниями новорожденных, внутричерепной гипертензией, врожденными аномалиями развития сетчатки, особенно с семейной экссудативной витреоретинопатией (болезнью Крисвика–Скепенса), характеризующейся нарушением васкуляризации сетчатки, фиброзными изменениями в стекловидном теле и частым развитием отслойки сетчатки. Ген, ответственный за развитие семейной экссудативной витреоретинопатии, локализуется в 11–й хромосоме на участке ql3–23.
Лечение ретинопатии недоношенных в ранних стадиях, как правило, не требуется. В более поздних стадиях в зависимости от клинических проявлений используют антиоксиданты, ангиопротекторы, кортикостероиды. Лечение при активной неоваскуляризации сетчатки включает местную криотерапию или лазер– и фотокоагуляцию. На глазах с отслойкой сетчатки эффект криотерапии, лазер– и фотокоагуляции кратковременный. Выбор метода хирургического лечения отслойки сетчатки зависит от вида и распространенности отслойки (витрэктомия или сочетание ее со склеротоксическими операциями).
Глава 16. Патология зрительного нерва
Глаз – тот орган чувств, который приносит нам более всего удовлетворения, ибо позволяет постичь суть природы.Аристотель
Аномалии развития диска зрительного нерва
Аплазия зрительного нерва – редко встречающаяся, очень тяжелая патология, при которой зрительный нерв вообще не формируется и зрительные функции отсутствуют вследствие запаздывания врастания аксонов (I нейрона в ножку глазного бокала или в связи с преждевременным закрытием зародышевой щели. Одновременно наблюдается недоразвитие ляп отсутствие ганглиозного слоя сетчатки. При офтальмоскопии обнаруживают отсутствие диска зрительного нерва и сосудов сетчатки на разном дне. На месте диска определяется зона атрофии или углубление, окруженное пигментным ободком. Процесс может быть односторонним или двусторонним.Гипоплазия зрительного нерва – недоразвитие диска зрительного нерва, обусловленное неполной диффернциацией ганглиозных клеток сетчатки и уменьшением числа аксонов нейрона, причем формирование мезодермальных и глиальных элементов обычно нормальное. При офтальмоскопии выявляют уменьшение диаметра диска до ½–⅓ его ветчины, монотонную бледность диска, узкие, иногда нитевидные сосуды сетчатки. Зрение низкое, редко 0,1–0,2.
Аплазия и гипоплазия часто сочетаются с микрофтальмом, нистагм, косоглазием и дефектами развития других органов.
Колобомы зрительного нерва – ратерообразные углубления бледно–серого цвета, округлой или овальной формы, обычно с неровным ступенчатым дном. Колобомы могут локализоваться в центре или по краю диска и сочетаться с колобомой хориоидеи. При центральной локализации колобомы резко сдвигается сосудистый пучок диска и все сосуды выходят по краю колобомы, чаще по нижнему. От величины и локализации колобомы зависят зрительные функции: если колобома сформировалась в зоне проекции папилломакулярного пучка (нижнетемпоральный квадрант), зрение низкое; если колобома небольшая и располагается в носовой половине диска, зрение высокое, вплоть до 1,0. Поля зрения при небольших колобомах сохраняются без изменений, при больших выявляют соответствующие дефекты.
Ямочки зрительного нерва представляют собой небольшие по диаметру, но значительные по глубине образования (до 4–5 мм) темно–серого цвета, хорошо видимые при биомикроскопии. При щелевом освещении луч света, проходя над ямочкой, "ныряет” в это углубление, делая клювовидный изгиб. Механизм формирования ямочки состоит в следующем. В норме сетчатка обрывается у края диска и в глубь ткани зрительного нерва не. проникает, при данной же патологии сегмент сетчатки внедряется в зрительный нерв и на этом месте формируется ямочка. Другими словами, на дне ямочки находится рудимент сетчатки. Аномалия может не оказывать влияния на зрительные функции и быть случайной находкой при обследовании пациента. Однако при локализации ямочки в темпоральной половине диска возможно развитие центральной серозной хориоретинопатии и вторичных дистрофических изменений макулы со значительным снижением зрения. Центральная серозная хориоретинопатия может проявиться в юношеском или более зрелом возрасте. Аномалия односторонняя.
Наклонные диски. Данная патология обусловлена косым ходом склерального канала зрительного нерва. При офтальмоскопии зрительный нерв имеет вытянутую овальную форму, причем с темпоральной стороны виден склеральный конус, напоминающий миопический,а с противоположной – диск насыщенной окраски, выстоящий над уровнем сетчатки, имеющий стушеванные границы. Вся ткань диска как бы сдвинута в сторону носа. Рефракция глаза чаще гиперметропическая с астигматизмом. Зрительные функции с коррекцией могут быть высокими. Дифференциальную диагностику проводят с невритами и начальными застойными дисками. Аномалия в большинстве случаев двусторонняя.
Пигментация диска зрительного нерва. В норме в ткани диска зрительного нерва нет пигментсодержащих клеток и диск имеет характерный желто–розовый цвет. По окружности диска, больше с темпоральной стороны, возможно скопление пигмента в виде кольца или полукольца. При патологических состояниях пигментные образования выявляют и в ткани зрительного нерва. Они имеют вид пигментных пятен, точек, дорожек, дугообразных полос. Описан случай диффузной пигментации диска, который был окрашен в серовато–черный цвет [Трон Е. Ж., 1968]. Такие больные должны находиться под диспансерным наблюдением.
Миелиновые волокна. Миелиновые волокна в норме располагаются в ретробульбарном, а именно интраорбитальном, отделе зрительного нерва, не проникая внутрь глазного яблока. При аномалиях развития часть миелиновых волокон заходит внутрь глаза, следуя по ходу аксонов ганглиозных клеток. На глазном дне они определяются как блестящие молочно–белого цвета волокна, располагающиеся по краю диска. Обычно эти волокна описывают как "языки белого пламени" разной степени выраженности и плотности. Иногда они значительно прикрывают центральные сосуды сетчатки. Диагностика не вызывает затруднений.
Друзы диска зрительного нерва. Друзы отмечаются в одном или, чаще, в двух глазах и представляют собой светложелтые образования округлой формы, напоминающие зерна саго. Они могут быть единичными и поверхностными, тогда их легко диагностировать, но иногда друзы располагаются глубоко в ткани и весь диск как бы нафарширован ими (рис. 16.1). В таких случаях диск имеет смазанные или фестончатые границы, проминирует, физиологическая экскавация отсутствует, вследствие чего диагностика затруднена и требуется проведение дифференциальной диагностики, в которой помогает прямая биомикроскопия с применением фильтров. В особо трудных случаях проводят флюоресцентную ангиографию, при которой отмечается фокальная гиперфлюоресценция диска соответственно зонам друз. Функции глаза могут быть не нарушены, но при большом количестве друз суживаются границы поля зрения. Следует отметить, что возрастные изменения ткани диска в таких глазах наступают рано. В основе патологии лежит нарушение обменных процессов с образованием коллоидных веществ – мукополисахаридов.
Симптом "утреннего сияния". Офтальмоскопическая картина характеризуется приподнятым грибовидным диском зрительного нерва, вокруг которого располагается неравномерно пигментированный приподнятый вал измененных тканей хориоидеи и сетчатки. Зрительные функции вариабельны.
Двойной (разделенный) диск зрительного нерва. Аномалия встречается крайне редко. Во всех описанных случаях процесс был односторонним. Два диска могут только соприкасаться ("тонкая талия") или почти сливаться ("широкая талия"). Каждый диск имеет собственную сосудистую систему с аномальными вариациями. Один диск по размерам и виду может приближаться к нормальному, а другой – значительно меньших размеров или оба небольшие (гипоплазия). Разделение зрительного нерва касается не только его видимой части – диска, но и интракраниальных отделов. Зрение, как правило, низкое (в пределах сотых).
Увеличенные диски (megalopapilla). Врожденная патология, чаще двусторонняя. В норме диаметр диска зрительного нерва варьирует от 1,2 до 1,9 мм, в среднем 1,5–1,6 мм. При данной патологии наблюдается увеличение диаметра диска до 2,2–2,5 мм независимо от рефракции глаза. При офтальмоскопии наблюдается характерная картина: большие диски насыщенного серорозового цвета значительно проминируют над уровнем сетчатки, края диска стушеваны, "расчесаны”, окружающая сетчатка имеет радиарную исчерченность. Сосуды как бы сползают с диска, делая характерный изгиб. Артериовенозное соотношение не изменено, но часто отмечается повышенная извитость вен. В ряде случаев выявляют аномалию ветвления сосудов на диске – рассыпной тип деления, тогда как в норме – дихотомический. В основе процесса лежит избыточное разрастание глиальной ткани – гиперплазия глии. Возможно, это последствие недостаточного обратного развития эмбриональных процессов формирования диска зрительного нерва.
Псевдозастойные диски. Данная патология – разновидность megalopapilla. Выявляемая при офтальмоскопии картина напоминает таковую при застойных дисках. Увеличенные диски проминируют над уровнем сетчатки, имеют насыщенную серорозовую окраску и стушеванные границы, однако в отличие от застойных дисков отсутствуют кровоизлияния и другие экстравазаты. Офтальмоскопическая картина стабильна в течение всей жизни пациента.
Псевдоневриты. Это также разновидность глиоза зрительного нерва, но степень развития глиальной ткани еще ниже, чем при псевдозастое. Картина, наблюдающаяся при офтальмоскопии, напоминает таковую при оптическом неврите: насыщенная окраска диска, стушеванные границы, проминенция, но в отличие от неврита экссудативного выпота и кровоизлияний нет. Офтальмоскопическая картина также стабильна в течение всей жизни. При дифференциальной диагностике важную роль играет биомикроскопия диска с использованием фильтров. Зрительные функции сохраняются высокими (0,4–0,8). Периферическое зрение без изменений или выявляется увеличение слепого пятна.
Аномалии развития сосудов зрительного нерва. Описаны различные варианты аномалий артериальной и венозной систем зрительного нерва: спиралевидный и петлеобразный ход сосудов с формированием артериовенозных и вено–венозных анастомозов, обвитие зрительного нерва сосудами.
Препапиллярные мембраны. Над диском зрительного нерва формируются полупрозрачные пленки, иногда связанные с остатками артерии стекловидного тела. Степень плотности мембраны может быть разной. При выраженном уплотнении диск зрительного нерва просматривается нечетко. Дифференциальную диагностику проводят с экссудативным выпотом в задние слои стекловидного тела.
Воспаление зрительного нерва
Воспалительный процесс в зрительном нерве – неврит – может развиться как в его волокнах, так и в оболочках. По клиническому течению выделяют две формы неврита зрительного нерва – интрабульбарную и ретробульбарную.Интрабульбарный неврит
Интрабульбарный неврит (папиллит) – воспаление внутриглазной части зрительного нерва, от уровня сетчатки до решетчатой пластины склеры. Этот отдел называют также головкой зрительного нерва. При офтальмоскопии данная часть зрительного нерва доступна для осмотра, и врач в деталях может проследить весь ход воспалительного процесса.Этиология.
Причины развития заболевания многообразны.Возбудителями воспаления могут быть: ■ стафило– и стрептококки ■ возбудители специфических инфекций – гонореи, сифилиса, дифтерии, бруцеллеза, токсоплазмоза, малярии, оспы, сыпного тифа и т. д. ■ вирусы гриппа, парагриппа, опоясывающего герпеса (herpes zoster) и др.
Воспалительный процесс в зрительном нерве всегда вторичный, т. е. является осложнением общей инфекции или фокального воспаления какого–либо органа, поэтому при возникновении неврита зрительного нерва всегда нужна консультация терапевта. К развитию заболевания могут привести: ■ воспалительные состояния глаза (кератит, иридоциклит, хориоидит, увеопапиллит – воспаление сосудистого тракта и головки зрительного нерва) ■ заболевания орбиты (флегмона, периостит) и ее травма ■ воспалительные процессы в околоносовых пазухах (гайморит, фронтит, синусит и др.) ■ тонзиллит и фаринголарингит ■ кариес ■ воспалительные заболевания мозга и его оболочек (энцефалит, менингит, арахноидит) ■ общие острые и хронические инфекции.
Из последних причиной развития неврита зрительного нерва наиболее часто являются острая респираторно–вирусная инфекция (ОРВИ), грипп и парагрипп. Очень характерен анамнез таких больных: через 5–6 дней после ОРВИ или гриппа, сопровождавшегося повышением температуры тела, кашлем, насморком, недомоганием, появляется "пятно" или "туман" перед глазом и резко снижается зрение, т. е. возникает симптоматика неврита зрительного нерва.
Клиническая картина.
Начало заболевания острое. Инфекция проникает через периваскулярные пространства и стекловидное тело. Различают тотальное и частичное поражение зрительного нерва. При тотальном поражении зрение снижается до сотых и даже может наступить слепота, при частичном зрение может быть высоким, вплоть до 1,0, но в поле зрения отмечаются центральные и парацентральные скотомы округлой, овальной и аркоподобной формы. Снижаются темновая адаптация и цветовосприятие. Показатели критической частоты слияния мельканий и лабильности зрительного нерва низкие. Функции глаза определяются степенью вовлечения в воспалительный процесс папилломакулярного пучка.Офтальмоскопическая картина: все патологические изменения сосредоточены в области диска зрительного нерва (рис. 16.2). Диск гиперемирован, по цвету может сливаться с фоном сетчатки, ткань его отечна, отек имеет экссудативный характер. Границы диска стушеваны, но большой проминенции, как при застойных дисках, не наблюдается. Экссудат может заполнять сосудистую воронку диска и имбибировать задние слои стекловидного тела. Глазное дно в этих случаях просматривается нечетко. На диске или около него отмечаются полосчатые и штрихообразн ые кровоизл ия н ия. Артерии и вены умеренно расширены.
На флюоресцентной ангиографии отмечается гиперфлюоресценция: при тотальном поражении всего диска, при частичном – соответствующих зон.
Продолжительность острого периода 3–5 нед. Затем отек постепенно спадает, границы диска становятся четкими, кровоизлияния рассасываются. Процесс может закончиться полным выздоровлением и восстановлением зрительных функций, даже если изначально они были очень низкими. При тяжелой форме неврита в зависимости от вида инфекции и тяжести ее течения наступает гибель нервных волокон, их фрагментарный распад и замещение глиальной тканью, т. е. процесс заканчивается атрофией зрительного нерва. Степень выраженности атрофии разная – от незначительной до полной, что и определяет функции глаза. Таким образом, исход неврита – это диапазон от полного выздоровления до абсолютной слепоты. При атрофии зрительного нерва на глазном дне виден монотонно бледный диск с четкими границами и узкими нитевидными сосудами.
Ретробульбарный неврит
Ретробульбарный неврит – это воспаление зрительного нерва на участке от глазного яблока до хиазмы.Причины развития ретробульбарного неврита те же, что и интрабульбарного, к которым присоединяется нисходящая инфекция при заболеваниях головного мозга и его оболочек. В последние годы одной из наиболее частых причин возникновения данной формы неврита зрительного нерва стали демиелинизирующие заболевания нервной системы и рассеянный склероз. Хотя последний не относится к истинным воспалительным процессам, во всей мировой офтальмологической литературе поражения органа зрения при данном заболевании описывают в разделе, посвященном ретробульбарному невриту, так как клинические проявления поражений зрительного нерва при рассеянном склерозе характерны для ретробульбарных невритов.
Клиническая картина.
Различают три формы ретробульбарного неврита – периферическую, аксиальную и трансверсальную.При периферической форме воспалительный процесс начинается с оболочек зрительного нерва и по перегородкам распространяется на его ткань. Воспалительный процесс имеет интерстициальный характер и сопровождается скоплением экссудативного выпота в субдуральном и субарахноидал ьном пространстве зрительного нерва. Основные жалобы больных при периферическом неврите – боли в области орбиты, усиливающиеся при движениях глазного яблока (оболочечные боли). Центральное зрение не нарушается, но в поле зрения выявляют неравномерное концентрическое сужение периферических границ на 20––40°. Функциональные тесты могут быть в пределах нормы.
При аксиальной форме (наблюдающейся наиболее часто) воспалительный процесс развивается преимущественно в аксиальном пучке, сопровождаясь резким снижением центрального зрения и появлением центральных скотом в поле зрения. Функциональные тесты значительно снижены.
Трансверсальная форма – наиболее тяжелая: воспалительный процесс захватывает всю ткань зрительного нерва. Зрение снижается до сотых и даже до слепоты. Воспаление может начаться на периферии или в аксиальном пучке, а затем по септам распространяется на остальную ткань, обусловливая соответствующую картину воспаления зрительного нерва. Функциональные тесты крайне низкие.
При всех формах ретробульбарного неврита в остром периоде заболевания отсутствуют какие–либо изменения на глазном дне, лишь спустя 3–4 нед появляется деколорация височной половины или всего диска – нисходящая частичная или тотальная атрофия зрительного нерва. Исход ретробульбарного неврита, так же как и интрабульбарного, колеблется от полного выздоровления до абсолютной слепоты пораженного глаза.
Лечение.
Основное направление терапии неврита (интра– и ретробульбарного) должно быть этиопатогенетическим в зависимости от выявленной причины заболевания, однако на практике установить ее удается далеко не всегда.Прежде всего назначают: ■ антибиотики пенициллинового ряда и широкого спектра действия, нежелательно применять стрептомицин и другие антибиотики данной группы ■ сульфаниламидные препараты ■ антигистаминные средства ■ местную гормональную (пара– и ретробульбарную) терапию, в тяжелых случаях – общую ■ комплексную антивирусную терапию при вирусной этиологии заболевания: противовирусные препараты (ацикловир, ганцикловир и др.) и индукторы интерфероногенеза (полудан, пирогенал, амиксин); применение кортикостероидов является спорным вопросом ■ симптоматическую терапию: дезинтоксиционные средства (глюкоза, гемодез, реополиглюкин); препараты, улучшающие окислительно–восстановительные и обменные процессы; витамины С и группы В.
В поздних стадиях при появлении симптомов атрофии зрительного нерва назначают спазмолитики, действующие на уровень микроциркуляции (трентал, сермион, ницерголин, никотиновая кислота, ксантинол). Целесообразно проведение магнитотерапии, электро– и лазер–стимуляции.
Токсические поражения зрительного нерва
Многие токсические поражения зрительного нерва протекают, как ретробульбарный неврит, но в основе патологии лежит не воспалительный процесс, а дистрофический. В результате токсического воздействия на нервные волокна нарушается их трофика вплоть до распада нервной ткани и замещения ее глиальной. Такие состояния могут возникать в результате экзогенной или эндогенной интоксикации.Метилалкогольная интоксикация.
Одна из наиболее часто отмечаемых причин поражения зрительного нерва – отравления чистым метиловым спиртом или его производными (денатурат, лаки и другие жидкости). Токсическая доза очень индивидуальна – от вдыхания паров до приема внутрь значительного количества токсичного вещества.В клинической картине на первый план выступают проявления общей интоксикации: головная боль, тошнота, рвота, желудочно–кишечные расстройства, кома. Иногда через несколько часов, но чаще через 2–3 дня значительно снижается центральное зрение обоих глаз. При осмотре пациента прежде всего обращают внимание на широкие, не реагирующие на свет зрачки. Других изменений в глазах не выявляют. Глазное дно и диск зрительного нерва не изменены.
Дальнейшее течение заболевания может быть различным. В одних случаях первоначальное снижение зрения сменяется улучшением, в других отмечается ремиттирующее течение: периоды ухудшений чередуются с периодами улучшений.
Через 4–5 нед развивается нисходящая атрофия разной степени выраженности. На глазном дне появляется деколорация диска зрительного нерва. При морфологическом исследовании выявляют изменения в слое ганглиозных клеток сетчатки и зрительном нерве, особенно выраженные в интраканаликулярной зоне.
При оказании помощи пострадавшему прежде всего нужно постараться вывести яд из организма (промывание желудка, солевое слабительное) и ввести антидот – этиловый спирт. Если больной в коме, то внутривенно вводят 10% раствор этилового спирта из расчета 1 г на 1 кг массытела, в среднем 700–800 мл при массе тела 70–80 кг. Внутрь – 50–80 мл алкоголя (водки) каждые 5 ч (в течение 2 сут). Показаны гемодиализ, инфузионная терапия (введение 4% раствора натрия гидрокарбоната), диуретики. В первые сутки введение окислителей метилового спирта (глюкозы, кислорода, витаминов) нецелесообразно.
Алкогольно–табачная интоксикация.
Токсические поражения зрительного нерва развиваются при злоупотреблении спиртными напитками и курением. Заболевание протекает как двусторонний хронический ретробульбарный неврит. В основе его развития лежит не только прямое токсическое воздействие алкоголя и никотина, но и возникновение эндогенного авитаминоза группы В: вследствие поражения слизистой оболочки желудочно–кишечного тракта и печени витамины группы В не усваиваются.Заболевание начинается исподволь, незаметно. Зрение ухудшается постепенно, больные обращаются к врачу, когда зрение снижено уже на несколько десятых. Слепота обычно не наступает, зрение сохраняется в пределах 0,1–0,2. В поле зрения выявляют центральную скотому и увеличенное слепое пятно. Постепенно расширяясь, они сливаются, образуя характерную центрацекальную скотому. Характерная жалоба больных – снижение зрения при ярком освещении: в сумерках и при слабом свете они видят лучше, чем днем, что объясняется поражением аксиального пучка и большей сохранностью периферических волокон, идущих от ганглиозных клеток, располагающихся на периферии сетчатки. На глазном дне в начале заболевания изменений не выявляют, позднее развивается нисходящая атрофия зрительного нерва, возникает выраженная деколорация височной половины, а затем и всего диска. При морфологическом исследовании констатируют очаги демиелинизации и фрагментарного распада волокон в зонах, соответствующих папилломакулярному пучку зрительного нерва (особенно в интраканаликулярном отделе), хиазмы и зрительного тракта. В последующем происходит замещение погибших волокон нервной ткани глиальной тканью.
При лечении прежде всего необходимо отказаться от приема алкоголя и курения. Несколько (2–3) раз в году проводят курсы лечения с применением витаминов группы В (парентерально), препаратов, улучшающих окислительно–восстановительные процессы, антиоксидантов и других симптоматических средств.
Токсические поражения зрительного нерва наблюдаются также при отравлении свинцом, хинином, сероуглеродом и передозировке или индивидуальной непереносимости сердечных гликозидов и сульфаниламидных препаратов.
Ишемическая нейропатия
В основе заболевания лежит острое нарушение артериального кровообращения в системе сосудов, питающих зрительный нерв. В развитии данной патологии основную роль играют следующие три фактора: нарушение общей гемодинамики, локальные изменения в стенке сосудов, коагуляционные и липопротеидные сдвиги в крови.Нарушения общей гемодинамики чаще всего обусловлены гипертонической болезнью, гипотонией, атеросклерозом, диабетом, возникновением стрессовых ситуаций и обильных кровотечений, атероматозом сонных артерий, окклюзирующими заболеваниями брахиоцефальных артерий, болезнями крови, развитием гигантоклеточного артериита.
Локальные факторы. В настоящее время придают большое значение местным локальным факторам, обусловливающим формирование тромбов. Среди них – изменение эндотелия стенки сосудов, наличие атероматозных бляшек и участков стеноза с образованием завихрения кровотока. Представленные факторы определяют патогенетически ориентированную терапию этого тяжелого заболевания.
Выделяют две формы ишемической нейропатии – переднюю и заднюю. Они могут проявляться в виде частичного (ограниченного) или полного (тотального) поражения.
Передняя ишемическая нейропатия – острое нарушение кровообращения в интрабульбарном отделе зрительного нерва. Изменения, происходящие в головке зрительного нерва, выявляют при офтальмоскопии (рис. 16.3).
 Рис. 16.4. Клиновидное выпадение поля зрения при ишемической нейропатии.
Рис. 16.4. Клиновидное выпадение поля зрения при ишемической нейропатии.
При тотальном поражении зрительного нерва зрение снижается до сотых и даже до слепоты, при частичном – сохраняется высоким, но отмечаются характерные клиновидные скотомы, причем вершина клина всегда обращена к точке фиксации взора (рис. 16.4). Клиновидные выпадения объясняются секторальным характером кровоснабжения зрительного нерва. Клиновидные дефекты, сливаясь, обусловливают квадрантное или половинчатое выпадение в поле зрения (рис. 16.5). Дефекты поля зрения чаще локализуются в его нижней половине. Зрение снижается в течение нескольких минут или часов. Обычно больные точно указывают день и час, когда резко снизилось зрение. Иногда могут отмечаться предвестники в виде головной боли или преходящей слепоты, но чаще заболевание развивается без предвестников. При офтальмоскопии виден бледный отечный диск зрительного нерва. Вторично изменяются сосуды сетчатки, прежде всего вены. Они широкие, темные, извитые. На диске и в парапапиллярной зоне могут быть кровоизлияния.
Продолжительность острого периода заболевания 4–5 нед. Затем отек постепенно уменьшается, кровоизлияния рассасываются и проявляется атрофия зрительного нерва разной степени выраженности. Дефекты поля зрения сохраняются, хотя могут значительно уменьшиться.
Задняя ишемическая нейропатия. Острые ишемические нарушения развиваются по ходу зрительного нерва за глазным яблоком – в интраорбитальном отделе. Это задние проявления ишемической нейропатии. Патогенез и клиническое течение заболевания идентичны таковым передней ишемической нейропатии, но в остром периоде отсутствуют изменения на глазном дне. Диск зрительного нерва естественного цвета с четкими границами. Лишь через 4–5 нед появляется деколорация диска, начинает развиваться частичная или полная атрофия. При тотальном поражении зрительного нерва центральное зрение может снижаться до сотых или до слепоты, как и при передней ишемической нейропатии, при частичном острота зрения может сохраняться высокой, но в поле зрения выявляют характерные клиновидные выпадения, чаще в нижних или нижненосовых отделах. Диагностика в ранней стадии сложнее, чем при ишемии головки зрительного нерва. Дифференциальную диагностику проводят с ретробульбарным невритом, объемными образованиями орбиты и центральной нервной системы.
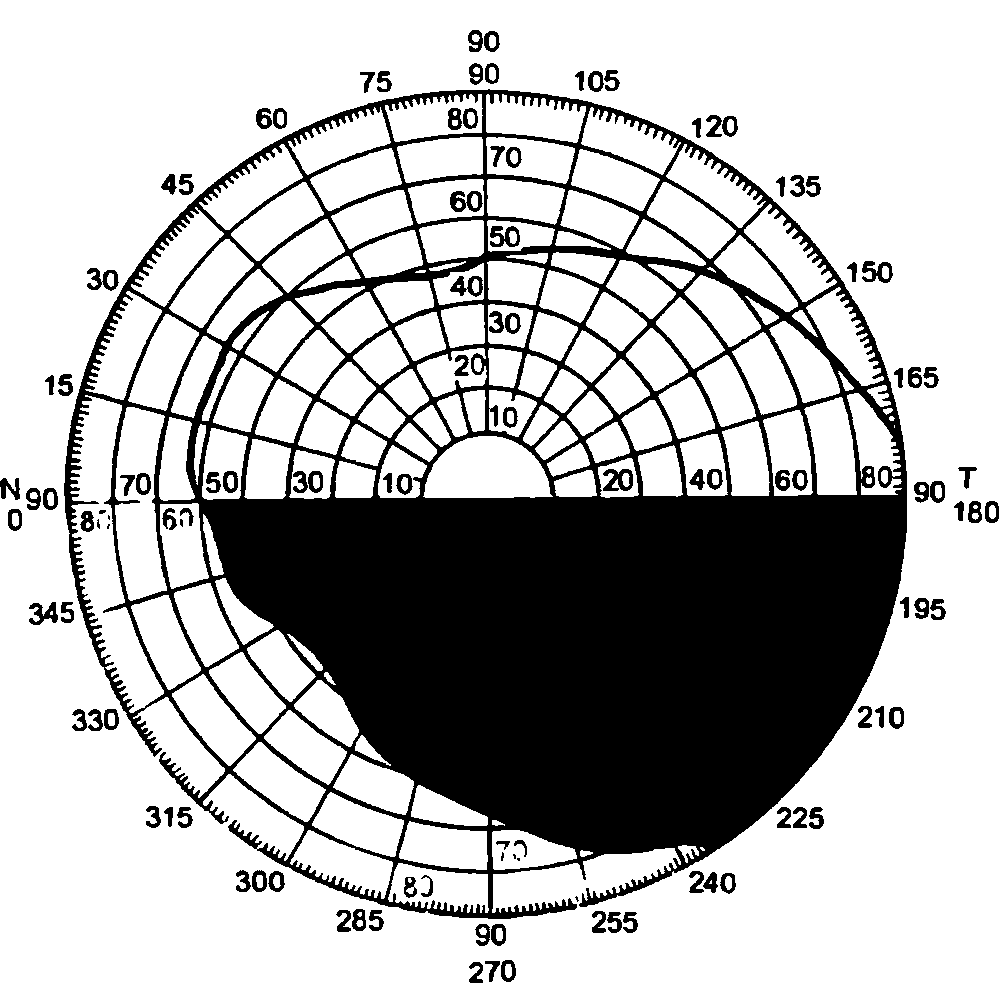 Рис. 16.5. Нижняя гемианопсия при ишемической нейропатии.
Рис. 16.5. Нижняя гемианопсия при ишемической нейропатии.
У Уз больных с ишемической нейропатией поражается второй глаз, в среднем через 1–3 года, но этот интервал может колебаться от нескольких дней до 10–15 лет.
Лечение ишемической нейропатии должно быть комплексным, патогенетически обусловленным с учетом общей сосудистой патологии больного.
Прежде всего предусматривается применение: ■ спазмолитических средств (сермион, ницерголин, трентал, ксантинол, никотиновая кислота и др.) ■ тромболитических препаратов – плазмина (фибринолизин) и его активаторов (урокиназа, гемаза, кавикиназа) ■ антикоагулянтов ■ симптоматических средств ■ витаминов группы В.
Проводят также магнитотерапию, электро– и лазерстимуляцию зрительного нерва.
Больные, перенесшие ишемическую нейропатию одного глаза, должны находиться под диспансерным наблюдением, им необходимо проводить соответствующую профилактическую терапию.
Застойный диск зрительного нерва
Застойный диск зрительного нерва – невоспалительный отек, являющийся признаком повышенного внутричерепного давления.Процессов, которые приводят к повышенному внутричерепному давлению, достаточно много. Первое место среди них занимают внутричерепные опухоли: они являются причиной возникновения застойных дисков зрительных нервов в ⅔ случаев. Среди других, менее значимых, причин повышения внутричерепного давления, а следовательно, и развития застойных дисков зрительных нервов следует назвать черепно–мозговую травму, посттравматическую субдуральную гематому, воспалительное поражение головного мозга и его оболочек, объемные образования неопухолевой природы, поражение сосудов и синусов головного мозга, гидроцефалию, внутричерепную гипертензию неясного генеза, опухоль спинного мозга. Выраженность застойных дисков зрительных нервов отражает степень повышения внутричерепного давления, но не зависит от величины объемного образования в полости черепа. Скорость развития застойного диска в большей степени обусловлена локализацией новообразования по отношению к ликворной системе головного мозга и венозным коллекторам, в частности к синусам головного мозга: чем ближе опухоль располагается к путям ликворооттока и синусам, тем быстрее развивается застойный диск зрительного нерва.
Клинически застойный диск проявляется его отеком, который обусловливает нечеткость рисунка и границ диска, а также гиперемию его ткани. Как правило, процесс двусторонний, но в редких случаях застойный диск может развиться только на одном глазу. Иногда односторонний застойный диск зрительного нерва сочетается с атрофией диска и низкими зрительными функциями на другом глазу (симптом Фостера–Кеннеди).
Отек возникает сначала по нижней границе диска, потом по верхней, затем последовательно отекают носовая и височная половины диска. Различают начальную стадию развития застойного диска, стадию максимального отека и стадию обратного развития отека.
По мере нарастания отека диск зрительного нерва начинает проминировать в стекловидное тело, отек распространяется на окружающую перипапиллярную сетчатку. Диск увеличивается в размерах (рис. 16.6), происходит расширение слепого пятна, выявляемое при исследовании поля зрения.
Зрительные функции могут сохраняться нормальными в течение достаточно длительного периода времени, что является характерным симптомом застойного диска зрительного нерва и важным дифференциально–диагностическим признаком. Таких пациентов к окулисту направляют терапевты и невропатологи для исследования глазного дна в связи с жалобами на головную боль.
Другой симптом застойного диска – внезапное кратковременное резкое ухудшение зрения вплоть до слепоты. Этот симптом связывают с преходящим спазмом артерий, питающих зрительный нерв. Частота возникновения таких приступов зависит от нескольких факторов, в том числе от степени выраженности отека диска, и может составлять до нескольких приступов в течение 1 ч.
По мере развития застойного диска увеличивается калибр вен сетчатки, свидетельствуя о затруднении венозного оттока. В определенных случаях возникают кровоизлияния, характерной локализацией которых является область диска и окружающая его сетчатка. Кровоизлияния могут появляться при выраженном отеке диска и свидетельствовать о значительном нарушении венозного оттока. Однако возможны кровоизлияния и при начальном или нерезко выраженном отеке. Причиной их развития в подобных случаях может быть быстрое, порой молниеносное, развитие внутричерепной гипертензии, например, при разрыве артериальной аневризмы и субарахноидальном кровоизлиянии, а также при злокачественной опухоли и токсическом воздействии на сосудистую стенку.
В стадии развитого отека, помимо описанных выше симптомов, могут появляться ватообразные белесые очаги и мелкие кровоизлияния в парамакулярной области на фоне отечной ткани, которые могут стать причиной понижения остроты зрения.
Выраженное понижение остроты зрения отмечается в случае развития атрофического процесса в зрительном нерве и перехода застойного диска зрительного нерва во вторичную (постзастойную) атрофию зрительного нерва, при которой офтальмоскопическая картина характеризуется бледным диском зрительного нерва с нечетким рисунком (рис. 16.7) и границами, без отека или со следами отека. Вены сохраняют свое полнокровие и извитость, артерии сужены. Кровоизлияний и белесых очагов на этом этапе развития процесса, как правило, уже не бывает. Как и всякий атрофический процесс, вторичная атрофия зрительного нерва сопровождается утратой зрительных функций. Помимо понижения остроты зрения, выявляют дефекты в поле зрения различного характера, которые могут быть обусловлены и непосредственно внутричерепным очагом поражения, но чаще начинаются в нижненосовом квадранте.
Поскольку застойный диск зрительного нерва является признаком внутричерепной гипертензии, очень важны его своевременное распознание и дифференциальная диагностика с другими сходными процессами в глазу. В первую очередь следует различать истинный отек диска зрительного нерва и псевдозастойный диск, при котором офтальмоскопическая картина напоминает таковую при застойном диске зрительного нерва, но обусловлена данная патология врожденной аномалией строения диска, наличием друз диска, часто сочетается с аномалией рефракции и выявляется уже в детском возрасте. Нельзя полностью полагаться на такой симптом, как наличие или отсутствие венного пульса, особенно в случаях аномального развития диска. Одним из основных симптомов, облегчающих дифференциальную диагностику, является стабильная офтальмоскопическая картина в процессе динамического наблюдения за пациентом при псевдозастой ном диске зрительного нерва. Проведение флюоресцирующей ангиографии глазного дна также помогает уточнить диагноз.
Однако в некоторых случаях очень сложно дифференцировать застойный диск зрительного нерва от таких заболеваний, как неврит зрительного нерва, начинающийся тромбоз центральной вены сетчатки, передняя ишемическая нейропатия, менингиома зрительного нерва. При этих заболеваниях также возникает отек диска зрительного нерва, но природа его иная. Он обусловлен патологическими процессами, развивающимися непосредственно в зрительном нерве, и сопровождается понижением зрительных функций разной степени выраженности.
В некоторых случаях в связи с затруднениями, возникающими при установлении диагноза, неизбежно проведение пункции спинного мозга с измерением давления цереброспинальной жидкости и исследованием ее состава.
При обнаружении признаков застойного диска зрительного нерва необходимо немедленно направить пациента на консультацию к нейрохирургу или невропатологу. Для уточнения причины возникновения внутричерепной гипертензии проводят компьютерную (КТ) или магнитно–резонансную (МРТ) томофафию головного мозга.
Атрофия зрительного нерва
Атрофия зрительного нерва клинически представляет собой совокупность признаков: нарушения зрительных функций (понижение остроты зрения и развитие дефектов поля зрения) и побледнения диска зрительного нерва. Атрофия зрительного нерва характеризуется уменьшением диаметра зрительного нерва вследствие уменьшения числа аксонов.Различают приобретенную и врожденную атрофию зрительного нерва.
Приобретенная атрофия зрительного нерва развивается в результате повреждения волокон зрительного нерва {нисходящая атрофия) или клеток сетчатки (восходящая атрофия).
К нисходящей атрофии приводят процессы, повреждающие волокна зрительного нерва на различном уровне (орбита, зрительный канал, полость черепа). Природа повреждения различна: воспаление, травма, глаукома, токсическое повреждение, нарушение кровообращения в сосудах, питающих зрительный нерв, нарушение метаболизма, сдавление зрительных волокон объемным образованием в полости глазницы или в полости черепа, дегенеративный процесс, близорукость и т. д.).
Каждый этиологический фактор обусловливают атрофию зрительного нерва с определенными, типичными для нее офтальмоскопическими особенностями, например глаукома, нарушение кровообращения в сосудах, питающих зрительный нерв. Тем не менее имеются характеристики, общие для атрофии зрительного нерва любой природы: побледнение диска зрительного нерва и нарушение зрительных функций.
Степень понижения остроты зрения и характер дефектов поля зрения определяются характером процесса, вызвавшего атрофию. Острота зрения может колебаться от 0,7 до практической слепоты.
По офтальмоскопической картине различают первичную (простую) атрофию, которая характеризуется побледнением диска зрительного нерва с четкими границами. На диске уменьшено число мелких сосудов (симптом Кестенбаума). Артерии сетчатки сужены, вены могут быть обычного калибра или также несколько сужены (рис. 16.8).
В зависимости от степени повреждения зрительных волокон, а следовательно, и от степени понижения зрительных функций и побледнения диска зрительного нерва различают начальную, или частичную, и полную атрофию зрительного нерва.
Время, в течение которого развивается побледнение диска зрительного нерва, и его выраженность зависят не только от характера заболевания, которое привело к атрофии зрительного нерва, но и от удаленности очага повреждения от глазного яблока. Так, например, при воспалительном или травматическом повреждении зрительного нерва первые офтальмоскопические признаки атрофии зрительного нерва появляются спустя несколько дней – несколько недель от начала заболевания или момента травмы. В то же время при воздействии объемного образования на зрительные волокна в полости черепа вначале клинически проявляются только зрительные расстройства, а изменения на глазном дне в виде атрофии зрительного нерва развиваются спустя много недель и даже месяцев.
Врожденную, генетически обусловленную атрофию зрительного нерва разделяют на аутосомно–доминантную, сопровождающуюся асимметричным понижением остроты зрения от 0,8 до 0,1, и аутосомно–рецессивную, характеризующуюся понижением остроты зрения нередко до практической слепоты уже в раннем детском возрасте.
При выявлении офтальмоскопических признаков атрофии зрительного нерва необходимо провести тщательное клиническое обследование пациента, включающее определение остроты зрения и границ поля зрения на белый, красный и зеленый цвета, исследование внутриглазного давления.
В случае развития атрофии на фоне отека диска зрительного нерва даже после исчезновения отека сохраняется нечеткость границ и рисунка диска. Такую офтальмоскопическую картину называют вторичной (постотечной) атрофией зрительного нерва. Артерии сетчатки сужены в калибре, в то время как вены расширены и извиты (см. рис. 16.7).
При обнаружении клинических признаков атрофии зрительного нерва необходимо в первую очередь установить причину развития этого процесса и уровень повреждения зрительных волокон. С этой целью проводят не только клиническое обследование, но также КТ и/или МРТ головного мозга и глазниц.
Помимо этиологически обусловленного лечения, применяют симптоматическую комплексную терапию, включающую сосудорасширяющую терапию, витамины С и группы В, препараты, улучшающие метаболизм ткани, различные варианты стимулирующей терапии, в том числе электро–, магнито– и лазерстимуляцию зрительного нерва.
Глава 17. Глаукома, гипотензия глаза
Пока видят глаза – не понимаешь, что такое зрение.Народная мудрость
Глаукома
Термин "глаукома" объединяет большую группу заболеваний глаза (около 60), имеющих следующие особенности: внутриглазное давление (ВГД) постоянно или периодически превышает толерантный (индивидуально переносимый) уровень; развивается характерное поражение головки зрительного нерва (ГЗН) и ганглионарных клеток сетчатки (глаукомная оптическая нейропатия – ГОН); возникают характерные для глаукомы нарушения зрительных функций.Глаукома может возникать в любом возрасте, начиная с рождения, но распространенность заболевания значительно увеличивается в пожилом и старческом возрасте. Так, врожденная глаукома наблюдается у 1 на 10.000–20.000 новорожденных, в возрасте 40–45 лет первичная глаукома наблюдается примерно у 0,1% населения, 50–60 лет – у 1,5%, 75 лет и старше – более чем у 3%.
Следующие патогенетические этапы лежат в основе развития многообразных клинических форм глаукомного процесса: ■ нарушения циркуляций водянистой влаги (ВВ), приводящие к ухудшению ее оттока из глаза ■ ВГД выше толерантного для зрительного нерва уровня ■ ишемия и гипоксия ГЗН ■ глаукомная оптическая нейропатия ■ дегенерация (апоптоз) ганглиозных клеток сетчатки.
Выраженность 2–го и 3–го этапов может существенно варьировать при различных формах глаукомного процесса и в каждом конкретном случае. Разделение глаукомного процесса на этапы до некоторой степени условно. Вместе с тем каждый предыдущий этап принимает участие в возникновении последующих.
Внутриглазное давление
Физиологическая роль ВГД заключается в том, что оно обеспечивает поддержание сферической формы глазного яблока и правильных топографических взаимоотношений его внутренних структур, а также облегчает обменные процессы в этих структурах и выведение продуктов обмена из глаза. Вместе с тем ВГД оказывает неблагоприятное влияние на циркуляцию крови во внутриглазных сосудах вследствие повышения венозного давления и снижения перфузионного давления крови.Глазное яблоко представляет собой шаровидное тело с жидким содержимым и упругими оболочками. Величина ВГД зависит от ригидности (упругости) оболочек и объема содержимого глаза. Ригидность можно считать постоянной величиной для одного и того же глаза. Следовательно, изменение ВГД (ДР) является функцией прироста объема глаза (AV): АР = f(AV). В клинических условиях тонус глаза измеряют с помощью тонометров. Все известные тонометры сдавливают глаз, в результате чего в нем повышается ВГД, поэтому различают истинное (Р0) и тонометрическое (Рт) давление. С помощью широко применяемых в России тонометров Маклакова массой 5–15 г определяют тонометрическое давление, а показания апланационного тонометра Гольдманна и бесконтактных пневмотонометров соответствуют истинному давлению.
 Рис. 17.1. Примеры ритмичных колебаний внутриглазного давления при глаукоме: амплитуда глазного пульса около 1,5 мм рт.ст. На нижней тонограмме амплитуда волн третьего порядка (Геринга–Траубе) достигает 2,5 мм рт.ст.
Рис. 17.1. Примеры ритмичных колебаний внутриглазного давления при глаукоме: амплитуда глазного пульса около 1,5 мм рт.ст. На нижней тонограмме амплитуда волн третьего порядка (Геринга–Траубе) достигает 2,5 мм рт.ст.
Следует различать уровень ВГД и его кратковременные колебания. Давление в глазу повышается при мигании, сжатии глаза, надавливании на глазное яблоко, ритмичных колебаниях кровенаполнения внутриглазных сосудов (глазной пульс, дыхательные волны, волны Геринга–Траубе; рис. 17.1). Уровень ВГД относительно стабилен и изменяется только при нарушениях циркуляции ВВ.
Относительное постоянство уровня ВГД свидетельствует о существовании активных механизмов его регуляции. Скорость продукции ВВ, по–видимому, находится под контролем гипоталамуса и вегетативной нервной системы. На отток жидкости из глаза оказывают влияние колебания тонуса цилиарной мышцы. Получены данные о существовании биохимической ’регуляции оттока ВВ. Полагают, что в трабекулярном аппарате (ТА) имеются сократительные элементы, напряжение которых регулируется оксидом азота и эндотелинами: под влиянием оксида азота отток ВВ через ТА усиливается, а повышение концентрации эндотелинов приводит к ухудшению оттока.
Нормальный уровень истинного ВГД варьирует от 9 до 21 мм рт.ст., нормативы для тонометра Маклакова массой 10 г – от 17 до 26мм рт.ст., массой 5 г – от 11 до 21 мм рт.ст. Поскольку нормативы рассчитаны с помощью методов вариационной статистики для 95–97% здоровых людей, в отдельных случаях ВГД в неглаукоматозных глазах может выходить за пределы верхней границы нормы на 2–3 мм рт.ст. Вместе с тем индивидуальные нормы ВГД уже статистических нормативов. В связи с этим продолжительное превышение верхней границы индивидуальной нормы ВГД может иметь опасные последствия, даже если давление находится в пределах статистических нормативов.
В последнее время все большее распространение получает понятие "толерантное ВГД". Под этим термином понимают диапазон ВГД, безопасного для конкретного человека. Толерантное ВГД не только подвержено индивидуальным колебаниям» но также изменяется в течение жизни и под влиянием некоторых общих и глазных заболеваний. В частности, отмечается тенденция к его снижению при сосудистых поражениях и прогрессировании глаукомного процесса. В связи с этим индивидуальная величина толерантного давления может быть существенно ниже верхней границы статистически нормального ВГД.
Возрастные изменения уровня ВГД невелики и не имеют клинического значения. Выраженные колебания ВГД наблюдаются в течение суток: как правило, максимальная величина офтальмотонуса отмечается в ранние утренние часы, к вечеру он снижается и достигает минимума ночью, реже наблюдается вечерний или дневной максимум ВГД. Амплитуда суточных колебаний ВГД не превышает 4–5 мм рт.ст.
Циркуляция водянистой влаги
ВВ непрерывно продуцируется (1,5–4 ммумин) цилиарной короной при активном участии непигментного эпителия и в меньшем количестве в процессе ультрафильтрации из капиллярной сети. Влага заполняет заднюю и переднюю камеры глаза (рис. 17.2) и оттекает в основном (85%) в эписклеральные вены по дренажной системе глаза, расположенной на передней стенке угла передней камеры. Около 15% ВВ уходит из глаза, просачиваясь через строму цилиарного тела и склеру в увеальные и склеральные вены – увеосклеральный путь оттока ВВ (рис. 17.3).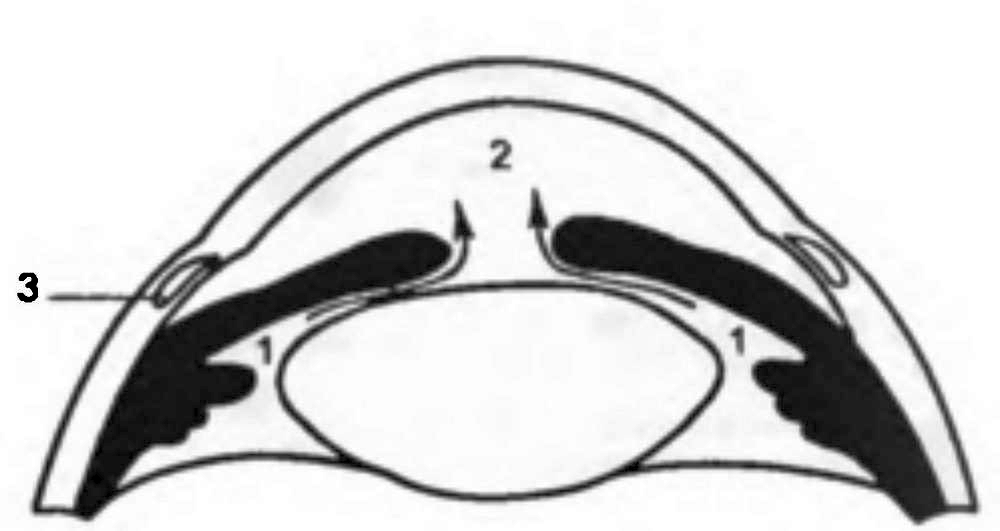 Рис. 17.2. Передний сегмент глаза.
1 – задняя камера; 2 – передняя камера; 3 – шлеммов канал. Стрелками указан путь оттока водянистой влаги из задней камеры в переднюю.
Рис. 17.2. Передний сегмент глаза.
1 – задняя камера; 2 – передняя камера; 3 – шлеммов канал. Стрелками указан путь оттока водянистой влаги из задней камеры в переднюю.
ВВ сначала поступает в заднюю камеру глаза, объем которой составляет около 80 мм3, а затем через зрачок переходит в переднюю камеру (объем 150–250 мм*), которая служит ее основным резервуаром. При плотном контакте радужки с хрусталиком переход жидкости из задней камеры в переднюю затруднен, что приводит к повышению давления в задней камере (относительный зрачковый блок).
 Рис. 17.3. Увеосклеральный путь оттока водянистой влаги (стрелки) из угла передней камеры через структуры цилиарного тела и склеру.
Рис. 17.3. Увеосклеральный путь оттока водянистой влаги (стрелки) из угла передней камеры через структуры цилиарного тела и склеру.
Угол передней камеры
Угол передней камеры (УПК) – наиболее узкая часть передней камеры. Передняя стенка УПК образована кольцом Швальбе, ТА и склеральной шпорой, задняя – корнем радужки, вершина – основанием цилиарной короны (рис. 17.4).В вершине УПК иногда расположены остатки эмбриональной увеальной ткани в виде узких или широких тяжей (гребенчатая связка), идущих от корня радужки к склеральной шпоре или ТА.
УПК классифицируют по его ширине и степени пигментации на основании результатов гониоскопии (рис. 17.5). Широкий угол (40–45°) – видны все структуры УПК (IV), среднеширокий (25–35°) – определяется только часть вершины угла (III), узкий (15–20°) – цилиарное тело и склеральная шпора не видны (II), щелевидный (5–10°) – определяется только часть ТА (I), закрытый – структуры УПК не просматриваются (0).
Степень пигментации УПК кодируют арабскими цифрами от 0 (нет пигментации) до 4 (плотная пигментация всех структур от кольца Швальбе до цилиарного тела).Пигмент откладывается в УПК при распаде клеток пигментного эпителия радужки и цилиарного тела.
Дренажная система глаза
Дренажная система глаза состоит из ТА, склерального синуса (шлеммов канал) и коллекторных канальцев (рис. 17.6).ТА представляет собой кольцевидную перекладину, переброшенную через внутреннюю склеральную бороздку. На разрезе ТА имеет форму треугольника, вершина которого прикрепляется к переднему краю бороздки (пограничное кольцо Швальбе), а основание – к ее заднему краю (склеральная шпора). Трабекулярная диафрагма состоит из трех основных частей: увеальной трабекулы, корнеосклеральной трабекулы и юкстаканаликулярной ткани. Две первые части имеют слоистое строение. Каждый слой (всего их 10–15) представляет собой пластинку, состоящую из коллагеновых фибрилл и эластических волокон, покрытую с обеих сторон базальной мембраной и эндотелием. В пластинах имеются отверстия, а между пластинами – щели, заполненные ВВ. Юкстаканаликулярный слой, состоящий из 2–3 слоев фиброцитов и рыхлой волокнистой ткани, оказывает наибольшее сопротивление оттоку ВВ из глаза. Наружная поверхность юкстаканаликулярного слоя покрыта эндотелием, содержащим "гигантские" вакуоли (рис. 17.7). Последние являются динамическими внутриклеточными канальцами, по которым ВВ переходит из ТА в шлеммов канал.



 Рис. 17.4. Структура угла передней камеры глаза.
а – на меридиональном срезе; б – картина при гониоскопии. 1 – переднее пограничное кольцо Швальбе; 2 – трабекулярный аппарат; 3 – шлеммов канал; 4 – склеральная шпора; 5 – цилиарное тело
Рис. 17.4. Структура угла передней камеры глаза.
а – на меридиональном срезе; б – картина при гониоскопии. 1 – переднее пограничное кольцо Швальбе; 2 – трабекулярный аппарат; 3 – шлеммов канал; 4 – склеральная шпора; 5 – цилиарное тело
 Рис. 17.5. Классификация утла передней камеры глаза по ширине а – широкий; б – средней ширины; в – узкий; г – щелевидный
Рис. 17.5. Классификация утла передней камеры глаза по ширине а – широкий; б – средней ширины; в – узкий; г – щелевидный
 Рис. 17.6. Дренажная система глаза (схема).
I – угол передней камеры, 2 – трабекулярный аппарат: 3 – шлеммов канал; 4 – колпекторный каналец
Рис. 17.6. Дренажная система глаза (схема).
I – угол передней камеры, 2 – трабекулярный аппарат: 3 – шлеммов канал; 4 – колпекторный каналец
 Рис. 17.7. Гигантская вакуоль (1), расположенная в эндотел иоците (2) между шлеммовым каналом (3) и юкстаканаликулярным слоем трабекулярного аппарата (4). *30.000.
Рис. 17.7. Гигантская вакуоль (1), расположенная в эндотел иоците (2) между шлеммовым каналом (3) и юкстаканаликулярным слоем трабекулярного аппарата (4). *30.000.
Шлеммов канал представляет собой циркулярную щель, выстланную эндотелием и расположенную в задненаружной части внутренней склеральной бороздки (см. рис. 17.4). От передней камеры он отделен ТА, кнаружи от канала расположены склера и эписклера с венозными и артериальными сосудами. ВВ оттекает из шлеммова канала по 20–30 коллекторным канальцам в эписклеральные вены (вены–реципиенты).
Гидродинамические показатели
Состояние гидродинамики глаза определяют на основании гидродинамических показателей. К последним относят ВГД, давление оттока, минутный объем ВВ и коэффициент легкости оттока ВВ из глаза. Давление оттока – это разность между ВГД и давлением в эписклеральных венах (Р0–Pv), минутный объем ВВ (F), выражаемый в кубических миллиметрах, характеризует объемную скорость продукции и оттока ВВ при стабильном ВГД, коэффициент легкости оттока (КЛО) – величина, показывающая, какой объем жидкости (в кубических миллиметрах) оттекает из глаза за 1 мин на 1 мм рт.ст. давления оттока.Гидродинамические показатели связаны между собой следующим уравнением:
Р0 = F/C + Pv.
В клинической практике значение Р0 определяют при тонометрии, КЛО (С) – тонографии, Pv принимают равным 10 мм рт.ст., F рассчитывают с помощью приведеного выше уравнения. Для здоровых глаз значения КЛО находятся в пределах от 0,18 до 0,45 мм5/мин/мм рт.ст., a F – от 1,5 до 4 мм3/мин (в среднем 2 мм3/мин).
Гидродинамические блоки
Гидродинамический блок – выраженное нарушение циркуляции ВВ в глазу или дренажной системе глаза – служит основной причиной повышения ВГД ири глаукоме.Различают следующие варианты гидродинамического блока: ■ неполное эмбриональное развитие УПК (лисгенез УПК) ■ зрачковый блок ■ блокада УПК корнем радужки ■ блокада УПК гониосинехиями ■ витреохрусталиковый блок ■ трабекулярный блок ■ блокада шлеммова канала (каналикулярный блок).
Дисгенез УПК служит причиной развития врожденной первичной глаукомы, следующие 4 вида блока характерны для первичной и вторичной закрытоугольной глаукомы, последние 3 вида – для открытоугольной глаукомы (первичной или вторичной). Описание блоков и их роли в патогенезе отдельных форм глаукомы приведены в других разделах настоящей главы.
Головка зрительного нерва в норме и при глаукоме
К головке зрительного нерва относят его внутриглазную часть и прилежащий к глазу участок нерва (протяженностью I–3 мм), кровоснабжение которого в некоторой степени зависит от уровня ВГД. Термин "диск зрительного нерва (ДЗН)" используют для обозначения видимой при офтальмоскопии части ГЗН.Анатомия и кровоснабжение
ГЗН состоит из аксонов ганглионарных клеток сетчатки (ГКС), астроглии, сосудов и соединительной ткани. Количество нервных волокон в зрительном нерве варьирует от 700.000 до 1 200.000, с возрастом оно постепенно уменьшается. Ежегодная потеря аксонов составляет около 4.000. ГЗН делят на 4 отдела (рис. 17.8): поверхностный (ретинальный), преламинарный, ламинарный и ретроламииариый. Поверхностный отдел образован аксонами ГКС (95% объема) и астроцитами (5%), в преламинарном отделе количество астроцитов значительно больше (20–25%), их отростки образуют глиальную решетчатую структуру. В ламинарном отделе к нервным волокнам и астроглии добавляется соединительная ткань, из которой образована решетчатая пластинка склеры (lamina cribrosa). Ретроламинарный отдел существенно отличается от других отделов ГЗН: в нем уменьшается количество астроцитов, появляется олигодендроглия, нервные волокна одеваются в миелииовые оболочки, а зрительный нерв – в мозговые.Решетчатая пластинка склеры состоит из нескольких перфорированных листков соедииительной ткани, разделенных астроглиальными прослойками. Перфорации образуют 200–400 канальнев, через каждый из которых проходит пучок нервных волокон (рис. 17.9). В верхнем и нижнем сегментах решетчатая пластинка тоньше, а отверстия в ней шире, чем на других ее участках. Эти сегменты легче деформируются при повышении ВГД.
 Рис. 17.8. Слои головки зрительного нерва.
I – ретинальный; 2 – преламинарный; 3 – ламинарный; 4 – рстроламинарный.
Рис. 17.8. Слои головки зрительного нерва.
I – ретинальный; 2 – преламинарный; 3 – ламинарный; 4 – рстроламинарный.
 Рис. 17.9. Прохождение пучков нервных волокон зрительного нерва через отверстия в слоях решетчатой пластинки склеры (схема).
Рис. 17.9. Прохождение пучков нервных волокон зрительного нерва через отверстия в слоях решетчатой пластинки склеры (схема).
Диаметр ДЗН варьирует от 1,2 до 2,0 мм, а его площадь – от 1,1 до 3,4 мм2. Следовательно, при одинаковом уровне ВГД деформирующая сила, действующая на ДЗН, может различаться в 3 раза. Величина ДЗН зависит от размера склерального канала. При близорукости канал более широкий, при гиперметропии – более узкий.
В ДЗН различают невральное (нейроретинальное) кольцо и центральное углубление – физиологическую экскавацию, в которой расположен фиброглиальный тяж, содержащий центральные сосуды сетчатки (рис. 17.10). Топографические особенности расположения нервных волокон в ДЗН представлены на рис. 17.11.
 Рис. 17.10. Диск зрительного нерва (схема, меридиональный срез).
1 – нейроретинальное кольцо; 2 – физиологическая экскавация с центральными сосудами сетчатки; 3 – центральная артерия сетчатки; 4 – центральная вена сетчатки.
Рис. 17.10. Диск зрительного нерва (схема, меридиональный срез).
1 – нейроретинальное кольцо; 2 – физиологическая экскавация с центральными сосудами сетчатки; 3 – центральная артерия сетчатки; 4 – центральная вена сетчатки.
 Рис. 17.11. Топография нервных волокон в диске зрительного нерва (схема).
1 и 2 – положение верхне– и нижневисочных аксонов ганглионарных клеток сетчатки; 3 и 4 – позиция верхне– и нижненосовых волокон; 5 – папилломакулярный пучок нервных волокон. N, Т – назальная и темпоральная стороны сетчатки.
Рис. 17.11. Топография нервных волокон в диске зрительного нерва (схема).
1 и 2 – положение верхне– и нижневисочных аксонов ганглионарных клеток сетчатки; 3 и 4 – позиция верхне– и нижненосовых волокон; 5 – папилломакулярный пучок нервных волокон. N, Т – назальная и темпоральная стороны сетчатки.
Вокруг ДЗН могут располагаться (не во всех случаях) склеральное кольцо (узкая щель между ДЗН и хориоидеей), а также α– и β–зоны. β–Зона – кольцо неравномерной ширины и часто неполное, образовавшееся в результате ретракции или дистрофии пигментного эпителия сетчатки и хориоидеи (рис. 17.12). Эта зона больше выражена с височной стороны ДЗН и часто наблюдается при близорукости и косом диске. α–Зона характеризуется гиперпигментацией и располагается по краю ДЗН или, если есть β–зона, по ее наружному краю.
Кровоснабжение преламинарного и ламинарного отделов ГЗН осуществляется из ветвей задних коротких цилиарных артерий (ЗКЦА), а ретинального отдела – из системы центральной артерии сетчатки (ЦАС). Ретроламинарный отдел ГЗН получает питание в основном из ЗКЦА, но также из центропетальных ветвей пиальных артерий и центрофугальных ветвей ЦАС. Ветви ЗКЦА могут образовывать в ГЗН полное или неполное артериальное кольцо (кольцо Цинна – Галлера). Зависимость кровотока от ВГД в ретроламинарном отделе ГЗН обусловлена существованием возвратных артериальных ветвей, идущих от внутриглазной части ГЗН (рис. 17.13).
 Рис. 17.12. Диск зрительного нерва в глазу с миопией и глаукомой. Видна обширная β–зона с височной стороны диска.
Рис. 17.12. Диск зрительного нерва в глазу с миопией и глаукомой. Видна обширная β–зона с височной стороны диска.
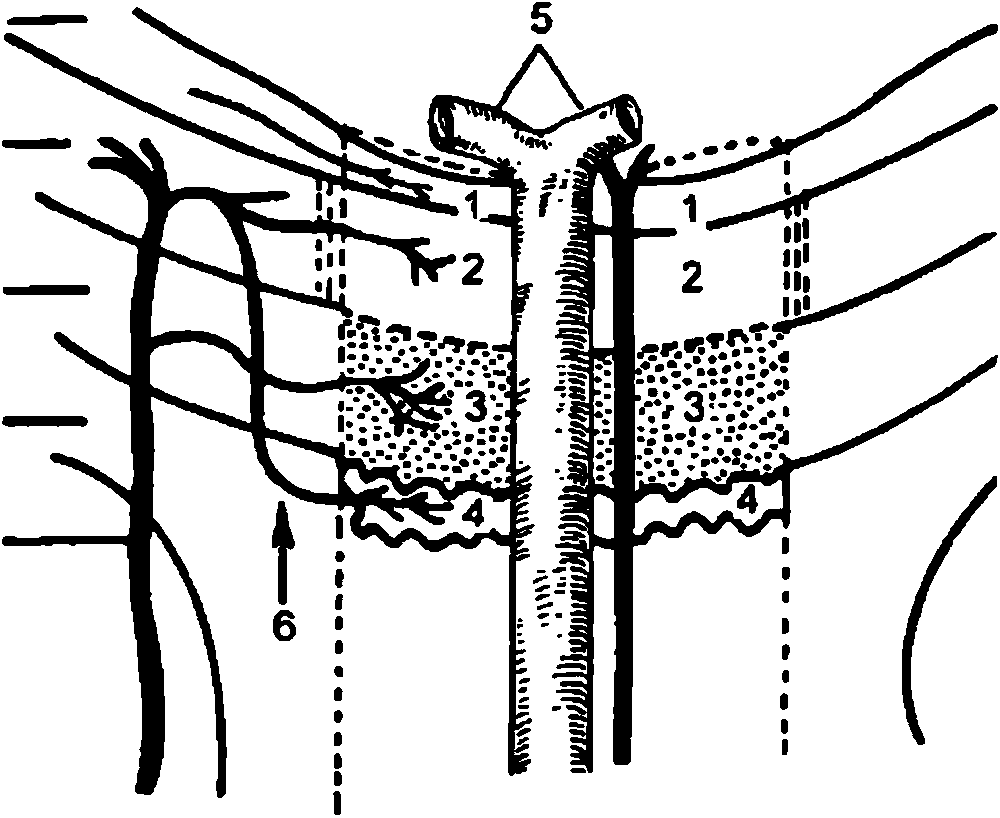 Рис. 17.13. Кровоснабжение головки зрительного нерва (схема): ретинальный слой (1) получает питание из ветвей центральной артерии сетчатки (5), преламинарный (2) и ламинарный (3) – из задних коротких цилиарных артерий ретроламинарный (4) – частично из возвратных ветвей задних коротких цилиарных артерий (6).
Рис. 17.13. Кровоснабжение головки зрительного нерва (схема): ретинальный слой (1) получает питание из ветвей центральной артерии сетчатки (5), преламинарный (2) и ламинарный (3) – из задних коротких цилиарных артерий ретроламинарный (4) – частично из возвратных ветвей задних коротких цилиарных артерий (6).
Микрососудистые сети ГЗН и сетчатки имеют одинаковое строение. Они осуществляют барьерную функцию и обладают выраженной способностью к ауторегуляции кровообращения. Кровоснабжение ГЗН имеет сегментарный характер, обусловленный существованием зон раздела сосудистой сети.
Особенности глаукомной оптической нейропатии
Глаукомная оптическая нейропатия – основное звено в патогенезе глаукомы, так как ее возникновение и развитие служат непосредственной причиной снижения зрительных функций и слепоты у больных глаукомой.Для ГОН характерны особенности, позволяющие отличить ее от других поражений зрительного нерва. Медленный процесс кавернозной дегенерации нервных волокон продолжается в течение многих лет. При этом сначала поражаются только отдельные пучки нервных волокон, являющиеся аксонами крупных ганглиозных клеток (М–клетки), расположенными в парамакулярной зоне сетчатки. Решетчатая пластинка склеры прогибается кзади, канальцы в ней деформируются (рис. 17.14). Атрофия нервных волокон начинается на уровне этой пластинки.
Прогрессирующее расширение центральной экскавации вследствие атрофии нервных волокон сопровождается неравномерным сужением неврального кольца (рис. 17.15) вплоть до полного его исчезновения в терминальной стадии болезни. В отличие от большинства других нейропатий распад нервных волокон не сопровождается пролиферацией астроглии и соединительной ткани. Атрофический процесс распространяется на сетчатку, в которой образуются характерные дефекты в слое нервных волокон ганглионарных клеток.
 Рис. 17.14. Деформация опорных структур головки зрительного нерва при повышенном ВГД в эксперименте, х40.
Рис. 17.14. Деформация опорных структур головки зрительного нерва при повышенном ВГД в эксперименте, х40.
 Рис. 17.15. Субтотальная экскавация диска зрительного нерва у больного с далеко зашедшей глаукомой; с височной стороны видна (3–зона.
Рис. 17.15. Субтотальная экскавация диска зрительного нерва у больного с далеко зашедшей глаукомой; с височной стороны видна (3–зона.
Нередко на ДЗН или около него в результате тромбирования микрососудов возникают расслаивающие геморрагии. ГОН часто сочетается с атрофическими изменениями в перипапиллярной хориоидее, ведущими к возникновению или расширению β–зоны (halo glaucomatosa).
Патогенез. Несмотря на многочисленные исследования, патофизиологические механизмы ГОН изучены не полностью. Ниже суммированы основные факторы, которым придают значение в патогенезе ГОН.
Продолжительное повышение ВГД приводит к механической деформации опорных структур ГЗН, неравномерному прогибу кзади решетчатой пластинки склеры и ущемлению в ее канальцах пучков нервных волокон, которое сопровождается нарушением их проводимости, а затем и атрофией. К аналогичным последствиям может привести снижение давления цереброспинальной жидкости в ретроламинарном отделе ГЗН.
Диффузная или фокальная ишемия также может послужить причиной развития характерных для глаукомы процессов в ГЗН. Ишемия может быть обусловлена изменениями в микрососудах и реологии крови, снижением перфузионного давления крови из–за повышения ВГД, дисфункцией сосудистого эндотелия и нарушением ауторегуляции кровообращения в ГЗН.
Механическое давление на ГЗН и ишемия служат пусковыми факторами, ведущими к развитию глаукомной оптической нейропатии. При экспериментальной глаукоме обнаруживают остановку всех видов аксоплазматического транспорта на уровне решетчатой пластинки склеры. Прекращение поступления нейротрофических компонентов от терминалов аксонов к телу клетки может служить причиной апоптоза – программированной смерти клеток.
В процессе апоптоза из поврежденных ганглионарных клеток действуют цитотоксические факторы, которые вызывают повреждение соседних клеток, расширяя таким образом сферу поражения. К таким факторам относят глутамат, перекиси, избыточное поступление в клетки ионов кальция, супероксид–аниона и оксида азота, образование токсичного для клеток пероксинитрита.
Офтальмоскопические симптомы. Различают несколько клинических разновидностей глаукомной экскавации ДЗН: вертикально–овальную, темпоральную, блюдцевидную и колбовидную экскавации, а также экскавацию с выемкой (рис. 17.16). Первые два типа характеризуются расширением экскавации во все стороны, но все же больше в нижне– и/или верхнетемпоральном направлениях. Края экскавации могут быть крутыми, подрытыми или пологими. В последнем случае углубление в ДЗН иногда имеет два уровня, напоминая по форме блюдце (блюдцевидная экскавация). Экскавация с выемкой характеризуется прорывом к верхнему или нижнему полюсу, колбовидная – подрытыми краями, она часто наблюдается при далеко зашедшей и терминальной глаукоме. Плоская и мелкая экскавация, занимающая весь диск или его височную половину,иногда имеет неглаукоматозное происхождение. Она встречается у лиц старческого возраста (склеротическая экскавация) и при близорукости высокой степени.
Изменения зрительных функций. Изменения зрительных функций при хронической глаукоме возникают незаметно для больного и медленно прогрессируют, их обнаруживают с помощью психофизических методов исследования только после потери значительной (30% и более) части нервных волокон в ГЗН. Это затрудняет выявление ГОН в ранней стадии и дифференциальную диагностику глаукомы и доброкачественной офтальмогипертензии.
Изменения зрительных функций» при ГОН проявляются в снижении светочувствительности, замедлении сенсомоторной реакции, снижении пространственной и временной контрастной чувствительности. Эти изменения могут быть диффузными и фокальными. Диффузные изменения зрительных функций не специфичны для глаукомы. Они наблюдаются при различных поражениях светопроводящей и световоспринимающей систем глаза. Фокальные изменения вызваны поражением отдельных пучков нервных волокон в ГЗН. Они проявляются в образовании характерных для глауком очаговых или секторальных дефектов поля зрения.
 Рис. 17.16. Основные типы глаукомной экскавации диска зрительного нерва, а – темпоральная; б – блюдцевидная; в – с выемкой; г – колбовидная.
Рис. 17.16. Основные типы глаукомной экскавации диска зрительного нерва, а – темпоральная; б – блюдцевидная; в – с выемкой; г – колбовидная.
Исследование поля зрения проводят с помощью периметрии или кампиметрии, при этом оценивают состояние всего поля зрения или его центрального отдела в пределах 25–30° от точки фиксации взора. Различают кинетическую и статическую периметрию. Первая позволяет определить границы поля зрения, положения изоптер, топографию и размер относительных и абсолютных скотом. Статическая периметрия имеет пороговые и надпороговые программы. В первом случае определяют пороговые значения дифференциальной световой чувствительности глаза в исследуемых точках поля зрения. Надпороговые методы позволяют выявить только грубые нарушения светочувствительности; их часто используют как скрининговые методики.
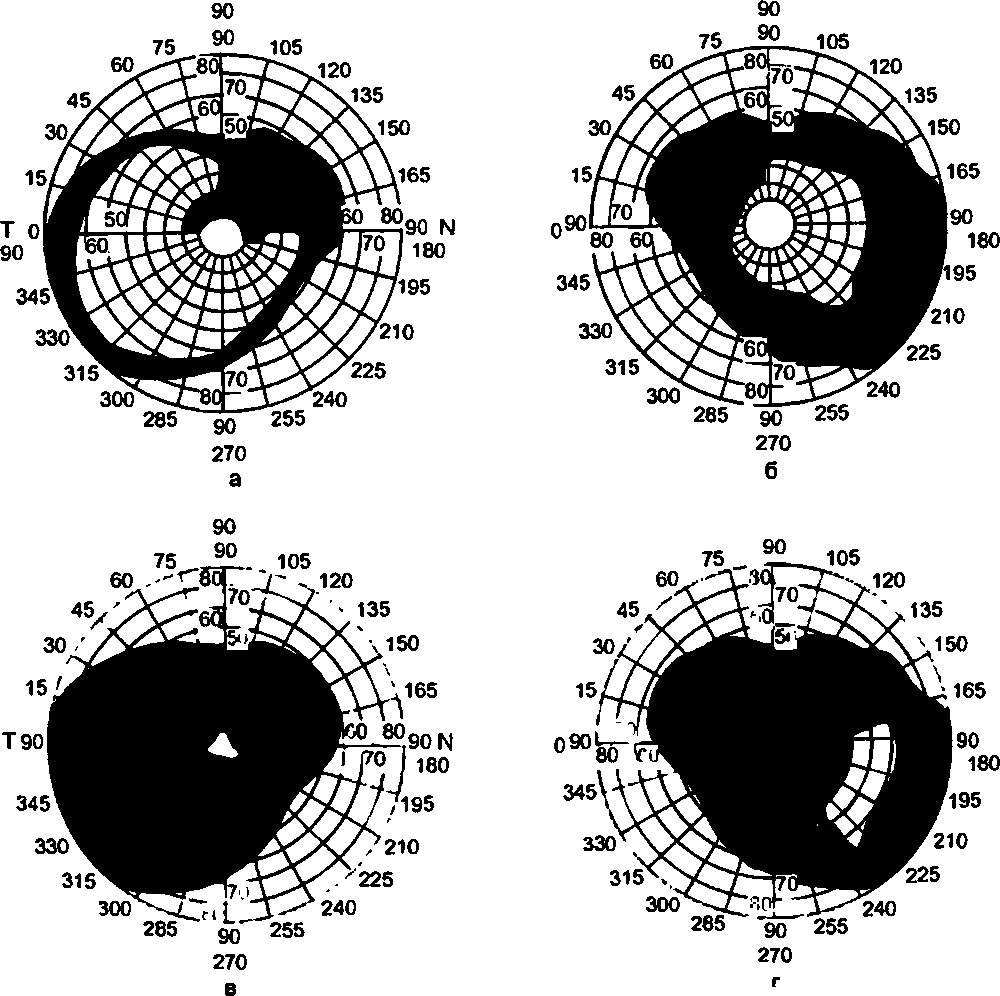 Рис. 17.18. Последовательность изменений периферического поля зрения.
а – сужение с носовой стороны; б – концентрическое сужение; в, г – остаточный островок центрального и периферического зрения.
Рис. 17.18. Последовательность изменений периферического поля зрения.
а – сужение с носовой стороны; б – концентрическое сужение; в, г – остаточный островок центрального и периферического зрения.
 Рис. 17.19. Изменения центрального поля зрения при глаукоме (статическая автоматическая периметрия). Серым цветом показаны относительные, черным – абсолютные дефекты светочувствительности глаза, располагающиеся преимущественно в парацентральных отделах поля зрения.
Рис. 17.19. Изменения центрального поля зрения при глаукоме (статическая автоматическая периметрия). Серым цветом показаны относительные, черным – абсолютные дефекты светочувствительности глаза, располагающиеся преимущественно в парацентральных отделах поля зрения.
 Рис. 17.17. Изменения центрального поля зрения при глаукоме (кинетическая периметрия), а – парацентральные относительные скотомы; б – дуговая относительная скотома в зоне Бьеррума и увеличение слепого пятна; в – начальная ступенька на изоптере; г – кольцевая абсолютная парацентраьная скотома.
Рис. 17.17. Изменения центрального поля зрения при глаукоме (кинетическая периметрия), а – парацентральные относительные скотомы; б – дуговая относительная скотома в зоне Бьеррума и увеличение слепого пятна; в – начальная ступенька на изоптере; г – кольцевая абсолютная парацентраьная скотома.
Для глаукомы характерна следующая последовательность изменений поля зрения: увеличение размеров слепого пятна, появление относительных и абсолютных парацентральных скотом и назальной ступеньки на изоптерах; сужение поля зрения с носовой стороны; концентрическое сужение поля зрения; светоощущение с неправильной проекцией света; полная слепота (рис. 17.17–17.19).
Изменения зрительных функций при ГОН включают органические и функциональные компоненты. Последние могут быть устранены или по крайней мере уменьшены с помощью рационального лечения.
Классификация
Основные типы глаукомы. Различают врожденную глаукому, первичную глаукому взрослых и вторичную глаукому. Врожденная глаукома генетически детерминирована (первичная врожденная глаукома) или вызвана заболеваниями и травмами плода в период эмбрионального развития или в процессе родов. Этот тип глаукомы проявляется в лервые недели, месяцы, но иногда и через несколько лет после рожденя. Первичная глаукома у взрослых имеет мультифакториальный генез и связана с инволюционными, возрастными изменениями в глазу. Вторичная глаукома является последствием других глазных заболеваний или общих болезней, сопровождающихся поражением тех глазных структур, которые участвуют в циркуляции ВВ в глазу или оттоке ее из глаза.Патофизиологические механизмы гипертензии. Выделяют закрытоугольную глаукому (ЗУГ), при которой повышение ВГД вызвано блокадой УПК внутриглазными структурами (радужкой, хрусталиком, стекловидным телом) или гониосинехиями, открытоугольную глаукому (ОУП, обусловленную поражением дренажной системы глаза, и смешанную глаукому, при которой сочетаются оба механизма повышения ВГД.
Существует также неглаукомная офтальмогипертензия, вызываемая дисбалансом между продукцией и оттоком ВВ.
Стадии глаукомы. Выделение 4 стадий развития глаукомы носит условный характер. При формулировании диагноза стадии обозначают римскими цифрами от 1 – начальная до IV – терминальная. При этом принимают во внимание состояние поля зрения и ДЗН.
Стадия I (начальная) – периферическое поле зрения нормальное, но имеются дефекты в центральном поле зрения. Экскавация ДЗН расширена, но не доходит до его края.
Стадия II (развитая) – поле зрения сужено с носовой стороны более чем на 10°, наблюдаются параиентральные изменения, экскавация в том или ином секторе доходит до края ДЗН.
Стадия III (далеко зашедшая) – периферическое поле зрения концентрически сужено (с носовой стороны до 15° и меньше от точки фиксации), при офтальмоскопии видна краевая субтотальная экскавация ДЗН.
Стадия IV (терминальная) – полная потеря зрения или сохранение светоощущения с неправильной проекцией света. Может быть небольшой островок остаточного поля зрения в височном секторе.
Уровень ВГД. Для оценки ВГД используют следующие градации: А – нормальное давление (не превышает 21 мм рт.ст.), В – умеренно повышенное давление (от 22 до 32 мм рт. ст.), С – высокое давление (превышает 32 мм рт. ст.).
Динамика глаукомного процесса. Различают стабилизированную и нестабилизированную глаукому. В первом случае при длительном наблюдении (не менее 3 мес) состояние поля зрения и ДЗН остаются стабильными, во втором увеличивается дефицит поля зрения и/или экскавация дзн.
Врожденная глаукома
Врожденную глаукому классифицируют на первичную, сочетанную и вторичную. В зависимости от возраста ребенка различают раннюю врожденную глаукому, которая возникает в первые 3 года жизни, инфантильную и ювенильную глаукому, проявляющуюся позднее, в детском или юношеском возрасте.Первичная (ранняя) врожденная глаукома (ПВГ). Раннюю ПВГ (гидокторофтальм) диагностируют в 80% всех случаев врожденной глаукомы. Чаще всего заболевание проявляется на первом году жизни ребенка. ПВГ – наследственное (рецессивное) заболевание, возможны и спорадические случаи.
Патогенез ПВГ заключается в задержке развития и дифференцирования УПК и дренажной системы глаза. Гомиодисгенез проявляется в переднем прикреплении корня радужки, чрезмерном развитии гребенчатой связки, частичном сохранении мезодермальной ткани в бухте угла и эндотелиальной мембраны на внутренней поверхности ТА.
Повышенное ВГД приводит к постепенному растяжению оболочек глаза, особенно роговицы. Диаметр роговицы увеличивается до 12 мм и больше, уменьшается ее толщина и увеличивается радиус кривизны. Растяжение роговицы часто сопровождается отеком стромы и эпителия, разрывами десцеметовой оболочки. Изменения роговицы служат причиной появления у ребенка светобоязни, слезотечения и гиперемии глаза. Для ПВГ характерны углубление передней камеры и атрофия стромы радужки. Экскавация ДЗН развивается быстро, но вначале она обратима и уменьшается при снижении ВГД. В поздней стадии болезни глаз и особенно роговица значительно увеличены в размерах, роговичный лимб растянут, роговица мутная, проросшая сосудами ("бычий глаз” – buphtalm). В дальнейшем возможно образование перфорирующей язвы роговицы с исходом во фтизис глаза.
Диагностика ранней ПВГ основана на учете клинических симптомов, описанных выше. Дифференциальную диагностику проводят с мегалокорнеа. В отличие от ПВГ при мегалокорнеа отсутствуют светобоязнь и слезотечение, роговица увеличена, но прозрачна, лимб не растянут, не отмечается повышения ВГД и изменений ДЗН.
Инфантильная врожденная глаукома (ИВГ). ИВГ возникает в возрасте 3–10 лет. Характер наследования и патомеханизм повышения ВГД такие же, как при ранней ПВГ. Клинические симптомы ИВГ существенно отличаются от проявлений ранней ПВГ. Роговица и глазное яблоко имеют нормальные размеры, отсутствуют светобоязнь, слезотечение и все симптомы, обусловливаемые растяжением и отеком роговицы. При гониоскопии обнаруживают симптомы дисгенеза УПК. Отмечаются характерные для глаукомы изменения ДЗН, размеры и глубина экскавации диска могут уменьшаться при нормализации ВГД.
Ювенильная глаукома (ЮГ). ЮГ возникает в возрасте 11–34 лет, часто сочетается с миопической рефракцией. Характер наследования связан с изменениями в 1–й хромосоме и TIGR. Повышение ВГД обусловлено недоразвитием или поражением трабекулярной ткани. Симптомы заболевания такие же, как при первичной открытоугольной глаукоме (ПОУГ).
Сочетанная врожденная глаукома (СВГ). СВГ имеет много общего с ПВГ. В большинстве случаев она также развивается вследствие дисгенеза УПК. Особенно часто врожденная глаукома сочетается с микрокорнеа, аниридией, мезодермальным дисгенезом, факоматозами, синдромами Марфана и Маркезани, а также с синдромами, вызванными внутриутробным инфицированием вирусом краснухи.
Вторичная врожденная глаукома (ВВГ). Наиболее частыми причинами ВВГ являются ретинобластомы, ретролентальная фиброплазия, ювенильная ксантогранулема, травмы и увеиты. Ретинобластомы и ретролентальная фиброплазия вызывают смещение кпереди иридохрусталиковой диафрагмы и возникновение закрытоугольной глаукомы. При ювенильной ксантогранулеме в радужке откладывается желтоватый пигмент. Глаукома может быть следствием внутриглазных кровоизлияний. Механизм возникновения ВВГ при травмах глаза и увеитах такой же, как при аналогичных поражениях у взрослых. Основное отличие в клинической картине и течении болезни заключается в тенденции к увеличению размеров глазного яблока и роговицы у детей в возрасте до 3 лет.
Лечение. Лекарственное лечение врожденной глаукомы малоэффективно. Предпочтение отдают хирургическому лечению. В ранней стадии болезни при открытом УПК чаще производят гонио– или трабекул отомию. В поздних стадиях более эффективны фистулизирующие операции и деструктивные вмешательства на ресничном теле.
Прогноз удовлетворительный, но только при своевременном выполнении оперативного вмешательства. Зрение сохраняется в течение всей жизни у 75% больных, которым операция была произведена в начальной стадии болезни, и только у 15–20% поздно прооперированных больных.
Первичная открытоугольная глаукома
Ежегодно ПОУГ вновь заболевает 1 из 1500 человек старше 45 лет. Пораженность населения в этой возрастной группе составляет около 1–2%, среди лиц старше 60 лет она достигает 3–4%. Вместе с тем ПОУГ возникает и в молодом возрасте, но значительно реже. Из всех больных глаукомой ПОУГ наблюдается у 70%.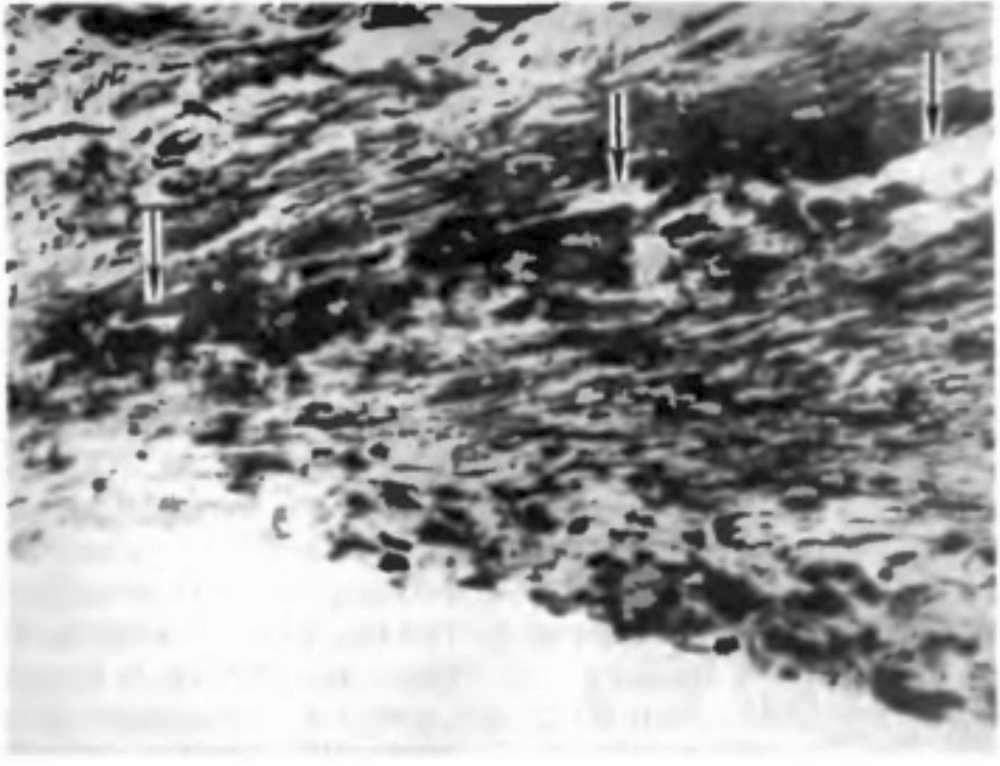 Рис. 17.20. Блокада шлеммова канала (стрелки) при повышении внутриглазного давления в эксперименте на изолированном глазу человека, х150.
Рис. 17.20. Блокада шлеммова канала (стрелки) при повышении внутриглазного давления в эксперименте на изолированном глазу человека, х150.
ПОУГ относят к генетически обусловленным заболеваниям. Описаны и доминантный, и рецессивный типы наследования, однако в большинстве случаев отмечается полигенная передача заболевания.
К факторам риска, влияющим на заболеваемость ПОУГ\ относятся пожилой возраст, наследственность (глаукома у близких родственников), раса (представители негроидной расы болеют в 2–3 раза чаще, чем европеоидной), сахарный диабет, нарушения глюкокортикоидного обмена, артериальная гипотензия, миопическая рефракция, ранняя пресбиопия, псевдоэксфолиативный синдром и синдром пигментной дисперсии.
Патогенез ПОУГ включает три основных патофизиологических механизма: гидромеханический, гемоциркуляторный и метаболический.
Первый из них начинается с ухудшения оттока ВВ из глаза и повышения ВГД. Ухудшение оттока вызвано трабекулопатией – дистрофическими изменениями в ТА. Для трабекулопатии характерны следующие особенности: уменьшение количества активных клеточных элементов; утолщение трабекулярных пластин и юкстаканаликулярной ткани; сужение и частичный коллапс межтрабекулярных щелей; деструкция коллагеновых и эластических волокон; отложение в трабекулярных структурах гранул пигмента, эксфолиаций, продуктов распада клеток, макрофагов.
Повышение ВГД обусловливает снижение перфузионного кровяного давления и интенсивности внутриглазного кровообращения, а также деформацию двух механически слабых структур – трабекулярной диафрагмы в дренажной системе глаза и решетчатой пластинки склеры. Смещение кнаружи первой из этих структур приводит к сужению и частичной блокаде шлеммова канала (каналикулярный блок; рис. 17.20), которая служит причиной дальнейшего ухудшения оттока ВВ из глаза, а прогиб и деформация второй вызывают ущемление волокон зрительного нерва в деформированных канальцах решетчатой пластинки склеры.
Гемоциркуляторные нарушения можно разделить на первичные и вторичные. Первичные нарушения предшествуют повышению ВГД, вторичные возникают в результате действия повышенного ВГД на гемодинамику глаза.
Среди причин возникновения метаболических сдвигов выделяют последствия гемоциркуляторных нарушений, приводящих к ишемии и гипоксии внутриглазных структур. К метаболическим нарушениям при глаукоме относят также псевдоэксфолиативную дистрофию, перекисное окисление липидов, нарушение обмена коллагена и гликозаминогликанов. Отрицательное влияние на метаболизм дренажной системы глаза оказывает возрастное снижение активности ресничной мышиы, сосуды которой участвуют и в питании бессосудистого ТА.
Разновидности ПОУГ. Выделяют 4 клинико–патогенетические формы ПОУГ: простую, эксфолиативную, пигментную и глаукому нормального давления. Эксфолиативная и пигментная формы занимают промежуточное положение между первичной и вторичной глаукомой.
Простая ПОУГ. Как правило, поражаются оба глаза, но на одном из них глаукома возникает раньше и протекает в более тяжелой форме. Клиническая симптоматика включает ухудшение оттока ВВ из глаза, повышение ВГД и увеличение амплитуды суточных колебаний офтальмотонуса, медленно нарастающее ухудшение зрительных функций по глаукоматозному типу, постепенное развитие атрофии и экскавации ДЗН. Из дополнительных симптомов часто наблюдаются дистрофические изменения в пигментном эпителии и строме радужки, снижение прозрачности и увеличение экзогенной пигментации ТА. В связи с отсутствием субъективной симптоматики больные часто обращаются к врачу только в поздних стадиях болезни.
Эксфолиативная открытоугольная глаукома (ЭОУГ) – разновидность ПОУГ, возникает при эксфолиативном синдроме, который проявляется отложением амилоидоподобного фибриллярного материала на задней поверхности ресничного тела, радужки и передней поверхности хрусталика. При биомикроскопии эксфолиации обнаруживают на хрусталике, по краю зрачка, иногда на задней поверхности роговицы и в УПК. Обычно поражаются оба глаза, но в 25% случаев глаукома бывает односторонней. По сравнению с простой ПОУГ для ЭОУГ характерны большая выраженность дистрофических изменений радужки, более высокие ВГД и скорость прогрессирования болезни.
Пигментная глаукома (ПГ) развивается у лиц с синдромом пигментной дисперсии, который характеризуется прогрессирующей депигментацией нейроэпителиального слоя радужки и отложением пигментных гранул в структурах переднего сегмента глаза, в том числе в трабекулярном фильтре. Депигментация вызвана трением между пигментным эпителием радужки и цинновыми связками в анатомически предрасположенных глазах. Трение возникает при колебаниях размера зрачка. Частота ПГ составляет 1 – 1,5% всех случаев глаукомы. Заболевают лица молодого и среднего возраста, а у пожилых возможно спонтанное улучшение, обусловленное возрастным утолщением хрусталика и исчезновением контакта между пигментным эпителием радужки и цинновыми связками. Больные жалуются на радужные круги вокруг источников света из–за обильного отложения пигментной пыли на задней поверхности роговицы. При трансиллюминации видны радиально расположенные полосы депигментации радужки.
Глаукома нормального давления (ГНД). Этот термин объединяет разнородные заболевания, для которых характерны типичные для глаукомы изменения поля зрения, атрофия зрительного нерва с экскавацией, ВГД в пределах нормальных значений, открытый УПК. При ГНД нередко наблюдаются глубокая экскавация ДЗН, микрогеморрагии на диске и около него, выраженная перипапиллярная β–зона. В большинстве случаев заболевание можно рассматривать как вариант ПОУГ с крайне низкой толерантностью зрительного нерва к ВГД. К ГНД могут привести низкий уровень давления цереброспинальной жидкости в ретробульбарном отделе зрительного нерва, а также острые нарушения гемодинамики (гемодинамические кризы, снижение артериального давления в ночное время, сосудистые спазмы) и хронические нарушения микроциркуляции крови в ДЗН (венозная дисциркуляция, микротромбозы). Лечение ГНД заключается в снижении ВГД до 12–15 мм рт.ст. и проведении курсовой терапии для улучшения кровообращения и обменных процессов в глазу и ДЗН.
Неглаукомная офтальмогипертензия (НОГ). Все случаи неглаукомного повышения ВГД можно разделить па три группы: псевдогипертензия глаза; эссенциальная НОГ; симптоматическая глазная гипертензия. У части здоровых людей ВГД выходит за пределы статистических нормативов, повышенный офтальмотонус – это индивидуальная норма. К псевдогипертензии следует отнести также кратковременное повышение ВГД вследствие волнения при приближении к глазу тонометра, увеличения артериального давления и тонуса экстраокулярных мышц. Эссенциальная НОГ возникает у лиц среднего или пожилого возраста как следствие относительной или абсолютной гиперсекреции ВВ. При этом наблюдается сочетание возрастного уменьшения легкости оттока ВВ с сохранением скорости ее продукции. Симптоматическая гипертензия является одним из симптомов какого–либо общего или местного заболевания. Временное повышение ВГД может быть вызвано воспалительными процессами, болевым раздражением глаза, отравлением сангвинарином, тетраэтилсвинцом, фурфуролом, продолжительным приемом кортикостероидов, эндокринными и диэнцефальными нарушениями. Эссенциальная и симптоматическая офтальмогипертензия в части случаев может перейти в глаукому, поэтому ее относят к факторам риска.
Дифференциальная диагностика НОГ и ПОУГ. НОГ характеризуется умеренным повышением ВГД, удовлетворительным состоянием оттока ВВ из глаза, отсутствием изменений в поле зрения и ДЗН, стабильным или регрессирующим течением. Для ПОУГ характерны нарушения оттока ВВ из глаза, дистрофические изменения в радужке, асимметрия в состоянии парных глаз, глаукоматозные изменения поля зрения и ДЗН, прогрессирование всех нарушений при недостаточно эффективном лечении.
Первичная закрытоугольная глаукома
Заболеваемость населения РФ первичной закрытоугольной глаукомой (ПЗУГ) в 2–3 раза ниже, чем ПОУГ. Женщины болеют чаще, чем мужчины. ПЗУГ относится к возрастным заболеваниям: обычно развивается в пожилом возрасте.Выделяют три этиологических фактора: анатомическое предрасположение, возрастные изменения в глазу и функциональный фактор, непосредственно обусловливающий закрытие УПК. Анатомическое предрасположение к заболеванию включает небольшие размеры глазного яблока, гиперметропическую рефракцию, мелкую переднюю камеру, узкий УПК, крупный хрусталик, а также увеличение его толщины в связи с набуханием, деструкцию и увеличение объема стекловидного тела. К функциональным факторам относятся расширение зрачка в глазу с узким УПК, повышение продукции ВВ, увеличение кровенаполнения внутриглазных сосудов.
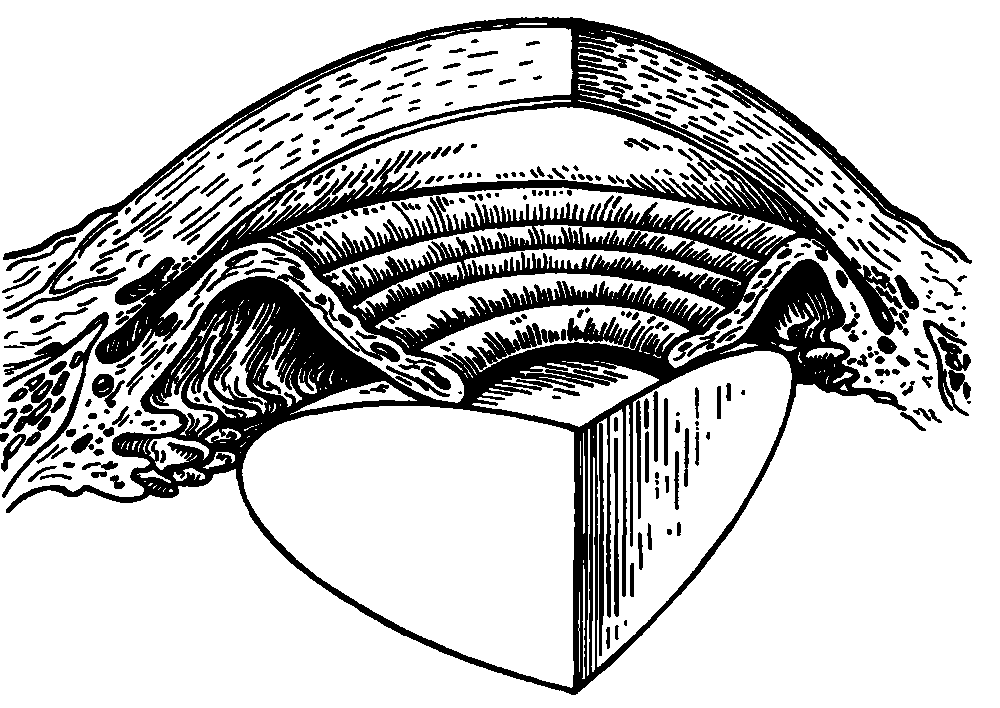 Рис. 17.21. Функциональный зрачковый блок и блокада угла передней камеры корнем радужки (схема).
Рис. 17.21. Функциональный зрачковый блок и блокада угла передней камеры корнем радужки (схема).
Основным звеном в патогенезе ПЗУГ является закрытие УПК корнем радужки. Описаны следующие механизмы такой блокады. ■ В результате плотного прилегания края зрачка к хрусталику ВВ скапливается в задней камере глаза, что приводит к выпячиванию кпереди корня радужки и блокаде УПК (рис. 17.21). ■ Прикорневая складка радужки, образующаяся при расширении зрачка, закрывает фильтрационную зону узкого УПК при отсутствии зрачкового блока. ■ Смещение стекловидного тела кпереди в результате скопления жидкости в заднем сегменте глаза может привести к возникновению витреохрусталикового блока. При этом корень радужки придавливается хрусталиком к передней стенке УПК (рис. 17.22). ■ В результате образования спаек (гониосинехий) и сращения корня радужки с передней стенкой УПК происходит его облитерация.
Различают 4 клинико–патогенетические формы ПЗУГ: со зрачковым блоком (80% больных); с плоской радужкой (10%); с витреохрусталиковым блоком (1%); с укорочением УПК ("ползучая" глаукома – 7% больных).
ПЗУГ со зрачковым блоком. Течение болезни волнообразное с приступами и спокойными межприступными периодами. Различают острые и подострые приступы ПЗУГ.
Острый приступ глаукомы. Больной жалуется на боли в глазу и надбровной дуге, затуманивание зрения и появление радужных кругов при взгляде на свет. При осмотре глаза отмечают расширение эписклеральных сосудов, отек роговицы, мелкую переднюю камеру, выпяченную кпереди радужку ("бомбаж” радужки), расширенный зрачок и закрытый УПК при гониоскопии. ВГД повышается до 40–60 мм рт.ст. В результате странгуляции части сосудов развиваются явления очагового или секторального некроза стромы радужки с последующим асептическим воспалением, образованием задних синехий по краю зрачка, гониосинехий, деформацией и смещением зрачка. Спонтанное обратное развитие приступа, наблюдаемое в части случаев, связано с подавлением секреции ВВ и ослаблением зрачкового блока вследствие атрофии радужки в зрачковой зоне и деформации зрачка. Увеличивающееся количество гониосинехий и повреждение ТА при повторных приступах приводит к развитию хронической ЗУГ с постоянно повышенным ВГД.
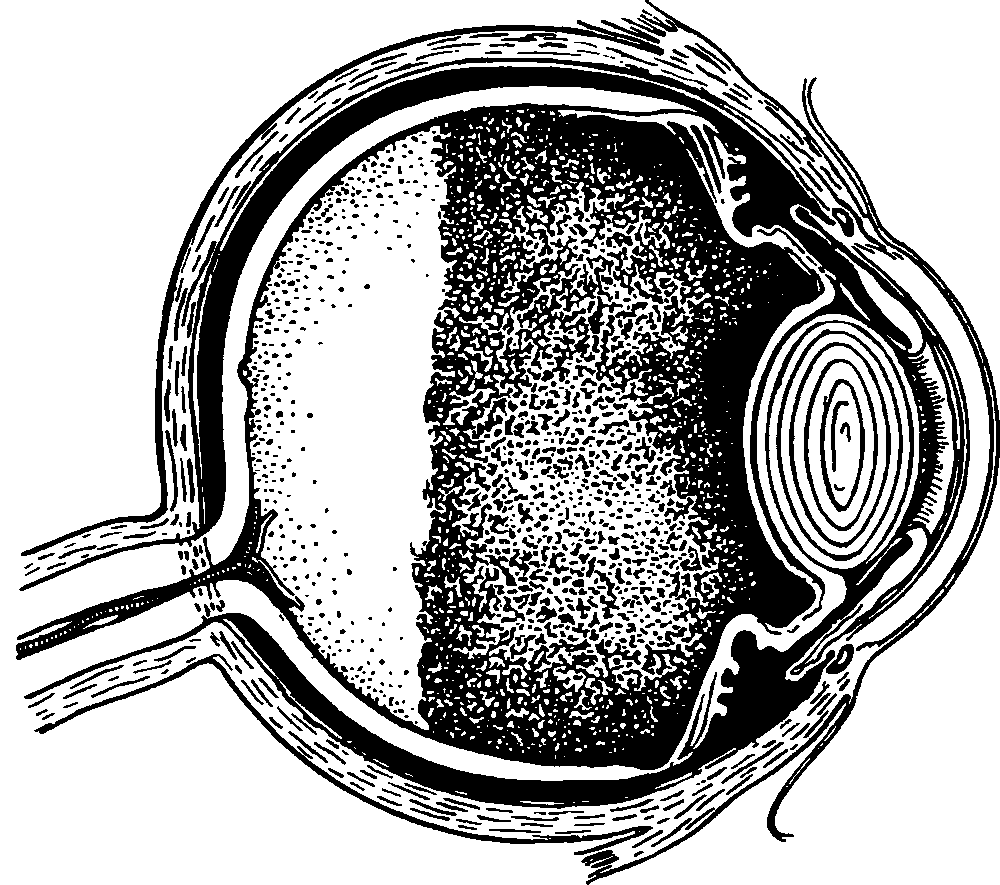 Рис. 17.22. Скопление внутриглазной жидкости в заднем отделе глаза и витреохрусталиковый блок в переднем сегменте глазного яблока.
Рис. 17.22. Скопление внутриглазной жидкости в заднем отделе глаза и витреохрусталиковый блок в переднем сегменте глазного яблока.
Подострый приступ ПЗУГ протекает в более легкой форме, если УПК закрывается не на всем протяжении или недостаточно плотно. Подострыми называют такие приступы, при которых не развивается странгуляция сосудов и не возникают некротические и воспалительные процессы в радужке. Больные жалуются на затуманивание зрения и появление радужных кругов при взгляде на свет. Болевой синдром выражен слабо. При осмотре отмечается расширение эписклеральных сосудов, легкий отек роговицы и умеренное расширение зрачка. После подострого приступа не происходит деформации зрачка, сегментарной атрофии радужки, образования задних синехий и гониосинехий.
Течение ПЗУГ со зрачковым блоком. Глаукома начинается с острого или подострого приступа. В ранней стадии заболевания ВГД повышается только во время приступов, в межприступные периоды оно в пределах нормы. После повторных приступов развивается хроническая глаукома, течение которой имеет много общего с течением ПОУГ: повышение ВГД отмечается постоянно, развиваются характерные для глаукомы изменения поля зрения и ДЗН.
ПЗУГ с плоской радужкой характеризуется тем, что приступы глаукомы возникают при отсутствии зрачкового блока. Передняя камера в таких случаях средней глубины и периферия радужки не прогибается кпереди. При гониоскопии в спокойном периоде обнаруживают узкий, часто щелевидный вход в бухту УПК. Острый или подострый приступ возникает в результате блокады узкого УПК периферической складкой радужки при расширении зрачка под влиянием мидриатиков, эмоционального возбуждения, пребывания в темноте.
 Рис. 17.23. Облитерация угла передней камеры (стрелки) при “ползучей” закрытоугольной глаукоме.
Рис. 17.23. Облитерация угла передней камеры (стрелки) при “ползучей” закрытоугольной глаукоме.
ПЗУГ с витреохрусгаликовым блоком. Эта редкая форма глаукомы возникает в анатомически предрасположенных глазах (уменьшенный размер глазного яблока, крупный хрусталик, массивное ресничное тело) вследствие скопления жидкости в заднем отделе глаза. Иридохрусталиковая диафрагма смещается кпереди и блокирует УПК (см. рис. 17.22). При этом хрусталик может ущемляться в кольце ресничного тела. Клиническая картина характерна для острого приступа глаукомы. Обращает на себя внимание плотное прилегание радужки по всей ее поверхности к хрусталику и очень мелкая, щелевидная передняя камера. Обычное лечение этой формы ПЗУГ неэффективно, поэтому она получила название “злокачественная глаукома ".
ПЗУГ с укорочением УПК ("ползучая" глаукома). При этой форме глаукомы происходит постепенное сращение корня радужки с передней стенкой УПК, которое начинается от вершины угла и затем распространяется кпереди (рис. 17.23). Заболевание часто протекает незаметно, но у отдельных больных возникают подострые приступы глаукомы. Причины возникновения и прогрессирования "ползучей" глаукомы не установлены.
Вторичная глаукома
Вторичная глаукома характеризуется большим разнообразием этиологических факторов, патогенетических механизмов и клинических проявлений. Ниже приведены наиболее частые причины возникновения и клинические формы вторичной глаукомы.Воспалительная глаукома возникает в процессе воспаления или после его окончания при кератитах, рецидивирующих эписклеритах, склеритах и увеитах. Болезнь протекает по типу хронической ОУГ при распространенном поражении дренажной системы глаза или ЗУГ в случае образования задних синехий, гониосинехий, сращения и заращения зрачка.
 Рис. 17.24. Новообразованные сосуды на радужке (рубеоз радужки) при неоваскулярной глаукоме.
Рис. 17.24. Новообразованные сосуды на радужке (рубеоз радужки) при неоваскулярной глаукоме.
Факогенная глаукома. Различают три вида факогенной глаукомы: факотопическую, факоморфическую и факолитическую.
Фокотопическая глаукома связана с вывихом хрусталика в стекловидное тело или переднюю камеру глаза. В последнем случае заболевание протекает по типу закрытоугольной глаукомы и удаление хрусталика является обязательной процедурой.
Факоморфическая глаукома возникает вследствие набухания хрусталиковых волокон при незрелой возрастной или травматической катаракте. Объем хрусталика увеличивается, возникает относительный зрачковый блок. В глазах с узким УПК развивается острый или подострый приступ вторичной закрытоугольной глаукомы. Экстракция катаракты (с предварительным медикаментозным снижением ВГД) может привести к полному излечению больного от глаукомы.
Факолитическая глаукома развивается в глазах с перезрелой катарактой. Крупные белковые молекулы выходят из хрусталика через измененную переднюю капсулу и вместе с макрофагами забивают трабекулярный фильтр. Клинически заболевание напоминает острый приступ глаукомы с выраженным болевым синдромом, гиперемией глазного яблока и высоким ВГД. Лечение заключается в экстракции катаракты.
Сосудистая глаукома проявляется в двух клинико–патогенетических формах: неоваскулярной и флебогипертензивной.
Неоваскулярная глаукома возникает как осложнение гипоксических заболеваний сетчатки, особенно часто пролиферативной диабетической ретинопатии и ишемической формы окклюзии ЦВС. При этом образующиеся в сетчатке (в зонах гипоксии) вазоформативные факторы путем диффузии поступают в стекловидное тело и через зрачок в переднюю камеру глаза. Новообразованные сосуды, возникающие сначала у зрачкового края радужки, затем по ее передней поверхности распространяются на структуры УПК (рис. 17.24). В результате рубцового сокращения новообразованной фиброваскулярной ткани наступает частичная или полная облитерация УПК. Клиническая картина неоваскулярной глаукомы, кроме рубеоза радужки, нередко включает болевой синдром, расширение сосудов эписклеры, отек роговицы и внутриглазные кровоизлияния (гифема, гемофтальм, геморрагии в сетчатке).
Флебогипертензивная глаукома возникает в результате стойкого повышения давления в эписклеральных венах глаза. В клинической картине болезни обращает на себя внимание выраженное расширение и извитость эписклеральных вен, заполнение кровью склерального синуса. Эта форма глаукомы может развиться при синдроме Стерджа–Вебера–Краббе, каротидно–кавернозном соустье, отечном эндокринном экзофтальме, новообразованиях орбиты, медиастинальном синдроме и идиопатической гипертензии эписклеральных вен.
Дистрофическая глаукома. В эту группу вторичной глаукомы отнесены те формы вторичной глаукомы, в происхождении которых решающую роль играют заболевания дистрофического характера.
Иридокорнеальный эндотелиальный синдром проявляется неполноценностью заднего эпителия роговицы, атрофией радужки, образованием тонкой мембраны, состоящей из клеток заднего эпителия роговицы и десцеметоподобной оболочки, на структурах УПК и передней поверхности радужки. Рубцовое сокращение мембраны приводит к частичной облитерации УПК, деформации и смещению зрачка, вывороту пигментного листка в зрачковой зоне, растяжению радужки и образованию в ней щелей и отверстий. ВГД повышается вследствие нарушения оттока ВВ из глаза. Обычно поражается только один глаз.
В группу дистрофических глауком относят также стойкое повышение ВГД при отслойке сетчатки, первичном системном амилоидозе и обширных внутриглазных кровоизлияниях (гемолитическая глаукома).
Травматическая глаукома может быть вызвана механическим, химическим и радиационным повреждением глаза. Причины повышения ВГД неодинаковы в разных случаях: внутриглазные геморрагии (гифема, гемофтальм), травматическая рецессия УПК, блокада дренажной системы глаза сместившимся хрусталиком или продуктами его распада, химическое или радиационное повреждение эпи– и интрасклеральных сосудов, последствия травматического увеита. Глаукома возникает в различные сроки после травмы, иногда через несколько лет, как, например, при травматической рецессии УПК.
Послеоперационная глаукома. Осложнением операции на глазном яблоке и орбите может быть временное и постоянное повышение ВГД. Наиболее часто причиной развития послеоперационной глаукомы служат экстракция катаракты (афакическая глаукома), кератопластика, операции, выполняемые при отслойке сетчатки. Послеоперационная глаукома может быть как открыто–, так и закрытоугольной. В отдельных случаях возможно возникновение вторичной злокачественной глаукомы (с витреохрусталиковым блоком).
Неопластическая глаукома возникает как осложнение внутриглазных или орбитальных новообразований. Наиболее частой причиной неопластической глаукомы служат меланобластомы, реже – метастатические опухоли, ретинобластомы, медуллоэпителиомы. Повышение ВГД обусловлено блокадой УПК опухолью, отложением продуктов распада опухолевой ткани в трабекулярном фильтре, образованием гониосинехий. Глаукома может возникнуть и при неопластических поражениях орбиты как последствие повышения давления в орбитальных, внутриглазных и эписклеральных венах или прямого давления на глазное яблоко содержимого орбиты.
Диагностика
Ранняя диагностика глаукомы, особенно ПОУГ, возможна только после полного обследования пациента. При возникновении подозрения на глаукому и отсутствии явных изменений поля зрения и ДЗН существенную роль в диагностике играют факторы риска. К ним относятся неблагополучная наследственность по глаукоме среди прямых родственников обследуемого, низкий коэффициент легкости оттока, устанавливаемый при тонографии (С < 0,15), дистрофические изменения радужки, особенно ее пигментного листка, выраженная пигментация структур УПК, эксфолиации в переднем сегменте глаза, вертикально–овальная форма физиологической экскавации ДЗН и ее большие размеры, подрытый край экскавации, выраженное сужение неврального кольца в одном из секторов ДЗН.Наиболее полное представление об уровне и устойчивости ВГД позволяет получить суточная тонометрия. Типы суточных кривых офтальмотонуса индивидуально варьируют. Чаше максимальные значения ВГД отмечаются в утренние часы (6–8 ч), а минимальные – в вечернее или ночное время. В редких случаях максимальные значения ВГД регистрируют в дневное или вечернее время. Для определения характера и амплитуды суточной кривой ВГД его измеряют 2–4 раза в сутки в течение 3–4 дней. Суточные колебания офтальмотонуса более 5–6 мм рт.ст. часто наблюдаются при глаукоме и крайне редко в здоровых глазах. Характерные для глаукомы изменения глазного дна заключаются в увеличении экскавации ДЗН, сужении неврального кольца, смещении центральных сосудов сетчатки в носовую сторону, появлении перипапиллярной хориоретинальной атрофии и дефектов в слое нервных волокон сетчатки.
Размер экскавации определяют как отношение ее диаметра к диаметру ДЗН в горизонта!ьном, вертикальном или косом меридианах (Э/Д). В здоровых глазах это отношение редко превышает 0,5. Большой размер экскавации ДЗН позволяет заподозрить глаукому.
Следует различать границы экскавации и побледнения ДЗН. Часто обе границы совпадают, но могут и существенно различаться. В последнем случае зона побледнения меньше зоны экскавации. Если зона побледнения больше экскавации, то это свидетельствует об атрофии зрительного нерва неглаукомного происхождения.
В части случаев расширению экскавации предшествует западение височной половины ДЗН относительно сетчатки. При значительной выраженности западения образуется блюдцеобразная экскавация с бледным более глубоким западением в центре и розовой плоской экскавацией по периферии.
Для глаукомы характерна асимметрия в размерах экскавации в парных глазах. У здоровых людей разница в величине Э/Д больше 0,2 бывает редко, преимущественно при анизометропии. Увеличение экскавации в вертикальном направлении (книзу или кверху) – важный, хотя и необязательный, признак ГОН. Обнаружение серых точек (отверстий в решетчатой пластинке склеры) на дне экскавации в верхнем или нижнем полюсе свидетельствует о ГОН.
Экскавация с выемкой в верхнем или нижнем сегменте ДЗН особенно характерна для глаукомы нормального давления. Расширение экскавации сочетается с неравномерным сужением неврального кольца. Локальное сужение кольца, особенно в нижне– или верхнетемпоральном сегменте, – один из симптомов ГОН. Нужно иметь в виду, что в здоровых глазах именно в этих сегментах невральное кольцо имеет наибольшую ширину. Сужение неврального кольца по височному радиусу при хорошей его сохранности в нижне– и верхнетемпоральных сегментах не имеет диагностического значения.
Важным диагностическим признаком является глубокая экскавация ДЗН с крутым или подрытым краем. Такой тип экскавации значительно, чаше наблюдается в глазах с ГОН, чем в отсутствие глаукомы.
Расслаивающие мелкие геморрагии в ДЗН могут быть обнаружены при ГОН, особенно часто при глаукоме с нормальным давлением. Их появление предшествует образованию дефектов в поле зрения. Геморрагии сохраняются от 1 до 12 нед.
ГОН часто сочетается с перипапиллярной хориоретинальной атрофией (p–зона, глаукомное гало), более выраженной там, где наблюдаются сужение неврального кольца и локальный дефект в слое нервных волокон сетчатки.
Диагностическое значение имеет локальная потеря дуговых аксонов, которая при офтальмоскопии в бескрасном свете проявляется как щелевидный или клиновидный дефект в слое нервных волокон сетчатки в верхнем или нижнем темпоральном сегменте.
Большое значение для ранней диагностики ГОН имеют обнаружение парацентральных скотом (особенно дуговой скотомы) в зоне Бьеррума (10–20°отточки фиксации), появление носовой ступеньки на одной или нескольких изоптерах, их сужение с носовой стороны, увеличение слепого пятна, увеличение длительности сенсомоторной реакции, повышение порогов восприятия на цвета, особенно синий. Значительно реже в ранней стадии болезни выявляют секторальный дефект в височном отделе поля зрения.
Для ранней диагностики глаукомы разработаны нагрузочные и разгрузочные тесты, основанные на определении изменений ВГД или размеров слепого пятна под влиянием темноты, лекарственных средств, расширения зрачка, изменения положения тела, водной или компрессионной нагрузки. Диагностические пробы сыграли важную роль в изучении патофизиологических механизмов глаукомы. Однако большинство таких тестов недостаточно информативно, некоторые небезопасны или для их проведения необходимы специальные устройства, которые не производят серийно. Заслуживает внимания пилокарпиновая диагностическая проба. Снижение ВГД на 3 мм рт.ст. или больше через 1–1,5 ч после инстилляции 1–2% раствора пилокарпина наблюдается практически у всех больных глаукомой и очень редко у здоровых лиц.
В неясных случаях больной остается под диспансерным наблюдением с диагнозом "подозрение на глаукому" в течение продолжительного периода времени. Вопрос о назначении офтальмогипотензивных средств решает врач индивидуально в каждом конкретном случае.
Лечение
Лечение глаукомы включает гипотензивную фармакотерапию и хирургию, а также коррекцию гемодинамических и метаболических нарушений с помощью медикаментозных и физиотерапевтических средств.К современным офтальмогипотензивным средствам относятся миотики, адреноагонисты (адреналин и α2–адреносгимуляторы), β–адреноблокаторы, ингибиторы карбоангидразы, некоторые простаглаидины, средства, оказывающие осмотическое действие. Механизм их влияния на ВГД связан или с улучшением оттока ВВ из глаза (миотики, адреналин, латанопрост), или с уменьшением секреции внутриглазной жидкости (α2–адреноагонисты, β–адреноблокаторы, ингибиторы карбоангидразы).
Миотики делят на холиномиметические и антихолинэстеразные. Первые действуют аналогично ацетилхолину, вторые блокируют или разрушают холинэстеразу. Миотики вызывают сокращение сфинктера зрачка и ресничной мышцы, способствуют расширению кровеносных сосудов и увеличению их проницаемости. Суживая зрачок и оттягивая складку радужки от УПК, миотики улучшают доступ ВВ к дренажной системе глаза. Одновременно вследствие сокращения ресничной мышцы растягивается трабекулярная диафрагма, уменьшается блокада шлеммова канала и улучшается отток ВВ из глаза.
Местные побочные эффекты – спазм аккомодации, возникновение псевдомиопии, чрезмерный постоянный миоз из–за фиброзного перерождения сфинктера зрачка, ухудшение тем новой адаптации, иногда появление задних синехий. Антихолинэстеразные миотики в настоящее время не применяют для лечения глаукомы из–за их катарактогенного действия и большей выраженности других побочных эффектов.
Из холиномиметиков для снижения ВГД используют пилокарпин, карбохолин и ацеклидин. Пилокарпина гидрохлорид выпускают в виде глазных капель 1%, 2% и 4% концентрации и глазных лекарственных пленок. При хронической глаукоме однократная инстилляция пилокарпина вызывает снижение ВГД на 3–8 мм рт.ст. на срок от 4 до 8 ч. В случае добавления в раствор пилокарпина препаратов метилцеллюлозы или поливинилового спирта продолжительность его действия увеличивается в среднем на 1 ч. Инстилляцию пилокарпина производят 2–4 раза в день, а при остром приступе глаукомы 8–10 раз в 1–е сутки. Карбохолин (1,5% и 3% раствор) оказывает примерно такое же по выраженности гипотензивного эффекта и по его продолжительности действие, как 1% и 2% раствор пилокарпина. Однако карбохолин вызывает более выраженное раздражение глаза, чем пилокарпин, и хуже переносится больными. Ацеклидин (2%, 3% и 5% водный раствор) применяют в виде глазных капель 3–6 раз в день.
Из адреностимуляторов в клинической практике используют дипивалат адреналина (дипивефрин) и α2–адреноагонист (клонидин, клофелин).
Дипивалат адреналина (дипивефрин) – препарат преадреналина – обладает липофильностью и проникает в глаз в 17 раз быстрее, чем адреналин. В роговице дипивалил эпинефрин гидролизуется в эпинефрин. В концентрации 0,1% этот препарат дает такой же гипотензивный эффект, как и 1% раствор адреналина. Снижение ВГД обусловлено улучшением оттока ВВ из глаза. Побочные эффекты слабовыраженные. Дипивефрин вызывает расширение зрачка, поэтому противопоказан при закрытоугольной глаукоме.
Клонидин (клофелин) – глазные капли 0,125%, 0,25% и 0,5% концентрации. При однократной инстилляции препарат вызывает уменьшение продукции ВВ на 20–30%, продолжительность гипотензивного действия около 8 м. Часть больных жалуются на жжение в глазу и сухость во рту. При продолжительном применении клонидина возможно развитие аллергического или хронического конъюнктивита. Клонидин легко проходит через гематоэнцефалический барьер, вызывая у чувствительных больных снижение артериального давления, брадикардию, сонливость, слабость. При появлении выраженных местных или общих побочных эффектов клонидин следует отменить.
β–адреноблокаторы играют ведущую роль в лечении глаукомы. Их делят на неселективные, блокирующие и β1– иβ2–адренорецепторы, и селективные, выключающие в основном только β1–рецепторы.
Тимолола малеат (тимоптик, офтан–тимолол, арутимол и др.) – глазные капли 0,25% и 0,5% концентрации – относится к неселективным β–адреноблокаторам. При однократном применении тимолола ВГД снижается на 6–12 мм рт.ст. Гипотензивный эффект сохраняется более 12 ч. Тимолол применяют 2 раза вдень. Он, как правило, хорошо переносится больными, не вызывает выраженного раздражения конъюнктивы, не оказывает влияния на ширину зрачка, рефракцию глаза и аккомодацию. Местные побочные реакции при лечении тимололом наблюдаются редко. Они заключаются в уменьшении продукции слезной жидкости, появлении поверхностного точечного кератита, иногда аллергического конъюнктивита. Тимолол противопоказан при бронхиальной астме, выраженной браликардии и нарушениях сердечной проводимости.
Тимоптик–депо – глазные капли тимолола малеата длительного действия в концентрации 0,25% и 0,5% – оказывает такое же гипотензивное действие, как и водные растворы этого препарата, но продолжительность его более 24 ч. Инстилляции производят 1 раз в сутки. В результате больной получает вдвое меньшую дозу тимолола и соответственно возникает меньше побочных реакций.
Проксодолол – оригинальный отечественный α– и β–адреноблокатор. Препарат, применяемый в виде 1% и 2% глазных капель 2 раза в день, оказывает выраженное гипотензивное действие на ВГД. Побочные эффекты и противопоказания такие же, как и при использовании тимолола.
Бетаксалола гидрохлорид (бетоптик) – селективный β1–адреноблокатор. Гипотензивное действие бетаксалола несколько менее выраженное, чем у тимолола, но его можно назначать с осторожностью и больным бронхиальной астмой и с другими бронхообструктивными поражениями. Остальные противопоказания такие же, как и для тимолола. Глазные капли бетаксалола в концентрации 0,5% применяют 2–3 раза в день. Получены данные, свидетельствующие о том, что бетоптик не только снижает ВГД, но и оказывает нейропротективное действие.
Ингибиторы карбоангццразы подавляют ее активность, уменьшают секрецию ВВ на 30–40% и снижают ВГД. Гипотензивный эффект сохраняется 6–8 ч. Наиболее эффективными препаратами этой группы являются ацетазоламид и дорзоламида гидрохлорид.
Ацетазоламид (диамокс, диакарб) выпускают в виде таблеток, содержащих 0,25 г активного вещества. Препарат принимают внутрь по 0,125–0,25 г 2–4 раза в день. Показаниями служат острые и подострые приступы глаукомы, реактивный синдром, хроническая глаукома при недостаточной эффективности других гипотензивных средств, включая хирургические. У части больных развиваются побочные реакции: парестезии в конечностях, преходящая миопия, отсутствие аппетита, тошнота, слабость, уретральные колики, лейкопения. При своевременной отмене ацетазоламида эти явления проходят без последствий. При лечении ацетазоламидом необходимо назначать препараты, содержащие калий.
Дорзоламида гидрохлорид (трусопт) – 2% глазные капли, оказывающие такое же действие, как и ацетазоламид. Препарат применяют 3 раза в день, а в комбинации с тимололом – 2 раза. При лечении трусоптом отмечены побочные реакции: жжение и зуд в глазах, слезотечение, затуманивание зрения, конъюнктивит, блефарит, горечь во рту, тошнота, головная боль. Препарат можно назначать при всех формах глаукомы у взрослых.
Латанопрост (ксалатан) – глазные капли 0,005% концентрации – представляет собой синтетический аналог простагландина F2o. Латанопрост оказывает выраженное и продолжительное гипотензивное действие, которое объясняют улучшением увеосклерального оттока В В из глаза. Препарат применяют 1 раз в день. При длительном лечении латанопростом наблюдается усиление пигментации радужки, описаны также случаи появления симптомов увеита и отечной макулопатии, исчезающих после отмены препарата.
Из комбинированных препаратов для лечения глаукомы используют следующие.
Тимпило, фотил и фотил–форте включают 0,5% раствор тимолола малеата и 2% или 4% раствор пилокарпина. Показанием к их применению служит недостаточно выражениый гипотензивный эффект каждого из компонентов в отдельности. Препараты вводят 2 раза в день.
Проксофилин содержит 2% раствор проксодолола и 0,25% раствор клофелина. Препарат назначают при недостаточном гипотензивном действии каждого из его компонентов в отдельности.
Средства, оказывающие осмотическое действие. Препараты этой группы повышают осмотическое давление крови, оттягивают жидкость из всех структур глаза, главным образом из стекловидного тела. Осмотическое действие является основным в механизме снижения ВГД. Показанием к применению препаратов этой группы служит острый приступ глаукомы. Их используют также при подготовке к внутриглазным операциям. Осмотические средства следует применять с осторожностью при заболеваниях сердца, почек и печени.
Глицерол назначают внутрь в виде 50% раствора в дозе 1 – 1,5 г препарата на 1 кг массы тела. При расчете дозы следует учитывать, что удельный вес глицерина равен 1,25. Гипотензивное действие достигает максимальной выраженности через 1–2 ч после приема препарата и прекращается через 5–8 ч. Побочные явления – тошнота, иногда рвота, у больных сахарным диабетом может усилиться гипергликемия.
Маннитол – шестиатомный спирт – вводят внутривенно в виде 20% раствора в дозе 2–2,5 г/кг со скоростью 10 мл/мин. ВГД снижается через 30–45 мии, продолжительность действия 2–4 ч. Препарат малотоксичен, по силе и длительности гипотензивного действия уступает глицерол у.
Принципы фармакотерапии хронической глаукомы. Гипотензивное лечение глаукомы направлено на снижение ВГД до "целевого" уровня. Под этим термином понимают предположительный уровень индивидуального толерантного ВГД. При этом принимают во внимание возраст пациента, величину системного артериального давления, стадию глаукомы и другие индивидуальные особенности. Величину "целевого" давления корригируют в процессе динамического наблюдения за больным.
Гипотензивную терапию начинают после полного обследования больного с назначания одного из препаратов первого выбора, к которым относят β–адреноблокаторы, ксалатан и пилокарпин. При недостаточно выраженном гипотензивном эффекте первого препарата добавляют второй. Наиболее часто применяемая комбинация препаратов – тимолол (или бетаксалол) и пилокарпип. Вместо раздельной инстилляции этих средств можно использовать комбинированный препарат – фотил.
Все остальные гипотензивные средства относятся к препаратам второго, дополнительного, выбора или из–за их недостаточной изученности, или в связи с высокой стоимостью. Показаниями к применению препаратов второго выбора служат противопоказания к назначению средств первого выбора, их плохая индивидуальная переносимость или недостаточная эффективность. Препараты второго выбора используют также при периодической смене лекарственных средств с целью предупреждения привыкания.
Назначение более двух гипотензивных препаратов оправдано только в тех случаях, когда антиглаукоматозная операция или не может быть произведена, или оказалась неэффективной.
Необходимо своевременно выявлять феномены тахифилаксии и привыкания, заключающиеся в снижении эффективности лекарственного средства. При тахифилаксии такое снижение эффективности наблюдается вскоре после назначения препарата, для привыкания характерно медленное уменьшение эффекта при его длительном применении.
Для уменьшения негативных последствий феномена привыкания целесообразно ежегодно производить замену лекарственных препаратов на 2–3 мес. Этого времени достаточно для восстановления чувствительности к ранее применявшемуся препарату. Следует также иметь в виду, что каждый гипотензивный препарат не только снижает ВГД, но и оказывает влияние на метаболические процессы в глазу. Периодическая смена лекарственных средств способствует поддержанию нормального метаболизма.
Лечение острого и подострого приступов глаукомы. Острый приступ глаукомы относится к состояниям, при которых требуется неотложная врачебная помощь.
В течение 1–го часа производят инстилляции пилокарпина каждые 15 мин, затем каждый час (2–4 раза) и в последующем каждые 4 ч. Одновременно в пораженный глаз закапывают какой–либо β–адреноблокатор. Внутрь больной принимает ацетазоламид и глицерол. Полезно поставить 2–3 пиявки на висок. Если через 24 ч приступ не удалось купировать. показано оперативное вмешательство (иридэктомия). Операцию рекомендуется производить и при успешном медикаментозном лечении острого приступа глаукомы, но в более поздние сроки. С профилактической целью производят иридэктомию и па втором глазу.
Лечение подострого приступа зависит от его выраженности. В легких случаях достаточно дополнительно произвести 3–4 инстилляции пилокарпина, тимолола и принять ацетазоламид. В последующем необходимо выполнить иридэкгомию.
Особенно сложно купировать приступ злокачественной глаукомы. Миотики в таких случаях противопоказаны, так как они расслабляют цинновы связки и способствуют возникновению витреохрусталикового блока. Больным назначают мидриатики циклоплегического действия (1% раствор атропина) 3–4 раза в день, тимолол 2 раза в день, внутрь диакарб и глицерол. Для устранения воспалительных явлений в глазу используют кортикостероиды. Если приступ удается купировать, то постепенно отменяют все препараты, кроме тимолола и атропина. Отмена атропина может привести к рецидиву приступа. В случае неэффективности лекарственного лечения производят операцию (удаление хрусталика, витрэктомию).
Лазерная хирургия глаукомы. Лазерная хирургия направлена прежде всего на устранение внутриглазных блоков на пути движения ВВ из задней камеры глаза в эписклеральные вены. С этой целью используют лазеры различных типов, по наибольшее распространение получили аргоновые лазеры с длиной волны 488 и 514 нм, импульсные неодимовые ИАГ–лазеры с длиной волны 1060 нм, а также полупроводниковые (диодные) лазеры с длиной волны 810 нм.
Лазерная ириджпюмия заключается в формировании небольшого отверстия в периферическом отделе радужки (рис. 17.25). Операция показана при функциональном или органическом блоке зрачка. Она приводит к выравниванию давления в задней и передней камерах глаза и открытию УПК. С профилактической целью операцию производят во всех случаях закрытоугольной глаукомы и при открытоугольной глаукоме с узким УПК.
Лазерная трабекул о пласт и ка состоит в нанесении серии прижиганий на внутреннюю поверхность трабекулярной диафрагмы (рис. 17.26), в результате чего улучшается ее проницаемость для ВВ и снижается опасность блокады шлеммова канала. Показанием к операции служит ПОУГ, пе поддающаяся компенсации с помощью лекарственных средств.
Другие операции. С помощью лазеров могут быть произведены и другие оперативные вмешательства, в частности фистулизирующие и циклодеструктивные, а также операции, направленные на коррекцию микрохирургических "ножевых” операций.
 Рис. 17.25. Колобома радужки после лазерной иридэктомии.
Рис. 17.25. Колобома радужки после лазерной иридэктомии.
Микрохирургия глаукомы. Микрохирургические операции производят с помощью операционного микроскопа и специальных микроинструментов. Существует большое разнообразие оперативных вмешательств, которые можно разделить на 4 основные группы.
Операции, улучшающие циркуляцию ВВ внутри глаза, – иридэктомия (устранение зрачкового блока) и иридоциклоретракция (расширение УПК). Показанием к выполнению этих операций служит первичная или вторичная закрытоугольная глаукома.
Фистулизирующие операции позволяют создать новый путь оттока ВВ из передней камеры в подконъюнктивальное пространство, откуда жидкость всасывается в окружающие сосуды. Наиболее распространенная операция этого типа – трабекулэктомия – представлена на рис. 17.27.
Фистулизирующая операция может быть произведена при хронической глаукоме, как открыто–, так и закрытоугольной.
Непроникающие фильтрующие операции (НФО) основаны на субсклеральном иссечении наружной стенки склерального синуса (синусотомия) в сочетании с растяжением трабекулярной стенки с помощью микроприжиганий (рис. 17.28). По одной из модификаций операции (неперфорирующая глубокая склерэктомия) глубокую пластинку лимбосклеральной ткани иссекают не только над шлеммовым каналом, но и кпереди от него до десцеметовой оболочки. Эффективность НФО повышается при использовании антиметаболитов в процессе операции или после нее. Уменьшение выраженности гипотензивного эффекта НФО в послеоперационном периоде служит показанием к выполнению лазерной перфорации трабекулярной диафрагмы в зоне операции.
Циклодеструктивные операции основаны на повреждении и последующей атрофии части отростков ресничной мышцы, что приводит к уменьшению продукции ВВ. Из модификаций этой операции наибольшее распространение получила циклокриодеструкция. В процессе выполнения операции наносят несколько криоаппликаций на склеру в зоне расположения цилиарной короны (рис. 17.29). При достаточной интенсивности и продолжительности криовоздействия можно добиться значительного снижения ВГД. Протяженность зоны воздействия не должна превышать 180–200° для исключения гипотензии и атрофии глазного яблока. В последнее время все большее распространение получает транссклеральная диодлазерная циклокоагуляция, отличающаяся большей безопасностью и высокой эффективностью. Циклодеструктивные операции показаны при далеко зашедшей глаукоме, как дополнительное вмешательство при неудачном исходе или неполном эффекте ранее произведенной фистулизирующей операции и при терминальной глаукоме с болевым синдромом.
 Рис. 17.26. Положение коагулятов на трабекуле после лазерной трабекулопластики.
Рис. 17.26. Положение коагулятов на трабекуле после лазерной трабекулопластики.
 Рис. 17.27. Трабекулэктомия.
а – приготовление лоскутов конъюнктивы и склеры; б – разрез глубокой лимбальной пластинки и введение пузырька воздуха в переднюю камеру; в, г – иссечение участка глубокой пластинки; д – лоскуты склеры и конъюнктивы фиксированы швами.
Рис. 17.27. Трабекулэктомия.
а – приготовление лоскутов конъюнктивы и склеры; б – разрез глубокой лимбальной пластинки и введение пузырька воздуха в переднюю камеру; в, г – иссечение участка глубокой пластинки; д – лоскуты склеры и конъюнктивы фиксированы швами.
Рис. 17.28. Субсклеральная синусотомия с трабекулоспазисом. а – приготовлен склеральный лоскут, иссечена наружная стенка шлеммова канала; б – нанесенные на склеру коагуляты вызвали растяжение внутренней (трабекулярной) стенки канала.

 Рис. 17.29. Положение криоаппликаций в лимбосклеральной зоне при транссклеральной циклодеструкции.
Рис. 17.29. Положение криоаппликаций в лимбосклеральной зоне при транссклеральной циклодеструкции.
Хирургия рефрактерной глаукомы. Основной причиной неудачных исходов фильтрующих операций служит фиброзное перерождение вновь созданных путей оттока. Особенно трудно получить устойчивые результаты при '’рефрактерной*' (от англ. refractory – упрямый, упорный) глаукоме. В эту группу включают неоваскулярную, афакическую и юношескую глаукому, а также первичную и вторичную глаукому у больных, поступивших в больницу на повторную операцию. В таких случаях при выполнении повторного вмешательства используют цитостатики (фторурацил, митомицин) или дренажи, которые соединяют переднюю камеру глаза с подконъюнктивальным пространством.
Показания к хирургическому лечению глаукомы. Лечение хронической глаукомы обычно начинают с проведения консервативной терапии. При ее недостаточной эффективности показано оперативное вмешательство. В понятие "недостаточная эффективность” включают повышенное ВГД, прогрессирующее ухудшение состояния поля зрения или ДЗН при офтальмотонусе в зоне верхней границы нормы. Операция показана также в тех случаях, когда больной по тем или иным причинам неаккуратно выполняет назначения врача либо не может систематически проверять ВГД, а также состояние ДЗН и зрительных функций. Вместе с тем хирургическое лечение может быть методом выбора сразу после установления диагноза при условии информированного согласия пациента. Показания к хирургическому лечению острой глаукомы изложены выше.
С целью коррекции гемодинамических и метаболических нарушений проводят общее и местное лекарственное лечение, физиотерапию, выполняют оперативные вмешательства на сосудах и зрительном нерве. В комплекс лекарственных средств включают вазодилататоры, антиагреганты, ангио– и нейропротекторы, антиоксиданты, витамины и другие препараты, оказывающие положительное влияние на гемоциркуляцию и обменные процессы. Физиотерапия включает электростимуляцию сетчатки и зрительного нерва, лечение переменным магнитным полем, низкоэнергетическое лазерное облучение световоспринимающего аппарата глаза. Лечение проводят курсами, продолжительность которых, а также подбор процедур и лекарственных средств индивидуальны в каждом конкретном случае.
Диспансеризация.
Диспансеризация больных глаукомой включает следующие основные мероприятия: периодические осмотры населения, входящего в группы риска, с целью раннего выявления глаукомы; систематическое наблюдение за состоянием больных глаукомой и их рациональное лечение; обучение больных методам самоконтроля и правильному выполнению лечебных назначений.Текущую работу по диспансеризации больных глаукомой выполняют офтальмологи поликлиник. Консультативную помощь оказывают в специализированных глаукомных кабинетах или консультативно–диагностических центрах. Роль стационара в системе диспансерного обслуживания заключается в оказании высококвалифицированной помощи (в основном хирургической) больным глаукомой.
При выборе рационального лечения больного большое внимание уделяют сохранению удовлетворительного качества жизни пациента. Ухудшение этого показателя обусловлено прежде всего установлением диагноза неизлечимой болезни, опасностью полной потери зрения. Неблагоприятное влияние на самочувствие больного оказывает необходимость постоянно принимать лекарственные препараты в определенные часы и связанные с этим дополнительные расходы, а также увеличивающиеся по мере прогрессирования глаукомы дефекты зрения и ограничения в профессиональной деятельности и повседневной жизни. Качество жизни больного в значительной степени зависит от продуманной информированности пациента и его семьи и рациональных лечебных рекомендаций с учетом особенностей состояния больного и его профессиональных, семейных и финансовых возможностей.
Режим труда и жизни. Режим труда и жизни имеет большое значение для поддержания удовлетворительного качества жизни больного глаукомой. Количество ограничений, которым подвергается больной, не должно быть большим. Отстранение от работы и изменение привычного образа жизни плохо переносят люди пожилого возраста.
Пациенту следует рекомендовать заниматься каким–либо трудом – интеллектуальным или умеренным физическим. Работать можно столько, сколько позволяет общее состояние. Ограничения касаются только тяжелых физических нагрузок, работы с большим нервным напряжением и при наклонном положении головы в течение продолжительного периода времени, а также в горячих цехах.
Известно, что умеренная физическая нагрузка способствует снижению ВГД, улучшению общего состояния, самочувствия и настроения больных с хроническими заболеваниями, поэтому им следует рекомендовать легкие физические упражнения и прогулки на свежем воздухе.
Питание больных глаукомой должно быть обычным, но с учетом возраста и сопутствующих заболеваний. Чай, кофе и напитки, содержащие кофеин, а также сухое вино в небольших дозах допустимы. Следует избегать одномоментного приема большого количества жидкости. Безусловно, должно быть исключено курение.
Противопоказаны тугие воротнички, туго затянутые галстуки и все, что затрудняет кровообращение в области головы. При предъявлении больными жалоб на плохой сон и беспокойство можно рекомендовать прием легких снотворных и седативных препаратов в течение ограниченного периода времени.
Гипотензия глаза
Гипотензия глаза (ГГ) возникает как последствие других заболеваний глаз или всего организма. При этом истинное ВГД снижается до 7–8 мм рт.ст. и ниже. Непосредственными причинами гипотензии являются повышенный оттокВ В из глаза или нарушение ее секреции. Особенно часто ГГ наблюдается после антиглаукоматозных операций и проникающих ранений с образованием фистулы. Гипосекреция ВВ связана с поражением цилиарного тела: воспалением, дегенерацией, атрофией или отслоением от склеры. К временному угнетению секреции ВВ может привести тупая травма глаза.
Причинами возникновения ГГ могут быть ацидоз, нарушение осмотического равновесия между плазмой крови и тканями, значительное снижение артериального давления. Этим объясняется развитие ГГ при диабетической и уремической коме, коллаптоидных состояниях.
В случае постепенно развивающейся и слабовыраженной гипотензии функции глаза сохраняются. Значительно выраженная и особенно остро возникающая гипотензия приводит к резкому расширению сосудов, венозному стазу, повышению проницаемости капилляров. В результате этого создаются условия для развития гипоксии, ацидоза, микротромбозов, плазмоидная жидкость пропитывает ткани, усиливая в них дистрофические процессы.
Клиническими проявлениями острой ГГ могут быть отек и помутнение роговицы, помутнение стекловидного тела, ретинальная макулопатия, образование складок сетчатки, отек ДЗН с последующей его атрофией. Глазное яблоко уменьшается в размерах (субатрофия глаза), а в тяжелых случаях вследствие развития рубцовых процессов сморщивается, достигая размеров горошины (атрофия глаза).
Лечение гипотензии направлено на устранение основных причин ее возникновения. Оно заключается в закрытии фистулы, вскрытии цилиохориоидального пространства, если там скапливается жидкость, лечении воспалительных и дистрофических процессов в сосудистой оболочке глаза.
Глава 18. Глазодвигательный аппарат
Глаз должен выучиться видеть, как язык – говорить.Глазодвигательный аппарат – сложный сенсомоторный механизм, физиологическое значение которого определяется двумя его главными функциями: двигательной (моторной) и сенсорной (чувствительной).Д. Дидро
Двигательная функция глазодвигательного аппарата обеспечивает наведение обоих глаз, их зрительных осей и центральных ямок сетчаток на объект фиксации, сенсорная – слияние двух монокулярных (правого и левого) изображений в единый зрительный образ.
Иннервация глазодвигательных мышц черепными нервами обусловливает тесную связь неврологической и глазной патологии, вследствие чего необходим комплексный подход к диагностике.
Анатомо–физиологические особенности
Движения глазного яблока осуществляются с помощью шести глазодвигательных мышц: четырех прямых – наружной и внутренней (т. rectus externum, m.rectus internum), верхней и нижней (m.rectus superior, m.rectus inferior) и двух косых – верхней и нижней (m.obliguus superior, m.obliguus inferior).Все прямые и верхняя косая мышца начинаются у сухожильного кольца, расположенного вокруг канала зрительного нерва у вершины орбиты и сращенного с ее надкостницей (рис. 18.1). Прямые мышцы в виде лент направляются кпереди параллельно соответствующим стенкам орбиты, образуя так называемую мышечную воронку. У экватора глаза они прободают тенонову капсулу (влагалище глазного яблока) и, не доходя до лимба, вплетаются в поверхностные слои склеры. Тенонова капсула снабжает мышцы фасциальным покрытием, которое отсутствует в проксимальном отделе у того места, где начинаются мышцы.
Верхняя косая мышца берет начало у сухожильного кольца между верхней и внутренней прямыми мышцами и идет кпереди к хрящевому блоку, находящемуся в верхневнутреннем углу орбиты у ее края. У блока мышца превращается в сухожилие и, пройдя через блок, поворачивает кзади и кнаружи. Располагаясь под верхней прямой мышцей, она прикрепляется к склере кнаружи от вертикального меридиана глаза. Две трети всей длины верхней косой мышцы находятся между вершиной орбиты и блоком, а одна треть – между блоком и местом прикрепления к глазному яблоку. Эта часть верхней косой мышцы и определяет направление движения глазного яблока при ее сокращении.
В отличие от упомянутых пяти мышц нижняя косая мышца начинается у нижневнутреннего края орбиты (в зоне входа слезно–носового канала), идет кзади кнаружи между стенкой орбиты и нижней прямой мышцей в сторону наружной прямой мышцы и веерообразно прикрепляется под ней к склере в задненаружном отделе глазного яблока, на уровне горизонтального меридиана глаза.
От фасциальной оболочки глазодвигательных мышц и теноновой капсулы идут многочисленные тяжи к стенкам орбиты.
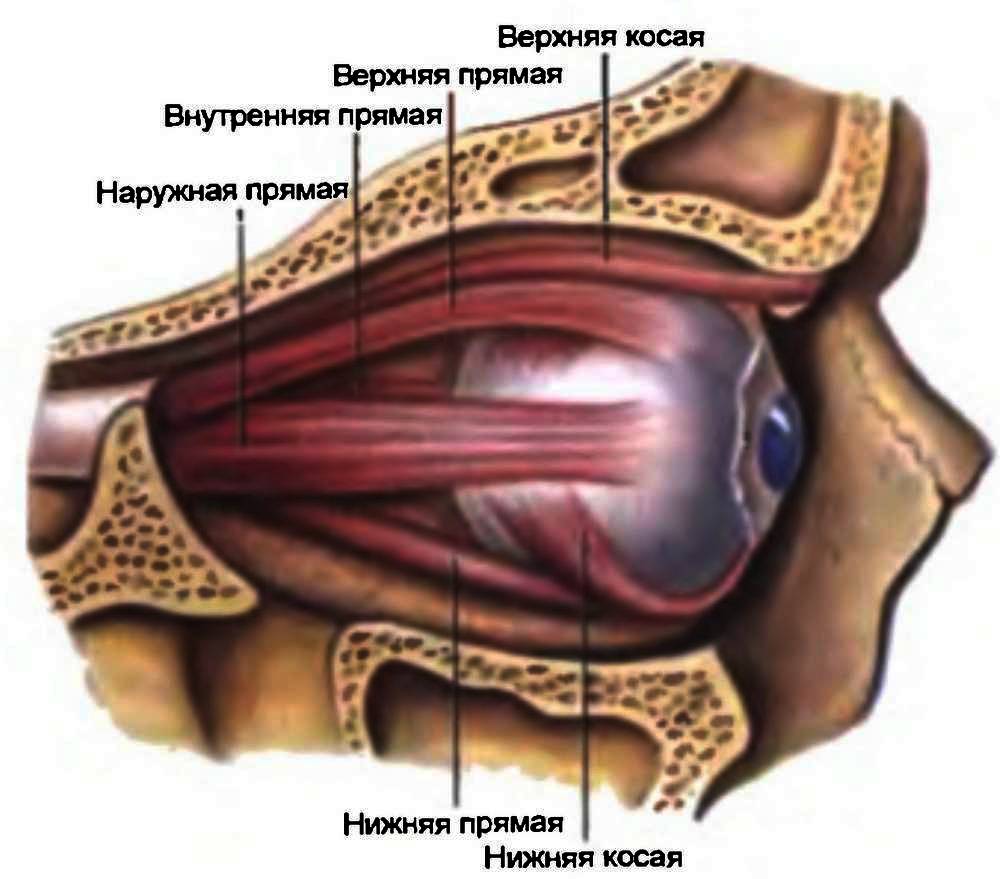 Рис. 18.1. Мышцы глаза [Брошевский Т. И., Бочкарева А. А., 1983].
Рис. 18.1. Мышцы глаза [Брошевский Т. И., Бочкарева А. А., 1983].
Фасциально–мышечный аппарат обеспечивает фиксированное положение глазного яблока, придает плавность его движениям.
Иннервацию мышц глаза осуществляют три черепных нерва: ■ глазодвигательный нерв – n. oculomotorius (III пара) – иннервирует внутреннюю, верхнюю и нижнюю прямые мышцы, а также нижнюю косую ■ блоковый нерв – n. trochlearis (IV пара) – верхнюю косую мышцу ■ отводящий нерв – n. abducens (VI пара) – наружную прямую мышцу.
Все эти нервы проходят в глазницу через верхнюю глазничную щель.
Глазодвигательный нерв после входа в орбиту делится на две ветви. Верхняя ветвь иннервирует верхнюю прямую мышцу и мышцу, поднимающую верхнее веко, нижняя – внутреннюю и нижнюю прямые мышцы, а также нижнюю косую.
Ядро глазодвигательного нерва и находящееся позади него и рядом с ним ядро блокового нерва (обеспечивает работу косых мышц) расположены на дне сильвиева водопровода (водопровод мозга). Ядро отводящего нерва (обеспечивает работу наружной прямой мышцы) находится в варолиевом мосту подо дном ромбовидной ямки.
Прямые глазодвигательные мышцы прикрепляются к склере на расстоянии 5–7 мм от лимба, косые мышцы – на расстоянии 16–19 мм.
Ширина сухожилий у места прикрепления мышц колеблется от 6–7 до 8–10 мм. Из прямых мышц наиболее широкое сухожилие у внутренней прямой мышцы, которая играет основную роль в осуществлении функции сведения зрительных осей (конвергенция).
Линия прикрепления сухожилий внутренней и наружной мышц, т. е. их мышечная плоскость, совпадает с плоскостью горизонтального меридиана глаза и концентрична лимбу. Это обусловливает горизонтальные движения глаз, их приведение, поворот к носу – аддукцию при сокращении внутренней прямой мышцы и отведение, поворот к виску – абдукцию при сокращении наружной прямой мышцы. Таким образом, эти мышцы по характеру действия являются антагонистами.
Верхняя и нижняя прямые и косые мышцы осуществляют в основном вертикальные движения глаза. Линия прикрепления верхней и нижней прямых мышц располагается несколько косо, их височный конец находится дальше от лимба, чем носовой. Вследствие этого мышечная плоскость этих мышц не совпадает с плоскостью вертикального меридиана глаза и образует с ним угол, равный в среднем 20° и открытый к виску.
Такое прикрепление обеспечивает поворот глазного яблока при действии этих мышц не только кверху (при сокращении верхней прямой мышцы) или книзу (при сокращении нижней прямой), но одномоментно и кнутри, т. е. аддукцию.
Косые мышцы образуют с плоскостью вертикального меридиана угол около 60°, открытый к носу. Это обусловливает сложный механизм их действия: верхняя косая мышца опускает глаз и производит его отведение (абдукцию), нижняя косая мышца является поднимателем и также абдуктором.
Помимо горизонтальных и вертикальных движений, указанные четыре глазодвигательные мышцы вертикального действия осуществляют торсионные движения глаз по часовой стрелке или против нее. При этом верхний конец вертикального меридиана глаза отклоняется к носу (инторзии) или к виску (эксторзии).
Таким образом, глазодвигательные мышцы обеспечивают следующие движения глаза: ■ приведение (аддукцию), т. е. движение его в сторону носа; эту функцию выполняет внутренняя прямая мышца, дополнительно – верхняя и нижняя прямые мышцы; их называют аддукторами ■ отведение (абдукцию), т. е. движение глаза в сторону виска; эту функцию выполняет наружная прямая мышца, дополнительно – верхняя и нижняя косые; их называют абдукторами ■ движение вверх – при действии верхней прямой и нижней косой мышц; их называют поднимателями ■ движение вниз – при действии нижней прямой и верхней косой мышц; их называют опускателями.
Сложные взаимодействия глазодвигательных мышц проявляются в том, что при движениях в одних направлениях они действуют как синергисты (например, частичные аддукторы – верхняя и нижняя прямые мышцы, в других – как антагонисты (верхняя прямая – подниматель, нижняя прямая – опускатель).
Глазодвигательные мышцы обеспечивают два типа содружественных движений обоих глаз: ■ односторонние движения (в одну и ту же сторону – вправо, влево, вверх, вниз) – так называемые верзионные движения ■ противоположные движения (в разные стороны) – вергентные, например к носу – конвергенция (сведение зрительных осей) или к виску – дивергенция (разведение зрительных осей), когда один глаз поворачивается вправо, другой – влево.
Вергентные и верзионные движения могут совершаться также в вертикальном и косом направлениях.
Описанные выше функции глазодвигательных мышц характеризуют моторную деятельность глазодвигательного аппарата, сенсорная же проявляется в функции бинокулярного зрения.
Бинокулярное зрение, т. е. зрение двумя глазами, когда предмет воспринимается как единый образ, возможно только при четких содружественных движениях глазных яблок. Глазные мышцы обеспечивают установку двух глаз на объект фиксации так, чтобы его изображение попадало на идентичные точки сетчаток обоих глаз. Только в этом случае возникает одиночное восприятие объекта фиксации. Идентичными, или корреспондирующими, являются центральные ямки и точки сетчаток, удаленные на одинаковое расстояние от центральных ямок в одном и том же меридиане. Точки же сетчаток, отстоящие на разные расстояния от центральных ямок, называются диспаратными, несоответствующими (неидентичными). Они не обладают врожденным свойством одиночного восприятия. При попадании изображения объекта фиксации на неидентичные точки сетчатки возникает двоение, или диплопия (греч. diplos – двойной, opos – глаз), – весьма мучительное состояние. Это происходит, например, при косоглазии, когда одна из зрительных осей смещена в ту или другую сторону от общей точки фиксации.
Два глаза расположены в одной фронтальной плоскости на некотором расстоянии друг от друга, поэтому в каждом из них формируются не вполпе одинаковые изображения предметов, находящихся спереди и сзади объекта фиксации. Вследствие этого неизбежно возникает двоение, называемое физиологическим. Оно нейтрализуется в центральном отделе зрительного анализатора, но служит условным сигналом для восприятия третьего пространственного измерения, т. е. глубины.
Такое смешение изображений предметов (ближе и дальше расположенных отточки фиксации) вправо и влево от желтого пятна на сетчатках обоих глаз создает так называемую поперечную диспарацию (смещение) изображений и попадание (проекцию) их на диспаратные участки (неидентичные точки), что и вызывает двоение, в том числе физиологическое.
Поперечная диспарация – первичный фактор глубинного восприятия. Есть вторичные, вспомогательные, факторы, помогающие в оценке третьего пространственного измерения. Это – линейная перспектива, величина объектов, расположение светотеней, что помогает восприятию глубины, особенно при наличии одного глаза, когда поперечная диспарация исключается.
С понятием бинокулярного зрения связаны такие термины, как фузия (психофизиологический акт слияния монокулярных изображений), фузионные резервы, обеспечивающие бинокулярное слияние при определенной степени сведения (конвергенции) и разведения (дивергенции) зрительных осей.
Патология глазодвигательного аппарата
Нарушения функции глазодвигательного аппарата могут проявляться в неправильном положении глаз (косоглазие), ограничении или отсутствии их движений (парезы, параличи глазодвигательных мышц), нарушении фиксационной способности глаз (нистагм).Косоглазие не только является косметическим недостатком, но и сопровождается выраженным расстройством монокулярных и бинокулярных зрительных функций, глубинного зрения, диплопией; оно затрудняет зрительную деятельность и ограничивает профессиональные возможности человека.
Нистагм часто приводит к слабовидению и инвалидности по зрению.
Косоглазие
Косоглазие (strabismus, heterotropia) – отклонение одного глаза от обшей точки фиксации, сопровождающееся нарушением бинокулярного зрения. Это заболевание проявляется не только формированием косметического дефекта, но и нарушением как монокулярных, так и бинокулярных зрительных функций.Косоглазие полиэтиологично. Причиной его развития могут быть аметропия (гиперметропия, миопия, астигматизм), анизометропия (разная рефракция двух глаз), неравномерность тонуса глазодвигательных мышц, нарушение их функции, заболевания, приводящие к слепоте или значительному снижению зрения одного глаза, врожденные пороки механизма бинокулярного зрения. Все эти факторы оказывают влияние на еще не сформировавшийся и недостаточно устойчивый механизм бинокулярной фиксации у детей и в случае воздействия неблагоприятных факторов (инфекционные заболевания, стрессы, зрительное утомление) могут привести к возникновению косоглазия.
Различают два вида косоглазия – содружественное и паралитическое, которые различаются как по патогенезу, так и по клинической картине.
От истинного косоглазия следует отличать скрытое и мнимое косоглазие.
Скрытое косоглазие, или гетерофория
Идеальное мышечное равновесие обоих глаз называют ортофорией (от греч. ortos – прямой, правильный). В этом случае даже при разобщении глаз (например, посредством прикрывания) сохраняются их симметричное положение и бинокулярное зрение.У большинства же (70–80%) здоровых людей наблюдается гетерофория (от греч. heteros – другой), или скрытое косоглазие. При гетерофории отсутствует идеальное равновесие функций глазодвигательных мышц, однако симметричное положение глаз сохраняется благодаря бинокулярному слиянию зрительных образов обоих глаз.
Гетерофория может быть обусловлена анатомическими или нервными факторами (особенностями строения глазницы, тонусом глазодвигательных мышц и др.). Диагностика гетерофории основана на исключении условий для бинокулярного зрения.
Простым способом определения гетерофории является проба с прикрыванием. Обследуемый фиксирует какой–либо предмет (конец карандаша, палец исследователя) двумя глазами, затем один его глаз врач прикрывает рукой. При наличии гетерофории прикрытый глаз отклонится в сторону действия превалирующей мышцы: кнутри (при эзофории) или кнаружи (при экзофории). Если руку убрать, этот глаз из–за стремления к бинокулярному слиянию (исключенному при прикрывании рукой) совершит установочное движение к исходной позиции. В случае ортофории симметричное положение глаз сохранится.
При гетерофории лечения не требуется, лишь при ее значительной выраженности могут возникать бинокулярная декомпенсация и астенопия (боли в области глаз, надбровья). В этих случаях назначают облегчающие зрение очки (сферические или призматические).
Мнимое косоглазие
У большинства людей имеется небольшой угол (3–4°) между оптической осью, проходящей через центр роговицы и узловую точку глаза, и зрительной осью, идущей от центральной ямки желтого пятна к объекту фиксации, – так называемый угол гамма (γ). В отдельных случаях этот угол достигает 7–8° и более. При обследовании таких пациентов световой рефлекс от офтальмоскопа на роговице смещен от ее центра к носу или к виску, в результате чего создается впечатление косоглазия. Правильный диагноз можно установить после определения бинокулярного зрения: при мнимом косоглазии бинокулярное зрение имеется и лечения не требуется.Содружественное косоглазие
Содружественное косоглазие – патология, наблюдающаяся преимущественно в детском возрасте, наиболее часто развивающаяся форма глазодвигательных нарушений, которая, помимо отклонения глаза от общей точки фиксации, характеризуется нарушением бинокулярного зрения. Его выявляют у 1,5–2,5% детей. При содружественном косоглазии функции глазодвигательных мышц сохраняются, при этом один глаз будет фиксирующим, другой – косящим.В зависимости от направления отклонения косящего глаза различают сходящееся косоглазие (эзотропия), расходящееся (экзотропия), вертикальное косоглазие при отклонении одного глаза вверх или вниз (гипер– и гипотропия). При торзионных смещениях глаза (наклон его вертикального меридиана в сторону носа или виска) говорят о циклотропии (экс– и инциклотропия). Возможно также комбинированное косоглазие.
Из всех видов содружественного косоглазия чаще всего наблюдаются сходящееся (70–80% случаев) и расходящееся (15–20%). Вертикальные и торзионные отклонения отмечаются, как правило, при паретическом и паралитическом косоглазии.
По характеру отклонения глаза различают одностороннее, т. е. монолатеральное, косоглазие, когда постоянно косит один глаз, и альтернирующее, при котором попеременно косит то один, то другой глаз.
В зависимости от степени участия аккомодации в возникновении косоглазия различают аккомодационное, частично–аккомодационное и неаккомодационное косоглазие. Импульс к аккомодации повышен при гиперметропии и снижен при миопии. В норме существует определенная связь между аккомодацией и конвергенцией и эти функции осуществляются одновременно. При косоглазии их соотношения нарушаются. Повышенный импульс к аккомодации при гинерметропии, наиболее часто наблюдающийся в детском возрасте, усиливает стимул к конвергенции и обусловливает высокую частоту сходящегося косоглазия.
Аккомодационное косоглазие (более 15% больных) характеризуется тем, что девиация (отклонение глаза) устраняется при оптической коррекции аметропии, т. е. постоянном ношении очков. При этом достаточно часто восстанавливается бинокулярное зрение и больные не нуждаются в хирургическом лечении. В случае неаккомодационного косоглазия ношение очков не устраняет девиацию и лечение должно обязательно включать оперативное вмешательство. При частично–аккомодационном косоглазии ношение очков уменьшает, но полностью не устраняет девиацию.
Косоглазие может быть также постоянным или периодическим, когда наличие девиации чередуется с симметричным положением глаз.
Содружественное косоглазие сопровождается следующими сенсорными нарушениями: снижением остроты зрения, эксцентричной фиксацией, функциональной скотомой, диплопией, асимметричным бинокулярным зрением (анормальной корреспонденцией сетчаток), нарушением глубинного зрения.
Одним из наиболее часто возникающих сенсорных нарушений при монолатеральном косоглазии является амблиопия, т. е. функциональное снижение зрения глаза вследст вие его бездействия, неупотребления.
По степени снижения остроты зрения, согласно классификации Э. С. Аветисова, выделяют амблиопию низкой степени – при остроте зрения косящего глаза 0,8–0,4, средней – 0,3–0,2, высокой – 0,1–0,05, очень высокой – 0,04 и ниже. Амблиопия высокой степени обычно сопровождается нарушением зрительной фиксации косящего глаза.
 Рис. 18.2. Топография зрительной фиксации.
Рис. 18.2. Топография зрительной фиксации.
В норме фиксация является фовеальной (рис. 18.2). Нецентральная фиксация может быть парафовеальной, макулярной, парамакулярной, околодисковой (периферической), при этом изображение попадает на эксцентричный участок сетчатки.
По механизму возникновения амблиопия может быть дисбинокулярной, т. е. возникающей вследствие нарушения бинокулярного зрения, что наблюдается при косоглазии, когда участие отклоненного глаза в зрительном акте значительно снижается, или рефракционной, которая является следствием несвоевременного назначения и непостоянного ношения очков при аметропиях, создающих нечеткое изображение на глазном дне.
При наличии некорригированной анизометропии возникает анизометропическая амблиопия. Рефракционная амблиопия может быть достаточно успешно преодолена посредством рациональной и постоянной оптической коррекции (очки, контактные линзы).
Помутнение глазных сред (врожденная катаракта, бельмо) может послужить причиной обскурационной амблиопии, трудно поддающейся лечению, для устранения которой требуется своевременное оперативное вмешательство (например, экстракция врожденной катаракты, пересадка роговицы).
Амблиопия может быть одно– и двусторонней.
При амблиопии снижается также цветовая и контрастная чувствительность.
При появлении косоглазия неминуемо возникает двоение, так как изображение в косящем глазу попадает на диспаратный участок сетчатки, однако благодаря адаптационным механизмам зрительно–нервная система приспосабливается к асимметричному положению глаз и возникает функциональное подавление, торможение, или "нейтрализация" (по терминологии Л. И. Сергиевского (1951)], изображения в косящем глазу. Клинически это выражается в возникновениифункциональной скотомы. В отличие от истинных скотом, наблюдающихся при органических поражениях органа зрения, функциональная скотома при косоглазии существует лишь в том случае, если оба глаза открыты, и исчезает при монокулярной фиксации (когда другой глаз прикрыт). Функциональная скотома является формой сенсорной адаптации, избавляющий от двоения, которая наблюдается у большинства больных с содружественным косоглазием.
При монолатеральном косоглазии наличие постоянной скотомы в косящем глазу приводит к стойкому снижению зрения. В случае альтернирующего косоглазия скотома проявляется поочередно то в правом, то в левом глазу в зависимости от того, какой глаз в данный момент косит, поэтому амблиопия не развивается.
Одной из форм сенсорной адаптации при содружественном косоглазии является так называемая анормальная корреспонденция сетчаток, или асимметричное бинокулярное зрение. Диплопия при этом исчезает благодаря возникновению так называемой .южной макулы. Появляется новая функциональная связь между центральной ямкой фиксирующего глаза и участком сетчатки косящего глаза, на который попадает изображение вследствие девиации (отклонения глаза). Такая форма адаптации наблюдается чрезвычайно редко (у 5–7% больных) и только при небольших углах косоглазия (микродевиациях), когда участок сетчатки отклоненного глаза органически и функционально мало отличается от центральной ямки. При больших углах косоглазия, когда изображение попадает на малочувствительный периферический участок сетчатки, исключается возможность его взаимодействия с высокофункциональной центральной ямкой фиксирующего глаза.
Методы исследования. Оценка состояния глазодвигательного аппарата предусматривает исследование как сенсорных (чувствительных), так и моторных (двигательных) функций.
Исследование сенсорных функций включает определение бинокулярного зрения и степени его устойчивости, глубинного (или стереоскопического) зрения, его остроты, наличия или отсутствия бифовеального слияния, фузионных резервов, функциональной скотомы подавления, характера диплоггии.
При исследовании моторных функций определяют подвижность глазных яблок, величину девиации, степень нарушения функций различных глазодвигательных мышц.
При сборе анамнеза необходимо выяснить, в каком возрасте возникло косоглазие, предполагаемую причину его развития, наличие травм и перенесенных заболеваний, косил ли всегда один глаз или проявлялось попеременное отклонение обоих глаз, характер проводимого лечения, длительность ношения очков.
Исследование остроты зрения следует проводить в очках и без них, а также при двух открытых глазах, что особенно важно при нистагме.
Помимо общего офтальмологического исследования, применяют специальные методы.
Для определения характера косоглазия (монолатеральное, альтернирующее) следует провести фиксационную пробу: прикрывают ладонью фиксирующий (например, правый) глаз обследуемого и просят его смотреть на конец карандаша или ручки офтальмоскопа. Когда отклоненный глаз (левый) начинает фиксировать объект, убирают ладонь и оставляют открытым правый глаз. Если левый глаз продолжает фиксировать конец карандаша, то, значит, у обследуемого альтернирующее косоглазие, если же при двух открытых глазах левый глаз снова косит, то косоглазие монолатеральное.
Вид косоглазия и величину девиации (угол косоглазия) определяют по направлению отклонения глаза (сходящееся, расходящееся, вертикальное).
Угол косоглазия можно определить по методу Гиршберга. Врач, приложив ручной офтальмоскоп к своему глазу, просит больного смотреть в отверстие офтальмоскопа и наблюдает за положением световых рефлексов на роговицах обоих глаз пациента с расстояния 35–40 см. О величине угла судят по смешению рефлекса от центра роговицы косящего глаза по отношению к зрачковому краю радужки и лимбу (рис. 18.3) при средней ширине зрачка 3–3,5 мм. При сходящемся косоглазии ориентируются по наружному краю зрачка, а при расходящемся – но внутреннему.
 Рис. 18.3. Положение светового рефлекса на роговице косящего глаза при определении угла косоглазия по метолу Гиршберга.
Рис. 18.3. Положение светового рефлекса на роговице косящего глаза при определении угла косоглазия по метолу Гиршберга.
Подвижность глаз определяют при перемещении объекта фиксации, за которым следит глазами пациент, в восьми направлениях взора: вправо, влево, вверх, вниз, вверх – вправо, вверх – влево, вниз – вправо, вниз – влево. При содружественном косоглазии глаза совершают движения в достаточно полном объеме. При паралитическом косоглазии целесообразно применение специальных методов – коордиметрии и спровоцированной диплопии (см. 18.2.3.2), позволяющих выявить пораженную мышцу.
При вертикальной девиации проводят определение угла косоглазия в боковых позициях – при аддукции и абдукции. Увеличение угла вертикального косоглазия при аддукции свидетельствует о поражении косых мышц, при абдукции – прямых мышц вертикального действия.
При наличии амблиопии оценивают состояние зрительной фиксации на монобиноскопе (рис. 18.4) – одном из основных приборов, применяемых для исследования и лечения косоглазия. Прибор сконструирован по типу стационарного офтальмоскопа Гульштранда, позволяющего при фиксации головы ребенка осуществлять исследование глазного дна, определять состояние зрительной фиксации, проводить лечебные процедуры. Ребенок смотрит на конец фиксационного стержня (“иглы") монобиноскопа, тень от которого проецируется (на глазном дне) на участок фиксации (см. рис. 18.2).
 Рис. 18.5. Занятия на синоптофоре [Брошевский Т. И., Бочкарева А. А., 1983].
Рис. 18.5. Занятия на синоптофоре [Брошевский Т. И., Бочкарева А. А., 1983].
Методы исследования бинокулярных функций при косоглазии основаны на принципе разделения полей зрения правого и левого глаза (гаплоскопия), что позволяет выявить участие (или неучастие) косящего глаза в бинокулярном зрении. Гаплоскопия может быть механической, цветовой, растровой и др.
Один из основных гаплоскопических приборов – синоптофор (рис. 18.5). Разделение полей зрения правого и левого глаза в этом приборе осуществляется механически, с использованием двух (отдельных для каждого глаза) подвижных оптических трубок, с помощью которых обследуемому предъявляют парные тест–объекты.
Тест–объекты синоптофора (рис. 18.6) могут перемещаться (по горизонтали, вертикали, торзионно, т. е. по часовой стрелке и против нее) и устанавливаться в соответствии с углом косоглазия. Они различаются контрольными для каждого глаза элементами, что и позволяет при совмещении парных (правого и левого) рисунков судить о наличии или отсутствии бинокулярного слияния, т. е. фузии, а при его отсутствии – о наличии функциональной скотомы (когда исчезает деталь или весь рисунок перед косящим глазом). При наличии слияния определяют фузионные резервы путем сведения или разведения тест–объектов (оптических трубок синоптофора) до момента двоения тест–объекта. При сведении трубок синоптофора определяют положительные фузионные резервы (резервы конвергенции), при разведении – отрицательные фузионные резервы (резервы девергенции).
 Рис. 18.6. Пример совмещения двух изображений на синаптофоре [Брошевский Т. И., Бочкарева А. А., 1983].
Рис. 18.6. Пример совмещения двух изображений на синаптофоре [Брошевский Т. И., Бочкарева А. А., 1983].
 Рис. 18.7. Четырехточечный цветотест для исследования бинокулярного зрения и красно–зеленые очки–фильтры.
Рис. 18.7. Четырехточечный цветотест для исследования бинокулярного зрения и красно–зеленые очки–фильтры.
Наиболее значительны положительные фузионные резервы. При исследовании на синоптофоре с тестом № 2 ("кошки") у здоровых лиц они составляют 16 ± 8°, отрицательные – 5 ± 2°, вертикальные – 2–4 призменные диоптрии (1–2°). Торзионные резервы составляют: инциклорезервы (при наклоне вертикального меридиана рисунка к носу) – 14 ± 2°, эксциклорезервы (при наклоне к виску) – 12 ± 2°.
Фузионные резервы зависят от условий исследования (при использовании разных методов – синоптофора или призмы), размеров тест–объектов, их ориентации (вертикальная или горизонтальная) и других факторов, которые учитывают при определении тактики лечения.
Для исследования бинокулярного зрения в естественных и близких к ним условиях применяют методы, основанные на цветовом, поляроидном или растровом разделении полей зрения. С этой целью используют, например, красные и зеленые светофильтры (красный – перед одним, зеленый – перед другим глазом), поляроидные фильтры с вертикально и горизонтально ориентированными осями, растровые фильтры взаимно перпендикулярной ориентации для обоих глаз. Использование этих методов позволяют ответить на вопрос о характере зрения у больного: бинокулярное, одновременное (диплопия) или монокулярное.
Цветовой четырехточечный цветотест Белостоцкого – Фридмана имеет два зеленых (или синих) кружка, один красный и один белый кружок (рис. 18.7). Обследуемый смотрит через красно–зеленые очки: перед правым глазом стоит красный фильтр, перед левым – зеленый (или синий). Средний белый круг, видимый через красный и зеленый фильтры очков, будет восприниматься как зеленый или красный в зависимости от преобладания правого или левого глаза (рис. 18.8). При монокулярном зрении правого глаза (рис. 18.8, а) через красное стекло обследуемый видит только красные кружки (их два), при монокулярном зрении левого глаза (рис. 18.8, б) – только зеленые (их три). При одновременном зрении (рис. 18.8, в) он видит пять кружков: два красных и три зеленых, при бинокулярном (рис. 18.8, г, д) – четыре кружка: два красных и два зеленых.
 Рис. 18.8. Видимое пациентом расположение кружков четырехточечного цветотеста. Объяснение с тексте.
Рис. 18.8. Видимое пациентом расположение кружков четырехточечного цветотеста. Объяснение с тексте.
При использовании поляроидных или растровых фильтров (так называемых очков Баголини), так же как и в цветовом приборе, имеются общий объект для слияния и объекты, видимые только правым или только левым глазом.
Методы исследования бинокулярного зрения различаются степенью разобщающего ("диccoцииpyющeгo") действия: оно более выражено в цветовом приборе, менее – в поляроидном тесте и в растровых очках, так как условия для зрения в них ближе к естественным.
При пользовании растровыми очками видно все окружающее пространство, как в естественных условиях (в отличие от зрения в цветовых красно–зеленых очках), а разобщающее действие растров проявляется лишь тонкими, взаимно перпендикулярными световыми полосами, проходящими через общий круглый источник света – объект фиксации. Поэтому при исследовании разными методами у одного и того же больного можно выявить одновременное зрение на четырехточечном тесте и бинокулярное – в растровых очках Баголини. Это необходимо помнить при оценке бинокулярного статуса и для определения лечебной тактики.
Существуют различные глубинно–глазомерные приборы и стереоскопы, позволяющие определить остроту и пороги (в градусах или линейных величинах) глубинного и стереоскопического зрения. При этом обследуемый должен правильно оценить или расположить предъявляемые тест–объекты, смещенные по глубине. По степени ошибки будет определена острота стереозрения в угловых или линейных величинах.
Расходящееся содружествен ное косоглазие – более благоприятная форма глазодвигательных нарушений, чем сходящееся, оно реже сопровождается амблиопией. Нарушения бинокулярного зрения проявляются при расходящемся косоглазии в более легкой форме, в основном выявляется недостаточность конвергенции.
Лечение. Конечная цель лечения содружественного косоглазия – восстановление бинокулярного зрения, поскольку только при этом условии восстанавливаются зрительные функции и устраняется асимметрия в положении глаз. С этой целью используют систему комплексного лечения содружественного косоглазия, которая включает: ■ оптическую коррекцию аметропии (очки, контактные линзы) ■ плеоптическое лечение (плеоптика – лечение амблиопии) ■ хирургическое лечение ■ ортоптодиплоптическое лечение, направленное на восстановление бинокулярных функций (пред– и послеоперационное) и глубинного зрения.
Оптическая коррекция. Оптическая коррекция аметропии способствует восстановлению остроты зрения и нормализации соотношения аккомодации и конвергенции. Это приводит к уменьшению или устранению угла косоглазия и в конечном итоге способствует восстановлению бинокулярного зрения (при аккомодационном косоглазии) или созданию условий для этого. Коррекция аметропии показана при любых формах косоглазия. Очки следует назначать для постоянного ношения под систематическим контролем остроты зрения (1 раз в 2–3 мес).
Плеоптика. Плеоптика – система методов лечения амблиопии.
Одним из традиционных и основных методов плеоптического лечения является прямая окклюзия – выключение здорового (фиксирующего) глаза[4]. Она создает условия для фиксации предметов косящим глазом, включая его в активную зрительную деятельность и в значительном числе случаев, особенно при своевременном назначении, приводит к восстановлению остроты зрения косящего глаза. С этой целью используют специальные пластиковые окклюдоры, прикрепляемые к очковой оправе, или самодельные мягкие шторки (занавески), а также полупрозрачные (с разной степенью плотности) окклюдоры, так как для лечения амблиопии достаточно исключить лишь форменное зрение.
По мере повышения остроты зрения амблиопичного глаза степень прозрачности окклюдора перед ведущим глазом можно увеличивать. Полупрозрачная окклюзия способствует также развитию бинокулярной координации обоих глаз. Режим окклюзии определяет врач. Окклюзию назначают на весь день (окклюдор снимают на ночь), на несколько часов в день или через день в зависимости от степени снижения остроты зрения.
Следует помнить, что прямая окклюзия может привести к нарушению функции и сокращению бинокулярных корковых нейронов, в результате чего ухудшается бинокулярное зрение, поэтому используют тактику постепенного перехода к другим методам лечения или использованию пенализации. Принцип пенализации (от франц. penalite – штраф, взыскание) заключается в создании у больного искусственной анизометропии с помощью специальных временных очков. Поводом для разработки метода явилось наблюдение французских исследователей (Pfandi, Pouliquen и Quera), которые отметили, что амблиопия отсутствует при анизометропии на фоне миопии слабой степени одного глаза и эмметропии или слабой гиперметропии другого глаза.
Пенализационные очки "штрафуют" лучше видящий глаз. Их подбирают индивидуально, при этом искусственно создают анизометропию, например путем гиперкоррекции (на 3,0 дптр) лучшего глаза плюсовыми линзами, иногда в сочетании с его атропинизацией. В результате этого ведущий глаз становится миопическим и ухудшается его зрение вдаль, амблиопичный же глаз подключается к активной работе путем полной оптической коррекции. При этом в отличие от прямой окклюзии сохраняется возможность зрения двумя глазами, поэтому пенализация более физиологична, но она эффективнее в более раннем возрасте – 3–5 лет.
В комплексе с окклюзией или отдельно применяют методы световой стимуляции амблиопичного глаза: метод локального "слепящего" раздражения центральной ямки сетчатки светом, разработанный 3. С. Аветисовым, метод последовательных зрительных образов по Кюпперсу, засветы парацентрального участка сетчатки (участка эксцентричной фиксации) по методу Бангертера. Эти методы обеспечивают растормаживающий эффект и снимают феномен подавления с центральной зоны сетчатки.
Метод выбирают в зависимости от возраста ребенка, особенностей его поведения и интеллекта, состояния зрительной фиксации.
Для лечения по методу Аветисова, которое можно сочетать с прямой окклюзией, используют различные источники яркости: световод, лазерный засвет. Продолжительность процедуры несколько минут, поэтому она может быть применена у детей младшего возраста.
Метод последовательных образов Кюпперса основан на их возбуждении путем засвета глазного дна при одновременном затемнении центральной ямки круглым тест–объектом. Последовательные зрительные образы после засвета наблюдаются на белом экране, и их образование стимулируют прерывистым освещением экрана. При использовании этого метода предъявляют более высокие требования к интеллекту пациента, чем при лечении по методу Аветисова.
Лечение указанными методами, а также с применением общего засвета, засвета через красный фильтр и других их разновидностей осуществляют на монобиноскопе. Прибор позволяет при фиксации головы ребенка проводить исследование глазного дна, зрительной фиксации, плеоптическое и диплоптическое лечение под контролем офтальмоскопии.
Все перечисленные выше методы необходимо использовать в сочетании с активными бытовыми зрительными тренировками (рисование, игра с мелкими деталями типа "Мозаика", "Лего" и др.).
Лазерное излучение используют при плеоптическом лечении в виде отраженного лазерного света, так называемых спеклов, путем наблюдения лазерной "зернистости", оказывающей стимулирующее действие на сетчатку. Используют отечественные приборы "ЛАР" и "МАКДЕЛ": первый – дистанционный, второй – приставляют к глазам. Лазерные спеклы можно применять и на монобиноскопе.
Перечисленные методы дают возможность оказывать воздействие в основном на световую и яркостную чувствительность глаза. Комплексное же воздействие на различные виды чувствительности при амблиопии успешно осуществляют с помощью динамических цветовых и частотноконтрастных стимулов различной яркости, формы и смыслового содержания. Это реализовано в специальных отечественных компьютерных программах *'ЕУЕИ (упражнения "Тир", "Погоня", "Крестики", "Паучок" и др.). Упражнения интересны детям, требуют их активного участия. Стимулирующие тесты динамичны и легко меняются. Принцип динамической смены цветовых и контрастно–частотных стимулов использован и в методе, основанном на феномене и нтерферен ции поляризованного света А. Е. Вакуриной. Комплексное воздействие на различные виды зрительной чувствительности существенно повышает эффективность плеоптического лечения.
Хирургическое лечение. При косоглазии цель операции – восстановить симметричное или близкое к нему положение глаз путем изменения мышечного баланса. Усиливают слабые или ослабляют сильные мышцы.
К операциям, ослабляющим действие мышц, относятся рецессия (перенесение места прикрепления мышцы кзади от анатомического), частичная миотомия (нанесение поперечных краевых насечек по обе стороны мышцы), удлинение мышцы путем различных пластических манипуляций), тенотомия (пересечение сухожилия мышцы). В настоящее время тенотомию практически не применяют, так как она может привести к резкому ограничению подвижности глазного яблока и исключить возможность восстановления зрительных функций.
С целью усиления действия мышцы производят резекцию участка мышцы (длиной 4–8 мм в зависимости от степени дозирования вмешательства и величины угла косоглазия) или образование мышечной складки либо складки сухожилия мышцы – теноррафию, а также перемещение места прикрепления мышцы кпереди (антепозиция). При сходящемся косоглазии ослабляют внутреннюю прямую мышцу и усиливают наружную прямую мышцу, при расходящемся выполняют обратные действия.
Основные принципы выполнения оперативного вмешательства при косоглазии таковы. ■ Необходимо отказаться от форсированных вмешательств, соблюдать принцип предварительного дозирования операции в соответствии с существующими расчетными схемами. Операцию выполняют поэтапно: вначале на одном глазу, затем (через 3–6 мес) на другом. ■ Равномерно распределяют дозированное вмешательство на несколько глазных мышц (ослабление сильных, усиление слабых мышц). ■ Обязательно сохраняют связь мышцы с глазным яблоком при операции на ней.
Восстановление правильного положения глаз создает условия для восстановления бинокулярного зрения, что может обеспечивать самокоррекцию остаточного угла косоглазия в послеоперационном периоде. При больших углах косоглазия (30° и более) операции делают в 2 (или 3) этапа в зависимости от исходной величины угла косоглазия.
Высокий косметический и лечебный эффект отмечается при использовании схемы дозирования эффекта операции, разработанной Э. С. Аветисовым и X. М. Махкамовой (1966). Эта схема предусматривает рецессию внутренней прямой мышцы на 4 мм при девиации по Гиршбергу менее 10°. Рецессия большей степени нередко приводит к ограничению подвижности глазного яблока. При углах косоглазия 10°, 15°, 20°, 25° эту операцию выполняют в сочетании с резекцией (усилением) антагониста – наружной прямой мышцы того же глаза – в дозировке 4–5; 6; 7–8 и 9 мм соответственно. При сохранении остаточной девиации второй этап операции выполняют на другом глазу по аналогичной схеме дозирования не ранее чем через 4–6 мес. Симметричное положение глаз достигается у 85% больных и более.
Аналогичную схему дозирования используют при операциях по поводу расходящегося косоглазия, но при этом ослабляют наружную мышцу (делают ее рецессию), а усиливают внутреннюю прямую.
Показанием к выполнению операции служит отсутствие лечебного эффекта при постоянном (в течение 1,5–2 лет) ношении очков (если они показаны).
Обычно операцию производят в возрасте 4–6 лет, что зависит от времени начала заболевания. При врожденных формах заболевания и больших углах отклонения глаза операцию делают раньше – в 2–3 года. Целесообразно устранение косоглазия в дошкольном возрасте, что способствует повышению эффективности дальнейшего функционального лечения и оказывает благоприятное влияние на восстановление зрительных функций.
Ортоптическое и диплоптическое лечение. Ортоптика и диплоптика – система методов восстановления бинокулярного зрения, точнее бинокулярных функций, элементами которых являются: бифовеальное слияние, фузионные резервы, относительная аккомодация, стереоэффект, глубинное восприятие пространства и другие функции. При этом ортоптика – это лечение на приборах с полным искусственным разделением полей зрения обоих глаз: каждому глазу предъявляют отдельный объект и устанавливают его под углом косоглазия; диплоптика – это лечение в естественных и близких к ним условиях.
Бинокулярные упражнения проводятся после достижения максимально возможной остроты зрения косящего глаза, однако допустимой является острота зрения 0,3–0,4.
Ортоптические упражнения обычно выполняют на приборах с механическим разделением полей зрения (механическая гаплоскопия), важнейшим из которых является синоптофор (см. рис. 18.5; аналоги – амблиофор, ортоамблиофор, синоптископ и др.). Парные тест–объекты для обоих глаз подвижны и могут быть расположены под любым углом косоглазия. В этом большое преимущество синоптофора перед приборами с неподвижными рисунками. Синоптофор имеет диагностическое и лечебное назначение. С диагностической целью (определение функциональной скотомы, бифовеального влияния) используют тест–объекты для совмещения ("цыпленок и яйцо”) или мелкие (2,5' или 5°) тест–объекты для слияния ("кошка с хвостом" и "кошка с ушами”). Для определения функциональных резервов и с лечебной целью применяют тест–объекты для слияния больших размеров (7,5°, 10° и др.).
Цель упражнений – устранение функциональной скотомы и развитие бифовеального слияния (сенсорной фузии). Для этого используют два вида упражнений: альтернирующую (попеременную) или одновременную световую стимуляцию ("мигания"). Тест–объекты необходимо устанавливать под объективным углом косоглазия, тогда они проецируются на центральные ямки сетчаток. Прибор позволяет изменять частоту миганий от 2 до 8 в 1 с, которую последовательно увеличивают в ходе выполнения упражнений.
Третий вид упражнений – развитие фузионных резервов: горизонтальных (положительных и отрицательных, т. е. конвергенции и дивергенции), вертикальных, циклорезервов (круговых). Вначале используют крупные, а затем более мелкие тесты для слияния. Упражнения назначают как в пред–, так и в послеоперационном периоде и проводят курсами по 15–20 сеансов с интервалом в 2–3 мес.
Ортоптические приборы при всей их привлекательности и необходимости (на начальных этапах лечения) ограничивают возможность восстановления бинокулярных функций в естественных условиях и обеспечивают излечение лишь у 25–30% больных, что обусловлено искусственными условиями зрения на этих приборах. В связи с этим после достижения симметричного положения глаз следует проводить лечение по восстановлению бинокулярных функций в "свободном пространстве", без механического разделения полей зрения.
Один из таких методов – метод бинокулярных последовательных образов [Кащенко Т. П., 1966]. Он позволяет восстановить бифовеальную фузию, устранить функциональную скотому и восстановить бинокулярное зрение. Метод можно применять в сочетании с упражнениями на синоптофоре при симметричном или близком к нему положении глаз в послеоперационном периоде. Последовательные образы (в виде круга с правой горизонтальной пометкой для правого глаза и с левой меткой
для левого) вызывают, как и при использовании метода Кюпперса (при лечении амблиопии), на монобиноскопе,, но засвечивают оба глаза, причем последовательно: сначала один, а затем другой. Затем вызванные в каждом глазу образы пациент наблюдает на белом экране при прерывистом освещении и совмещает их в единый образ. Через 1–2 мин процедуру; засвета повторяют еще 2 раза. Применение метода бинокулярных последовательных образов повышает эффективность лечения и способствует восстановлению бинокулярного зрения.
Недостатки методов ортоптики послужили поводом к разработке другой системы лечения – диплоптики (Аветисов Э. С., 1977]. Основной принцип диплоптики – устранить феномен подавления зрительного сбраза косящего глаза в естественных условиях путем возбуждения диплопии и выработки фузионного рефлекса бификсации.
Все диплоптические методы применяют при двух открытых глазах, наличии, бифовеальной фузии, симметричном или близком к нему положении глаз, достигнутом с помощью операции или оптической коррекции. Имеемся ряд диплоптических способов, при применении которых для возбуждения диплопии используют различные диссоциирующие ("провокационные") приемы.
Восстановление механизма бификсации по методу, разработанному Э. С. Аветисовым и Т. П. Кащенко (1976), осуществляют с помощью призмы, ритмически предъявляемой перед одним глазом на 2–3 с с интервалом 1–2 с. Призма отклоняет изображение объекта фиксации на парацентральные участки сетчатки, что вызывает двоение, которое является стимулом к бинокулярному слиянию – так называемому фузионному рефлексу (бификсации). Силу призмы последовательно увеличивают с 2–4 до 10–12 дптр. Разработана серия приборов "Диплоптик", в которую входит набор призм (рис. 18.9). Существуют приборы, позволяющие менять силу призмы и направление ее основания то к носу, то к виску в автоматическом режиме.
Способ разобщения аккомодации и конвергенции (способ "диссоциации") "обучает" бинокулярному слиянию в условиях возрастающей нагрузки отрицательными линзами, а затем в условиях последовательной релаксации положительными сферическими линзами. Больной преодолевает возбуждаемое при этом двоение. Метод способствует развитию не только бификсации и фузии, но и бинокулярной (относительной) аккомодации, без которой бинокулярное зрение невозможно. С помощью отечественного прибора "Форбис" можно тренировать бинокулярное зрение и относительную аккомодацию в условиях цветового, растрового и поляроидного разделения полей зрения.
Любое диплоптическое упражнение выполняют в течение 15–25 мин, на курс назначают 15–20 занятий. При выполнении упражнений осуществляют контроль за бинокулярным зрением с разных рабочих расстояний – 33 см, 1 м, 5 м, в очках и без очков. Контролируют также запасы относительной аккомодации: величина переносимых отрицательных сферических линз характеризует положительные запасы, переносимых положительных линз – отрицательные запасы. При использовании метода "диссоциации" на цветотесте для близи с 33 см (на приборе "Форбис") отрицательные запасы в норме составляют в среднем +5,0 дптр, положительные – до 7,0 дптр; у больных на начальных этапах лечения они существенно меньше и могут составлять примерно +1,0 и –1,0 дптр.
Диплоптический метод использования цветовых (красных, зеленых и др.) светофильтров возрастающей плотности реализуют с помощью специальных линеек – светофильтров [Кащенко Т. П., Тарасцова М. М., 1980]. Плотность (или пропускная способность) светофильтров различается в среднем на 5%. Самый слабый фильтр – № 1 (5% плотности, или высокая пропускная способность – до 95%), самый плотный – № 15 (75% плотности) (рис. 18.10).
Перед одним глазом пациента (при двух открытых глазах, как и при выполнении любого диплоптического упражнения) ставят линейку со светофильтрами и просят его фиксировать круглый светящийся тест–объект диаметром 1–2 см, находящийся на расстоянии 1–2 м. После возникновения двоения, спровоцированного цветным фильтром, пациент должен соединить (слить) немного отличающиеся по цвету изображения объекта фиксации (например, белый и розовый). Последовательно увеличивают плотность цветного фильтра и на каждом из них тренируют бинокулярное слияние.
Впервые линейку с красными светофильтрами использовал итальянский ученый В. Bagolini (1966) с диагностической целью. В отечественной страбологии красные светофильтры применяют не только с лечебной целью, но и для определения устойчивости достигнутого бинокулярного зрения. Критерием оценки устойчивости является плотность (измеряют в процентах) того светофильтра, при котором бинокулярное зрение нарушается и возникает двоение.
С лечебной целью используют набор нейтральных (светло–серых), зеленых (синих), красных и желтых светофильтров. Если при предъявлении красных фильтров (которые также применяют как диагностические) слияние осуществляется с трудом, лечение начинают с менее диссоциирующих (разобщающих) нейтральных фильтров. После достижения бинокулярного слияния на нейтральных фильтрах (всех степеней плотности) последовательно предъявляют зеленые или синие, а за*;ем красные и желтые светофильтры. Этот способ вошел в клиническую практику как хроматическая диплоптика.
Для бинокулярных тренировок в системе диплоптического лечения используют компьютерные программы ("EYE", "Контур"), основанные на цветовом разделении полей зрения. Упражнения увлекательные, игрового характера, обеспечивают активное участие пациента.
В диплоптике используют тагоке метод бинариметрии (J1. И. Могилев, И. Э. Рабичев, Т. П. Кащенко, В. В. Соловьева и др.), заключающийся в предъявлении двух парных тест–объектов (рис. 18.11) на бинариметре в свободном пространстве. В процессе выполнения упражнений добиваются слияния тест–объектов, уменьшая расстояние между ними, приближая и отодвигая их по оси прибора (поиск зоны комфорта).
При этом возникает третий, средний бинокулярный образ – мнимый, причем по глубине он располагается ближе или дальше кольца прибора и может совпадать с его плоскостью при перемещении рамки с тест–объектами. Эти упражнения развивают бинокулярное, глубинное восприятие и тренируют относительную аккомодацию.
Существуют и другие методики выполнения диплоптических упражнений. Диплопию вызывают, создавая искусственную анизейконию1 путем увеличения размеров одного из монокулярных изображений с помощью объектива с переменным увеличением. В естественных условиях1 переносится разница в величине изображений между правым и левым глазом до 5%, искусственно вызнанная анизейкония у здоровых людей может быть переносима при разнице в величине изображений до 60–70%, а у больных с косоглазием лишь до 15–20%.
Оригинален диплоптический метод, основанный на фазовом (во времени) предъявлении стимулирующих тестов то для правого, то для левого глаза.
Существует мнение, что зрительная информация передается поочередно – то по правому, то по левому зрительному каналу. Отмечается также определенная частота ("фазовость") такой передачи, нарушаемая при различных патологических состояниях, например при косоглазии. На этом основан способ фазовой гаплоскопии с применением жидкокристаллических очков (ЖКО). При прохождении электрического импульса через пластины таких очков в определенном частотно–фазовом режиме изменяется их прозрачность: одно стекло будет прозрачным, другое в этот момент – непрозрачным. Высокую частоту смены таких временных фаз в ЖКО (более 80 Гц) обследуемый не ощущает. В этом преимущество ЖКО по сравнению с другими способами фазового предъявления тест–объектов.
Такие очки используют в двух вариантах. В первом больной должен выполнять увлекательные глубинные упражнения "попадание в цель" на экране компьютера, на котором с такой же частотой предъявляются рисунки, диспаратно расположенные для обоих глаз, что и создает эффект глубины. В процессе выполнения упражнений уровень их сложности повышается (сближение парных рисунков, уменьшение порогов глубины), что способствует повышению остроты глубинного зрения.
Во втором варианте применяют ЖКО для ношения с автономной системой электропитания. В этих очках наряду с попеременно предъявляемыми для каждого глаза фазами включается бинокулярная фаза, когда оба глаза смотрят через прозрачные пластины очков (И. Э. Рабичев, Т. П. Кащенко, С. И. Рычкова, П. Шамон), в результате чего тренируемый постепенно приближается к естественным условиям зрительного восприятия.
Диплоптические упражнения по сравнению с ортоптическими повышают эффективность лечения и способствуют более значительному восстановлению бинокулярного зрения – о25–30% (после ортоптики) до 60–65%, а при раннем применении и более.
Глубинное зрение и стереозрение тренируют с помощью различных глубинно–глазомерных устройств и стереоскопов. Упражнения с использованием глубинных приборов (прибор для забрасывания шариков, трехпалочковый прибор Говарда–Долмана, прибор Литинского и др.) основаны на предъявлении реальной глубинной разности. При проведении исследования больной не должен видеть концы стержней трехпалочкового прибора (подвижного среднего и двух боковых, стоящих на одной поперечной линии). После смещения (исследователем) среднего стержня больной должен расположить его с помощью подвижной спицы в одном ряду с боковыми. По степени расхождения стержней определяют остроту глубинного зрения (в градусах или линейных величинах). В норме острота глубинного зрения при исследовании с 1–2 м составляет до 1*–2 см. Глубинное зрение хорошо тренируется в реальной обстановке, например в играх с мячом (волейбол, теннис, баскетбол и др.).
Исследование с использованием стереоскопов основано на предъявлении стереопарных тест–объектов с диспарацией (смещением) разной степени. Они служат для измерения остроты стереозрения, которая зависит от размеров тест–объектов, возраста и степени тренированности обследуемого. У здоровых лиц она составляет 10–30“ (угловых секунд).
При диплоптическом лечении определенная роль отводится призматическим очкам. Призматические линзы, как известно, преломляют световой луч, смещая изображение объекта фиксации на сетчатке в сторону основания призмы. При наличии небольших или остаточных углов косоглазия в послеоперационном периоде назначают призматические очки для ношения наряду с диплоптическим лечением. По мере уменьшения угла косоглазия силу призматических линз уменьшают, а затем очки отменяют.
Призмы применяют также для развития фузионных резервов в "свободном пространстве". При этом удобно использовать бипризму типа Ландольта – Гершеля, конструкция которой позволяет плавно увеличивать (или уменьшать) ее призматическое действие путем вращения диска.
Бипризма отечественного производства (ОКП – офтальмокомпенсатор призменный) может быть фиксирована в специальном устройстве или очковой оправе. Смена направления основания призмы к виску способствует развитию положительных фузионных резервов, к носу – отрицательных.
Паралитическое косоглазие
Паралитическое косоглазие обусловлено параличом или парезом одной или нескольких глазодвигательных мышц, вызванным различными причинами: травмой, инфекциями, новообразованиями и др. Оно характеризуется прежде всего ограничением или отсуствием подвижности косящего глаза в сторону действия парализованной мышцы. При взгляде в эту сторону возникает двоение, или диплопия. Если при содружественном косоглазии от двоения избавляет функциональная скотома, то при паралитическом косоглазии возникает другой адаптационный механизм: больной поворачивает голову в сторону действия пораженной мышцы, что компенсирует ее функциональную недостаточность. Таким образом, возникает третий характерный для паралитического косоглазия симптом – вынужденный поворот головы. Так, при параличе отводящего нерва (нарушение функции наружной прямой мышцы), например правого глаза, голова будет повернута вправо. Вынужденный поворот головы и наклон к правому или левому плечу при циклотропии (смещении глаза вправо или влево от вертикального меридиана) называют тортиколлисом. Глазной тортиколлис следует дифференцировать от нейрогенного, ортопедического (кривошея), лабиринтного (при отогенной патологии). Вынужденный поворот головы позволяет пассивно переводить изображение объекта фиксации на центральную ямку сетчатки, что избавляет от двоения и обеспечивает бинокулярное зрение, хотя и не вполне совершенное.При раннем возникновении и длительном существовании. паралитического косоглазия может быть подавлено изображение в косящем глазу и исчезнуть диплопия.
Признаком паралитического косоглазия является также неравенство первичного угла косоглазия (косящего глаза) вторичному углу отклонения (здорового глаза). Если попросить больного фиксировать точку (например, смотреть в центр офтальмоскопа) косящим глазом, то здоровый глаз отклонится на значительно больший угол.
При паралитическом косоглазии необходимо определить пораженные глазодвигательные мышцы. У детей дошкольного возраста об этом судят по степени подвижности глаз в разные стороны (определение поля взора). В более старшем возрасте используют специальные методы – коордиметрию и спровоцированную диплопию.
Упрощенный способ определения поля взора заключается в следующем. Больной сидит напротив врача на расстоянии 50–60 см, врач фиксирует левой рукой голову обследуемого и предлагает ему поочередно следить каждым глазом (второй глаз в это время прикрыт) за перемещением предмета (карандаш, ручной офтальмоскоп и т. д.) в 8 направлениях. О недостаточности мышцы судят по ограничению подвижности глаза в ту или иную сторону. При этом используют специальные таблицы. С помощью этого метода можно выявить только выраженные ограничения подвижности глаз.
При видимом отклонении одного глаза по вертикали для выявления паретичной мышцы можно использовать простой способ аддукции–абдукции. Больному предлагают смотреть на какой–либо предмет, перемещают его вправо и влево и наблюдают, увеличивается или уменьшается вертикальная девиация при крайних отведениях взора. Определения пораженной мышцы этим способом осуществляют также по специальным таблицам.
Коордиметрия по Чессу основана на разделении полей зрения правого и левого глаза с помощью красного и зеленого фильтров.
Для проведения исследования используют коордиметрический набор, в который входят разграфленный экран, красный и зеленый фонарики, красно–зеленые очки. Исследование выполняют в полутемной комнате, на одной из стен которой укреплен экран, разделенный на маленькие квадраты. Сторона каждого квадрата равна трем угловым градусам. В центральной части экрана выделено девять меток, размещенных в виде квадрата, положение которых соответствует изолированному физиологическому действию глазодвигательных мышц.
Больной в красно–зеленых очках сидит на расстоянии 1 м от экрана. Для исследования правого глаза в руку ему дают красный фонарик (красное стекло перед правым глазом). В руках у исследователя зеленый фонарик, луч света от которого он поочередно направляет на все девять точек и предлагает больному совместить с зеленым световым пятном световое пятно от красного фонарика. При попытке совместить оба световых пятна обследуемый обычно ошибается на какую–то величину. Положение фиксируемого зеленого и подравниваемого красного пятна врач регистрирует на схеме (лист миллиметровой бумаги), представляющей собой уменьшенную копию экрана. В момент исследования голова больного должна быть неподвижна.
На основании результатов коордиметрического исследования одного глаза нельзя судить о состоянии глазодвигательного аппарата, необходимо сопоставить результаты коордиметрии обоих глаз.
Поле взора на схеме, составленной по результатам исследования, бывает укорочено в направлении действия ослабленной мышцы, одновременно наблюдается компенсаторное увеличение поля взора на здоровом глазу в сторону действия синергиста пораженной мышцы косящего глаза.
Метод исследования глазодвигательного аппарата в условиях спровоцированной диплопии по Хаабу–Ланкастеру основан на оценке положения в пространстве изображений, принадлежащих фиксирующему и отклоненному глазу. Диплопию вызывают, приставляя к косящему глазу красное стекло, что позволяет одновременно определить, какое из двойных изображений принадлежит правому и какое – левому глазу.
Схема исследования с девятью точками аналогична применяемой при коордиметрии, но она одна (а не две). Исследование проводят в полутемной комнате. Нарасстоянии 1–2 м от больного находится источник света. Голова больного должна быть неподвижна.
Как и при коордиметрии, регистрируют расстояние между красным и белым изображениями в девяти позициях взора. При трактовке результатов необходимо пользоваться правилом, согласно которому расстояние между двойными изображениями увеличивается при взгляде в сторону действия пораженной мышцы. Если при коордиметрии регистрируют поле взора (уменьшается при парезах), то при "спровоцированной диплопии" – расстояние между двойными изображениями, которое при парезах уменьшается.
Хирургическое лечение – основной вид лечения паралитического косоглазия.
Нередко показаны пластические операции. Так, при параличе отводящего нерва и отсутствии движений глазного яблока кнаружи может быть произведено подшивание к наружной прямой мышце волокон (в ⅓– ½ ширины мышцы) верхней и нижней прямых мышц.
Сложнее хирургические подходы к косым мышцам, особенно к верхней косой, что обусловлено сложностью ее анатомического хода. Предложены различные виды вмешательств на этих, а также прямых мышцах вертикального действия (верхняя и нижняя прямые). Последние также могут быть рецессированы (ослаблены) или резецированы (усилены).
При выполнении операции на глазодвигательных мышцах необходимо обращаться с ними осторожно, не нарушая естественного направления мышечной плоскости, особенно если это клинически не оправдано. Специальные операции, осуществляемые при сложных видах косоглазия, могут изменять не только силу, но и направление действия мышц, однако перед их выполнением необходимо провести тщательное диагностическое исследование.
Одним из методов лечения паралитического косоглазия является призматическая коррекция. Чаще она помогает при лечении недавно возникших парезов и параличей глазодвигательных мышц у взрослых, например после черепно–мозговых травм.
Призматические очки совмещают двойные изображения, предотвращая развитие у больного диплопии и вынужденного поворота головы. Возможно также медикаментозное и физиотерапевтическое лечение.
Нистагм
Нистагм – тяжелая форма глазодвигательных нарушений, проявляющаяся в самопроизвольных колебательных движениях глаз и сопровождающаяся значительным снижением остроты зрения – слабовидснием. Развитие нистагма может быть обусловлено воздействием центральных или местных факторов.Нистагм обычно возникает при врожденном или раноприобретенном снижении зрения в связи с различными заболеваниями глаз (помутнения оптических сред, атрофия зрительного нерва, альбинизм, дистрофия сетчатки и др.), в результате чего нарушается механизм зрительной фиксации.
При некоторых разновидностях нистагма сохраняется достаточно высокая острота зрения, в таких случаях причина его развития состоит в нарушениях регуляции глазодвигательного аппарата.
В зависимости от направления колебательных движений различают горизонтальный (наиболее часто наблюдаемый), вертикальный, диагональный и вращательный нистагм, по характеру движений – маятникообразный (при равной амплитуде колебательных движений), толчкообразный (при разной амплитуде колебаний: медленной фазы – в одну сторону и быстрой – в другую) смешанный (проявляются то маятникообразные, то толчкообразные движения). Толчкообразный нистагм называют лево– или правосторонним в зависимости от направления его быстрой фазы. При толчкообразном нистагме отмечается вынужденный поворот головы в сторону быстрой фазы. Этим поворотом больной компенсирует слабость глазодвигательных мышц, и амплитуда нистагма уменьшается, поэтому, если голова повернута вправо, слабыми считаются "правые*' мышцы: наружная прямая правого глаза и внутренняя прямая левого глаза. Такой нистагм называют правосторонним.
Нистагм может быть крупнокалиберный (с амплитудой колебательных движений глаз более 15°), среднекалиберный (с амплитудой 15––5°), мелкокалиберный (с амплитудой менее 5°).
Для определения амплитуды, частоты и характера колебательных нистагмоидных движений используют объективный метод исследования – нистагмографию. При отсутствии нистагмографа характер амплитуды нистагма можно определить по степени смещения светового рефлекса от офтальмоскопа на роговице. Если световой рефлекс при колебательных движениях глаз перемещается от центра роговицы до середины расстояния между центром и краем зрачка, говорят о мелкокалиберном, мелкоразмашистом нистагме, если выходит за эти пределы – крупнокалиберном. Если движения обоих глаз неодинаковы, такой нистагм называют диссоциированным. Он наблюдается крайне редко.
При обследовании больных с нистагмом важны результаты электрофизиологических исследований (электроретинограмма, зрительные вызванные потенциалы и др.), позволяющие уточнить диагноз, определить степень органических поражений, наличие амблиопии и определить тактику лечения.
При нистагме остроту зрения каждого глаза исследуют в очках и без очков, при прямом и вынужденном положении головы. В этом положении амплитуда нистагма обычно уменьшается и острота зрения становится выше. Этот критерий используют для решения вопроса о целесообразности выполнения оперативного вмешательства на глазодвигательных мышцах. Важно определить остроту зрения при двух открытых глазах (в очках и без очков), так как при бинокулярной фиксации амплитуда нистагма также уменьшается и острота зрения становится выше.
Система мер по повышению зрительных функций при нистагме включает тщательно подобранную оптическую коррекцию для дали и близи. При альбинизме, дистрофии сетчатки, частичной атрофии зрительных нервов целесообразен подбор защитных и повышающих остроту зрения цветных светофильтров (нейтральных, желтых, оранжевых, коричневых) той плотности, которая обеспечивает наибольшую остроту зрения.
При нистагме нарушается также аккомодационная способность и отмечается относительная амблиопия, поэтому назначают плеоптическое лечение и упражнения по тренировке аккомодации. Полезны засветы через красный фильтр (на монобиноскопе), избирательно стимулирующие центральную зону сетчатки, стимуляция контрастно–частотными и цветовыми тест–объектами (прибор "Иллюзион", компьютерные упражнения по программам "Зебра", "Паучок", "Крестики", "EYE"). Эти упражнения можно выполнять последовательно для каждого глаза и при двух открытых глазах. Весьма полезны бинокулярные упражнения и диплоптическое лечение (способ "диссоциации", бинариметрия), также способствующие уменьшению амплитуды нистагма и повышению остроты зрения.
Медикаментозную терапию при нистагме используют для улучшения питания тканей глаза, сетчатки (сосудорасширяющие препараты, комплекс витаминов).
Хирургическое лечение нистагма проводят для уменьшения колебательных движений глаз. При толчкообразном нистагме, когда диагностируют вынужденный поворот головы с повышением остроты зрения и уменьшением амплитуды нистагма в этой позиции ("зона покоя"), цель операции – перенести "зону покоя" в срединное положение. Для этого ослабляют более сильные мышцы (на стороне медленной фазы) и усиливают более слабые мышцы (на стороне быстрой фазы). В результате выпрямляется положение головы, уменьшается нистагм, повышается острота зрения.
Глава 19. Болезни глазницы
Глазница (орбита) – замкнутое пространство, в котором располагается большое количество сложных анатомических структур, обеспечивающих жизнедеятельность и функции органа зрения.Болезнь всегда легко в наш дом приходит,Но вот беда: с трудом потом уходит.Санаи
Анатомо–топографическими особенностями орбиты (ее взаимоотношение с окружающими областями – полостью черепа и параназальными синусами, отсутствие клапанов в венах орбиты, непосредственная связь ее артериальной системы с системами внутренней и наружной сонных артерий, изолированность орбитального пространства – см. главу 3) объясняется частое появление однотипных симптомов, в первую очередь экзофтальма, при различных заболеваниях орбиты и смежных областей.
Воспалительные заболевания
Воспалительные заболевания орбиты могут быть как острыми, так и хроническими. Причины их многочисленны: острые и хронические воспаления параназальных синусов, острые респираторные заболевания, травматические повреждения костных стенок орбиты, кожи век, наружных тканей глаза, неудачно выполненные операции на параназальных синусах или в полости рта, в том числе экстирпация зуба (целлюлит, абсцесс), хронические инфекции (туберкулез, сифилис), хронические неспецифические воспаления (псевдотумор, саркоидоз, болезнь Вегенера).Острые воспалительные заболевания орбиты (целлюлит и абсцесс) часто являются результатом перехода воспалительных процессов с соседних областей. Тонкие стенки орбиты, три из которых граничат с параназальными синусами, врожденные или приобретенные щели в них, многочисленные отверстия для сосудов и нервов, через которые орбита сообщается с параназальными синусами, большое количество венозных анастомозов, в которых отсутствуют клапаны, – это основные пути проникновения бактериальной инфекции в орбиту. Гнойный процесс может распространяться в орбиту из височной или крылонебной ямок непосредственно через нижнюю глазничную щель. Входными воротами может служить также анастомоз, соединяющий венозное сплетение, расположенное в крылонебной ямке, с нижней глазной веной. Вены слизистой оболочки верхнечелюстной пазухи тоже анастомозируют с венами орбиты, поэтому развивающиеся в них воспалительные заболевания (флебит) могут стать источниками гнойного воспаления орбитальной клетчатки.
Целлюлит орбиты – разлитое острое воспаление тканей орбиты. Ранее (до конца XX в.) для обозначения данной патологии использовали термин "флегмона”. До эры антибиотиков умирали около 50% больных с данной патологией, практически с такой же частотой развивалась полная слепота на стороне поражения. Заболевание возникает в любом возрасте, но чаще у детей до 5 лет. Почти у 80% больных развитию целлюлита предшествует воспалительный процесс в параназальных синусах или острое респираторное заболевание (особенно часто у детей). Целлюлит может возникнуть также после травмы кожи век и конъюнктивы.
Клиническая картина заболевания характеризуется отеком и гиперемией кожи век. Вначале процесс бывает локальным во внутренней части века, а затем в течение нескольких дней распространяется на оба века. У больного наблюдаются отек мягких тканей щеки, внезапно возникающий экзофтальм с ограничением подвижности глазного яблока, хемоз конъюнктивы. На фоне высокой температуры тела эти изменения сопровождаются чувством распирания в орбите, головной болью. Как правило, результаты посевов отделяемого из носоглотки, со слизистой оболочки век, крови, несмотря на общее тяжелое состояние больного, отрицательные. На рентгенограмме наряду с затемнением орбиты обнаруживают понижение прозрачности одного или двух синусов. При компьютерной томографии в орбите выявляют диффузное затемнение без четких границ, наружные мышцы и задний полюс глаза плохо дифференцируются.
Абсцесс – ограниченное острое воспаление тканей орбиты. Он может быть следствием орбитального целлюлита или развиться в результате перелома одной из стенок орбиты. Особенно опасен перелом верхней и внутренней стенок с формированием субпериостальной гематомы. Абсцесс развивается в течение 24–48 ч. Общее состояние больного тяжелое: высокая температура тела, признаки интоксикации; появляются экзофтальм, хемоз, глаз неподвижен; веки отечны, напряжены настолько, что их иногда невозможно раздвинуть, кожа век резко гиперемирована; подкожные вены лба расширены, резко извиты, цианотичны. В течение нескольких часов может развиться полная слепота в результате острого неврита зрительного нерва. В развитии слепоты играет роль и быстро нарастающий экзофтальм, который может быть столь значительным, что глазная щель не закрывается и напряженные несмыкающиеся отечные веки не в состоянии защитить роговицу. Вследствие отека тканей и кровенаполнения сосудов происходит быстрое натяжение зрительного нерва (исчезает его S–образный изгиб), конически вытягивается задний полюс глазного яблока, при этом давление в артериях снижается, а в венах повышается, что приводит к выраженной ишемии сетчатки.
Лечение целлюлита и абсцесса должно быть начато как можно раньше. В первые часы заболевания показано внутривенное введение антибиотиков широкого спектра действия. При внезапном ухудшении зрения или появлении признаков абсцедирования показано срочное оперативное вмешательство с дренированием полости абсцесса. При наличии патологического процесса в параназальных синусах необходимо их дренирование. Сроки разрешения процесса под влиянием комбинированного лечения неодинаковы. Полная регрессия целлюлита или абсцесса в течение 7 дней наблюдается только у 55–60% больных, у 40–45% лечение затягивается до 4 нед.
Хронические воспалительные заболевания орбиты представлены редко встречающимся туберкулезным и сифилитическим вялотекущим периоститом. В последние три десятилетия преобладают хронические неспецифические заболевания (псевдотумор, саркоидоз и гранулематоз Вегенера), в развитии которых важную роль играют аутоиммунные процессы.
Псевдотумор – собирательный термин, объединяющий группу заболеваний, в основе возникновения которых лежат неспецифические воспалительные изменения в тканях орбиты. Для этих заболеваний характерны внезапное начало с быстрым нарастанием клинических симптомов, напоминающих проявления злокачественной опухоли орбиты, а иногда абсцесса, и однотипная картина хронического неспецифического воспаления, обнаруживаемая при патогистологическом исследовании. В зависимости от локализации очага воспаления выделяют первичный идиопатический миозит (поражены наружные глазные мышцы; рис. 19.1), локальный васкулит орбиты (патологический фокус располагается в орбитальной клетчатке) и дакриоаденит (очаг поражения локализуется в слезной железе). Окончательный диагноз устанавливают только после гистологического исследования патологически измененной ткани. Забор биоптата производят во время диагностической орбитотомии. Лечение медикаментозное: кортикостероиды ретробульбарно или парентерально (причинная терапия), местно – симптоматическая терапия (антибактериальные капли, искусственная слеза).
Саркоидоз – мультисистемное гранулематозное заболевание, природа которого до сих пор неизвестна, несмотря на то что первое описание болезни появилось более 100 лет тому назад. Кожные поражения при саркоидозе описали независимо друг от друга Е. Besnier (1889) и С. Воеск (1899), а в 1914 г. С. Schaumann установил, что неказеозные гранулемы могут развиваться не только в коже, но и в других органах. Туберкулоподобные узелки, представляющие собой эпителиально–клеточные гранулемы, не связанные с эпителием, никогда не подвергаются некрозу. Они содержат большие мононуклеарные фагоциты и гигантские клетки. Клиническая картина саркоидоза орбиты напоминает таковую при медленно растущей опухоли, а поскольку процесс, как правило, локализуется в верхненаружном отделе орбиты, заболевание нередко ошибочно расценивают как опухоль слезной железы Лечение только хирургическое – иссечение гранулем.
Граиулематоз Вегенера – системное заболевание с поражением мельчайших сосудов, при котором возникают деструктивно–продуктивные и продуктивные васкулиты, полиморфно–клеточные гранулемы, содержащие многоядерные гигантские клетки. Заболевание характеризуется триадой клинических симптомов: некротизирующее воспаление верхних дыхательных путей, хронический диффузный нефрит и диффузный ангиит. Орган зрения страдает у 40–45% больных. Первое описание поражения орбиты при гранулематозе Вегенера было дано в 1960 г. Заболевание характеризуется внезапным появлением симптомов быстро растущей опухоли орбиты (рис. 19.2), и только после возникновения лихорадки и уменьшения массы тела можно заподозрить гранулематоз Вегенера. Точный диагноз может быть установлен только после патогистологического исследования биоптата из орбиты. Лечение комбинированное (химиотерапия и кортикостероиды), длительное.
Эндокринная офтальмопатия
Первые сведения об эндокринном экзофтальме появились в 1776 г., когда Грейвс описал случай заболевания щитовидной железы, сопровождавшегося выпячиванием глаза (экзофтальм). Более детально это заболевание начали изучать в конце 40–х годов XX в., и тогда было установлено, что заболевание щитовидной железы с поражением органа зрения встречается достаточно часто. В основе патологического процесса при эндокринной офтальмопатии лежат изменения в наружных глазных мышцах и орбитальной клетчатке, возникающие на фоне нарушенной функции щитовидной железы. При этом характер и степень поражения щитовидной железы могут быть различными. Дисфункцию щитовидной железы обнаруживают у 80% больных, из них у 73–75% выявляют ее гиперфункцию, и только у 8–9% – гипофункцию. В 18–20% случаев эндокринная офтальмопатия возникает на фоне эутиреоидного состояния. Глазные симптомы могут возникнуть как до начала проявления гипертиреоза, так и спустя 15–20 лет после его развития.Выделены три самостоятельные формы заболевания: тиреотоксический экзофтальм, отечный экзофтальм и эндокринная миопатия. В ходе развития патологического процесса тиреотоксический экзофтальм может перейти в отечный, который может завершиться эндокринной миопатией. При двух последних формах морфологически в экстраокулярных мышцах и орбитальной клетчатке вначале выявляют интенсивную клеточную инфильтрацию, на смену которой приходит стация фиброза.
Тиреотоксический экзофтальм всегда развивается на фоне тиреотоксикоза, чаще у женщин. Процесс может быть односторонним, сопровождается тремором рук, тахикардией, уменьшением массы тела, нарушением сна. Больные жалуются на раздражительность, постоянное чувство жара. Глазная щель значительно расширена вследствие ретракции верхнего века (мышца Мюллера – средний пучок мышцы, поднимающей верхнее веко, – находится в состоянии спазма), хотя экзофтальма при этом нет, но расширение глазной щели симулирует его. Для больного с тиреотоксическим экзофтальмом характерен пристальный взгляд из–за редкого мигания. Объем движений экстраокулярных мышц не изменен, глазное дно нормальное, функции глаза не нарушены, смещение глазного яблока кзади при надавливании свободное. Результаты инструментальных исследований, в первую очередь компьютерной и магнитно–резонансной томографии, свидетельствуют об отсутствии изменений в мягких тканях орбиты. Описанные симптомы исчезают под влиянием медикаментозной коррекции дисфункции щитовидной железы.
Отечный экзофтальм чаще возникает на фоне гипертиреоза. Процесс, как правило, двусторонний, но глаза обычно поражаются в разное время, иногда с интервалом в несколько месяцев. В начале развития патологического процесса возникает частичный интермитгирующий птоз: верхнее веко по утрам несколько опускается, а к вечеру занимает нормальное положение. На смену ему быстро приходит выраженная ретракция верхнего века, в развитии которой принимают участие спазм мышцы Мюллера, повышенный тонус верхней прямой мышцы и мышцы, поднимающей верхнее веко (рис. 19.3). В исходе формируется контрактура мышцы Мюллера.
Появляется стационарный экзофтальм, иногда ему предшествует мучительная диплопия. В процессе декомпенсации патологического процесса возникают хемоз, невоспалительный отек периорбитальных тканей и внутриглазная гипертензия. Поскольку при морфологическом исследовании в этот период обнаруживают выраженный отек орбитальной клетчатки, интерстициальный отек и клеточную инфильтрацию экстраокулярных мышц (лимфоцитами, плазмоцитами, тучными клетками, макрофагами и большим количеством мукополисахаридов), последние оказываются значительно увеличенными. Экзофтальм нарастает достаточно быстро, репозиция глазного яблока невозможна, глазная щель закрывается не полностью (рис. 19.4). Глаз неподвижен, развивается оптическая нейропатия, которая может достаточно быстро перейти в атрофию зрительного нерва. В результате сдавления цилиарных нервов возникает тяжелая кератопатия или язва роговицы. В случае отсутствия лечения отечный экзофтальм по истечении 12–14 мес завершается фиброзом тканей орбиты, что сопровождается полной неподвижностью глаза и значительным снижением зрения в результате поражения роговицы или атрофии зрительного нерва (некомпенсированная форма).
Эндокринная миопатия возникает на фоне гипотиреоза или эутиреоидного состояния, чаще у мужчин; процесс двусторонний. Заболевание начинается с появления диплопии, интенсивность которой нарастает постепенно. Диплопия обусловлена резкой ротацией глаза (одного или обоих) в сторону и ограничением его подвижности. Постепенно развивается экзофтальм с затрудненной репозицией глазного яблока. При компьютерной томографии обнаруживают утолщенные и уплотненные наружные глазные мышцы, чаще поражаются нижняя и внутренняя прямые мышцы (рис. 19.5). Другие симптомы, характерные для отечного экзофтальма, отсутствуют. При морфологическом исследовании у таких больных не обнаруживают выраженного отека орбитальной клетчатки, но выявляют значительное утолщение одной или двух экстраокулярных мышц, плотность которых резко повышена. Стадия клеточной инфильтрации очень короткая, и через 4–5 мес развивается фиброз.
 Рис. 19.5. Компьютерная томограмма орбиты при отечном экзофтальме. Утолщение нижней и внутренней прямых мышц правого глаза.
Рис. 19.5. Компьютерная томограмма орбиты при отечном экзофтальме. Утолщение нижней и внутренней прямых мышц правого глаза.
Лечение эндокринной офтальмопатии причинное, симптоматическое и восстановительное. Причинную терапию кортикостероидами назначают при субкомпенсации и декомпенсации процесса. Суточная доза в зависимости от длительности заболевания и степени агрессивности глазных симптомов составляет 40–80 мг/сут в пересчете на преднизолон. При продолжительности заболевания не более 12–14 мес стероидную терапию можно комбинировать с наружным облучением орбит. Симптоматическое лечение заключается в назначении пациенту антибактериальных капель, искусственной слезы, солнцезащитных очков и обязательно глазной мази на ночь. Восстановительное хирургическое лечение проводят при эндокринной миопатии с целью улучшения функций пораженных экстраокулярных мышц или при выраженной ретракции верхнего века для восстановления его нормального положения.
Паразитарные заболевания
Паразитарные заболевания человека многочисленны. В орбите могут паразитировать представители классов цестоды (ленточные черви) и нематоды (круглые черви).Эхинококкоз орбиты вызывается личиночной формой паразита, заражение происходит через мясные продукты. У ⅔ больных поражения обнаруживают в первые 20 лет жизни. В орбите паразит находится в виде одно– или двухкамерного пузыря.
Клинически рост паразита проявляется медленным увеличением экзофтальма (в течение 5–8 лет). Общие патологические изменения, как правило, отсутствуют, в течение длительного периода времени не развивается даже столь характерная для паразитарных заболеваний эозинофилия. Чувство напряжения в орбите появляется, когда пузырь достигает больших размеров и сильно сдавливает мягкие ткани орбиты и глазное яблоко. Из диагностических методов исследования наиболее информативны ультразвуковое сканирование и компьютерная томография, с помощью которых удается четко визуализировать тень кисты и ее капсулу. Лечение хирургическое – орбитотомия и извлечение кисты, желательно без нарушения капсулы.
Аскаридоз – наиболее распространенный гельминтоз человека. Заражение происходит при употреблении немытых овощей и фруктов, через загрязненную воду и руки. Поражение орбиты связано с миграцией личинок паразита с током крови. Аскариды, локализующиеся в орбите, приводят к появлению симптомов объемного процесса в орбите (экзофтальм осевой или со смещением) в сочетании с признаками интермиттирующего воспаления (периодически возникают отек и гиперемия век). Лечение аскаридоза орбиты комбинированное – хирургическое и медикаментозное (противогельминтное).
Филяриатоз орбиты наблюдается нечасто, хотя паразит и называют глазным червем. Заражение происходит через укусы насекомых. Паразит располагается в лимфатической системе, что сопровождается отеком подкожной жировой клетчатки. Характерна гиперэозинофилия. Продукты распада паразитов могут привести к тяжелой общей реакции: лихорадка, слабость, боли в мышцах и суставах. Иногда паразиты выходят под конъюнктиву глаза и становятся видимыми (рис. 19.6), при понижении внешней температуры они уходят в глубь орбиты. При этом возникают диплопия и симптомы, схожие с проявлениями абсцесса орбиты. Лечение хирургическое. Во время операции удается извлечь червя длиной до 10 см. Возможна медикаментозная терапия с использованием противогельминтных средств, однако гибель большого количества филярий может сопровождаться аллергическими реакциями.
Глава 20. Опухоли органа зрения
В 60–70–е годы XX в. в офтальмологии было выделено самостоятельное клиническое направление – офтальмоонкология, которая должна решать вопросы диагностики и лечения опухолей органа зрения. Опухоли этой локализации характеризуются большим полиморфизмом, своеобразием клинического и биологического течения. Диагностика их трудна, для ее проведения требуется комплекс инструментальных методов исследования, которыми владеют офтальмологи. Наряду с этим необходимы знания о применении диагностических мероприятий, используемых в общей онкологии. Значительные сложности возникают при лечении опухолей глаза, его придаточного аппарата и орбиты, так как в малых объемах глаза и орбиты сконцентрировано большое количество важных для зрения анатомических структур, что усложняет проведение лечебных мероприятий с сохранением зрительных функций.Мы пьем из чаши бытияС закрытыми очами,Златые омочив краяСвоими же слезами.М. Ю. Лермонтов
Ежегодная заболеваемость опухолями органа зрения по обращению больных составляет 100–120 на 1 млн населения. Заболеваемость среди детей достигает 10–12% от показателей, установленных для взрослого населения. С учетом локализации выделяют опухоли придаточного аппарата глаза (веки, конъюнктива), внутриглазные (сосудистая оболочка и сетчатка) и орбиты. Они различаются по гистогенезу, клиническому течению, профессиональному и жизненному прогнозу.
Среди первичных опухолей первое место по частоте занимают опухоли придаточного аппарата глаза, второе – внутриглазные и третье – опухоли орбиты.
Опухоли век
Опухоли кожи век составляют более 80% всех новообразований органа зрения. Возраст больных от I года до 80 лет и более. Преобладают опухоли эпителиального генеза (до 67%).Доброкачественные опухоли составляют основную группу опухолей век. Источником их роста могут быть элементы кожи (папиллома, сенильная бородавка, фолликулярный кератоз, кератоакантома, сенильный кератоз, кожный рог, эпителиома Боуэна, пигментная ксеродерма), волосяные фолликулы (эпителиома Малерба, трихоэпителиома). Реже встречаются опухоли, происходящие из других тканей.
Папиллома составляет 13–31% всех доброкачественных опухолей кожи век. Обычно папиллома возникает после 60 лет, ее излюбленная локализация – нижнее веко. Опухоль растет медленно, для нее характерны сосочковые разрастания шаровидной или цилиндрической формы (рис. 20.1). Цвет папилломы серовато–желтый с грязным налетом за счет роговых пластинок, покрывающих поверхность сосочков. Опухоль растет из элементов кожи, имеет развитую строму. Клеточные элементы хорошо дифференцированы, покрывающий эпителий утолщен. Лечение хирургическое. Озлокачествление наблюдается в 1% случаев.
Сенильная бородавка развивается после 50 лет. Локализуется в области виска, век, по ресничному краю или в интермаргинальном пространстве, чаще нижнего века. Имеет вид плоского или слегка выступающего образования с четкими и ровными границами (рис. 20.2). Цвет серый, желтый или коричневый, поверхность сухая и шероховатая, дифференцируются роговые пластинки Рост медленный. При лечении эффективно лазерное испарение или криодеструкция. Известны случаи озлокачествления, но без метастазирования.
Сенильный кератоз появляется после 60–65 лет. Растет на участках, подвергающихся инсоляции, особенно часто в области кожи век, в виде множественных плоских участков белого цвета, покрытых чешуйками. При микроскопическом исследовании обнаруживают истончение или атрофию эпидермиса. Наиболее эффективные методы лечения – криодеструкция и лазерное испарение. В случае отсутствия лечения примерно в 20% случаев наступает озлокачествление.
Кожный рог представляет собой пальцеобразный кожный вырост с элементами ороговения, поверхность его имеет серовато–грязный оттенок. Диагностируют у лиц пожилого возраста. При лечении используют электро– или лазерэксцизию.
Эпителиома Боуэна представлена плоским, округлой формы пятном темно–красного цвета. Толщина опухоли незначительная, края ровные, четкие. Она покрыта нежными чешуйками, при снятии которых обнажается мокнущая поверхность. Инфильтративный рост появляется при переходе в рак. Эффективные методы лечения – криодеструкция, лазерное испарение и короткодистанционная рентгенотерапия.
Пигментная ксеродерма – редко наблюдающееся заболевание с аутосомно–рецессивным типом наследования. Проявляется у маленьких детей (до 2 лет) в виде повышенной чувствительности к ультрафиолетовому облучению. В местах, подвергающихся даже кратковременной инсоляции, возникают очаги эритемы кожи, впоследствии замещающиеся участками пигментации. Кожа постепенно становится сухой, истонченной, шероховатой, на ее атрофированных участках развиваются телеангиэктазии. После 20 лет на измененных участках кожи, по краю век появляются множественные опухолевые очаги, чаще базально–клеточного рака. Лечение – исключить ультрафиолетовое облучение.
Капиллярная гемангиома в ⅓ случаев врожденная, чаще наблюдается у девочек. В первые 6 мес жизни опухоль растет быстро, затем наступает период стабилизации, а к 7 годам у большинства больных возможна полная регрессия гемангиомы. Опухоль имеет вид узлов ярко–красного цвета или синюшных. Чаще локализуется на верхнем веке, прорастает его, что приводит к появлению частичного, а иногда и полного птоза. В результате закрытия глазной щели развивается амблиопия, а вследствие давления утолщенного века на глаз возникает роговичный астигматизм. Отмечается тенденция к распространению опухоли за пределы кожи век. Микроскопически гемангиома представлена капиллярными щелями и стволиками, заполненными кровью. Лечение плоской поверхностной капиллярной гемангиомы осуществляют с помощью криодеструкции. При узловой форме эффективна погружная диатермокоагуляция игольчатым электродом, при распространенных формах используют лучевую терапию.
Невусы – пигментные опухоли – выявляют у новорожденных с частотой 1 случай на 40 детей, во второй – третьей декадах жизни их количество резко увеличивается, а к 50 годам значительно уменьшается. Источником роста невуса могут быть эпидермальные или дендритические меланоциты, невусные клетки (невоциты), дермальные или веретенообразные меланоциты. Первые два типа клеток расположены в эпидермисе, а последние – в субэпителиальном слое. Выделены следующие типы невусов.
Пограничный (юнкциональный) невус характерен для детского возраста, представлен маленьким плоским темным пятном, располагающимся преимущественно по интермаргинальному краю века. Лечение заключается в полной электроэксцизии опухоли.
Ювенильный (веретеноклеточный) невус появляется у детей и молодых лиц в виде розовато–оранжевого хорошо отграниченного узелка, на поверхности которого не бывает волосяного покрова. Опухоль увеличивается достаточно медленно. Лечение хирургическое.
Гигантский (системный меланоцитарный) невус выявляют у 1% новорожденных. Как правило, опухоль имеет большие размеры, интенсивно пигментирована, может располагаться на симметричных участках век, так как развивается в результате миграции меланоцитов на стадии эмбриональных век до их разделения, захватывает всю толщу век, распространяясь на интермаргинальное пространство, иногда на конъюнктиву век. Границы невуса неровные, окраска – светло–коричневая или интенсивно–черная (рис. 20.3). Опухоль может иметь волосяной покров и сосочковые разрастания на поверхности. Рост по всей толще века приводит к появлению птоза. Сосочковые разрастания по краю век и неправильный рост ресниц вызывают слезотечение, упорный конъюнктивит. Лечение эффективно при поэтапном лазерном испарении, начиная с младенческого возраста. Риск озлокачествления при больших невусах достигает 5%, фокусы малигнизации образуются в глубоких слоях дермы, в связи с чем ее ранняя диагностика практически невозможна.
Невус Ота, или окулодермальный меланоз, возникает из дермальных меланоцитов. Опухоль врожденная, практически всегда односторонняя, проявляется плоскими пятнами красноватого или пурпурного цвета, обычно располагающимися по ходу ветвей тройничного нерва. Невус Ога может сопровождаться меланозом конъюнктивы, склеры и хориоидеи. Описаны случаи озлокачествления при сочетании невуса Ота с увеальным меланозом.
Доброкачественные невусы могут прогрессировать с разной частотой и скоростью. В связи с этим крайне важно выделение признаков прогрессирования невуса: изменяется характер пигментации, вокруг невуса образуется ореол нежного пигмента, поверхность невуса становится неровной (папилломатозной), по периферии невуса появляются застойно–полнокровные сосуды, увеличиваются его размеры.
Злокачественные опухоли век представлены в основном раком кожи и аденокарциномой мейбомиевой железы. В развитии играют роль избыточное ультрафиолетовое облучение, особенно у лиц с чувствительной кожей, наличие незаживающих язвенных поражений или влияние папилломатозного вируса человека.
Базально–клеточный рак составляет 72–90% среди злокачественных эпителиальных опухолей. До 95% случаев его развития приходится на возраст 40–80 лет. Излюбленная локализация опухоли – нижнее веко и внутренняя спайка век. Выделяют узловую, разъедающе–язвенную и склеродермоподобную формы рака. Клинические признаки зависят от формы опухоли. При узловой форме границы опухоли достаточно четкие (рис. 20.4, а); она растет годами, по мере увеличения размеров в центре узла появляется кратерообразное западение, иногда прикрытое сухой или кровянистой корочкой, после снятия которой обнажается мокнущая безболезненная поверхность; края язвы каллезные. При разъедающе–язвенной форме вначале появляется маленькая, практически незаметная безболезненная язвочка с приподнятыми в виде вала краями. Постепенно площадь язвы увеличивается, она покрывается сухой или кровянистой коркой, легко кровоточит. После снятия корочки обнажается грубый дефект, по краям которого видны бугристые разрастания. Язва чаще локализуется вблизи маргинального края века, захватывая всю его толщу (рис. 20.4, б). Склеродермоподобная форма в начальной стадии представлена эритемой с мокнущей поверхностью, покрытой желтоватыми чешуйками. В процессе роста опухоли центральная часть мокнущей поверхности замещается достаточно плотным белесоватым рубцом, а прогрессирующий край распространяется на здоровые ткани.
Чешуйчато–клеточный рак составляет 15–18% всех злокачественных опухолей век. Заболевают преимущественно лица старшего возраста с чувствительной к инсоляции кожей. Предрасполагающими факторами являются пигментная ксеродерма, окулокутанный альбинизм, хронические кожные заболевания век, длительно не заживающие язвочки, избыточное ультрафиолетовое облучение. В начальной стадии опухоль представлена слабовыраженной эритемой кожи, чаще нижнего века. Постепенно в зоне эритемы появляется уплотнение с гиперкератозом на поверхности. Вокруг опухоли возникает перифокальный дерматит, развивается конъюнктивит (рис. 20.5). Опухоль растет в течение 1–2 лет. Постепенно в центре узла образуется углубление с изъязвленной поверхностью, площадь которой постепенно увеличивается. Края язвы плотные, бугристые. При локализации у края век опухоль быстро распространяется в орбиту.
Лечение рака век планируется после получения результатов гистологического исследования материала, полученного при биопсии опухоли. Хирургическое лечение возможно при диаметре опухоли не более 10 мм. Использование микрохирургической техники, лазерного или радиохирургического скальпеля повышает эффективность лечения. Может быть проведена контактная лучевая терапия (брахитерапия) или криодеструкция. При локализации опухоли вблизи интермаргинального пространства можно осуществить только наружное облучение или фотодинамическую терапию. В случае прорастания опухоли на конъюнктиву или в орбиту показана поднадкостничная экзентерация последней.
При своевременном лечении 95% больных живут более 5 лет.
Аденокарцинома мейбомиевой железы (железа хряща века) составляет менее 1% всех злокачественных опухолей век. Обычно опухоль диагностируют в пятой декаде жизни, чаще у женщин. Опухоль располагается под кожей, как правило, верхнего века в виде узла с желтоватым оттенком, напоминающего халазион, который рецидивирует после удаления или начинает агрессивно расти после медикаментозного лечения и физиотерапии. После удаления халазиона обязательно выполняют гистологическое исследование капсулы. Аденокарцинома может проявляться блефароконъюнктивитом и мейбомитом, растет быстро, распространяется на хрящ, пальпебральную конъюнктиву и ее своды, слезоотводящие пути и полость носа. С учетом агрессивного характера роста опухоли хирургическое лечение не показано. При опухолях небольших размеров, ограниченных тканями век, можно использовать наружное облучение. В случае появления метастазов в региональных лимфатических узлах (околоушных, подчелюстных) следует провести их облучение. Наличие признаков распространения опухоли на конъюнктиву и ее своды обусловливает необходимость экзентерации орбиты. Опухоль характеризуется чрезвычайной злокачественностью. В течение 2–10 лет после лучевой терапии или хирургического лечения рецидивы возникают у 90% больных. От дистантных метастазов в течение 5 лет умирают 50–67% больных.
Меланома составляет не более 1% всех злокачественных опухолей век. Пик заболеваемости приходится на возраст 40–70 лет. Чаще болеют женщины. Выделены факторы риска развития меланомы: невусы, особенно пограничный, меланоз, индивидуальная повышенная чувствительность к интенсивному солнечному облучению. Считают, что в развитии меланомы кожи солнечный ожог боле опасен, чем при базально–клеточном раке. Факторами риска являются также неблагоприятный семейный анамнез, возраст старше 20 лет и белый цвет кожи. Опухоль развивается из трансформированных внутрикожных меланоцитов.
Клиническая картина полисимптомна. Меланома может быть представлена плоским очагом поражения с неровными и нечеткими краями светло–коричневого цвета, по поверхности – гнездная более интенсивная пигментация. Узловая форма меланомы (чаще наблюдается при локализации на коже век) характеризуется заметной проминенцией над поверхностью кожи, рисунок кожи в этой зоне отсутствует, пигментация выражена в большей степени. Опухоль быстро увеличивается, поверхность ее легко изъязвляется, наблюдаются спонтанные кровотечения. Даже при самом легком прикосновении марлевой салфетки или ватного тампона к поверхности такой опухоли на них остается темный пигмент (рис. 20.6). Вокруг опухоли кожа гиперемирована в результате расширения перифокальных сосудов, виден венчик распыленного пигмента. Меланома рано распространяется на слизистую оболочку век, слезное мясцо, конъюнктиву и ее своды, в ткани орбиты. Опухоль метастазирует в региональные лимфатические узлы, кожу, печень и легкие.
Лечение следует планировать только после полного обследования пациента с целью выявления метастазов. При меланомах с максимальным диаметром менее 10 мм и отсутствии метастазов можно произвести ее хирургическое иссечение с использованием лазерного скальпеля, радиоскальпеля или электроножа с обязательной криофиксацией опухоли. Удаление очага поражения сквозное, отступя не менее 3 мм от видимых (под операционным микроскопом) границ. Криодеструкция при меланомах противопоказана. Узловые опухоли диаметром более 15 мм с венчиком расширенных сосудов не подлежат локальному иссечению, так как в этой фазе, как правило, уже наблюдаются метастазы. Лучевая терапия с использованием узкого медицинского протонного пучка является альтернативой экзентерации орбиты. Облучению следует подвергнуть и регионарные лимфатические узлы.
Прогноз для жизни очень тяжелый и зависит от глубины распространения опухоли. При узловой форме прогноз хуже, поскольку рано возникает инвазия опухолевыми клетками тканей по вертикали. Прогноз ухудшается при распространении меланомы на реберный край века, интермаргинальное пространство и конъюнктиву.
Опухоли конъюнктивы и роговицы
Опухоли конъюнктивы и роговицы рассматриваются совместно, так как эпителий роговицы топографически является продолжением эпителия конъюнктивы. Богатая соединительнотканная основа конъюнктивы предрасполагает к возникновению широкого спектра опухолей. В конъюнктиве ироговице преобладают доброкачественные опухоли (дермоиды, дермолипомы, пигментные опухоли), а в детском возрасте они составляют более 99% всех опухолей этой локализации.Доброкачественные опухоли. Дермоид относится к порокам развития (хористомам); составляет около 22% всех доброкачественных опухолей конъюнктивы у детей. Опухоль выявляют в первые месяцы жизни. Она нередко сочетается с пороками развития век, может быть двусторонней. При микроскопическом исследовании в образовании находят элементы потовых желез, жировых долек, волос. Дермоид – образование беловато–желтого цвета, чаще расположенное вблизи наружного или нижненаружного лимба. При такой локализации опухоль рано распространяется на роговицу и может прорастать до ее глубоких слоев. К новообразованию подходят расширенные сосуды. Поверхность дермоида на роговице гладкая, блестящая, белого цвета. Дермолипома (рис. 20.7) – дермоид с большим содержанием жировой ткани, чаще локализуется в области сводов конъюнктивы. Лечение хирургическое.
Папиллома конъюнктивы чаше развивается в первые две декады жизни, может быть представлена двумя типами. Опухоль первого типа наблюдается у детей; она проявляется множественными узелками, чаще локализующимися на нижнем своде конъюнктивы. Отдельные узелки можно наблюдать в конъюнктиве глазного яблока или на полулунной складке. Узелки полупрозрачные с гладкой поверхностью, состоят из отдельных долек, пронизанных собственными сосудами, что придает им красновато–розовый цвет. Мягкая консистенция и тонкое основание в виде ножки делает узелки подвижными и легкоранимыми: их поверхность кровоточит даже при легком прикосновении стеклянной палочкой. У старших пациентов ороговевающая папиллома (второй тип), как правило, локализуется вблизи лимба в виде одиночного неподвижного образования серовато–белого цвета. Поверхность его шероховатая, дольки плохо различимы. При такой локализации папиллома распространяется на роговицу, где имеет вид полупрозрачного образования с сероватым оттенком. Папиллома первого типа микроскопически представлена неороговевающими сосочковыми разрастаниями, в центре которых расположены сосудистые петли. Такие папилломы могут спонтанно регрессировать. Учитывая многофокусность поражения, их хирургическое лечение чаще неэффективно; показано лазерное испарение или аппликации 0,04% раствора митомицина С на зону поражения. Для ороговевающей папилломы (второй тип) характерна сосочковая гиперплазия эпителия с выраженными явлениями пара– и гиперкератоза. Подобная папиллома подлежит лазерэксцизии, так как описаны случаи ее озлокачествления. При полном удалении опухоли прогноз хороший.
Эпителиому Боуэна выявляют, как правило, в пятом десятилетии жизни и позднее, чаще у мужчин. Обычно процесс односторонний, монофокальный. К этиологическим факторам относят ультрафиолетовое облучение, длительный контакт с продуктами переработки нефти, присутствие папилломатозного вируса человека. Опухоль представляет собой плоскую или слегка выступающую над поверхностью конъюнктивы бляшку с четкими границами серого цвета, при выраженной васкуляризации может иметь красноватый оттенок. Эпителиома Боуэна возникает в эпителии, может проникать в глубокие слои конъюнктивы, но базальная мембрана всегда остается интактной. Распространяясь на роговицу, опухоль не прорастает боуменову мембрану (передняя пограничная пластинка). Лечение хирургическое или комбинированное, включающее обработку опухоли 0,04% раствором митомицина С за 2–3 дня до операции, иссечение опухоли и обработку операционной раны раствором митомицина С на операционном столе и в последующие 2–3 дня. Эффективна короткодистанционная рентгенотерапия.
Сосудистые опухоли конъюнктивы представлены капиллярной гемангиомой и лимфангиомой; относятся к группе гамартом, наблюдаются с рождения или проявляются в первые месяцы жизни. Капиллярная гемангиома чаще локализуется во внутреннем углу глазной щели, состоит из резко извитых синюшных сосудов небольшого калибра, которые инфильтрируют полулунную складку и конъюнктиву глазного яблока. Распространяясь на своды, сосуды могут проникать в орбиту. Возможны спонтанные кровоизлияния. Лечение заключается в дозированной погружной электрокоагуляции. На ранней стадии эффективна лазеркоагуляция.
Лимфангиома встречается значительно реже гемангиом, представлена расширенными тонкостенными сосудистыми каналами неправильной формы, внутренняя поверхность которых выстлана эндотелием. Эти каналы содержат серозную жидкость с примесью эритроцитов. Опухоль локализуется в конъюнктиве глазного яблока или ее сводах. В процесс вовлекаются полулунная складка и слезное мясцо. Опухоль выглядит, как полупрозрачное желтоватое утолщение конъюнктивы, состоит из мелких долек, заполненных прозрачной жидкостью, иногда с примесью крови. На поверхности лимфангиомы нередко видны мелкие кровоизлияния. В дольках и между ними располагаются сосуды, заполненные кровью. Опухоль инфильтрирует мягкие ткани орбиты. Маленькие, нераспространенные лимфангиомы могут быть излечены с помощью CO2–лазера. При более распространенных опухолях можно рекомендовать брахитерапию с использованием стронциевого аппликатора с выведением роговицы из зоны облучения.
Невус – пигментная опухоль конъюнктивы – составляет 21–23% ее доброкачественных новообразований. Впервые выявляется в детском возрасте, реже – во второй–третьей декадах жизни. По клиническому течению невусы делят на стационарные и прогрессирующие, голубой невус и первичный приобретенный меланоз.
Стационарный невус выявляют у маленьких детей. Излюбленная локализация – конъюнктива глазного яблока в области глазной щели, никогда не возникает в слизистой оболочке век. Окраска невуса от светло–желтой или розовой до светло–коричневой с хорошо развитой сосудистой сетью. Обычно опухоль располагается вблизи лимба. До ⅓ стационарных невусов беспигментные. В пубертатном возрасте цвет невуса может измениться. Поверхность опухоли гладкая или слегка шероховатая вследствие формирования в ней маленьких светлых кист, границы четкие. При локализации в конъюнктиве глазного яблока невусы легко смещаются над склерой, у лимба – неподвижны. Невусы, локализующиеся в области полулунной складки и слезного мясца, обнаруживают, как правило, у взрослых (рис. 20.8). Они часто более интенсивно пигментированы (окраска от светло– до интенсивно–коричневой). Нередки случаи очаговой пигментации, особенно невусов, располагающихся в области слезного мясца. Полулунная складка при невусе утолщена, а в области слезного мясца опухоль слегка проминирует. Границы ее четкие.
Для прогрессирующего невуса характерны увеличение размеров, изменение окраски. Поверхность невуса выглядит пестрой: наряду с беспигментными или слабо пигментированными участками появляются зоны интенсивной пигментации, границы опухоли становятся менее четкими вследствие распыления пигмента. Скопление пигмента можно наблюдать и вне видимых границ опухоли. Значительно расширяются собственные сосуды опухоли, увеличивается их количество. Наличие триады признаков – усиления пигментации, васкуляризации невуса и нечеткости границ – позволяет дифференцировать истинную профессию опухоли от ее увеличения вследствие реактивной гиперплазии эпителия. Ограничение смещаемости невуса по отношению к склере – поздний симптом, свидетельствующий о развитии меланомы. Пограничный невус чаще диагностируют у детей, смешанные, особенно локализующиеся в области слезного мясца, – у взрослых. Лечение – иссечение невуса – показано при появлении признаков его роста. По последним сведениям, частота озлокачествления конъюнктивальных невусов достигает 2,7%.
Голубой (клеточный) невус – врожденное образование, встречающееся крайне редко. Его рассматривают как один из симптомов системного поражения кожи окулодермальной области. При голубом невусе конъюнктива глазного яблока в отличие от кожи окрашена в коричневый цвет. Образование плоское, достигает больших размеров, не имеет четкой формы, но границы его хорошо очерчены. Голубой невус может сочетаться с меланозом. Лечение не требуется, так как злокачественных вариантов голубого невуса в конъюнктиве не описано.
Первичный приобретенный меланоз (ППМ) конъюнктивы, как правило, односторонний. Опухоль возникает в среднем возрасте; может локализоваться на любом участке конъюнктивы, в том числе в сводах и пальпебральной части. В процессе роста ППМ характерно появление новых зон пигментации. Очаги ППМ плоские, с достаточно четкими границами, имеют интенсивнотемную окраску. Достигая зоны лимба, опухоль легко распространяется на роговицу. Лечение заключается в широкой лазер коагуляции или электроэксцизии опухоли с предварительными аппликациями 0,04% раствора митомицина С. При небольшом распространении ППМ неплохие результаты дает криодеструкция. В случаях поражения сводов и тарзальной конъюнктивы более эффективна брахитерапия. Прогноз неблагоприятный, так как в ⅔ случаев ППМ подвергается озлокачествлению (рис. 20.9).
Злокачественные опухоли. Чешуйчато –клетонный рак наблюдается редко. К провоцирующим факторам относят ультрафиолетовое облучение, папилломатозный вирус человека и ВИЧ–инфекцию. Чаще опухоль диагностируют у лиц старше 50 лет. Она может располагаться в любом отделе конъюнктивы. Первыми признаками заболевания являются локальная гиперемия и утолщение конъюнктивы. Опухоль может иметь вид папилломатозного беловато–розового узла и даже белесоватого птеригиума в сочетании с элементами воспаления. Границы ее нечеткие, на поверхности в опухолевых сосочках хорошо видны хаотично расположенные нежные собственные сосуды. Опухоль характеризуется достаточно медленным ростом. Агрессивность ее обусловлена инвазией в глубжележащие ткани, разрушением роговицы, склеры и прорастанием опухолевых масс в полость глаза. Выбор метода лечения определяется локализацией и размерами опухоли. При небольших опухолях, расположенных на лимбе и роговице, выраженный эффект дает инстилляция
митомицина С по специальной схеме в течение 2 нед. Возможна комбинация локального иссечения опухоли с криодеструкцией. При локализации опухоли вне лимба и роговицы показана брахитерапия в сочетании с локальной лазеркоагуляцией или электроэксцизией либо широкая эксцизия с одновременными криоаппликациями по раневой поверхности.
Меланома конъюнктивы составляет около 2% всех злокачественных опухолей конъюнктивы; ее чаще диагностируют в пятой–шестой декадах жизни, чаще у мужчин. Опухоль развивается из первичного приобретенного меланоза (75%) и предсуществующих невусов (20%) или бывает первичной (5%). Меланома может локализоваться в любом отделе конъюнктивы, но чаще (до 70%) – на конъюнктиве глазного яблока. Опухоль может быть пигментированной или беспигментной, последняя длительное время протекает бессимптомно; растет быстро в виде узла или поверхностно; иногда образуются множественные очаги, которые могут сливаться (рис. 20.10). Поверхность меланомы гладкая, блестящая. При пигментированной форме на границе узла видны радиально расположенные пигментные "дорожки" или россыпь пигмента. Вокруг опухоли формируется сеть расширенных, застойнополнокровных сосудов. По мере роста меланомы ее поверхность изъязвляется, появляется кровоточивость опухоли. Характерно возникновение сателлитов в результате образования отсевов и контакта с основным опухолевым узлом. Беспигментные отсевы особенно опасны, так как из–за розового цвета врач нередко их не замечает. У половины больных меланома прорастает в роговицу.
Лечение опухоли следует начинать как можно раньше. При локализованной меланоме показано комбинированное органосохраняющее лечение, могут быть проведены локальная эксцизия и брахитерапия, локальная химиотерапия митомицином С и локальная блокэксцизия (удаление опухоли с окружающими ее здоровыми тканями). При распространенной опухоли, а также при меланоме слезного мясца и полулунной складки эффективно облучение узким медицинским протонным пучком.
Прогноз при конъюнктивальной меланоме плохой. При гематогенном метастазировании смертность достигает 22–30%. При адекватном лечении 5–летняя выживаемость составляет 95%. Исход лечения во многом зависит от локализации и размеров опухоли. При меланомах толщиной до 1,5 мм прогноз лучше. Если толщина опухоли достигает 2 мм и больше, увеличивается риск возникновения регионарных и дистантных метастазов. Прогноз ухудшается в случае распространения опухоли на слезное мясцо, своды и пальпебральную конъюнктиву. При эпибульбарной меланоме, особенно локализующейся в области лимба, прогноз более благоприятный.
Внутриглазные опухоли
Среди новообразований органа зрения внутриглазные опухоли по частоте занимают второе место, большинство из них злокачественные.Опухоли сосудистой оболочки глаза
Опухоли сосудистой оболочки составляют более ⅔ всех внутриглазных новообразований, развиваются в возрасте от 3 до 80 лет Они чаще представлены опухолями нейроэктодермального генеза, реже – мезодермального. В радужке и цилиарном теле локализуется около 23–25% всех опухолей, остальные 75–77% – в хориоидее.Опухоли радужки
До 84% опухолей радужки относятся к доброкачественным, более половины из них (54–62%) имеют миогенную природу.Доброкачественные опухоли. Лейомиома развивается из элементов зрачковых мышц, характеризуется крайне медленным ростом, может быть беспигментной и пигментной. Разнообразие окраски опухоли можно объяснить морфогенезом радужки. Дело в том, что зрачковые мышцы радужки формируются из наружного слоя пигментного эпителия иридоцилпарного зачатка. В эмбриогенезе клетки сфинктера радужки продуцируют меланин и миофибриллы, в постнатальном периоде способность вырабатывать меланин исчезает, дилататор же ее сохраняет. Этим можно объяснить появление беспигментных лейомиом, развивающихся из сфинктера, и пигментных лейомиом, формирующихся из элементов дилататора. Опухоль диагностируют преимущественно в третьем – четвертом десятилетиях жизни.
Беспигментная лейомиома растет локально в виде желтовато–розового полупрозрачного проминирующего узла (рис. 20.11, а). Опухоль локализуется по краю зрачка или, реже, в прикорневой зоне (в области цилиарных крипт). Границы опухоли четкие, консистенция рыхлая, студенистая. На поверхности ее видны полупрозрачные выросты, в центре которых находятся сосудистые петли. Лейомиома, расположенная у края зрачка, приводит к вывороту пигментной каймы и изменению его формы. При локализации опухоли в зоне цилиарных крипт одним из первых симптомов является повышение внутриглазного давления, поэтому таким больным нередко ставят диагноз односторонней первичной глаукомы.
Пигментная лейомиома имеет цвет от светло– до темно–коричневого. Форма опухоли может быть узловой, плоскостной или смешанной (рис. 20.11, б). Она чаще локализуется в цилиарном поясе радужки. Характерно изменение формы зрачка, его удлинение вследствие выворота пигментной каймы, направленной в сторону опухоли. Консистенция пигментной лейомиомы более плотная, чем беспигментной, поверхность бугристая, новообразованные сосуды не видны. Прорастание опухоли в угол передней камеры более чем на у3 ее окружности приводит к развитию вторичной внутриглазной гипертензии. Признаками прогрессирования опухоли принято считать изменения вокруг опухоли: сглаженность рельефа радужки и появление зоны распыления пигмента, пигментных дорожек, направляющихся в стороны от опухоли, сосудистого венчика в радужке; изменяется также форма зрачка. Прорастая в структуры угла передней камеры и цилиарное тело, опухоль выходит в заднюю камеру, вызывая смещение и помутнение хрусталика. Диагноз может быть установлен на основании результатов биомикро–, гонио–, диафаноскопии и иридоангиографии (рис. 20.12, а). Лечение хирургическое: опухоль удаляют вместе с окружающими здоровыми тканями (блокэксцизия). При удалении не более ⅓ окружности радужки целость ее может быть восстановлена путем наложения микрошвов (рис. 20.12, б). В результате восстановления целости радужки как диафрагмы значительно снижаются степень выраженности и частота хрустал и кового астигматизма, уменьшаются световые аберрации. Прогноз для жизни благоприятный, для зрения зависит от исходной величины опухоли: чем меньше опухоль, тем больше вероятность сохранения нормального зрения.
Невус. Цвет радужки и рисунок крипт у каждого человека генетически запрограммированы. Окраска ее практически у всех неоднородна: по поверхности радужки могут быть разбросаны участки гиперпигментации в виде мелких пятнышек – "веснушек". Истинные невусы относят к меланоцитарным опухолям, производным нервного гребешка. Их выявляют как у детей, так и у взрослых. Клинически невус имеет вид более интенсивно пигментированного участка радужки. Цвет его варьирует от желтого до интенсивно–коричневого. Поверхность опухоли бархатистая, слегка неровная. Иногда невус слегка выступает над поверхностью радужки. Границы его четкие, рисунок радужки на поверхности невуса сглажен, в центральной части, где опухоль более плотная, рисунок отсутствует. Размеры невуса колеблются от участка пигментации размером 2–3 мм до крупных очагов, занимающих один квадрант поверхности радужки и более. При прогрессировании опухоль темнеет и увеличивается, вокруг нее появляются распыление не наблюдавшегося ранее пигмента и венчик расширенных сосудов, границы образования становятся менее четкими. Стационарные невусы должны находиться под наблюдением. При прогрессировании невуса показано его иссечение. Прогноз для жизни и зрения хороший.
Злокачественные опухоли. Меланома развивается в возрасте от 9 до 84 лет, чаще в пятом десятилетии жизни у женщин. У половины больных длительность заболевания до обращения к врачу составляет около 1 года, у остальных темное пятно на радужке замечают в детстве. Меланома радужки морфологически характеризуется выраженным структурным и клеточным атипизмом. В основном наблюдается веретеноклеточный тип опухоли, что определяет ее более доброкачественное течение.
По характеру роста выделяют узловую, диффузную (встречается крайне редко) и смешанную меланомы. Узловая меланома имеет вид нечетко отграниченного узла, проминирующего в переднюю камеру. Поверхность опухоли неровная, глубина передней камеры неравномерная. Цвет меланомы варьирует от светлодо темно–коричневого. Врастая в строму радужки, опухоль может имитировать кисту. При соприкосновении меланомы с задним эпителием роговицы возникает ее локальное помутнение. Прорастая дилататор радужки, опухоль приводит к изменению формы зрачка: его край на стороне опухоли уплощается, не реагирует на мидриатики. В углу передней камеры – застойные явления в сосудах радужки. Опухоль может заполнить заднюю камеру, вызвав компрессию хрусталика, его помутнение и дислокацию кзади. По поверхности радужки рассеиваются комплексы клеток опухоли, она приобретает пестрый вид (рис. 20.13). Вследствие прорастания опухоли в угол передней камеры нарушается отток внутриглазной жидкости, развивается стойкая, не поддающаяся медикаментозной терапии внутриглазная гипертензия.
Диагноз устанавливают на основании результатов биомикро–, гонио–, диафаноскопии и флюоресцентной иридоангиографии. Лечение хирургическое. Локализованная меланома радужки, занимающая не более ⅓ ее окружности, подлежит локальному удалению. Возможно проведение локальной фотодинамической терапии. При большем размере очага поражения следует рекомендовать энуклеацию глазного яблока. Прогноз для жизни, как правило, благоприятный с учетом преобладания веретеноклеточного типа опухоли. Метастазирование наблюдается в 5–15% случаев и в основном при больших опухолях. Прогноз для зрения после выполнения органосохранных операций, как правило, благоприятный.
Опухоли ресничного (цилиарного) тела
Доброкачественные опухоли наблюдаются редко, представлены аденомой, эпителиомой, медуллоэпителиомой.Злокачественные опухоли встречаются чаще.
Меланома ресничного тела составляет менее 1% всех меланом сосудистой оболочки. Опухоль развивается в пятом – шестом десятилетиях жизни, однако в литературе имеются сведения о возникновении меланомы указанной локализации у детей. По морфологической характеристике эта опухоль ничем не отличается от меланом хориоидеи и радужки, но отмечается преобладание ее эпителиоидных и смешанных форм. Опухоль растет медленно, может достигать больших размеров. Через широкий зрачок хорошо виден четко отграниченный узел округлой формы, чаще темного цвета. В большинстве случаев опухоль имеет смешанную локализацию: в радужке или хориоидее и ресничном теле. В течение длительного периода времени заболевание протекает бессимптомно. При больших опухолях больные предъявляют жалобы на ухудшение зрения из–за деформации и дислокации хрусталика. Прорастание меланомы в угол передней камеры сопровождается образованием складок радужки, концентричных опухоли, ложного иридодиализа. При прорастании опухоли в дилататор изменяется форма зрачка. Зрачок не реагирует на свет, край его уплощается. При расширении мидриатиками зрачок приобретает неправильную форму. Врастание опухоли в радужку иногда симулирует картину хронического переднего увеита. Беспигментная меланома имеет розоватый оттенок, в ней хорошо визуализированы собственные сосуды. В секторе, где локализуется опухоль, видны застойные, извитые эписклеральные сосуды. На поздних стадиях развивается вторичная глаукома. Опухоль может прорастать склеру, формируя под конъюнктивой узел, чаще темного цвета.
В диагностике меланомы ресничного тела помогают биомикроскопия, микроциклоскопия при широком зрачке, гонио– и диафаноскопия. При лечении локализованных меланом ресничного тела можно ограничиться ее удалением (частичная ламелярная склероувеоэктомия). Возможно лучевое лечение. При больших опухолях (занимающих более ⅓ окружности ресничного тела) показана только энуклеация глазного яблока. Прорастание опухолью склеральной капсулы с формированием подконъюнктивальных узлов обусловливает необходимость энуклеации при инструментально доказанном отсутствии региональных или гематогенных метастазов. Прогноз зависит от клеточного состава и размеров опухоли. Как правило, меланомы ресничного тела растут медленно. Однако при эпителиоидных и смешанных формах, которые наблюдаются чаще, чем в радужке, прогноз ухудшается. Пути метастазирования такие же, что и при хориоидальных меланомах.
Опухоли хориоидеи
Доброкачественные опухоли возникают редко, представлены гемангиомой, остеомой и фиброзной гистиоцитомой.Гемангиома – редкая врожденная опухоль, относится к гамартомам. Обнаруживают ее случайно либо при нарушении зрительных функций. Снижение зрения – один из ранних симптомов растущей гемангиомы у взрослых, в детском возрасте прежде всего обращает на себя внимание косоглазие. В хориоидее гемангиома почти всегда имеет вид изолированного узла с достаточно четкими границами, округлой или овальной формы, максимальный диаметр опухоли 3–15 мм. Проминенция опухоли варьирует от 1 до 6 мм. Обычно цвет опухоли бледно–серый или желтовато–розовый, может быть интенсивно–красным. Вторичная отслойка сетчатки, ее складчатость наблюдаются практически у всех больных, при больших опухолях она становится пузыревидной. Калибр ретинальных сосудов в отличие от такового при хориоидальной меланоме не изменяется, но на поверхности опухоли могут образовываться мелкие геморрагии. При слабовыраженном субретинальном экссудате кистовидная дистрофия сетчатки создает картину ,,aжypнocти,, опухоли.
Диагностика кавернозной гемангиомы затруднена. Расхождение клинических данных и результатов гистологического исследования отмечаются в 18,5% случаев. В последние годы диагноз стал более достоверным благодаря использованию флюоресцентной ангиографии. Лечение долгое время считали бесперспективным. В настоящее время используют лазеркоагуляцию или брахитерапию (контактное облучение с помощью радиоактивных офтальмоаппликаторов). Резорбция субретинальной жидкости способствует уменьшению отслойки сетчатки и повышению остроты зрения. Прогноз для жизни благоприятный, но зрение при нелеченой гемангиоме или отсутствии эффекта от лечения может быть потеряно безвозвратно в результате тотальной отслойки сетчатки. В ряде случаев тотальная отслойка заканчивается вторичной глаукомой.
Пигментные опухоли. Источником развития пигментных опухолей служат меланоциты (клетки, продуцирующие пигмент), которые распространены в строме радужки и цилиарного тела, а также в хориоидее. Степень пигментации меланоцитов различна. Увеальные меланоциты начинают продуцировать пигмент в поздней стадии эмбрионального развития.
Невус – наиболее часто встречающаяся доброкачественная внутриглазная опухоль, почти в 90% случаев локализуется в заднем отделе глазного дна. При офтальмоскопии невусы выявляют у 1–2% взрослого населения. Есть основание полагать, что частота невусов в действительности значительно выше, так как часть их не содержит пигмента. Большинство невусов врожденные, но пигментация их появляется значительно позже, и обнаруживают эти опухоли случайно после 30 лет. На глазном дне они имеют вид плоских или слегка проминирующих очагов (высотой до 1 мм) светло–серого или серо–зеленого цвета с перистыми, но четкими границами, диаметр их колеблется от 1 до 6 мм (рис. 20.14). Беспигментные невусы имеют овальную или округлую форму, границы их более ровные, но менее четкие в связи с отсутствием пигмента. У 80% пациентов обнаруживают единичные друзы стекловидной пластинки. По мере увеличения невуса увеличиваются дистрофические изменения в пигментном эпителии, что приводит к появлению большего количества друз стекловидной пластинки и субретинального экссудата, вокруг невуса возникает желтоватый ореол. Окраска невуса становится более интенсивной, границы – менее четкими. Описанная картина свидетельствует о прогрессировании невуса.
Больным со стационарными невусами не требуется лечение, но они нуждаются в диспансерном наблюдении, так как в процессе жизни опухоли могут расти, переходя в стадию прогрессирующего невуса и даже начальной меланомы. Прогрессирующие невусы с учетом потенциальной возможности их перерождения и перехода в меланому подлежат лечению. Наиболее эффективный метод разрушения прогрессирующего невуса – лазеркоагуляция. При стационарном невусе прогноз как для зрения, так и для жизни хороший. Прогрессирующий невус следует рассматривать как потенциально злокачественную опухоль. Существует мнение, что 1,6% невусов обязательно перерождаются в меланому. Как правило, озлокачествляются до 10% невусов, диаметр которых более 6,5 мм и высота более 3 мм.
Меланоцитома – крупноклеточный невус с доброкачественным течением, обычно локализуется на диске зрительного нерва, но может располагаться и в других отделах сосудистой оболочки. Опухоль бессимптомна, и у 90% больных ее выявляют случайно. При больших меланоцитомах могут отмечаться небольшие нарушения зрения и увеличение слепого пятна. Опухоль представлена одиночным узлом, она плоская или слегка проминирующая (1–2 мм), границы достаточно четкие. Размеры и локализация различны, но чаще меланоцитома расположена у диска зрительного нерва, прикрывая один его квадрант. Цвет опухоли у большинства больных интенсивно–черный, на поверхности могут быть светлые очажки – друзы стекловидной пластинки (рис. 20.15). Лечение не требуется, но пациенты должны находиться под систематическим наблюдением офтальмолога. При стационарном состоянии опухоли прогноз для зрения и жизни хороший.
Злокачественные опухоли представлены в основном меланомами.
Возможны три механизма развития хориоидальной меланомы: возникновение как первичной опухоли – de novo (чаще всего) на фоне предшествующего хориоидального невуса либо существующего окулодермального меланоза. Меланома начинает развиваться в наружных слоях хориоидеи и, согласно последним данным, представлена двумя основными клеточными типами: веретеноклеточным А и эпителиоидным. Веретеноклеточная меланома метастазирует почти в 15% случаев. Частота метастазирования эпителиоидной меланомы достигает 46,7%. Таким образом, клеточная характеристика увеальной меланомы является одним из определяющих факторов прогноза для жизни. Более половины меланом локализуется за экватором. Опухоль, как правило, растет в виде солитарного узла. Обычно больные предъявляют жалобы на ухудшение зрения, фото– и морфопсии.
В начальной стадии опухоль представлена небольшим очагом коричневого или темно–серого цвета диаметром 6–7,5 мм, на поверхности и вокруг которого видны друзы (келоидные тельца) стекловидной пластинки (рис. 20.16). Кистовидные полости в прилежащей сетчатке образуются в результате дистрофических изменений в пигментном эпителии и появления субретинальной жидкости. Поля оранжевого пигмента, обнаруживаемые на поверхности большинства меланом, обусловлены отложением зерен липофусцина на уровне пигментного эпителия сетчатки. По мере роста опухоли окраска ее может стать более интенсивной (иногда даже темно–коричневой) или же остается желтовато–розовой, беспигментной (рис. 20.17). Субретинальный экссудат появляется при сдавливании хориоидальных сосудов или в результате некробиотических изменений в быстро растущей опухоли. Увеличение толщины меланомы вызывает дистрофические изменения в мембране Бруха и пигментном эпителии сетчатки, в результате чего нарушается целость стекловидной пластинки и опухоль прорастает под сетчатку – формируется так называемая грибовидная форма меланомы (рис. 20.18). Такая опухоль имеет обычно достаточно широкое основание, узкий перешеек в мембране Бруха и шаровидную головку под сетчаткой. При разрыве мембраны Бруха могут возникать кровоизлияния, являющиеся причиной увеличения отслойки сетчатки или ее внезапного появления. При юкстапапиллярной локализации меланомы субретинальная экссудация в ряде случаев вызывает застойные явления в диске зрительного нерва, что при беспигментных опухолях иногда ошибочно расценивают как неврит или односторонний застойный диск зрительного нерва.
Чрезвычайно трудно распознать меланому хориоидеи при непрозрачных средах. В таких случаях уточнить диагноз помогают дополнительные методы исследования (ультразвуковое сканирование, компьютерная томография). До решения вопроса о характере лечения онколог должен провести тщательное обследование больного с увеальной меланомой с целью исключения метастазов. Следует помнить, что при первичном обращении к офтальмологу метастазы обнаруживают у 2–6,5% больных с крупными опухолями и у 0,8% с небольшими меланомами.
Более 400 лет единственным лечением меланомы хориоидеи была энуклеация глазного яблока. С 70–х годов XX столетия в клинической практике начали использовать органосохраняющие методы лечения, целью которых является сохранение глаза и зрительных функций при условии локального разрушения опухоли. К таким методам относятся лазеркоагуляция, гипертермия, криодеструкция, лучевая терапия (брахитерапия и облучение опухоли узким медицинским протонным пучком). При преэкваториально расположенных опухолях возможно их локальное удаление (склероувеоэктомия). Естественно, органосохраняющее лечение показано только при небольших опухолях.
Меланома метастазирует гематогенным путем, чаще всего в печень (до 85%), второе место по частоте возникновения метастазов занимают легкие. Применение химио– и иммунотерапии при метастазах увеальной меланомы пока ограничено в связи с отсутствием положительного эффекта. Прогноз для зрения после брахитерапии определяется размерами и локализацией опухоли. В целом хорошее зрение после брахитерапии удается сохранить почти у 36% больных при локализации опухоли вне макулярной зоны. Глаз как косметический орган сохраняется у 83% больных. После лечения больные должны находиться под наблюдением практически до конца жизни. После лучевой терапии и локального удаления опухоли врач должен осматривать больных каждые 3 мес в первые 2 года, затем 2 раза в год в течение 3–го и 4–го года, далее 1 раз в год.
Опухоли сетчатки
Опухоли сетчатки составляют ⅓ всех внутриглазных новообразований. Доброкачественные опухоли (гемангиома, астроцитарная гамартома) встречаются крайне редко. Основная группа представлена единственной злокачественной опухолью сетчатки у детей – ретинобластомой.Учение о ретинобластоме имеет более чем четырехвековую историю (первое описание ретинобластомы дал в 1597 г. Petraus Pawius из Амстердама). Долгие годы ее относили к редко встречающимся опухолям – не более 1 случая на 30.000 живых новорожденных. В последние годы отмечено увеличение заболеваемостью ретинобластомой более чем в 3 раза. По данным Европейской ассоциации офтальмологов, частота ее в популяции составляет 1 на 10.000–13.000 живых новорожденных.
Выделены две формы заболевания: наследственная и спорадическая. У 10% больных ретинобластома сопровождается хромосомной патологией (делеции участка хромосомы 13ql4.1), у остальных – структурными и функциональными нарушениями в гене RB1, который в последние годы был выделен и клонирован благодаря использованию молекулярных маркеров. Белковый продукт этого гена функционирует в нормальных тканях и других опухолях, и только при ретинобластоме он оказывается измененным. Таким образом, предрасположенность к возникновению ретинобластомы в настоящее время связывают с наличием герминальной мутации в одном из аллелей гена RBly который наследуется по аутосомно–доминантному типу и обнаруживается у 60–75% больных.
Опухоль развивается у детей раннего возраста (до 1 года). У ⅔ больных с наследственной формой ретинобластомы она оказывается билатеральной. Кроме того, при семейных формах ретинобластомы ген RB1 поврежден во всех соматических клетках, поэтому у таких больных высок (около 40%) риск появления опухолей других локализаций. В настоящее время исследование точковых мутаций в гене ретинобластомы путем хромосомного анализа позволяет не только подтвердить или исключить наследственную форму этой опухоли в семьях с отягощенной наследственностью по ретинобластоме, но и объяснить развитие этой формы у детей, имеющих здоровых родителей. Обнаружение ретинобластомы у ребенка в возрасте до 10 мес свидетельствует об ее врожденном характере, ретинобластому, симптомы которой появились после 30 мес, можно расценивать как спорадическую. Спорадическая форма составляет около 60% всех ретинобластом, всегда односторонняя, возникает через 12–30 мес после рождения в результате мутаций de novo в обоих аллелях гена RB1, находящихся в клетках сетчатки.
Ретинобластома развивается в любом отделе оптически деятельной части сетчатки, в начале своего роста выглядит как нарушение четкости рефлекса на глазном дне. Позднее появляется сероватый, мутный плоский очаг с нечеткими контурами. В дальнейшем клиническая картина изменяется в зависимости от особенностей роста ретинобластомы. Выделяют эндофитный, экзофитный и смешанный характер роста опухоли.
Эндофитно растущая ретинобластома возникает во внутренних слоях сетчатки и характеризуется ростом в стекловидное тело. Поверхность опухоли бугристая. Толщина узла постепенно увеличивается, цвет сохраняется беловато–желтым, сосуды сетчатки и собственные сосуды опухоли не видны (рис. 20.19). В стекловидном теле над опухолью появляются конгломераты опухолевых клеток в виде стеариновых капель, стеариновых дорожек. Быстрый рост опухоли, сопровождающийся нарушением в ней обменных процессов, приводит к появлению зон некроза с творожистым распадом, впоследствии обызвествляющихся с формированием кальцификатов. При локализации опухоли в преэкваториальной зоне ее клетки, оседая в задней и передней камерах глаза, создают картину псевдогипопиона, цвет которого в отличие от окраски истинного гипогтиона беловато–серый. Рано происходит выворот зрачковой пигментной каймы. На поверхности радужки – узелки опухоли, массивные синехии, новообразованные сосуды. Передняя камера становится мельче, влага ее мутнеет. Увеличиваясь в размерах, опухоль заполняет всю полость глаза, разрушает и прорастает трабекулярный аппарат, в результате чего повышается внутриглазное давление. У детей раннего возраста развивается буфтальм, происходит истончение склеролимбальной зоны, что облегчает распространение опухоли за пределы глаза. При прорастании опухолью склеры позади экватора возникает картина целлюлита, частота развития которого колеблется от 0,2 до 4,6%.
Экзофитио растущая ретинобластома возникает в наружных слоях сетчатки и распространяется под сетчатку, что приводит к ее массивной отслойке, купол которой виден за прозрачным хрусталиком. При офтальмоскопии опухоль выявляют в виде одного или нескольких отграниченных узлов с ровной поверхностью. К опухоли подходят дренирующие расширенные и извитые сосуды сетчатки. На поверхности опухоли видны нежные извитые, хаотично расположенные новообразованные сосуды.
Для ретинобластомы характерен мультифокальный рост. Узлы опухоли локализуются на разных участках глазного дна, имеют округлую или овальную форму, толщина их различная. Иногда геморрагии на поверхности опухоли сливаются и полностью перекрывают опухоль. В подобных случаях при периферическом расположении ретинобластомы первым симптомом может оказаться "спонтанно" возникший гемофтальм.
Смешанная ретинобластома характеризуется комбинацией офтальмологических симптомов, свойственных двум описанным формам. Хорошо известные признаки ретинобластомы – "свечение” зрачка и косоглазие, гетерохромия или рубеоз радужки, микрофтальм, буфтальм, гифема, гемофтальм – следует расценивать как косвенные, которые могут наблюдаться и при других заболеваниях. У 9,4% больных ретинобластома протекает без косвенных признаков и ее обнаруживают, как правило, при профилактических осмотрах.
Ретинобластома у детей старшего возраста характеризуется снижением остроты зрения. В клинической картине преобладают признаки вялотекущего увеита, вторичной боляшей глаукомы, отслойки сетчатки, редко развивается ангиоматоз сетчатки. Возникновение ретинобластомы в этом возрасте, когда вероятность ее развития мала, усложняет диагностику.
Трилатеральную ретинобластому расценивают как билатеральную опухоль, сочетающуюся с эктопической (но не метастатической!) интракраниальной опухолью примитивного нейроэктодермального происхождения (пинеалобластомой). Третья опухоль, как правило, локализуется в области шишковидной железы, но может занимать и срединные структуры мозга. Клинически опухоль проявляется спустя 2–3 года после обнаружения билатеральной ретинобластомы признаками интракраниального новообразования. Трилатеральную ретинсйбластому выявляют у детей первых 4 лет жизни. У маленьких детей признаки внутричерепного поражения могут наблюдаться до появления видимых признаков поражения глаз.
Ретиноцитому расценивают как редкий вариант ретинобластомы с более доброкачественным течением в связи с неполной мутацией гена ретинобластомы. Прогноз при ретиноцитоме более благоприятный в связи с наличием четких признаков дифференциации в виде формирования истинных розеток и склонности к самопроизвольной регрессии.
Для диагностики ретинобластомы используют офтальмоскопию, которую следует проводить при максимальном расширении зрачка, а у маленьких детей – во время медикаментозного сна. При осмотре глазного дна на крайней периферии необходимо применить склерокомпрессию, что позволяет более детально осмотреть эти труднодоступные для визуального контроля участки. Проводить офтальмоскопию следует по всем меридианам (!). В затруднительных случаях при преэкваториальном расположении опухоли или наличии псевдогипопиона показана тонкоигольная аспирационная биопсия. Ультразвуковое сканирование позволяет определить размеры ретинобластомы, подтвердить или исключить наличие кальцификатов.
Лечение ретинобластомы комплексное, направлено на сохранение жизни больного ребенка и его глаза, всегда индивидуальное, его планируют в зависимости от стадии процесса, общего состояния ребенка, риска возникновения вторых злокачественных опухолей и ультимативного требования родителей сохранить зрение. При небольших опухолях применение методов локального разрушения позволяет сохранить глаз в 83% случаев, а в комбинации с полихимиотерапией – добиться 5–летней выживаемости почти 90%. При больших опухолях проведение полихимиотерапии в комбинации с энуклеацией обеспечивает 4–летнюю выживаемость более чем 90%. Ретинобластома диссеминирует вдоль зрительного нерва по межоболочечному пространству, гематогенным путем распространяется в кости, головной мозг, лимфогенным путем – в регионарные лимфатические узлы.
Прогноз для жизни при ретинобластоме зависит от ряда факторов (расположение опухоли кпереди от зубчатой линии, наличие множественных узлов опухоли, суммарный диаметр которых более 15 мм, объем опухоли, достигающий половины объема полости глаза и более, распространение опухоли в стекловидное тело или орбиту, рост опухоли в хориоидею, зрительный нерв). Риск возникновения метастазов повышается до 78% при распространении опухоли в орбиту. Конечно, к факторам риска относится и наследственная отягощенность. Стандартизованные показатели смертности от ретинобластомы при ее наследственных формах в последние годы увеличились с 2,9 до 9, в то время как при спорадических случаях ретинобластомы отмечено их уменьшение с 1,9 до 1,0.
С целью выявления ранних рецидивов опухоли после энуклеации глазного яблока или возникновения опухоли впарном глазу обязателен контрольный осмотр ребенка. При монолатеральной ретинобластоме его следует проводить каждые 3 мес в течение 2 лет, при билатеральной – в течение 3 лет. У детей старше 12 мес после окончания лечения 1 раз в год целесообразно проводить компьютерную томографию головы, что позволит проконтролировать состояние мягких тканей орбит и исключить метастаз опухоли в головной мозг. Излеченные дети должны находиться под диспансерным наблюдением пожизненно.
Опухоли глазницы составляют 23–25% от всех новообразований органа зрения. В ней развиваются практически все опухоли, наблюдающиеся у человека. Частота первичных опухолей – 94,5%, вторичных и метастатических – 5,5%.
Доброкачественные опухоли. В этой группе доминируют сосудистые новообразования (25%), нейрогенные опухоли (невринома, нейрофиброма, опухоли зрительного нерва) составляют около 16%. Доброкачественные опухоли эпителиального происхождения развиваются в слезной железе (плеоморфная аденома), на них приходится не более 5%. Частота возникновения мягкотканных опухолей (тератома, фиброма, липома, мезенхимома и др.) в целом составляет 7%. Врожденные новообразования (дермоидные и эпидермоидные кисты) выявляют у 9,5% больных.
Для доброкачественных опухолей орбиты характерна общая клиническая картина: отек век, стационарный экзофтальм, затруднение репозиции и ограничения подвижности глаза, изменения на глазном дне, снижение зрения, боли в пораженной орбите и соответствующей половине головы. Небольшая опухоль, расположенная у вершины орбиты, длительное время может протекать бессимптомно.
Сосудистые опухоли чаще всего (до 70% случаев) представлены кавернозной гемангиомой. Опухоль выявляют в возрасте 12–65 лет, у женщин в 2,5 раза чаще; она имеет хорошо выраженную псевдокапсулу. Микроскопически кавернозная гемангиома состоит из крупных расширенных сосудистых каналов, выстланных уплощенными эндотелиальными клетками, отсутствует непосредственный переход сосудов опухоли в сосуды окружающих орбитальных тканей. Клинически опухоль характеризуется медленно нарастающим стационарным экзофтальмом (рис. 20.20, а). Близкое расположение ее у склеры приводит к формированию на глазном дне складчатости стекловидной пластинки (мембрана Бруха) и сухих дистрофических очажков в парамакулярной области (рис. 20.20, б). Репозиция глаза, несмотря на достаточную эластичность гемангиомы, как правило, затруднена. Более глубокая локализация кавернозной гемангиомы (у вершины орбиты) может сопровождаться болями в пораженной орбите и соответствующей половине головы. Обычно при такой локализации рано возникает картина застойного диска зрительного нерва или его первичная атрофия. Диагноз уточняют с помощью компьютерной томографии, при которой выявляют ячеистую округлую тень с ровными контурами, отграниченную от окружающих тканей тенью капсулы. Интенсивность тени опухоли увеличивается в случае ее контрастирования При ультразвуковом сканировании обнаруживают тень опухоли, ограниченную капсулой. Лечение хирургическое. С учетом появившихся возможностей четкой тонометрии опухоли с помощью компьютерной томографии и использования микрохирургической техники следует рекомендовать выполнять операцию сразу же после установления диагноза. Нет оснований ждать прогрессирования клинических симптомов, так как их появление может привести к невосполнимой утрате зрительных функций.
Нейрогенные опухоли являются производными единого зародышевого пласта нейроэктодермы, но различаются по морфологической картине. Опухоли зрительного нерва представлены менингиомой и глиомой.
Менингиома появляется в возрасте 20–60 лет, чаще у женщин. Опухоль развивается из арахноидальных ворсинок, расположенных между твердой и паутинной оболочками. Диаметр зрительного нерва, пораженного опухолью, увеличивается в 4–6 раз и может достигать 50 мм (рис. 20.21). Менингиома способна прорастать оболочки зрительного нерва и распространяться на мягкие ткани орбиты. Как правило, опухоль односторонняя, характеризуется экзофтальмом с ранним снижением зрения. При прорастании тканей орбиты возникает ограничение движений глаза. На глазном дне – резко выраженный застойный диск зрительного нерва, реже – его атрофия. Появление значительно расширенных вен синюшного цвета на застойном диске свидетельствует о распространении опухоли непосредственно до заднего полюса глаза.
 Рис. 20.21. Компьютерная томограмма глаза. Менингиома зрительного нерва. Видна тень неравномерно утолщенного зрительного нерва, опухоль не выходит за пределы орбиты.
Рис. 20.21. Компьютерная томограмма глаза. Менингиома зрительного нерва. Видна тень неравномерно утолщенного зрительного нерва, опухоль не выходит за пределы орбиты.
Диагностика менингиомы трудна, так как даже на компьютерных томограммах, особенно в начальной стадии заболевания, зрительный нерв не всегда настолько увеличен, чтобы предположить его опухолевое поражение. Лечение – операция или лучевая терапия. Прогноз для зрения неблагоприятный. При росте опухоли вдоль ствола зрительного нерва имеется угроза распространения ее в полость черепа и поражения хиазмы. Прогноз для жизни благопрйятный при расположении опухоли в пределах полости орбиты.
Глиома, как правило, развивается в первой декаде жизни. Однако в последние десятилетия в литературе описывается все большее количество случаев выявления опухоли у лиц старше 20 лет. Женщины болеют несколько чаще. Поражение только зрительного нерва наблюдается у 28–30% больных, у 72% глиома зрительного нерва сочетается с поражением хиазмы. Опухоль состоит из клеток трех типов: астроцитов, олигодендроцитов и макроглии. Характеризуется крайне медленным, но неуклонно прогрессирующим снижением остроты зрения. У детей до 5 лет первый признак, на который обращают внимание родители, – косоглазие, возможен нистагм. Экзофтальм стационарный, безболезненый, появляется позднее и очень медленно нарастает. Он может быть осевым или со смещением при эксцентричном росте опухоли. Репозиция глаза всегда затруднена. На глазном дне одинаково часто выявляют застойный диск или атрофию зрительного нерва. При росте опухоли вблизи склерального кольца отек диска зрительного нерва выражен особенно сильно, вены значительно расширены, извиты, с синюшным оттенком. Кровоизлияния вблизи диска возникают вследствие непроходимости центральной вены сетчатки. В отличие от менингиомы глиома никогда не прорастает твердую мозговую оболочку, но по стволу зрительного нерва может распространяться в полость черепа, достигая хиазмы и контралатерального зрительного нерва. Интракраниальное распространение сопровождается нарушением функций гипоталамуса, питуитарной железы, повышением внутричерепного давления.
Диагноз глиомы устанавливают на основании результатов компьютерной томографии, с помощью которой можно не только визуализировать увеличенный зрительный нерв в орбите, но и судить о распространении опухоли по каналу зрительного нерва в полость черепа (рис. 20.22). Ультразвуковое сканирование недостаточно информативно, так как представляет изображение только проксимальной и средней третей зрительного нерва. С учетом крайне медленного роста опухоли лечение строго индивидуально. При сохранении зрения и возможности наблюдения за больным альтернативой длительного наблюдения может быть лучевая терапия, после которой отмечается стабилизация опухолевого роста, а у 75% больных – даже улучшение зрения. Хирургическое лечение показано при поражении опухолью только орбитального отрезка зрительного нерва в случаях быстро прогрессирующего снижения зрения. Вопрос о сохранении глаза решают до операции. Если опухоль прорастает до склерального кольца, что хорошо видно на компьютерных томограммах, пораженный зрительный нерв подлежит удалению вместе с глазом, и об этом следует обязательно предупредить родителей ребенка. В случае распространения опухоли в канал зрительного нерва или полость черепа вопрос о возможности выполнения оперативного вмешательства решает нейрохирург. Прогноз для зрения всегда плохой, а для жизни зависит от распространения опухоли в полость черепа. При вовлечении в опухолевый процесс хиазмы смертность достигает 20–55%.
 Рис. 20.22. Компьютерная томограмма глаза. Глиома зрительного нерва. В просвете орбиты проецируется тень веретенообразно утолщенного зрительного нерва, канал зрительного нерва свободен от опухоли.
Рис. 20.22. Компьютерная томограмма глаза. Глиома зрительного нерва. В просвете орбиты проецируется тень веретенообразно утолщенного зрительного нерва, канал зрительного нерва свободен от опухоли.
Невринома (синонимы: леммома, шваннома, нейролеммома) составляет Уз от всех доброкачественных опухолей орбиты. Возраст больных к моменту операции от 15 до 70 лет. Женщины болеют несколько чаще. В орбите источником этой опухоли в большинстве случаев являются цилиарные нервы, надблоковый или надорбитальный, она может формироваться также из леммоцитов симпатических нервов, иннервирующих сосуды менингеальной оболочки зрительного нерва и ретинальной артерии. Одним из первых признаков опухоли могут быть локализованные боли в пораженной орбите, невоспалительный отек век (чаще верхнего), частичный птоз, диплопия. У 25% больных прежде всего обращает на себя внимание экзофтальм, осевой или со смещением. Опухоль чаще располагается под верхней орбитальной стенкой в наружном хирургическом пространстве. Зона кожной анестезии позволяет предположить "заинтересованность" надблокового или надорбитального нерва. У 1/А больных отмечается анестезия роговицы. Большая опухоль ограничивает подвижность глаза в сторону ее локализации. Изменения на глазном дне обнаруживают у 65–70% больных, чаще констатируют отек диска зрительного нерва. При ультразвуковом сканировании удается визуализировать тень опухоли, отграниченную капсулой. На компьютерной томограмме видны не только тень опухоли, но и ее взаимоотношения со зрительным нервом. Окончательный диагноз устанавливают после гистологического исследования. Лечение только хирургическое. Не полностью удаленная опухоль склонна к рецидивированию. Прогноз для зрения и жизни благоприятный.
Врожденные новообразования. К новообразованиям этой группы относятся дермоидные и эпидермоидные (холестеатома) кисты, которые составляют около 9% среди всех опухолей орбиты. Рост их ускоряется перенесенной травмой, описаны случаи озлокачествления.
Дермоидная киста более чем у половины больных появляется в возрасте до 5 лет, однако почти 40% больных обращаются за помощью только после 18 лет. Она растет крайне медленно, но в пубертатном периоде и во время беременности наблюдаются случаи ее быстрого увеличения. Киста развивается из блуждающих эпителиальных клеток, концентрирующихся вблизи костных швов, располагается под надкостницей. Эпителий внутренней стенки кисты секретирует слизистое содержимое с примесью кристаллов холестерина, что придает ему желтоватый оттенок. В кисте могут находиться короткие волосы. Излюбленная локализация – области костных швов, чаще верхневнутренний квадрант орбиты. До 85% дермоидных кист располагается вблизи костного края орбиты и не вызывает экзофтальм, но при расположении в верхненаружном отделе может смещать глаз книзу и кнутри. Жалобы больных, как правило, сводятся к появлению безболезненного отека верхнего века соответственно расположению кисты. Кожа века в этой зоне слегка растянута, но окраска ее не изменена, пальпируется эластичное, безболезненное, неподвижное образование.
До 4% кист локализуется глубоко в орбите. Это так называемая котомковидная дермоидная киста орбиты, описанная Kronlein в конце XIX в. Образование состоит из трех частей: головка кисты – ампулообразное расширение – находится за пределами тарзоорбитальной фасции в глубине орбиты, хвост кисты – в височной ямке, а перешеек – в области лобно–скулового шва. Для такой локализации характерно длительное (иногда в течение 20–30 лет) постепенное увеличение экзофтальма. Опухоль, смещая глаз в сторону, ограничивает функции экстраокулярных мышц, появляется диплопия. Увеличение экзофтальма до 7–14 мм сопровождается постоянными распирающими болями в орбите. Нарушение зрения может быть обусловлено изменением рефракции вследствие как деформации глаза, так и развивающейся первичной атрофии зрительного нерва. Котомковидную кисту обычно диагностируют после 15 лет. Длительно существующая киста может распространяться в полость черепа. Диагноз подтверждают с помощью рентгенографии орбиты (выявляют истончение и углубление костного края орбиты в зоне расположения кисты). Наиболее информативна компьютерная томография, при которой хорошо визуализируются не только измененные костные стенки, но и сама киста с капсулой.
Лечение хирургическое: показана поднадкостничная орбитотомия. Прогноз для жизни и зрения благоприятный. Рецидива следует ожидать при выраженных изменениях в подлежащих костях или появлении послеоперационного свища. Рецидивные дермоидные кисты могут озлокачествляться.
Холестеатома, или эпидермоидная киста, развивается в четвертом десятилетии жизни, у мужчин почти в 3 раза чаше. Этиология и патогенез неясны. Для холестеатомы характерно локальное разволокнение костной ткани, которая становится мягкой; прогрессируют участки остеолизиса, поднадкостнично скапливается значительное количество желтоватого мягкого содержимого, включающего дегенеративно измененные клетки эпидермоидной ткани, кровь, кристаллы холестерина. В результате отслоения надкостницы с подлежащими некротическими массами уменьшается объем орбиты, ее содержимое смещается кпереди и книзу. Образование развивается, как правило, под верхней или верхненаружной стенкой орбиты. Заболевание начинается с одностороннего смещения глаза книзу или книзу кнутри. Постепенно развивается безболезненный экзофтальм. Репозиция затруднена. Изменения на глазном дне отсутствуют, функции экстраокулярных мышц сохраняются в полном объеме. Диагноз устанавливают на основании результатов рентгенографии и компьютерной томографии. Лечение только хирургическое. Прогноз для жизни и зрения, как правило, благоприятный, однако описаны случаи озлокачествления кисты.
Плеоморфная аденома (смешанная опухоль) – доброкачественный вариант первичной опухоли слезной железы. Возраст больных от 1 до 70 лет. Женщины заболевают почти в 2 раза чаще. Опухоль состоит из двух тканевых компонентов: эпителиального и мезенхимального. Эпителиальный компонент образует участки слизе– и хондроподобных структур. Строма (мезенхимальный компонент) неоднородна в пределах одного узла: иногда она рыхлая, на некоторых участках присутствуют соединительнотканные тяжи, отмечаются участки гиалиноза. Опухоль развивается медленно. Более 60% больных обращаются к врачу через 2–32 года с момента появления клинических симптомов. Один из первых – безболезненный, невоспалительный отек век. Постепенно глазное яблоко смещается книзу и кнутри. Экзофтальм возникает значительно позднее и очень медленно увеличивается. В этот период уже удается пальпировать неподвижное образование, расположенное под верхненаружным или верхним краем орбиты. Поверхность опухоли гладкая, при пальпации она безболезненная, плотная. Репозиция затруднена.
При рентгенографии выявляют увеличение полости орбиты вследствие истончения и смещения кверху и кнаружи ее стенки в области слезной ямки. Ультразвуковое сканирование позволяет определить тень плотной опухоли, окруженной капсулой, и деформацию глаза. При компьютерной томографии опухоль визуализируется более четко, можно проследить целость капсулы, распространенность опухоли в орбите, состояние ее прилежащих костных стенок. Лечение только хирургическое. Прогноз для жизни и зрения в большинстве случаев благоприятный, но пациента следует предупредить о возможности рецидива, который может возникнуть через 3–45 лет. Приблизительно у 57% больных при первом же рецидиве обнаруживают элементы озлокачествления. Опасность злокачественного перерождения плеоморфной аденомы возрастает по мере увеличения периода ремиссии.
Злокачественные опухоли. Первичные злокачественные опухоли орбиты составляют не более 0,1% всех злокачественных опухолей человека, в то же время в группе всех первичных опухолей – 20–28%. Они практически с одинаковой частотой развиваются во всех возрастных группах. Мужчины и женщины заболевают одинаково часто. Злокачественные опухоли орбиты, как и доброкачественные, полиморфны по гистогенезу, степень их злокачественности вариабельна. Более часто встречаются саркомы и рак. Общие клинические симптомы злокачественных опухолей орбиты – рано возникающая диплопия и отек век, первоначально транзиторный, появляющийся по утрам, а затем переходящий в стационарный. Для этих опухолей характерен постоянный болевой синдром, экзофтальм возникает рано и нарастает достаточно быстро (в течение нескольких недель или месяцев). Вследствие сдавления сосудисто–нервного пучка растущей опухолью, деформации глаза и большого экзофтальма нарушается защитная функция век: у этих больных быстро нарастают дистрофические изменения в роговице, заканчивающиеся ее полным расплавлением.
Рак в орбите в подавляющем большинстве случаев развивается в слезной железе, реже он представлен гетеротопическим раком или эмбриональной инфантильной карциномой.
Рак слезной железы в 2 раза чаще развивается у женщин в любом возрасте, характеризуется инвазивным ростом уже на самых ранних этапах развития. Опухоль отличается значительной клеточной вариабельностью, растет быстро. Анамнез заболевания обычно не превышает 2 лет, чаще больные отмечают ускоренное нарастание всех симптомов в течение нескольких (до 6) месяцев. Нередко первыми симптомами развивающегося рака являются боли, дискомфорт, слезотечение в пораженной орбите. Рано появляется неравномерное опущение верхнего века (первоначально птоз развивается в его наружной трети). Верхняя переходная складка становится мельче. Развивается экзофтальм со смещением глазного яблока книзу и кнутри, иногда только книзу. В результате механической деформации глаза опухолью развивается миопический астигматизм. Пальпируемая опухоль бугристая, практически не смещается по отношению к подлежащим тканям. Движения глаза в сторону расположения опухоли ограничены, репозиция резко затруднена.
Диагноз устанавливают только после гистологического исследования. Предположительный диагноз может быть установлен на основании анализа клинических симптомов и результатов инструментального исследования. При рентгенографии на фоне увеличенной в размерах орбиты выявляются участки костной деструкции, чаще в верхненаружной, верхней и наружной стенках орбиты. Компьютерная томография позволяет определить протяженность тени опухоли, неравномерность ее краев, распространение в прилежащие экстраокулярные мышцы и неравномерность контуров костной стенки орбиты или ее полное разрушение, а ультразвуковое исследование – лишь наличие тени опухоли и ее плотность. Радиосцинтиграмма орбиты при аденокарциноме характеризуется увеличением коэффициента асимметрии, свойственного злокачественным опухолям. Информативна дистанционная термография, особенно с сахарной нагрузкой. Уточнить диагноз помогает дооперационная тонкоигольная аспирационная биопсия.
Лечение рака слезной железы – задача сложная. Наряду с радикальной точкой зрения, сторонники которой требуют обязательной экзентерации орбиты, существует мнение о возможности проведения органосохранного лечения, сочетающего в себе локальное иссечение опухоли с блоком прилежащих здоровых тканей и послеоперационное наружное облучение орбиты. Выбор того или иного метода лечения зависит от размеров опухоли и ее распространенности. При дооперационном выявлении нарушения целости костей орбиты хирургическое лечение, в том числе экзентерация, противопоказано. Прогноз для жизни и зрения плохой, так как опухоль не только склонна к рецидивированию с прорастанием в полость черепа, но и к метастазированию в легкие, позвоночник или региональные лимфатические узлы. Сроки возникновения метастазов варьируют от 1–2 до 20 лет.
Первичный рак орбиты встречается редко. Мужчины болеют чаще. Первичный рак орбиты принято рассматривать как результат опухолевой трансформации дистоп ирован ных эпителиальных клеток в мягкие ткани орбиты. Опухоль растет медленно, без капсулы. Клиническая картина зависит от ее первоначальной локализации. При локализации опухоли в переднем отделе орбиты первым симптомом является смещение глаза в сторону, противоположную локализации опухоли, резко ограничивается его подвижность, медленно нарастает экзофтальм, который никогда не достигает больших степеней, но репозиция глаза оказывается невозможной. Плотная инфильтративно растущая опухоль сдавливает венозные пути орбиты, в результате чего возникает застой в эписклеральных венах, повышается офтальмотонус. Глаз как бы замуровывается опухолью в орбите, костные края ее "сглаживаются" окружающей опухолью и становятся не доступными для пальпации. Зрительные функции сохраняются в течение длительного периода времени, несмотря на вторичную внутриглазную гипертензию.
Первоначальный рост опухоли у вершины орбиты проявляется рано возникающими болями в ней с иррадиацией в соответствующую половину головы и диплопией. По мере роста опухоли возникает полная офтальмоплегия. Характерна первичная атрофия диска зрительного нерва с быстрым снижением зрительных функций. Экзофтальм замечают поздно, обычно он не достигает высоких степеней.
Особенности клинической картины и результаты ультразвукового сканирования позволяют определить инфильтративное распространение патологического процесса, не раскрывая его характер. Компьютерная томография демонстрирует плотную инфильтративно растущую опухоль, ее взаимосвязь с окружающими мягкотканными и костными структурами орбиты. Результаты радионуклидной сцинтиграфии и термографии свидетельствуют о злокачественном характере роста опухоли. Тонкоигольная аспирационная биопсия с цитологическим исследованием полученного материала возможна при локализации опухоли в переднем отделе орбиты. В случае расположения ее у вершины орбиты проведение аспирации сопряжено с опасностью повреждения глаза.
Хирургическое лечение (поднадкостничная экзентерация орбиты) показано при передней локализации процесса. Лечение более глубоко расположенных опухолей затруднено, так как они рано прорастают в полость черепа. Лучевая терапия малоэффективна, поскольку первичный гетеротопический рак рефрактерен к облучению. Прогноз плохой. При переднем расположении опухоль метастазирует в регионарные лимфатические узлы. Случаи гематогенного метастазирования неизвестны, но при раннем прорастании опухоли в подлежащие кости и полость черепа процесс становится почти неуправляемым.
Саркомы – наиболее частая причина первичного злокачественного роста в орбите. Они составляют 11–26% всех злокачественных опухолей орбиты. Источником развития саркомы в орбите может быть практически любая ткань, но частота возникновения ее отдельных видов различна. Возраст больных от 3–4 нед до 75 лет.
 Рис. 20.23. Рабдомиосаркома правой орбиты.
а – невоспалительный отек век, красный хемоз, экзофтальм со смешением глаза книзу и кнутри; б – компьютерная томограмма: тень опухоли с нечеткими и неровными границами в области наружной прямой мышцы.
Рис. 20.23. Рабдомиосаркома правой орбиты.
а – невоспалительный отек век, красный хемоз, экзофтальм со смешением глаза книзу и кнутри; б – компьютерная томограмма: тень опухоли с нечеткими и неровными границами в области наружной прямой мышцы.
Рабдомиосаркома – чрезвычайно агрессивная опухоль орбиты, является наиболее частой причиной злокачественного роста в орбите у детей. Мальчики болеют почти в 2 раза чаще. Источником роста рабдомиосаркомы являются клетки скелетных мышц. Выделены три типа опухоли: эмбриональный, альвеолярный и плеоморфный, или дифференцированный. Последний тип встречается редко. У детей до 5 лет чаще развивается эмбриональный тип опухоли, после 5 лет – альвеолярный. Как правило, рабдомиосаркома состоит из элементов нескольких типов (смешанный вариант). Точный диагноз можно установить только на основании результатов электронной микроскопии.
В последние годы изучены иммуногистохимические признаки рабдомиосаркомы. Выявление миоглобин–антител к мышечным протеинам, десмин–мышечно–специфичного и виметин–мезенхимального интермедиарных филаментов облегчает диагностику и позволяет уточнить прогноз заболевания. Показано, что миоглобинсодержащая рабдомиосаркома более чувствительна к химиотерапии, чем десминсодержащая.
Излюбленная локализация опухоли – верхневнутренний квадрант орбиты, поэтому в процесс рано вовлекаются мышца, поднимающая верхнее веко, и верхняя прямая мышца. Птоз, ограничение движений глаза, смещение его книзу и книзу кнутри – это первые признаки, на которые обращают внимание как сами больные, так и окружающие лица. У детей экзофтальм или смещение глаза при локализации опухоли в переднем отделе орбиты развивается в течение нескольких недель (рис. 20.23, а). У взрослых опухоль растет медленнее, в течение нескольких месяцев. Быстрое увеличение экзофтальма сопровождается появлением застойных изменений в эписклеральных венах, глазная щель полностью не смыкается, отмечаются инфильтраты на роговице и ее изъязвление. На глазном дне – застойный диск зрительного нерва. Первично развиваясь вблизи верхневнутренней стенки орбиты, опухоль быстро разрушает прилежащую тонкую костную стенку, прорастает в полость носа, вызывая носовые кровотечения. Ультразвуковое сканирование, компьютерная томография, термография и тонкоигольная аспирационная биопсия – это оптимальный диагностический комплекс инструментальных методов исследования при рабдомиосаркоме (рис. 20.23, б). Лечение комбинированное. Протокол лечения предусматривает предварительное проведение полихимиотерапии в течение 2 нед, после чего проводят наружное облучение орбиты. После комбинированного лечения более 3 лет живут 71% больных.
Злокачественная лимфома (неходжкинская) по частоте в последние годы выходит на одно из первых мест среди первичных злокачественных опухолей орбиты. В орбите опухоль чаще развивается на фоне аутоиммунных заболеваний или иммунодефицитных состояний. Мужчины болеют в 2,5 раза чаще. Средний возраст заболевших 55 лет. В настоящее время злокачественную неходжкинскую лимфому рассматривают как новообразование иммунной системы. В процесс вовлекаются преимущественно лимфоидные элементы Т– и В–клеточной принадлежности, а также элементы нулевых популяций. При морфологическом исследовании в орбите чаще диагностируют В–клеточную лимфому низкой степени злокачественности, в которой содержатся достаточно зрелые опухолевые и плазматические клетки. Как правило, поражается одна орбита. Характерны внезапное появление безболезненного экзофтальма, чаще со смещением глаза в сторону, и отек периорбитальных тканей. Экзофтальм может сочетаться с птозом (рис. 20.24, а). Процесс местно неуклонно прогрессирует, развивается красный хемоз, становится невозможной репозиция глаза, возникают изменения на глазном дне, чаще застойный диск зрительного нерва (рис. 20.24, б). Резко снижается зрение. В этот период могут появиться боли в пораженной орбите.
Диагноз злокачественной лимфомы орбиты труден. Из инструментальных методов исследования более информативны ультразвуковое сканирование, компьютерная томография (рис. 20.24, в) и тонкоигольная аспирационная биопсия с цитологическим исследованием. Необходимо обследование у гематолога для исключения системного поражения. Наружное облучение орбиты – практически безальтернативный высокоэффективный метод лечения. Полихимиотерапию подключают при системном поражении. Эффект лечения проявляется в регрессии симптомов патологического процеса в орбите и восстановлении утраченного зрения. Прогноз при первичной злокачественной лимфоме для жизни и зрения благоприятный (83% больных переживают 5–летний период). Прогноз для жизни резко ухудшается при диссеминированных формах, но частота поражения орбиты при последних составляет чуть более 5%.
 Рис. 20.24. Злокачественная лимфома правой орбиты.
а – птоз верхнего века, глазная щель сужена, экзофтальм со смещением; б – глазное дно; в – компьютерная томограмма глаза: тень опухоли, заполняющая практически всю полость орбиты.
Рис. 20.24. Злокачественная лимфома правой орбиты.
а – птоз верхнего века, глазная щель сужена, экзофтальм со смещением; б – глазное дно; в – компьютерная томограмма глаза: тень опухоли, заполняющая практически всю полость орбиты.
Глава 21. Изменения органа зрения при общих заболеваниях
Все, что влияет на целое, влияет на часть, все, что влияет на часть, влияет на целое, а посему всякая болезнь организма отражается на органе зрения и каждая болезнь глаз отражается на организме.Зрительный анализатор связан со всем организмом посредством большого количества анатомических и физиологических механизмов, поэтому часто при общих заболеваниях в нем возникают функциональные или морфологические изменения. По существу вся патология органа зрения (за исключением травм и локальных инфекций) – это проявление общих или системных заболеваний. Так, например, изменения сосудов и ткани сетчатки в большинстве случаев обусловлены сердечно–сосудистыми заболеваниями, эндокринными нарушениями, заболеваниями крови, воспалительными и дегенеративными процессами в организме.П. Бер
Изменения сосудов сетчатки чаще всего возникают при гипертонической болезни. В настоящее время диагноз "артериальная гипертензия” устанавливают в том случае, если в анамнезе имеются указания на стабильное повышение систолического артериального (выше 140 мм рт. ст.) и/или диастолического (выше 90 мм рт. ст.) давления (норма 130/85). Даже при незначительном повышении артериального давления нелеченая артериальная гипертензия приводит к поражению органов–мишеней, которыми являются сердце, головной мозг, почки, сетчатка, периферические сосуды. При артериальной гипертензии нарушается микроциркуляция, отмечаются гипертрофия мышечного слоя сосудистой стенки, локальный спазм артерий, застой в венулах, снижение интенсивности кровотока в капиллярах.
Выявляемые при офтальмоскопическом исследовании изменения в некоторых случаях являются первыми симптомами гипертонической болезни и могут помочь в установлении диагноза. Изменения сосудов сетчатки в разные периоды основного заболевания отражают его динамику, помогают определить стадии развития болезни и составить прогноз.
Для оценки изменений глазного дна, обусловленных артериальной гипертензией, используют классификацию, предложенную М. Л. Красновым, согласно которой выделяют три стадии изменений сосудов сетчатки (см. главу 15).
Первая стадия – гипертоническая ангиопатия – характерна для I стадии гипертонической болезни – фазе функциональных сосудистых расстройств. В этой стадии происходят сужение артерий и расширение вен сетчатки, соотношение калибра этих сосудов становится 1:4 вместо 2:3, отмечаются неравномерность калибра и увеличение извилистости сосудов, может наблюдаться симптом артериовенозного перекреста I степени (симптом Салюса–Гунна). Иногда (примерно в 15% случаев) в центральных отделах сетчатки имеет место штопорообразная извилистость мелких венул (симптом Гвиста). Все эти изменения обратимы; при нормализации артериального давления они регрессируют.
Вторая стадия – гипертонический ангиосклероз сетчатки – стадия органических изменений Отмечается неравномерность калибра и просвета артерий, увеличивается их извитость.
В связи с гиалинозом стенок артерий центральная световая полоска (рефлекс по ходу сосуда) становится уже, приобретает желтоватый оттенок, что придает сосуду сходство со светлой медной проволокой. Позднее она еще больше суживается и сосуд приобретает вид серебряной проволоки. Некоторые сосуды полностью облитерируютея и видны в виде тонких белых линий. Вены несколько расширены и извиты. Для этой стадии артериальной гипертензии характерен симптом артериовенозного перекреста – симптом Салюса–Гунна) (рис. 21.1). Склерозированная упругая артерия, пересекающая вену, продавливает ее вниз, в результате чего вена слегка изгибается (Салюс–Гунн I). При артериовенозном перекресте II степени изгиб вены становится отчетливо видимым, дугообразным. Она кажется истонченной в середине (Салюс–Гунн II). Позднее венозная дуга на месте перекреста с артерией становится невидимой, вена как будто пропадает (Салюс–Гунн III). Изгибы вены могут провоцировать тромбоз и кровоизлияния. В области диска зрительного нерва могут наблюдаться новообразованные сосуды и микроаневризмы. У части больных диск может быть бледным, однотонным с восковым оттенком.
Стадия гипертонического ангиосклероза сетчатки соответствует фазе устойчивого повышения систолического и диастолического артериального давления при гипертонической болезни IIA и IIБ стадии.
Третья стадия – гипертоническая ангиоретинопатия и нейроретинопатия. На глазном дне, кроме изменений сосудов, появляются кровоизлияния в сетчатку, ее отек и белые очаги, похожие на комки ваты, а также мелкие белые очаги экссудации, иногда с желтоватым оттенком, появляются участки ишемии. В результате нарушения нейроретинальной гемодинамики изменяется состояние диска зрительного нерва, отмечаются его отеки и нечеткость границ. В редких случаях при тяжелой и злокачественной гипертонической болезни наблюдается картина застойного диска зрительного нерва, в связи с чем возникает необходимость дифференциальной диагностики с опухолью мозга.
Скопление мелких очагов вокруг желтого пятна образуют фигуру звезды (рис. 21.2). Это признак плохого прогноза не только для зрения, но и для жизни.
Состояние сосудов сетчатки зависит от уровня артериального давления, величины периферического сопротивления кровотоку и в определенной степени свидетельствует о состоянии сократительной способности сердца. При артериальной гипертензии диастолическое давление в центральной артерии сетчатки повышается до 98–135 мм рт. ст. (при норме 31–48 мм рт. ст.). У многих больных изменяется поле зрения, снижаются острота зрения и темновая адаптация, нарушается световая чувствительность.
У детей и подростков изменения сосудов сетчатки обычно ограничиваются стадией ангиоспазма.
Выявленные офтальмологом изменения в сосудах сетчатки свидетельствуют о необходимости активного лечения гипертонической болезни.
Патология сердечно–сосудистой системы, в том числе артериальная гипертензия, могут вызывать острые нарушения кровообращения в сосудах сетчатки.
Острая непроходимость центральной артерии сетчатки (ЦАС) и ее ветвей может быть обусловлена спазмом, эмболией или тромбозом сосуда. В результате непроходимости ЦАС и ее ветвей возникает ишемия, обусловливающая дистрофические изменения в сетчатке и зрительном нерве.
Спазм ЦАС и ее ветвей у молодых людей бывает проявлением вегетососудистых расстройств, а у лиц пожилого возраста чаще возникает органическое поражение сосудистой стенки в связи с артериальной гипертензией, атеросклерозом и др. За несколько дней и даже недель до спазма больные могут жаловаться на временное затуманивание зрения, появление искр, головокружение, головную боль, онемение пальцев рук и ног. Такие же симптомы могут возникать при эндартериите, некоторых отравлениях, эклампсии, инфекционных заболеваниях, при введении анестезирующих средств в слизистую оболочку носовой перегородки, удалении зуба или его пульпы. При офтальмоскопии выявляют сужение всех или отдельных веточек ЦАС с ишемией вокруг. Непроходимость ствола ЦАС возникает внезапно, чаще в утренние часы, и проявляется значительным снижением зрения, вплоть до полной слепоты. При поражении одной из ветвей ЦАС острота зрения может сохраняться. В поле зрения выявляют дефекты.
Эмболия ЦАС и ее ветвей чаще наблюдается у молодых людей с эндокринными и септическими заболеваниями, острыми инфекциями, ревматизмом, при травме. При офтальмоскопии глазного дна обнаруживают характерные изменения в области центральной ямки вишневое пятно – симптом "вишневой косточки" (рис. 21.3). Наличие пятна объясняется тем, что на этом участке сетчатка очень тонкая и сквозь нее просвечивает ярко–красная сосудистая оболочка. Диск зрительного нерва постепенно бледнеет, и наступает его атрофия. При наличии цилиоретинальной артерии, являющейся анастомозом между ЦАС и цилиарной артерией, имеется дополнительный кровоток в области желтого пятна и симптом "вишневой косточки” не появляется. На фоне общей ишемии сетчатки папилломакулярная область глазного дна может иметь нормальный цвет. В этих случаях сохраняется центральное зрение.
При эмболии ЦАС зрение никогда не восстанавливается. При кратковременном спазме у молодых людей зрение может вернуться полностью, при длительном же возможен неблагоприятный исход. Прогноз у лиц пожилого и среднего возраста хуже, чем у молодых. При закупорке одной из ветвей ЦАС возникает ишемический отек сетчатки по ходу пораженного сосуда, зрение снижается только частично, наблюдается выпадение соответствующего участка поля зрения.
Лечение острой непроходимости ЦАС и ее ветвей заключается в немедленном назначении общих и местных сосудорасширяющих средств. Под язык – таблетку нитроглицерина, под кожу – 1,0 мл 10% раствора кофеина, вдыхание амилнитрита (2–3 капли на ватке), ретробульбарно – 0,5 мл 0,1% раствора сульфата атропина или раствор прискола (10 мг на одно введение, ежедневно в течение нескольких дней), 0,3–0,5 мл 15% раствора компламина. Внутривенно – 10 мл 2,4% раствора эуфиллина, внутримышечно – 1 мл 1% раствора никотиновой кислоты в качестве активатора фибринолиза, 1 мл 1% раствора дибазола, 2 мл 2% раствора папаверина гидрохлорида, 2 мл 15% компламина.
Внутривенно вводят также 1% раствор никотиновой кислоты (1 мл), 40% раствор глюкозы (10 мл), чередуя его с 2,4% раствором эуфиллина (10 мл). Если у больного имеются общие заболевания (нарушения мозгового кровообращения, инфаркт миокарда), показана антикоагулянтная терапия. При тромбозе ЦАС, возникшем в результате эндартериита, ретробульбарно делают инъекции фибринолизина с гепарином на фоне внутримышечного введения гепарина в дозе 5.000–10.000 ЕД 4–6 раз в день под контролем свертываемости крови и протромбинового индекса. Затем назначают внутрь антикоагулянты непрямого действия – финилин по 0,03 мл 3–4 раза в первые сутки, а в последующем – 1 раз в день.
Внутрь принимают эуфиллин по 0,1 г, папаверин по 0,02 г, дибазол по 0,02 г, но–шпу по 0,04 г, нигексин по 0,25 г 2–3 раза в день, трентал по 0,1 г 3 раза в день.
Показано внутримышечное введение 25% раствора магния сульфата по 5–10 мл на инъекцию. Антисклеротические средства (препараты йода, метионин по 0,05 г, мисклерон по 0,25 г 3 раза в день), витамины А, В6, В|2 и С назначают в обычных дозах.
Тромбоз центральной вены сетчатки (ЦВС) возникает главным образом при гипертонической болезни, атеросклерозе, сахарном диабете, чаще у лиц пожилого возраста. У молодых людей причиной тромбоза ЦВС может быть общая (грипп, сепсис, пневмония и др.) или фокальная (чаще заболевания околоносовых пазух и зубов) инфекция. В отличие от острой непроходимости ЦАС тромбоз ЦВС развивается постепенно.
В стадии претромбоза на глазном дне появляется венозный застой (рис. 21.4). Вены темные, расширенные, извитые, четко выражены артериовенозные перекресты. При выполнении ангиографических исследований регистрируют замедление кровотока. При начинающемся тромбозе вены сетчатки темные, широкие, напряжены, по ходу вен – транссудатавный отек ткани, на периферии глазного дна по ходу конечных вен имеются точечные кровоизлияния. В активной стадии тромбоза внезапно наступает ухудшение, а затем и полное снижение зрения. При офтальмоскопии диск зрительного нерва отечен, границы смыты, вены расширены, извиты и прерывисты, часто погружены в отечную сетчатку, артерии сужены, наблюдаются кровоизлияния разной величины и формы (рис. 21.5).
При полном тромбозе кровоизлияния располагаются по всей сетчатке, а при тромбозе ветви они локализуются только в бассейне пораженного сосуда. Тромбоз отдельных ветвей чаще происходит в области артериовенозных перекрестов. Через некоторое время образуются фокусы белого цвета – скопления белка, дегенерации. Под влиянием лечения кровоизлияния могут частично рассосаться, в результате чего улучшается центральное и периферическое зрение.
В центральной зоне глазного дна после полного тромбоза часто появляются новообразованные сосуды, которые обладают повышенной проницаемостью, о чем свидетельствует свободный выход флюоресцеина при ан гиографич ес ко м исследо ва н и и. Осложнениями позднего периода тромбоза ЦВС являются рецидивирующие преретинальные и ретинальные кровоизлияния, гемофтальм, связанный с новообразованными сосудами.
После тромбоза ЦВС часто развиваются вторичная геморрагическая глаукома, дегенерация сетчатки, макулопатия, пролиферативные изменения в сетчатке, атрофия зрительного нерва. Тромбоз отдельных ветвей ЦВС редко осложняется вторичной геморрагической глаукомой, значительно чаще появляются дистрофические изменения центральной области сетчатки, особенно при поражении височной ветви, так как она отводит кровь от макулярного отдела сетчатки.
При непроходимости вен сетчатки у больных с гипертонической болезнью необходимо снизить артериальное давление и повысить перфузионное давление в сосудах глаза. Для снижения артериального давления необходимо дать таблетку клофелина, а для повышения перфузионного давления в сосудах глаза, уменьшения отека в области венозного застоя и снижения экстравазального давления на внутриглазные сосуды рекомендуют этакриновую кислоту по 0,05 г и диакарб по 0,25 г 2 раза в день в течение 5 дней, а также инстилляции 2% раствора пилокарпина. Благоприятное действие оказывает плазм иноген. Парабульбарно вводят гепарин и кортикостероиды, внутривенно – реополиглюкин и трентал, внутримышечно – гепарин, дозу которого устанавливают в зависимости от времени свертывания крови: оно должно быть увеличено в 2 раза по сравнению с нормой. Затем применяют антикоагулянты непрямого действия (фенилин, неодекумарин). Из симптоматических средств рекомендуют ангиопротекторы (продектин, дицинон), препараты, улучшающие микрониркулянию (компламин,теоникол, трентал, кавинтон), спазмолитические препараты (папаверин, но–шпа), кортикостероиды (дексазон ретробульбарно и под конъюнктиву), витамины, антисклеротические препараты. В поздние сроки (через 2–3 мес) проводят лазеркоагуляцию пораженных сосудов, используя результаты флюоресцентной ангиографии.
Заболевания почек, особенно хронические гломерулонефриты, часто вызывают изменения в сосудах сетчатки. Уже при небольшой продолжительности заболевания отмечается сужение артерий сетчатки, что считают началом развития почечной ангиопатии. При длительном течении заболевания в стенках сосудов возникают склеротические изменения, в патологический процесс вовлекается сетчатка и развивается почечная ретинопатия, последствия которой тяжелее, чем при гипертонической болезни.
При почечной ретинопатии сосуды сетчатки сужены и умеренно склерозированы, имеется отек сетчатки вокруг диска зрительного нерва и в центральном отделе глазного дна. Характерно большое количество поверхностных хлопьевидных белых экссудативных очагов. В макулярной области множественные мелкие очаги (см. рис. 21.2) образуют фигуру звезды, которая характерна для этой патологии.
Почечная ретинопатия может осложниться геморрагиями или отслойкой сетчатки, полной либо частичной. При остром гломерулонефрите таких грубых изменений на глазном дне нет и изменения в сетчатке могут претерпевать обратное развитие, хотя часто дегенеративные изменения как в сетчатке, так и в зрительном нерве сохраняются.
При ухудшении состояния почек ретинопатия может перейти в III стадию – почечную нейроретинопатию, при которой офтальмоскопическая картина напоминает таковую при нейроретинопатии у больных гипертонической болезнью. Диск зрительного нерва отечный, границы его нечеткие, наблюдаются отек сетчатки, геморрагии, очаги экссудата почти всегда располагаются в области желтого пятна в форме звезды. Это всегда является плохим прогностическим признаком для жизни больного.
Изменения желтого пятна в виде фигуры звезды могут появиться после острых инфекций – гриппа, менингита, кори, туберкулеза, сифилиса, а также при очаговых инфекциях. В таких случаях патологические изменения в сетчатке обратимы.
Лечение проводят совместно с нефрологом. Местно применяют средства, способствующие укреплению сосудистой стенки (дицинон, продектин) и улучшению трофических процессов (АТФ, витамины А, группы В, С).
Токсикоз беременных. В том случае, если беременность протекает нормально, изменений сосудов сетчатки не бывает. Как исключение иногда наблюдаются ангиоспазм и гиперемия диска зрительного нерва без понижения остроты зрения.
При раннем токсикозе беременных наблюдаются различные варианты ангиопатий сетчатки (расширение вен, сужение артерий, извитость отдельных артериол, гиперемия диска зрительного нерва), могут возникать кровоизлияния в сетчатку и ретробульбарный неврит.
Одной из форм позднего токсикоза беременных является нефропатия беременных, при которой поражаются в основном сосудистая система и почки и которая характеризуется отеками, артериальной гипертензией и протеинурией. Сосудистые расстройства обнаруживают прежде всего при исследовании глазного дна: отмечают сужение артерий и расширение вен, отек сетчатки и даже отслойку сетчатки. В отличие от гипертонической болезни при спазме артерий сетчатки на почве токсикоза беременных нет сдавления вен в местах артериовенозных перекрестов.
Тяжелой формой позднего токсикоза беременных является эклампсия, характеризующаяся внезапным появлением судорог и потерей сознания. К симптомам нефропатии беременных (отеки, артериальная гипертензия, протеинурия) присоединяются мучительная головная боль, чувство тяжести в голове, головокружение, отдельные зрительные галлюцинации, подавленное настроение, тревога, вялость, адинамия, расстройства зрения (мелькание мушек, туман, пелена перед глазами, ухудшение зрения вплоть до его кратковременной потери), ухудшение памяти, возникают тошнота, рвота, понос, отмечаются одутловатость лица, цианоз кожи и слизистых оболочек. Особенно тяжело протекает эклампсия при сопутствующих соматических заболеваниях (гипертонической болезни, хроническом гломерулонефрите и пиелонефрите, сахарном диабете), а также у женщин, перенесших энцефалит, менингит, гепатит, ревмокардит. По мере прогрессирования эклампсии нарастают расстройства функций жизненно важных органов, что приводит к кровоизлияниям в мозг, отслойке сетчатки, кровоизлияниям в нее, нейроретинопатии с потерей зрения, почечной, печеночной и дыхательной недостаточности.
Все лечебные мероприятия направлены на устранение генерализованного спазма сосудов, гиповолемии, снижение артериального давления, борьбу с интоксикацией, улучшение микроциркуляции и т. д. Обязателен контроль за диурезом, дыханием, зрением, состоянием сердечно–сосудистой системы. При неэффективности интенсивной терапии проводится кесарево сечение. Одним из показаний к его выполнению являются кровоизлияния в сетчатку, ее отслойка и нейроретинопатия. Особое внимание следует уделить женщинам с миопией высокой степени и периферическими витреоретинальными дистрофиями (решетчатая, кистозная, в виде булыжной мостовой, пигментированная), так как в этих случаях существует угроза отслойки сетчатки при родоразрешении естественным путем. Аргоновая профилактическая лазеркоагуляция позволяет у многих беременных не прибегать к кесареву сечению.
Болезни крови оказывают влияние на все системы и органы, в том числе на орган зрения.
При анемиях (апластической, гипохромной, пернициозной, вторичной) отмечается бледность кожного покрова и слизистых оболочек, кровоизлияния под конъюнктиву и в толщу век, в основе которых лежит гипоксия тканей, может возникнуть паралич наружных мышц глазного яблока. Характерными симптомами являются расширение сосудов сетчатки, микроаневризмы сосудов, кровоизлияния в виде полос, мазков по ходу сосудов или округлой формы, если они расположены в наружных слоях сетчатки. Чаще всего кровоизлияния концентрируются вокруг зрительного нерва и желтого пятна. Могут наблюдаться преретинальные кровоизлияния и кровоизлияния в стекловидное тело. Наиболее тяжелы проявления анемии – экссудация в виде фигуры звезды в макулярной области, а также экссудативная отслойка сетчатки и застойный диск зрительного нерва.
При лейкозах обнаруживают нарушение микроциркуляции в сосудах конъюнктивы глазного яблока. Оно проявляется в неравномерности калибра и извитости вен, образовании единичных аневризм. По мере прогрессирования процесса происходит сужение артериол. У некоторых больных выявляют микротромбы вен конъюнктивы. В поздних стадиях болезни почти у половины больных наблюдаются субконъюнктивальные кровоизлияния, более выраженные при хроническом миелобластном лейкозе.
Особенностью состояния глазного дна при лейкозах является общий бледный фон с желтоватым оттенком, отмечаются деколорация диска зрительного нерва, стушеванность его границ вследствие перипапиллярного отска сетчатки. При острых лейкозах у 15% больных имеется застойный диск зрительного нерва. Сосуды сетчатки бледные, сопровождаются белыми полосами. При хроническом лимфолейкозе самые ранние изменения сосудов – расширение и извитость вен сетчатки, неравномерность их калибра.
По мере прогрессирования процесса отмечается сужение артерий сетчатки, а в терминальной стадии – их расширение (прогностически неблагоприятный признак). Кровоизлияния овальной или круглой формы, окаймленные красноватым кольцом, характерны только для лейкоза. Могут наблюдаться также преретинальные кровоизлияния. Причиной кровоизлияний являются тромбоцитопения, анемическая диспротеинемия и антикоагуляционное действие глобулинов.
При миелоидной лейкемии в сетчатке имеется множество возвышающихся над ее поверхностью узелков, окруженных кольцом кровоизлияний – миелом (рис. 21.6). Такие же образования имеются в костях, твердой мозговой оболочке, но там их нельзя увидеть. Глазное дно бледное, диск зрительного нерва обнаруживают с трудом. Тонус сосудов снижен, артерию нельзя отличить от вены: острота зрения снижается при наличии центрально расположенных миелом и кровоизлияний.
Довольно часто глазные симптомы обнаруживают раньше, чем другие клинические проявления заболевания.
Лечение глазных проявлений проводят совместно с врачом–гематологом. При массивных кровоизлияниях в сетчатку общее лечение дополняют ангиопротекторами (дицинон, аскорутин) и кортикостероидами (местно – дексазон в каплях).
В стадии улучшения общего состояния больных улучшается и состояние органа зрения. Установлена тенденция к рассасыванию кровоизлияния в сетчатку.
При геморрагических диатезах отмечается общая повышенная кровоточивость. Кровоизлияния находят в конъюнктиве и во внутренних слоях сетчатки вблизи диска зрительного нерва. Кровоизлияния часто сопровождаются экссудацией.
При эритремии в связи с изменением реологических свойств крови нарушается микроциркуляция, что приводит к образованию тромбов как в мелких, так и в крупных сосудах сетчатки. Диск зрительного нерва отечен, красного цвета, вены извиты и расширены, вокруг них – большое количество кровоизлияний. Артерии не изменены. Глазное дно темное, цианотичное. Изучение изменений на глазном дне при болезнях крови позволяет своевременно установить диагноз, следить за динамикой процесса и действием лекарственных средств, а также оценить прогноз.
Эндокринная патология. При недостаточной деятельности паращитовидных желез в результате гипокальциемии вместе с судорогами, тахикардией, расстройствами дыхания развивается катаракта. Помутнение хрусталика при тетании может возникнуть в течение нескольких часов. При биомикроскопии в корковом слое хрусталика, под передней и задней капсулами видны точечные и штрихообразные помутнения серого цвета, перемежающиеся с вакуолями и водными щелями, затем катаракта прогрессирует. Ее удаляют хирургическим путем. Лечение гипокальциемии состоит в назначении препаратов паращитовидной железы и солей кальция.
У больных с акромегалией на почве дисфункции гипофиза развивается ангиопатия сетчатки, появляется симптом застойного диска, снижается центральное зрение восприятие цвета, битемпорально выпадают поля зрения. Заболевание может закончиться атрофией зрительных нервов и полной слепотой. Чаще всего причина заболевания – эозинофильная аденома гипофиза.
При гиперфункции коры и мозгового вещества надпочечников развивающаяся гипертензия вызывает в сетчатке изменения, свойственные вторичной артериальной гипертензии. При гипофункции (болезнь Аддисона) нарушается электролитный и углеводный обмен. У больного отсутствует аппетит, развивается общая слабость, уменьшается масса тела, отмечаются гипотермия, артериальная гипотензия и пигментация кожи, в том числе кожи век и конъюнктивы. В случае длительного течения болезни окраска радужки и глазного дна становится более темной. Лечение проводит эндокринолог.
Нарушение функции щитовидной железы вызывает изменения в орбитальной клетчатке и наружных глазных мышцах, что приводит к возникновению эндокринного экзофтальма (см. главу 19).
Сахарный диабет (СД) развивается у представителей всех человеческих рас. Согласно мировой статистике, диабетом болеют от 1 до 15% всего населения земного шара, а заболеваемость постоянно увеличивается. В центре внимания современных диабетологов находится проблема сосудистых осложнений сахарного диабета, от которых зависят прогноз заболевания, трудоспособность и продолжительность жизни больного. При диабете интенсивно поражаются сосуды сетчатки, почек, нижних конечностей, головного мозга и сердца. Офтальмолог может первым обнаружить на глазном дне изменения, характерные для СД, когда больные приходят с жалобами на понижение зрения, видение черных точек и пятен, не подозревая о наличии у них СД. Помимо ретинопатии, при диабете развиваются катаракта, вторичная неоваскулярная глаукома, поражение роговицы в виде точечных кератопатий, рецидивирующих эрозий, трофической язвы, эндотелиальной дистрофии, отмечаются также блефариты, блефароконъюнктивиты, ячмени, иридоциклиты, иногда поражаются глазодвигательные нервы.
Первые признаки изменений глазного дна – расширение вен сетчатки, венозный стаз, венозная гиперемия. По мере прогрессирования процесса вены сетчатки приобретают веретенообразную форму, становятся извитыми, растянутыми – это стадия диабетической ангиопатии. Далее стенки вен утолщаются, появляются пристеночные тромбы и очаги перифлебита. Наиболее характерный признак – рассеянные по всему глазному дну мешотчатые аневризматические расширения мелких вен, расположенные парамакулярно. При офтальмоскопии они выглядят как скопление отдельных красных пятен (их путают с кровоизлиянием), затем аневризмы превращаются в белые очажки, содержащие липиды. Патологический процесс переходит в стадию диабетической ретинопатии, для которой характерно появление геморрагий, от мелкоточечных до крупных, покрывающих все глазное дно. Они чаще возникают в области желтого пятна и вокруг диска зрительного нерва. Кровоизлияния появляются не только в сетчатке, но и в стекловидном теле. Преретинальные кровоизлияния часто являются предвестниками пролиферативных изменений.
Вторым характерным признаком диабетической ретинопатии являются глубокие восковидные и хлопкообразные беловатые очаги экссудации с расплывчатыми границами. Они встречаются чаще при сочетании диабетической ретинопатии с гипертонией или нефропатией. Восковидные экссудаты имеют форму капель с беловатым оттенком.
Отек сетчатки и очаговые изменения часто локализуются в макулярной области, что приводит к снижению остроты зрения и появлению относительных или абсолютных скотом в поле зрения. Поражение области желтого пятна на СД называют диабетической макулопатией, которая может возникнуть в любой стадии заболевания и проявляется в экссудативной, отечной и ишемической (наихудший прогноз в отношении зрения) формах.
Установить правильный диагноз и решить вопрос о проведении лазерной коагуляции пораженных сосудов помогает флюоресцентная ангиография. Это наиболее информативный метод, который позволяет определить начальные поражения стенки сосудов, их диаметр, проницаемость, микроаневризмы, тромбирование капилляров, зоны ишемии и скорость циркуляции крови.
Следующая стадия развития патологических изменений – пролиферативная диабетическая ретинопатия, при которой к изменениям, появившимся в стадии ангиопатии и простой диабетической ретинопатии, присоединяются пролиферативные изменения в сетчатке и стекловидном теле (рис. 21.7). В этой стадии отмечается новообразование капилляров, петли которых появляются на поверхности сетчатки, диске зрительного нерва и по ходу сосудов (рис. 21.8).
При прогрессировании процесса происходит врастание капилляров в стекловидное тело с отслоением гиалоидной мембраны. Параллельно с неоваскуляризацией появляются фиброзные разрастания, локализующиеся преретинально и врастающие в стекловидное тело и сетчатку. При офтальмоскопии пролифераты выглядят как серовато–белые полосы, очаги разнообразной формы, покрывающие сетчатку.
Фиброваскулярная ткань, пенетрирующая заднюю гиалоидную мембрану стекловидного тела, постепенно уплотняется и сокращается, вызывая отслойку сетчатки. Пролиферативная форма диабетической ретинопатии отличается особой тяжестью, быстрым течением, плохим прогнозом и проявляется обычно у молодых людей.
Картина глазного дна при СД изменяется, если он сочетается с гипертонической болезнью, атеросклерозом, нефропатией. Патологические изменения в этих случаях нарастают быстрее.
Диабетическую ретиноангиопатию считают доброкачественной, если она течет стадийно в течение 15–20 лет.
Лечение патогенетическое, т. е. регуляция углеводного, жирового и белкового обмена, и симптоматическое – устранение и профилактика проявлений и осложнений СД.
Для рассасывания кровоизлияний в стекловидном теле эффективны ферментные препараты: лидаза, химотрипсин, йод в небольших дозах. С целью улучшения окислительновосстановительных процессов назначают АТФ.
Наиболее эффективный метод лечения диабетической ретинопатии – лазерная коагуляция сосудов сетчатки, направленная на подавление неоваскуляризации, закрытие и отграничение сосудов с повышенной проницаемостью, а также на предотвращение тракционной отслойки сетчатки. При разных вариантах диабетической патологии используют специальные методы лазерного лечения.
В случае появления диабетической катаракты показано хирургическое лечение. После экстракции катаракты нередко возникают осложнения: кровоизлияния в переднюю камеру глаза, отслойка сосудистой оболочки и др.
При наличии кровоизлияний в стекловидное тело со значительным снижением остроты зрения, тракционной отслойки сетчатки, а также фиброваскулярной пролиферации производят удаление измененного стекловидного тела (витрэктомию) с одновременной эндолазерной коагуляцией сетчатки. В последние годы благодаря новому техническому оснащению витреоретинальная хирургия достигла больших успехов. Стало возможным иссечение преретинальных шварт, закрывающих область желтого пятна. Такие операции возвращают зрение больным, которых раньше считали инкурабельными.
Специфические инфекции (туберкулез, сифилис, токсоплазмоз, саркоидоз, лепра, тифы и многие вирусные заболевания) могут осложняться появлением очагов воспаления в сосудистом тракте глаза. Это могут быть иридоциклиты или хориоидиты. При хориоидитах в воспалительный процесс всегда вовлекается сетчатка, поэтому следует говорить о хориорети н итах.
В активной стадии хориоретинита воспалительные фокусы представлены белыми или желтоватыми очагами с нечеткими границами. Изменения сосудов проявляются в виде сужения, расширения, неравномерности калибра, частичной облитерации, образования муфт, кровоизлияний в сетчатку.
При стихании процесса очаги уплотняются, границы их становятся четкими, появляются глыбки пигмента, Субъективный симптом хориоретинита при локализации в центральной области – снижение остроты зрения, а при периферической локализации процесса жалобы могут отсутствовать. В поле зрения находят центральные, парацентральные и периферические скотомы, которые могут исчезнуть при благоприятном разрешении процесса.
При диссеминированном туберкулезном хориоретините с помощью офтальмоскопии выявляют различной давности и формы очаги в хориоидее и сетчатке. На фоне старых очагов, имеющих четкие границы и выраженную пигментацию по краю, появляются более свежие очаги желтовато–серого цвета с нечеткими границами, окруженные перифокальным отеком, несколько проминирующие, а иногда окаймленные кровоизлиянием. Отек сетчатки некоторое время может наблюдаться и по краю старых очагов. Очаги имеют разные размеры и форму, располагаются группами, занимая обширные участки глазного дна, не сливаются друг с другом. Процесс может распространяться на передний отдел собственно сосудистой оболочки, сопровождаться высыпанием преципитатов, появлением гониосинехий, экзогенной пигментации угла передней камеры глаза, новообразованных сосудов в радужке у ее корня.
Диффузный туберкулезный хориоретинит чаще развивается у детей и подростков на фоне хронически текущего первичного туберкулеза. При данной патологии наблюдается также массивная экссудация в преретинальные отделы стекловидного тела. В процесс могут вовлекаться ресничное тело и радужка.
Центральный туберкулезный хориоретинит может развиться при туберкулезе всех локализаций. В области желтого пятна имеется относительно большой проминирующий очаг экссудации с желтоватым оттенком или серо–аспидного цвета с перифокальным отеком (экссудативная форма). Очаг может быть окружен кровоизлияниями в виде пятен или венчика (экссудативно–геморрагическая форма). Перифокальный отек и обусловленные им двухконтурные лучевые рефлексы видны лучше в бескрасном свете.
Центральный туберкулезный хориоретинит дифференцируют с транссудативной дистрофией желтого пятна, центральным гранулематозным процессом, развивающимся при сифилисе, бруцеллезе, малярии и пр.
Возможны и другие формы заболевания, например метастатическая туберкулезная гранулема, локализующаяся у диска зрительного нерва. В этом случае наблюдаются отек сетчатки в окружности зрительного нерва, отек диска зрительного нерва и смазанность его границ. Вследствие отека сетчатки хориоидальный очаг в активной фазе может не выявляться. В некоторых случаях устанавливают ошибочный диагноз оптического папиллита или неврита. В поле зрения определяется секторообразная скотома, сливающаяся со слепым пятном. По мере рассасывания инфильтрата и отека сетчатки выявляется хориоидальный очаг, локализующийся вблизи диска зрительного нерва под сетчаткой. Очаг рубцуется. Центральное зрение остается хорошим. Это юкстапапиллярный хориоидит Йенсена. Заболевание обычно развивается в старшем детском и юношеском возрасте, чаще у лиц, склонных к аллергии.
Лечение туберкулезных хориоретинитов проводят противотуберкулезными препаратами в сочетании с десенсибилизирующей терапией и общеукрепляющим лечением после консультации фтизиатра.
Необходима санация очагов инфекции (зубов, околоносовых пазух, миндалин и др.). Местно назначают мидриатики, кортикостероиды. Парабульбарно вводят раствор дексазона, под конъюнктиву стрептомицин – хлоркальциевый комплекс по 25.000–50.000 ЕД, 5% раствор салюзида по 0,3–0,5 мл. Показан электрофорез с противотуберкулезными препаратами.
Флюоресцентная ангиография дает возможность оценить степень активности туберкулезного хориоретинита, контролировать эффективность проводимого лечения, определить объем и сроки лазерной коагуляции.
Поражение глаз при токсоплазмозе В зависимости от времени заражения различают врожденный и приобретенный токсоплазмоз.
При врожденном токсоплазмозе патологический процесс чаще локализуется в центральной нервной системе и глазу. Основными характерными чертами врожденных поражений глаза являются значительная тяжесть патологических изменений и сочетание их с врожденными дефектами (анофтальм, микрофтальм, колобома соска зрительного нерва, колобома век).
Задний отдел глаза при токсоплазмозе поражается значительно чаще, чем передний, преимущественно папилломакулярная область. Для токсоплазмоза характерны большие грубые, иногда множественные атрофические очаги неправильной формы с отложением большого количества пигмента, преимущественно по краям очага. На фоне очага могут быть видны сосуды сетчатки и сосуды хориоидеи (рис. 21.9). Сосуды хориоидеи сильно изменены, склерозированы.
В ряде случаев при врожденном токсоплазмозе может быть единственный хориоретинальный очаг в макулярной или парамакулярной области, но нередко рядом с ним на периферии можно обнаружить другие, более мелкие очаги.
В случае возникновения рецидива болезни наряду со старыми появляются свежие очаги.
Изолированные ретиниты при врожденном токсоплазмозе наблюдаются редко. Они протекают с явлениями выраженной экссудации, иногда заканчиваются экссудативной отслойкой сетчатки.
Течение приобретенного токсоплазмоза в большинстве случаев более легкое. Заболевание выявляют с помощью серологических методов при массовом обследовании населения. При свежем поражении сетчатки в макулярной или папилломакулярной области появляется круглый очаг светло–серого или серо–зеленоватого цвета, размером больше диаметра диска зрительного нерва, проминирующий в стекловидное тело. Границы смыты из–за отека сетчатки. Почти всегда такие очаги окружены каймой кровоизлияний. Иногда на некотором расстоянии от очага возникают кровоизлияния в виде точек или небольших пятен красного цвета. Рецидивы кровоизлияний у краев очага свидетельствуют об активности процесса. Благополучный исход наблюдается нечасто. У большинства больных бывают рецидивы. При токсоплазмозе могут развиться ретинальный перифлебит, тромбоз вен сетчатки, парезы и параличи глазодвигательных мышц. Заболевание глаза обычно сочетается с изменениями в нервной и сердечно–сосудистой системах, лимфатическом аппарате, крови.
Диагностика на основании клинических признаков довольно часто сопряжена со значительными трудностями. Необходимо использовать серологические реакции.
Лечение проводят сульфаниламидными препаратами в сочетании с дарапримом (отечественный препарат – хлоридин) циклами по общепринятой схеме.
Местно назначают ретробульбарные инъекции линкомицина по 25 мг и гентамицина по 20 мг, а также раствор дексаметазона по 0,3–0,5 мл ежедневно в течение 10 дней, мидокториатические средства с профилактической целью.
При сифилисе в разные периоды его течения поражаются сердечнососудистая, центральная нервная системы и другие органы, в том числе глаз. Появляются изменения кожи век и конъюнктивы. Чаще поражаются роговица, сосудистый тракт глаза и сетчатка.
Последствия врожденного хориоретинита имеют характерную офтальмоскопическую картину: на периферии глазного дна множество мелких серовато–белых очажков, чередующихся с мелкими пигментными глыбками. Они придают глазному дну специфический вид: как будто оно посыпано солью с перцем. Сосуды сетчатки узкие, диск зрительного нерва бледный. Наблюдаются и атипичные формы, когда в периферической части глазного дна видны только пигментированные очаги или, наоборот, крупные белые очаги, окаймленные пигментом в виде кольца. Изредка очаги доходят до центрального отдела. В белых очагах, кроме пигмента, видны остатки запустевших сосудов хориоидеи.
При приобретенном сифилисе сосудистая оболочка и сетчатка поражаются во втором и третьем периодах заболевания.
Различают диффузную и очаговую формы сифилитического хориоретинита. Для приобретенного сифилиса характерен диффузный хориоретинит. Одним из первых признаков диффузной формы сифилитического хориоретинита является нежное помутнение заднего отдела стекловидного тела. Диск зрительного нерва розовый, границы его не совсем четкие, сетчатка отечная. Иногда на фоне отечной сетчатки видны розоватые или светло–серые мелкие очажки без резких границ размером около половины диска зрительного нерва. Очажки расположены в области желтого пятна или рядом с ним. Сосуды сетчатки над очагами проходят без изменений. Затем происходят изменения в пигментном эпителии, образуются глыбки пигмента во внутренних и средних слоях сетчатки. В результате перемещения пигмента обнаруживается диффузное обесцвечивание сосудистой оболочки и на этом фоне видны атрофированные сосуды хориоидеи.
Диск зрительного нерва становится бледным, приобретает серый оттенок, границы его нечеткие. Сосуды сетчатки узкие. Развивается типичная атрофия зрительного нерва. Зрение резко снижается. Хориоидиты нередко сочетаются с иридоциклитом.
Диссеминированный хориоретинит при сифилисе трудно отличить от диссеминированного хориоретинита другой этиологии. Важное значение имеют серологические реакции.
Специфическое лечение осуществляет венеролог. Местно применяют средства, расширяющие зрачок, кортикостероиды в каплях и субконъюнктивально. Кроме того, применяют лекарственные средства, улучшающие метаболизм сетчатки.
Сифилитическое воспаление в мозге сопровождается односторонним мидокториазом и параличом аккомодации, возникает картина застойного диска зрительного нерва, а затем развиваются неврит и паралич глазодвигательного нерва. Характерным симптомом является гомонимная гемианопсия.
При спинной сухотке одним из ранних симптомов является отсутствие реакции зрачков на свет при сохраненной реакции на конвергенцию (симптом Аргайлла Робертсона). Позднее развивается атрофия зрительных нервов, приводящая к полной потере зрения.
Для лечения применяют кортикостероиды внутрь по схеме, а также местно в виде инстилляций 0,1% раствора дексаметазона, закладывания 0,5% гидрокортизоновой мази и субконъюнктивальных инъекций 0,4% раствора дексаметазона по 0,3 мл через день. Назначают десенсибилизирующие средства, ангиопротекторы, витамины. Рекомендуют принимать индометацин по 0,025 г 2–3 раза в день. Местно – инстилляции 3% раствора калия йодида или электрофорез 0,1% раствора лидазы. Рекомендуют также парабульбарно вводить антибиотики широкого спектра действия (гентамицин и др.). Для рассасывания кровоизлияний используют ультразвук, по показаниям проводят лазерную коагуляцию пораженных вен сетчатки.
Изменения в органе зрения при ревматизме. В основе тканевых изменений при ревматизме лежит системная дезорганизация соединительной ткани, наиболее глубокая в сердце и сосудах, в сочетании со специфическими экссудативно–пролиферативными реакциями и поражением сосудов микроциркуляторного русла, обнаруживающимися во всех органах.
Изменения в органе зрения при ревматизме чаще всего проявляются в виде токсико–аллергических увеитов, васкулитов и ретиноваскулитов, которые могут затрагивать как артерии, так и вены сетчатки и протекать по типу пери– и панангиита.
В артериолах и артериях развиваются деструктивно–пролиферативный васкулит, периваскулярная клеточная инфильтрация, иногда плазматическое пропитывание, фибриноидное набухание и некроз стенки сосуда, реже тромбоз.
При ретиноваскулитах вокруг сосудов 2–4–го порядка образуются сероватые муфты и точечные кровоизлияния. Муфты могут охватывать несколько сосудов. Вследствие макулярного отека возможно небольшое снижение остроты зрения.
Для ревматизма характерна наклонность к внутрисосудистому тромбообразованию, поэтому может возникнуть непроходимость центральной артерии или вены сетчатки. В таких случаях отмечается значительное снижение остроты зрения.
Диагноз ревматического васкулита легче установить, если имеются муфты–манжетки или расположенная с одной стороны сосуда "обкладка", которая напоминает снег на ветке дерева, – патогномоничный симптом ревматизма. При распространенном поражении артерий и вен с вовлечением в процесс сосудистых ветвей на диске зрительного нерва течение ревматического периваскулита очень тяжелое.
На диске зрительного нерва может появиться экссудат, прикрывающий сосудистую воронку и большую часть поверхности диска в виде сероватой шапки. Возможны множественные кровоизлияния в сетчатку, отложения фибрина и иногда фигура звезды в макулярной области.
Рано начатое лечение (совместно с ревматологом) приводит к обратному развитию процесса и восстановлению зрения. У детей ревматическая ретинопатия развивается редко.
Септические состояния, наблюдающиеся после родов, у больных эндокардитом, цереброспинальным менингитом, пневмонией и др., часто осложняются ретинитом.
Офтальмоскопическая картина при септических ретинитах неспецифична и отличается от таковой при ретинитах другой этиологии только тяжестью процесса, т. е. по количеству и величине экссудативных очагов в сетчатке.
Наиболее типична картина глазного дна при метастатическом ретините у больных септицемией: появляются возвышающиеся над уровнем глазного дна белые экссудативные очаги различной величины с многочисленными кровоизлияниями, вены расширены и извиты, диск зрительного нерва гиперемирован, границы его стушеваны, зрение значительно снижено. Очень редко происходит обратное развитие процесса, после чего остаются атрофические очаги. Чаще вблизи очага происходит помутнение стекловидного тела, которое затем распространяется на все стекловидное тело, вследствие чего развивается типичный эндофтальмит, а затем и панофтальмит.
Известен другой вид септического ретинита, при котором в основе изменений лежит воспаление вокруг сосудов–периваскулиты. При офтальмоскопии выявляют муфты, сопровождающие сосуды, которые гистологически представляют собой воспалительные клеточные инфильтраты в стенках сосудов. Между сосудами в сетчатке видны желто–белые резко отграниченные очажки; могут наблюдаться кровоизлияния.
Показано интенсивное лечение основного заболевания. Под конъюнктиву вводят антибиотики широкого спектра действия, дексазон, мидриатики.
ВИЧ–инфекция. У больных с приобретенным иммунодефицитом на фоне других поражений при генерализации цитомегаловирусной инфекции обычно обнаруживают хориоретинит (рис. 21.10).
Нарушение зрения может быть первым симптомом не только манифестной цитомегаловирусной инфекции, но и начинающегося СПИДа.
Выявление ретинита на ранних стадиях возможно при регулярном и полном офтальмологическом исследовании обоих глаз. Рано начатое лечение может предотвратить разрывы сетчатки, которые развиваются у 15–29% больных при прогрессировании атрофии и истончении ткани сетчатки.
В начале заболевания больные могут жаловаться на нечеткость очертаний предметов, мелькание "мушек" перед одним глазом, а при прогрессировании инфекции заболевает и второй глаз.
При офтальмологическом исследовании обнаруживают зону некроза сетчатки белого цвета с отеком и геморрагиями в окружающей ткани сетчатки, с закупоркой сосудов и инфильтрацией их стенок (рис. 21.11).
У ВИЧ–инфицированных пациентов возможны поражения сетчатки, напоминающие цитомегаловирусные, но вызванные другими возбудителями.
Токсоплазмозный ретинит при ВИЧ–инфекции проявляется большим количеством очагов бело–желтого цвета, возвышающихся над поверхностью сетчатки, которые напоминают хлопья. Они имеют нечеткие края и локализуются в заднем отделе. Почти никогда не наблюдается геморрагий. Более чем у 50% больных СПИДом появляются так называемые ватообразные пятна – поверхностные поражения сетчатки без геморрагий (рис. 21.12). При офтальмоскопии они напоминают пушистые хлопья, как при сахарном диабете, гипертонической болезни, системных коллагенозах, анемии, лейкозах. В отличие от цитомегаловирусного ретинита эти пятна не увеличиваются, часто спонтанно регрессируют и никогда не вызывают значительного нарушения зрения.
Кандидозный ретинит при ВИЧ–инфекции обычно сочетается с изменениями в стекловидном теле и может закончиться развитием эндофтальмита.
Герпетические ретиниты, вызванные вирусом простого герпеса и вирусом Varicella zoster на фоне ВИЧ–инфекции, проявляются острым прогрессирующим некрозом сетчатки в виде четко отграниченных полей. Герпетические поражения вызывают деструкцию сетчатки и слепоту гораздо быстрее, чем цитомегаловирусный ретинит. Острый ретинальный некроз, вызванный вирусом Varicella zoster, чаще начинается на периферии сетчатки и быстро захватывает всю ее ткань, несмотря на мощную терапию (рис. 21.13). Терапия с использованием различных противовирусных препаратов почти всегда безуспешна.
Сифилитическое поражение глаза при ВИЧ–инфекции проявляется папиллитом и хориоретинитом. Патологический процесс захватывает большие участки сетчатки, на которых располагается множество точечных инфильтратов (рис. 21.14). Проводят лечение основного заболевания и сопутствующих инфекций. Местная терапия симптоматическая.
Менингиты, энцефалиты, очаговые воспалительные и опухолевые процессы в мозге всегда вызывают глазные симптомы: изменение реакции зрачков, характерные выпадения полей зрения, застойные диски и невриты зрительных нервов, парезы и параличи глазодвигательных нервов и др. (см. главу 18).
Глава 22. Некоторая сочетанная стоматологическая и глазная патология
И сладок свет, и благо очам – видеть солнце.Известно значительное количество сочетанной патологии глаза и органов зубочелюстной системы: невралгии с болями, иррадиирующими в глаз, вазомоторные расстройства, сопровождающиеся гиперемией конъюнктивы, явления гипо– и гиперсекреции, слезной жидкости и слюны, моторные расстройства, захватывающие двигательный аппарат глаза, нейротрофические поражения зубочелюстной системы, роговицы, склеры, увеального тракта, сетчатки, зрительного нерва, орбиты."Книга Экклесиаст" 1:7 (из Библии)
Изменения в глазу чаще возникают при таких стоматологических заболеваниях, как кариес, периодонтиты, периоститы, абсцессы, гангрена, пародонтоз, гранулемы. При зубных гранулемах и хроническом воспалении периодонта раздражаются концевые окончания не только тройничного, но и симпатического нерва, что вызывает патологическое рефлекторное воздействие на глаз и другие органы. Очаги патологического раздражения могут возникнуть после лечения депульпированных, запломбированных или покрытых металлическими коронками зубов. Известны случаи развития паралича аккомодации одонтогенного происхождения.
Появление мельканий, темных и светлых пятен, звездочек, полосок или тумана перед глазами, снижение зрения различной продолжительности в некоторых случаях можно объяснить рефлекторными сосудистыми реакциями, исходящими из зубных очагов.
Прорезывание зубов может явиться причиной блефароспазма и гиперемии конъюнктивы.
Одонтогенная инфекция может обусловить развитие тромбофлебита и воспаления лицевых вен, часто на стороне пораженных кариесом верхних зубов. Кариес, периодонтиты, абсцессы, периоститы, остеомиелиты, пародонтоз, гранулемы вызывают различные изменеиия в глазу. Иногда инфекция переходит в соседние околоносовыс полости, а затем поражает глаз.
Причиной таких воспалительных заболеваний, как целлюлит орбиты, остеопериоститы и субпериостальные абсцессы орбиты, могут послужить также рожистое воспаление, фурункулы и абсцессы кожи лица и головы, различные воспалительные заболевания зубочелюстной системы – острые и хронические перицементиты, околокорневые гранулемы челюстей, целлюлиты и абсцессы челюстно–лицевой области и шеи.
У детей раннего грудного возраста наиболее частой причиной целлюлита орбиты является воспаление верхней челюсти. После гематогенного остеомиелита верхней челюсти, как правило, образуются дефекты нижнеглазничного края орбиты с рубцовым выворотом век.
Острое воспаление глазницы следует дифференцировать от гематогенного остеомиелита верхней челюсти, хронический остеомиелит верхней челюсти – от дакриоцистита, абсцессы подглазничного края – от целлюлита слезного мешка.
Злокачественные опухоли околоносовых пазух, как первичные, так и вторичные (прорастающие из носоглотки), опухоли верхней челюсти твердого и мягкого неба проникают в орбиту. При этом офтальмолог может обнаружить первые симптомы: на глазном дне в результате сдавления зрительного нерва и сосудов отмечаются застойные явления, возникают экзофтальм и диплопия, а самым ранним симптомом является отек век. особенно по утрам. При опухолях, происходящих из основной пазухи, отмечаются упорная головная боль, осевой экзофтальм, снижение остроты зрения, на глазном дне – застойный диск зрительного нерва.
Возможно развитие сочетанных глазничных и челюстно–лицевых опухолей. Наиболее часто выявляют гемангиомы, лимфангиомы, дермоиды. Эти опухоли могут располагаться под мышцами дна полости рта, под языком, в языке и области корня носа.
Врожденная расщелина верхней губы и неба, гипоплазия эмали могут сочетаться с врожденными катарактами. На фоне тетании нередко возникает слоистая катаракта и слоистое распределение эмали в зубах.
Двусторонний, часто значительно выраженный экзофтальм может быть вызван недоразвитием верхней челюсти и глазницы. При черепно–лицевых экзостозах могут наблюдаться монголоидный тип лица, астигматизм, нистагм, подвывих хрусталика, деформация черепа, открытый прикус, параличи черепных нервов и т. д.
Болезнь Бехчета. Турецкий дерматолог Н. Behcet (1937) объединил в один синдром рецидивирующий гипопион–иридоциклит, афтозный стоматит, изъязвление половых органов и поражение кожи.
Мужчины заболевают чаще и главным образом в возрасте 20–30 лет. Очень редко болезнь может начаться в детском возрасте.
Заболевание возникает внезапно, протекает в виде приступов, которые продолжаются от нескольких недель до нескольких месяцев и затем рецидивируют в течение длительного периода времени – до 25 лет (рис. 22.1). В течение года, как правило, бывает 4–5 обострений, поражаются оба глаза, иногда одновременно, чаще в разные сроки.
Наличие всех симптомов отмечается приблизительно у У3 больных, чаще отдельные симптомы проявляются с промежутками в несколько месяцев или даже лет. Это затрудняет своевременную диагностику.
Продолжительность инкубационного периода не установлена. Заболевание редко начинается с глазных симптомов, чаше – с недомогания и лихорадки, появления афт на слизистой оболочке полости рта и языка, затем возникает изъязвление половых органов.
Афты болезненны и имеют вид беловато–желтоватых пятен, окруженных красным ободком разной величины. Чаще образуется несколько афт и очень редко – единичные. Афты исчезают, не оставляя следов.
Афтозный стоматит чаще других симптомов совпадает с обострением гипопиониридоциклита. Изъязвления половых органов проявляются небольшими поверхностными язвами, образованием папул или везикул, которые затем изъязвляются. После их исчезновения остается пигментация или рубцы. В разные сроки от начала заболевания развивается гипопиониридоциклит, который при каждом рецидиве протекает тяжелее (рис. 22.2). Больные отмечают снижение зрения, мутнеет влага передней камеры, затем – гипопион, радужка становится гиперемированной, в стекловидном теле образуются помутнения различной интенсивности. Гипопион сначала рассасывается довольно быстро, как и помутнения стекловидного тела. В результате повторных приступов образуются задние синехии (рис. 22.3), организуется экссудат в области зрачка, повышается внутриглазноедавление, развиваются осложненная катаракта и стойкое помутнение стекловидного тела. Процесс, как правило, заканчивается слепотой.
Заболевание иногда начинается с экссудативного хориоретинита, нейроретинита, периартериита с кровоизлияниями в сетчатку и стекловидное тело, ретробульбарного неврита, папиллита, атрофии зрительных нервов, дегенеративных изменений сетчатки. Результаты флюоресцентно–ангиографического исследования свидетельствуют, что при болезни Бехчета имеется генерализованное поражение сосудистой системы глаза.
Патологические изменения на глазном дне являются фактором, определяющим плохой прогноз для зрения при болезни Бехчета.
В редких случаях болезнь сопровождается конъюнктивитом и поверхностным кератитом с рецидивирующими изъязвлениями роговицы или наличием стромальных инфильтратов.
Поражения кожи проявляются в виде фолликулитов, фурункулов, узловатой эритемы, эрозивной эктодермии, пиодермии.
Описаны и другие симптомы: трахеобронхиты, тромбофлебит и тромбозы вен нижних конечностей, заболевания суставов по типу ревматоидного полиартрита, тонзиллит, орхит, поражение нервной системы в виде менингоэнцефалита.
Необходимо отметить, что боли и отек в пораженных суставах, т. е. артропатии, могут быть первым симптомом болезни Бехчета.
Диагностика основывается на комплексе клинических признаков.
Болезнь Бехчета дифференцируют от саркоидоза, энцефалита, болезни Крона, синдромов Рейтера и Стивенса–Джонсона и других сходных по клинической картине заболеваний.
Эффективного лечения нет, как и общепринятой системы лечения.
Применяемое лечение – антибиотики широкого спектра действия, сульфаниламидные препараты, кальция хлорид, переливание одногруппной крови, плазмы дробными дозами, глобулин, кортикостероиды под конъюнктиву ретробульбарно и внутрь, закапывание атропина, аутогемотерапия, ультразвуковая и дегидратирующая терапия и др. – дает лишь временное улучшение.
В настоящее время лечение дополняют иммунодепрессантами, иммуномодуляторами.
Сицдром Съегрена. Клиническими симптомами заболевания являются поражения слезных и слюнных желез, верхних отделов дыхательных путей и желудочно–кишечного тракта, возникающие на фоне деформирующего полиартрита. Болезнь развивается медленно, течение хроническое с обострениями и ремиссиями.
Жалобы больных сводятся к ощущению рези, сухости, жжения в глазах, затруднению при открывании глаз по утрам, светобоязни, затуманиванию, отсутствию слез при плаче, ухудшению зрения и болям в глазу. При объективном исследовании могут отмечаться незначительная гиперемия и разрыхленность конъюнктивы век, тягучее отделяемое из конъюнктивальной полости в виде тонких сероватых эластичных нитей (слизь и слущенные клетки эпителия).
Роговица теряет блеск, истончена. На ее поверхности имеются сероватые нити, после удаления которых могут оставаться эрозии, а в последующем развивается ее помутнение с врастанием сосудов, процесс заканчивается ксерозом. Чувствительность роговицы не изменяется. С помощью пробы Ширмера № 1 выявляют снижение функции слезных желез (от 3–5 мм до 0).
Через некоторое время, после появления глазной патологии отмечаются изменения слизистой оболочки полости рта и языка. Слюна становится вязкой, в результате чего затрудняются речь, акт жевания и глотания. Пищу приходится запивать водой. Спустя некоторое время развивается сухость из–за недостатка слюны (сиалопения), а в более позднем периоде из отверстия стенонова протока (проток околоушной железы) с большим трудом можно выдавить каплю густой желтоватой слюны. Позднее увеличиваются околоушные слюнные железы, что иногда ошибочно расцениваются как признак эпидемического паротита. Слизистая оболочка полости рта и красная кайма iy6 становятся сухими, на языке возникают эрозии и трещины. Сухость распространяется на слизистую оболочку глотки, пищевода, желудка, гортани, трахеи и т. д., так как в процесс вовлекаются носоглоточные, щечные, желудочные, трахеобронхиальные и другие железы. Развиваются гастрит и колит, появляются осиплость, иногда сухой кашель. Реже поражается слизистая оболочка уретры, прямой кишки и заднепроходного отверстия.
В результате понижения секреции потовых и сальных желез появляется сухость кожи, могут отмечаться гиперкератоз, гиперпигментация, выпадение волос.
У большинства больных наблюдаются артропатии в виде хронического деформирующего полиартрита, субфебрильная температура, ускорение СОЭ, нормо– и гипохромная анемия, сначала лейкоцитоз, затем лейкопения, альбуминоглобулиновый сдвиг, дисфункция печени, нарушения в деятельности сердечнососудистой и мочеполовой систем, неврологические расстройства.
Не все симптомы возникают одновременно, но сухость конъюнктивы и роговицы, слизистой оболочки полости рта и носа являются постоянными признаками этого синдрома. Течение заболевания хроническое. Всегда поражаются оба глаза.
Согласно современным представлениям, заболевание относится к коллагенозам, группе аутоиммунных заболеваний. Для диагностики предложен следующий порядок проведения исследований функции слюнных желез: цитологическое исследование мазков секрета, радиосиалография, радиометрическое исследование слюны, сканирование, контрастное рентгенологическое исследование желез и полное офтальмологическое исследование с изучением функционального состояния слезных желез.
Лечение симптоматическое: применяют витаминотерапию, иммунодепрессанты, внутрь капли 5% раствора пилокарпина, подкожные инъекции 0,5% раствора галантамина, местно – инстилляции искусственной слезы, кортикостероидов, лизоцима, персикового и облепихового масла, лазерная стимуляция околоушной слюнной и слезной желез.
Синдром Стивенса–Джонсона. Характерными признаками заболевания являются эрозивное воспаление слизистых оболочек большинства естественных отверстий, полиморфные высыпания на коже, лихорадочное состояние. Доминирующий симптом – поражение слизистых оболочек полости рта, носоглотки, глаз и половых органов.
Заболевание чаще наблюдается у детей и подростков, но может возникнуть в любом возрасте. Рецидивы бывают весной и осенью. Заболевание связывают с фокальной инфекцией, лекарственной аллергией, аутоиммунными процессами. Оно чаще всего начинается с появления головной боли, недомогания и озноба, повышения температуры тела до 38–39°С, депрессии или раздражительности, болей в суставах. В последующем появляется полиморфная сыпь на коже лица, туловища, конечностей. Этому предшествуют тяжелые поражения слизистых оболочек полости рта, носоглотки, глаз и половых органов. На слизистых оболочках шек, десен, миндалин, зева, неба, языка и губ отмечаются резко выраженная гиперемия и отек с образованием быстро лопающихся пузырей. Пузыри, сливаясь, превращаются в сплошные кровоточащие эрозии. Язык увеличивается и покрывается слизисто–гнойным налетом, что вызывает выраженную болезненность, саливацию, затруднения при разговоре и приеме пищи. Лимфатические узлы увеличены, особенно значительно шейные.
Заболевания глаз наблюдаются у всех больных (рис. 22.4). Поражение конъюнктивы проявляется в форме катарального, гнойного или мембранозного конъюнктивита. Веки отечны, гиперемированы, склеены обильным гнойно–кровянистым экссудатом. Катаральный конъюнктивит заканчивается благополучно, не оставляя последствий. При гнойном конъюнктивите вследствие присоединения вторичной инфекции в процесс вовлекается роговица, происходит поверхностное или глубокое изъязвление с последующим рубцеванием, а иногда перфорацией, в результате чего наступает частичная или полная слепота. Мембранозный конъюнктивит сопровождается некрозом конъюнктивы и заканчивается рубцеванием. Последствиями являются трихиаз, заворот век, ксероз, симблефарон и даже анкилоблефарон. Глазные проявления этого синдрома не ограничиваются конъюнктивитами. Описаны также случаи ирита, эписклерита, дакриоцистита и даже панофтальмита.
Больным ошибочно устанавливают диагноз пкорьи, "ящур”, "трахома”, "дифтерия глаза", "пемфигус", "натуральная оспа".
Лечение – антибиотики широкого спектра действия в сочетании с сульфаниламидными препаратами, витамины, кортикостероиды, десенсибилизирующие средства, переливание крови, иммунной сыворотки. Местно применяют кортикостероиды в виде капель и субконъюнктивальных инъекций, витаминные капли, при сухости – искусственную слезу. При трихиазе, завороте век, ксерозе показано хирургическое лечение.
Синдром носоресничного (назоцилиарного) нерва (синдром Шарлена) – комплекс симптомов, вызванных невралгией носоресничного (назоцилиарного) нерва – наиболее крупной ветки первой ветви тройничного нерва. От него отходят длинные цилиарные нервы, идущие к глазному яблоку.
При раздражении носоресничного нерва в зоне его иннервации отмечаются изменение чувствительности (болевые ощущения), нарушение секреции (слезотечение, усиление секреторной функции слизистой оболочки носовой полости) и трофические расстройства (в коже и роговице).
Заболевание связывают с гипертрофией средней носовой раковины, искривлением носовой перегородки, аденоидами в носоглотке, полипами, синуситами, травмами лица.
Синдром проявляется внезапно возникающими приступами острых болей в глазу, вокруг него, соответствующей половине головы, блефароспазмом, слезотечением, болями и обильным выделением секрета из ноздри на стороне поражения. Приступ болей может длиться от 10–60 мин до нескольких дней и даже недель. Если причина невралгии не устранена, то развиваются поверхностный, язвенный или нейротрофический кератит, ирит либо иридоциклит.
Лечение заключается в устранении основной причины заболевания. Субъективные ощущения временно снимают смазыванием слизистой оболочки носа 5% раствором кокаина с адреналином. Применяют антибиотики, транквилизаторы, болеутоляющие препараты, снотворные средства, ганглиоблокаторы.
Синдром следует дифференцировать от поражения крылонебного узла и других лицевых невралгий.
Синдром крылонебного узла (синдром Слюдера) – комплекс симптомов, вызванных невралгией крылонебного узла.
Крылонебный узел – это образование парасимпатической нервной системы. Он содержит мультиполярные клетки и имеет три корня: чувствительный, парасимпатический и симпатический. Ветви крылонебного узла иннервируют слезную железу, слизистую оболочку неба, слизистую носа, задних ячеек решетчатой кости и пазух верхнечелюстной и основной костей.
В начале заболевания у больного появляются острые стреляющие боли у основания носа, вокруг и позади глаза, в глазу, в верхней и нижней челюсти, в зубах. Боли иррадиируют в висок, ухо, в область шеи, плеча, предплечья и кисти. Наиболее интенсивная боль в области орбиты, корня носа и сосцевидного отростка. Продолжительность болей от нескольких часов и дней до нескольких недель.
В момент приступа больной также жалуется на чувство жжения в носу, приступы чиханья, насморк, слезотечение, слюнотечение, головокружение, тошноту, могут быть астмоподобные приступы и извращение вкуса.
Со стороны глаз отмечаются резкая светобоязнь, блефароспазм, слезотечение, бывает отек верхнего века, гиперемия конъюнктивы, мидриаз или миоз, иногда кратковременное повышение внутриглазного давления (ВГД). Заболевание может протекать длительно, иногда месяцами и даже годами. В межприступном периоде довольно часто остается тупая боль в области верхней челюсти, корня носа, глазницы, может оставаться отек пораженной половины лица.
Невралгия крылонебного узла связывается с перифокальной инфекцией околоносовых пазух и полости рта, инфекцией в различных участках головы (гнойный отит, церебральный арахноидит), с травмами носа, гипертрофией раковин и искривлением носовой перегородки, перитонзиллярными абсцессами, аллергией.
Причиной могут быть также зачелюстные опухоли.
В отличие от синдрома назоцилиарного нерва при поражении крылонебного узла не бывает анатомических изменений в переднем сегменте глазного яблока. Повышение чувствительности слизистой оболочки носа сосредоточивается в заднем отделе носовой полости. Дифференцировать надо и с другими лицевыми невралгиями.
Во время приступа рекомендуется кокаиновая блокада в области крылонебного узла. Лечение должно быть направлено в первую очередь на устранение основной причины заболевания.
Назначают болеутоляющие и противоотечные средства, кортикостероиды, противоинфекционную терапию, ганглиоблокаторы, холинолитические средства и физиотерапевтические процедуры, биогенные стимуляторы.
Синдром цилиарного узла (синдром Хагемана – Почтмана) возникает при воспалении цилиарного узла, расположенного за глазным яблоком (12–20 мм) между началом наружной прямой мышцы и зрительным нервом. От цилиарного узла к глазу отходят 4––6 коротких цилиарных нервов.
Заболевание появляется внезапно возникающими болями в голове и глубине орбиты, отдающими в челюсти и зубы. Боли могут усиливаться при движении глазного яблока и давлении на него. Они могут иррадиировать в соответствующую половину головы. Продолжительность болей от нескольких дней до нескольких недель.
У больных отмечаются односторонний мидриаз с сохранением правильной круглой формы зрачка, отсутствие зрачковых реакций на свет и конвергенцию, слабость или паралич аккомодации, гипестезия роговицы, возможны отек эпителия и преходящее повышение офтальмотонуса. Редко развивается неврит зрительного нерва. Синдром, как правило, односторонний. Обычно он проходит через 2–3 дня, иногда через неделю и позже. Дольше всего сохраняется паралич или парез аккомодации, что иногда является единственным свидетельством перенесенного процесса. Возможны рецидивы.
Причинами развития заболевания являются воспалительные процессы в околоносовых пазухах, зубах, инфекционные заболевания, травма или контузия орбиты.
Лечение: санация околоносовых пазух, полости рта, ганглионарные блокады, кортикостероиды, витамино– и пиротерапия, димедрол, новокаин ретробульбарно, местно – хинин с морфином, витаминные капли.
Синдром Маркуса – Гунна. Парадоксальные движения век – односторонний птоз, исчезающий при открывании рта и движении челюсти в противоположную сторону. Если рот открывается больше, то глазная щель может стать шире (рис. 22.5). При жевании птоз уменьшается. Синдром может быть врожденным и приобретеным, чаще наблюдается у мужчин. С возрастом может стать менее выраженным.
При приобретенном заболевании парадоксальные движения век появляются после травмы, удаления зубов, ранения лицевого нерва, сотрясения мозга, энцефалита, психической травмы. Предполагают наличие аномальной связи между тройничным и глазодвигательным нервами или ядрами этих нервов. Иногда этот синдром рассматривают как результат нарушения кортикобульбарных связей.
Наблюдаются сопутствующие изменения в органе зрения и организме в целом (паралитическое косоглазие на стороне птоза, эпилепсия с редкими судорожными припадками и др.). Лечение в основном хирургическое – устранение птоза.
Синдром Мартина Ама – синдром, обратный синдрому Маркуса – Гунна, – опущение верхнего века при открывании рта. Птоз появляется также во время жевания. Развитию парадоксальных синкинетичес ких движений предшествует периферический паралич лицевого нерва.
Болезнь Микулича – симптомокомплекс, который характеризуется медленно прогрессирующим симметричным, часто значительным увеличением слезных и слюнных желез, смещением глазных яблок книзу и внутри и выпячиванием их вперед. Движения глаз ограничены, иногда имеется диплопия. Кожа век растянута, может быть цианотичной, в ней видны расширенные вены, а в толще век отмечаются кровоизлияния. Конъюнктива век гиперемирована. На глазном дне иногда обнаруживают периваскулиты, кровоизлияния, явления застойного диска или неврита. Болезнь развивается медленно, в течение нескольких лет. Начинается чаще в возрасте 20–30 лет с постепенно увеличивающегося припухания слюнных, а затем слезных желез, иногда процесс распространяется даже на мелкие железы полости рта и гортани. Припухшие крупные железы подвижны, эластичны, безболезненны, с гладкой поверхностью. Нагноения желез никогда не происходит. В процесс вовлекаются лимфатические узлы. Патологоанатомические изменения проявляются в виде лимфоматоза, реже гранулематоза слезных и слюнных желез. Лечение зависит от предполагаемой этиологии заболевания. Во всех случаях показано применение препарата мышьяка и раствора йодида калия внутрь.
Болезнь дифференцируют от хронического продуктивного паренхиматозного воспаления слюнной железы, слюннокаменной болезни, опухолей слюнной и слезной желез, синдрома Съегрена.
Синдром Стерджа – Вебера – Краббе – энцефалотригеминальный синдром, характеризующийся сочетанием кожного и мозгового ангиоматоза с глазными проявлениями. Этиология – врожденная нейроэктодермальная дисплазия. Кожный ангиоматоз может быть врожденным или развивается в раннем детстве в виде ангиом лица, чаще располагающихся на одной половине лица вдоль первой и второй ветвей тройничного нерва. Окраска очагов в грудном возрасте розовая, затем становится синюшно–красной (рис. 22.6). Ангиоматоз кожи лица часто распространяется на кожу век, конъюнктиву и склеру. Ангиома может развиться в сосудистой оболочке, иногда возникает отслойка сетчатки соответственно локализации ангиомы. Как правило, синдром сопровождается глаукомой, которая протекает с незначительным гидрофтальмом. Симптомы поражения мозга проявляются в виде умственной отсталости, клонических судорог, эпилептиформных припадков, рецидивирующих гемипарезов или гемиплегий. Возможны гемангиомы во внутренних органах. Также отмечаются эндокринные расстройства: акромегалия, ожирение.
Лечение – рентгенотерапия, склерозирующая терапия, хирургическое лечение кожных ангиом, лечение глаукомы.
Прогноз для жизни обычно неблагоприятный из–за тяжелых неврологических осложнений.
Черепно–лицевой дизостоз (болезнь Крузона). Основной симптом – двусторонний, часто значительный экзофтальм, обусловленный недоразвитием верхней челюсти и орбиты.
Также наблюдаются расходящееся косоглазие, расширение области корня носа, гипертелоризм. На глазном дне – застойные диски зрительных нервов с последующей вторичной атрофией в результате сужения оптического канала или повышения внутричерепного давления вследствие синостоза большинства черепных швов (рис. 22.7). Наблюдают монголоидный тип глазных шелей, астигматизм, нистагм, могут отмечаться врожденные подвывихи хрусталика, гидрофтальм, катаракта. Из других симптомов встречаются деформация черепа типа башенного, клювовидный нос, короткая верхняя губа, эпилептические припадки, нарушения обоняния и слуха, умеренно выраженная умственная отсталость. Болезнь Крузона иногда сочетается с открытым прикусом, синдактилией кистей и стоп.
Заболевание расценивают как семейно–наследственную аномалию черепа. Лечение – хирургическая костная пластика.
Мандибулофациальный дизостоз (болезнь Франческетти) – сем ей нонаследственный синдром, характеризуется разнообразием челюстно–лицевых аномалий в различных комбинациях. Со стороны глаз отмечаются косые "антимонголоидные" глазные щели (двустороннее опущение наружного угла глазной щели), колобомы век, эпибульбарные дермоиды, парез глазодвигательных мышц, редко микрофтальм, врожденные катаракты, колобомы сосудистого тракта, зрительного нерва.
Со стороны челюстно–лицевой системы имеется гипоплазия костей лица, что приводит к значительной асимметрии лица, резкое недоразвитие зубов.
Часто бывает аплазия ушей, гиперплазия лобных пазух, расщепление костей лица и деформация скелета. Иногда отмечается увеличение языка, отсутствие околоушной железы, гидроцефалия, поражение сердца и др. Наряду с типичными формами синдрома встречаются и атипичные, при которых имеется лишь часть симптомов.
Синдром Мейер–Швиккерата – Грютериха – Вейерса (околоденто–дигитальная дисплазия) – сочетаные поражения глаз, лица, зубов, пальцев, кистей, стоп. Глазные симптомы – эпикантус, узкие глазные щели, птоз, двусторонняя микрофтальмия, аномалия радужки в виде гипоплазии переднего листка, врожденная глаукома. Со стороны зубов – генерализованная дисплазия эмали с коричневым окрашиванием микродентия и олигодентия. Лицо с маленьким носом, гипоплазией крыльев носа и широкой переносицей. Из аномалий конечностей следует отметить изменение кожного покрова между пальцами, квадратный вид средней фаланги мизинца, гипоплазия или полное отсутствие средних фаланг нескольких пальцев, дистрофия ногтей или их отсутствие. Также могут быть микроцефалия, изменения носа, гипотрихоз и недостаточность пигментации кожи.
Синдром Ригера – это наследственая эктомезодермальная дисгенезия радужки и роговицы, сочетающаяся с зубочелюстными изменениями. Со стороны глаза может быть мегалокорнеа или микрокорнеа, плоская роговица, остатки мезенхимальной ткани в углу передней камеры, краевые сращения задней поверхности роговицы с передней поверхностью радужки, деформация зрачка, атрофия радужки с образованием сквозных дефектов, глаукома. Возможна врожденная катаракта, колобома радужки и сосудистой оболочки, косоглазие, дермоидные кисты у лимба, аномалии рефракции высокой степени.
Из общих проявлений имеются широкая переносица, гипоплазия верхней челюсти, расщелина неба, олигодентия, коническая форма передних зубов, дисплазия зубной эмали, гидроцефалия, пороки развития сердца, почек, позвоночника. У некоторых больных имеется низкорослость вследствие дефицита гормона роста.
Тип наследования аутосомно–доминантный.
Глава 23. Травмы органа зрения
Ораторы восхваляли глаз, певцы воспевали его, но действительная оценка глаза покоится в безмолвной тоске тех, кто имел глаз и лишился егоТравма (от греч. trauma – рана) – повреждение тканей организма человека или животного с нарушением их целости и функций, вызванное внешним воздействием, главным образом механическим и термическим.А. Грефе
Травматизм – совокупность вновь возникших травм в определенных группах населения.
Различают производственный (промышленный и сельскохозяйственный), бытовой, транспортный, военный, детский, спортивный и, в последние годы, криминальный травматизм.
Механизм травмы – контузия, проникающее ранение, осколочная травма, ожоги.
Характер травмы – непроникающая, проникающая.
Клиническая картина травмы органа зрения полиморфна: возможно повреждение как одной оболочки глаза, так и нескольких, а иногда и всех структур, что приводит к гибели глаза.
Особой тяжестью отличается травма глаз, сопровождающаяся внедрением в него одного или нескольких инородных тел, что обусловливает повышенный риск развития внутриглазного воспаления асептического, септического характера и на иммунной основе. Формирование шварт по ходу раневого канала и выраженные пролиферативные процессы, индуцируемые воспалительными реакциями, приводят к развитию тракционного синдрома, отслойке внутренних оболочек, анатомической и функциональной гибели глазного яблока.
В современных условиях в распоряжении врача имеются высокоинформативные методы диагностики.
Рентгенологическое исследование глаза и орбиты должно быть проведено сразу после осмотра больного и осуществления традиционных исследований. Результаты рентгенографии позволят оценить состояние костных стенок орбиты и околоносовых пазух, исключить наличие инородного тела в глазу и орбите, а в случае присутствия такового установить его локализацию.
Ультразвуковое исследование, которое проводят после рентгенологического, дает возможность уточнить и подтвердить его результаты, оценить состояние внутренних структур и оболочек глаза и орбиты. При ранениях, сопровождающихся внедрением множественных инородных тел в глаз, судить об их истинном количестве, о расположении осколков относительно друг друга и оболочек глаза можно лишь на основании результатов трехмерной эхолокации. Диагностика особенно сложна в случаях локализации осколков в оболочках заднего полюса и орбите.
Неоценимую помощь в диагностике повреждений орбиты и глаза оказывает компьютерная томография, позволяющая выявить рентгенонеконтрастные осколки и установить их локализацию, определить расположение осколков по отношению к оболочкам глаза и структурам орбиты (зрительному нерву, мышцам, костным образованиям); обнаружить множественные осколки в глазу и орбите.
Определение функциональной сохранности сетчатки и зрительного нерва помогает в ранней диагностике металлоза, когда необходимо решать вопрос о показаниях к удалению инородных тел и сроках его осуществления. На основании результатов электроретинографии можно прогнозировать исходы консервативного или хирургического лечения.
Анализ реакций гуморального и клеточного иммунитета при повреждениях органа зрения имеет важное значение, поскольку в комплексе с другими методами обследования позволяет оценить степень выраженности воспалительных изменений в глазу и установить показания к выполнению оперативного вмешательства, а также решить вопрос об удалении глазного яблока при угрозе развития симпатической офтальмии.
Флюоресцентную ангиографию проводят в тех случаях, когда оптические среды глаза прозрачны и решается вопрос о проведении отграничивающей или барьерной лазер–коагуляции при глубоком залегании осколка в сетчатке.
С целью уточнения магнитных свойств осколка использует электронную локацию.
Экзофтальмометрия показана при повреждениях орбиты.
Помимо описанных предоперационных диагностических методов, в ходе выполнения оперативного вмешательства проводят гониоскопию для визуализации инородных тел, локализующихся в углу передней камеры, трансиллюминацию – при диасклеральных операциях, ультразвуковую локацию осколка по мере вскрытия оболочек и приближения к нему, эндоскопический контроль в ходе операции и др.
На всех этапах реабилитации больных с повреждениями органа зрения важную роль играет консервативная терапия. В связи с многообразием клинических проявлений травмы глаза, его придаточного аппарата и орбиты представляется целесообразным отметить, что при назначении лекарственных препаратов необходимо применять средства, оказывающие воздействие не только на глаз, но и на весь организм в целом, так как травма влияет на психосоматическое состояние и иммунный статус пациента, снижая его защитные силы и создавая тем самым условия для развития тяжелых осложнений.
Травмы глазницы
Травмы глазницы, наблюдающиеся в мирное время, делят на бытовые, производственные, сельскохозяйственные, транспортные и др. В зависимости от механизма возникновения различают травмы, получаемые при падении, ударе тупым, длинным или острым предметом, а также огнестрельные ранения. В связи с разнообразием механизмов травмы одновременно могут наблюдаться контузии, открытые повреждения мягких тканей, переломы костных стенок, внедрение инородных тел в полость глазницы. Травмы могут быть изолированными или сочетаются с повреждениями головного мозга и околоносовых пазух.В зависимости от тяжести переломов стенок орбиты их симптомы различны: боли, затуманивание зрения вследствие шока, диплопия, которая возникает почти незамедлительно и может сохраняться долго. При переломах наблюдаются также отек и гематома век, сужение глазной щели, ограничение подвижности глазного яблока, энофтальм (или экзофтальм), птоз, подкожная эмфизема.
Ранения мягких тканей орбиты могут быть рваными, резаными, колотыми.
Переломы костных стенок возникают при ударах тяжелыми предметами: топором, ломом, кирпичом и т. д. Открытыми переломами костных стенок орбиты называют такие повреждения, при которых плоскость перелома сообщается с внешней средой.
Во многих случаях травмы орбиты со п ро вожд аются по врежде! I ия м и глазного яблока. Такие ранения называют сочетанными. Нередко при ранениях орбиты происходит внедрение инородного тела в ее полость.
Контузии глазницы
К контузиям относятся тупые травмы мягких тканей орбиты, при которых не отмечается видимых нарушений их анатомической целости.Больные с контузиями орбиты жалуются на тошноту и рвоту. У них выявляют брадикардию, значительно выраженную гематому век, субконъюнктивальное кровоизлияние, ограничение подвижности глазного яблока, экзофтальм. У пострадавших может отмечаться снижение зрения или полная его потеря.
После контузий мягких тканей орбиты могут возникнуть вторичный менингит и абсцесс головного мозга, что связано с проникновением инфекции из нагноившейся гематомы орбиты в полость черепа. Следствием контузии может быть частичная или полная атрофия зрительного нерва.
Больным с контузиями любой степени тяжести назначают строгий постельный режим, местно – холод, внутривенно – 30 мл 10% раствора натрия хлорида, внутримышечно – 10 мл 25% раствора магния сульфата, внутрь – глицерин по 1 – 1,5 г на 1 кг массы тела. В качестве диуретиков применяют диакарб по 1–2 таблетки 2 раза в день в течение 3 дней, лазикс (фуросемид) внутримышечно или внутривенно в дозе 20–60 мг. Для уменьшения проницаемости сосудов назначают рутин (0,05–0,1 г) с аскорбиновой кислотой внутрь 2–3 раза в день. Показано применение гемостатических средств, а также ангиопротекторов: переливание по 50–100 мл одногруппной крови, внутривенные вливания 10% раствора кальция хлорида по 20 мл, прием аминокапроновой кислоты внутрь по 2–3 г 3–5 раз в день или внутривенное (капельное) введение 5% раствора (до 100 мл), фибриноген внутривенно (капельно) по 3–4 мл, химотрипсин в виде компрессов. Через 2–3 нед после травмы можно начать ультразвуковую терапию.
Для улучшения обмена веществ в зрительном нерве применяют препараты, воздействующие на трофику тканей: неробол (по 0,005 г 2 раза в день), ретаболил (внутримышечно 1 мл в неделю), пентоксил (по 0,2–0,4 г 3–4 раза в день) и метилурацил (по 0,5 г 3–4 раза в день) внутрь. Антиоксиданты и витамины (1 мл 5% раствора α–токоферола, внутримышечно эмоксипин по 0,5 мл под конъюнктиву или по 1 мл внутримышечно витамины группы В) способствуют восстановлению трофических расстройств.
Показанием к хирургическому лечению является обширное кровоизлияние в орбиту, проявляющееся значительным экзофтальмом, смещением глазного яблока, резким ограничением подвижности его в одну сторону и не подвергающееся обратному развитию на 3–4–й день после получения травмы.
Ранения мягких тканей глазницы
Раны мягких тканей глазницы могут быть рваными, резаными и колотыми.Особенностями рваных ран являются выпадение жировой клетчатки, повреждение наружных мышц глаза, ранение слезной железы; могут отмечаться также опущение верхнего века, офтальмоплегия, экзофтальм.
При рваных ранах мягких тканей в первую очередь производят их ревизию (определение размеров и глубины раны, а также отношения ее к костным стенкам орбиты), при этом необходимо решить основной вопрос: не распространяется ли раневой канал в полость черепа и околоносовые пазухи. Всем больным с травмами мягких тканей орбиты производят рентгенографию в двух проекциях.
Первичная хирургическая обработка рваных ран состоит в экономном иссечении загрязненных краев в пределах 0,1 – 1 мм, иногда можно ограничиться их подравниванием. Раневой канал промывают растворами фурацилина, этакридина лактата (риванола) или перекиси водорода. При наличии показаний выполняют пластику прилежащими тканями.
При колотых ранах экзофтальм, офтальмоплегия, опущение верхнего века часто свидетельствуют о глубоком распространении раневого канала и повреждении нервных стволов и сосудов у вершины орбиты ранящим предметом. Одним из факторов, определяющих тяжесть колотых ран, служит повреждение зрительного нерва.
Тактика в отношении колотых ран мягких тканей глазницы аналогична той, которую применяют при колотых ранениях любой локализации: производят тщательную ревизию раневого канала и первичную хирургическую обработку. Мягкие ткани рассекают на протяжении 2–2,5 см; раневой канал исследуют осторожно с соблюдением принципа максимального щажения мышцы, поднимающей верхнее веко, наружных мышц глаза, сосудов и нервов. После исключения проникновения раневого канала в полость черепа или околоносовые пазухи и наличия инородного тела в орбите на рану накладывают швы.
При резаных ранах производят ревизию раны и первичную хирургическую обработку с восстановлением анатомических соотношений мягких тканей орбиты.
При сквозном ранении глаза с наличием инородного тела в орбите клиническая картина характеризуется полиморфизмом патологических изменений глазного яблока. Больные предъявляют жалобы на снижение зрения, болевые ощущения, смещение глазного яблока. При обследовании у них выявляют воспаление тканей орбиты, поражение зрительного нерва, синдром верхней глазничной щели, невралгию нижнеглазничного нерва, энофтальм, обусловленный атрофией жировой клетчатки, или экзофтальм как следствие ретробульбарной гематомы (рис. 23.1).
Удалению подлежат деревянные осколки, а также осколки, содержащие медь и железо, при развитии гнойного воспаления в тканях орбиты – и осколки, локализующиеся в зоне цилиарного узла и вблизи зрительного нерва, при наличии болевого синдрома.
При касательном ранении внедрившееся в орбиту инородное тело, особенно фрагмент дерева или тростника, вызывает слепоту при повреждении зрительного нерва и флегмону орбиты, представляющую угрозу для жизни больного.
Внедрение металлических осколков в орбиту способствует развитию воспаления мягких тканей, экзофтальма, миоза, ретробульбарной гематомы, снижению чувствительности роговицы, при этом острота зрения может оставаться высокой.
Лечение больных включает комплекс консервативных мероприятий: противовоспалительные средства (антибиотики, стероидные и нестероидные препараты), гемостатики, ферментотерапию, препараты, улучшающие репаративные процессы и уменьшающие формирование фиброзной ткани и шварт вокруг осколка. При отсутствии эффекта от медикаментозной терапии производят удаление инородных тел из орбиты. После уточнения места расположения инородного тела в глазнице в этой зоне выполняют орбитотомию, послойно разделяя ткани и осторожно продвигаясь к инородному телу. В том случае, если прощупывается конгломерат соединительной ткани, окружающий осколок, его удаляют с капсулой единым блоком, затем производят тщательную ревизию места вмешательства с удалением всех мелких инородных тел.
Травмы век
Травматические повреждения вспомогательных органов глаза весьма разнообразны. Практически невозможно найти двух больных с одинаковыми по типу и механизму ранениями.Различают резаные, рваные и колотые раны век. Возможны изолированные повреждения кожи, мышцы, хрящевой пластинки, конъюнктивы или их различные комбинации. Наиболее сложны для репозиции рваные раны. Если неточное сопоставление краев кожной раны может не иметь неблагоприятных последствий, то неправильное ушивание хрящевой пластинки практически всегда приводит к стойкой деформации века.
Первостепенная задача хирургической обработки – создание правильного контура края века, причем не в грубом приближении, а с большой точностью. Нужно стремиться к идеальному сопоставлению линии ресниц, а также переднего и заднего ребра века, поскольку только в этом случае можно избежать образования уродливой выемки на краю века. Затем приступают к восстановлению целости остальной хрящевой пластинки. Если края раны размозжены, то предварительно необходимо их ровно срезать, создав новые параллельные, хорошо сопоставимые раневые поверхности. Вопрос о последовательности наложения швов решают индивидуально в каждом конкретном случае. Рану хряща можно ушить двумя способами: наложением рассасывающихся швов 6/0 на передние губы раны хряща или нерассасывающихся нитей той же толщины на задние губы раны. Преимущество первого способа состоит в отсутствии контакта шовного материала с роговицей.
Первоначальную адаптацию краев кожной раны производят отдельными швами в узловых точках (обычно это места изломов по ходу раны), окончательную – непрерывным швом или отдельными швами. Наиболее подходящий шовный материал для закрытия раны на нежной коже век – шелк или нейлон 6/0–8/0. Интервал между стежками на горизонтальной ране может доходить до 5 мм, а на вертикальной не должен быть больше 2 мм. Оптимальное расстояние между местом вкола иглы и краем раны при указанной толщине нити составляет 1 мм. Степень натяжения шва зависит от слоя: на хряще узел завязывают с большим натяжением, мышечно–фасциальный слой ушивают без особых усилий, кожный шов затягивают до хорошего сопоставления краев с учетом инфильтрационной анестезии и отека тканей.
В случае наличия дефекта ткани первичная хирургическая обработка раны более трудоемкая. При небольших дефектах края раны сближают и фиксируют, используя технику прямого сшивания. Неровные или размозженные края срезают таким образом, чтобы сопоставляемые поверхности были комплементарны по конфигурации.
После хирургического лечения с целью профилактики инфекции и улучшения репарации поврежденных тканей назначают антисептики (витабакт, цинкборные капли, 0,01% раствор мирамистина), антибиотики (гентамицин – 0,3–0,5% раствор, левомицетин – 0,25%, тобрекс – 0,3%, оксацин – 0,3%, колбиоцин). Частота инстилляций и длительность лечения зависят от характера повреждения и динамики процесса. Из антибактериальных мазей используют 1% тетрациклиновую и 1% эритромициновую. В ряде случаев показано применение в виде инстилляций и мазей комбинированных препаратов (софрадекс, макситрол, гаразон, эубитал), а также стимуляторов репарации (актовегин, солкосерил, баларпан, витасик, тауфон и др.). Безусловно, не следует назначать все препараты одновременно, а нужно выбрать те из них, которые показаны в конкретном случае. При наличии инфекции выбор препарата зависит от результата микробиологического исследования.
Повреждения глазного яблока
Различают тупые травмы (контузии), непроникающие и проникающие травмы глазного яблока.Контузии глазного яблока
Сила удара, вызвавшего контузию, зависит от кинетической энергии, складывающейся из массы и скорости движения ранящего предмета.Контузия может быть прямой, т. е. возникать при непосредственном ударе предмета о глаз, или непрямой, т. е. являться следствием сотрясения туловища и лицевого скелета от ударной волны при взрывах, возможно также сочетание этих воздействий.
В зависимости от силы, направления удара и положения глаза в орбите в момент контузии травматические изменения могут быть минимальными или, наоборот, настолько значительными, что происходит разрыв склеральной капсулы (рис. 23.2). Повреждения склеры при тупом ударе идут изнутри кнаружи, внутренние слои склеры разрываются раньше, чем наружные, при этом возникают как полные разрывы, так и надрывы склеры. Клинически последние обычно невидимы через конъюнктиву.
Для контузионной травмы характерны разрывы оболочек глаза: более эластичные оболочки, например сетчатка, растягиваются, а менее эластичные (мембрана Бруха, пигментный эпителий, сосудистые ткани, десцеметова оболочка) рвутся. При умеренной силе травматического воздействия разрывы на глазном дне расположены концентрично диску, при огнестрельных контузиях разрывы оболочек глазного дна имеют полигональный вид. Поскольку на уровне экватора сталкиваются различные течения волн сдавливания, здесь происходят так называемые противоразрывы, т. е. разрывы не в месте удара, а с противоположной стороны, отрывы сетчатки, разрывы сосудистой оболочки и пр.
Особенности анатомической структуры глаза, смена сред и оболочек различной плотности, более плотное прикрепление сосудистой оболочки в местах прохождения цилиарных сосудов, сокращение цилиарной мышцы в ответ на удар, прикрепление сетчатки у диска зрительного нерва и зубчатой линии цилиарного тела обусловливают расположение разрывов и отрывов оболочек глаза и величину смещения стекловидного тела. При этом нельзя не учитывать и возрастной фактор, а также состояние глаза до контузии. Например, при высокой близорукости, сопровождающейся комплексом дегенеративных изменений в тканях (кистозное перерождение сетчатки, изменение структуры стекловидного тела, ретиношизис), контузия глаза может вызвать более тяжелые травматические изменения, чем в здоровых глазах. Все дегенеративные изменения, существовавшие в глазу до травмы, при контузии обусловливают большую вероятность разрывов сетчатки и отрывов от зубчатой линии.
Помимо болей в черепно–лицевой области на стороне поражения, у большинства больных в первые дни и часы после травмы отмечаются головная боль, головокружение, легкая тошнота, затруднения при попытке чтения из–за нарушенной конвергенции.
Самостоятельные боли в глазу появляются при гипертензии, больших ретробульбарных гематомах или размозженных ранах век либо краев орбиты.
В первые часы после травмы смешанная инъекция глазного яблока выражена, как правило, значительно слабее, чем в последующие дни. Она нарастает в течение 1–х суток, сохраняется на одном уровне 3–4 дня и постепенно к концу 1–й – началу 2–й недели начинает уменьшаться.
Отсутствие инъекции глазного яблока при осмотре больного в условиях естественного освещения в стадииклинического выздоровления не означает, что сосудистая система контуженного глазного яблока стала такой же, как и в здоровом глазу. Для того чтобы убедиться в этом, достаточно дотронуться пальцами до век больного или перевести его в темную комнату: при осмотре с помощью офтальмоскопа или щелевой лампы можно видеть, как быстро нарастает гиперемия сосудов конъюнктивы контуженного глазного яблока, в то время как в здоровом глазу этого не происходит.
Ранения часто сочетаются с субконъюнктивальными кровоизлияниями и разрывами склеры (рис. 23.3), поэтому необходимо проверить целость склеральной оболочки.
При контузиях глазного яблока часто возникают кровоизлияния в разных отделах глаза.
Субконъюнктивальные кровоизлияния по степени выраженности очень разнообразны. Самые небольшие из них исчезают быстро, в течение нескольких дней, и не оказывают заметного влияния на течение постконтузионного периода. Более обширные плоские кровоизлияния, занимающие половину поверхности глазного яблока или ббльшую ее часть, рассасываются в течение 2–3 нед. После массивных субконъюнктивальных кровоизлияний в течение нескольких месяцев сохраняется серовато–желтушная окрашенность склеры.
Точечные кровоизлияния в толщу роговицы у лимба рассасываются медленно.
Кровоизлияние в переднюю камеру (гифема) – наиболее частый симптом контузии глаза (рис. 23.4). Скопление большого количества крови в передней камере приводит к резкому снижению зрения из–за имбибиции роговицы кровью (рис. 23.5). Небольшие кровоизлияния в переднюю камеру рассасываются бесследно.
Если кровь попадает в стекловидное тело и оно оказывается полностью пронизанным кровью, то такое состояние называют гемофтальмом. В этих случаях острота зрения снижается до светоощущения (иногда с неправильной проецией света).
Частичные кровоизлияния в стекловидное тело офтальмоскопически видны в виде точек или хлопьев либо имеют вид красноватых масс разнообразной формы. Кровоизлияние в стекловидное тело рассасывается значительно медленнее, чем гифема. Частичное кровоизлияние и полный гемофтальм сопровождаются образованием стойких помутнений, формированием шварт и общим огрубением остова стекловидного тела.
Изменившийся вид крови, находящейся в стекловидном теле, настолько отличается от первоначального, что постоянно служит причиной диагностических ошибок: ее принимают за опухоль, солитарный туберкул или отслойку сетчатки. Ультразвуковое сканирование и КТ–диагностика помогают установить правильный диагноз.
Медленно рассасываются ретролентальные и преретинальные кровоизлияния. Рассасывание ускоряется при нарушении передней пограничной мембраны стекловидного тела или врастании соединительнотканного тяжа в стекловидное тело. В области желтого пятна нередко встречаются преретинальные кровоизлияния, в которых кровь длительное время остается жидкой.
Кровоизлияния под сосудистую оболочку отслаивают хориоидею и выпячивают ее в стекловидное тело в виде бугра.
Поражение роговицы. Наиболее распространенной формой поражения роговицы являются эрозии разной величины. Скорость эпителизации роговицы зависит от величины дефекта: локальные эрозии закрываются за несколько часов, эпителизация больших эрозий затягивается на неделю. Обычно эрозия роговицы не оказывает заметного влияния на остроту зрения.
Повреждения радужки. При контузии чаще всего изменяется зрачок. Он приобретает форму вытянутого овала, грушевидную или полигональную форму из–за надрывов или разрывов сфинктера.
Парез или паралич сфинктера вызывает паралитический мидриаз. При этом существенно ухудшается зрение, особенно вблизи.
При посттравматическом мидриазе сохраняется очень вялая или отсутствует реакция на свет, однако остается реакция на мидриатики. При закапывании атропина в условиях сохранного дилататора зрачок максимально расширяется и больше не сужается, так как сфинктер парализован. В связи с этим нельзя назначать мидриатики даже однократно. Парез цилиарной мышцы сопровождается расстройством аккомодации. При обездвиженном зрачке образуются круговые задние синехии, возникают зрачковый блок и вторичная глаукома.
Частичный отрыв (иридодиализ) корня радужки или ее полный отрыв, как правило, сопровождается кровоизлиянием в полость глаза. В этих случаях назначают гемостатическую терапию. При больших отрывах, закрывающих область зрачка, производят хирургическую репозицию.
Катаракта и смещения хрусталика. При тупых травмах часто развивается катаракта, происходят смещения хрусталика – вывихи и подвывихи (рис. 23.6; см. главу 13).
Клинически передние и задние субкапсулярные катаракты проявляются в конце 1–й – начале 2–й недели. Консервативное лечение их, как правило, неэффективно. Острота зрения контуженного глаза зависит от расположения помутнений в хрусталике: при центральной локализации зрение значительно снижается, а при расположении вблизи зрачкового края зрение сохраняется и может оставаться при многолетнем наблюдении на одном и том же уровне.
При полном вывихе хрусталика в переднюю или заднюю камеру показано его удаление.
Наиболее частым видом поражения сосудистой оболочки являются разрывы, всегда сопровождающиеся кровоизлияниями. Следует подчеркнуть, что в этих случаях вначале, как правило, чаще всего устанавливают диагноз "кровоизлияние в сосудистую оболочку", так как только после рассасывания крови становятся видимыми беловатые или розоватые полосы разрыва сосудистой оболочки. Чаще разрывы располагаются концентрично диску, реже – в макулярной или парамакулярной области и на периферии. Следствием травмы может быть пери папиллярная атрофия хориоидеи, обусловленная растяжением задних отделов склеры и повреждением коротких задних цилиарных сосудов.
К изменениям ресничного тела относится его отслойка – циклодиализ, приводящий к свободному сообщению между передней камерой и супрахориоидальным пространством. Циклоскопия позволяет прижизненно увидеть поверхностные или более глубокие разрывы ресничного тела после рассасывания гифем.
Наиболее частая патология сетчатки при тупой травме – берлиновское помутнение и кровоизлияние в сетчатку, которые обнаруживают в первые дни после травмы. По интенсивности берлиновского помутнения сетчатки (от бледно–серого до молочно–белого) можно судить о тяжести поражения: чем белее сетчатка, тем медленнее исчезает помутнение.
После рассасывания кровоизлияний в сетчатке остаются помутнения, которые чаще располагаются в центральной части, но одновременно могут локализоваться и на периферии сетчатки. Обширные кровоизлияния в сетчатке оставляют после себя грубые очаги (рис. 23.7).
Причиной атрофии зрительного нерва после контузии глаза могут быть длительный приступ вторичной глаукомы, повреждение зрительного нерва или сосудов, питающих зрительный нерв.
Из множества разрывов сетчатки разного вида для контузии наиболее характерны отрывы от зубчатой линии, макулярные разрывы и гигантские атипические разрывы. При макулярных разрывах происходит значительное снижение центрального зрения, а при остальных разрывах степень его снижения зависит от расположения их по отношению к макулярной области. Возникновение и распространение отслойки сетчатки в некоторых случаях происходят в очень отдаленные сроки.
Лечение постконтузионных повреждений зависит от клинических проявлений, как правило, это комплексное использование лекарственных средств и оперативных вмешательств.
Консервативная терапия контузионных повреждений глаза заключается в использовании следующих групп фармакологических препаратов: ■ антимикробных средств для местного и общего применения, в том числе антибиотиков и антисептиков ■ ферментов в виде субконъюнктивальных инъекций гемазы (5.000 ME на изотоническом растворе натрия хлорида, всего 10 инъекций), фибринолизина (600–700 ЕД ежедневно, всего 5–10 инъекций), лекозима (ежедневно, всего 5–10 инъекций), лидазы (6–12 ЕД ежедневно, всего 5–10 инъекций), химотрипсина в виде компрессов (2–3 раза) и др. ■ ангиопротекторов: дицинон (этамзилат натрия) – парабульбарно по 40–60 мг (5–10 раз), внутривенно – 250–300 мг (8 инъекций) или в таблетках 3–4 раза в день в течение 10–30 дней, аскорутин по 1–2 таблетке 3 раза в день в течение 10–30 дней, аминокапроновая кислота внутривенно 100–300 мг в день ■ диуретиков: диакарб внутрь, лазикс внутримышечно или внутривенно, глицерол внутрь, маннитол – 10–20% раствор внутривенно ■ антигистаминных препаратов: супрастин, тавегил, кларитин, димедрол, диазолин в таблетках или внутримышечно ■ дезинтоксикационных средств: для инфузий изотонический раствор натрия хлорида, гемодез, реополиглюкин, глюкоза, полифепам ■ анальгетиков и транквилизаторов: трамал, реланиум, феназепам и др. в виде таблеток или внутримышечных инъекций.
В зависимости от клинических проявлений контузии глаза производят разные оперативные вмешательства. Так, при субконъюнктивальном разрыве склеры показана хирургическая обработка раны, иногда с применением склерального трансплантата; при стойкой гифеме необходимо вымыть кровь из передней камеры и заполнить ее изотоническим раствором натрия хлорида. В случаях образования гемофтальма время выполнения и объем витрэктомии зависят от давности травмы, массивности кровоизлияния, эффективности консервативной терапии и функциональной сохранности сетчатки и зрительного нерва. При кровоизлияниях под сосудистую оболочку показана трепанация склеры с выпусканием крови. В случаях повреждения радужки и возникновения разрывов сфинктера зрачка, оказывающих существенное влияние на зрительные функции, необходима иридопластика. При посттравматическом паралитическом мидриазе по краю зрачка накладывают кисетный круговой шов и стягивают его так, чтобы диаметр зрачка был равен 3 мм. При наличии катаракты или дислокации хрусталика показано его удаление. Отслойку цилиарного тела, которая часто приводит к гипотонии и сопровождается угрозой перехода в субатрофию глазного яблока, устраняют хирургически: выпускают жидкость из супрахориоидального пространства и подшивают цилиарное тело на фоне противовоспалительной терапии. Лечение отслойки сетчатки хирургическое (см. главу 15).
Непроникающие ранения глазного яблока
Непропикающие ранения глазного яблока можно классифицировать по двум признакам: по локализации раны (роговица, склера, корнеосклеральная зона) и по отсутствию или наличию одного либо нескольких инородных тел.Непроникающие ранения характеризуются раздражением слизистой оболочки глаза, слезотечением, светобоязнью, болезненностью, иногда значительным снижением зрения при локализации процесса в оптической зоне.
Осмотр пациента проводят с большой осторожностью. Выворачивают верхнее и нижнее веки, чтобы обнаружить инородные тела на конъюнктиве век и в сводах. Инородное тело из роговицы удаляют с помощью копья, долотца, бора в кабинете неотложной помощи. В случаях глубокого залегания осколка и его частичного выхода в переднюю камеру лучше производить операцию в стационарных условиях, используя соответствующие хирургические методики.
Непрободные раны роговицы могут иметь различную форму, глубину и локализацию, и вопрос о необходимости их хирургической обработки решают индивидуально. Для установления глубины раны используют биомикроскопию, кроме того, надавливая стеклянной палочкой на фиброзную капсулу глаза вблизи места поражения, определяют, наблюдаются ли фильтрация влаги передней камеры и расхождение краев раны. Наиболее показательной является проба с флюоресцеином, на основании результатов которой с уверенностью можно судить о наличии или отсутствии проникающего ранения. При небольшой ране линейной формы с хорошо адаптированными и сомкнутыми краями от наложения шва можно воздержаться, однако в случаях обширных лоскутных, глубоких скальпированных ран предпочтительнее сопоставить их края узловыми швами 10/0.
Из медикаментозных препаратов рекомендуют гентамицин, левомицетин, тобрекс, витабакт, цинк–борные капли в виде инстилляций, мази (тетраци кл и новая, эритром ици новая, колбиоциновая, тиаминовая) и гели (солкосерил, актовегин), оказывающие антимикробное и антисептическое действие, а также стимуляторы репарации.
Длительность и частота применения лекарственных средств зависят от динамики течения процесса, в ряде случаев необходимо использовать антибиотики и комбинированные препараты в виде субконъюнктивальных инъекций, а также мидриатики в зависимости от степени выраженности воспалительной реакции глаза.
Проникающие ранения глазного яблока
Известно, что при ранениях любого типа к анамнестическим сведениям следует относиться с определенной осторожностью. Необходимо всегда предвидеть медико–юридические последствия повреждения глаз, и это увеличивает важность подробной записи анамнеза и результатов обследования. Особенно внимательным следует быть к анамнестическим сведениям, которые дают дети. Нередко ребенок получает травму во время совершения действий, от выполнения которых его постоянно предостерегали, поэтому он скрывает ее истинную причину.Очистив рану влажным тампоном от кровяных сгустков и посторонних включений, следует осмотреть конъюнктиву, вывернув нижнее веко и приподняв (но не выворачивать) верхнее.
Существенное значение имеют наличие и время появления субконъюнктивальных кровоизлияний. Кровоизлияние, возникшее непосредственно после травмы, может быть расценено и как субконъюнктивальный разрыв склеры. Кровоподтек же, появившийся через несколько дней после ранения, особенно в нижнем своде, позволяет заподозрить трещины в основании черепа ("симптом очков").
Клиническая картина проникающего ранения глазного яблока характеризуется нарушением целости капсулы глаза. Наличие гипотонии, хотя и не является признаком, характерным только для проникающего ранения, так как может появиться и при контузии, все же служит важным диагностическим признаком в первый момент после проникающего ранения.
Раны при проникающих ранениях роговицы могут быть линейными, лоскутными с гладкими и рваными неровными краями, зияющими с дефектом ткани, а локализация ран – центральной, меридиональной, экваториальной (рис. 23.8). Ранения роговицы и корнеосклеральной области могут осложняться выпадением и дефектом радужки, травмой хрусталика и стекловидного тела с последующим развитием травматической катаракты, гемофтальма. При инфицировании раны могут развиться иридоциклит, эндофтальмит (гнойные очаги в стекловидном теле) и в ряде случаев панофтальмит (воспаление всех оболочек глаза).
Первая помощь. В экстремальных ситуациях следует наложить стерильную повязку на глаз и направить пострадавшего в специализированное учреждение. При любом ранении век и глазного яблока требуется ввести противостолбнячную сыворотку. В дальнейшем назначают седативные средства для снятия стресса и антибиотики широкого спектра действия до получения результатов бактериологического исследования отделяемого конъюнктивальной полости.
Рентгенологическое исследование позволит исключить или подтвердить наличие инородного тела. Ультразвуковое исследование поможет определить наличие изменений в стекловидном теле, выявить отслойку сетчатки, инородное тело. В 1–е сутки после травмы производят первичную хирургическую обработку раны глазного яблока и назначают иммунодепрессанты.
Обработка проникающих ран роговицы. Основной задачей хирурга является по возможности полное восстановление анатомической структуры органа или ткани с целью максимального сохранения функции.
При операциях на роговице накладывают глубокие швы из некрученого однонитевого нейлона 10/0 на ⅔ ее толщины на расстоянии 1 мм от краев раны. Расстояние между швами должно быть не более 1 мм, а при небольших ранах – 2 мм. Удаление швов производят через 1,5–2 мес. Для обработки звездчатых проникающих ран лучше всего использовать методику наложения кисетного шва, принцип которого заключается в проведении через все углы рваной раны кругового шва, чтобы стянуть его в центре, а затем обязательно накладывают отдельные швы на все участки, которые отходят от центра раны.
В 1–е сутки после проникающего ранения роговицы с выпадением радужки считается целесообразным производить ее вправление с помощью мидриатиков и хирургического шпателя, если она не размозжена и не загрязнена. Предварительно радужку орошают раствором антибиотика. При проникающем ранении роговицы, сопровождающемся травмой хрусталика, рекомендуется выполнить экстракцию катаракты и наложить швы на края раны.
В тех случаях, когда имеется размозженная рана роговицы и соединить ее края практически невозможно, производят пересадку роговицы.
Ранения склеры и корнеосклеральной области редко бывают изолированными. Тяжесть их определяется сопутствующими осложнениями: выпадением сосудистой оболочки, кровоизлияниями в стекловидное тело и т. д. Наиболее тяжелые повреждения склеры сопровождаются дефектом ткани, причем наибольшие трудности возникают при ее субконъюнктивальных разрывах. При этом основными задачами офтальмолога являются диагностика и хирургическая обработка ранений, позволяющая восстановить герметичность глазного яблока и структурные соотношения внутри глаза. В ходе обработки раны склеры производят ревизию раны с широким разрезом конъюнктивы. В случае небольшого выпадения и ущемления в ране ресничного тела или сосудистой оболочки после орошения ткани антибиотиками рекомендуется осторожно вправить их и наложить швы. При проникающих ранениях глазного яблока любой локализации проводят местное лечение и, кроме того, принимают меры для снятия стресса у больного, профилактики инфекций, коррекции иммунологического статуса.
Клиническая картина при проникающих ранениях глаза с внедрением инородных тел. При подозрении на попадание инородного тела в глаз большое значение имеют анамнестические данные. Тщательно собранные сведения о механизме травмы часто играют решающую роль в определении тактики лечения такого больного.
В тех случаях, когда осколок проходит через склеру за пределами видимой части глаза, трудно обнаружить входное отверстие. При ранах роговицы значительных размеров может отсутствовать передняя камера или наблюдаются кровоизлияния в нее. Если осколок внедрился в глаз не по центру, то при биомикроскопии не всегда можно увидеть отверстие в радужке. При центральном расположении раны инородное тело может остаться в хрусталике или проникает в задний отдел глаза.
Кровоизлияние в стекловидное тело различной интенсивности чаще наблюдается при травме цилиарного тела или сосудистой оболочки инородным телом. При внедрении инородного тела больших размеров клинически определяется зияние раны роговицы или склеры с выпадением сосудистой оболочки и стекловидного тела. При биомикроскопии инородное тело выявляют в передней камере, хрусталике, стекловидном теле или на глазном дне.
При длительном пребывании железосодержащего инородного тела в глазу проявляются симптомы сидероза. В роговице появляется пигментация коричневого цвета вокруг осколка, радужка приобретает более темную или желто–бурую окраску, в углу передней камеры при гониоскопии также обнаруживают отложения пигмента, в хрусталике наряду с помутнениями, вызванными его травмой, под передней капсулой наблюдаются отложения коричневых зерен пигмента.
В том случае, если в глазу длительное время находится медьсодержащее инородное тело, в оболочках и жидкостях глаза появляются признаки халькоза. В роговице видны мельчайшие зерна пигмента голубого, золотисто–голубого и зеленоватого цвета. Влага передней камеры приобретает золотисто–зеленоватый оттенок. Радужка отличается по цвету от радужки другого глаза, окрашена в зеленоватый или зеленовато–желтый цвет, у зрачкового края отмечаются отложения коричневого пигмента, при гониоскопии обнаруживают усиление пигментации зоны корнеосклеральных трабекул. На передней капсуле хрусталика появляется помутнение в виде диска с желтоватым оттенком (рис. 23.9), которое в поздней стадии напоминает головку цветущего подсолнуха. Желтовато–зеленоватый оттенок приобретают фибриллы стекловидного тела, которое в более поздние сроки имеет кирпично–красный оттенок. Халькоз сетчатки наблюдается редко, при этом окрашивается только область желтого пятна в медно–красный цвет.
Удаление инородных тел из роговицы. Даже очень мелкие инородные тела в роговице могут стать причиной развития воспалительных инфильтратов, которые затем приводят к ее помутнению (рис. 23.10).
Инородные тела, локализующиеся в поверхностных слоях роговицы, иногда выпадают самостоятельно. Для удаления поверхностно расположенных инородных тел, кроме специальных инструментов, можно использовать иглы, пинцеты, зубной бор, осколок бритвенного лезвия. Труднее извлечь инородное тело из стромы роговицы. После закапывания 1% раствора дикаина над местом расположения осколка делают надрез роговицы линейным ножом или бритвенным лезвием. При этом нужно соблюдать осторожность, чтобы не протолкнуть осколок в переднюю камеру. Если инородное тело не удается извлечь магнитом, то его удаляют копьем или иглой. Для удаления магнитных инородных тел из передней камеры над осколком делают разрез, в который вводят наконечник магнита. Инородное тело, локализующееся в хрусталике (рис. 23.11), удаляют магнитом после вскрытия передней камеры или вместе с хрусталиком в случае амагнитной природы осколка с последующей интраокулярной коррекцией афакии.
Из оболочек переднего отдела глаза инородное тело удаляют через произведенный над ним разрез склеры с помощью магнита. Если инородное тело не удалось извлечь магнитом, его удаляют пинцетом.
Наибольшие трудности возникают при удалении инородных тел, расположенных в стекловидном теле, приоболочечно или частично в оболочках заднего полюса глаза (рис. 23.12). С этой целью применяют трансвитреальный метод с подходом через плоскую часть ресничного тела. После обычной предоперационной подготовки с созданием медикаментозного мидриаза глазное яблоко фиксируют лигатурой так, чтобы при прямом освещении микроскопа через контактную линзу инородное тело было видно в центре поля зрения. Через склеральный разрез под офтальмоскопическим контролем к инородному телу подводят инструменты – цанговый пинцет с сомкнутыми браншами, магнитзоид, аспирационное устройство. Если инородное тело плотно фиксировано, пересекают шварту специальными ножницами или витреофагом, захватывают инородное тело и извлекают. Под конъюнктиву вводят антибиотики широкого спектра действия и корти костеро иды.
Перед трансвитреальным удалением инородного тела, расположенного в оболочках заднего полюса глаза, при прозрачных оптических средах производят предварительную лазер–коагуляцию вокруг осколка для профилактики отслойки сетчатки; при мутных средах (травматическая катаракта, помутнение стекловидного тела) сначала выполняют экстракцию катаракты, витрэктомию с удалением осколка и одновременно профилактическую лазеркоагуляцию с помощью эндолазера.
При проникающих ранениях глаза с внедрением инородных тел, помимо выполнения оперативных вмешательств, требуется назначение разнообразных лекарственных средств, поскольку, как правило, эти ранения осложняются посттравматическим гемофтальмом, развитием инфекции, стойкой гипотонией или гипертензией, выраженными рубцовыми изменениями фиброзной капсулы и внутренних структур глаза, что может привести к деформациям, функциональной и косметической неполноценности.
В ранние сроки после ранения показаны инстилляции антисептиков и антибиотиков, а также инъекции под конъюнктиву антибиотиков широкого спектра действия (гентамицин, ампициллин, линкомицин, клафоран) для профилактики внутриглазной инфекции. Можно также принимать внутрь таривид (по 200 мг в день в течение 7–10 дней), квинтор (в дозе 250–500 мг 2 раза в день 7 дней), сумамед (по 500 мг 3 дня), максаквин (в дозе 400 мг 7–10 дней). Местно в виде капель назначают антибиотики и глюкокортикостероидные препараты (софрадекс, макситрол, гаразон, дексагентамицин, тобрадекс, максидекс, дексапос и Др.).
Хороший эффект дают несгероидные противовоспалительные препараты (наклоф, диклоф) в виде капель. При необходимости используют индометацин, реопирин, бутадион, метиндол, ибупрофен, вольтарен и др. (в таблетках).
В зависимости от клинических проявлений процесса назначают ангиопротекторы, стимуляторы репарации, миотики или мидриатики, антигипертензивные препараты и диуретики.
Внутриглазная раневая инфекция. Эндофтальмит
Внутриглазная раневая инфекция – одно из наиболее тяжелых осложнений проникающих ранений глаза. Частота ее развития, по данным разных авторов, колеблется в широких пределах – от 6 до 24%. Слепота и гибель глаза в результате эндофтальмита наблюдаются в 60–80% случаев.Основными источниками внутриглазной раневой инфекции при проникающих ранениях глаза являются микрофлора ранящего предмета, в том числе внутриглазного инородного тела, а также микроорганизмы, присутствующие в конъюнктивальном мешке. Микробы проникают в полость глазного яблока непосредственно в момент ранения (первичная микробная инвазия), но могут попасть туда спустя некоторое время после травмы (вторичная микробная инвазия). Если в первом случае раневая инфекция развивается, как правило, в первые 2–3 сут после проникающего ранения глаза, то во втором ее клинические признаки могут проявиться в более поздние сроки. Вторичной микробной экзогенной инвазии способствуют недостаточная адаптация краев раны, ее зияние, размозжение краев, случайное ранение фильтрующего рубца, очаги хронической инфекции в организме (кариозные зубы, синуситы) и т. д.
Наиболее часто (до 82,2% случаев внутриглазного инфекционного поражения) возбудителем раневой инфекции глаза является стафилококк. Другие микроорганизмы значительно реже служат причиной развития данного патологического процесса. Обращают на себя внимание участившиеся в последние годы случаи развития внутриглазной инфекции, вызванной некоторыми палочковидными бактериями и так называемыми слабо– и непатогенными микроорганизмами (сенной палочкой), палочкой ксероза, кишечной и синегнойной палочками, которые раньше редко являлись причиной внутриглазного инфекционного поражения. Следовательно, применительно к глазу деление бактерий на патогенные, слабо– и непатогенные следует считать условным: практически любой микроб, попавший в полость глазного яблока, может вызвать внутриглазное гнойное воспаление.
Немаловажное значение имеют локализация и величина проникающей раны глазного яблока, выпадение и ущемление в ране внутренних оболочек, наличие внутриглазного инородного тела, кровоизлияния в полость глаза, сочетание травмы глазного яблока с повреждением его защитного аппарата. Выявлено закономерное увеличение частоты развития гнойных иридоциклитов и особенно эндо– и панофтальмитов в тех случаях, когда ранение переднего отдела глазного яблока сопровождается внедрением инородного тела, выпадением и ущемлением внутренних оболочек.
Внутриглазной инфекционный процесс, как правило, начинается с развития экссудативного гнойного воспаления ресничного тела и радужки с последующим формированием абсцесса стекловидного тела и вовлечением в процесс сетчатки, хориоидеи и склеры. Эндо– и панофтальмит могут быть последовательно развивающимися стадиями внутриглазного гнойного процесса.
Гнойный иридоциклит начинается с возникновения сильных болей в глазу, соответствующей половине головы и при пальпации глаза в области цилиарного тела. К ним быстро присоединяется перикорнеальная инъекция сосудов, появляются экссудат гнойного характера, гипопион, преципитаты на задней поверхности роговицы. Легко образуются задние синехии. В случае проведения адекватной консервативной терапии иридоциклит быстро купируется, но иногда он принимает затяжной характер, приводя к прогрессирующему ухудшению зрительных функций. В связи с обилием белкового экссудата, набуханием травмированного хрусталика, образованием передних и задних синехий нарушается гидродинамика глаза, развивается вторичная глаукома.
Эндофтальмит – гнойное воспаление в стекловидном теле – наиболее тяжелое осложнение проникающих ранений глаза.
Клинические признаки эндофтальмита – быстро нарастающие гиперемия и отек век и конъюнктивы с выраженным блефароспазмом и слезотечением. Вместо яркого розового рефлекса непосредственно за хрусталиком видно желтоватосерое содержимое стекловидного тела (рис. 23.13). Это скопление гнойного экссудата (абсцесс стекловидного тела. Глаз становится гипотоничным, резко снижается зрение, вплоть до слепоты. У большинства больных отмечаются субфебрильная температура, лейкоцитоз, увеличение процентного содержания нейтрофилов и увеличение СОЭ.
Степень выраженности эндофтальмита различна, иногда происходит полное расплавление роговицы и хрусталика. В ряде случаев очаговые эндофтальмиты могут быть следствием воспаления вокруг разрушенного хрусталика, железо– или, чаще, медьсодержащего осколка. Инфекция, развивающаяся после проникающих ранений в заднем отрезке глаза, по внутренним оболочкам распространяется на значительном протяжении, вовлекая в процесс и передние отделы сосудистого тракта. Прогноз относительно зрения всегда крайне неблагоприятный.
Контроль за динамикой изменений в стекловидном теле и сетчатке проводят с помощью исследования в проходящем свете, биомикроскопии, ультразвукового сканирования и электрофизиологических исследований.
Панофтальмит – это острое гнойное воспаление, охватывающее все среды и оболочки глаза, в том числе склеру. Оно быстро переходит на мягкие ткани орбиты, при этом всегда существует угроза распространения инфекции в мозг.
Пациента беспокоят не только сильные боли в глазу и голове, но и общая слабость, повышение температуры. Значительно выражен отек век и конъюнктивы. Отечная конъюнктива выпячивается за пределы глазной щели (хемоз), веки не смыкаются. Вследствие отека и воспалительной реакции тканей орбиты возникает экзофтальм. Роговица мутная, передняя камера заполнена гноем, другие отделы глаза не посматриваются. Он не реагирует на свет. Процесс всегда заканчивается гибелью глаза и крайне опасен для жизни пациента.
Профилактика внутриглазной инфекции после проникающих ранений глаза. Большое значение имеет оказание квалифицированной помощи пострадавшим с травмами глаза в ранние сроки. При выполнении первичной хирургической обработки ран глазного яблока в 1–е сутки после травмы инфекционные осложнения развиваются у 3–4% пострадавших. Если же хирургическую обработку производят на 2–е сутки или позднее, частота развития внутриглазной инфекции значительно увеличивается, составляя 20% и выше.
Микробиологические исследования позволяют выявить потенциального возбудителя инфекции и установить его чувствительность к антибактериальным препаратам.
Для борьбы с инфекцией глаза, помимо антибиотиков широкого спектра действия, используют сульфаниламидные препараты.
Методы применения лекарственных средств в офтальмологической практике условно принято разделять на две группы – общие (внутрь, парентерально) и местные (эпибульбарно, подконъюнктивально, интрабульбарно, ретробульбарно). Следует помнить, что при общей антибиотикотерапии лишь незначительное количество препарата попадает в ткани глаза. При местном лечении макситрол, гаразон, эубетал, дсксагентамицин, тобрадекс используют в виде капель и мазей.
Внутрь принимают антигистаминные препараты – супрастин, тавегил, семпрекс, димедрол, кларитин. При сильных болях назначают анальгетики и транквилизаторы, а также препараты для дезинтоксикации: гемодез (200–800 мл внутривенно), глюкозу (400 мл 5% раствора внутривенно), полифепам (внутрь по 30–50 г 3 раза в день).
Высокие концентрации препарата во внутриглазных жидкостях и тканях могут быть достигнуты путем введения антибиотика с помощью электрофореза или субконъюнктивалыю.
Во время хирургической обработки рамы роговицы непосредственно в переднюю камеру вводят антибиотик.
Лучшим способом профилактики бактериального эндофтальмита является введение антибиотиков интравитреально. Из других способов следует отметить введение антибактериальных препаратов в супрахориоидалыюе пространство через разрез склеры в области плоской части ресничного тела. При этом нельзя превышать предельно допустимую концентрацию препаратов в связи с опасностью расплавления внутренних оболочек.
При выборе оптимального метода местного применения антибиотика и длительности лечения следует учитывать следующие факторы: локализацию раны (роговица, область ресничного тела, задние отделы склеры), сохранность хрусталика и ресничного пояска как естественного анатомического барьера между передним и задним отрезками глазного яблока, наличие внутриглазного инородного тела и его локализацию, сроки оказания квалифицированной офтальмологической помощи пострадавшим после проникающего ранения глаза.
При любых повреждениях фиброзной капсулы глаза в качестве профилактической меры хороший эффект дает озонид, обладающий регенеративными свойствами и оказывающий выраженное бактерицидное и фунгицидное действие.
В том случае, если ранение роговицы сопровождается повреждением хрусталика, его удаляют во время хирургической обработки. Хрусталиковые массы могут, с одной стороны, вызвать факогенный иридоциклит или даже эндофтальмит, с другой – способствовать развитию инфекции, поскольку они являются хорошей питательной средой для бактерий.
Во время хирургической обработки раны, а также при диасклеральном удалении внутриглазного осколка производят интравитреальную инъекцию антибиотика, например мономицина или неомицина в дозе 2.000 ЕД либо гентамицина в дозе 0,4 мг.
Для создания необходимой терапевтической концентрации антибиотиков в полости глазного яблока их вводят в систему глазничной артерии ретроградно через верхнеорбитальную артерию.
Непрерывная перфузия – промывание инфицированного стекловидного тела соответствующим раствором антибиотика обеспечивает поступление антибактериального препарата непосредственно в очаг инфекции и одновременно создает условия для активного дренирования полости глазного яблока.
Наиболее эффективным методом лечения эндофталъмитов является витрэктомия – удаление стекловидного тела, заполненного гноем и микробными телами.
В процессе операции осуществляют непрерывное орошение полости глазного яблока раствором антибактериального препарата. В последние годы для лечения эндофтальмита, в частности в процессе витрэктомии, с успехом используют озонотерапию. Озонированный раствор состоит из 0,9% раствора хлорида натрия и озона и сохраняет бактерицидные свойства в течение 20–22 мин, не оказывая токсического влияния на внутренние структуры глаза.
Активное хирургическое и консервативное лечение эндофтальмита приводит к купированию воспаления, однако в ряде случаев при отсутствии положительной динамики приходится прибегать к удалению (энуклеации) глазного яблока. При благоприятном исходе эндофтальмита иногда удается сохранить не только глаз как косметический орган, но и небольшое (остаточное) зрение. Панофтальмит всегда заканчивается гибелью глаза.
Симпатическое воспаление
Проникающие ранения глазного яблока влекут за собой тяжелые осложнения, при возникновении которых существует опасность не только гибели травмированного глаза, но и развития симпатической офтальмии второго, здорового, глаза, которое наблюдается в 0,1–0,2% случаев после проникающей травмы и 0,06–0,07% – после внутриглазных операций. Симпатическая (сочувствующая) офтальмия – это воспаление второго, до этого времени здорового глаза в ответ на травму первого. Воспаление чаще всего проявляется в виде вялотекущего фибринозно–пластического иридоциклита.Первые симптомы симпатического воспаления появляются не ранее чем через 14 дней, поздние могут возникнуть через много месяцев и даже лет. В здоровом глазу сначала отмечаются легкая болезненность, светобоязнь, слабо выраженная (заметная только в процессе обследования) перикорнеальная инъекция сосудов. Позднее появляются преципитаты на задней поверхности роговицы, нарушается четкость рисунка радужки, сужается зрачок, образуются задние синехии, происходят сращение и заращение зрачка. Глазная гипертензия сменяется гипотензией, а затем субатрофией глазного яблока. Клиническая и гистологическая картины воспаления первого и второго глаза очень похожи. Воспаление в первом, травмированном, глазу называют "симпатизирующим", а во втором – "симпатическим". Симпатическая офтальмия может проявляться в виде нейроретинита или очагового хориоидита и осложняться отслойкой сетчатки. В настоящее время установлена ведущая роль в развитии симпатической офтальмии аутоиммунных реакций с формированием гиперчувствительности замедленного типа и образованием гуморальных антител к увеаретинальным антигенам с развитием в последующем вторичной иммунологической недостаточностью.
В связи с применением широкого арсенала мощных противовоспалительных и стероидных препаратов, своевременным проведением хирургических операций (квалифицированная обработка ран, удаление катаракты, инородного тела и др.) на высоком техническом уровне клинические проявления симпатической офтальмии, характер ее течения и частота развития осложнений претерпели изменения и значительно отличаются от таковых в случаях, ранее описанных в офтальмологической литературе.
Удаление слепого травмированного глаза, являющегося источником аутосенсибилизации, может служить надежной мерой профилактики развития симпатической офтальмии на здоровом глазу, если операция была выполнена в течение 14 дней после ранения.
Решение об удалении глаза принимают в том случае, если через 2 нед после травмы вялотекущее фибринозно–пластическое воспаление не стихает. Трудно решиться на такой шаг, когда поврежденный глаз зрячий. Если возникли признаки симпатической офтальмии в здоровом глазу, травмированный глаз удаляют только в том случае, если он слепой. При наличии даже очень слабого зрения энуклеацию травмированного глаза не производят. Прогноз симпатической офтальмии всегда очень тяжелый, и может так случиться, что впоследствии этот глаз будет лучшим.
Диагностика симпатической офтальмии нередко бывает сложной, особенно при развитии воспаления в парном глазу в поздние сроки после травмы, а также при стертых формах и локализации процесса в задних отделах глазного яблока. Факторами риска развития данной патологии являются локализация ранений в корнеосклеральной зоне, выпадение радужки, травма хрусталика, отслойка сетчатки, развитие посттравматического иридоциклита. Установлено, что наиболее часто симпатическая офтальмия развивается в 1–2–й месяцы после травмы (57,6% случаев) и на первый год приходится 92,5% всех случаев.
При появлении первых признаков воспаления в парном глазу проведение консервативной терапии начинают с назначения стероидов местно и внутрь. Местно – дексаметазон в виде инстилляций, под конъюнктиву и парабульбарно. Возможно применение фоно– или электрофореза 1% раствора преднизолона эндоназально. Обязательно использование мидокториатиков.
Длительность курса терапии стероидами, которые принимают внутрь, определяется клиническими проявлениями воспалительного процесса. Так, при различных формах иридоциклита начальная доза преднизолона у взрослых составляет в среднем 40–80 мг (8–12 таблеток) в день, у детей – 25–40 мг с постепенным снижением ее каждые 5 дней по 5 мг до ¼ таблетки. С целью предупреждения рецидивов применяют нестероидные противовоспалительные препараты (индометацин, ибупрофен и др. по 50–75 мг в день) на фоне лечения стероидами, а также в течение 2–3 мес после окончания курса лечения стероидов. Длительность курсового лечения (преднизолон, мети пред и др.) в среднем 75–80 дней. Таким образом, продолжительность местного лечения составляет не менее 12 мес, а общего – 6 мес. Преждевременное прекращение лечения приводит к ранним рецидивам и хроническому течению. Если воспаление захватывает весь сосудистый тракт переднего и заднего отрезков глаза, то стероиды принимают длительно, в течение 1–2 лет, в поддерживающей дозе 10–15 мг (для преднизолона). Выбор препарата определяется клинической формой симпатической офтальмии и уровнем кортикостероидов в плазме крови больного. При иридоциклитах предпочтительнее применять преднизолон, при увеанейроретините – полькортолон, кенакорт, при панувеитах – метипред. В ряде случаев необходимо назначать цитостатики (циклофосфамид по 50 мг 2 раза в день в течение 1–2 мес). В качестве иммуностимуляторов используют декарис, нуклеинат натрия, пирогенал, жидкий экстракт алоэ для инъекций, ФиБС, дробное переливание крови и др.
Все больные с симпатической офтальмией нуждаются в постоянном диспансерном наблюдении окулиста в течение всей жизни. Если возникает необходимость в осуществлении экстракции катаракты, операции по формированию зрачка или других вмешательств, их можно производить только в период ремиссии (не менее чем через 6–12 мес после обострения) на фоне консервативной терапии и под строгим иммунологическим контролем.
Удаление глазного яблока (энуклеация)
Удаление глаза во времяпервичной хирургической обработки оправдано только при тяжелом общем состоянии больного (черепно–мозговая травма, тяжелые соматические болезни), когда первичная обработка не может быть проведена в необходимом объеме, или при полном разрушении глазного яблока.Помимо лечебно–профилактической цели, удаление глазного яблока может преследовать и чисто косметические цели в тех случаях, когда слепой глаз спокоен, но косметически неприемлем.
Показаниями к удалению глаза в позднем периоде после ранения являются не купирующийся вялотекущий посттравматический иридоциклит на слепом глазу, рецидивирующие кровоизлияния и гемофтальм, внутриглазная инфекция, вторичная абсолютная глаукома, субатрофия и атрофия глазного яблока при отсутствии зрительных функций (рис. 23.14). Абсолютным показанием к удалению травмированного слепого глаза является повторное тяжелое проникающее ранение или контузия.
Удаление глазного яблока производят различными способами: энуклеация, эвисцерация, эвисцерация с иссечением заднего полюса и невротомией. Операцию, как правило, выполняют под наркозом, но иногда и под местной анестезией.
Энуклеацию глазного яблока осуществляют следующим образом. После отсепаровки конъюнктивы от лимба глазные мышцы захватывают крючком, прошивают (за исключением косых мышц) и отсекают от глазного яблока. За него заводят ножницы, нащупывают нерв, глазное яблоко подтягивают кпереди, а ножницы раскрывают и углубляют, чтобы пересечь зрительный нерв в пределах 2–5 мм от заднего полюса. После невротомии осуществляют гемостаз, помещая в полость орбиты тампон с 3% раствором перекиси водорода. Затем формируют опорнодвигательную культю, удобную для протезирования, обеспечивающую оптимальный косметический результат. Для этого в область мышечной воронки помещают орбитальный имплантат, который изготавливают из разных материалов: углеродных композитов, силиконов, гидрогелей, гидроксиапатита, донорского хряща и др. Прямые мышцы ушивают над имплантатом, на тенонову капсулу (влагалище глазного яблока) накладывают кисетный шов, а на рану конъюнктивы – непрерывный шов в горизонтальном направлении. Операцию заканчивают инъекцией антибиотика. Первый протез можно поместить в конъюнктивальную полость непосредственно во время операции или на первой перевязке. Если стандартный протез не устраивает пациента, то заказывают индивидуальный в Центре глазного протезирования. Протезы следует менять ежегодно.
Эвисцерация глазного яблока – это операция, производимая с целью удаления внутреннего содержимого глазного яблока. Полость склеры обрабатывают спиртовым раствором йода и промывают антисептиками. В склеральный мешок помещают имплантат. Заканчивают операцию и выполняют протезирование так же, как при энуклеации.
Эвисцерация с иссечением заднего полюса и невротомией отличается тем, что в задней трети склерального мешка лезвием вырезают склеральное кольцо, через образованное отверстие выполняют невротомию, для того чтобы предотвратить развитие симпатической офтальмии. Затем в склеральный мешок вводят имплантат и ушивают ткани.
После удаления глазного яблока пациенты находятся под наблюдением лечащего врача в течение 1–6 мес. Через 5–6 мес после окончательного формирования культи и орбитальной полости (рис. 23.15) возможно изготовление индивидуального протеза в Центре глазного протезирования.
Ожоги глаз
Ожоги органа зрения, по данным разных авторов, составляют 6–38% всех повреждений глаза.Ожоги глаз делят на термические и химические, выделяют также лучевые ожоги и ожоги, вызванные отравляющими веществами. В клинической практике выделяют основные этиологические группы: ожоги, вызванные кислотами, щелочами, термические ожоги и их сочетание. В лечении ожогов различают два этапа – оказание первой помощи и лечение осложнений ожоговой болезни.
Термический ожог. Термические ожоги глаз происходят под действием высокой температуры. Это могут быть бытовые и производственные травмы, вызванные расплавленным металлом, горячим шлаком, пламенем, горячей водой и паром.
Термические ожоги паром и горячей водой ввиду ее химической индифферентности можно рассматривать как чисто термические повреждения. Повреждающее действие на роговицу оказывает даже вода, подогретая до 45°С; при температуре воды 47°С через 1–2 мин роговичный эпителий становится мутным, при 65°С страдает строма, наблюдается отек роговичных пластинок, при 80°С происходят отчетливые изменения в заднем эпителии роговицы, повреждается ткань радужки и хрусталика.
На производстве термические ожоги чаще вызываются горячим металлом. Температура попавшей в глаз капли или стружки металла обычно очень высокая и соответствует точке плавления: 280°С – для олова, 330°С – для свинца, 419°С – для цинка, 960°С – для серебра, 1083°С – для меди, 1530°С – для железа и т. п. Однако в связи с высокой теплопроводностью металла температура попавшей в глаз капли снижается. Между каплей расплавленного металла и поверхностью глаза образуется газообразная прослойка вследствие испарения слезы с поверхности роговицы и конъюнктивы в момент прикосновения горячей капли металла. Эта газообразная прослойка защищает ткани глаза и может несколько уменьшить повреждающее действие металла.
При термическом ожоге возникает очаг некроза клеток, окруженный участками паранекроза, расширяющимися и углубляющимися уже после того, как действие термического агента прекращено. Причиной прогрессирования поражения тканей является нарушение обменных процессов, вызванное потерей эпителиальных клеток, выбросом токсичных продуктов из обломков поврежденных клеток, возникновением новой антигенной структуры белковых молекул, подвергшихся термической денатурации. Это приводит к аутосенсибилизации.
Учитывая особое анатомо–физиологическое положение роговицы, отсутствие в ней кровеносных сосудов, приносящих к тканям необходимые для жизнедеятельности вещества и уносящих от них продукты распада, можно понять, что накопление токсинных продуктов после ожога роговицы бывает более интенсивным, нем после ожога кожи, и вторинное поражающее действие их имеет выраженный характер, несмотря на небольшую площадь поражения.
Кислотный ожог. Тяжесть ожога, вызванного кислотами, зависит от их концентрации и времени действия. Анионы некоторых кислот имеют выраженное сродство к белкам, вследствие чего поражающий эффект наблюдается при не столь уж низких значениях pH. Так, если повреждающее действие соляной кислоты проявляется при pH 2,5, то трихлоруксусная кислота, в состав молекулы которой входит анион с более высоким сродством к белку, поражает ткани при pH 4,5.
В течение 1 ч после ожога серной, соляной и азотной кислотами достаточно высокой концентрации (10–30%) на поверхности роговицы еще сохранен эпителий, но при этом он как бы фиксирован. При действии кислоты более высокой концентрации эпителий может оказаться частично поврежденным. В строме изменение роговичных клеток строго соответствует участку ожога, нарушение клеток заднего эпителия также ограничено. Через несколько часов процесс распространяется по поверхности и в глубину, поражаются новые, сохранившиеся вначале клетки, находившиеся в состоянии некробиоза.
Боуменова мембрана превращается в гомогенную массу. При воздействии кислоты высокой концентрации эти нарушения появляются через 8–24 ч после ожога и становятся необратимыми.
Щелочной ожог. Растворы щелочей оказывают непосредственное обжигающее действие на ткани глаза. Омыляя жиры и жи|эоподобные вещества клеточных мембран, щелочи проникают в тело клетки, изменяют pH клеточного вещества, приводят к растворению (колликвации) белков, убивают клетку и проникают глубоко в ткани. При тяжелом ожоге глаза поражаются не только роговица и конъюнктива, но и внутренние оболочки переднего отдела глаза.
Из ожогов глаз щелочами наиболее часто наблюдаются ожоги гидратом окиси кальция [Са(ОН)2]. По мнению многих авторов, катион Са2+ имеет особое сродство к белкам роговицы. Вступая во взаимодействие с белками роговицы, он образует Са–альбуминаты или Са–коллагенаты в виде очагов обызвествления в роговице.
Клинические проявления ожогов
Легкие ожоги. В большинстве случаев независимо от этиопатогенетического фактора отмечается одинаковая клиническая картина поражения глаз: гиперемия и незначительный отек кожи век, явления раздражения глаза, гиперемия конъюнктивы и повреждение роговицы на большем или меньшем протяжении в виде дефектов эпителия, которые окрашиваются флюоресцеином.В области эрозии в самых поверхностных слоях роговицы наблюдается небольшой отек, который бесследно исчезает по мере ее эпителизации. Чувствительность роговицы, как правило, незначительно снижена. Радужка и ресничное тело в процесс не вовлекаются.
Субъективные ощущения при легких ожогах глаз характеризуются светобоязнью, режущими болями в глазу и слезотечением. Снижение остроты зрения бывает небольшим, до нескольких десятых.
Легкие ожоги могут сочетаться с внедрением мелких инородных тел в конъюнктиву и роговицу (при взрыве пороха, карбида и т. д.). Течение таких ожогов благоприятное: через 4–6 дней воспалительный процесс в конъюнктиве заканчивается, дефекты в роговице эпителизируются, происходит восстановление зрительных функций и наступает полное выздоровление. Чувствительность роговицы также полностью восстанавливается. Однако возможны осложнения и при легких ожогах. Присоединение вторичной инфекции может привести к появлению инфильтратов в роговице и развитию воспалительной реакции в радужке. При этом наблюдается более длительное течение процесса.
Нередко отмечается неблагоприятное течение ожога паром. Начавшись как легкое повреждение, в последующем такой ожог характеризуется длительным, рецидивирующим течением и может закончиться значительным снижением зрения.
Ожоги средней тяжести. При ожогах средней тяжести (И степень) кожа век гиперемирована, отечна. На коже век образуются пузыри в результате скопления выпота между слоями эпидермиса. Веки могут быть настолько напряжены, что открыть их удается с трудом (с помощью векоподъемника). При асептическом течении ожога через 8–10 дней происходит эпителизация дефектов кожи за счет неповрежденного эпителия с периферии и эпителия, сохранившегося на участке ожога. Присоединение инфекции ведет к образованию рыхлых корочек, сплошь покрывающих веки. Заживление в этих случаях происходит медленнее, но, как правило, рубцов на коже не остается.
При ожогах средней тяжести конъюнктива отечная, бледная с участками поверхностного некроза. На поверхности конъюнктивы выпотевает фибрин, который рыхло склеивает веки с глазным яблоком. Тяжи фибрина можно легко расслоить стеклянной палочкой. В глубине свода конъюнктива обычно гиперемированная. В 1–е сутки после ожога происходит расширение капиллярных петель перилимбальных и цилиарных сосудов в результате вазомоторного пареза капиллярной сети. В связи с увеличением проницаемости капиллярных мембран развивается значительный отек конъюнктивы, что может привести к сдавливанию капиллярных петель и возникновению обширных участков ишемии конъюнктивы.
В первые часы после ожога эпителий роговицы рыхлый, в связи с чем он очень быстро отторгается, приводя к образованию эрозий. При биомикроскопии можно видеть, что отек располагается преимущественно в поверхностных слоях роговицы (рис. 23.16). Острота зрения значительно снижается. Чаще всего она составляет от нескольких сотых до одной–двух десятых и реже бывает выше. Больного беспокоят резкая светобоязнь, слезотечение, боли в глазу, которые проходят по мере ликвидации воспалительного процесса.
К осложнениям ожогов средней тяжести относятся инфильтраты роговицы, рецидивирующие эрозии, экссудативный иридоциклит. Внутриглазное давление, как правило, не повышается. В случае рационального проведения терапии исходы ожогов средней тяжести в подавляющем большинстве случаев благоприятны.
Поверхностные повреждения конъюнктивы заканчиваются полным восстановлением ее нормальной структуры через 1,5–2 нед. В роговице остаются незначительные поверхностные помутнения. При расположении в центре они могут привести к умеренно выраженному снижению остроты зрения.
В случае присоединения инфекции патологический процесс становится затяжным, создаются условия для развития соединительнотканных рубцов в роговице. В исходе образуются более грубые поверхностные помутнения, а в наиболее неблагоприятных случаях – васкуляризированные бельма, обусловливающие значительное снижение зрения.
Тяжелые и особо тяжелые ожоги.
При тяжелых ожогах патологический процесс характеризуется глубокими нарушениями жизненных функций тканей глаза, а осложнения, вызванные этими нарушениями, нередко приводят к полной утрате зрительных функций и инвалидности больного. Клинически тяжелые ожоги проявляются необратимыми изменениями в виде некроза тканей глаза. Многие химические вещества, вызывая тяжелейшие ожоги конъюнктивы и роговицы, оказывают слабое воздействие на кожу (рис. 23.17). Даже наиболее активно действующие вещества (например, едкие щелочи, свежегашеная известь, аммиак и др.) обычно вызывают ожоги кожи не тяжелее II степени. Однако в ряде случаев при термических ожогах, ожогах концентрированными минеральными кислотами возможны глубокие поражения кожи век, при которых требуется более активная терапия, а иногда и оперативное вмешательство.
К тяжелым ожогам век относятся обширные поражения III степени, характерным признаком которых является образование темного струпа в результате коагуляционного некроза тканевого белка, резкого обезвоживания тканей и нарушения их жизнедеятельности. При ожогах III степени повреждаются все слои кожи, при
IV поражаются также подлежащая клетчатка, мышцы, хрящ.
После ожога III степени всегда образуются деформирующие рубцы, которые могут быть более грубыми при инфицировании ожоговой раны и вялом течении процессов регенерации, формируется симблефарон (спайки века с глазом) различной степени выраженности (рис. 23.18). Еще более глубокие рубцы оставляют ожоги IV степени, при которых некроз распространяется на все слои века, иногда возможно даже обнажение костей орбиты.
Ограниченный ожог IV степени, занимающий небольшой участок, относится к тяжелым ожогам. При распространении поражения более чем на ½ площади век ожог считается особо тяжелым. Даже ограниченный ожог III или IV степени сопровождается выраженным отеком и гиперемией окружающих участков кожи, а иногда и всего лица.
Таблица 23.1. Классификация тяжести ожогового повреждения глаз в зависимости от глубины и протяженности поражения тканей (по Н. А. Пучковской)
| Тяжесть ожога | Степень (глубина) ожога | Поражение переднего отрезка глаз | Ранние сопутствующие симптомы | ||||||
|---|---|---|---|---|---|---|---|---|---|
| веки | конъюнктива | склера | лимб | роговица | внутриглазное давление | поражение радужки и ресничного тела | поражение хрусталика | ||
| Легкий | I | Гиперемия кожи | Гиперемия | – | Гиперемия | Эрозия, легкий отек поверхностных слоев (щелевая лампа) | Нормальное | – | – |
| Средней тяжести | II | Образование пузырей | Ишемия, отек, поверхностные пленки | – | Кратковременная ишемия, гиперемия | Помутнение передних слоев (неинтенсивное "матовое стекло”) | Нормальное | Гиперемия (без экссудации) | – |
| Тяжелый | III–IV | Некроз кожи III степени либо поражения IV степени менее ½ поверхности века | Некроз не более ½ поверхности конъюнктивы глазного яблока | Поражения на площади не более Уз глазного яблока | Резкая ишемия сосудов не более ½ окружности лимба | Глубокое помутнение всех слоев (интенсивное "матовое стекло") либо IV степень ("фарфоровая" роговица занимает не более У2 ее площади). Дефект ткани (не сквозной) занимает не более ⅓ роговицы | Кратковременное повышение либо гипотония | Выраженный иридоциклит, экссудат заполняет не более ⅓ камеры | – |
| Особо тяжелый | IV | Некроз кожи и подлежащих тканей на площади более ½ века | Некроз конъюнктивы на площади более ½ века и глазного яблока | Поражение более ½ глазного яблока | Полная ишемия и тромбоз сосудов | "Фарфоровая" роговица занимает более ½ ее плошали; глубокий дефект ткани (истончение) на площади более '/3 роговицы | Стойкое повышение | Выраженный пластический иридоциклит, экссудат заполняет более ½ камеры | Помутнениехрусталика |
Далеко не всегда сразу после травмы можно точно установить степень ожога и определить его прогноз. Иногда, например при ожогах некоторыми кислотами, тяжелое на первый взгляд поражение глаз может протекать вполне благоприятно, и уже через несколько дней такой ожог можно отнести к группе менее тяжелых повреждений, чем предполагалось в первый момент. Значительно чаще развитие ожогового процесса в глазу характеризуется нарастанием его тяжести, особенно в первые 3 нед после травмы. Проводим сводную таблицу симптомов поражения век и глаза, предложенную Н. А. Пучковской, по которой можно определить степень тяжести ожога (табл. 23.1).
Лечение ожогов
Основными принципами лечения ожогов глаз являются экстренность, интенсивность и дифференцированный подход в каждой стадии ожоговой болезни.В первые минуты поражения глаз при ожоге необходимы обильное струйное промывание глаз водой из крана, водоема и т. д. в течение 10–30 мин, закапывание нейтрального, химически не активного масляного раствора (вазелиновое, оливковое масло) и экстренное направление пострадавшего в специализированное учреждение.
В 1 стадии ожоговой болезни (стадия ожогового шока продолжительностью до 2 сут) независимо от вида ожога проводят орошение глаза изотоническим раствором натрия хлорида или водой в течение 30 мин. Далее применяют химические нейтрализаторы для щелочей и кислот в виде инстилляций, которые производят через каждые 2 ч. При ожоге известью химическим нейтрализатором являются ЭДТА (3% раствор) и тартрат аммония, при ожоге негашеной известью – 10% раствор аммония хлорида + раствора виннокаменной кислоты, при ожоге тиоловыми ядами – 5% раствор унитиола, при ожоге серной кислотой – 0,4% раствор глюконата кальция, при ожоге спиртовым раствором – гипосульфит натрия. Если неизвестен состав кислоты или щелочи, попавшей в глаз, в качестве химических нейтрализаторов для щелочи можно применить 2% раствор борной кислоты, либо 5% раствор лимонной кислоты, либо 0,1% раствор молочной кислоты; для кислоты – 2% раствор натрия бикарбоната. Затем проводят дегидратационную терапию – 40% раствор глюкозы и уротропина внутривенно, диакарб либо гипотиазид внутрь в сочетании с панангином.
В связи с нарастанием болевого синдрома в первые часы после ожога необходимо применять анестетики (дикаин, леокаин или новокаин) в виде инстилляций. С целью профилактики вторичной инфекции назначают антибиотики в каплях: левомицетин, колбиоцин, эубитал, гентамицин, нестероидные противовоспалительные препараты (наклоф, диклофенак натрия), при отсутствии изъязвления роговицы – стероидные препараты (милидекс, дексаметазон, пренацид). Для предотвращения образования задних синехий на фоне токсического ожогового иридоциклита применяют мидриатики кратковременного действия (мидриацил, мезатон, гоматропин).
Хирургическое лечение в I стадии ожоговой болезни производят только при тяжелых и особо тяжелых ожогах по экстренным показаниям. Оно включает выполнение следующих вмешательств: секторальной конъюнкта вотом и и при некрозе конъюнктивы, некрэктомии конъюнктивы и роговицы, пластики век, пересадки лимбальных стволовых клеток с парного здорового глаза, послойной лечебной кератопластики.
Во II стадии ожоговой болезни, которая носит название "острая ожоговая токсемия" и продолжается до 18–20 сут после ожога, необходимо применять ингибиторы протеолитических ферментов для предотвращения изъязвления и перфорации роговицы. К ним относятся гордокс либо контрикал 10 мл внутривенно, под конъюнктиву и в виде инстилляций. С 3–й недели после ожога отмечается дисбаланс иммунологических показателей в сочетании с аутосенсибилизацией, в связи с чем при тяжелых ожогах необходимо применять иммуномодуляторы (левамизол либо иммунофан). Местно, помимо лечения, начатого в I стадии ожога, назначают антиоксиданты (эмоксипин, α–токоферол), стимуляторы репарaтивной регенерации (адгелон, тауфон, витасик, баларпан, глекомен и пр.), глазные мази (тиаминовая) и желе (солкосериловое, актовегиновое и др.).
Хирургическое лечение во II стадии ожоговой болезни производится исключительно при развитии осложнений – истончении и перфорации роговицы. По экстренным показаниям выполняют тектоническую послойную либо сквозную кератопластику.
В III стадии ожоговой болезни (септикопиемия, или стадия деструктивных изменений), которая длится до 2–3 мес после тяжелых ожогов, проводят симптоматическое лечение в зависимости от характера осложнений. При возникновении вторичной глаукомы назначают гипотензивные препараты – арутимол, бетоптик, ксалатан, трусопт местно, диакарб внутрь, лазикс внутримышечно. В том случае, если внутриглазное давление не нормализуется, проводят антиглаукоматозные операции. При наличии рецидивирующих эрозий роговицы, характерных для тяжелых ожогов, продолжают лечение стимуляторами репаративной регенерации.
В IV стадии ожоговой болезни (рис. 23.19) (стадия рубцевания, или реконвалесценции), которая длится от нескольких месяцев до нескольких лет после ожога, при наличии бельма роговицы местно проводят рассасывающую терапию (протеолитические ферменты, лидаза, препараты меда), а также применяют стероидные препараты и др.
Хирургическое восстановительное лечение начинают не ранее чем через 1 год после ожога. В первую очередь устраняют вывороты и завороты век, производят рассечение симблефарона с пластикой сводов, лечебную и мелиоративную послойную кератопластику, а в дальнейшем с оптической целью выполняют сквозную кератопластику либо кератопротезирование в особо тяжелых случаях (см. главу 10).
Действие на глаз отравляющих веществ
Почти все отравляющие вещества (ОВ) влияют и на орган зрения. ОВ по их действию делят на следующие группы. ■ Вещества, вызывающие слезотечение, – так называемые лакриматоры. Действие этих ОВ проявляется в раздражении конъюнктивы и блефароспазме, но особенно характерно слезотечение. При высоких концентрациях ОВ в воздухе усиливается и их действие, появляются помутнения роговицы; при непосредственном воздействии вещества на роговицу может развиться даже ее некроз. В легких случаях изменения носят преходящий характер и раздражение слизистой оболочки постепенно, в течение 2–3 дней, исчезает. Помутнения роговицы сохраняются дольше (до 1 мес), но также проходят бесследно ■ Удушающие газы (хлор, фосген, дифосген). В сравнительно невысокой концентрации эти газы вызывают раздражение слизистой оболочки глаз, в более тяжелых случаях развиваются острый конъюнктивит и поверхностное воспаление роговицы, которые проходят без всяких последствий. При тяжелых поражениях, проявляющихся в развитии отека легких и выраженных нарушениях деятельности сердечно–сосудистой системы, наблюдаются изменения в сетчатке в виде кровоизлияний, тромбозов, эмболии сосудов, нейроретинитов, кровоизлияний в стекловидное тело. Во всех случаях первая помощь заключается в промывании глаз изотоническим раствором натрия хлорида. При кератитах за веки закладывают тиаминовую эритромициновую мазь, актовегин в виде геля. Заболевания сетчатки лечат традиционными способами. ■ ОВ общетоксического действия, к которым относится синильная кислота. Они настолько токсичны, что пострадавший умирает раньше, чем проявится их воздействие на глаза. Окись углерода, которая также входит в эту группу, вызывает разнообразные расстройства зрения в зависимости от интенсивности кровоизлияний и очагов размягчения по ходу зрительных путей. ■ ОВ кожно–нарывного действия (иприт, люизит). В боевых условиях иприт оказывает действие в первую очередь на кожу, слизистую оболочку глаз и дыхательные пути. Вызывает поражения иприт, находящийся в жидком, парообразном или туманообразном состоянии. Действие иприта проявляется не сразу после соприкосновения с органом зрения: длительность скрытого периода в среднем около 2–5 ч.В легких случаях после скрытого периода появляются слезотечение, светобоязнь и учащенное мигание, развиваются гиперемия и отек слизистых оболочек век. При поражении средней степени тяжести наблюдаются сильнейшая светобоязнь, слезотечение, спазм век, значительно выраженный отек кожи век и конъюнктивы глазного яблока, гиперемия конъюнктивы, развивается кератит. В случае тяжелого поражения, наблюдающегося при действии капельно–жидкого иприта, отмечается сильный отек кожи век, развивается гнойный конъюнктивит, роговица мутнеет, теряет блеск, изъязвляется, развиваются деструктивные явления с самыми тяжелыми исходами. Гнойные процессы в роговице и других тканях глаза обычно развиваются не в результате непосредственного воздействия ОВ, а представляют собой проявление вторичной инфекции. При оказании первой помощи прежде всего необходимо промыть конъюнктивальный мешок изотоническим раствором натрия хлорида или 2% раствором натрия гидрокарбоната, после чего 3–4 раза в день за веки закладывают мазь на щелочной основе. При попадании в глаза капельно–жидкого иприта необходимо прежде всего немедленно промыть их водой, а затем 0,5% водным раствором хлорамина. Дальнейшее лечение проводят в зависимости от имеющихся симптомов. ■ ОВ раздражающего действия – чихательные (дифенилхлорарсин, дифеиилцианарсин). В зависимости от их концентрации в атмосфере и путей поступления в организм различают несколько клинических форм поражения: раздражение верхних дыхательных путей, – появление симптомов нервно–психических расстройств, поражение кожного покрова и желудочно–кишечного тракта.
ОВ раздражающего действия вызывают неудержимое чиханье; наблюдаются слезотечение, раздражение конъюнктивы, иногда помутнение роговицы.
Лечение заключается в промывании глаз изотоническим раствором натрия хлорида или 2% раствором натрия гидрокарбоната, наложении мазевых повязок, применении дезинфицирующих средств в виде капель.
Глава 24. Иммунологические аспекты глазных заболеваний
Всякий успех медицины в целом отражается на успехах офтальмологии, и каждый успех последней отражается на успехах медицины в целом.В. П. Филатов
Значение нарушений в иммунной системе организма при заболеваниях глаз
Нарушения в иммунной системе организма оказывают влияние на течение практически всех нозологических форм глазных заболеваний. Роль иммунологических сдвигов может быть различной: ключевой – этиопатогенетической (т. е. они являются основной причиной развития офтальмопатологии, например аутоиммунных увеитов, симпатической офтальмии), отягощающей (усугубляют течение патологического процесса в глазу, вызванного другими факторами, например инфекцией, травмой), сопутствующей (не оказывают существенного влияния на развитие глазного заболевания, но способны привести к ухудшению результатов лечения, например при посггравматических катарактах, отслойке сетчатки, осложненной близорукости).Задачи иммунологических исследований в офтальмологии: 1) изучение патогенетических механизмов глазного заболевания; 2) иммунодиагностика; 3) прогнозирование характера течения патологического процесса в глазу, его исхода и осложнений; 4) контроль проводимого лечения; 5) определение показаний к применению иммунотропных средств.
При иммунологическом обследовании больных с офтальмопатологией применяют общепринятые тесты естественного (неспецифического) и адаптивного (специфического, развивающегося в ответ на воздействие конкретных антигенов) иммунитета. По сложившейся в офтальмоиммунологии традиции факторы естественной резистентности (фагоцитоз, естественные киллеры, система комплемента, белки острой фазы) привлекают сравнительно меньшее внимание исследователей, чем адаптивный иммунный ответ. Изучение последнего касается практически всех звеньев иммунной защиты (Т–клеточный иммунитет, антителообразование, гуморальный MALT–ассоциированный иммунитет). Широко используют следующие тесты: ■ показатели Т–клеточного (тимус–зависимого) звена (цитометрия, иммунофлюоресценция с применением моноклональных антител к основным рецепторам Т–клеток, CD–маркерам): общее содержание Т–лимфоцитов (CD3), субпопуляции CD4+ (хелперная), CD8+ (киллерно–супрессорная) и их соотношение (CD4/CD8 – иммунорегуляторный индекс) ■ показатели В–клеточного иммунитета (гуморального, ответственного за образование антител): общее содержание В–клеток (CD19, CD20 или CD72), концентрация иммуноглобулинов (Ig) основных классов – IgG, IgA, IgM (метод радиальной иммунодиффузии по Манчини) и IgE – главным образом при подозрении на аллергические заболевания глаз (иммуноферментный – ИФА или радиоиммунный анализ) ■ концентрация (и размер) циркулирующих иммунных комплексов – ЦИК (спектрофотометрия, нефелометрия) ■ состояние аутоиммунитета – органоспецифического (индуцированного компонентами тканей глаза) или межорганного (индуцированного антигенами, имеющими общие детерминанты в тканях глаза и других органов). Определяют Т–клеточную сенсибилизацию (с помощью реакций бласттрансформации лимфоцитов – РБТЛ, торможения миграции лейкоцитов – PTMJT) и аутоантитела (с помощью ИФА или реакции непрямой гемагглютинации – РИГА); довольно редко (в связи с трудоемкостью методов) идентифицируют "специфические" ЦИК, содержащие конкретные аутоантигены и антитела к ним (после предварительной дезинтеграции химическими способами или ультразвуком). ■ Цитокины – медиаторы межклеточных и межсистемных взаимодействий, участвующие практически во всех жизненно важных процессах, происходящих в организме. Цитокины подразделяют на несколько групп (интерлейкины, интерфероны, факторы некроза опухоли, ростовые факторы), учитывают также их главные биологические эффекты (про– и противовоспалительные, хемотаксические, ангиогенные и т. д.). Это деление весьма условно, так как практически все цитокины полифункциональны и действуют по сетевому, каскадному принципу: усиление секреции одного из медиаторов приводит к стимуляции (или подавлению) продукции другого и т. д. При взаимодействии цитокинов их биологические эффекты могут изменяться. ■ В норме цитокины не вырабатываются или секретируются в низких (пикограммовых) концентрациях (гемопоэз, репарация). При развитии патологии, иммунного ответа, воспаления и т. д. продукция их может значительно усиливаться. Основными клетками–продуцентами цитокинов являются активированные стромальные клетки (фибробласты, эндотелиальные клетки), моноциты/ макрофаги, лимфоциты, главным образом CD4+–клетки. В глазу цитокины продуцируются кератоцитами, клетками слезной железы, радужки и цилиарного тела, пигментного эпителия сетчатки, эпителия хрусталика, сосудистого эндотелия. Определение цитокинов обычно проводят с помощью ИФА.
Методологический подход к иммунологическому обследованию больных с офтальмопатологией имеет некоторые особенности. В общей клинической иммунологии нарушения в иммунной системе пациента оценивают по наличию и степени выраженности сдвигов от нормальных, физиологических параметров. Контролем служат показатели, полученные при иммунологическом обследовании здоровых лиц соответствующего возраста и пола, проживающих в данном регионе. В офтальмоиммунологии при формировании контрольных групп важно исключить наличие каких–либо проявлений глазных заболеваний, в том числе в анамнезе.
В практике клинико–иммунологических лабораторий общего профиля основными объектами исследований являются сыворотка крови и клеточные элементы, выделенные из плазмы. Это позволяет выявлять сдвиги в иммунной системе всего организма. Исследование крови необходимо и при заболеваниях глаз, так как многие формы офтальмопатологии являются одним из проявлений системных иммунозависимых заболеваний и ассоциируются с поражением других органов. Примером могут служить увеиты при синдромах Бехчета, Фогта–Коянаги–Харады, ревматоидные увеиты, диабетическая ретинопатия. Иногда глазная патология оказывается первым клиническим симптомом болезни. Часто поражение глаз является следствием острых, хронических или латентных инфекций, возбудители которых длительно персистируют в организме. В патогенезе таких заболеваний системные нарушения иммунитета (спонтанные, индуцированные, приобретенные) играют очень важную роль. В качестве примера можно привести офтальмогерпес, офтальмотоксоплазмоз, туберкулезные увеиты, изменения в различных оболочках глаза при гепатите В. Даже в тех случаях, когда поражение глаз (например, травма или экзогенная инфекция) возникает у лиц с нормальным иммунным статусом, оно может сопровождаться иммунологической реакцией на уровне всего организма.
Вместе с тем при офтальмопатологии важное значение приобретает исследование "местных" иммунных реакций – на уровне глаза. В течение длительного периода времени глаз рассматривали как "забарьерный" орган, отделенный от общей иммунной системы организма гематоофтальмическим барьером (ГОБ) и вследствие этого не обладающий иммуногенным потенциалом. В свете современных представлений следует говорить об "иммунной привилегии" глаза.
Несколько десятилетий назад в экспериментальных исследованиях было установлено, что чужеродные ткани, помещенные внутрь глаза (в строму роговицы, переднюю камеру, стекловидное тело, субретинальное пространство), могут выживать там неограниченно долго в отличие от чужеродных тканей, помещенных в обычные условия (вне глаза) и отторгающихся в результате иммунологического конфликта между донором и реципиентом. Неожиданное приживление посторонних тканей в глазу оказалось связанным с локальной регуляцией иммунного ответа на трансплантат собственно внутри глаза, что было проявлением его "иммунной привилегии".
Сущность "иммунной привилегии" заключается в обеспечении защиты с помощью иммунных эффектов, не сопровождающихся повреждением тканей. Формирование и сохранение иммунопривилегированного состояния глаза обусловлено рядом факторов, которые условно можно разделить на "пассивные" и "активные". К "пассивным" относятся особенности морфологии и "иммуноархитектоники" глаза. Гематоофтальмический барьер, включающий сосуды радужки и эпителий цилиарного тела, пигментный эпителий и сосуды сетчатки, в значительной степени (хотя и не полностью) препятствует доступу в глаз молекул и клеток крови, в частности эффекторных Т–клеток и антител. Отсутствие во внутренних отделах глаза подлинной лимфатической дренажной системы также ограничивает возможность внутриорганной сенсибилизации лимфоцитов; как правило, антигенная информация "просачивается" с внутриглазными жидкостями через трабекулярную сеть и шлеммов канал в венозную циркуляцию. Кроме того, стромальные клетки глаза редко экспрессируют или совсем не экспрессируют молекулы главного комплекса гистосовмесгимости (МНС) классов I и II, необходимые Т–клеткам для распознавания антигенных субстанций. В итоге эти "пассивные" факторы ограничивают развитие иммуногенных реакций, в значительной степени уменьшая проявление локального воспаления.
В качестве "активных" факторов рассматривают конститутивную экспрессию на поверхности интраокулярных клеток молекул, которые оказывают сильное влияние на поведение клеток иммунной системы: Fas–лиганд, мембранные ингибиторы компонентов активации комплемента. Последние противодействуют образованию каскада комплемента и таким образом предотвращают иммунозависимый клеточный лизис. Связывание Fas–лиганда с его ко–рецептором Fas на активированных Т–клетках индуцирует апоптоз. Предполагают, что этот механизм может быть причиной уничтожения сенсибилизированных Т–лимфоцитов при их встрече с антигеном внутри глаза.
В дополнение к этим мембрансвязанным молекулам жидкие внутриглазные среды (как установлено при исследовании влаги передней камеры) содержат ряд факторов, которые подавляют и регулируют функцию иммунных клеток. В их число входят трансформирующий фактор роста (TGF–(3–2), α–меланоцитстимулирующий гормон, вазоактивный кишечный (интестициальный) полипептид, кальцитонинсвязанный пептид, свободный кортизол, рецепторный антагонист ИЛ–1. Это обусловливает способность влаги передней камеры подавлять активные проявления иммунитета, особенно эффекты, способные вызывать сильное воспаление.
Другая сторона глазной "иммунной привилегии" – особенности системного иммунного ответа на антигены, присутствующие внутри глаза или выходящие из него. Главную роль при этом играет феномен, получивший название "иммунное отклонение, связанное с передней камерой" – ACAID (от англ. "anterior chamber associated immune deviation"). Суть его состоит в том, что антигенный материал, попавший (или введенный) в переднюю камеру глаза, вызывает системный иммунный ответ (активацию регуляторных Т–клеток и предшественников цитотоксических Т–клеток, а также В–клеток, продуцирующих антитела, не связывающие комплемент), в котором не участвуют Т–клетки, определяющие развитие гиперчувствительности замедленного типа (ГЧЗТ), и В–клетки, секретирующие комплементфиксирующие антитела, что позволяет избежать развития сильной воспалительной реакции. Этот феномен подобен одному из типов "частичной иммунологической толерантности", рассматриваемой в экспериментальной иммунологии.
Описаны разные пути передачи ACAID–сигнала, которые зависят от природы антигена. Корпускулярные антигены (например, вирус простого герпеса, опухолевые клетки), введение которых в переднюю камеру глаза сопровождается локальным Т–клеточным ответом, вызывают продукцию растворимого медиатора, при попадании в кровь индуцирующего системную супрессию ГЧЗТ, характерную для ACAID. Растворимые белковые антигены (бычий сывороточный альбумин, S–антиген сетчатки) индуцируют клеточно–ассоциированный АСА1 D–сигнал. Показано, что Т–клетки, в частности инфильтрирующие, способны к изменению типа ACAID–сигнала. Получены данные о том, что главными иммуномедиаторами, участвующими в развитии событий, ведущих к супрессии ГЧЗТ, являются TGF–β (ингибитор Т–клеточной активации) и фактор некроза опухоли (ФНО–α) – один из ключевых иммунорегуляторных цитокинов.
Таким образом, "иммунная привилегия" обеспечивает активную регуляцию реакций на антигены, как попавшие (введенные) внутрь глаза, так и выходящие из него, а также регуляцию иммунных проявлений в самом глазу. Срыв этого ключевого защитного механизма сопряжен с развитием иммунопатологии и иммуногенным повреждением структур глаза, усугублением (или возникновением) глазного заболевания.
Обнаружено, что иммунологически неактивные в норме интраокулярные ткани могут активироваться под воздействием лимфокинов и интерферонов, особенно у–интерферона (ИФН–у). Причиной повышения продукции этих иммуномедиаторов могут стать различные экзогенные и эндогенные факторы. К таким потенциально "иммунокомпетентным" зонам глаза относятся периферия и центр поверхности роговицы, ее эндотелий, цилиарное тело, радужка, трабекула, пигментный эпителий сетчатки.
Установлено, что конъюнктива глаза человека, в том числе зона лимба, дренажная система и слезная железа, содержат мукозоассоциированную лимфоидную ткань – MALT (от англ. "mucose associated lymphoid ticcue"), представляющую собой часть иммунной системы, связаную со слизистыми оболочками. В MALT имеются все компоненты, необходимые для гуморального иммунного ответа (лимфоциты и плазматические клетки, фолликулярные скопления В–лимфоцитов, прикрытые лимфоэпителием, высокий, кубовидный, эндотелий посткапиллярных венул). Ряд исследователей полагают, что MALT всегда присутствует в нормальной конъюнктиве; другие авторы читают, что она формируется в течение жизни у части лиц.
В условиях нарушения ГОБ (причины чего могут быть различными) и инфильтрации внутриглазных структур клетками, проникающими из сосудистого русла, развитие локальных иммунопатологических реакций может обеспечиваться и "иммунокомпетентными" зонами собственно глаза, и инфильтрирующими его клетками или гуморальными факторами.
Важность изучения иммунологических реакций на уровне глаза определяется особенностями "местного" иммунного ответа, далеко не всегда совпадающего с системными сдвигами.
Наиболее доступным объектом исследования при изучении "местного" иммунитета является слезная жидкость. У больных, которым производят операции на глазах, возможно исследование внутриглазных жидкостей – влаги передней камеры, стекловидного тела, субретинальной жидкости. Следует отметить, что при исследовании локальных иммунных реакций, когда объектом исследования служат слезная или внутриглазные жидкости (где клетки обнаруживаютредко), как правило, используют тесты гуморального иммунитета (цитокины, иммуноглобулины, антитела, реже ЦИК).
Параллельное исследование крови, слезной и внутриглазных жидкостей позволяет провести более точную оценку изменений иммунного статуса на уровне глаза и организма.
Основные принципы иммунологических исследований в офтальмологической практике
Целью иммунологического обследования больного может быть: ■ установление или уточнение этиологии глазного заболевания ■ прогнозирование характера течения патологического процессса в глазу; исключение или подтверждение риска развития осложнений ■ контроль проводимого консервативного лечения и выявление причин его неэффективности ■ исключение (или установление) противопоказаний к выполнению оперативного вмешательства на глазах; оценка риска развития послеоперационных осложнений ■ определение показаний к применению и выбор иммунокорригирующих средств.При интерпретации иммунограммы необходимо учитывать: ■ клинический диагноз, локализацию и характер изменений в различных структурах глаза ■ давность глазного заболевания (рецидива) или травмы (бытовой, хирургической) ■ стадию, активность процесса ■ наличие сопутствующих заболеваний ■ возраст пациента ■ лечение, предшествовавшее иммунологическому обследованию ■ проведение профилактической или лечебной вакцинации, внутрикожных диагностических проб.
Необходимость тщательного анализа клинической картины заболевания определяется закономерностями иммунного реагирования. Например, отрицательные результаты иммунологического обследования (отсутствие различий при сравнении с нормой) могут свидетельствовать или о полном благополучии, что, естественно, должно соответствовать клинической характеристике течения процесса (излечение, стойкая ремиссия), или, наоборот, о состоянии иммунодефицита, т. е. неадекватном "молчании" иммунной системы или ее отдельных звеньев, что часто наблюдается при наиболее тяжелых формах глазных заболеваний. Отрицательные результаты могут быть обусловлены также активной иммуносупрессивной терапией, например использованием цитостатиков, кортикостероидов. Информативность иммунологического обследования в этих случаях значительно снижается. Вместе с тем применение некоторых препаратов, например индукторов интерферона, витаминов Е и С, или проведение вакцинации, диагностических внутрикожных проб (например, с туберкулином) может вызвать искусственную стимуляцию иммунных реакций и обусловить ложноположительные результаты.
При оценке иммунограмм и отдельных иммунологических параметров необходимо учитывать временной фактор. Например, усиление иммунного ответа в первые дни (редко недели) заболевания, как правило, отражает закономерную активацию защитных сил организма и является благоприятным патогенетическим фактором. Если же иммунная гиперреактивность или признаки иммунодефицита сохраняются в течение нескольких недель или месяцев, то следует думать о развитии иммунопатологии.
Наиболее ясное представление о наличии и характере сдвигов в иммунной системе обеспечивает комплексное, многофакторное исследование. Однако на практике получить полную иммунограмму удается далеко не всегда. Учитывая цель обследования и исходя из того, что характер иммунопатологических проявлений (нарушения в том или ином звене иммунитета), их глубина (степень отклонения от нормы) и доминирующая локализация (местная, системная, сочетанная) при заболеваниях глаз различной природы имеют ряд особенностей, среди широкого диапазона иммунологических параметров можно выделить наиболее характерные для различных нозологических форм офтальмопатологии.
В этиологической диагностике глазных заболеваний иммунологические исследования обычно проводят при инфекционных и аутоиммунных или смешанных инфекционно–аутоиммунных формах офтальмопатологии.
Иммунодиагностика инфекционных заболеваний глаз, вызванных вирусами, микробами, простейшими, обычно включает обнаружение антигенов возбудителя вирусной инфекции (вирус простого герпеса, цитомегаловирус, вирус гриппа, адено– и энтеровирусы) в соскобах с конъюнктивы (для этого используют метод флюоресцирующих антител – МФА). В сыворотке и слезной жидкости исследуют специфические противоинфекционные антитела (с помощью ИФА, МФА, РНГА) класса IgG (показатель хронической инфекции) и IgM (индикатор первичного заражения или активизации латентных инфекций). Выявляют специфическую сенсибилизацию лимфоцитов периферической крови и оценивают интенсивность клеточного иммунного ответа на инактивированные антигены возбудителя в реакциях in vitro (РБТЛ, РТМЛ). Широкое использование иммунологических тестов обусловлено трудоемкостью и часто недоступностью вирусологических исследований по непосредственному выделению предполагаемого возбудителя инфекции в культуре клеток или на животных.
Иммунодиагностика аутоиммунных заболеваний глаз, или "аутоиммунного компонента" при заболеваниях другой этиологии основывается на обнаружении клеточной сенсибилизации (РБТЛ, РТМЛ), аутоантител (ИФА, РИГА), исследовании концентрации ЦИК. При этом следует учитывать, что в норме аутоантитела и аутосенсибилизация не обнаруживаются (их уровень ниже чувствительности лабораторных методов).
В качестве антигенных препаратов в реакциях in vitro часто используют высо кооч и те нные тканевые фракции, полученные из тканей глаз (сетчатка, роговица, хрусталик) или других органов (печень, почки, коллагены, ДНК и т. д.) крупного рогатого скота или свиньи. Идеально применение искусственно синтезированных полипептидов – аналогов аутоантигенов человека, что позволяет исключить ошибки диагностики, обусловленные видоспецифичностью тканевых белков.
К тканеспецифическим антигенам глаза (встречающимся только в глазу) относят ряд белков сетчатки: S–антиген (от "soluble" – растворимый, мол. масса 48–52 кДа), 1RBP (интерфоторецепторный, мол. масса 140 кДа), RBP (ретиноидсвязываюший протеин, мол. масса 13 кДа) и др.; хрусталиковые кристаллины (a, pi и ph, у – отдельные субклассы); аутоантигены роговицы (мол. масса 64 и 54–55 кДа – так называемая главная пара кератинов). Важная роль этих антигенов в развитии аутоиммунных поражений соответствующих структур глаза установлена при таких заболеваниях, как экспериментальный аутоиммунный увеит, симпатическая офтальмия, язва Мурена, краевые кератиты, факогенные увеиты.
В глазу имеется также ряд перекрестно реагирующих антигенов, как интраокулярных, так и межорганных. Первое положение важно для понимания возможных механизмов генерализации патологического процесса в глазу, второе – при расшифровке причины развития офтальмопатологии на фоне сопутствующих соматических заболеваний. Примером может служить наличие сходных антигенных детерминант в структурах роговицы и склеры, а также в пигментном эпителии сетчатки. S–антигенподобный белок обнаружен в клетках цилиарного тела и трабекулы животных. Единственным экстраокулярным органом, где присутствует S–антиген (и IRBP), является эпифиз, что обусловлено общностью эмбриогенеза эпифиза и глаза. В хрусталике обнаруживают антигены, имеющие общие детерминанты с другими тканями глаза (роговица, радужка, хориоидея, пигментный эпителий сетчатки, цилиарное и стекловидное тело), а также тканями других органов (базальные мембраны почечных клубочков, синовиальная ткань суставов и сухожилий, мышцы, кожа, печень, селезенка, слюнные железы и эндотелий сосудов). Перекрестно реагирующие эпитопы выявлены в сосудистой оболочке глазного яблока и печени.
Некоторые из тканеспецифических антигенов глаза имеют перекрестно реагирующие детерминанты с компонентами отдельных микроорганизмов, что может служить предпосылкой для развития офтальмопатологии у инфицированных лиц (например, М–пептид S–антигена сетчатки и ДНК вируса гепатита В, а также вирусов лейкемии и саркомы; IRBP–антиген и белок с мол. массой 86 кДа, выделенный из Е. coli).
Важно иметь в виду, что органоспецифические реакции могут развиваться не только при "истинно" аутоиммунных формах офтальмопатологии. Эти реакции являются закономерной составной частью иммунного ответа на травму, инфекцию, сосудистые изменения и другие повреждающие факторы при ряде глазных заболеваний неаутоиммунной природы.
Выраженное и продолжительное усиление иммунного ответа на антигены измененных тканей свидетельствует о нарушении органоспецифического аутоиммунитета. В таких случаях аутоиммунные реакции могут стать одним из ключевых или доминирующим патогенетическим фактором офтальмопатологии.
Клинико–иммунологическое прогнозирование течения глазных заболеваний и определение показаний к применению иммунотропных средств базируется на знании особенностей реагирования больных и роли иммунопатологических факторов при той или иной форме офтальмопатологии.
Воспалительные заболевания глаз
Кератиты и кератоувеиты. При воспалительном процессе в роговице очень важно провести исследование слезной жидкости, прежде всего определить содержание в ней иммуноглобулинов трех основных классов. В нормальной слезной жидкости обязательно присутствует IgA (5–20 мг%), частично связанный с секреторным компонентом; IgG обнаруживают редко (примерно у 30% в популяции) и обычно в низких концентрациях (до 10 мг%). IgM в норме обычно отсутствует или, как и IgG, присутствует в следовых количествах, которые можно выявить только с помощью высокочувствительных тестов.Повышение концентрации иммуноглобулинов в слезной жидкости свидетельствует об активации местного (MALT–опосредованного) иммунитета, причем подъем уровня IgA и особенно обнаружение IgM чаще всего обусловлены развитием острого инфекционного процесса в роговице, а наличие IgG – хронической инфекцией или развитием аутоиммунного компонента. Умеренное повышение секреции IgA чаще всего имеет компенсаторный характер и редко ассоциируется с неблагоприятным прогнозом заболевания.
Патогенетически неблагоприятным признаком является дефицит IgA в слезной жидкости, отражающий недостаточность местного иммунитета. Установлено, что при офтальмогерпесе значительное снижение уровня IgA в больном глазу (по сравнению с содержанием его в парном, клинически интактном, глазу) может служить прогностическим критерием изъязвления роговицы и является показанием к проведению заместительной γ–глобулинотерапии (местно в инъекциях) и строгим противопоказанием к применению кортикостероидов. Гиперпродукция IgA (концентрация его в слезной жидкости больного глаза в 2–3 раза выше, чем в парном глазу) отмечается преимущественно при дисковидных кератитах без изъязвления. В случаях одновременного повышения уровня IgA в слезной жидкости (до 60 мг% и выше) и сыворотке (более 500 мг%) патогенетически обосновано применение кортикостероидной терапии в сочетании с противовирусными препаратами.
При вирусных кератитах очень важным фактором иммунной защиты является интерферонообразование. У больных офтальмогерпесом ИФН–α в слезной жидкости выявляют редко (не более чем у 20%), в сыворотке – по–разному – от отсутствия до обнаружения у 80% больных (по данным разных авторов). Ослабление способности к продукции ИФН–α сопряжено с тяжелым течением и частыми рецидивами вирусиндуцированных кератитов и кератоувеитов. Этим объясняется высокая терапевтическая эффективность интерферонотерапии. Наиболее целесообразно применение индукторов интерферона (например, полудана, актипола), стимулирующих выработку эндогенного цитокина. Введение экзогенного интерферона (лекарственная форма) может привести к ослаблению интерфероногенеза и соответственно к снижению лечебного эффекта.
Наряду с дефицитом интерферонообразования при кератитах может отмечаться выраженное усиление продукции ФНО–α в сыворотке (до 700–1.000 пкг/мл) и слезной жидкости (до 70–100 пкг/мл), например при ассоциации воспалительного процесса в роговице с хроническим гепатитом В. Предполагают, что гииерпродукция этого провоспалительного белка наряду с цитодеструктивным действием вируса может способствовать развитию аутоиммунного компонента и внести существенный вклад в развитие тяжелой стромалыюй патологии роговицы.
Установлены критерии, позволяющие прогнозировать течение кератитов, основываясь на определении уровня нротивороговичных антител с помощью РНГА. Титры антител в слезной жидкости в пределах 1:32–1:128 (при отсутствии аутоантител в крови и слабой клеточной сенсибилизации) расцениваются как нормальная ткансспецифическая реакция и ассоциируются с благоприятным исходом заболевания. Гиперпродукция антител в слезной жидкости (титры больше 1:512) в сочетании с системными аутоиммунными реакциями часто сопровождается изъязвлением роговицы. Отсутствие или низкие уровни нротивороговичных антител в слезной жидкости и сыворотке (меньше 1:8–1:16) при клинической картине тяжелого стромального кератита свидетельствуют о неадекватном ослаблении местного иммунитета (подобно дефициту IgA в слезной жидкости) и/или образовании патологических ЦИК, способствующих формированию поствоспалительных бельм.
При вирусиндуцированных кератитах, а также кератоувеитах и увеитах одним из главных патогенетических факторов является специфический противоинфекционный иммунитет. Показано значительное ослабление его клеточного звена у больных с рецидивирующими стромальными кератитами и язвами роговицы, у которых атаки офтальмогерпеса перемежаются с экстраокулярными проявлениями инфекции (herpes labialis и др.) или сопутствуют им. Гуморальный ответ при этом, как правило, сохраняется (антитела классов IgG и IgM, антитела к ранним неструктурным белкам вируса). Титры вируснейтрализующих антител достигают 1:160–1:320, но они не защищают от инфекции, что подтверждает основное значение клеточного иммунитета ари герпесе в целом.
Вместе с тем при часто рецидивирующих герпетических кератоувеитах и увеитах угнетение специфического клеточного иммунитета наблюдается сравнительно редко (25% больных); у большинства таких пациентов отмечается антигениндуцированная гиперреактивность, особенно в начале рецидива, о чем свидетельствует резкое усиление бласт–трансформации лимфоцитов в ответ на инактивированный вирус (in vitro). Обычно оно сочетается с низкими титрами противовирусных антител и более редким обнаружением вирусного антигена в конъюнктиве, что позволяет предположить доминирование иммунопатологического компонента. Для больных с такими формами кератоувеитов и увеитов характерна полисенсибилизация к антигенам офтальмотропиых возбудителей (вирус простого герпеса, туберкулин, токсоплазмин).
Обсуждается несколько возможных путей формирования иммунодефицитного состояния при офтальмогерпесе. Получены данные о том, что во время реактивации инфекции наблюдается дефицит продукции ИЛ–1 и ИЛ–2 (медиаторов, необходимых для нормального иммунопролиферативиого ответа) и снижается способность лимфоцитов отвечать на эти цитокины in vitro, что в целом обусловливает нарушение интерлейкинзависимых этапов иммунологического реагирования.
При герпетической инфекции состояние иммунодефицита характерно и для межрецидивного периода. Однако в этот период основное значение имеет нарушение естественной резистентности – местного, секреторного иммунитета, антителозависимой и естественной цитотоксичности, что, по–видимому, связано с генетически детерминированными дефектами иммунной системы. Оптимизация лечения достигается за счет применения иммуностимулирующих и иммунокорригирующих средств (тактивин, тималин, полудан. актипол, имунофан, герпетическая поливакцина).
Увеиты. Иммунопатология является одним из ключевых этиопатогенетических факторов воспалительных заболеваний сосудистой оболочки и сетчатки. Известно, что причиной развития эндогенных увеитов часто бывают хронические или острые инфекции, для которых характерны сдвиги практически во всех звеньях естественного и адаптивного иммунитета: туберкулез, токсоплазмоз, простой герпес, цитомегаловирус, грипп; в последние годы установлено офтальмотропное действие энтеровирусов и вируса гепатита В.
Иммунные нарушения могут быть как предпосылкой развития, так и следствием инфекционного процесса. При увеитах наблюдаются стимуляция местной и/или системной продукции и нарушение баланса про– и противовоспалительных цитокинов, дефекты в системе интерферонов (дефицит или, наоборот, гиперпродукция ИФН–α и/или ИФН–γ), ослабление Т–клеточного иммунитета, особенно его хелперного звена, дисиммуноглобулинемия (в сыворотке и слезной жидкости), повышение концентрации ЦИК и т. д.
Успехи в изучении цитокинов позволили расшифровать основные звенья патогенеза увеитов, остававшиеся длительное время неясным. Главными медиаторами воспаления, по мнению большинства исследователей, являются ФНО–α и ИЛ–1β. В опытах на животных установлено, что интраокулярные инъекции этих цитокинов индуцируют увеиты, а последующее введение антител к ФНО или антагониста рецептора ИЛ–1b супрессирует воспаление. Экспериментально установлен также увеитогенный эффект ИЛ–8, цитокина, обладающего выраженной хемотаксической активностью для лейкоцитов и посредством этого участвующего в развитии воспаления. Другие цитокины, такие как ИЛ–6, ИЛ–10, трансформирующий фактор роста – ТФР–β1, ИЛ–4, ИФН–α, ИФН–γ, проявляют неоднозначный, дозозависимый эффект, в разных условиях усиливая или, наоборот, супрессируя внутриглазное воспаление. Показано, например, что первичное введение ИЛ–6 в стекловидное тело индуцирует развитие увеитов у крыс, однако при повторных инъекциях, наоборот, формируется резистентность к заболеванию. Объяснением этого могут служить особые свойства ИЛ–6: являясь типичным цитокином воспаления, он ограничивает выработку других провоспалительных цитокинов, что определяет его двойственную патогенетическую роль.
В патогенезе эндогенных увеитов важное значение имеет аутоиммунный компонент. Развитие аутоиммунных реакций сопряжено с ослаблением Т–супрессорного звена и изменением соотношения иммупорегуляторных субпопуляций Т–клеток. Косвенным показателем аутоиммунного процесса может служить повышение индекса CD4/CD8 (до 2,0 и выше), тогда как при "чисто" инфекционных увеитах он часто бывает ниже нормы (меньше 1,0).
Главными свидетельствами аутоиммунизации являются клеточный иммунный ответ и антитела, направленные против тканей глаза. К наиболее активным увеитогенным антигенам глаза относится S–антиген сетчатки. Установлено, что аутоиммунные реакции, индуцированные этим белком, наблюдаются только при наличии изменений на глазном дне. Этот факт учитывают при иммунодиагностике вовлечения сетчатки в патологический процесс у пациентов с помутнением оптических сред в тех случаях, когда офтальмоскопия не может быть проведена.
Иммунный ответ на S–антиген развивается при увеоретинитах разной этиологии: токсоплазмозных, герпетических, туберкулезных, ассоциированных с синдромами Бехчета, Фогта–Коянаги–Харады, гепатитом В или С, а также увеитами неясной природы. Значительно реже S–аутоиммунизацию обнаруживают при ревматоидных увеитах, практически не выявляют при синдроме Фукса, болезни Стилла, увеитах, вызванных вакциной БЦЖ.
На материале изучения герпетических и туберкулезных увеоретинитов показано, что хронические вялотекущие процессы характеризуются усилением иммунного ответа на инфекционный агент и S–антиген. При туберкулезе глаз "чистую" инфекцию диагностируют лишь у 30% больных с редко рецидивирующими и у 5% – с часто рецидивирующими увеитами. Патогенетическая роль аутоиммунного компонента подтверждается выявлением очаговых реакций (обострение увеита в ответ на внутрикожное введение туберкулина) на фоне смешанной сенсибилизации к туберкулину и S–антигену в 100% случаев. У больных, у которых отсутствуют признаки аутоиммунизации, независимо от напряженности противоинфекционного ответа, очаговые реакции наблюдаются значительно реже.
Среди эндогенных увеитов принято выделять собственно аутоиммунные формы: факогенные воспаления в сосудистом тракте глаза, увеиты, ассоциированные с синдромами Бехчета, Фогта–Коянаги–Харады, некоторые формы периферических увеитов. При этих заболеваниях явно доминируют аутоиммунные реакции (тканеспецифические, иногда межорганные), повышены концентрации ЦИК малых размеров (наиболее патогенных). Однако и в этих группах значение инфекций как пускового фактора полностью не исключается.
Иммунопатологические реакции являются одним из главных факторов в механизме поражения второго глаза у больных с односторонними увеитами. Установлено, что ведущую роль в этом процессе играют системные нарушения иммунитета. Показателями риска развития заболевания парного глаза могут служить длительное выявление клеточного иммунного ответа (в РТМЛ) на S–антиген или другие аутоантигены сетчатки; обнаружение одновременно двух классов антител к S–антигену (IgG и IgM) и антител к ДНК (у детей); повышение в сыворотке концентрации IgG и ЦИК, в том числе специфических, содержащих S–антиген и антитела к нему.
Рассмотрим концепцию патогенетического механизма билатеризации эндогенного увеита. В условиях нарушения ГОБ больного глаза отмечаются выход в циркуляцию тканеспецифических антигенов, появление в крови сенсибилизированных лимфоцитов и антител. При ослаблении Т–супрессорного звена и под воздействием инфекций, вакцин и т. п. происходит усиление системных аутоиммунных реакций, что в итоге приводит к поражению второго глаза по типу классического экспериментального аутоиммунного увеита. Ключевую роль в этом процессе играют провоспалительные цитокины. Известно, что ФНО–α и ИЛ–1β проявляют дистанционные эффекты и способны вызывать изменения в эндотелии сосудов ГОБ, повышая его проницаемость, активируя молекулы клеточной адгезии и таким образом способствуя миграции воспалительных клеток в парный глаз.
Локальные иммунологические сдвиги, оказывающие существенное влияние на течение патологического процесса в больном глазу, играют значительно меньшую роль в билатеризации увеита. Недостаточно ясен механизм развития содружественной иммунной реакции, которую выявляют при исследовании слезной жидкости парного глаза (в ней нарушается секреция иммуноглобулинов и некоторых цитокинов, обнаруживаются антитела). Предполагают, что этот феномен отражает субклинические изменения в структурах парного глаза, переход которых в клиническую форму ассоциируется с активацией иммунопатологических реакций на уровне всего организма.
Необходимость использования при лечении увеитов иммунотропных препаратов не вызывает сомнения. При выборе препаратов следует учитывать особенности иммунного статуса пациента.
Для подавления аутоиммунных реакций необходимо применять иммуносупрессоры (кортикостероиды, цитостатики, циклоспорин A, FK–506). Однако при их необоснованном использовании, например дексаметазона при увеитах у больных с ослабленным местным иммунитетом (низкие уровни IgA и отсутствие тканеспецифических антител в слезной жидкости в активный период заболевания), повышается риск развития постувеальных осложнений, в частности хориоретинальных дистрофий.
В некоторых ситуациях для устранения иммунодефицитных состояний необходимо применить иммуностимуляторы. С этой целью используют индукторы интерферона, тактивин, левамизол и т. д. Следует учитывать, что чрезмерная иммуностимуляция или "заместительная" цитокинотерапия также могут вызвать осложнения. Накоплены, например, многочисленные данные, свидетельствующие об изменениях в структурах глаза (внутриглазные кровоизлияния, ретинопатия и ретинит, нейропатия, неоваскулярная глаукома и др.) вследствие применения препаратов интерферона у больных гепатитами и другими соматическими заболеваниями.
Оптимальным представляется применение иммунокорректоров – средств, позволяющих добиться нормализации исходно нарушенных параметров иммунитета (ослабить гиперреактивность и повысить сниженные показатели, не влияя на нормальные). К таким препаратам относятся миелопид, имунофан; иммунокорригирующий эффект могут дать тактивин, левамизол, полудан, экстракорпоральные методы (плазмаферез, гемосорбция) в комплексе с малыми дозами кортикостероидов.
Пролиферативные заболевания глаз
Диабетическая ретинопатия. Известно, что в основе инсулинзависимого сахарного диабета (ИЗСД) лежат опосредованные Т–клстками аутоиммунные реакции, приводящие к деструкции островковых β–клеток поджелудочной железы и нарушению продукции инсулина. Для ИЗСД характерны нарушения в различных звеньях иммунной системы. Имеются сведения как об угнетении, так и об активации отдельных субпопуляций Т– и В–клеток, дисиммуноглобулинемии, ослаблении фагоцитарной функции нейтрофилов, повышении уровня ЦИК.Установлена связь ИЗСД с определенными антигенами системы HLA, сопряженной с генами иммунного ответа. При наличии одного из антигенов HLA (DR3 или DR4; В8 или В15) вероятность развития заболевания увеличивается в 2–4 раза, двух – в 10–12 раз. Антигены HLA–B7, АЗ, DW2 и DRW2 рассматривают как протективные, т. е. снижающие риск развития ИЗСД.
Часто возникновению ИЗСД предшествуют вирусные инфекции: цитомегаловирусная, энтеровирусная, эпидемический паротит, краснуха, корь, гепатит, поражение вирусом Коксаки, в большинстве случаев ассоциирующиеся с вторичной иммунной недостаточностью.
В настоящее время все осложнения диабета рассматривают в аспекте обменных нарушений, развивающихся на фоне измененной иммунореактивности. Одним из наиболее тяжелых осложнений является диабетическая ретинопатия (ДР).
В патогенезе ДР участвуют цитокины, оказывающие активное влияние на развитие и регуляцию антигенспецифического иммунного ответа, в том числе аутоиммунного (ФНО–α, ИЛ–1, ИЛ–6, ИФН–γ, ТФР–β1), на регуляцию процессов пролиферации (ИФН–α, ТФР–β1 и ангиогенеза (ФНО–α, ИЛ–8, ТФР–β1, а также обладающие цитотоксическими (ФНО–α) и противовирусными (ИФН–α, ИФН–γ) свойствами. Многие из этих цитокинов, как известно, проявляют взаимно перекрывающиеся эффекты.
Характерно, что у больных ИЗСД нарушения цитокинового статуса, как системные, очевидно, связанные с развитием основного заболевания, гак и местные (в глазу), наблюдаются задолго до появления клинических признаков ДР и предшествуют им. Особое внимание привлекает ФНО–α. Практически во всех стадиях заболевания, начиная с субклинической и вплоть до терминальной, обнаруживают гиперсекрецию этого цитокина в слезной и внутриглазных жидкостях. Для больных с ДР характерно также выраженное усиление системной продукции ФНО–α, что в литературе рассматривают как один из ключевых факторов общего патогенеза ИЗСД. Полипотентность функций ФНО–α, в частности такие важные в плане рассматриваемой проблемы эффекты, как активация эндотелиальных клеток сосудов и соответственно стимуляция ангиогенеза, стимуляция Т– и В–лимфоцитов и аутоиммунных реакций, цитотоксическое действие непосредственно на клетки–мишени, дают основание считать стойкое повышение его продукции неблагоприятным фактором, способствующим развитию и прогрессированию ДР.
Увеличение выраженности сдвигов в цитокиновом статусе ассоциируется с переходом в терминальную, пролиферативную стадию ДР. Определены ключевые, прогностические маркеры этого периода: в слезной жидкости – значительный подъем уровня ИФН–γ (до 25.000–30.000 пкг/мл при норме 8.000–10.000 пкг/мл), с гиперпродукцией которого связано нежелательное усиление иммунопатологических реакций; в сыворотке – избыток одного из основных регуляторов пролиферативных процессов – ТФР–β1 (40.000–60.000 пкг/мл при норме в 2 раза ниже).
Существенный вклад в развитие и прогрессирование ДР вносят аутоиммунные реакции, индуцированные S–антигеном сетчатки. Об их патогенетической роли свидетельствует достоверная связь манифестации ДР с пиком концентрации IgM и/или IgG–антител в сыворотке (100%) и слезной жидкости (80%). Пролиферативная ДР ассоциируется с накоплением антител (преимущественно IgG) во внутриглазных жидкостях при наличии в сыворотке антител обоих классов (или их исчезновении, обусловленном формированием ЦИК малых размеров).
Выявлена отягощающая роль хронической цитомегаловирусной инфекции, обострения которой (на фоне ослабления интерферонового статуса) рассматривают как один из возможных индукторов аутоиммунных реакций, направленных против сетчатки.
Иммунный статус пациента влияет и на исход лечения ДР с использованием основного метода – лазеркоагуляции сетчатки. Сама лазеркоагуляция вызывает сдвиги в продукции цитокинов на уровне как глаза, так и всего организма. Положительный эффект лечения ассоциируется с тенденцией к нормализации их продукции. При неблагоприятных исходах (дальнейшее прогрессирование ДР) наблюдается нарастание сдвигов в системе цитокинов и тканеспецифического иммунитета по сравнению с таковыми как у успешно оперированных, так и у неоперированных пациентов.
Обнаружение повышенных уровней ФНО–α в слезе и/или сыворотке крови перед лазеркоагуляцией ассоциируется с риском развития послеоперационных осложнений и расценивается как противопоказание к ее проведению.
В специальной литературе обсуждается актуальность разработки подходов к активному применению иммунокорригирующих средств при лечении ДР.
Травмы глаза
Травмы глаза обычно сопровождаются нарушениями в иммунной системе на уровне как поврежденного органа, так и всего организма. Эти нарушения в свою очередь оказывают влияние на течение посттравматического периода и формирование осложнений.Ожоги глаз. Иммунологический конфликт наряду с расстройствами трофики и регенерации является одним из определяющих компонентов многофакторного патогенетического механизма ожоговой болезни глаз.
Ожоговая травма глаз любой этиологии в подавляющем большинстве случаев вызывает выраженные нарушения в иммунном статусе всего организма: ослабление функции макрофагов/моноцитов, уменьшение абсолютного и относительного числа Т–лимфоцитов, а также субпоиуляций Т–хелперов и Т–супрессоров, нарушения в системе комплемента, повышение концентрации ЦИК, дисбаланс сывороточных иммуноглобулинов. Системные сдвиги обнаруживаются с первых дней после травмы и сохраняются в отдаленном периоде (более 6–12 мес). Местный иммунный ответ наблюдается в течение сравнительно короткого периода (до 2–3 нед после ожога), тогда как ослабление MALT–опосредованного иммунитета (судя по дефициту IgA в слезной жидкости) выявляется значительно дольше (до 3–4 мес). Дефект локальной защиты в отдаленные сроки объясняют нарастающими некротическими изменениями в конъюнктиве, роговице, других тканях глаза и поражением вследствие этого его "им му некомпетентных” зон.
Признаки вторичного посттравматического иммунодефицита с максимальной частотой выявляют после термических и термохимических ожогов, несколько реже – после кислотных и щелочных ожогов. Заметные различия в частоте выявления и глубине иммунопатологических сдвигов у больных с ожогами глаз разной этиологии отмечаются в ранние сроки, особенно на 2–3–й неделе после травмы; спустя 1–2 мес различия значительно нивелируются, а через 3–4 мес практически исчезают. Это наблюдение позволяет считать, что природа ожога может обусловить иммунопатогенетические особенности в основном раннего послеожогового периода. Выявление признаков иммунодефицита в отдаленные сроки определяется тяжестью травмы, а также генетической предрасположенностью пациента.
Множественные и продолжительные нарушения в иммунной системе всего организма характерны для неблагоприятного течения послеожогового периода с развитием тяжелых осложнений. Рецидивирующие и персистирующие эрозии, изъязвления и перфорации роговицы в ранние сроки после травмы ассоциируются с гиперсскрецией ИЛ–lp и значительным повышением уровня IgA в слезной жидкости, увеличением системной продукции ИЛ–1β и ФНО–α при дефиците ИФН–α, в отдаленном периоде – с сочетанным усилением клеточного и гуморального ответа на антигены глаза, причем не только обожженной роговицы, но также хрусталика и сетчатки.
В последние годы при лечении больных с ожогами глаз начали применять иммунотропные препараты: тактивин, тималин, миелопид (В–активин), левамизол, тимоген, циклоспорин А; развивается новое направление – цитокинотерапия. В эксперименте на кроликах установлен терапевтический эффект комплекса гетерологичных цитокинов (препарат "Суперлимф") при свежих ожогах роговицы. Клинические испытания показали, что инстилляции этого препарата 5 раз в день в течение первых 2 нед после ожога (при условии начала курса не позднее 2–х суток) позволяют оптимизировать традиционное лечение больных со свежими ожогами глаз и снизить частоту неблагоприятных исходов при ожогах II–III степени тяжести более чем на 20%.
Иммунологический механизм положительного воздействия комплексного консервативного лечения определяется ранней умеренной стимуляцией и последующей нормализацией местного иммунитета на фоне подавления патогенетически неблагоприятных системных сдвигов.
Кориеосклеральные ранения. Проникающие ранения глаза, как правило, сопровождаются сочетанным, местным и системным иммунным ответом, затрагивающим основные звенья неспецифического и специфического иммунитета (гиперпродукция провоспалительных цитокинов, нарушение фагоцитоза, изменения в содержании Т– и В–клеток, аутоиммунные реакции и т. д.).
У подавляющего большинства пациентов с тяжелыми и средней тяжести травмами глаза с 1–го дня и в течение последующих 6–9 мес в слезной жидкости и сыворотке обнаруживают усиленную продукцию ФНО–α и ИЛ–1β – ключевых цитокинов, участвующих в развитии неспецифического воспаления и индукции антигенспецифического иммунного ответа. Установлена прямая зависимость между гиперпродукцией этих цитокинов и тяжестью течения посттравматического периода. Формирование грубых рубцов на роговице, развитие хронических посттравматических увеитов (ХПТУ) и субатрофии травмированного глаза ассоциируются со значительным подъемом уровней ФНО–α и ИЛ–1р в слезной жидкости – до концентраций, превышающих их сывороточный уровень или сопоставимых с ним. Благоприятные клинические исходы, наоборот, отмечаются при минимальном содержании цитокинов в слезе, меньшем, чем в сыворотке.
Показано, что формированию грубого корнеосклерального рубца способствует дефицит противороговичных антител в слезной жидкости (титры меньше 1:16 в РПГА) в первые 2–3 нед после первичной хирургической обработки раны, отражающий ослабление локального иммунитета, ассоциированного с MALT.
В патогенезе ХПТУ наряду с гиперпродукцией провоспалительных цитокинов важную роль играют вызванное стрессом нарушение баланса иммунорегуляторных субпопуляций Т–клеток и развитие аутоиммунных реакций, индуцированных антигенами хрусталика и ретинальным S–антигеном. Реакция на S–антиген может развиться даже в отсутствие клинически выраженных посттравматических повреждений сетчатки (например, у пациентов с диабетом, миопией).
Ослабление Т–супрессорного звена, способствующее усилению аутоиммунных реакций, ассоциируется с угрозой развития симпатической офтальмии.
Для коррекции нарушений в иммунной системе при проникающих ранениях глаза используют кортикостероиды, циклоспорин А, декарис, тактивин, имунофан, полиоксидоний системно; положительный эффект отмечен при местном применении комплекса аутологичных цитокинов.
Контузии глаза. Исследования, проводимые с целью оценки иммунологических изменений, сопровождающих контузии глаза, немногочисленны. Анализ опубликованных данных свидетельствует о том, что коптузионные травмы глаза сопровождаются нарушениями в системе цитокинов, аутоиммунитета, уровне Т– и В–клеток, ЦИК, которые могут рассматриваться в аспекте общей концепции иммунного реагирования при стрессе.
При контузиях глазного яблока легкой степени выраженных изменений в состоянии изучавшихся параметров иммунитета не происходит.
Контузии средней тяжести сопровождаются умеренным повышением уровня ИЛ–1b – одного из главных цитокинов, участвующих в первой, "экстренной", линии иммунной защиты, ИФН–α – противовирусного, антипролиферативного медиатора, ранним развитием клеточных и гуморальных реакций на органоспецифические антигены глаза, сравнительно быстро затухающим. В целом такой иммунный ответ на травму характерен для постстрессовой "реакции тревоги" на этапе "срочной адаптации". Согласно современным представлениям, если сила стресса не является запредельной, то после него наступает стадия "резистентности", когда организм, "включив свои резервные возможности", способен противостоять неблагоприятным воздействиям.
Тяжелые контузии сопровождаются нарушениями в иммунной системе, свидетельствующими о развитии вторичного иммунодефицита: ослаблением способности к продукции иммунорегуляторпых цитокинов (ИЛ–1, ФИО, ИФН–α); повышением концентрации ЦИК "малых" размеров; быстрым развитием гуморальных, но не клеточных реакций на антигены глаза (хрусталика, сетчатки) в ранний посттравматический период с последующим нарастанием и длительным поддержанием напряженности обоих типов аутоиммунного ответа. Такие сдвиги близки к проявлениям "безмолствующего" иммунитета при выраженных стрессовых воздействиях и связаны с угрозой перехода в "стадию истощения", когда иммунный дисбаланс переходит в иммунопатологию. Наличие посттравматических кровоизлияний на глазном дне может стать клинической предпосылкой усиления аутоиммунных реакций, как клеточных, так и гуморальных.
Выявленные нарушения в иммунной системе и связь их с тяжестью травмы и развитием постконтузионных осложнений рассматривают как показание к введению в комплекс лечебных мероприятий иммунокорригирующих средств с целью умеренной стимуляции секреции иммунорегуляторных цитокинов и предупреждения усиления аутоиммунных реакций. Проведение такой терапии обосновано при тяжелых контузиях глаза и наличии постконтузионных кровоизлияний на глазном дне независимо от степени тяжести травмы. Первый опыт применения иммунокорректора имунофана оказался обнадеживающим и подтвердил актуальность дальнейшей целенаправленной разработки подходов к соответствующей коррекции лечения при контузиях глаза.
Влияние нарушений в иммунной системе на исход оперативных вмешательств на глазах
У многих пациентов, направляемых на операцию по поводу катаракт (осложненных, ностувеальных, врожденных), бельм роговицы (поствоспалительных, послеожоговых и образующихся после проникающих ранений), глаукомы (первичной, вторичной), диабетической ретинопатии, выявляют признаки вторичной иммунной недостаточности.Любая операция на глазах сопровождается местным и системным иммунным ответом на хирургическую травму и может привести к усугублению уже имевшихся нарушений естественного и адаптивного иммунитета. На исход хирургического лечения оказывает влияние как предоперационный, так и послеоперационный иммунный фон. При этом в послеоперационном периоде следует различать нормальный, адекватный оперативному вмешательству иммунный ответ (как правило, локальный и ограниченный несколькими педелями) и развитие интенсивных и длительных (до нескольких месяцев) иммунопатологических реакций.
Кератопластика. Известно, что решающую роль в достижении успеха при пересадке аллогенных органов и тканей (в том числе роговицы) играют их совместимость с органами и тканями реципиента по генам HLA II класса (особенно DR) и антигенам HLA–B I класса, а также обязательная иммуносупрессия. При полной совместимости по генам DR и В и проведении после операции адекватной иммуносупрессивной терапии (оптимальным средством признан циклоспорин А) высока вероятность прозрачного приживления донорской роговицы. Однако даже при таком оптимальном подходе нет гарантий полного успеха; кроме того, он далеко не всегда возможен (в том числе по экономическим причинам). Вместе с тем известны многочисленные клинические случаи, когда без специального подбора донора и реципиента и без соответствующей иммунодепрсссивной терапии сквозной трансплантат приживал идеально прозрачно. Это происходит в основном в тех случаях, когда кератопластику производят на бессосудистых бельмах, отступив от лимба (одной из "иммунокомпетентных" зон глаза), если соблюдаются все технические условия операции. Наблюдаются и другие ситуации, когда вероятность иммунологического конфликта после операции очень велика. Прежде всего это относится к послеожоговым бельмам, глубоким и длительно не заживающим язвам роговицы, обильно васкуляризированным бельмам, образующимся на фоне диабета и сопутствующих инфекций. В связи с этим особую актуальность приобретают методы предоперационного иммунологического прогнозирования риска отторжения трансплантата и послеоперационный мониторинг (постоянное слежение).
Среди пациентов, направляемых на кератопластику, особенно часто встречаются лица с нарушениями иммунитета. Так, например, лишь у 15–20% больных с послеожоговыми бельмами выявляют нормальные иммунологические показатели. Признаки вторичного иммунодефицита обнаруживают более чем у 80% больных: у половины из них – преимущественно системные отклонения, у 10–15% – селективные локальные сдвиги, примерно у 20% – сочетанные нарушения местного и системного иммунитета. Установлено, что определенное влияние на развитие вторичной иммунной недостаточности оказывают не только тяжесть и природа перенесенного ожога, но и оперативные вмешательства, произведенные раньше. Среди пациентов, ранее перенесшихкератопластику или какую–либо другую операцию на обожженных глазах, нормореактивные лица встречаются примерно в 2 раза реже, а сочетанные нарушения иммунитета у таких пациентов выявляют в 2 раза чаще, чем у ранее не оперированных больных.
Пересадка роговицы может привести к усугублению нарушений иммунитета, наблюдавшихся до операции. Иммунопатологические проявления бывают наиболее выраженными после сквозной кератопластики (по сравнению с послойной), повторных оперативных вмешательств (на том же или парном глазу), при отсутствии адекватной иммуносупрессивной и иммунокорригирующей терапии.
Для прогнозирования исходов оптической и реконструктивной кератопластики весьма важен контроль за изменением соотношения иммунорегуляторных субпопуляций Т–клеток. Прогрессирующее увеличение в крови содержания СD4+–лимфоцитов (хелперов) и уменьшение уровня СD8+–клеток (супрессоров) с повышением индекса CD4/CD8 способствует развитию системной тканеспецифической аутоиммунизации. Увеличение выраженности (до или после операции) аутоиммунных реакций, направленных против роговицы, обычно сопряжено с неблагоприятным исходом. Признанным прогностическим тестом является "торможение" миграции лейкоцитов при контакте с роговичными антигенами in vitro (в PTMЛ), свидетельствующее об уамении специфического клеточного иммунного ответа (ключевого иммунологического фактора в трансплантологии). Его обнаруживают с разной частотой (от 4 до 50% случаев) в зависимости от предшествующих нарушений иммунитета, вида кератопластики, характера пред– и послеоперационного консервативного лечения. Пик обычно отмечается на 1–3–й неделях после оперативного вмешательства. Риск биологической реакции трансплантата в таких случаях значительно увеличивается.
Тестирование противороговичных антител (в PHГА) малоинформативно, что, по–видимому, обусловлено образованием специфических иммунных комплексов.
Иммунологическое прогнозирование исходов кератопластики возможно на основе изучения цитокинов. Обнаружение (до или после операции) в слезной жидкости и/или сыворотке крови ИЛ–1b (ответственного за развитие антигенспецифического клеточного ответа) ассоциируется с угрозой болезни трансплантата. В слезной жидкости этот цитокин обнаруживают лишь в первые 7–14 дней после операции и не у всех больных (примерно у ⅓). В сыворотке его могут выявлять значительно дольше (в течение 1–2 мес) и чаще (до 50% случаев после послойной, до 100% – после сквозной кератопластики), особенно при недостаточной иммуносупрессивной терапии. Прогностически неблагоприятным признаком служит также обнаружение в слезной жидкости или сыворотке другого цитокина – ФНО–α (синергиста ИЛ–1, способного вызывать воспалительные, цитогоксические реакции). Эти факты следует учитывать при контроле эффективности проводимого лечения и определении продолжительности применения иммунодепрессантов, подавляющих продукцию про воспалительных цитокинов.
Несмотря на то что иммунодефицитное состояние у больных с проникающими ранениями и ожогами глаза может быть обусловлено гиперпродукцией простагландинов, подавляющих секрецию ИЛ–2 (одного из главных индукторов иммунного ответа) и зависящего от него ИФН–γ, назначение ИЛ–2 (препарат Ронколейкин) или стимуляторов его продукции при пересадке роговицы противопоказано, поскольку они могут вызвать активацию цитотоксических лимфоцитов, в результате чего повышается риск поражения трансплантата.
Выраженное влияние на исход кератопластики оказывает ингерфероновый статус больного. Повышение концентрации ИФН–α в сыворотке (до 150 пкг/мл и более), наблюдаемое у каждого пятого больного с послеожоговыми бельмами и в 1,5–2 раза чаще после пересадки обожженной роговицы (в течение 2 мес), ассоциируется с неблагоприятными исходами кератопластики. Эти наблюдения согласуются с данными о неблагоприятном патогенетическом значении гиперпродукции интерферонов и противопоказаниях к применению интерферонотерапии (в частности, рекомбинантного α2–интерферона – реоферона) при пересадке других органов и тканей. Иммунопатологический эффект обусловлен способностью интерферонов всех типов усиливать экспрессию молекул HLA I класса (ИФН–α, ИФН–β, ИФН–γ) и II класса (ИФН–γ), стимулировать продукцию ИЛ–1 и, следовательно, ИЛ–2, способствуя тем самым активации цитотоксических лимфоцитов, аутоиммунных реакций и развитию биологической реакции трансплантата с последующим его помутнением.
Неспособность к умеренной выработке интерферонов (особенно ИФН–α, ИФН–β), т. е. в концентрациях, необходимых для защиты от латентных, хронических вирусных инфекций (часто обостряющихся в условиях иммунодепрессивной терапии), так же как и гиперпродукция интерферонов, оказывают неблагоприятное влияние на результаты кератопластики. Примером могут служить наблюдения за больными, инфицированными вирусом гепатита В, для которых дефицит ИНФ–а особенно характерен. В данной группе реакция отторжения роговичного трансплантата отличалась в 4 раза чаще, чем у неинфицированных пациентов. Эти наблюдения показывают, что у больных с дефектом и нтерферонообразован ия целесообразна его умеренная стимуляция (с целью активации противовирусной защиты на уровне всего организма) без нежелательного усиления иммунопатологических реакций. Такое лечение можно проводить в комплексе с терапией иммуносупрессивными и симптоматическими средствами с помощью мягких иммунокорректоров при системном (но не местном!) их применении.
Экстракция катаракты. Иммунологические факторы оказывают влияние и на результаты хирургического лечения катаракт.
Сдвиги в показателях местного и системного иммунитета, на фоне которых производят экстракцию катаракты (и введение ИОЛ), разнообразны и определяются прежде всего природой заболевания и возрастом больного. Наиболее значительные нарушения в иммунной системе (на уровне глаза и всего организма) наблюдаются у пациентов с постувеальными катарактами. Иммунопатологические сдвиги, характерные для увеитов в целом, способствуют развитию осложнений, в том числе помутнению хрусталика, и часто сохраняются у больных со сформировавшимися катарактами. В группу повышенного риска входят и больные с осложненными катарактами другой природы (диабетическими, сочетающимися с глаукомой), преимущественно молодого и среднего возраста.
У таких пациентов отмечаются накопление аутоантител к ДНК в сыворотке и повышение концентрации ЦИК со средней молекулярной массой в сыворотке и слезной жидкости.
При врожденных катарактах особое значение имеют внутриутробные инфекции, часто сочетающиеся с признаками вторичной (а в отдельных случаях первичной) иммунной недостаточности. Доказана возможность развития вирусиндуцированных врожденных катаракт вследствие трансплацентарного проникновения вирусов краснухи, гепатита В, гриппа, герпеса, цитомегаловируса. В развитии этих катаракт важное значение придают не только собственно инфекционным факторам, но и аутоиммунным (факогенным) реакциям.
При старческих катарактах сдвиги в иммунной системе организма, как правило, связаны с возрастом; иммунопатологические реакции наблюдаются реже, чем при врожденных и осложненных катарактах, и обычно ассоциируются с сопутствующими соматическими заболеваниями, инфекциями и т. д.
Исходя из аутоиммунной концепции катарактогенеза, принимаемой многими исследователями, особо важную роль в развитии помутнений хрусталика играют тканеспецифические антитела и образуемые ими иммунные комплексы. С помощью РИГА установлено, что накопление противохрусталиковых антител одновременно в слезной жидкости и сыворотке крови является ранним доклиническим признаком поражения хрусталика. Селективное обнаружение противохрусталиковых антител только в слезной жидкости или сыворотке не может служить достоверным прогностическим критерием формирования катаракты, так как его выявляют примерно у */? практически здоровых взрослых людей в популяции. Максимальная интенсивность антителообразования в ответ на комплекс антигенных фракций хрусталика (а–, у–, ph– и pl–кристаллины, суммарные белки кортекса) отмечается в период формирования катаракты; по мере ее созревания уровни антител и частота их выявления снижаются до минимума (2–5% в слезной жидкости, 10–30% в крови).
Установлено, что выполнение операций на пике аутоиммунного ответа сопряжено с возникновением послеоперационных осложнений. Риск развития воспалительных реакций в таких случаях достигает 90%, при низких титрах сывороточных аугоантител он в 2 раза ниже.
Причинами неблагоприятного исхода хирургического лечения катаракт (послеоперационные увеиты, хориоретинальные дистрофии) могут послужить продукция провоспалительных цитокинов (ИЛ–1, ФНО–α), возвратная послеоперационная активация аутоиммунных реакций, индуцированных ДНК, компонентами хрусталика, поврежденного при операции, развитием иммунного ответа на S–антиген (наиболее вероятен при сопутствующих изменениях в сетчатке). С учетом этого определены оптимальные сроки выполнения операции на втором глазу у детей с двусторонними врожденными катарактами: 1–я неделя и спустя 4 мес после экстракции хрусталика на первом глазу (до развития и после затухания иммунного ответа на хирургическую травму).
Накопленные данные свидетельствуют, что при хирургическом лечении катаракт наряду со стероидами, подавляющими аутоиммунные реакции, целесообразно применять средства, способствующие дезинтеграции и элиминации ЦИК, а также иммунокорригирующие и противовирусные препараты (по индивидуальным показаниям).
Глаукома и антиглаукоматозные операции. Елиного мнения о роли нарушений в иммунной системе при первичной открытоугольной глаукоме (ПОУГ) нет. В то же время получены данные, свидетельствующие о влиянии иммунологических факторов как на патогенез ПОУГ, так и на исход ее хирургического лечения, в частности развитие избыточного рубцевания вновь созданных путей оттока внутриглазной жидкости.
Описаны изменения антигенной структуры тканей угла передней камеры глаза вследствие инволюционных процессов и сосудистых нарушений, связанных со старением. Выявлены изменения в трабекулярной ткани и прилежащих к синусу слоях, ассоциированные с наличием плазматических клеток – продуцентов иммуноглобулинов, реже – активированных лимфоцитов, способных секретировать лимфокины, обусловливающие спонтанную и антигензависимую цитотоксичность, что рассматривают как предпосылку к развитию аутоиммунных реакций. Получены экспериментальные данные о роли факторов роста и интерферона в регуляции послеоперационного процесса и избыточного рубцевания.
Эти наблюдения нашли подтверждение в клинике. У больных ПОУГ выявлены признаки вторичной иммунной недостаточности: дефицит Т–лимфоцитов и снижение их функциональной активности, сывороточная поликлональная дисиммуноглобулинемия, повышение уровня Т–супрессоров, регулирующих аутоиммунный процесс. Установлено, что при ПОУГ имеют место аутоиммунизация к ДНК и коллагенам I и III типов (преобладающим в трабекулярной ткани), нарушения антипролиферативного звена иммунитета, проявляющиеся дисбалансом местной и системной продукции ТФР–β1 и системным дефицитом ИФН–α.
Показано, что проведение антиглауком атозных операций вызывает ответную иммунологическую реакцию, проявляющуюся изменением местной и системной продукции ТФР–β1 (как при первичной, так и при вторичной глаукоме) и активацией цитокинов, регулирующих воспалительные реакции (ИЛ–6, ИЛ–4), преимущественно при вторичной глаукоме.
Выявлена зависимость исхода антиглаукомных операций от фонового уровня и послеоперационной динамики содержания цитокинов и аутоантител. При быстром рубцевании вновь созданных путей оттока (от 2 нед до 6 мес) отмечаются нарастающий дисбаланс в продукции ТФР–β1 (увеличение системного дефицита при местной гиперпродукции цитокина), исчезновение антител (класса IgG) к коллагенам I и III типов и ДНК, что может быть связано с включением их в иммунные комплексы, повреждающие ткани глаза.
Накопленные данные свидетельствуют о необходимости включения в группу риска не только лиц молодого возраста и повторно оперированных больных, как это традиционно принято в хирургии глаукомы, но и всех пациентов с признаками иммунодефицитного состояния. Это обусловливает необходимость проведения иммунокорригирующего лечения больных с ПОУГ, особенно в послеоперационном периоде. Имеются сообщения об успешном применении тактивина (системно), имунофана (местно+системно), комплекса гетерологичных (свиных) цитокинов (местно).
Таким образом, результаты клинико–иммунологического мониторинга показывают, что даже при безукоризненно выполненных операциях иммунопатологические реакции могут препятствовать достижению желаемого лечебного эффекта. Это обусловливает необходимость проведения специальной предоперационной подготовки и послеоперационного консервативного лечения с обязательным включением в комплекс терапевтических средств иммунокорригирующих препаратов, к выбору которых нужно подходить дифференцированно, с учетом особенностей иммунопатогенеза и клинической формы офтальмопатологии, вида и объема оперативного вмешательства.
Глава 25. Офтальмофармакология
Хорошие врачи говорят, что невозможно лечить одни глаза, а необходимо в то же время лечить голову, если желают, чтобы поправились глаза.Сократ
Методы введения глазных лекарственных средств и особенности их фармакодинамики
Наиболее широко распространенными в офтальмологической практике формами лекарственных средств являются глазные капли и мази. Объем конъюнктивальной полости позволяет однократно инстиллировать не более 1 капли раствора или заложить за нижнее веко полоску мази длиной 1 см.В основном все активные ингредиенты лекарственных средств проникают в полость глазного яблока через роговицу. Однако возникающие местные и общие побочные реакции могут быть связаны с попаданием действующего вещества непосредственно в ток крови через сосуды конъюнктивы и радужки, вместе со слезой через слизистую оболочку носа. Выраженность системных побочных эффектов может варьировать в зависимости от индивидуальной чувствительности больного. Так, инстилляция 1 капли 1% раствора атропина сульфата может вызвать не только мидриаз и циклоплегию, но также гипертермию и сухость во рту у детей. Местное применение β–адреноблокаторов (тимолол малеат) у лиц с повышенной чувствительностью может спровоцировать артериальный коллапс.
Большинство глазных капель и мазей противопоказано применять во время ношения контактных линз из–за опасности кумулирования побочных эффектов.
При использовании разных видов глазных капель одновременно интервал между инстилляциями должен быть не меньше 10–15 мин, чтобы предотвратить разведение и вымывание ранее введенных капель.
В зависимости от используемых носителей для растворения действующих веществ срок действия 1 капли различен. Наиболее короткое действие оказывают водные растворы, более длительное – растворы поверхносто–активных веществ (метилцеллюлоза, поливиниловый спирт), максимальное – гелевые растворы. Например, при однократной инстилляции продолжительность действия водного раствора пилокарпина 4–6 ч, пролонгированного раствора на метил целлюлозе – 8 ч, гелевого раствора – около 12 ч.
При острых инфекционных заболеваниях глаза (бактериальный конъюнктивит) частота инстилляций может доходить до 8–12 в день, при хронических процессах (глаукома) – не более 2–3 в день. Следует помнить, что объем конъюнктивальной полости, в которую попадает лекарственное вещество, всего 1 капля, поэтому лечебный эффект не повышается при увеличении количества закапываемой жидкости.
Все глазные капли и мази готовят в асептических условиях. Капли, предназначенные для многократного использования, кроме растворителя и буферных компонентов, содержат консерванты и антисептики, а в изготавливаемых в аптечных условиях таких веществ нет, поэтому срок их хранения и использования лимитирован соответственно 7 и 3 днями. При повышенной чувствительности пациента к дополнительным ингредиентам производят однодозовые пластиковые упаковки для одноразового применения, не содержащие консервантов и предохраняющих веществ.
Срок годности фабрично изготовленных капель – 2 года при условии хранения при комнатной температуре вне воздействия прямого солнечного света. После первого открывания флакона капли можно использовать только в течение 1 мес.
Глазные мази имеют срок годности в среднем около 3 лет при хранении в таких же условиях. Их закладывают за нижнее веко в конъюнктивальную полость, как правило, 1–2 раза в день. Не рекомендуется использовать глазную мазь в раннем послеоперационном периоде при внутриполостных вмешательствах.
Дополнительный путь введения лекарственных средств в офтальмологии – инъекции. Различают подконъюнктивальные, парабульбарные и ретробульбарные инъекции. В особых случаях лекарственные средства вводят непосредственно в полость глаза (в переднюю камеру или стекловидное тело). Как правило, объем вводимого препарата не более 0,5–1 мл.
Подконъюнктивальные и парабульбарные инъекции показаны для лечения заболеваний и травм переднего отдела глаза (склериты, кератиты, иридоциклиты), ретробульбарные – при патологии заднего отдела (хориоретиниты, невриты, гемофтальм).
В случае использования инъекционного способа введения препарата его терапевтическая концентрация в полости глаза резко возрастает по сравнению с инстилляциями. Однако введение препаратов с помощью местных инъекций требует определенного навыка и не всегда показано. Шестикратное закапывание глазных капель с интервалом 10 мин в течение 1 ч по эффективности равно субконъюнктивальной инъекции.
При лечении заболеваний глаз применяют также внутримышечные и внутривенные инъекции и инфузии (антибиотики, кортикостеромды, плазмозамещающие растворы И др.).
Во внутриглазной хирургии используют только невскрытые одноразовые упаковки, содержащие изотонические растворы с необходимыми буферными присадками для достижения нейтрального pH.
Лекарственные препараты можно вводить также с помощью фоно– или электрофореза.
При назначении лекарственных средств следует учитывать их фармакодинамические и фармакокинетические особенности. Особенностью фармакодинамики глазных лекарственных форм является избирательность их действия на ткани глаза. Они в основном дают местный фармакологический эффект и редко оказывают системное воздействие на организм. Попадание лекарственных веществ в ткани глаза при системном применении (пероральном или парентеральном) зависит от их способности проникать через гематоофтальмический барьер. Так, дексаметазон легко проникает в различные ткани глаза, в то время как полимиксин практически не попадает в них.
Классификация лекарственных средств, используемых для лечения глазных заболеваний ■ Противоинфекционные препараты. • Антисептики. • Сульфаниламидные препараты. • Антибиотики. • Противогрибковые препараты. • Противовирусные препараты. ■ Противовоспалительные препараты. • Глюкокортикостероиды. • Нестероидные противовоспалительные средства. • Противоаллергические препараты. ■ Препараты, применяемые для лечения глаукомы. • Средства, стимулирующие отток внутриглазной жидкости. • Средства, угнетающие продукцию внутриглазной жидкости. ■ Противокатаракгальные препараты. ■ Мидриатики. • Длительного (лечебного) действия. • Короткого (диагностического) действия. ■ Местные анестетики. ■ Диагностические средства. ■ Офтальмологические препараты разных групп.
Противоинфекционные препараты
Антисептики. Для лечения и профилактики инфекционных заболеваний век и конъюнктивы широко используют различные лекарственные средства, оказывающие антисептическое, обеззараживающее, дезодорирующее и противовоспалительное действие.Антисептические препараты применяют для обработки края век при блефаритах и ячмене, лечения конъюнктивитов и кератитов, а также для профилактики инфекционных осложнений в послеоперационном периоде, при травмах конъюнктивы, роговицы и попадании инородных тел в конъюнктивальную полость.
Современный антисептический препарат – 0,05% раствор пиклоксидина (Picloxydine; витабакт, vitabact), являясь производным бигуанидов, обладает широким спектром антибактериальных свойств, оказывает воздействие на многие грамположительныс и грамотрицательные бактерии, хламидии, некоторые вирусы и грибы. Пиклоксидин используют для профилактики и лечения инфекционных конъюнктивитов, в том числе хламидийной этиологии, а также кератитов и кератоконъюиктивитов. Препарат инсталлируют по 1 капле 2–6 раз в день. Продолжительность курса лечения не более 10 дней.
Фармацевтическая промышленность выпускает комбинированные препараты, оказывающие антисептическое действие, которые содержат борную кислоту (acidum borici). Следует помнить, что борная кислота легко проникает через кожу и слизистые оболочки, особенно у детей раннего возраста, медленно выводится из организма и может накапливаться в тканях и органах. В результате этого могут развиться токсические реакции: тошнота, рвота, диарея, десквамация эпителия, головная боль, нарушение сознания, олигурия.
В связи с выявленными побочными эффектами не рекомендуется использовать препарат при беременности, лактации и в педиатрической практике, особенно у новорожденных, а также применять препараты, содержащие более 2% раствора борной кислоты, из–за возможного тератогенного действия.
Комбинированные препараты, содержащие борную кислоту, 0,25% раствор сульфата цинка и 2% раствор борной кислоты (zinci sulfatis + + Boric acid), – глазные капли в тюбик–капельницах по 1,5 мл – применяю!' для лечения катаральных форм инфекционных конъюнктивитов, инстиллируют по 1 капле 1–3 раза в день. Препараты, содержащие борную кислоту, не рекомендуется использовать у больных с синдромом "сухого глаза".
Некоторые лекарственные средства, содержащие соли серебра, – У% раствор нитрата серебра, 2% раствор колларгола и /% раствор протаргола – применяют для профилактики бленнореи у новорожденных. С этой целью их закапывают однократно сразу после рождения ребенка. Препараты серебра несовместимы с органическиими веществами, хлоридами, бромидами, йодидами. При длительном применении препаратов серебра возможно прокрашивание тканей глаза восстановленным серебром (аргироз).
Сульфаниламидные препараты. В офтальмологической практике используют сульфацетамид (сульфацил–натрий, sulfacylum–natrium) в виде 10% и 20% растворов (глазные капли), а также 30% мази в тубах. Препарат применяют для лечения и профилактики конъюнктивитов, блефаритов и кератитов, 20% раствор – для профилактики и лечения гонорейных заболеваний глаз у новорожденных и взрослых.
Сульфаниламиды инсталлируют в конъюнктивальный мешок по 1 капле 5–6 раз в сутки. Для профилактики бленнореи у новорожденных закапывают по 1 капле 20% раствор сульфацетамида в каждый глаз 3 раза с интервалом 10 мин.
При одновременном применении сульфаниламидных препаратов с новокаином и дикаином снижается бактериостатический эффект сульфаниламидов. Это обусловлено содержанием в молекуле дикаина и новокаина остатка парааминобензойной кислоты. Лидокаин и оксибупрокаин не оказывают антисульфаниламидного действия. Установлена несовместимость сульфаниламидов с солями серебра.
Антибиотики. Для профилактики и лечения инфекционных заболеваний глазного яблока и его придатков применяют антибактериальные препараты, относящиеся к разным группам (хлорамфепикол, тетрациклины, макролиды, аминогликозиды, фторхинолоны, фузидиевая кислота, полимиксины). Выбор антибактериального средства зависит от чувствительности патогенных микроорганизмов и тяжести инфекционного процесса.
При лечении инфекционных заболеваний глаз используют не только глазные лекарственные формы (глазные капли, мази и пленки) антибактериальных препаратов, но также их инъекции (субконъюнктивальные, парабульбарные, внутримышечные и внутривенные инъекции) и интраокулярное введение.
Хлорамфеникол (левомицетин, Laevomycetinum). Это антибиотик широкого спектра действия, при местном и системном применении, в лекарственной форме (глазные капли – 0,25% раствор) легко проходит гематоофтальмический барьер. При местном применении терапевтическая концентрация хлорамфеникола создается в роговице, водянистой влаге, радужке, стекловидном теле; в хрусталик препарат не проникает.
Тетрациклины. Препараты этой группы не проникают в ткани глаза через неповрежденный эпителий. В случае повреждения эпителия роговицы эффективная концентрация тетрациклина во влаге передней камеры достигается через 30 мин после аппликации. При системном применении тетрациклин плохо проникает через гематоофтальмический барьер.
В офтальмологической практике используют как тетрациклин (Tetracycline), так и дитетрациклин (Ditetracycline) – дибензилэтилендиамииовая соль тетрациклина, который оказывает пролонгированное действие. При местном применении антибактериальное действие препарата сохраняется в течение 48–72 ч. Ранее использовавшийся окситетрациклин исключен из номенклатуры лекарственных средств.
Антибактериальные препараты, относящиеся к тетрациклиновой группе, используют для лечения и профилактики инфекционных конъюнктивитов, кератитов, а также для лечения трахомы. Следует отметить, что тетрациклин применяют для профилактики бленнореи у новорожденных. Не рекомендуется назначать эти препараты с лечебной целью новорожденным и детям в возрасте до 8 лет. Усиление антибактериального действия тетрациклинов наблюдается при их комбинировании с олеандомицином и эритромицином.
Препараты этой группы выпускают в виде 1% глазной мази, которую закладывают за нижнее веко: тетрациклиновую мазь 3–5 раз в день, а
дитетрацикли новую – 1 раз в день. Не рекомендуется применять препарат более 10 дней, за исключением случаев лечения трахомы: с этой целью препарат можно использовать в течение 2–5 мес. Длительность лечения устанавливает врач. Для профилактики бленнореи у новорожденных полоску тетрациклиновой мази длиной 0,5–1 см закладывают за нижнее веко однократно.
Макролиды. Для лечения инфекционных заболеваний глаз и профилактики бленнореи у новорожденных используют эритромицин (Erytromycin), который относится к группе макролидов.
Для лечения конъюнктивитов, кератитов, трахомы и профилактики бленнореи у новорожденных эритромицин применяется в виде мази (10.000 ЕД/г), которую закладывают за нижнее веко 3 раза в день, а при лечении трахомы 4–5 раз в день. Продолжительность лечения зависит от формы и тяжести заболевания, но не должна превышать 14 дней. При трахоме лечение следует сочетать с экспрессиями фолликулов. При стихании воспалительного процесса препарат применяют 2–3 раза в день. Длительность курса лечения трахомы не более 3 мес. Для профилактики бленнореи у новорожденных полоску мази длиной 0,5–1 см закладывают за нижнее веко однократно.
Гликопептиды. К гликопептидным антибиотикам относится ванкомищм (Vancomycin)y который легко проникает в ткани глазного яблока при местном и системном применении. Максимальная концентрация препарата достигается в течение первого часа после введения, эффективная концентрация сохраняется в течение 4 ч. Ваикомицин не оказывает токсического воздействия на ткани глаза при внутриглазном введении.
При лечении заболеваний глаз ванкомицин вводят также внутривенно в дозе 0,5–1 г каждые 8–12 ч. Кроме того, используют введение в стекловидное тело, для которого раствор ванкомицина готовят по следующей схеме: содержимое флакона (500 мг) растворяют в 5 мл изотонического раствора натрия хлорида, далее берут 1 мл полученного раствора и добавляют к нему изотонический раствор до 10 мл, затем к 0,1 мл полученного раствора добавляют изотонический раствор до 5,0 мл. Интравитреально вводят 0,5 мл полученного раствора.
Аминогликозиды (гентамицин, тобрамицин). Не рекомендуются одновременное применение нескольких аминогликозидных антибиотиков (возможно нефротоксическое, ототоксическое действие, нарушение минерального обмена и гемопоэза), а также использование аминогликозидов в сочетании с эритромицином и хлорамфениколом (вследствие фармацевтической несовместимости), полимиксином В, колистином, цефалоспоринами, ванкомицином, фуросемидом, анестетиками.
Аминогликозидные антибиотики выпускают в виде глазных капель (0,3% раствор гентамицина), 0,3% мази и глазных лекарственных пленок.
При умеренно выраженном инфекционном процессе 1–2 капли препарата инсталлируют в конъюнктивальный мешок каждые 4 ч или полоску мази длиной 1,5 см закладывают за нижнее веко пораженного глаза 2–3 раза в день. В случае развития тяжелого инфекционного процесса препарат закапывают каждый час или мазь закладывают за нижнее веко каждые 3–4 ч. По мере уменьшения выраженности явлений воспаления снижается частота инстилляций препарата. Длительность лечения не более 14 дней.
Антибиотики из группы аминогликозидов, кроме того, часто используют в составе комбинированных антибактериальных препаратов.
Фторхинолоны. При системном применении фторхинолоны легко проходят через гематоофтальмический барьер во внутриглазную жидкость.
Препараты данной группы (норфлоксацин, ципрофлоксацин, офлоксацин, ломефлоксацин) используют для лечения инфекционных заболеваний век, слезных органов, конъюнктивы (в том числе трахомы и паратрахомы), роговицы, а также для профилактики инфекционных осложнений после глазных операций и травм.
Фторхинолоны применяют в виде 0,3% глазных капель и мази. При нетяжелом инфекционном процессе в конъюнктивальный мешок пораженного глаза инсталлируют по 1 капле 5–6 раз в день или за нижнее веко закладывают полоску мази длиной 1–1,5 см 2–3 раза вдень. В случае развития тяжелого инфекционного процесса препарат закапывают каждые 15–30 мин или закладывают мазь каждые 3–4 ч. По мере уменьшения выраженности явлений воспаления снижают частоту применения препарата. Продолжительность курса лечения не более 14 дней. Для лечения трахомы 1–2 капли препарата инсталлируют в конъюнктивальный мешок пораженного глаза 2–4 раза в день в течение 1–2 мес.
Препараты не следует применять при повышенной чувствительности к ним больного, беременности, лактации и у детей до 15 лет.
Противогрибковые препараты. В настоящее время в России нет официально зарегистрированных глазных форм противогрибковых препаратов, за рубежом же широко применяют 5% суспензию натамицина. Из препаратов, которые используют системно для приема внутрь, можно отметать нистатин, кетоконазол, миконазол, флуконазол и флуцитозин.
Противовирусные препараты. При лечении вирусных заболеваний глаз используют химиотерапевтические средства (антиметаболиты), а также препараты, оказывающие неспецифическое и специфическое иммунокорригирующее действие.
Одним из первых антиметаболитов был синтезирован 5–йод–2–дезоксиуридин (Идоксуредин, ИДУ) – галогенопроизводный аналог тимидина. Идоксуредин – высокоэффективный противовирусный препарат, однако он обладает узким спектром противовирусной активности, так как эффективен только в отношении вируса простого герпеса. При местном применении ИДУ определяется в терапевтической концентрации только в эпителии и в меньшей степени в строме роговицы, незначительное его количество, не оказывающее вируцидного действия, накапливается во влаге передней камеры, радужке и стекловидном теле.
Учитывая особенности фармакокинетики ИДУ, его применяют для лечения поверхностных форм герпетического кератита в виде 0,1% раствора (глазные капли), который закапывают 3–5 раз в сутки. Поскольку при длительном применении препарата могут развиться токсико–аллергические реакции в конъюнктиве и роговице (фолликулез, хемоз, диффузная эпителиопатия, отек роговицы), продолжительность курса лечения не должна быть больше 2–3 нед, а при отсутствии признаков ремиссии – 7–10 дней.
Ацикловир (Aciclovir) – высокоэффективный противовирусный препарат, оказывающий вируцидное действие на вирусы простого (herpes simplex) и опоясывающего (herpes zoster) герпеса, в меньшей степени он эффективен в отношении вируса Эпштейна–Барр и цитомегаловируса. Ацикловир не влияет на нормальные клеточные процессы и не задерживает процесс регенерации роговицы.
Ацикловир применяют в виде 3% глазной мази, которую закладывают за нижнее веко 5 раз вдень в течение 7–10 дней. С целью профилактики рецидива заболевания необходимо продолжать лечение в течение 3 дней после клинического излечения. При местном применении препарата после закладывания мази могут отмечаться умеренное жжение, воспалительные реакции, точечный кератит.
При глубоких формах герпетических кератитов и увеитов одновременно назначают местное лечение ацикловиром и его прием внутрь (по 200 мг 3–5 раз в день в течение 5–10 дней) или парентеральное введение (внутривенно капельно из расчета 5 мг/кг каждые 8 ч в течение 5 дней).
Неспецифическая иммунотерапия. При лечении вирусных заболеваний глаз применяют как экзогенные интерфероны, так и препараты, стимулирующие выработку эндогенных интерферонов. В качестве противовирусных средств используют интерфероны, вырабатываемые лейкоцитами донорской крови человека под воздействием вируса и получаемые методами генной инженерии.
Интерферон лейкоцитарный человеческий сухой (Intcrferonum leucocyticum humanum siccum) выпускают в ампулах (емкостью 2 мл), содержащих лиофилизированный порошок (1.000 ME) для приготовления раствора. Содержимое ампулы разводят в 1 мл стерильной дистиллированной воды. При поверхностных кератитах и конъюнктивитах раствор инстиллируют по 1 капле не менее 12 раз в день, при стромальном кератите и кератоиридоциклите препарат вводят субконъюнктивально по 600.000 ME ежедневно или через день. Продолжительность курса лечения 15–25 дней.
Индукторы интерферона (интерфероногены) при введении в организм стимулируют выработку эндогенных интерферонов различных типов. Для лечения вирусных заболеваний глаз используют различные интерфероногены.
Полудан (Poludanum) – биосинтетический интерфероноген отечественного производства – применяют в виде глазных капель и субконъюнктивальных инъекций при аденовирусных и герпетических конъюнктивитах, кератоконъюнктивитах, кератитах и кератоиридоциклитах (кератоувеитах), иридоциклитах, хориоретинитах, невритах зрительного нерва.
Раствор полудана, предназначенный для инстилляций в глаз, готовят путем растворения содержимого флакона в 2 мл воды для инъекций. Готовый раствор должен быть использован в течение 7 дней. Раствор полудана для субконъюнктивальных инъекций готовят путем растворения содержимого флакона в 1 мл воды для инъекций.
Для лечения конъюнктивитов и поверхностных кератитов раствор полудана инсталлируют в конъюнктивальный мешок по 1–2 капли 6–8 раз в сутки. По мере стихания воспалительных явлений число инстилляций уменьшают до 3–4 раз в день.
При стромальных кератитах и кератоиридоциклитах раствор полудана вводят субконъюнктивально по 0,5 мл ежедневно или через день. На курс назначают 15–20 инъекций.
Пирогенал (Pyrogenalum) – полисахарид бактериального происхождения отечественного производства – оказывает пирогенное и интерфероногенное действие. Препарат выпускают в ампулах в виде раствора, в 1 мл которого содержится по 100, 250, 500 или 1.000 МПД. Его вводят субконъюнктивально 1 раз в день или в 2–3 дня, начиная с дозы 2,5 мкг (25 МПД), которую затем постепенно повышают до 5 мкг (50 МПД). Курс лечения включает 5–15 инъекций в зависимости от его эффективности.
При применении возможны повышение температуры тела, появление головной боли, тошноты, рвоты, болей в пояснице.
Циклоферон (Cycloferonum); отечественный препарат – полисан – низкомолекулярный индуктор интерферона – выпускают в виде раствора для инъекций, концентрация циклоферона в котором 125 мг/мл, и лиофилизированного порошка для приготовления раствора (250 мг во флаконе). Препарат вводят внутримышечно по 250 мг 1 раз в сутки. Базовый курс, состоящий из 10 инъекций, проводят по схеме: 1; 2; 4; 6; 8; 11; 14; 17; 20–й и 23–й день. По другой схеме курс состоит из 5 инъекций: первые 2 инъекции ежедневно, а остальные – через день. Курс лечения повторяют через 10–14 дней.
Для специфической иммунотерапии применяют нормальный иммуноглобулин человека, противокоревой иммуноглобулин, чигаин (очищенная сыворотка молозива человека) и противогерпетическую вакцину. Однако широкого распространения в клинической практике эти препараты не получили.
Противовоспалительные препараты
Для лечения воспалительных заболеваний глаз используют глюкокортикостероиды (ГКС) и нестероидные противовоспалительные средства.Глюкокортикостероиды. По продолжительности противовоспалительного эффекта выделяют ГКС короткого, средней продолжительности, длительного и пролонгированного действия. Лекарственные формы, используемые в офтальмологической практике, содержат практически все группы ГКС. ■ ГКС короткого действия (6–8 ч) – гидрокортизон (0,5%, 1% и 2,5% глазная мазь) ■ ГКС средней продолжительности действия (12–36 ч) – преднизолон (0,5% и 1% глазные капли) ■ ГКС длительного действия (до 72 ч) – дексаметазон (0,1% глазные капли и мазь), бетаметазон (0,1% глазные капли и мазь) ■ ГКС пролонгированного действия (7–10 дней) – триамцинолона ацетоннд, бетаметазона пропионат (инъекционные формы).
ГКС, за исключением гидрокортизона, легко проникают практически во все ткани глазного яблока, в том числе в хрусталик, как при местном, так и при системном применении.
Показания к использованию ГКС в офтальмологической практике довольно широки: ■ аллергические заболевания глаз (дерматиты век, блефариты, конъюнктивиты и кератоконъюнктивиты) ■ увеиты ■ симпатическая офтальмия ■ профилактика и лечение воспалительных явлений после травм и операций ■ восстановление прозрачности роговицы и подавление неоваскуляризации после кератитов, химических и термических ожогов (после полной эпителизации роговицы).
ГКС не рекомендуется применять при вирусных заболеваниях роговицы (поверхностных формах кератитов, сопровождающихся дефектом эпителия) и конъюнктивы, микобактериальной и грибковой инфекции глаз. С осторожностью следует использовать ГКС при высоком риске повышения внутриглазного давления.
При длительном применении стероидных препаратов могут наблюдаться повышение внутриглазного давления с последующим развитием глаукомы, образование задней субкапсулярной катаракты, а также замедление процесса заживления ран и развитие вторичной инфекции.
Грибковое поражение роговицы особенно часто возникает при длительном применении стероидов. Появление на роговице незаживающих язв после длительного лечения стероидными препаратами может свидетельствовать о развитии грибковой инвазии. Вторичная бактериальная инфекция может возникнуть как следствие подавления защитной реакции организма больного.
Для лечения заболеваний глаз ГКС применяют в виде глазных капель и мази, а также парентерально и перорально. При местном применении препарат закапывают в конъюнктивальный мешок пораженного глаза (глаз) 3 раза в день. В течение 24–48 ч лечения при выраженном воспалительном процессе возможно применение препарата через каждые 2 ч. Мазь закладывают за нижнее веко 2–3 раза в день.
Нестероидные противовоспалительные средства. Из этой группы лекарственных средств в офтальмологической практике применяют ликлофенак натрия – производное фен ил уксусной кислоты. Диклофенак натрия (0,1% раствор – глазные капли) оказывает выраженное противовоспалительное, жаропонижающее и аналгезирующее, а при длительном применении и десенсибилизирующее действие, способен ингибировать агрегацию тромбоцитов.
Диклофенак используют для усиления мидриаза во время операций по поводу катаракты, лечения конъюнктивитов неинфекциониой природы, а также профилактики и лечения послеоперационного и посттравматического увеита, предупреждения кистозной макулопатии.
Больные хорошо переносят препарат при местном применении. Не рекомендуется назначать его детям, беременным и кормящим женщинам, а также применять с осторожностью у больных с бронхиальной астмой и выраженным вазомоторным ринитом.
Для предотвращения сужения зрачка в ходе оперативного или лазерного вмешательства в течение 2 ч до его выполнения 0,1% раствор диклофенака закапывают 4 раза с интервалом 30 мин. С лечебной целью препарат применяют 4–6 раз в день в течение 5–14 дней. Для профилактики послеоперационной кистозной макулопатии (после экстракции катаракты, антиглаукоматозных операций) диклофенак закапывают 3 раза в день в течение 1 мес после вмешательства.
Противоаллергические препараты. Лечение аллергических заболеваний глаз включает применение глюкокортикостероидов, стабилизаторов мембран тучных клеток, антигистаминных и сосудосуживающих препаратов.
Мембраностабилизаторы. Из препаратов данной группы наиболее широко применяют кромоглициевую кислоту (Cromoglicic acid). Наибольшая высокая терапевтическая эффективность отмечается при профилактическом использовании препарата. Довольно часто кромоглициевую кислоту применяют в сочетании со стероидными препаратами при лечении аллергических конъюнктивитов, в результате чего уменьшается потребность в стероидныхлекарственных средствах; 2% и 4% растворы (глазные капли) кромоглициевой кислоты используют для лечения сезонного и других видов аллергических конъюнктивитов, в том числе гиперпапиллярного конъюнктивита, вызванного ношением контактных линз. Препарат не рекомендуется назначать лицам с повышенной чувствительностью к кромоглициевой кислоте, беременным и кормящим матерям, а также детям до 4 лет.
Раствор кромоглициевой кислоты инстиллируют в конъюнктивальный мешок по 1 капле 2–6 раз в день. Лечение рекомендуется начинать за 7–10 дней до возможного развития сезонного аллергического конъюнктивита и продолжать еще в течение 7–10 дней после исчезновения симптомов заболевания. Сразу после инстилляции возможны развитие временного затуманивания зрения и жжение.
В офтальмологической практике для лечения аллергических заболеваний, помимо кромоглициевой кислоты, используют лодоксамид (Lodoxamide), который не только препятствует дегрануляции тучных клеток, но также подавляет миграцию и выделение ферментов и цитотоксических факторов из эозинофилов. Лодоксамид (0,1% раствор) применяют по тем же показаниям, что и кромоглициевую кислоту. Препарат закапывают4раза вдень. Продолжительность курса лечения не более 4 нед. Однако он может вызвать развитие большого числа побочных эффектов, к которым относятся преходящее жжение, покалывание, зуд и слезотечение, головокружение, нарушения зрения, отек, отложение кристаллов и изъязвление роговицы, сухость слизистой оболочки носа, кожный зуд.
Антигистаминные препараты. В настоящее время для лечения заболеваний глаз используют блокаторы Н1–рецепторов: антазолин, ацеластин, левокабастин и фенирамин. Эти лекарственные средства применяют для лечения аллергических заболеваний глаз как в качестве монокомпонентных, так и комбинированных препаратов по 1 капле 2–3 раза в лень. Не рекомендуется применять их в период беременности и лактации, а также при лечении у детей до 4 лет. При использовании антигистаминных препаратов могут отмечаться легкое раздражение глаз и горький вкус во рту.
Сосудосуживающие препараты. Аллергические заболевания сопровождаются выраженной сосудистой реакцией, проявляющейся отеком и гиперемией тканей. Симпатомиметические средства, оказывающие сосудосуживающее действие, уменьшают отек и гиперемию конъюнктивы.
Для уменьшения выраженности симптомов аллергии используют монокомпонентные и комбинированные препараты, содержащие α–адреномиметики, – тетразолин, нафазолин, оксиметазолин.
Данные лекарственные средства не рекомендуется назначать лицам с повышенной чувствительностью к ним, больным с закрытоугольной глаукомой, тяжелыми заболеваниями сердечно–сосудистой системы (ИБС, артериальная гипертензия, феохромоцитома), болезнями обмена веществ (гиперфункция щитовидной железы, сахарный диабет) и детям моложе 5 лет.
Сосудосуживающие препараты закапывают в конъюнктивальный мешок по 1 капле 2–3 раза в день. Не рекомендуется проводить инстилляции глазных капель более 7–10 дней. При отсутствии эффекта в течение 48 ч необходимо прекратить применение препарата.
На фоне лечения препаратами этой группы могут развиваться побочные реакции: расплывчатое зрение, раздражение конъюнктивы, повышение внутриглазного давления, расширение зрачка. Иногда возможны системные побочные эффекты: сердцебиение, головная боль, повышенная утомляемость, потоотделение и повышение артериального давления, гипергликемия.
Препараты, применяемые для лечения глаукомы
По влиянию на гидродинамику глаза антиглаукомные препараты можно разделить на две группы: лекарственные средства, улучшающие отток внутриглазной жидкости, и средства, угнетающие ее продукцию (табл. 25.1).Средства, улучшающие отток жидкости из глаза. Холиномиметики. Из М–холиномиметиков для лечения глаукомы используют пилокарпин и карбахол.
Пилокарпин (Pilocarpine) – растительный алкалоид, получаемый из растения Pilocarpus pinnatifolius Faborandi. Препарат используют в виде пилокарпина гидрохлорида или пилокарпина нитрата. Пилокарпин выпускают в виде 1%, 2%, 4% или 6% водного раствора (глазные капли), расфасованного в тюбики–капельницы по 1,5 мл или во флаконы по 5, 10 и 15 мл.
Таблица 25.1. Распределение гипотензивных средств по точкам приложения
| Группа | Подгруппа | Основные препараты |
|---|---|---|
| Средства, улучшающие отток внутриглазной жидкости | ||
| Холиномиметики | М–холиномиметики | Пилокарпин, карбахол |
| Симпатомиметики | α– и β–Стимуляторы | Эпинефрин, дипивефрин |
| Простагландины | Просгагландин F2а | Латанопрост |
| Средства, угнетающие продукцию внутриглазной жидкости | ||
| Симпатомиметики | α2–Стимуляторы | КлонИДИН |
| Адреноблокаторы | α– и β–адреноблокаторы | Проксодолол |
| β1–адреноблокаторы | Бетаксолол | |
| β1– и β2–адреноблокаторы | Тимолола малеат | |
| Ингибиторы карбоангидразы | Бринзоламид,дорзоламид,ацетазоламид | |
| Комбинированные препараты | ||
| – | – | Проксофилин |
| Фотил | ||
Фармацевтическая промышленность выпускает глазные капли пилокарпина пролонгированного действия, в которых в качестве растворителя используют 0,5% или 1% раствор метил целлюлозы, 2% раствор карбоксиметилцеллюлозы или 5–10% раствор поливинилового спирта. Длительность действия при однократной инстилляции этих препаратов увеличена до 8–12 ч. Наиболее продолжительное действие оказывают гель и мазь, содержащие пилокарпин. Данные лекарственные формы пилокарпина применяют 1 раз в день.
Карбахал (Carbachol) относится к синтетическим холиномиметикам. Гипотензивное действие карбахола (1,5% и 3% раствор) начинается через 20–30 мин после инстилляции, достигает максимума ко 2–му часу и продолжается 4–8 ч. По выраженности гипотензивного эффекта карбахол несколько превосходит пилокарпин. Карбахол рекомендуется закапывать 2–4 раза в день.
При длительном применении препарата отмечаются такие же побочные эффекты, как и при использовании других миотиков. Однако все эти явления выражены в большей степени, чем при применении пилокарпина. В некоторых случаях у лиц пожилого возраста отмечается появление или ускорение созревания катаракты. Возможно развитие помутнений роговицы и преходящей буллезной кератопатии.
Из побочных эффектов системного характера следует отметить ощущение прилива крови к лицу, потливость, боли в эпигастральной области, усиление перистальтики кишечника, затруднение мочеиспускания.
Неселективные симпатомиметики. В эту подгруппу входят эпинефрин и дипивефрин, которые являются прямыми стимуляторами α– и β–адренорецепторов различной локализации.
Эпинефрин (Epinephrine) плохо проникает через роговицу, и для достижения достаточного терапевтического эффекта необходимо использовать высокие концентрации препарата (1–2% растворы). При этом возможно развитие побочных эффектов как местного, так и системного характера.
Побочные эффекты системного характера – повышение артериального давления, тахиаритмии, кардиалгии, цереброваскулярные расстройства; местные явления – жжение после инстилляции, гиперемия конъюнктивы, отложение пигмента в конъюнктиве и роговице, мидриаз, макулопатии, уменьшение кровообращения в диске зрительного нерва.
В настоящее время глазных лекарственных средств, содержащих адреналин, разрешенных к применению в России, не имеется.
Дипивефрин (Dipivejrine) является предшественником эпинсфрина, в который он биотрансформ ируется при прохождении через роговицу. Дипивефрин (0,1% раствор) обладает высокой липофильностью и проникает в глаз в десятки раз легче. Гипотензивный эффект 0,1% раствора дипивефрина соответствует эффекту 2% раствора эпинефрина.
Местные побочные явления менее выражены, чем при использовании эпинсфрина, значительно реже отмечаются пигментация переднего отдела глаза и век, а также макулопатия, однако у больных с афакией или артифакией риск развития макулопатии выше.
В связи с низкой концентрацией глазных капель дипивефрина показания к его применению расширяются у пожилых больных, а также пациентов с артериальной гипертензией и другими заболеваниями сердечно–сосудистой системы. Обычно раствор дипивефрина закапывают 1–2 раза в сутки.
Простаглапдины f2«. В последние годы огромный интерес вызывают препараты, относящиеся к группе простагландинов Ffc. Улучшая увеосклеральный путь оттока водянистой влаги вследствие воздействия на простагландиновые рецепторы различных подклассов, эти препараты значительно снижают внутриглазное давление. Согласно последним данным, усиление увеосклерального оттока обусловлено разряжением эксграцеллюлярного матрикса ресничной мышцы.
К подгруппе простагландинов F2u относятся два препарата – 0,005% раствор латанопроста (во флаконах по 2,5 мл) и 0,12% раствор унопростона. Препараты данной подгруппы дают выраженный гипотензивный эффект, кроме того, по данным литературы, унопростон улучшает кровообращение в тканях глаза.
Латанопрост (Latanoprost) вызывает снижение внутриглазного давления примерно через 3–4 ч после введения, максимальный эффект отмечается через 8–12 ч. Гипотензивное действие продолжается в течение не менее 24 ч. В среднем офтальмотонус снижается на 35% от исходного уровня.
Через 3 мес после начала лечения отмечается усиление пигментации радужки глаза от голубой до коричневой. Возможно усиление роста ресниц, в редких случаях могут развиться ирит и кистовидный отек макулы. Рекомендуемый режим закапывания – 1 раз в день (на ночь).
Унопростон (Unoproston) дает менее выраженный гипотензивный эффект, однако, по данным литературы, он улучшает кровообращение в тканях глаза.
Часто (в 1–7% случаев) возникают побочные реакции местного характера: гиперемия конъюнктивы, кератит, эрозия роговицы. Менее часто (в 0,1–1% случаев) наблюдаются точечные помутнения роговицы, хемоз, дерматит век, жжение, ощущение инородного тела в глазу и затуманивание зрения. Длительное применение унопростона может вызвать пигментные изменения в тканях глазного яблока или окружающих его структур, эти изменения могут быть преходящими.
Могут возникать следующие системные побочные реакции: головная боль, повышение артериального давления, чувство заложенности носа, сухость во рту, нарушение чувствительности кончика языка, рвота, тошнота и учащенное сердцебиение.
Рекомендуемый режим применения – 2 раза в день.
Средства, угнетающие продукцию внутриглазной жидкости. Селективные симпатомиметики. К препаратам данной группы относится клонидин (Clonidine), который способствует уменьшению продукции внутриглазной жидкости. Гипотензивный эффект клон идина проявляется через 30 мин после инстилляции, максимально выражен через 3 ч и сохраняется до 8 ч.
Побочные эффекты местного характера – жжение и ощущение инородного тела в глазу, сухость во рту, заложенность носа, выявляют также гиперемию и отек конъюнктивы, хронические конъюнктивиты. Нежелательные явления общего характера – сонливость, замедление психических и двигательных реакций. Периодически могут отмечаться брадикардия, запор, снижение желудочной секреции. Применение глазных капель клонидина может сопровождаться снижением артериального давления.
Клонидин рекомендуется закапывать 2–4 раза в день. Лечение начинают с назначения 0,25% раствора. В случае недостаточного снижения внутриглазного давления используют 0,5% раствор. При наличии побочных явлений, связанных с использованием 0,25% раствора, назначают 0,125% раствор.
β–адреноблокаторы. При лечении глаукомы препаратами первого выбора в большинстве случаев являются β–адреноблокаторы.
β1,β2–адреноблокаторы. К неселективным β–адреноблокаторам относят тимолола малеат.
Тимолол (Timololum) угнетает секрецию внутриглазной жидкости. Однако, по некоторым данным, при длительном применении тимолола наблюдается улучшение показателей оттока водянистой влаги, что, по–видимому, связано с деблокадой склерального синуса. Гипотензивный эффект наступает через 20 мин после инстилляции, достигает максимума через 2 ч и сохраняется не менее 24 ч. Снижение внутриглазного давления составляет около 35% от исходного уровня. Разница в выраженности гипотензивного действия 0,25% и 0,5% растворов составляет 10–15%.
Побочные эффекты местного характера – сухость глаза, раздражение конъюнктивы, отек эпителия роговицы, точечный поверхностный кератит, аллергический блефароконъюнктивит.
Лечение начинают с применения 0,25% раствора 1–2 раза вдень. При его неэффективности используют 0,5% раствор в той же дозе. Оценку гипотензивного эффекта следует проводить через 2 нед регулярного применения. Не реже I раза в полгода необходимо осуществлять контроль состояния роговицы, слезоотделения и зрительных функций.
Препарат выпускают в виде 0,25% или 0,5% глазных капель в стеклянных и пластмассовых флаконах по 5 и 10 мл.
β1–адреноблокаторы. Из селективных β–адреноблокаторов в офтальмологической практике в настоящее время широко применяют бетаксолол. После однократного закапывания бетаксалола (Betaxolol) гипотензивный эффект обычно проявляется через 30 мин, а максимальное снижение офтальмотонуса, составляющее около 25% от исходного уровня, наступает примерно через 2 ч и сохраняется в течение 12 ч. По некоторым данным, в отличие от тимолола бетаксолол не вызывает ухудшения кровотока в зрительном нерве, а наоборот, сохраняет или даже улучшает его.
Побочные явления местного характера, возникающие сразу после закапывания, – кратковременный дискомфорт и слезотечение. Редко выявляют точечный кератит, снижение чувствительности роговицы, светобоязнь, зуд, сухость и покраснение глаз, анизокорию. Побочные эффекты системного характера такие же, как при применении тимолола, однако влияние на дыхательную систему незначительное.
α,β–адреноблокаторы. В последние годы вызывают интерес "гибридные" адреноблокаторы.
Представителем этой группы является оригинальный отечественный адреноблокатор проксодолол (Proxodolol), оказывающий блокирующее действие на β1–, β2– и α1–адренорецепторы. Механизм снижения офтальмотонуса заключается в угнетении продукции внутриглазной жидкости. Гипотензивное действие проявляется через 30 мин после однократной инстилляции, достигает максимума через 4–6 ч, эффект сохраняется до 8–12 ч. Гипотензивный эффект довольно выражен: максимальное снижение внутриглазного давления около 7 мм рт.ст. от исходного уровня.
Лечение начинают с применения 1% раствора 2–3 раза в день. При его неэффективности используют 2% раствор в той же дозе. Гипотензивный эффект проксодолола, как и других адреноблокаторов, проявляется постепенно, поэтому его оценку следует проводить через 2 нед регулярного применения.
Побочные эффекты – брадикардия, артериальная гипотензия, бронхоспазм у чувствительных к проксодололу больных.
Ингибиторы карбоангидразы. Эта подгруппа препаратов оказывает угнетающее воздействие на фермент карбоангидразу, которая содержится в отростках цилиарного тела и играет важную роль в продукции внутриглазной жидкости.
Бринзоламид (Brinzolamide) – новый ингибитор карбоангидразы местного действия, угнетающий продукцию внутриглазной жидкости. Препарат выпускают в виде 1% гл ной суспензии. Показания и провопоказания к применению также, как для дорзоламида, однг бринзоламид лучше переноси: больными.
Дорзоламид (Dorzolamide) дает максимальный гипотензивный эффект через 2 ч после инстилляции прег рата. Последействие сохраняется через 12 ч. Максимальное снижен офтальмотонуса составляет 18–26 от исходного уровня.
Противопоказания к примению – повышенная чувствите; ность к компонентам препарата.
У 10–15% больных возмож развитие точечной кератопатии и а лергической реакции. Нарушен зрения, слезотечение, светобояз отмечают у 1–5% больных. Край редко отмечаются боли, покраснен глаз, преходящая миопия и ирид циклит. Редко возникают системж побочные реакции, такие как голо ная боль, тошнота, астения, поче нокаменная болезнь, кожная сыпь
При монотсрапии препарат зак пывают 3 раза в день, при использ вании в сочетании с другими гип« тензивными лекарственными сре. ствами – 2 раза в день. Следует о метить, что совместное применен1 дорзоламида практически со веек антиглаукомными препаратами да» дополнительный эффект.
В отличие от дорзоламида ацетх золамид (Acetazolamide) снижает внутриглазное давление при системном применении.
Офтальмотонус при приеме ацетазоламида начинает снижаться через 40–60 мин, максимум действия Не блюдается через 3–5 ч, внутриглазное давление остается ниже исходного уровня в течение 6–12 ч.
Препарат применяют для купирования острого приступа глаукомы предоперационной подготовки больных, при комплексном лечении глаукомы с упорным течением.
При лечении глаукомы препарат принимают внутрь по 0,125–0,25 г 1–3 раза в день. После каждых 5 дней приема делают перерыв на 2 дня. При длительном лечении ацетазоламидом необходимо назначать калиевые препараты (оротат калия, панангин) и калийсберегающую диету. При подготовке к операции назначают по 0,5 г накануне и утром в день ее выполнения.
Комбинированные препараты. Для повышения эффективности медикаментозного лечения и улучшения качества жизни больных с глаукомой разработан ряд комбинированных препаратов, содержащих вещества с различным механизмом гипотензивного действия, при одновременном применении которых наблюдается аддитивный эффект.
С этой целью в офтальмологической практике чаще всего используют сочетание β–адреноблокаторов с холиномиметиками. Одной из наиболее часто применяемых комбинаций является сочетание 0,5% раствора тимолола с 2% раствором пилокарпина – фотил (Fotil) или его 4% раствором – фотил форте (Fotil forte). После инстилляции данных препаратов эффективное снижение внутриглазного давления начинается со 2–го часа, максимальный эффект отмечается через 3–4 ч, продолжительность гипотензивного действия составляет около 24 ч. Максимальное снижение офтальмотонуса составляет более 32% от исходного уровня. Рекомендуемый режим применения 1–2 раза в день.
Комбинированный препарат проксофилин, включающий "гибридный” α,β–адреноблокатор проксодолол (1% раствор) и α–стимулятор клонидин (0,25% раствор), оказывает потенцированное гипотензивное действие вследствие угнетения продукции внутриглазной жидкости.
При применении данной комбинации снижение внутриглазного давления начинается через 30 мин – 1 ч после однократной инстилляции, достигает максимума спустя 4–6 ч и сохраняется в течение 24 ч. Максимальное уменьшение офтальмотонуса составляет более 10 мм рт.ст. от исходного уровня. Рекомендуемый режим применения 2–3 раза в день.
Противокатарактальные препараты
Лекарственные средства, применяемые для лечения катаракты, условно можно разделить на 2 группы: средства, содержащие неорганические соли в сочетании с витаминами, цистеином и другими препаратами, нормализующими обменные процессы, и средства, содержащие соединения, нормализующие окислительно–восстановительные процессы в хрусталике и тормозящие действие хининовых соединений.Группа препаратов, содержащих минеральные соли и активаторы обменных процессов, довольно многочисленна. Данные лекарственные средства могут содержать одно действующее вещество (таурин) или комплекс активных веществ, таких как цитохром С, аденозин, тиамин, глутатион, никотинамид и цистеин. Наиболее широко применяют следующие лекарственные средства: ■ офтан катахром (Oftan Catachrom) – глазные капли во флаконах по 10 мл. В состав препарата входят (на 1 мл раствора): цитохрома С 0,675 мг, натрия сукцината 1 мг, аденозина 2 мг, никотинамида 20 мг, бензалкония хлорида 40 мкг ■ витайодурол (Vitaiodyrol) – глазные капли во флаконах по 10 мл. В состав препарата входят (на 100 мл): цистеина гидрохлорида 30 мг, АТФ 2,7 мг, никотиновой кислоты 30 мг, глутатиона 6 мг, тиамина 30 мг, кальция хлорида 0,3 мг, магня хлорида 0,3 мг, калия йодида 1,5 г.
Вторая группа препаратов представлена двумя лекарственными средствами – пиреноксином и азапентаценом.
Пиреноксин избирательно ингибирует действие хиноновых веществ, продуцируемых в результате аномального метаболизма ароматической аминокислоты, которые стимулируют превращение водорастворимого белка в нерастворимый в хрусталике, в результате чего вещество хрусталика мутнеет. Ингибируя действие хиноновых веществ, пиреноксин предотвращает развитие катаракты.
Азапентацен предохраняет сульфгидрильные группы белков хрусталика от окисления, оказывает активизирующее воздействие на протеолитические ферменты, содержащиеся во влаге передней камеры глаза.
Мидриатики
Мидриаз может быть обусловлен усилением действия дилататора зрачка под воздействием симпатомиметиков, а также ослаблением эффекта сфинктера зрачка вследствие блокады холинорецепторов, при этом одновременно происходит парез цилиарной мышцы. В связи с этим для расширения зрачка применяют М–холиноблокаторы (непрямые мидриатики) и симпатомиметики (прямые мидриатики).М–холиноблокаторы. В результате блокады М–холинорецепторов, расположенных в сфинктере зрачка и цилиарной мышце, происходит пассивное расширение зрачка за счет преобладания тонуса мышцы, расширяющей зрачок, и расслабления мышцы, суживающей его. Одновременно вследствие расслабления нилиарной мышцы возникает парез аккомодации.
Мидриатики не рекомендуется применять при лечении больных с закрытоугольной глаукомой.
Интенсивно пигментированная радужка более устойчива к дилатации, для достижения эффекта иногда необходимо увеличивать концентрацию препарата или частоту введения, поэтому следует опасаться передозировки мидриатиков. Расширение зрачка может спровоцировать острый приступ глаукомы у пациентов с данной патологией, лиц старше 60 лет и лиц с гиперметропией, предрасположенных к глаукоме, в связи с тем что у них неглубокая передняя камера.
Необходимо предупреждать пациентов о том, что вождение автомобиля в течение как минимум 2 ч после исследования запрещается.
По силе и длительности действия различают М–холиноблокаторы короткого (диагностического) и длительного (лечебного) действия.
Длительно действующие мидриатики используют для достижения циклоплегии с целью исследования рефракции у детей. Кроме того, их применяют для лечения спазмов аккомодации полустойкого и стойкого характера у детей с аномалиями рефракции и в комплексной терапии воспалительных заболеваний переднего отдела глаза с целью предотвращения развития задних синехий.
Атропин (Atropin) оказывает максимально выраженное мидриатическое и циклоплегическое действие. Расширение зрачка и циклоплегия достигают максимума через 30–40 мин после однократного закапывания атропина и сохраняются в течение 10–14 дней.
В клинической практике используют 0,5% и 1% раствор атропина. У взрослых и детей старше 7 лет с лечебной целью применяют 1% раствор атропина, который закапывают 2–3 раза в день, для достижения циклоплегии – 2 раза в день. У детей до 7 лет можно использовать только 0,5% раствор.
Препарат не рекомендуется назначать больным с закрытоугольной глаукомой, выраженными нарушениями мочеиспускания при аденоме предстательной железы и у детей до 3 мес. Атропин следует применять с осторожностью у больных с тяжелыми заболеваниями сердечно–сосудистой системы.
При лечении атропином возможно развитие системных побочных эффектов, для уменьшения выраженности которых на 1 мин после инстилляции необходимо пережимать слезные канальцы у внутреннего угла глаза.
Местные побочные эффекты – повышение внутриглазного давления, гиперемия кожи век, гиперемия и отек конъюнктивы (особенно при длительном применении атропина), светобоязнь.
Атропин выпускают в виде 1% глазных капель и мази; 0,5% глазные капли, содержащие атропин, изготовляют ex tempore.
Циклопентолат (Cyclopentolate) оказывает менее выраженное по сравнению с атропином мидриатическое действие. Максимальный фармакологический эффект наступает через 15–30 мин после однократной инстилляции циклопентолата. Мидриаз сохраняется в течение 6–12 ч. Остаточные явления циклоплегии сохраняются 12–24 ч.
Препарат используют для достижения циклоплегии с целью исследования рефракции у детей для лечения спазмов аккомодации полустойкого и стойкого характера и в комплексной терапии воспалительных заболеваний переднего отдела глаза, при предоперационной подготовке больных к экстракции катаракты.
С целью исследования глазного дна циклопентолат закапывают 1–3 раза по 1 капле с интервалом 10 мин, для достижения циклоплегии требуется 2–3–кратное закапывание с интервалом 15–20 мин. С лечебной целью его применяют 3 раза в день.
Циклопентолат не рекомендуется назначать больным с закрытоугольной глаукомой и детям до 3 мес. При его применении возможно повышение внутриглазного давления и раздражение конъюнктивы.
Тропикамид (Tropicamid) – короткодействующий мидриатик. Расширение зрачка после закапывания тропикамида наблюдают через 5–10 мин, максимальный мидриаз отмечают через 20–45 мин, продолжительность эффекта 1–2 ч, исходная ширина зрачков восстанавливается через 6 ч. Максимальный парез аккомодации возникает через 25 мин и сохраняется в течение 30 мин. Полное купирование циклоплегии наступает через 3 ч.
Препарат применяют при исследовании глазного дна, редко используют для определения рефракции у маленьких детей и с лечебной целью для профилактики задних синехий при воспалительных заболеваниях глаз. Тропикамид применяют в виде 0,5% и 1% растворов.
Для диагностического расширения зрачка однократно инсталлируют 1 каплю 1% раствора или двукратно по 1 капле 0,5% раствора с интервалом 5 мин. Через 10 мин можно проводить офтальмоскопию. Для определения рефракции препарат закапывают 6 раз с интервалом 6–12 мин. Примерно через 25–50 мин наступает парез аккомодации и можно проводить исследование. С лечебной целью тропикамид применяют 3–4 раза в день.
Препарат следует применять с осторожностью у больных с закрытоугольной глаукомой.
При применении возможны развитие фотофобии, повышение внутриглазного давления, острого приступа закрытоугольной глаукомы.
Симпатомиметики. Симпатомиметики, являясь агонистами α–адренорецепторов, повышают тонус мышцы, расширяющей зрачок, в результате чего развивается мидриаз, однако при этом не наблюдается пареза цилиарной мышцы и повышения внутриглазного давления. Мидокториатический эффект выраженный, но кратковременный (4–6 ч), потенцируется М–холиноблокаторами.
Для диагностического расширения зрачка и усиления эффекта М–холиноблокаторов перед оперативными вмешательствами на глазном яблоке и после них применяют раствор фенилэфрина (Phenylephrin).
Как и М–холиноблокаторы, фенилэфрин не рекомендуется применять у больных с закрытоугольной глаукомой. Следует избегать использования 10% раствора фенилэфрина у детей и лиц пожилого возраста, при сердечно–сосудистых заболеваниях его назначать нельзя или нужно применять 2,5% раствор. Фенилэфрин следует с осторожностью использовать при тахикардии, гипертиреоидизме, сахарном диабете. Необходимо предупреждать больных, что водить автомобиль как минимум в течение 2 ч после исследования нельзя.
При местном применении возможно появление боли и покалывание в глазах (может потребоваться использование местных анестетиков за несколько минут), затуманивание зрения, фотофобии. У чувствительных больных возможно развитие побочных эффектов системного характера: аритмия, артериальная гипертензия, коронароспазм. Возможно усиление сосудосуживающего эффекта при одновременном системном применении ингибиторов моноаминоксидазы.
Местные анестетики
В офтальмологической практике местные анестетики применяют для проведения проводниковой, инфильтрационной и поверхностной анестезии. При использовании местных анестетиков возможно развитие побочных эффектов местного характера (поражение эпителия роговицы и аллергические реакции), а также системного действия, обусловленных генерализованной стабилизацией мембран.Для пролонгирования эффекта и уменьшения системного неблагоприятного воздействия местные анестетики можно применять в сочетании с вазоконстрикторами.
Наиболее часто используют такие местные анестетики, как новокаин, тетракаин, лидокаин, оксибупрокаин, пропаракаин.
Новокаин (Novocain) плохо проникает через неповрежденные слизистые оболочки, поэтому его практически не используют для поверхностной анестезии. Для проводниковой анестезии применяют 1–2% растворы, для инфильтрационной анестезии – 0,25% и 0,5% растворы новокаина.
Тетракаин (Tetracaine) применяют для поверхностной анестезии при проведении амбулаторных оперативных вмешательств, удаления инородных тел, диагностических процедур (гониоскопия, тонометрия и т. д.). Анестезирующее действие развивается через 2–5 мин после закапывания и сохраняется в течение 30 мин – 1 ч.
Закапывают по 1 капле 1–2 раза. При хирургических амбулаторных вмешательствах дополнительные инстилляции проводят по необходимости.
Тетракаин не рекомендуется использовать при повышенной чувствительности, повреждении эпителия роговицы.
Возможно развитие таких побочных реакций, как гиперемия слизистых оболочек, преходящее повышение внутриглазного давления у чувствительных больных, отек и десквамация эпителия роговицы, аллергические реакции.
Из наиболее часто используемых препаратов, содержащих тетракаин, является дикаин (Dicain) в виде 1% глазных капель во флаконах по 5 и 10 мл.
Лидокаин (Lidocaine) по сравнению с другими анестетиками оказывает более выраженное и продолжительное действие. При поверхностной анестезии местноанестезирующее действие 2–4% раствора лидокаина наступает через 5–10 мин после инстилляции и сохраняется в течение 1–2 ч. При проводниковой анестезии эффект отмечается через 5–10 мин и сохраняется в течение 2–4 ч.
Для поверхностной анестезии лидокаин применяют при проведении диагностических процедур, небольших амбулаторных оперативных вмешательств. Инстиллируют по 1 капле 1–3 раза с интервалом 30–60 с перед проведением обследования или вмешательства, при амбулаторных оперативных вмешательствах в случае необходимости лидокаин можно инсталлировать дополнительно.
Оксибупрокаин (Oxybuprocaine) – один из наиболее известных в мире местных анестетиков, используемых в офтальмологической практике. Поверхностная анестезия конъюнктивы и роговицы наступает через 30 с и сохраняется 15 мин. Длительную анестезию (до 1 ч) обеспечивает троекратное закапывание 0,4% раствора оксибупрокаина с интервалом 4–5 мин.
Препарат применяют при проведении диагностических процедур (непосредственно перед обследованием инстиллируют по 1 капле 1–2 раза с интервалом 30–60 с) и небольших амбулаторных оперативных вмешательств (непосредственно перед вмешательством инстиллируют по 1 капле 3–4 раза с интервалом 4–5 мин).
Пропаракаин (Proparacain) по химической структуре относится к эфирам. Местноанестезирующий эффект обычно наступает через 30 с после инстилляции и сохраняется в течение 15 мин и дольше.
Для проведения диагностических процедур и кратковременных вмешательств 0,5% раствор пропаракаина инстиллируют по 1 капле однократно перед обследованием. С целью обеспечения более глубокой анестезии препарат закапывают по 1 капле каждые 5–10 мин от 5 до 7 раз перед проведением вмешательства.
Обычно пациенты хорошо переносят препарат. Редко и, как правило, сразу же после закапывания могут возникать тяжелые реакции, такие как эпителиальный кератит, эрозия роговицы, нитевидные инфильтраты роговицы, ирит.
Диагностические препараты
При проведении флюоресцентной ангиографии сосудов сетчатки, зрительного нерва и переднего отрезка глаза, а также для обнаружения дефектов эпителия роговицы используют флюоресцеин натрия (Fluorescein sodium). Флюоресцентную ангиографию сосудов сетчатки проводят при различных формах абиотрофий сетчатки, экссудативно–геморрагических формах центральной хориоретинопатии различного генеза, диабетической, гипертонической, посттромботической ретинопатиях, невусах и меланобластомах хориоидеи. Флюоресцентную ангиографию сосудов диска зрительного нерва выполняют при его отеке, воспалении, псевдозастое, друзах и т. д. Кроме того, данное исследование сосудистого ложа переднего отрезка глаза проводят при эпибульбарных невусах и т. д.Применение препарата противопоказано при заболеваниях почек и повышенной чувствительности к его компонентам. Перед применением необходимо проверить чувствительность больного к флюоресцеину. Для этого внутрикожно вводят 0,1 мл 10% раствора флюоресцеина. При отсутствии местной реакции (покраснение, отек, сыпь) через 30 мин выполняют флюоресцентную ангиографию: 5 мл препарата вводят внутривенно быстро (в течение 2–3 с). Диагностическое исследование осуществляют по общепринятой методике с учетом характера заболевания и целей исследования. Повторное введение флюоресцеина возможно через 3 дня.
При введении флюоресцеина могут отмечаться тошнота и рвота, реже – головокружение, кратковременное обморочное состояние, а также аллергические явления (крапивница, зуд и т. д.). Большинство этих явлений проходят самостоятельно. При выраженных аллергических реакциях проводят десенсибилизирующую терапию.
После введения флюоресцеина иногда отмечается преходящее желтое окрашивание кожи и слизистых оболочек (в течение 6–12 ч) и мочи (24–36 ч). Используют 10% раствор для инъекций (препарат выпускают как отечественная промышленность, так и зарубежные фирмы).
Для обнаружения дефектов эпителия роговицы применяют 1% раствор флюоресцеина (глазные капли), который готовится ex tempore.
Офтальмологические препараты разных групп
Увлажняющие и вяжущие глазные средства (препараты искусственной слезы). Синдром "сухого глаза", или сухой кератоконъюнктивит, развивается вследствие ряда различных глазных болезней, а также системных заболеваний (синдром Микулича, синдром Съегрена, ревматоидный артрит). Кроме того, нарушение слезоотделения наблюдается с увеличением возраста и в результате воздействия экзогенных факторов на секрецию слезы.При синдроме "сухого глаза" проводят симптоматическую терапию, которая в основном базируется на восполнении недостающего количества слезной жидкости. В качестве искусственных слез используют водные растворы различной вязкости или гелеподобные заменители слезной пленки с высокой вязкостью.
К числу веществ, которые способны повышать вязкость, относятся полусинтетические производные целлюлозы в концентрациях от 0,5% до 1% (метилцеллюлоза, гидрокиспропилметил целлюлоза, гидроксиэтил целлюлоза), поливинилгликоль, поливинилпирролидон, производные полиакриловой кислоты, 0,9% раствор декстрана, карбомер 974Р.
Заменители слезы используют не только при синдроме "сухого глаза'*, но и при нарушении положения век (лагофтальм, выворот века). Данные препараты не рекомендуется применять при инфекционных заболеваниях век, конъюнктивы и роговицы. Частоту применения определяют индивидуально.
Стимуляторы регенерации роговицы. При заболеваниях роговицы с нарушением ее целости, травмах и ожогах глаза необходимо ускорение ее регенерации. С этой целью применяют такие препараты, как 10% метилурациловая мазь, солкосер ил, корнерегель, а также лекарственные средства, содержащие гликозаминогликаны, выделяемые из роговицы различных животных (например, адгелон). Кроме того, стимулирующее воздействие на регенеративные процессы оказывают антиоксиданты: цитохром С дрожжевой (0,25% глазные капли) и эрисод.
Препараты этой группы используют в комплексной терапии лучевых, термических, химических ожогов конъюнктивы и роговицы, травм переднего отдела глаза, эрозивных и дистрофических кератитов. Обычно данные препараты применяют 3–6 раз в день.
Препараты, оказывающие фибринолитическое и антиоксидантное действие. Многие заболевания глаз сопровождаются развитием геморрагического и фибриноидного синдромов. Для их лечения применяют различные фибринолитическис препараты.
Наибольшее распространение получили такие ферментативные препараты как пролонгированный аналог стрептокиназы – стрептодеказа и урокиназа. При лечении внутриглазных кровоизлияний различного генеза и дисциркуляторных нарушений в сосудах сетчатки эти препараты вводят парабульбарно по 0,3–0,5 мл (30.000–45.000 ФЕ). Кроме того, стрептодеказу можно использовать в виде глазных лекарственных пленок.
В Российском кардиологическом научно–производственном комплексе М3 РФ разработан препарат гемаза – лиофилизированный порошок в ампулах по 5.000 ЕД, который содержит рекомбинантную проурокиназу. Препарат оказывает выраженное фибринолитическое действие; его вводят парабульбарно и субконъюнктивально.
Большой интерес представляют отечественные препараты, которые, помимо фибринолитического, оказывают антиоксидантное и ретинопротекторное действие, – эмоксипин и гистохром.
Эмоксипин (Emoxipin) давно и успешно применяют для лечения различных заболеваний глаз. Он оказывает антиоксидантное действие, стабилизирует клеточную мембрану, ингибирует агрегацию тромбоцитов и нейтрофилов, обладает фибрино–литической активностью, увеличивает содержание циклических нуклеотидов в тканях, уменьшает проницаемость сосудистой стенки. Эмоксипин, оказывая ретинопротекторное действие, также защищает сетчатку от повреждающего воздействия света высокой интенсивности.
Препарат применяют для лечения внутриглазных кровоизлияний различного генеза, ангиоретинопатий (включая диабетическую ретинопатию); хориоретинальных дистрофий, тромбоза центральной вены сетчатки и ее ветвей, осложненной миопии. Кроме того, его используют для лечения и профилактики поражений тканей глаза светом высокой интенсивности (солнечные лучи, излучение лазера или лазеркоагуляции); в послеоперационном периоде у больных глаукомой, с отслойкой сосудистой оболочки; при дистрофических заболеваниях роговицы; травмах и ожогах роговицы.
Препарат используют в виде 1% раствора для инъекций и глазных капель. Раствор эмоксипина вводят субконъюнктивально и парабульбарно, при необходимости – ретробульбарно. Субконъюнктивально вводят по 0,2–0,5 мл (2–5 мг), парабульбарно – 0,5–1 мл (5–1 мг) 1% раствора. Препарат применяют 1 раз в сутки или через день в течение 10–30 дней. При необходимости лечение можно повторять 2–3 раза в год. Ретробульбарно вводят 0,5–1 мл 1% раствора препарата 1 раз в сутки в течение 10–15 дней.
Гистохром (Hystochrom) – препарат, содержащий эхинохром (хиноидный пигмент морских беспозвоночных). Гистохром выполняет роль "перехватчика" свободных радикалов, образующихся при перекисном окислении липидов. Кроме антиоксидантного, препарат оказывает ретинопротекторное и бактерицидное действие. Гистохром используют в виде 0,02% раствора (в ампулах по 1 мл). Препарат вводят субконъюнктивально и парабульбарно при лечении геморрагического и фибриноидного синдромов.
Глава 26. Медико–социальная экспертиза и реабилитация лиц с заболеваниями и повреждениями органа зрения
Слепых больше там, где ниже культура, понимаемая в самом широком смысле.Медико–социальная экспертиза (МСЭ) и реабилитация лиц с патологией органа зрения базируется на основных положениях отечественной концепции инвалидности и общих позициях МСЭ.Авербах
Главные положения современной концепции инвалидности и государственной политики по отношению к инвалидам отражены в Федеральном Законе "О социальной защите инвалидов в РФ” (№ 181 от 24.11.95 г.), в котором содержатся новая трактовка понятия “инвалид" и новые критерии определения инвалидности.
"Инвалид" – лицо, имеющее нарушение здоровья со стойким расстройством функций организма, обусловленное заболеваниями, последствиями травм или дефектами, приводящее к ограничению жизнедеятельности и вызывающее необходимость его социальной защиты".
"Ограничение жизнедеятельности – полная или частичная утрата человеком вследствие нарушения здоровья способности осуществлять самообслуживание, передвижение, ориентацию, общение, контроль за своим поведением, обучение, трудовую деятельность и игровую деятельность (у детей)”.
Медико–социальная экспертиза – определение потребности освидетельствуемого лица в мерах социальной защиты, включая реабилитацию, иа основе оценки ограничений жизнедеятельности, вызванных нарушением здоровья со стойким расстройством функций организма.
Согласно Постановлению Правительства РФ № 965 от 13.08.96 г. "О порядкепризнания граждан инвалидами”, инвалидность определяется учреждениями (бюро) МСЭ. В зависимости от тяжести нарушения здоровья и степени ограничения жизнедеятельности лицу, признанному инвалидом, устанавливают I, II или III группу инвалидности, а в возрасте до 16 лет (с 1999 г. – до 18 лет) – категорию "ребенок–инвалид".
Вопрос о направлении в бюро МСЭ для установления инвалидности рассматривается в лечебно–профилактических учреждениях после проведения всех необходимых диагностических и лечебных мероприятий.
На учреждения МСЭ, помимо определения группы и причины инвалидности, возлагается разработка индивидуальных программ реабилитации инвалидов как формы их социальной защиты.
Реабилитация инвалидов – процесс и система медицинских, психологических, педагогических, социально–экономических мероприяти й, направленных на устранение или наиболее полную компенсацию ограничений жизнедеятельности, вызванных нарушением здоровья со стойким расстройством функций организма.
Цели реабилитации – восстановление социального статуса инвалида, достижение им материальной независимости и его социальная адаптация.
Определение инвалидности базируется на тщательной оценке комплекса клинико–функциональных, социально–бытовых, профессиональных, психологических факторов. При этом требуется установить не только степень утраты либо нарушения медицинского и социального статусов, но и уровень их сохранности, компенсаторно–адаптационные резервы, возможность их мобилизации для полной или частичной реабилитации больного.
С целью объективной оценки состояния здоровья и степени социальной адаптации используют результаты всестороннего обследования, функциональных и лабораторных исследований, проводят осмотр больного и беседы с ним, анализ необходимых документов.
Офтальмологическая экспертиза предполагает использование общих положений МСЭ, но имеет также специфические особенности.
Зрение – сложнейший психофизиологический процесс, полноценность которого необходима для нормальной жизнедеятельности человека, так как 90% информации о внешнем мире поступает через зрительный анализатор. Зрительные расстройства, приводящие к ограничению жизнедеятельности, могут быть обусловлены различной офтальмопатологией, которая является следствием заболеваний, аномалий развития, повреждений как различных структур глазного яблока и его придатков, так и центральных, интракраниальных отделов зрительного анализатора.
При МСЭ лиц с офтальмопатологией клинико–функциональный диагноз и прогноз нужно определять с учетом следующих факторов: ■ наследственной отягощенности ■ анамнеза и катамнеза заболевания, особенностей его течения ■ сроков наступления зрительных расстройств ■ нозологической формы офтальмопатологии ■ детальной характеристики структурных изменений в органе зрения ■ состояния и динамики зрительных функций ■ электрофизиологических характеристик зрительно–нервного аппарата ■ данных о зрительной работоспособности ■ сведений о сопутствующей патологии других органов и систем организма ■ результатов оценки возможности и эффективности восстановительного лечения, коррекции зрения.
Из социальных факторов необходимо учитывать возраст, семейное положение, бытовые условия, образование, профессию, стаж работы, характер трудовой деятельности. Оценивают также психологические особенности больного и нуждаемость в различных видах социальной помощи.
На основе сопоставления результатов подобного комплексного анализа с содержанием основных категорий жизнедеятельности делают заключение о наличии и степени ограничений жизнедеятельности, наличии инвалидности.
Нарушение зрения оказывает неблагоприятное влияние почти на все проявления жизнедеятельности, однако степень этого влияния различна.
Способность человека к передвижению, самообслуживанию, ориентации, общению зависит главным образом от состояния основных зрительных функций – остроты зрения и поля зрения.
Зрительные функции определяют при моно– и бинокулярном предъявлении испытательных тестов, но при МСЭ тяжесть нарушений оценивают по состоянию функций лучше видящего или единственного глаза в условиях переносимой (оптимальной) коррекции.
Оценка возможностей зрительного анализатора применительно к специфическим задачам трудовой деятельности и обучения более сложная. Помимо анализа приоритетных для всех категорий жизнедеятельности зрительных функций, таких как острота и поле зрения, требуется оценка других функций зрительного анализатора, имеющих особенное значение для осуществления деятельности различных видов, в том числе работ зрительного профиля, а также общего и профессионального обучения. К этим функциям относятся световая (темповая) чувствительность, цветоощущение, бинокулярное зрение, острота зрения вблизи, аккомодация, зрительное утомление, зрительная продуктивность и другие офтальмоэргономические характеристики.
Иногда, особенно при аметропии, заболеваниях центральной нервной системы, нарушениях функций глазных мышц, патологии зрительно–нервного аппарата, даже при относительно хороших показателях остроты и поля зрения патологическое зрительное утомление снижает возможность осуществления работ зрительного профиля, в том числе требующих постоянного использования компьютеров. Ограничена способность выполнять зрительные работы, связанные с постоянным использованием компьютерной техники, у лиц с высокой аметропией, одноглазием, нистагмом.
Большое значение имеют данные о состоянии гидро– и гемодинамики глаза, особенно при оценке способности к выполнению труда, связанного с большой физической и нервно–эмоциональной нагрузкой.
Важную информацию о состоянии зрительного анализатора при определении ограничений жизнедеятельности получают с помощью электрофизиологических исследований (ЭФИ), позволяющих провести качественную и количественную оценку функционального состояния различных отделов и компонентов зрительного нервного аппарата.
Особенно важны данные, получаемые в процессе ЭФИ, при заболеваниях зрительного нерва и сетчатки в тех случаях, когда при визуальных исследованиях (офтальмоскопия, офтальмобиомикроскопия, офтальмохромоскопия) не удается выявить изменения и только ЭФИ позволяют установить наличие, локализацию и выраженность патологического процесса. Столь же необходимы результаты ЭФИ при помутнениях преломляющих сред, когда визуальное исследование структур глазного дна невозможно.
Интегральная оценка функционального состояния зрительного анализатора с учетом Международной классификации зрительных расстройств (МКБ 10–го пересмотра. ВОЗ. Женева) позволяет выделить 4 степени тяжести нарушений его функций: ■ I – низкая ■ II – средняя ■ III – высокая степень слабовидения ■ IV – практическая, или абсолютная, слепота (табл, 26.1).
Комплексная оценка всех перечисленных выше позиций позволяет определить степень ограничения жизнедеятельности, наличие инвалидности и ее группу в соответствии с общими критериями инвалидности.
В зависимости от тяжести выделяют 3 степени ограничений жизнедеятельности, оценка которых имеет особенности при каждой из восьми перечисленных выше категорий жизнедеятельности, однако существуют основные характеристики этих ограничений, свойственные большинству категорий жизнедеятельности.
Ограничения I степени – незначительно или умеренно выраженные – имеют место в том случае, если больной человек способен осуществлять жизнедеятельность того или иного вида с определенными трудностями и преимущественно с помощью вспомогательных средств в связи с умеренно выраженными стойкими нарушениями функций организма.
Таблица 26.1. Критерии оценки нарушений основных зрительных функций
| Функции единственного или лучше видящего глаза | Степень тяжести нарушений функции | |||
|---|---|---|---|---|
| I незначительные | II умеренные | III выраженные | IV значительно выраженные | |
| Острота зрения с коррекцией | 0,4–0,7 | 0,1–о,3 | 0,1–0,05; | 0,04–0 |
| Поле зрения: | ||||
| периферические границы по меридиану от точки фиксации | Сужено до 40° | Меньше 40°, но больше 20° | Меньше 20°, но больше 10° | 10°–0° |
| скотомы в центральном поле зрения | Нет | Единичные относительные скотомы | а. Единичные абсолютные скотомы. б. Множественные абсолютные несливные скотомы | а. Центральные абсолютные скотомы 10° и больше, б. Парацентральные абсолютные сливные скотомы |
Ограничения III степени – значительно выраженные – констатируют при полной неспособности больного человека самостоятельно осуществлять основные категории жизнедеятельности и постоянной зависимости его от других лиц ввиду значительно выраженных стойких нарушений функций организма.
В зависимости от степени тяжести ограничений жизнедеятельности и функциональных расстройств, а также с учетом потребности в мерах социальной защиты и помощи устанавливают одну из трех групп инвалидности.
Инвалидность I группы устанавливают при ухудшении здоровья со стойким значительно выраженным нарушением функций организма, приводящим к значительному ограничению основных категорий жизнедеятельности.
У лиц со зрительными расстройствами показания к установлению I группы инвалидности имеются при практической или абсолютной слепоте на оба глаза.
Инвалидность II группы устанавливают при ухудшении здоровья с выраженным нарушением функций организма, приводящим к выраженному ограничению жизнедеятельности.
При нарушении зрения показанием к определению II группы инвалидности является слабовидение высокой степени на единственном или лучше видящем глазу либо на обоих глазах.
Инвалидность III группы устанавливают при ухудшении здоровья с незначительным нарушением функций организма, приводящим к умеренно выраженному ограничению жизнедеятельности.
У лиц с офтальмопатологией инвалидность III группы устанавливают главным образом при ограничении способности к трудовой, профессиональной деятельности, обусловленном слабовидением средней или низкой степени либо другими зрительными нарушениями.
При определении наличия и группы инвалидности, помимо состояния органа зрения, учитывают многие социальные и психологические факторы, клинический и реабилитационный прогноз.
Важной задачей МСЭ, помимо определения инвалидности, является формирование индивидуальной программы реабилитации больных.
В проведении мероприятий с целью реабилитации инвалидов по зрению должны участвовать лечебнопрофилактические учреждения, службы социальной помощи, сами инвалиды и их семьи, различные предприятия, производства, а также правления и предприятия обществ слепых.
В России создана научно обоснованная система медико–социальной реабилитации слепых и инвалидов по зрению, включающая комплекс медицинских, психологических, социальных, педагогических, профессионально–трудовых мероприятий, поэтапное и взаимосвязанное применение которых способствует восстановлению здоровья, трудоспособности, других видов жизнедеятельности и социальной интеграции незрячих.
В комплексе реабилитационных мероприятий главную роль играет восстановительное лечение. Благодаря достижениям отечественной офтальмологии, особенно офтальмохирургии и лазерной терапии, многим тысячам слепых возвращено зрение.
Большое значение имеет также элементарная реабилитация слепых – развитие мобильности, сенсорного восприятия, обучение навыкам ориентировки в пространстве, самообслуживания, домоводства, обучение письму и чтению по точечной азбуке Брайля (дающей возможность из комбинации шести выпуклых точек создать 63 знака, достаточных для обозначения букв алфавита, цифр, знаков препинания, а также математических и нотных знаков), овладение средствами тифлотехники (от англ. tyhlos – слепой) – совокупности приспособлений, приборов и систем, компенсирующих частичную или полную потерю зрения.
Значительную помощь в реабилитации инвалидов оказывает психологическая коррекция, преодоление психологического комплекса неполноценности.
Для осуществления элементарной реабилитации созданы специальные школы, а также организована соответствующая служба при правлениях и на предприятиях обществ слепых.
Необходимое для социально–трудовой реабилитации профессиональное обучение или переобучение слепых и слабовидящих осуществляют в специальных техникумах и профессионально–технических училищах, где они приобретают доступные им профессии, а также непосредственно на предприятиях обществ слепых.
Незрячие дети проходят курс элементарной реабилитации в специальных школах–интернатах, где они получают общее среднее образование. Обучение и воспитание в этих школах строится с учетом особенностей развития детей с разными формами нарушения зрения. Существуют раздельные школы для слепых и слабовидящих детей. Обучение в школах ведется по типовым и специальным программам, основанным на принципах тифлопедагогики. В школах–интернатах осуществляют и трудовую подготовку, имеющую политехническую направленность. Выпускники школ–интернатов работают на предприятиях обществ слепых либо государственных предприятиях. Многие из них продолжают обучение в высших или средних специальных учебных заведениях и по окончании их работают в различных отраслях народного хозяйства.
Эффективная разносторонняя реабилитация инвалидов со зрительными нарушениями создает предпосылки для достижения равных возможностей и равных прав со зрячими для получения общего и специального образования, разностороннего развития, активного участия в современном производстве и общественной жизни общества.
Последние комментарии
14 часов 19 минут назад
18 часов 27 минут назад
18 часов 44 минут назад
19 часов 5 минут назад
21 часов 47 минут назад
1 день 5 часов назад