Путешествие в страну РАИ [Дмитрий Николаевич Трифонов] (fb2) читать онлайн
[Настройки текста] [Cбросить фильтры]
[Оглавление]
Дмитрий Николаевич Трифонов
Путешествие в страну РАИ
Маршрут первый

Каждые пять минут мы подбрасываем дрова в маленькую железную печурку. Кажется, она должна раскалиться добела, но резкий ветер нахально проникает во все щели, которых так много в старой охотничьей избушке. Если бы не солидный запас дров под дощатыми нарами, нам пришлось бы плохо.
Непогода — холодный ветер с метелью, застала нас перед самым перевалом. Февральская пурга — дело затяжное, и если она продлится хотя бы еще три дня, придется возвращаться обратно. И наша давнишняя мечта — зимой пройти через суровый Аламинский перевал — отложится на год.
Вторые сутки мы сидим в избушке, наполовину утонувшей в снегу. Олег и Алеша уже дважды отгребали снег от маленького окошка; благодаря этому днем в избушке относительно светло. Но свет какой-то мутный, он навевает грусть. Сперва мы не замечали ее, разгоряченные страстными спорами о «высоких материях», — дело привычное в нашей туристской группе. Потом грусть подползла еще ближе, мы попытались прогнать ее песнями, но они почему-то не пелись в этой заброшенной на край света избушке.
Тогда наступила тишина. Она нарушалась лишь потрескиванием поленьев и яростными порывами ветра за ненадежными стенками нашего случайного убежища. Как только становилось совсем темно, мы зажигали свечку. Ее робкий огонек колебался, и фантастические тени метались по стенам, словно призраки бескрайной тайги.
— Дело ясное, придется идти назад, — проговорил Сергей. — Даже если пурга кончится завтра… Не топать же по грудь в снегу!
Ему никто не ответил. Всем было немножечко не по себе не потому, что мы растерялись, а из-за проклятого вынужденного безделья, хуже которого нет ничего на свете.
— А хорошо бы сейчас… на минутку оказаться в Москве! — мечтательно произнесла Майка. — Только на минутку — и обратно!
— Обратно бы ты не вернулась! — зло сказал Илья.
И разговор оборвался. Снова воцарилось молчание. Для меня — начальника группы — оно было особенно тягостным: распустил народ, не сумел поднять настроение… Но что я мог придумать, когда у самого на душе скребли кошки.
— Эх вы, так и будем молчать? — заворочалась на нарах Наташа. У нее был удивительно мелодичный голос, и сейчас он прозвучал в диссонанс с мрачным полумраком избушки. — Рассказали бы что-нибудь интересное.
«Рассказали бы» относилось прежде всего к нам с Ильей. Это мы с ним — представители точных специальностей — всегда заводили споры на научные темы. А наши спутники, хотя и были филологами и историками, с охотой и интересом прислушивались, каждый из них вдруг вспоминал прочитанное в каком-нибудь популярном журнале, выдвигал «свою» гипотезу, и в итоге спор превращался в невообразимую мешанину из строгих научных доказательств, непостижимых вопросов, популярных объяснений и дилетантских высказываний. Это и увлекало и приносило определенную пользу.
Но Илья посапывал в своем углу или делал вид, что спит, а я не знал, как ответить Наташе. Я встал, чтобы подкинуть в печку дров. Языки пламени вырвались наружу, на мгновение озарив комнату. На пол посыпались угли, я затоптал их и залил водой из кружки, чтобы не оставалось тлеющих.
И вдруг по странной ассоциации мне вспомнился эпизод из школьных времен. Большая река тускло блестит под осенним солнцем, словно старое серебряное зеркало. Наш туристский отряд покидает бивак на берегу, мы весело затаптываем костер, а наш учитель химии (он-то и привил мне страсть к химии и туризму) говорит: «Через много веков люди найдут эти уголья и определят, в каком году мы ставили здесь бивак…» И рассказал нам, как такое определение делается. Наверное, это было первым толчком к выбору специальности…
— Ты о чем задумался? — неожиданно прозвучал голос Наташи.
Вид у меня действительно странный: смотрю куда-то в пространство и верчу в руках обыкновенный уголек.
— Хочешь, я расскажу тебе про этот уголек? — говорю я Наташе. И подсаживаюсь около на нары. В ней порой бывает много детского, и хочется взъерошить ее прическу, взять за руку, как берут маленького ребенка, или, присев рядом, медленно рассказывать старинную сказку…
— С помощью такого уголька можно выяснить много важных для науки вещей. Например, с большой точностью узнать время существования какого-нибудь первобытного поселения, обнаруженного при археологических раскопках. Уголек — это самый обычный углерод. Углерод — химический элемент и состоит в основном из двух изотопов, двух различных сортов атомов, отличающихся атомными весами. Их обычно записывают, как «це двенадцать» и «це тринадцать». Их химические символы C12 и C13, — я написал их угольком на куске фанеры. — Но есть, оказывается, и третий изотоп — C14, который является радиоактивным, то есть неустойчивым. Он непрерывно образуется в атмосфере. Его вызывают к жизни космические лучи, поток атомных ядер и элементарных частиц, постоянно падающих на Землю из глубин мирового пространства. В их состав входят и нейтроны, элементарные частицы, не имеющие заряда. Они-то и вступают в ядерную реакцию с ядрами атомов азота атмосферы.
 В результате из атома азота образуется атом радиоактивного углерода C14. Это происходит непрерывно и с постоянной скоростью. Ученые установили, что в течение по крайней мере последних 20 000 лет интенсивность потока космических лучей на Землю оставалась неизменной.
Но что происходит далее с появившимся на свет C14? В момент ядерной реакции образовавшийся радиоуглерод приобретает большую энергию и переходит в особое «возбужденное» состояние. В этот момент он обладает повышенной химической активностью и немедленно соединяется с кислородом. Так возникает углекислый газ, содержащий радиоактивный углерод, — C14O2.
Растения улавливают углекислый газ, в том числе и C14O2, приобретая тем самым радиоактивность. Животные питаются растениями, и радиоуглерод оказывается в их организмах. Нетрудно измерить радиоактивность животных и растений, обусловленную присутствием C14. Нужно также учесть, что C14 имеет период полураспада около 6000 лет, то есть за это время распадается половина всех атомов, содержащихся, например, в 1 грамме его.
В результате из атома азота образуется атом радиоактивного углерода C14. Это происходит непрерывно и с постоянной скоростью. Ученые установили, что в течение по крайней мере последних 20 000 лет интенсивность потока космических лучей на Землю оставалась неизменной.
Но что происходит далее с появившимся на свет C14? В момент ядерной реакции образовавшийся радиоуглерод приобретает большую энергию и переходит в особое «возбужденное» состояние. В этот момент он обладает повышенной химической активностью и немедленно соединяется с кислородом. Так возникает углекислый газ, содержащий радиоактивный углерод, — C14O2.
Растения улавливают углекислый газ, в том числе и C14O2, приобретая тем самым радиоактивность. Животные питаются растениями, и радиоуглерод оказывается в их организмах. Нетрудно измерить радиоактивность животных и растений, обусловленную присутствием C14. Нужно также учесть, что C14 имеет период полураспада около 6000 лет, то есть за это время распадается половина всех атомов, содержащихся, например, в 1 грамме его.

 Ученые подсчитали, что каждый грамм углерода животных и растительных организмов имеет постоянную радиоактивность, поскольку между распадом содержащихся в организме атомов C14 и поглощением новых существует динамическое равновесие. На 1 грамм углерода организма приходится примерно 15 распадов в минуту. Радиоактивность образца, содержащего C14, и количество распадов в минуту определяется с помощью специального счетчика.
Когда организм погибает, равновесие нарушается: мертвое растение не способно усваивать углекислоту. Следовательно, содержание C14 в нем начинает уменьшаться.
Раз период полураспада радиоактивного углерода составляет около 6000 лет, то по истечении этого срока 1 грамм углерода погибшего растения будет давать лишь 7 распадов в минуту, спустя еще 6000 лет — половину и так далее.
Американский ученый Либби и предложил использовать это явление в качестве своеобразных «радиоактивных часов».
Если определить количество импульсов, которое дает в минуту 1 грамм углерода изучаемого образца древнего растения (угля, куска дерева), можно высчитать возраст этого образца.
Метод определения возраста по C14 весьма прост. Однако у него есть свои ограничения и недостатки. Прежде всего короткий период полураспада C14. Если возраст образца равен нескольким периодам полураспада, радиоактивность его настолько слаба, что не поддается измерению. Значит, мы имеем возможность заглянуть лишь в сравнительно недалекое прошлое (30 000–40 000 лет). Кроме того, метод очень чувствителен. Поэтому при определении активности нужно устранить все мешающие факторы.
Хорошие результаты получены для образцов, возраст которых не превышает 7000–10 000 лет.
В начале XX века на стенах пещеры в Ласка (Франция) были обнаружены рисунки животных, сделанные доисторическим человеком. «Бизоны из Ласка» явились предметом спора многих ученых. Что касалось времени выполнения рисунков, то предлагались самые различные даты. Ясность внесло определение C14. Возраст рисунков оказался равным 15 516 ± 900 лет.
Историки оценивали возраст погребальной ладьи из гробницы египетского фараона Сазостриса III в 3750 лет. Применение радиоуглерода подтвердило их данные.
Ученые долго затруднялись в точном определении времени смерти великого греческого астронома и географа Клавдия Птолемея. Анализ древесины, взятой из стенки гроба мыслителя древности, позволил сделать вывод, что Птолемей скончался около 200 года до нашей эры.
Наконец, возраст остатков тканей, в которые были обернуты кожаные рукописи, найденные в пещере в Палестине, оказался равным 1917 ± 200 лет, что также совпало с мнением историков.
Ученые подсчитали, что каждый грамм углерода животных и растительных организмов имеет постоянную радиоактивность, поскольку между распадом содержащихся в организме атомов C14 и поглощением новых существует динамическое равновесие. На 1 грамм углерода организма приходится примерно 15 распадов в минуту. Радиоактивность образца, содержащего C14, и количество распадов в минуту определяется с помощью специального счетчика.
Когда организм погибает, равновесие нарушается: мертвое растение не способно усваивать углекислоту. Следовательно, содержание C14 в нем начинает уменьшаться.
Раз период полураспада радиоактивного углерода составляет около 6000 лет, то по истечении этого срока 1 грамм углерода погибшего растения будет давать лишь 7 распадов в минуту, спустя еще 6000 лет — половину и так далее.
Американский ученый Либби и предложил использовать это явление в качестве своеобразных «радиоактивных часов».
Если определить количество импульсов, которое дает в минуту 1 грамм углерода изучаемого образца древнего растения (угля, куска дерева), можно высчитать возраст этого образца.
Метод определения возраста по C14 весьма прост. Однако у него есть свои ограничения и недостатки. Прежде всего короткий период полураспада C14. Если возраст образца равен нескольким периодам полураспада, радиоактивность его настолько слаба, что не поддается измерению. Значит, мы имеем возможность заглянуть лишь в сравнительно недалекое прошлое (30 000–40 000 лет). Кроме того, метод очень чувствителен. Поэтому при определении активности нужно устранить все мешающие факторы.
Хорошие результаты получены для образцов, возраст которых не превышает 7000–10 000 лет.
В начале XX века на стенах пещеры в Ласка (Франция) были обнаружены рисунки животных, сделанные доисторическим человеком. «Бизоны из Ласка» явились предметом спора многих ученых. Что касалось времени выполнения рисунков, то предлагались самые различные даты. Ясность внесло определение C14. Возраст рисунков оказался равным 15 516 ± 900 лет.
Историки оценивали возраст погребальной ладьи из гробницы египетского фараона Сазостриса III в 3750 лет. Применение радиоуглерода подтвердило их данные.
Ученые долго затруднялись в точном определении времени смерти великого греческого астронома и географа Клавдия Птолемея. Анализ древесины, взятой из стенки гроба мыслителя древности, позволил сделать вывод, что Птолемей скончался около 200 года до нашей эры.
Наконец, возраст остатков тканей, в которые были обернуты кожаные рукописи, найденные в пещере в Палестине, оказался равным 1917 ± 200 лет, что также совпало с мнением историков.
 …Когда я кончил свой рассказ, оказалось, что слушала его не только Наташа, но и остальные. Алеша поспешил тут же скептически заметить:
— Метод все-таки очень приблизительный… Плюс-минус сто восемьдесят лет, плюс-минус двести лет… Не мала ли такая точность для истории?
Илья, который, видимо, вовсе не спал, подал голос из своего угла:
— Ишь ты, какой скорый! Точность, конечно, не абсолютная! Но метод-то ведь еще очень молод! Со временем механизм «радиоактивных часов» отрегулируют и усовершенствуют. И не придется историкам гадать на кофейной гуще о возрасте того или иного объекта. Между прочим, методы, основанные на подобных применениях радиоактивных изотопов, — это не что иное, как одно из мирных использований атомной энергии.
— Какая же тут связь? — хмыкнула Майка. — Насколько я знаю, атомная энергия — это деление атомного ядра урана. Ну, я понимаю, атомные электростанции, атомный ледокол… А причем тут радиоактивный углерод?
— Вот! Налицо слабость связи школы с практикой. Что атомную энергию получают в ядерных реакторах — все знают. Что при делении урана выделяется громадная энергия — всем известно. Но ведь это же только одна сторона. А есть две другие — и о них наша популярная литература мало заботится. Какие? Пожалуйста! Применение радиоактивных изотопов — раз. Действие радиоактивных излучений на вещества — два. Ведь, друзья мои, радиоактивность есть результат процессов, которые совершаются в атомном ядре. Всякий радиоактивный распад сопровождается выделением энергии, и эта энергия тоже в конечном счете атомная.
Илья не любил спорить по пустякам. Но если его задевали за живое, он начинал произносить страстные монологи. В университете товарищи звали его за глаза «энциклопедистом»: физик по специальности, он неплохо разбирался в химии, и в геологии, и в медицине.
Алеша тоже был своеобразным «энциклопедистом», но только в области литературы. По-моему, никто на свете не знал на память столько стихов, сколько он. Но что касалось наук точных, в них Алеша ориентировался, мягко говоря, слабо и порой попадал впросак.
— Наверное, не так уж велико применение радиоактивных изотопов? — огорошил он Илью новым вопросом.
Тут уж Илья совсем вскипел:
— Вот что, братцы гуманитарии, скажите мне, какие вы применения знаете?
— Что-то слышали! — пробурчал Олег неопределенно. — В геологии, например, в медицине…
— А поконкретнее?
— Вспомнила! — обрадованно крикнула Майка. — Они помогают выяснить распределение питательных веществ удобрений в томатах…
— Вспомнила! — передразнил Илья. — Чудесный примерчик из школьных учебников, который повторяется уже который год! Как будто нет других применений! Их десятки, к вашему сведению! Например, Либби считает, что каждые пять минут можно выдумывать по крайней мере два новых использования… Так-то, товарищи гуманитарии!
— Было бы очень хорошо, — ядовито сказала Наташа, — если бы придумали какое-нибудь применение радиоизотопов, которое научило бы тебя вежливости! Ты, Илья, не забывайся. В филологии ты ведь тоже профан…
— Я профан? — завопил Илья, но рука Сергея легла ему на плечо:
— Погодите, бросьте ругаться! Мы, кажется, начали говорить о занятных вещах… Давайте продолжать! Про эти самые десятки применений… Вы с начальником — физик и химик, вам и карты в руки. Да и веселее будет зимовать!
— Я что? Я пожалуйста! — миролюбиво сказал Илья. — Значит, изотопы. Что такое изотопы? Атомное ядро состоит из протонов, положительно заряженных частиц, и нейтронов, которые не имеют заряда. Например, в ядре углерода шесть протонов, а нейтронов шесть — тогда имеем изотоп C12, или семь C13, или восемь C14. Это основа! А дальше, может быть, ты продолжишь? — обратился Илья ко мне. — Ведь изотопы — твоя специальность…
Мне всегда доставляет удовольствие рассказывать о своей работе. Сейчас это было вдвойне приятно, потому что тоска рассеивалась и не таким тягостным начинало казаться вынужденное пребывание в избушке.
— Хорошо! Значит, подробнее об изотопах.
…Когда я кончил свой рассказ, оказалось, что слушала его не только Наташа, но и остальные. Алеша поспешил тут же скептически заметить:
— Метод все-таки очень приблизительный… Плюс-минус сто восемьдесят лет, плюс-минус двести лет… Не мала ли такая точность для истории?
Илья, который, видимо, вовсе не спал, подал голос из своего угла:
— Ишь ты, какой скорый! Точность, конечно, не абсолютная! Но метод-то ведь еще очень молод! Со временем механизм «радиоактивных часов» отрегулируют и усовершенствуют. И не придется историкам гадать на кофейной гуще о возрасте того или иного объекта. Между прочим, методы, основанные на подобных применениях радиоактивных изотопов, — это не что иное, как одно из мирных использований атомной энергии.
— Какая же тут связь? — хмыкнула Майка. — Насколько я знаю, атомная энергия — это деление атомного ядра урана. Ну, я понимаю, атомные электростанции, атомный ледокол… А причем тут радиоактивный углерод?
— Вот! Налицо слабость связи школы с практикой. Что атомную энергию получают в ядерных реакторах — все знают. Что при делении урана выделяется громадная энергия — всем известно. Но ведь это же только одна сторона. А есть две другие — и о них наша популярная литература мало заботится. Какие? Пожалуйста! Применение радиоактивных изотопов — раз. Действие радиоактивных излучений на вещества — два. Ведь, друзья мои, радиоактивность есть результат процессов, которые совершаются в атомном ядре. Всякий радиоактивный распад сопровождается выделением энергии, и эта энергия тоже в конечном счете атомная.
Илья не любил спорить по пустякам. Но если его задевали за живое, он начинал произносить страстные монологи. В университете товарищи звали его за глаза «энциклопедистом»: физик по специальности, он неплохо разбирался в химии, и в геологии, и в медицине.
Алеша тоже был своеобразным «энциклопедистом», но только в области литературы. По-моему, никто на свете не знал на память столько стихов, сколько он. Но что касалось наук точных, в них Алеша ориентировался, мягко говоря, слабо и порой попадал впросак.
— Наверное, не так уж велико применение радиоактивных изотопов? — огорошил он Илью новым вопросом.
Тут уж Илья совсем вскипел:
— Вот что, братцы гуманитарии, скажите мне, какие вы применения знаете?
— Что-то слышали! — пробурчал Олег неопределенно. — В геологии, например, в медицине…
— А поконкретнее?
— Вспомнила! — обрадованно крикнула Майка. — Они помогают выяснить распределение питательных веществ удобрений в томатах…
— Вспомнила! — передразнил Илья. — Чудесный примерчик из школьных учебников, который повторяется уже который год! Как будто нет других применений! Их десятки, к вашему сведению! Например, Либби считает, что каждые пять минут можно выдумывать по крайней мере два новых использования… Так-то, товарищи гуманитарии!
— Было бы очень хорошо, — ядовито сказала Наташа, — если бы придумали какое-нибудь применение радиоизотопов, которое научило бы тебя вежливости! Ты, Илья, не забывайся. В филологии ты ведь тоже профан…
— Я профан? — завопил Илья, но рука Сергея легла ему на плечо:
— Погодите, бросьте ругаться! Мы, кажется, начали говорить о занятных вещах… Давайте продолжать! Про эти самые десятки применений… Вы с начальником — физик и химик, вам и карты в руки. Да и веселее будет зимовать!
— Я что? Я пожалуйста! — миролюбиво сказал Илья. — Значит, изотопы. Что такое изотопы? Атомное ядро состоит из протонов, положительно заряженных частиц, и нейтронов, которые не имеют заряда. Например, в ядре углерода шесть протонов, а нейтронов шесть — тогда имеем изотоп C12, или семь C13, или восемь C14. Это основа! А дальше, может быть, ты продолжишь? — обратился Илья ко мне. — Ведь изотопы — твоя специальность…
Мне всегда доставляет удовольствие рассказывать о своей работе. Сейчас это было вдвойне приятно, потому что тоска рассеивалась и не таким тягостным начинало казаться вынужденное пребывание в избушке.
— Хорошо! Значит, подробнее об изотопах.
Подробнее об изотопах
Не так уж много лет назад даже крупнейшие ученые заходили в тупик, пытаясь объяснить один, казалось бы, весьма простой факт. В своей периодической системе Д. И. Менделеев расположил химические элементы в порядке увеличения их атомных весов. У каждого последующего элемента атомный вес должен быть больше, чем у предыдущего: у азота больше, чем у углерода, у марганца больше, чем у хрома и т. д. Это последовательное увеличение атомных весов выдерживалось почти на протяжении всей таблицы и прекрасно согласовывалось с ходом периодического изменения свойств элементов. Но в этом «почти» и таилась загвоздка. Было в периодической системе три точки, где нарушался ход последовательного увеличения атомных весов. Это пары элементов: аргон — калий, кобальт — никель, теллур — йод. Сравним атомные веса элементов этих пар:
Ar K Co Ni Те J 39,944 39,100 58,94 58,69 127,61 126,91.— Как ты помнишь все эти цифры? — удивилась Майка. — Не мешай! — Илья недовольно поморщился. — Химик их должен знать. В них — кусочек истории таблицы элементов. Продолжай, Толя. — Нетрудно убедиться, что атомный вес последующего элемента меньше, чем у предыдущего. Кажется, что же тут такого? Взять да переставить элементы. С известной натяжкой это можно сделать для кобальта и никеля — близких по свойствам элементов VIII группы. Поменяйте местами аргон и калий, теллур и йод. Получается нелепость: аргон окажется в группе щелочных металлов, а калий — среди инертных газов. Теллур попадет к галогенам, не имея с ними ничего общего. Периодическая система элементов подрывается в самой основе. Одни ученые предсказывали крах периодической системы. Другие оставались спокойными: «Все дело в более точном определении атомных весов!» — заявляли они. И ставили эксперименты с весьма чистыми препаратами, совершенствовали методы определения атомных весов. Рассчитывали — и недоуменно пожимали плечами: все оставалось по-прежнему: аргон был тяжелее калия, кобальт «забегал» вперед никеля; более легкий йод следовал за теллуром. Найти объяснение этим загадочным случаям или отказаться от таблицы элементов? Такова была дилемма. Отказаться всегда просто. Те, кто верил в периодический закон, стали искать объяснения. Среди них был великий русский химик Александр Михайлович Бутлеров. Он широко известен как создатель теории строения органических соединений. — Все ли атомы данного элемента одинаковы? — спрашивал Бутлеров. — Известно, что атомы одного и того же элемента могут иметь разную кинетическую энергию. Нельзя ли допустить, что они обладают и различными атомными весами? И отвечал: «Каждый элемент может иметь несколько разновидностей. Все эти разновидности имеют совершенно одинаковые свойства и отличаются только по атомному весу. Кроме того, атомный вес каждой разновидности выражается целым числом». Если продолжить мысль Бутлерова, можно предположить: отдельные разновидности содержатся в элементе в разных количествах. Вероятно, у аргона преобладает наиболее тяжелая разновидность элемента, а у калия — наиболее легкая. Тогда атомный вес калия может оказаться в целом меньше, чем у аргона. Бутлерову не удалось прийти к такому выводу: смерть прервала его работы. Но никто другой ни в одной стране не был в те времена — в восьмидесятых годах прошлого столетия, за тридцать лет до открытия явления изотопии — так близок к отысканию истины, как русский ученый! Но работы Бутлерова никем не были продолжены. Все оставалось как раньше. Нет, даже не как раньше! С открытием радиоактивности, с изучением продуктов радиоактивного распада урана, тория и актиния положение ухудшилось. Среди продуктов радиоактивного распада тория нашли пять элементов, которые были похожи как две капли воды друг на друга и на элемент торий. Эти элементы получили названия «уран икс один», «ионий», «радиоторий», «уран игрек» и «радиоактиний». Единственное их отличие заключалось в радиоактивных свойствах. Для них не нашлось мест в таблице элементов. Периодическая система оказалась перед новым испытанием. Но в 1910 году английский ученый Содди предложил выход из создавшегося положения. Он ввел понятие «изотопы». «Изотопы» — слово греческое, и по-русски означает «занимающие одно и то же место», «одинаковоместные». Под изотопами Содди подразумевал разновидности химических элементов, которые имеют разные атомные веса и радиоактивные свойства, но обладают одинаковыми химическими и физическими характеристиками. Стало быть, химический элемент торий имеет шесть изотопов. Так было открыто явление изотопии. Оказалось, что радиоактивные элементы конца периодической системы состоят из нескольких изотопов. Хорошо, но уран, торий, актиний и другие «замыкающие» таблицы Менделеева составляют лишь очень небольшую часть от всех известных химических элементов! Что же, явление изотопии характерно лишь для немногих «избранных» или же для всех элементов периодической системы? Ученые занялись исследованием этого вопроса. В 1913 году английский физик Мозели показал, что заряд ядра элемента, а не атомный вес должен быть положен в основу периодического закона. Места аргона (заряд ядра 18) и калия (19), кобальта (27) и никеля (28), теллура (52) и йода (53) оказались правильными. Теперь уже никто не сомневался, что объяснение неправильностей в атомных весах этих элементов следует искать в явлении изотопии. Но как его обнаружить у других элементов? Здесь появились трудности. У элементов конца периодической системы тот или иной изотоп можно определить по характеру радиоактивного излучения. Большинство элементов не обладают свойством радиоактивности. Значит, надо искать другой путь определения. Иначе говоря, нужно было найти способ, с помощью которого удалось бы различить химически одинаковые, но разные по массе атомы одного элемента. Это сделал физик Томсон. Сконструировав остроумную экспериментальную установку, он провел на ней исследования с инертным газом неоном. Результаты подтвердили высказанные ранее предположения. Выяснилось, что у неона существуют две разновидности атомов: Ne20 и Ne22, то есть изотопы неона с атомными весами 20 и 22 соответственно. Оказалось, что почти все известные нам элементы представляют собой смесь изотопов. Объяснить, почему, например, атомный вес калия меньше атомного веса аргона, теперь не составило труда. В самом деле, напишем изотопный состав K и Ar и процентное содержание отдельных изотопов в них:
Аргон Калий Ar36 Ar38 Ar40 K39 K40 K41 0,337 0,063 99,600 % 93,259 0,012 6,729 %.Майка все-таки с недоверием смотрела, как я выписываю на фанерке длинный ряд цифр. — Вы видите, что у аргона преобладает самый тяжелый изотоп (Ar40), а у калия — самый легкий (K39). В итоге и получается (можно убедиться в этом, проделав простой арифметический расчет), что атомный вес у Ar больше, чем у K. То же самое мы получим для Co с Ni и Te с J.
 Илья уже сказал, что ядро состоит из протонов и нейтронов. Число протонов выражает собой положительный заряд ядра и равно, следовательно, порядковому номеру элемента. Однако число нейтронов, связанных с протонами, может быть различным. Так, в атоме калия протонов всегда 19, а нейтронов может быть 20, 21 и 22. Эти три случая отвечают изотопам калия K39, K40 и K41 соответственно. Итак, ядра изотопов одного и того же химического элемента отличаются лишь числом нейтронов. Сумма нейтронов и протонов в ядре данного изотопа определяет его атомный вес.
Все изотопы можно разделить на две группы — устойчивые (или стабильные) и радиоактивные.
Стабильные изотопы не обладают радиоактивностью. Их число в настоящее время приблизилось к 280. Различные элементы состоят из разного количества стабильных изотопов. «Рекордсменом» в этом отношении является олово, у которого насчитывается десять изотопов.
Мнение, что радиоактивность присуща лишь элементам конца периодической системы, просуществовало недолго. Оказалось, что водород, углерод, калий, рубидий, индий, теллур, лантан, неодим, самарий, лютеций, тантал, рений также имеют радиоактивные изотопы. Их называют, как и продукты распада урана и тория, естественно радиоактивными изотопами. Их шестьдесят.
Радиоактивные изотопы характеризуются периодом полураспада и энергией распада, той энергией, которой обладает вылетающая частица.
Периодом полураспада называется количество времени, в течение которого данный радиоактивный изотоп распадается наполовину, то есть половина его количества превращается в изотоп другого элемента. Величины периодов полураспада (они обозначаются буквой T) у разных изотопов различные: от долей секунды до миллиардов лет. В зависимости от величины T различают изотопы короткоживущие, имеющие среднюю продолжительность жизни, и долгоживущие.
Сейчас известно почти 1500 стабильных и радиоактивных изотопов химических элементов, и большая часть из них получена искусственно.
— Подумать только — полторы тысячи изотопов! — удивилась Майка. — И что, все они применяются?
— Нет, конечно, не все, — улыбнулся я. — Многие вообще нельзя применять, потому что у них очень маленький период полураспада. Но если подсчитать количество изотопов, которые в наше время можно использовать, то сотня смело наберется…
— Кстати говоря, — вмешался Илья, — если внедрение радиоизотопов пойдет и дальше такими же быстрыми темпами, как и сейчас, то в человеческой жизни произойдет целая революция!
— Такой же переворот, какой произвело электричество? — улыбнулся Сергей.
— А ты не смейся! Я говорю серьезно… Внимательнее читайте газеты! В них то и дело встречаются сообщения о том, как все в новые и новые отрасли хозяйства внедряются радиоизотопы. Они и ускоряют производственные процессы, и помогают их автоматизировать, и во много раз повышают их эффективность… Они несут миллиарды рублей экономии. Подумайте только: в Москве, на Юго-Западе, есть специальный магазин «Изотопы»! Единственный в мире! А ты еще сомневаешься! — Илья вызывающе взглянул на Сергея.
— Ну, а где же конкретные применения? — спросила Наташа. — Мы ждем да ждем, а вы все вокруг да около. Ну расскажите, например, как радиоактивные изотопы используют в медицине… Я слышала, с их помощью лечат рак…
— Давайте договоримся! — сказал Илья. — Пусть в этих рассказах будет какая-то система. Больше всего меня убивает в наших спорах полнейшая бессистемность! Анатолий рассказал про определение возраста органических остатков. Но ведь с помощью радиоактивных изотопов определяют возраст и других объектов… Например, Земли. Да, кстати, сколько, по-вашему, лет камню, который лежит около печки?
— Странный вопрос! — удивился Алеша. — Столько же, сколько и Земле!
— Отнюдь нет! Образование различных горных пород и минералов происходило не одновременно. Есть минералы очень древние, есть сравнительно молодые. Так утверждает геология. Как образовывались различные минералы — вопрос сложный. Об этом можно узнать из геологической литературы. Я хочу подчеркнуть, что возраст Земли и разных минералов — величины не всегда одни и те же.
Итак, сколько лет Земле?
Люди пытались ответить на этот вопрос в глубокой древности, задолго до накопления того комплекса знаний об окружающем мире, который позволил подойти к делу научно.
Церковники считали, что образование Земли (сиречь сотворение мира) произошло сравнительно недавно. Согласно библейскому «летосчислению» в этом году исполняется 5716 годовщина сотворения Земли «всемогущим».
Но в различных религиозных догматах не было единства взглядов. Так, вавилонские летописи определяли, что «сотворение мира» произошло несколько сот тысяч лет назад. Японские предания гласили, что Земля была создана за несколько миллионов лет до заселения Японских островов. Китайские источники устанавливают срок в 3,5 миллиона лет.
Когда же в дело вмешалась наука, все эти представления были отвергнуты.
Ученые по-разному пытались определить возраст Земли. Они использовали астрономические данные, исходили из скорости образования осадочных пород в морях, пытались рассчитать, сколько лет потребовалось для охлаждения планеты до современного состояния. Однако все эти методы были грубо приближенными. Они давали самые различные величины от 20 до 5000 миллионов лет.
В наши дни ученые заявляют: Земля образовалась около 5 миллиардов лет назад. Можно вполне доверять этой цифре. Разумеется, она не является абсолютно точной, но, во всяком случае, достаточно близка к истинной.
Эта цифра была определена с помощью радиоактивных изотопов.
Большинство элементов состоит из нескольких изотопов. Обычно преобладает какой-нибудь один или два; процентное содержание остальных значительно меньше. Изотопный состав элемента сравнительно просто определить с помощью специальных устройств.
Проведем следующий эксперимент. Возьмем несколько образцов минералов, в состав которых входит интересующий нас элемент. Установим в каждом отдельном случае его изотопный состав. Мы придем к интересному выводу: изотопный состав нашего элемента почти одинаков независимо от соединения, в котором он содержится. Добавим еще: и от происхождения этого соединения. Так, сходство изотопного состава земных минералов и метеоритов доказано для 12 элементов.
Но можем ли мы утверждать, что изотопный состав любого элемента есть нечто неизменное, раз навсегда установившееся не только со времени образования Земли, но и происхождения химических элементов вообще? Оказывается, нет.
Какие же процессы могут привести к нарушению этого постоянства? Прежде всего естественная радиоактивность.
Например, два классических радиоактивных элемента уран и торий после длинной цепочки распадов превращаются в стабильные изотопы свинца. Так, уран 238 имеет конечным продуктом радиоактивных превращений свинец 206, уран 235 — свинец 207, торий 232 — свинец 208. Будем называть свинец, образовавшийся в результате распада урана и тория, радиогенным. Он всегда есть в свинцовых минералах, одновременно содержащих эти радиоактивные элементы. И если обыкновенный природный свинец состоит из 53,02 процента Pb208, 23,33 процента Pb207, 22,07 процента Pb206 и 1,58 процента Pb204, то изотопный состав свинца минералов, в состав которых входят также уран и торий, существенно отличается. Радиогенный свинец сильно изменяет общий изотопный состав свинца.
Давайте рассуждать дальше. Мы можем определить величины отклонения изотопного состава свинца в радиоактивном ураноториевом минерале от обычного и отсюда рассчитать, сколько добавилось радиогенного свинца. По цепочкам превращений урана и тория просто найти количество этих элементов, распавшихся за время существования минерала. Теперь подвергнем минерал обычному химическому анализу. Он покажет, сколько урана и тория содержится в настоящее время в нашем минерале. Следовательно, получим очень важные цифры, которые показывают, какая часть урана и тория успела превратиться в свинец. Зная же периоды полураспада этих элементов, можем легко найти возраст минерала.
Этот метод является наиболее точным из всех, которыми располагает наука для определения возраста Земли и горных пород. Правда, предполагается, что возраст Земли и древних пород, содержащих уран и торий, — величины примерно одинаковые.
А как же быть с нашим булыжником? Ведь он не содержит ни урана, ни тория… Но все же можно определить и его возраст.
Илья уже сказал, что ядро состоит из протонов и нейтронов. Число протонов выражает собой положительный заряд ядра и равно, следовательно, порядковому номеру элемента. Однако число нейтронов, связанных с протонами, может быть различным. Так, в атоме калия протонов всегда 19, а нейтронов может быть 20, 21 и 22. Эти три случая отвечают изотопам калия K39, K40 и K41 соответственно. Итак, ядра изотопов одного и того же химического элемента отличаются лишь числом нейтронов. Сумма нейтронов и протонов в ядре данного изотопа определяет его атомный вес.
Все изотопы можно разделить на две группы — устойчивые (или стабильные) и радиоактивные.
Стабильные изотопы не обладают радиоактивностью. Их число в настоящее время приблизилось к 280. Различные элементы состоят из разного количества стабильных изотопов. «Рекордсменом» в этом отношении является олово, у которого насчитывается десять изотопов.
Мнение, что радиоактивность присуща лишь элементам конца периодической системы, просуществовало недолго. Оказалось, что водород, углерод, калий, рубидий, индий, теллур, лантан, неодим, самарий, лютеций, тантал, рений также имеют радиоактивные изотопы. Их называют, как и продукты распада урана и тория, естественно радиоактивными изотопами. Их шестьдесят.
Радиоактивные изотопы характеризуются периодом полураспада и энергией распада, той энергией, которой обладает вылетающая частица.
Периодом полураспада называется количество времени, в течение которого данный радиоактивный изотоп распадается наполовину, то есть половина его количества превращается в изотоп другого элемента. Величины периодов полураспада (они обозначаются буквой T) у разных изотопов различные: от долей секунды до миллиардов лет. В зависимости от величины T различают изотопы короткоживущие, имеющие среднюю продолжительность жизни, и долгоживущие.
Сейчас известно почти 1500 стабильных и радиоактивных изотопов химических элементов, и большая часть из них получена искусственно.
— Подумать только — полторы тысячи изотопов! — удивилась Майка. — И что, все они применяются?
— Нет, конечно, не все, — улыбнулся я. — Многие вообще нельзя применять, потому что у них очень маленький период полураспада. Но если подсчитать количество изотопов, которые в наше время можно использовать, то сотня смело наберется…
— Кстати говоря, — вмешался Илья, — если внедрение радиоизотопов пойдет и дальше такими же быстрыми темпами, как и сейчас, то в человеческой жизни произойдет целая революция!
— Такой же переворот, какой произвело электричество? — улыбнулся Сергей.
— А ты не смейся! Я говорю серьезно… Внимательнее читайте газеты! В них то и дело встречаются сообщения о том, как все в новые и новые отрасли хозяйства внедряются радиоизотопы. Они и ускоряют производственные процессы, и помогают их автоматизировать, и во много раз повышают их эффективность… Они несут миллиарды рублей экономии. Подумайте только: в Москве, на Юго-Западе, есть специальный магазин «Изотопы»! Единственный в мире! А ты еще сомневаешься! — Илья вызывающе взглянул на Сергея.
— Ну, а где же конкретные применения? — спросила Наташа. — Мы ждем да ждем, а вы все вокруг да около. Ну расскажите, например, как радиоактивные изотопы используют в медицине… Я слышала, с их помощью лечат рак…
— Давайте договоримся! — сказал Илья. — Пусть в этих рассказах будет какая-то система. Больше всего меня убивает в наших спорах полнейшая бессистемность! Анатолий рассказал про определение возраста органических остатков. Но ведь с помощью радиоактивных изотопов определяют возраст и других объектов… Например, Земли. Да, кстати, сколько, по-вашему, лет камню, который лежит около печки?
— Странный вопрос! — удивился Алеша. — Столько же, сколько и Земле!
— Отнюдь нет! Образование различных горных пород и минералов происходило не одновременно. Есть минералы очень древние, есть сравнительно молодые. Так утверждает геология. Как образовывались различные минералы — вопрос сложный. Об этом можно узнать из геологической литературы. Я хочу подчеркнуть, что возраст Земли и разных минералов — величины не всегда одни и те же.
Итак, сколько лет Земле?
Люди пытались ответить на этот вопрос в глубокой древности, задолго до накопления того комплекса знаний об окружающем мире, который позволил подойти к делу научно.
Церковники считали, что образование Земли (сиречь сотворение мира) произошло сравнительно недавно. Согласно библейскому «летосчислению» в этом году исполняется 5716 годовщина сотворения Земли «всемогущим».
Но в различных религиозных догматах не было единства взглядов. Так, вавилонские летописи определяли, что «сотворение мира» произошло несколько сот тысяч лет назад. Японские предания гласили, что Земля была создана за несколько миллионов лет до заселения Японских островов. Китайские источники устанавливают срок в 3,5 миллиона лет.
Когда же в дело вмешалась наука, все эти представления были отвергнуты.
Ученые по-разному пытались определить возраст Земли. Они использовали астрономические данные, исходили из скорости образования осадочных пород в морях, пытались рассчитать, сколько лет потребовалось для охлаждения планеты до современного состояния. Однако все эти методы были грубо приближенными. Они давали самые различные величины от 20 до 5000 миллионов лет.
В наши дни ученые заявляют: Земля образовалась около 5 миллиардов лет назад. Можно вполне доверять этой цифре. Разумеется, она не является абсолютно точной, но, во всяком случае, достаточно близка к истинной.
Эта цифра была определена с помощью радиоактивных изотопов.
Большинство элементов состоит из нескольких изотопов. Обычно преобладает какой-нибудь один или два; процентное содержание остальных значительно меньше. Изотопный состав элемента сравнительно просто определить с помощью специальных устройств.
Проведем следующий эксперимент. Возьмем несколько образцов минералов, в состав которых входит интересующий нас элемент. Установим в каждом отдельном случае его изотопный состав. Мы придем к интересному выводу: изотопный состав нашего элемента почти одинаков независимо от соединения, в котором он содержится. Добавим еще: и от происхождения этого соединения. Так, сходство изотопного состава земных минералов и метеоритов доказано для 12 элементов.
Но можем ли мы утверждать, что изотопный состав любого элемента есть нечто неизменное, раз навсегда установившееся не только со времени образования Земли, но и происхождения химических элементов вообще? Оказывается, нет.
Какие же процессы могут привести к нарушению этого постоянства? Прежде всего естественная радиоактивность.
Например, два классических радиоактивных элемента уран и торий после длинной цепочки распадов превращаются в стабильные изотопы свинца. Так, уран 238 имеет конечным продуктом радиоактивных превращений свинец 206, уран 235 — свинец 207, торий 232 — свинец 208. Будем называть свинец, образовавшийся в результате распада урана и тория, радиогенным. Он всегда есть в свинцовых минералах, одновременно содержащих эти радиоактивные элементы. И если обыкновенный природный свинец состоит из 53,02 процента Pb208, 23,33 процента Pb207, 22,07 процента Pb206 и 1,58 процента Pb204, то изотопный состав свинца минералов, в состав которых входят также уран и торий, существенно отличается. Радиогенный свинец сильно изменяет общий изотопный состав свинца.
Давайте рассуждать дальше. Мы можем определить величины отклонения изотопного состава свинца в радиоактивном ураноториевом минерале от обычного и отсюда рассчитать, сколько добавилось радиогенного свинца. По цепочкам превращений урана и тория просто найти количество этих элементов, распавшихся за время существования минерала. Теперь подвергнем минерал обычному химическому анализу. Он покажет, сколько урана и тория содержится в настоящее время в нашем минерале. Следовательно, получим очень важные цифры, которые показывают, какая часть урана и тория успела превратиться в свинец. Зная же периоды полураспада этих элементов, можем легко найти возраст минерала.
Этот метод является наиболее точным из всех, которыми располагает наука для определения возраста Земли и горных пород. Правда, предполагается, что возраст Земли и древних пород, содержащих уран и торий, — величины примерно одинаковые.
А как же быть с нашим булыжником? Ведь он не содержит ни урана, ни тория… Но все же можно определить и его возраст.
 Есть один весьма распространенный химический элемент, который входит в большинство горных пород и минералов. Это калий. Среди его природных изотопов — два стабильных (K39 и K41) и один естественно радиоактивный (K40) с периодом полураспада около десяти миллиардов лет.
Калий 40 используется для определения возраста многих минералов. Он претерпевает своеобразный радиоактивный распад, который в ядерной физике носит название К-захвата и заключается в поглощении ядром калия 40 электрона с близлежащей электронной оболочки. При этом заряд атома понижается на единицу и образуется изотоп инертного газа аргона Ar40. В аргоне атмосферного воздуха наряду с изотопами Ar36 и Ar38 содержится Ar40, который, по-видимому, весь или почти весь произошел вследствие распада калия 40.
А теперь о возрасте нашего камня. Он осколок горной породы, содержащей калий. Условимся, что весь аргон, получившийся в результате распада калия 40, остается внутри образца, а не улетучивается Кроме того, мы вводим поправку на возможное содержание в образце атмосферного аргона.
Анализируем наш камень на содержание K и Ar. Учтя введенную поправку, определяем содержание радиогенного аргона. Отсюда находим количество калия, которое успело распасться со времени образования горной породы. Зная, сколько калия содержится в образце, рассчитываем, какая часть этого элемента распалась. Теперь, использовав величину полураспада K40, определяем возраст.
— Эх, Илья, а зря ты не литератор, — вздохнул Алеша. — У тебя не рассказ получился, а законченная новелла!
— А может, и незаконченная! — сказала Майка. — Илья, а вот если у тебя порода, в которой нет ни урана, ни тория, ни калия, как ты определишь ее возраст?
— Сейчас разрабатываются и другие методы. Применяют так называемый стронциевый метод. Он состоит в определении количества стронция, который образуется из радиоактивного изотопа рубидия 87. Есть попытки установить абсолютный возраст минералов по парам изотопов так называемых редкоземельных элементов: самарий 147 — неодим 143; лантан 138 — церий 138, лютеций 176 — иттербий 176. И, несомненно, число таких способов будет расти с каждым годом…
Есть один весьма распространенный химический элемент, который входит в большинство горных пород и минералов. Это калий. Среди его природных изотопов — два стабильных (K39 и K41) и один естественно радиоактивный (K40) с периодом полураспада около десяти миллиардов лет.
Калий 40 используется для определения возраста многих минералов. Он претерпевает своеобразный радиоактивный распад, который в ядерной физике носит название К-захвата и заключается в поглощении ядром калия 40 электрона с близлежащей электронной оболочки. При этом заряд атома понижается на единицу и образуется изотоп инертного газа аргона Ar40. В аргоне атмосферного воздуха наряду с изотопами Ar36 и Ar38 содержится Ar40, который, по-видимому, весь или почти весь произошел вследствие распада калия 40.
А теперь о возрасте нашего камня. Он осколок горной породы, содержащей калий. Условимся, что весь аргон, получившийся в результате распада калия 40, остается внутри образца, а не улетучивается Кроме того, мы вводим поправку на возможное содержание в образце атмосферного аргона.
Анализируем наш камень на содержание K и Ar. Учтя введенную поправку, определяем содержание радиогенного аргона. Отсюда находим количество калия, которое успело распасться со времени образования горной породы. Зная, сколько калия содержится в образце, рассчитываем, какая часть этого элемента распалась. Теперь, использовав величину полураспада K40, определяем возраст.
— Эх, Илья, а зря ты не литератор, — вздохнул Алеша. — У тебя не рассказ получился, а законченная новелла!
— А может, и незаконченная! — сказала Майка. — Илья, а вот если у тебя порода, в которой нет ни урана, ни тория, ни калия, как ты определишь ее возраст?
— Сейчас разрабатываются и другие методы. Применяют так называемый стронциевый метод. Он состоит в определении количества стронция, который образуется из радиоактивного изотопа рубидия 87. Есть попытки установить абсолютный возраст минералов по парам изотопов так называемых редкоземельных элементов: самарий 147 — неодим 143; лантан 138 — церий 138, лютеций 176 — иттербий 176. И, несомненно, число таких способов будет расти с каждым годом…
Маршрут второй

Когда догорела свеча, мы легли спать. Засыпали, надеясь, что к утру непогода утихнет. Но природа, видимо, крепко хотела нам насолить, и когда забрезжил рассвет, маленькое окошко избушки было на три четверти засыпано снегом. Помещение за ночь основательно простыло. Вылезать из теплых спальных мешков и разжигать печку не хотелось.
— Опять двадцать пять! — разочарованно произнес Олег, прислушиваясь к посвисту ветра. — Зимовка продолжается…
— Хотите я зачитаю вам потрясающий документ! — подал голос из своего угла Илья. — Цитирую по памяти: «В течение первой декады февраля малооблачная погода без осадков. Температура днем минус десять — минус двенадцать, ночью до двадцати — двадцати пяти градусов мороза».
— Это что, анекдот? — спросила Наташа.
— Отнюдь! Это выдержка из долгосрочного прогноза, который я имел честь достать в Москве перед походом. Совпадение, как видите, блистательное!
Алеша сердито засопел:
— Я еще не видел организации, которая бы столь бессовестно и столь постоянно вводила в заблуждение миллионы граждан. Неужели нельзя научиться точно предсказывать погоду. Хотя бы с помощью этих самых радиоактивных изотопов.
— Ты зря горячишься! — возразил я. — Предсказание погоды — дело исключительно сложное, и ошибки и случайности здесь неизбежны. А что касается изотопов, то здесь ты угодил в самую точку. Можно с их помощью определять погоду. Пока, к сожалению, не на завтрашний день, а ту, которая была миллионы и сотни миллионов лет назад.
— Толя, ты, часом, не угорел ночью? — участливо спросила Майка.
— Начальник говорит истину! — торжественно воскликнул Илья. — Есть такая наука — палеоклиматология! Изучение климата древности. В ней большую роль играет изотоп кислорода O18. Это его самый тяжелый изотоп. Впрочем, Анатолий, рассказывай. «Продолжим наши игры», как говорил Остап Бендер.
Изотопы и климат прошлого
— Наверное, всем известно, — заговорил я, — что многие десятки миллионов лет назад на месте, где теперь находится Московская область, плескалось море. И жили в этом море особые моллюски — белемниты, раковины которых сохранились до наших дней в виде так называемых чертовых пальцев. Но пока маленькое отступление. В науке существует процесс, носящий название изотопного обмена. Суть его в том, что распределение изотопов одного и того же элемента между разными химическими соединениями может изменяться. Объяснение явления просто: химические свойства изотопов элемента бесконечно близки, но не тождественны. Есть некоторые отличия, они и проявляются в изотопном обмене. Вот пример. В нашем распоряжении вода, но не обычная, а составленная из двух атомов водорода и одного атома так называемого «тяжелого» кислорода, то есть его изотопа с атомным весом 18. Формула такой воды запишется, как H2O18. Будем пропускать через эту воду обычный молекулярный кислород O216. Получится система, состоящая из воды и растворенного в воде кислорода:
O216 + H2O18.Оказывается, что в этом случае произойдет изотопный обмен: атомы О16 будут замещать атомы О18 в молекуле воды. А вот как запишется реакция:
O216 + 2H2O18↔O218 + 2H2O16.Расчеты показывают, что эта обратимая реакция лучше идет слева направо, или, как говорят химики, равновесие реакции сдвинуто вправо. Иными словами, О16 охотнее входит в состав воды, чем остается в виде молекулярного кислорода. Можно подсчитать величину отношения:
(О16/О18) воды к (О16/О18) молекулярного кислорода.При 25 °C оно равно 1,041, а при 100 °C составит 1,005. Эта величина называется постоянной равновесия и зависит от температуры. Эта зависимость лежит в основе так называемого геологического термометра. Но как с помощью такого термометра определять температуру? Есть другая реакция изотопного обмена:
CaCO316 + 3H2O18↔CaCO318 + 3H2O16.Она подчиняется тем же закономерностям, что и предыдущая. Теперь маленький экскурс в область геологии. CaCO3, карбонат кальция, — это известняк, относящийся к так называемым осадочным породам. Они являются отложениями древних морей. Раковины низших организмов — также известняк. Обломки таких раковин часто попадаются при исследовании отложений. Когда-то организмы, которым принадлежали раковины, жили в морях. Они использовали в качестве «строительного материала» именно CaCO3, содержащийся в морской воде. И чем выше была температура воды, тем больше O18 входило в их состав.
 Достаточно определить изотопный состав кислорода в отложениях известняка, в различных их слоях, чтобы установить температуру «рождения» и «роста» раковин. Значит, мы имеем реальную возможность судить о температурах в невообразимо далеком прошлом.
Точность метода потрясающая: плюс-минус полградуса!
Так какая же температура была в районе нынешней Московской области сто пятьдесят миллионов лет назад?
На этот вопрос отвечают белемниты.
В учебнике геологии можно прочесть: «Белемниты известны с триасового периода, достигли расцвета в юрский и меловой периоды, к началу третичного периода вымерли».
В учебнике найдется и другая справка: триасовый период закончился 180 миллионов лет назад, юрский — примерно 130, меловой — 60 миллионов; далее начался третичный.
Значит, нас должны интересовать юрские белемниты, которые особенно процветали 150 миллионов лет назад.
Применение «геологического термометра» показало, что в «юности» эти моллюски жили в более теплой воде, чем «на склоне лет», что они пережили четыре «зимы» и три «лета» и вымерли «зимой». Под «летом» и «зимой» понимаются периоды потепления и похолодания климата. «Термометр» отметил максимальные сезонные изменения температуры на протяжении периода. Они оказались равными примерно шести градусам. Средняя температура в период существования исследованного образца белемнита составляла — +17,6°.
Такая температура была 150 миллионов лет назад!
— Есть о чем задуматься прогнозистам современности! — сказал Илья. — Впрочем, ведь и в современную метеорологию проберутся радиоизотопы. Например, можно будет следить за перемещением воздушных масс, если их «пометить» специальным радиоактивным изотопом.
Достаточно определить изотопный состав кислорода в отложениях известняка, в различных их слоях, чтобы установить температуру «рождения» и «роста» раковин. Значит, мы имеем реальную возможность судить о температурах в невообразимо далеком прошлом.
Точность метода потрясающая: плюс-минус полградуса!
Так какая же температура была в районе нынешней Московской области сто пятьдесят миллионов лет назад?
На этот вопрос отвечают белемниты.
В учебнике геологии можно прочесть: «Белемниты известны с триасового периода, достигли расцвета в юрский и меловой периоды, к началу третичного периода вымерли».
В учебнике найдется и другая справка: триасовый период закончился 180 миллионов лет назад, юрский — примерно 130, меловой — 60 миллионов; далее начался третичный.
Значит, нас должны интересовать юрские белемниты, которые особенно процветали 150 миллионов лет назад.
Применение «геологического термометра» показало, что в «юности» эти моллюски жили в более теплой воде, чем «на склоне лет», что они пережили четыре «зимы» и три «лета» и вымерли «зимой». Под «летом» и «зимой» понимаются периоды потепления и похолодания климата. «Термометр» отметил максимальные сезонные изменения температуры на протяжении периода. Они оказались равными примерно шести градусам. Средняя температура в период существования исследованного образца белемнита составляла — +17,6°.
Такая температура была 150 миллионов лет назад!
— Есть о чем задуматься прогнозистам современности! — сказал Илья. — Впрочем, ведь и в современную метеорологию проберутся радиоизотопы. Например, можно будет следить за перемещением воздушных масс, если их «пометить» специальным радиоактивным изотопом.
 — Пока нам от этого не легче, — сказал Олег. — Между прочим, не пора ли вставать? Илья, который час?
— Десять минут девятого!
— А по моим без двадцати десять! — заявила Наташа.
— Кому прикажете верить?
— Стоят мои часы! — сказал Илья. — Забыл завести за вчерашними разговорами. Хорошо хоть в группе есть вторые, а то пришлось бы определять время по наитию.
— Куда как удобны электрические стенные часы! — высказался Алеша. — И заводить не надо.
— И наручные часы, которые годами не останавливаются, теперь уже не проблема, — сказал я.
— А где же источник тока? Какой-нибудь сверхаккумулятор?
— Отнюдь. — Илья начинал растапливать печку. — Источник более простой. Атомная батарейка — слышали?
— Пока нам от этого не легче, — сказал Олег. — Между прочим, не пора ли вставать? Илья, который час?
— Десять минут девятого!
— А по моим без двадцати десять! — заявила Наташа.
— Кому прикажете верить?
— Стоят мои часы! — сказал Илья. — Забыл завести за вчерашними разговорами. Хорошо хоть в группе есть вторые, а то пришлось бы определять время по наитию.
— Куда как удобны электрические стенные часы! — высказался Алеша. — И заводить не надо.
— И наручные часы, которые годами не останавливаются, теперь уже не проблема, — сказал я.
— А где же источник тока? Какой-нибудь сверхаккумулятор?
— Отнюдь. — Илья начинал растапливать печку. — Источник более простой. Атомная батарейка — слышали?
Атомные батарейки
— Я об этом где-то читал, — ответил Сергей. — Насколько помню, принцип действия таков: берется пластинка с радиоактивным изотопом, к ней вплотную прижаты стержни из полупроводниковых материалов. Под действием излучения такая батарейка дает ток. — Что-то мне не совсем понятен принцип, — сказала Наташа. — А чего тут не понимать? — удивился Илья. — Олег просто не договорил до конца. Дело вот в чем: два соседних полупроводника образуют термопару. Знаете, что такое термопара? — Насколько я помню, если спаять концами два различных металла и нагреть спай, то возникает электрический ток, — смущаясь, проговорила Майка. — Вот-вот! — обрадовался Илья. — Люблю, когда филологи смыслят в технике. Далее вы, наверное, знаете, что при радиоактивном распаде выделяется тепло. Это тепло нагревает внутренние концы стержней, внешние же имеют комнатную температуру. Благодаря разнице в температуре возникает термоэлектричество. В Америке создана такая установка. Размером она не больше поллитровой кружки, весит всего пять килограммов, а дает столько же энергии, сколько мощная батарея из самых лучших современных аккумуляторов, весящая 700 килограммов. В ней применяются радиоактивные изотопы стронций 90 или полоний 210. — Это да! — восхитился Алеша. — Взять такую батарейку в поход — и свет и тепло на все путешествие. И костра не надо! — Остановка за малым. Знаешь, сколько стоит такая «карманная электростанция»? Десятки миллионов долларов! — Дорогая игрушка, — пробурчал Сергей. — Какое же у нее может быть практическое применение? Видимо, превратить атомную энергию непосредственно в электрическую далеко не просто. — Конечно, до предмета ширпотреба ей далеко. Но эти батарейки можно применять как источники электроэнергии в искусственных спутниках и космических ракетах, где крайне важен выигрыш в весе и объеме. — Хорошо, — произнесла Наташа. — Ну, а атомная батарейка для часов? — Тут можно использовать батарейку, работающую по другому принципу, — ответил я.
 Наиболее портативная, прямо-таки микробатарейка, работает на энергии бета-распада изотопа прометия 147.
Как же устроена такая батарейка? Окись прометия, содержащая прометий 147, смешивают с самым обыкновенным фосфором. Фосфор поглощает бета-частицы, испускаемые прометием. Энергия радиоактивного излучения превращается в световую; фосфор светится. Это свечение улавливается специальными фотоэлементами, назначение которых превращать световую энергию в электрическую. Прометиевая батарейка миниатюрна. Ее диск имеет размер обычной канцелярской кнопки и толщину около одного миллиметра.
Температура и давление практически не сказываются на работе такой батарейки. Интересно, что при очень низкой температуре (около –100°) она действует даже лучше, чем при комнатной.
Прометиевая батарейка может постоянно производить электроэнергию по крайней мере в течение пяти лет.
— На атомных плитках пища, вероятно, не будет подгорать, — ухмыльнулся Сергей. — А сейчас я чувствую отчетливый запах гари. Как там, Илья, наш завтрак?
Каша действительно подгорела, что, правда, не испортило нам аппетита. Теперь дело за чаем. А это было не просто: снова растапливать снег, без конца подкладывать в печурку дрова и ждать бесконечно терпеливо, когда же, наконец, закипит мутная жидкость в ведре. Дежурному не завидовали. А им был Илья.
— Вот что, друзья, — заявил он. — Чего хотите: чаю или новую порцию изотопов?
— Чаю, — сказал Алеша.
— И того и другого, — пробасил Сергей.
— Или того или другого! — настаивал Илья. — Я думал сейчас рассказать о том, как получают изотопы. О ядерной химии. Совмещать и то и другое не смогу. Сами видите, миллион удовольствий с печкой возиться…
Просто Илье захотелось на сейраз увильнуть от дежурства.
— Не выйдет! — заявил я. — Будешь топить печку и рассказывать. А за снегом, уж так и быть, я сбегаю.
Илья метнул на меня недовольный взгляд.
— Ну, нет! Общество хочет взвалить на меня двойную работу.
— Брось, Илья, торговаться, — вмешался Олег. — Дело мы затеяли нужное, и нечего спорить по пустякам.
Илья протянул мне ведро:
— Ладно, тащи снегу! — и, усевшись около печки, начал: — Классическую химию можно назвать химией электронных оболочек. Знаете почему?
Наиболее портативная, прямо-таки микробатарейка, работает на энергии бета-распада изотопа прометия 147.
Как же устроена такая батарейка? Окись прометия, содержащая прометий 147, смешивают с самым обыкновенным фосфором. Фосфор поглощает бета-частицы, испускаемые прометием. Энергия радиоактивного излучения превращается в световую; фосфор светится. Это свечение улавливается специальными фотоэлементами, назначение которых превращать световую энергию в электрическую. Прометиевая батарейка миниатюрна. Ее диск имеет размер обычной канцелярской кнопки и толщину около одного миллиметра.
Температура и давление практически не сказываются на работе такой батарейки. Интересно, что при очень низкой температуре (около –100°) она действует даже лучше, чем при комнатной.
Прометиевая батарейка может постоянно производить электроэнергию по крайней мере в течение пяти лет.
— На атомных плитках пища, вероятно, не будет подгорать, — ухмыльнулся Сергей. — А сейчас я чувствую отчетливый запах гари. Как там, Илья, наш завтрак?
Каша действительно подгорела, что, правда, не испортило нам аппетита. Теперь дело за чаем. А это было не просто: снова растапливать снег, без конца подкладывать в печурку дрова и ждать бесконечно терпеливо, когда же, наконец, закипит мутная жидкость в ведре. Дежурному не завидовали. А им был Илья.
— Вот что, друзья, — заявил он. — Чего хотите: чаю или новую порцию изотопов?
— Чаю, — сказал Алеша.
— И того и другого, — пробасил Сергей.
— Или того или другого! — настаивал Илья. — Я думал сейчас рассказать о том, как получают изотопы. О ядерной химии. Совмещать и то и другое не смогу. Сами видите, миллион удовольствий с печкой возиться…
Просто Илье захотелось на сейраз увильнуть от дежурства.
— Не выйдет! — заявил я. — Будешь топить печку и рассказывать. А за снегом, уж так и быть, я сбегаю.
Илья метнул на меня недовольный взгляд.
— Ну, нет! Общество хочет взвалить на меня двойную работу.
— Брось, Илья, торговаться, — вмешался Олег. — Дело мы затеяли нужное, и нечего спорить по пустякам.
Илья протянул мне ведро:
— Ладно, тащи снегу! — и, усевшись около печки, начал: — Классическую химию можно назвать химией электронных оболочек. Знаете почему?
Что такое ядерная химия
Потому что при всех химических процессах происходят изменения в строении внешних электронных оболочек тех атомов, которые принимают участие в химических реакциях. При этом атомы или отдают часть своих электронов и превращаются в положительно заряженные ионы, или приобретают дополнительные электроны; тогда они становятся отрицательными ионами. Но какой бы заряд ни имел ион данного элемента, он будет только ионом именно этого элемента. Например, в азотной кислоте ион азота имеет заряд +5, в окиси азота +2, в закиси +1, наконец, в аммиаке –3, но во всех этих случаях азот остается азотом. Он лишь выступает, как говорят химики, в разных валентных состояниях. Следовательно, при химических процессах строение атомного ядра не меняется. Если же каким-нибудь путем удается изменить структуру ядра, то в этом случае следует говорить о ядерных реакциях. Они приводят к образованию различных радиоактивных изотопов. Такие реакции происходят и в природе. Так, образование углерода 14 из азота — ядерная реакция. Превращение радиоактивных элементов друг в друга: урана в торий, тория в радий, радия в радон и т. д. — это тоже ядерные реакции. Как же удается человеку совершать превращения элементов? Честь первого искусственного превращения элементов принадлежит английскому физику Эрнсту Резерфорду. Уже в начале XX века знали о естественных превращениях элементов, например радиоактивном распаде урана, тория, актиния, полония и радона. Но ученые не располагали средствами, чтобы как-либо повлиять на этот процесс — ускорить его или замедлить, провести мгновенно или прекратить вовсе. Тем труднее и фантастичнее казалась поставленная задача. Вызвать искусственное превращение элементов — это значило вторгнуться в пределы ядра, нарушить его структуру, изменить заряд. Нужно было сначала подготовиться теоретически. При естественных радиоактивных превращениях выделяется огромная энергия. Если выразить ее величину через температуру, то получится громадная величина, миллионы градусов. Возможно, такая высокая температура способна вызвать ядерные реакции. Но подобных сверхвысоких температур не было в руках людей. Существовали пока смутные догадки, что процессы превращения элементов происходят лишь в звездах. А если найти такие частицы, такие «снаряды», которые, проникнув через электронную оболочку атома, смогли бы преодолеть отталкивающее действие ядра? У них, этих частиц, должна быть очень высокая кинетическая энергия. В руках ученых были лишь положительные альфа- и отрицательные бета-частицы. Но бета-частицы отпадали: их легко оттолкнули бы электронные оболочки атома. Оставались альфа-частицы, ядра атомов гелия. Резерфорд и решил применить эти частицы в качестве стремительных «снарядов». Он использовал альфа-частицы изотопа полония, которые вылетают с громадной скоростью, почти 20 000 километров в секунду. Опыт Резерфорда, несмотря на всю необычность поставленной задачи, был прост. Его установка представляла собой небольшую камеру. Внутри располагался радиоактивный препарат, испускавший альфа-частицы. На стенке камеры помещался специальный экран, покрытый сернистым цинком. Это вещество способно светиться под действием альфа-частиц. На экране под микроскопом можно наблюдать очень характерные вспышки — сцинтилляции. Они-то и вызывались альфа-частицами. Резерфорд наполнил свою камеру азотом и продолжал наблюдения. Снова на экране появлялись вспышки, но совсем не похожие на те, что вызываются альфа-частицами. Значит, это были другие частицы. Ученый провел тщательные и многочисленные опыты и установил, что эти непонятные частицы — протоны, ядра атома водорода. Так обстояло дело на практике. Процесс нужно было объяснить теоретически. И Резерфорд рассуждал: Мы имеем ядро азота. Его можно обозначить, как 7N14, где цифра 7 показывает заряд ядра азота, а цифра 14 — атомный вес. Если в ядро азота попадает альфа-частица, то, по-видимому, образуется новое ядро, обозначаемое через X. Так как альфа-частица имеет заряд, равный двум, и вес, равный четырем, то можно записать «составное» ядро символом 9X18. И если при опыте обнаруживаются протоны, они могут испускаться только этим составным ядром. В итоге получается новое ядро; обозначим его через 8Y17, потому что протон имеет заряд, равный единице, и вес, равный единице. Ядро 8Y17 не может быть ничем иным, как ядром атома кислорода 8O17. Итак, при бомбардировке азота альфа-частицами образуется кислород. Происходит искусственное превращение элементов.
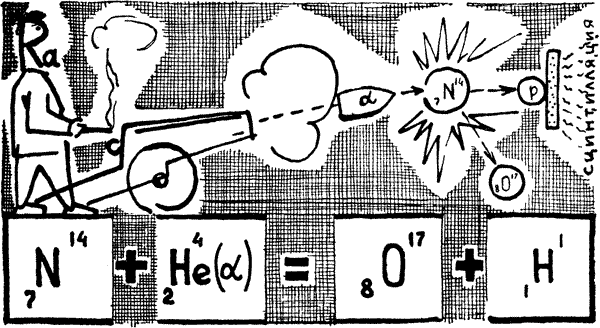 Вторым важнейшим шагом в развитии ядерной химии было открытие искусственной радиоактивности.
Это явление связано с именами супругов Ирэн и Фредерика Жолио-Кюри — представителей второго поколения Кюри.
Так же, как и Резерфорд, супруги Жолио-Кюри пытались в 1933 году провести реакцию превращения элементов. «Мишенью» они избрали металлический алюминий 13Al27. «Снарядами» служили альфа-частицы ядра гелия — 2He4, испускаемые сильно радиоактивным элементом полонием. Если реакция превращения элементов будет иметь место, то получится изотоп фосфора 15P30. Если также учесть, что алюминий во время облучения испускает нейтроны 0n1, то ядерную реакцию можно записать так:
Вторым важнейшим шагом в развитии ядерной химии было открытие искусственной радиоактивности.
Это явление связано с именами супругов Ирэн и Фредерика Жолио-Кюри — представителей второго поколения Кюри.
Так же, как и Резерфорд, супруги Жолио-Кюри пытались в 1933 году провести реакцию превращения элементов. «Мишенью» они избрали металлический алюминий 13Al27. «Снарядами» служили альфа-частицы ядра гелия — 2He4, испускаемые сильно радиоактивным элементом полонием. Если реакция превращения элементов будет иметь место, то получится изотоп фосфора 15P30. Если также учесть, что алюминий во время облучения испускает нейтроны 0n1, то ядерную реакцию можно записать так:
13Al27 + 2He4→0n1 + 15P30.Все, казалось бы, просто. Но неожиданно обнаруживается удивительная вещь: сама пластинка алюминия становится источником излучения. Оно не прекращается даже в отсутствие препарата полония. Супруги Кюри тщательно исследовали характер неизвестного излучения и выяснили, что оно является потоком позитронов. Позитрон представляет собой частицу, аналогичную электрону, но имеющую положительный заряд (e+). Эта частица была открыта двумя годами раньше американцем Андерсоном в космических лучах. Таким образом, рассуждали супруги Кюри, изотоп фосфора 15P30 оказывается радиоактивным и, испуская позитроны, превращается в стабильный изотоп кремния 14Si30. Иными словами:
15P30 – e+→4Si30.Это предположение было подтверждено химическими методами. Так человек нашел пути к получению искусственных радиоактивных изотопов. Таким образом, в основе ядерных реакций, процессов ядерной химии, лежат изменения атомного ядра. Конечным продуктом ядерной реакции может быть изотоп другого элемента (или других элементов) или другой изотоп того же элемента. Кроме того, в результате реакции могут получаться вторичные элементарные частицы (например, протон, дейтрон и другие) или испускаться гамма-лучи. Для того чтобы ядерная реакция осуществилась, требуется несколько условий. Во-первых, нужно располагать бомбардирующими частицами, своеобразными ядерными «агентами», «снарядами». Одни из них альфа-частицы — их применили в своих опытах Резерфорд и супруги Кюри. Кроме альфа-частиц, в качестве «снарядов» используются протоны (1p1), дейтроны (ядра «тяжелого» изотопа водорода 1d2) и нейтроны 0n1). Ядерные реакции могут вызываться также действием гамма-лучей. Эти элементарные частицы не трудно получить. В качестве источника альфа-частиц служат некоторые сильно радиоактивные элементы, например полоний, радий. Нейтронным источником оказывается смесь солей радия и бериллия: альфа-частицы, испускаемые радием, выбивают нейтроны из ядер бериллия. Тип бомбардирующих частиц имеет огромное значение для ядерных реакций. В зависимости от того, какая частица (альфа-частица, дейтрон, протон или нейтрон) выбрана в качестве «снаряда», меняется сам характер ядерной реакции и ее конечный результат. Второе условие несколько сложнее. Реакция происходит только тогда, когда бомбардирующей частице удается столкнуться с ядром. Оно обладает положительным зарядом, а значит, и сильным электрическим полем. Поэтому положительно заряженные частицы (α, p, d) будут испытывать сильное отталкивание со стороны поля ядра. В обычных условиях лишь очень редким частицам удается «просочиться» через «оборону» атомного ядра.
 Чтобы сделать ядерную реакцию интенсивной, бомбардирующим частицам надо придать большую энергию, их нужно ускорить.
Ускорить, но до какой степени?
Для измерения энергии бомбардирующих частиц используются специальные единицы — электроновольты. Электроновольтом называется энергия, которую получит частица с зарядом, равным заряду электрона, при прохождении разности потенциалов в один вольт (обозначение эв). Ядерные реакции происходят обычно при энергиях, измеряемых миллионами электроновольт, или мегаэлектроновольтами — Мэв).
Так, протон, чтобы проникнуть в ядро свинца, должен иметь энергию около 10 мегаэлектроновольт. Энергия же излучения большинства радиоактивных изотопов не достигает и одного электроновольта.
Но как ускорить заряженные частицы? Используются специальные установки, ускорители элементарных частиц.
В этих установках (их несколько типов) частицы ускоряются благодаря многократному повторному приложению магнитного поля. В циклотронах можно ускорить, например, протоны до энергии в 22 мегаэлектроновольта.
Старые типы ускорителей не давали возможности сообщать частицам энергии больше нескольких десятков мегаэлектроновольт. Современные — синхроциклотрон, синхрофазотрон — значительно совершеннее и позволяют достигать энергии в 10 000 мегаэлектроновольт. Такой мощный ускоритель работает, например, в Объединенном институте ядерных исследований в Дубне.
Создание ускорителей позволило провести и изучить большое количество различных ядерных реакций.
— Горим! — Спрыгнув с нар, Олег с остервенением начал топтать свой ватник, пристроенный возле печки для просушки и не желавший высыхать уже вторые сутки. Только сейчас мы почувствовали, что в избушке пахнет гарью.
— Олежка, дорогой! — улыбнулась Наташа. — Будет ли у нас хоть раз такой поход, когда у тебя ничего не сгорит и не утонет? То мы пьем кофе с твоими носками, то вытаскиваем твои тапочки из болота, а теперь в твоем ватнике будет безобразная дыра…
— Рассказывай таким растяпам о ядерной химии! — Илья не любил, если его внезапно перебивали.
— Сам-то ты хорош! — уныло произнес Олег. — Может, тебе напомнить историю, как некий опытный турист повел новичков в однодневный поход и вечером вышел точнехонько к тому месту, откуда ушел утром. Тема похода была, кажется, «Ориентировка на местности».
Это было темное пятно в туристской биографии Ильи. Слегка смутившись, он счел нужным продолжить свое сообщение.
— Многие трудности, связанные с применением в качестве «снарядов» заряженных частиц, исчезают, если в этой роли выступают нейтроны. Они не имеют заряда, и поэтому положительное поле ядра не представляет для них препятствия. Ядерные реакции могут идти с нейтронами очень низкой энергии (менее одного электроновольта). Эти нейтроны носят название тепловых, потому что их энергия близка к энергии теплового движения молекул. Ускоренные нейтроны подразделяются в зависимости от их энергии на медленные и быстрые.
Все известные ядерные реакции можно поделить на две группы. Одни реакции происходят под действием частиц или гамма-лучей невысокой энергии (до 50 мегаэлектроновольт). Другие требуют высокой энергии (более 50 мегаэлектроновольт).
Ядерные реакции также можно описать уравнением. Например, уравнение ядерной реакции Резерфорда будет выглядеть так:
Чтобы сделать ядерную реакцию интенсивной, бомбардирующим частицам надо придать большую энергию, их нужно ускорить.
Ускорить, но до какой степени?
Для измерения энергии бомбардирующих частиц используются специальные единицы — электроновольты. Электроновольтом называется энергия, которую получит частица с зарядом, равным заряду электрона, при прохождении разности потенциалов в один вольт (обозначение эв). Ядерные реакции происходят обычно при энергиях, измеряемых миллионами электроновольт, или мегаэлектроновольтами — Мэв).
Так, протон, чтобы проникнуть в ядро свинца, должен иметь энергию около 10 мегаэлектроновольт. Энергия же излучения большинства радиоактивных изотопов не достигает и одного электроновольта.
Но как ускорить заряженные частицы? Используются специальные установки, ускорители элементарных частиц.
В этих установках (их несколько типов) частицы ускоряются благодаря многократному повторному приложению магнитного поля. В циклотронах можно ускорить, например, протоны до энергии в 22 мегаэлектроновольта.
Старые типы ускорителей не давали возможности сообщать частицам энергии больше нескольких десятков мегаэлектроновольт. Современные — синхроциклотрон, синхрофазотрон — значительно совершеннее и позволяют достигать энергии в 10 000 мегаэлектроновольт. Такой мощный ускоритель работает, например, в Объединенном институте ядерных исследований в Дубне.
Создание ускорителей позволило провести и изучить большое количество различных ядерных реакций.
— Горим! — Спрыгнув с нар, Олег с остервенением начал топтать свой ватник, пристроенный возле печки для просушки и не желавший высыхать уже вторые сутки. Только сейчас мы почувствовали, что в избушке пахнет гарью.
— Олежка, дорогой! — улыбнулась Наташа. — Будет ли у нас хоть раз такой поход, когда у тебя ничего не сгорит и не утонет? То мы пьем кофе с твоими носками, то вытаскиваем твои тапочки из болота, а теперь в твоем ватнике будет безобразная дыра…
— Рассказывай таким растяпам о ядерной химии! — Илья не любил, если его внезапно перебивали.
— Сам-то ты хорош! — уныло произнес Олег. — Может, тебе напомнить историю, как некий опытный турист повел новичков в однодневный поход и вечером вышел точнехонько к тому месту, откуда ушел утром. Тема похода была, кажется, «Ориентировка на местности».
Это было темное пятно в туристской биографии Ильи. Слегка смутившись, он счел нужным продолжить свое сообщение.
— Многие трудности, связанные с применением в качестве «снарядов» заряженных частиц, исчезают, если в этой роли выступают нейтроны. Они не имеют заряда, и поэтому положительное поле ядра не представляет для них препятствия. Ядерные реакции могут идти с нейтронами очень низкой энергии (менее одного электроновольта). Эти нейтроны носят название тепловых, потому что их энергия близка к энергии теплового движения молекул. Ускоренные нейтроны подразделяются в зависимости от их энергии на медленные и быстрые.
Все известные ядерные реакции можно поделить на две группы. Одни реакции происходят под действием частиц или гамма-лучей невысокой энергии (до 50 мегаэлектроновольт). Другие требуют высокой энергии (более 50 мегаэлектроновольт).
Ядерные реакции также можно описать уравнением. Например, уравнение ядерной реакции Резерфорда будет выглядеть так:
7N14 + 2He4→1p1 + 8O17.Однако более принята сокращенная запись: N14(α, p)O17. Например, выражение Na23(d, p)Na24 описывает ядерную реакцию изотопа Na23 с дейтроном, в результате которой образуется Na24 — другой изотоп натрия — и выделяется протон. Другой пример Fe54(d, n)Co55 — пример еще одной реакции с дейтроном, вторичной частицей, в которой является медленный нейтрон. С помощью реакций под действием медленных нейтронов получены многие радиоактивные изотопы, широко применяющиеся в науке и промышленности: так, по реакциям нейтрон — протон (n, p) и нейтрон — альфа-частица (n, α) удается получить изотопы углерода C14, серы S35, фосфора P32, железа Fe59 и другие. Радиоизотопы очень многих химических элементов стали доступны человеку именно благодаря реакциям с медленными нейтронами. Но стоит перейти к тяжелым элементам — торию, урану и трансурановым элементам, как ядерная реакция приобретает иной характер. Ядро тяжелых элементов раскалывается на два осколка, которые могут быть равными или разными по величине. Среди этих осколков обнаруживают изотопы элементов середины периодической системы — иттрия, стронция, циркония, церия, бария, лантана и цезия, а также многих других. Например, при делении урана медленными нейтронами образуются изотопы химических элементов от цинка (порядковый номер 30) до гадолиния (порядковый номер 64). На практике такая ядерная реакция осуществляется в ядерном реакторе. А если энергия бомбардирующих частиц превышает 50 мегаэлектроновольт, если она достигает значений в сотни и тысячи мегаэлектроновольт? Как в классической химии при очень высоких температурах и давлениях становятся возможными многие процессы, не происходящие в нормальных условиях, так и в ядерной химии высоких энергий наблюдаются весьма своеобразные явления. Взаимодействие частиц высоких энергий с атомными ядрами приводит их к расщеплению. Этот процесс не надо путать с обычным делением на два осколка. При расщеплении ядер из них вылетает большое количество ядерных частиц и образуются разнообразные новые ядра. Например, если облучать элемент гафний протонами с энергией 660 мегаэлектроновольт, то образуется много изотопов предыдущих элементов, вплоть до изотопа церия, отстоящего от гафния на 14 порядковых номеров. Если такими же протонами бомбардировать уран, то получаются изотопы 16 химических элементов, при более высоких энергиях — большие количества. — Вот вкратце я и рассказал, как получают радиоактивные изотопы. — По-моему, кое-что нужно добавить! — вступил я в беседу. — Илья упомянул о ядерных реакциях в природе. Их только совсем недавно начали по-настоящему изучать. Они весьма разнообразны. Распад естественных радиоактивных элементов — примеры ядерных реакций в земной коре. При этом могут испускаться различные частицы, которые, в свою очередь, вступают в ядерные реакции с разными элементами. Наконец, космические лучи! Ведь составляющие их частицы обладают огромной энергией… — Но здесь есть и другая сторона, — перебил меня Илья. — Ведь изучая ядерные реакции в земной коре, изучая процессы, протекающие в звездах, человек тем самым выясняет пути, которые привели к образованию химических элементов. Одним словом, приближается к решению проблемы происхождения элементов. На этот счет существует немало гипотез, и многие из них сводятся к тому, что химические элементы последовательно образуются на разных стадиях развития звезд. Раньше можно было лишь строить теоретические догадки, а сейчас ученые практически исследуют различные ядерные реакции. — Но ведь это крайне сложно. И очень интересно! — воскликнула Майка. — Разумеется. Что следует выяснить? Какие ядерные реакции с наибольшей вероятностью приводят к образованию того или иного изотопа. Известно, что химические элементы содержатся во вселенной в различных количествах. Более того, изотопы одного и того же элемента имеют различную распространенность. Можно построить кривую распространенности всех изотопов. Пока существующие теории происхождения элементов объясняют лишь отдельные участки кривой. А надо объяснить весь ее ход! Вот, друзья филологи, где чудесная тема для научной фантастики. Да что фантастики! Возьмите, например, тот же уран и как следует напишите его биографию. Целая поэма получится… Ей-богу, хорошая мысль! Мечта о превращении элементов! Она владела человеком с глубокой древности. В средние века алхимики пытались превратить в золото неблагородные металлы. А теперь получить один элемент из другого не составляет труда… Напишите об этом. Честное слово, если у вас когда-нибудь возникнет такое желание, я поверю, что наши беседы в этой заброшенной избушке не пропали даром. — А сейчас не веришь? — укоризненно спросила Наташа. Но монолог Ильи не так-то просто было прервать. — Посудите сами, человек искусственно получил десять элементов тяжелее урана, трансурановых элементов, которых фактически нет в земной коре. Более того, многие из них играют роль отнюдь не меньшую, чем большинство обычных, классических элементов. Ладно уж! Чай готов. Считайте, что я справился с двойной нагрузкой: обеспечил пищу духовную и телесную… Темнело рано. К половине четвертого вечные сумерки в нашей избушке незаметно сменялись темнотой, и лишь чуть светлым пятном выделялось маленькое оконце, от которого то и дело приходилось отгребать снег. Правда, на какое-то время стихла пурга, и мы все выскочили из помещения, пристально вглядываясь, искали просвета в облаках, но тщетно. Густой серой пеленой были окутаны горы. Эта пелена, казалось, ползла вниз. Снова завыл ветер, и рассудительный Сергей сказал, что, по его мнению, завтра придется позаботиться о дровах, так как их осталось совсем мало. — В атомный век зависеть от самой обычной печки! — возмутился Алеша. — Строить кибернетические машины и думать о каких-то поленьях! Он был явно не в духе. Наши рассказы на время увлекли его, но потом он заскучал: — Удивительно вы черствый народ, химики-физики! Всё атомы да изотопы. Хоть бы кто из вас о стихах заговорил. Ваши споры, может, и интересно слушать, только романтика где? Трогают ум, но не волнуют сердца. Чувствуя, что Илья готовит нелицеприятный ответ, я вмешался: — По-моему, в науке не меньше поэзии, чем где-либо! Я не буду с тобой спорить, что важней: физика или лирика. Плох физик, которого не трогает поэзия, но, прости меня, Алексей, тебе следовало хотя бы немного заинтересоваться естественными науками. Так, для общего образования. — А то уж ты слишком однобок! — взорвался Илья. — Витаешь в эмпиреях… Майка прекратила спор. Она сказала, обратившись к Алеше: — Если тебе не интересно, не слушай! В таком положении Алексей всегда пасовал. И на сей раз он махнул рукой и обиженно уселся на нары. — Свечку будем зажигать? — спросил Сергей. — Будем, будем! — ответил Илья. — Кое-что придется изображать… Доска есть! — он подтянул кусок фанеры. — Грифель тоже есть! — отгреб горсть угольков. — Итак, если мне не изменяет память, мы остановились на искусственном получении элементов… — Да! — подтвердила Наташа. — На трансурановых элементах… — Нет, погоди! О них позже. Есть четыре очень своеобразных элемента в середине периодической системы. Прошу внимания! К 1869 году, году открытия периодического закона, наука знала 63 химических элемента. За пятьдесят с небольшим лет после этой даты было открыто еще двадцать пять. К концу 1925 года «здание» таблицы элементов почти заполнилось; в нем осталось лишь четыре незанятых «квартиры», жильцы которых никак не хотели получить ордер на въезд. Это были элементы с порядковыми номерами 43, 61, 85 и 87. Ученые разных стран предпринимали множество попыток обнаружить неизвестные элементы в природе. Но шли годы, объявленные открытия не подтверждались, и четыре клетки периодической таблицы продолжали пустовать. Куда же делись неуловимые элементы? Цифры 43, 61, 85, 87 приобретали ореол таинственности. Хорошо, рассуждали ученые, элементы № 85 и № 87 находятся в конце периодической системы. Самые тяжелые элементы неустойчивы. Примером тому сильная радиоактивность урана, протактиния, тория, радия, радона. Логично допустить, что № 85 и № 87 имели малые периоды полураспада и за время существования Земли успели нацело распасться, превратиться в соседние элементы периодической таблицы. С такими доводами легко можно было согласиться. Ну, а как быть с № 43 и № 61? Они расположены в середине системы, весьма далеко от ее неустойчивого конца. Почему же их до сих пор не удалось обнаружить в природе? Теоретические объяснения здесь заходили в тупик. — Позвольте, — говорили одни исследователи, — ведь нельзя забывать, что среди элементов середины периодической системы встречаются и радиоактивные. К ним относятся калий, рубидий, индий, лантан, самарий, лютеций, рений. Нельзя ли считать, что сорок третий и шестьдесят первый элементы когда-то существовали в природе, но, будучи сильно радиоактивными, давно исчезли с Земли? — Ваши предположения несостоятельны! — возражали им другие. — У перечисленных элементов неустойчивыми являются лишь отдельные изотопы. Наряду с ними существует много стабильных изотопов. Обратите также внимание на их периоды полураспада: они настолько велики, что зачастую бывает трудно обнаружить сам факт естественной радиоактивности. В самом деле, у индия 115 он равен 6·1014 лет, а у калия 40 — 1,32·109 лет. Рассудить этот спор удалось физикам-теоретикам, когда были открыты так называемые изобары. Слово «изотопы» в переводе с греческого означает «одинаковоместные», «занимающие одно место». Слово же «изобары» переводится как «одинаковотяжелые». Короче говоря, изобарами называют два изотопа, имеющие одинаковое массовое число, но разные заряды ядер. Так, калий 40 и аргон 40 представляют пару изобаров. Теперь известно, что в природе их насчитывается много. Используя это явление, физики-теоретики установили очень важную закономерность. Оказалось, что если два изотопа соседних элементов являются изобарами, изотоп элемента с нечетным зарядом ядра оказывается неустойчивым. Исключения очень редки. Так, в паре аргон 40 — калий 40 обладающий нечетным зарядом ядра изотоп калия радиоактивен. Применим эту закономерность к элементам № 43 и № 61. Из периодической системы видно, что № 43 расположен между молибденом и рутением. Эти элементы имеют четный заряд ядра и образуют много устойчивых изотопов с массовыми числами 94–102. Ясно, что ни один из изотопов элемента № 43, возможные массовые числа которых должны находиться в указанном интервале, не будет устойчивым. Также объясняется и отсутствие стабильных изотопов у элемента № 61, расположенного между неодимом (№ 60) и самарием (№ 62). Таким образом, картина прояснилась. Сорок третий и шестьдесят первый элементы, безусловно, многие миллионы лет назад существовали в природе, но, имея сравнительно короткие периоды полураспада, не сумели «дожить» до нашего времени. Они разделили судьбу неустойчивого восемьдесят пятого и восемьдесят седьмого элементов. Только благодаря ядерным реакциям могут быть получены эти элементы. В 1937 году ученые обнаружили, что при бомбардировке неодима дейтронами (ядрами тяжелого водорода) образуются различные изотопы элемента № 61. А девять лет спустя он был выделен химическими методами из осколков деления урана в ядерном реакторе. Его изотоп с массовым числом 147 имел период полураспада около 3,7 года. Американские ученые Маринский и Гленденин, авторы открытия, дали элементу название «прометий» (символ Pm) в честь героя древнегреческой мифологии Прометея. Прометей, рассказывает легенда, похитил с неба огонь и передал его людям. За это боги жестоко покарали смельчака: они приковали его к скале и каждый день посылали стервятника терзать прикованного. Авторы открытия писали: «Это название не только символизирует драматический путь получения нового элемента в заметных количествах в результате овладения людьми энергией ядерного деления, но и предостерегает людей о грозящей опасности наказания стервятником войны».
 Это высказывание в равной мере можно применить ко всем искусственно полученным новым элементам.
Элемент № 43 был синтезирован в 1937 году итальянскими физиками Сегре и Перье, которые мишень из молибдена бомбардировали дейтронами.
Известно много других путей синтеза изотопов элемента № 43: облучение ниобия альфа-частицами, рутения — нейтронами и так далее. Однако основным источником получения элемента № 43, так же как № 61, оказывается его образование в ядерных реакторах. Оба они выделяются из осколков деления урана.
В знак того, что № 43 был первым искусственно полученным новым элементом, он получил название «технеций» (Tc) — от греческого слова «техникос» — «искусственный».
Восемьдесят пятый и восемьдесят седьмой элементы также были получены с помощью ядерных реакций.
Восемьдесят пятый родился в 1940 году, когда Сегре с сотрудниками облучали висмут ускоренными альфа-частицами. Так как полученные изотопы нового элемента оказались весьма короткоживущими, он получил название «астатина» (At) — от греческого слова, обозначающего «неустойчивый».
Последний из «таинственной четверки», восемьдесят седьмой элемент, удалось-таки обнаружить в природе. Его назвали францием.
— Между прочим, — добавил я, — в очень малых концентрациях в природных материалах был обнаружен астатин. Как и франций, он продукт последовательного радиоактивного распада урана и тория. В ходе естественных превращений этих элементов образуется много радиоактивных изотопов, пока, наконец, не возникнут стабильные изотопы свинца. Стало быть, астатин и франций являются членами радиоактивных семейств. Таких семейств ранее было известно три: урана 235, урана 238 и тория 232. Теперь к ним прибавилось еще одно: нептуния 237 — первого трансуранового элемента.
— А есть ли надежда, что прометий и технеций также будут найдены в земной коре? — спросила Наташа.
— Что касается прометия, то безусловно, — ответил Илья. — Доказано, что в ничтожных количествах он должен присутствовать в минералах. Теперь дело за химиками, надо суметь его выделить. С технецием дело сложнее. А знаете, что интересно? Технеций обнаружен в спектрах атмосферы Солнца и некоторых звезд.
Это высказывание в равной мере можно применить ко всем искусственно полученным новым элементам.
Элемент № 43 был синтезирован в 1937 году итальянскими физиками Сегре и Перье, которые мишень из молибдена бомбардировали дейтронами.
Известно много других путей синтеза изотопов элемента № 43: облучение ниобия альфа-частицами, рутения — нейтронами и так далее. Однако основным источником получения элемента № 43, так же как № 61, оказывается его образование в ядерных реакторах. Оба они выделяются из осколков деления урана.
В знак того, что № 43 был первым искусственно полученным новым элементом, он получил название «технеций» (Tc) — от греческого слова «техникос» — «искусственный».
Восемьдесят пятый и восемьдесят седьмой элементы также были получены с помощью ядерных реакций.
Восемьдесят пятый родился в 1940 году, когда Сегре с сотрудниками облучали висмут ускоренными альфа-частицами. Так как полученные изотопы нового элемента оказались весьма короткоживущими, он получил название «астатина» (At) — от греческого слова, обозначающего «неустойчивый».
Последний из «таинственной четверки», восемьдесят седьмой элемент, удалось-таки обнаружить в природе. Его назвали францием.
— Между прочим, — добавил я, — в очень малых концентрациях в природных материалах был обнаружен астатин. Как и франций, он продукт последовательного радиоактивного распада урана и тория. В ходе естественных превращений этих элементов образуется много радиоактивных изотопов, пока, наконец, не возникнут стабильные изотопы свинца. Стало быть, астатин и франций являются членами радиоактивных семейств. Таких семейств ранее было известно три: урана 235, урана 238 и тория 232. Теперь к ним прибавилось еще одно: нептуния 237 — первого трансуранового элемента.
— А есть ли надежда, что прометий и технеций также будут найдены в земной коре? — спросила Наташа.
— Что касается прометия, то безусловно, — ответил Илья. — Доказано, что в ничтожных количествах он должен присутствовать в минералах. Теперь дело за химиками, надо суметь его выделить. С технецием дело сложнее. А знаете, что интересно? Технеций обнаружен в спектрах атмосферы Солнца и некоторых звезд.

 — Я где-то читал, — прервал его Олег, — что гелий тоже сперва нашли на Солнце, а потом уже на Земле…
— Аналогия не совсем удачна, — сказал я. — Ведь гелий непрерывно образуется на Земле при альфа-распаде урана, тория и других радиоактивных элементов. Земной же технеций давно распался. Однако то, что он обнаружен на некоторых звездах, интересно с другой стороны. Видимо, в них все время протекает процесс образования химических элементов… Собственно, об этом уже говорил Илья.
Вдруг издалека донесся глухой шум. Он нарастал, и уже не слышно было воя пурги. Мы замолчали, прислушиваясь к непонятному грохоту. Стало тревожно на душе, как перед неясной опасностью.
— Лавина! — закричал Сергей и рывком распахнул дверь.
Снежная крупа посыпалась на пол. Лавина в горах!
Мы выскочили из избушки. Эта лавина была не страшна нам. Видимо, она сошла с крутого склона пика справа от перевала. А наше «зимовье» находилось на левой стороне.
— До нас не дойдет, — успокоил всех Олег, но все-таки мы стояли на ветру, вглядываясь в ночную мглу. Те, кому довелось не раз побывать в горах, знают, что такое снежная лавина.
Шум вскоре затих, растворившись в завывании ветра.
— Не приведи бог оказаться под таким склоном! — в сердцах сказал Алеша. — Вот вам пример одной из стихий, которую еще не укротил человек.
— Укротит! — уверенно заявил Илья. — Укротить реакцию деления урана было труднее. Сделать управляемой цепную реакцию. Та же лавина, и куда страшнее. Вспомнить только Хиросиму и Нагасаки!
— Наверное, — размечталась вдруг Наташа, — человек с помощью атомной энергии когда-нибудь в корне изменит климат Земли.
— Безусловно! Но, пока он еще не изменил, айда в избу! Опасность миновала, нечего попусту мерзнуть!
Уютно потрескивала печка. Обжитой казалась маленькая избушка, словно поселились мы в ней давно-давно, а не каких-то три дня назад.
— Послушай, Анатолий! — обратилась ко мне Майка. — Как по-твоему, кого из ученых нужно считать главным… то есть, представь себе, что когда-нибудь поставят памятник тем людям, кто сумел овладеть атомной энергией. Чье имя первым будет высечено на нем?
Я пожал плечами. Их было много — преданных и беззаветных тружеников, следопытов атомных дорог.
— Я бы поставил на первое место Ферми, великого итальянского физика Энрико Ферми! — не вытерпел Илья.
— Это его книжка «Атомы у нас дома»? — спросил Алеша.
Мы с Ильей посмотрели друг на друга и дружно расхохотались.
— Ты, как всегда, — пальцем в небо! — давился от смеха Илья. — Это книга вдовы ученого, Лауры Ферми. Почитай, между прочим, интересно…
На сей раз Алеша действительно чувствовал себя смущенно. Но Илья уже говорил серьезно:
— Ферми первым облучал уран нейтронами. Впоследствии он доказал, что при делении урана всегда образуется два-три свободных нейтрона. Следовательно, наметился путь к осуществлению цепной реакции. Наконец, он принимал основное участие в создании первого ядерного реактора. Его биография — это биография ученого и борца. Не желая работать на итальянских фашистов, он в 1938 году эмигрировал из Италии в США. Ему нужно было бы поставить отдельный памятник.
Илья замолчал. Свечка уже сгорела до половины.
— Я где-то читал, — прервал его Олег, — что гелий тоже сперва нашли на Солнце, а потом уже на Земле…
— Аналогия не совсем удачна, — сказал я. — Ведь гелий непрерывно образуется на Земле при альфа-распаде урана, тория и других радиоактивных элементов. Земной же технеций давно распался. Однако то, что он обнаружен на некоторых звездах, интересно с другой стороны. Видимо, в них все время протекает процесс образования химических элементов… Собственно, об этом уже говорил Илья.
Вдруг издалека донесся глухой шум. Он нарастал, и уже не слышно было воя пурги. Мы замолчали, прислушиваясь к непонятному грохоту. Стало тревожно на душе, как перед неясной опасностью.
— Лавина! — закричал Сергей и рывком распахнул дверь.
Снежная крупа посыпалась на пол. Лавина в горах!
Мы выскочили из избушки. Эта лавина была не страшна нам. Видимо, она сошла с крутого склона пика справа от перевала. А наше «зимовье» находилось на левой стороне.
— До нас не дойдет, — успокоил всех Олег, но все-таки мы стояли на ветру, вглядываясь в ночную мглу. Те, кому довелось не раз побывать в горах, знают, что такое снежная лавина.
Шум вскоре затих, растворившись в завывании ветра.
— Не приведи бог оказаться под таким склоном! — в сердцах сказал Алеша. — Вот вам пример одной из стихий, которую еще не укротил человек.
— Укротит! — уверенно заявил Илья. — Укротить реакцию деления урана было труднее. Сделать управляемой цепную реакцию. Та же лавина, и куда страшнее. Вспомнить только Хиросиму и Нагасаки!
— Наверное, — размечталась вдруг Наташа, — человек с помощью атомной энергии когда-нибудь в корне изменит климат Земли.
— Безусловно! Но, пока он еще не изменил, айда в избу! Опасность миновала, нечего попусту мерзнуть!
Уютно потрескивала печка. Обжитой казалась маленькая избушка, словно поселились мы в ней давно-давно, а не каких-то три дня назад.
— Послушай, Анатолий! — обратилась ко мне Майка. — Как по-твоему, кого из ученых нужно считать главным… то есть, представь себе, что когда-нибудь поставят памятник тем людям, кто сумел овладеть атомной энергией. Чье имя первым будет высечено на нем?
Я пожал плечами. Их было много — преданных и беззаветных тружеников, следопытов атомных дорог.
— Я бы поставил на первое место Ферми, великого итальянского физика Энрико Ферми! — не вытерпел Илья.
— Это его книжка «Атомы у нас дома»? — спросил Алеша.
Мы с Ильей посмотрели друг на друга и дружно расхохотались.
— Ты, как всегда, — пальцем в небо! — давился от смеха Илья. — Это книга вдовы ученого, Лауры Ферми. Почитай, между прочим, интересно…
На сей раз Алеша действительно чувствовал себя смущенно. Но Илья уже говорил серьезно:
— Ферми первым облучал уран нейтронами. Впоследствии он доказал, что при делении урана всегда образуется два-три свободных нейтрона. Следовательно, наметился путь к осуществлению цепной реакции. Наконец, он принимал основное участие в создании первого ядерного реактора. Его биография — это биография ученого и борца. Не желая работать на итальянских фашистов, он в 1938 году эмигрировал из Италии в США. Ему нужно было бы поставить отдельный памятник.
Илья замолчал. Свечка уже сгорела до половины.
Трансурановые элементы
— Ну что? — поинтересовался я. — Будем продолжать? Я расскажу, ребята, о трансурановых элементах. В конце тридцатых годов таблица Менделеева заканчивалась на уране. Почему так? И вообще могут ли быть элементы тяжелее урана? Вопрос имеет долгую историю. Уран, девяносто второй элемент, был рожден трижды. Еще в 1789 году немецкий химик Мартин Клапрот провозгласил открытие нового элемента и дал ему название «уран» в честь одноименной планеты солнечной системы. Спустя 52 года француз Пелиго доказал, что за уран ошибочно приняли его окисел, и выделил элемент в металлическом состоянии. Третьим «крестным отцом» урана стал Д. И. Менделеев, который изменил неправильный атомный вес элемента и поместил его в VI группу периодической системы, а не в III, куда уран должен был бы попасть соответственно прежнему атомному весу. Так уран оказался последним (и самым тяжелым) элементом периодической таблицы. Тогда и возник вопрос: есть ли элементы тяжелее урана? Многие ученые пытались на него ответить. Периодическая система подсказывала путь к поискам в природе заурановых элементов. Первый из них должен располагаться в VII группе, и его, видимо, следовало искать в марганцевых рудах. Второй мог быть обнаружен среди благородных металлов VIII группы. Сам Менделеев писал о возможности существования по крайней мере пяти заурановых элементов. Открытие радиоактивных превращений элементов конца периодической системы, казалось, дало ответ на вопрос о существовании элементов с бóльшим атомным весом, чем у урана. Безусловно, рассуждали ученые, когда-то в земле существовали элементы тяжелее урана. Однако, будучи радиоактивными, они практически нацело распались на протяжении предшествующих геологических эпох. А если и сохранились в земной коре, то в столь ничтожных концентрациях, что никакие современные химические и физические методы не могут выделить их и отличить от других элементов. Тем не менее поиски следов трансурановых элементов в природе, хотя и безуспешно, продолжались. Окончательно решила проблему трансурановых элементов ядерная физика. Большую роль сыграло открытие английским ученым Чедвиком нейтрона. Это случилось в 1932 году — дата, которая навсегда будет запечатлена в истории радиоактивных изотопов. Располагая нейтроном, ученые повели яростный штурм атомного ядра. Среди всех химических элементов не оказалось, пожалуй, ни одного, который не подвергся бы нейтронной бомбардировке. Не избежал этой участи и уран. И вот в 1934 году Энрико Ферми сообщил о поразительных результатах. Он бомбардировал уран медленными нейтронами. Продукты, полученные в результате этого эксперимента, были изучены химическими методами. Выяснилось, что среди них нет ни одного, похожего по своим химическим свойствам на элементы между свинцом (порядковый номер 82) и ураном. Вывод напрашивался сам собой: продукты бомбардировки суть трансурановые элементы. Но первые обнадеживающие результаты нуждались еще в проверке и новых доказательствах. Десятки ученых разных стран включились в эту работу. Среди них были француз Жолио-Кюри и серб Савич, немцы Хан, Мейтнер, Штрассманн и другие — словом, все звезды ядерной физики занялись проверкой результатов Ферми. Новые открытия не заставили себя ждать. Изучая продукты бомбардировки урана, ученые обнаружили интересный факт. Некоторые радиоактивные изотопы возникали не в момент нейтронной бомбардировки, а позднее. Следовательно, здесь происходил радиоактивный распад, в результате которого образуется новое вещество. Предположим, что ядро изотопа урана U238 присоединило к себе нейтрон, то есть произошла ядерная реакция:
92U238 + 0n1→92U239.Получился изотоп урана U239. Этот изотоп также радиоактивен и, выбрасывая бета-частицу, превращается в изотоп элемента 93, поскольку при бета-распаде заряд ядра увеличивается на единицу. Такое объяснение казалось весьма логичным. Ученые составили даже последовательную цепь образования трансурановых элементов вплоть до элемента № 97. На основании периодической системы можно было предположить, что трансурановые элементы являются химическими аналогами соответствующих элементов шестого периода менделеевской таблицы: 93 — аналогом рения, 94 — аналогом осмия и так далее. Оставалось химически выделить и изучить эти элементы, и периодическая система расширила бы свои рамки. Однако выделение оказалось отнюдь не простой задачей и привело к таким неожиданностям, которые как будто перечеркивали результаты предыдущих опытов. В 1938 году Фредерик Жолио-Кюри и Савич пытались извлечь из продуктов бомбардировки урана трансурановые элементы, но… (известное скептическое «но», которое столько раз ставило под сомнение даже самые выдающиеся открытия человечества и так часто знаменовало начало нового, высшего этапа исследований!), но они обнаружили элемент, который по свойствам очень напомнил редкоземельные. А годом позже Хан и Штрассманн определили в облученном уране барий и лантан — элементы середины периодической системы. Это казалось бессмыслицей: искали элементы тяжелее урана, а нашли куда более легкие, отстоящие от урана очень далеко. Как объяснить подобное явление? Неужели нужно признать выводы Ферми и других целиком и полностью ошибочными? Откуда взяться в облученном уране лантану и барию? Ведь для опытов брался чистейший уран. Значит, они образовались в процессе бомбардировки. Вероятнее всего, нейтрон, попадая в ядро урана, как бы раскалывает его на две приблизительно равные части, на два «осколка», каковыми и являются лантан и барий. Так рассуждали Мейтнер и Фриш, впервые предположившие возможность деления урана. Это явление легло в основу последующих блестящих открытий, приведших к овладению энергией атома. Как настоящий докладчик, я попросил воды. Наташа, тихо ступая по расшатанным половицам, зачерпнула из ведра кружку мутной жижи. Я сделал глоток и поморщился. Илья последовал моему примеру. — Упрек вчерашним дежурным — плохо ведро вымыли. Не разберешь, вода или нет… Идея! — хохотнул он. — Вот, Толя, чудесный прием популяризации! Ты можешь сравнить положение в ядерной физике после первых работ по получению трансуранов с подобной мутной водицей, где что-то непонятное плавает. — Ты вульгаризатор! — рассердилась Майка. — Очень уж ты непоэтичный человек, Илья. — Ну, будет, — махнул я рукой. — Пошли дальше. Итак, при бомбардировке урана медленными нейтронами никакие трансурановые элементы не образуются, а все «загадочные» продукты — осколки деления, элементы середины периодической системы. Но можно ли считать окончательным этот вывод. Первое веское «нет» сказали советские ученые. Академик В. Г. Хлопин и его сотрудники привели несколько весьма убедительных доказательств в пользу того, что наряду с осколками деления должны получаться (правда, в весьма небольших количествах) трансурановые элементы. Значит, все заключается в совершенствовании методов выделения продуктов бомбардировки. Химия ядерная ставила перед химией классической, химией электронных оболочек, интересную и трудную задачу: выделить следы новых элементов и изучить их химические и физические свойства. И вот, наконец, наступил момент, когда можно было с уверенностью заявить об открытии первого трансуранового элемента. Эта честь принадлежит американским ученым Макмиллану и Эйбельсону. Ход их рассуждений таков: когда нейтроны попадают в ядра урана, образуются осколки, которые благодаря значительной кинетической энергии разлетаются из исходных ядер на относительно большие расстояния. Но часть ядер урана, поглотивших нейтроны, не делится и в отличие от осколков как бы остается на месте. Если отделить осколочные ядра от неразделившихся, среди последних можно с большой вероятностью обнаружить изотопы трансурановых элементов. Действительно, в 1940 году Макмиллану и Эйбельсону удалось подтвердить образование изотопа элемента 93 среди неразделившихся ядер урана. Вот она, эта ядерная реакция. Она послужила началом блестящих исследований, приведших в итоге к получению десятков радиоактивных изотопов трансурановых элементов:
92U238 + 0n1→92U239.Получается радиоизотоп урана с периодом полураспада 23 минуты. Он и превращается в ядро элемента с зарядом 93: 92U239 – β→93U239. Элемент 93 получил название «нептуний» (символ Np) в честь планеты Нептун, расположенной в солнечной системе за Ураном. В том же году был синтезирован следующий трансурановый элемент, плутоний (Pu). Роль бомбардирующих частиц в данном случае играли дейтроны, мишенью служил уран 238. Авторами открытия явилась группа американских ученых, возглавляемая будущим нобелевским лауреатом Гленном Сиборгом. Год спустя был получен другой изотоп плутония — Pu239, который вскоре приковал к себе внимание не одних только физиков-теоретиков. Оказалось, что плутоний 239 способен делиться, подобно урану, под действием медленных нейтронов, с выделением огромного количества энергии. В руках человечества оказалась перспектива использования нового ядерного горючего наряду с ураном. Так как в те суровые военные годы в США интенсивно разрабатывалась проблема атомной бомбы, то на решение задачи получения плутония в значительных количествах были брошены большие силы и средства. В Чикаго уже в 1942 году вступил в действие ядерный реактор. В нем уран 238 облучали нейтронами. В результате последующей цепочки радиоактивных превращений образовался Pu239. К этому времени свойства плутония и нептуния были изучены уже очень хорошо. Эта задача была бы непосильной для старой химии, привыкшей оперировать с относительно большими количествами вещества. Но нужно пояснить, что следует понимать под «большими количествами». Перенесемся к началу XX века, ко времени открытия первых радиоактивных элементов. Как много сил и труда вложили супруги Кюри, чтобы из тонн руды получить препарат радия весом в 0,1 грамма и, работая с этим мизерным количеством, изучить его свойства! Для тех времен это было действительно случаем беспрецедентным, настоящим подвигом ума, таланта и воли. Но дайте такое количество какого-нибудь трансуранового элемента современному химику и попросите его изучить свойства элемента. Не сомневайтесь, химик придет в восторг. Еще бы! Держать в руках целую десятую часть грамма вещества, да ведь это же громадное количество! С ним можно быстро и просто определить любые свойства. Видите, как меняются времена! Пионерам изучения нептуния и плутония пришлось работать с такими количествами препаратов, перед которыми оказались бы бессильными фантастическое трудолюбие и неистощимая энергия супругов Кюри! Знаете ли вы, что такое микрограмм? Это одна миллионная часть грамма, или 10–6 грамма, — величина, в сто тысяч раз меньшая, чем одна десятая грамма. Вот краткая справка: первое чистое соединение плутония весило 2,77 микрограмма, а нептуния — чуть больше, 10 микрограммов. Изволь с таким количеством изучать свойства первых трансурановых элементов! Но химики решили и эту задачу. Была разработана и сконструирована специальная ультрамикрохимическая аппаратура. Вместо обычных пробирок применили так называемые микроконусы — буквально микроскопические пробирки, по форме напоминавшие конус. Были сконструированы весы, на которых оказалось возможным взвешивать почти невесомые количества — до 10–9 грамма. Так были исследованы свойства нептуния и плутония, причем плутоний получил настолько детальную характеристику, что на основании этих данных удалось спроектировать большой завод для получения элемента. В наши дни свойства первых трансурановых элементов изучены так хорошо, как свойства немногих из встречающихся в природе элементов. К 1957 году было получено 15 радиоизотопов плутония и 11 нептуния. Эти успехи возродили прежние попытки обнаружить трансурановые элементы в природе. Различные урановые руды исследовались на содержание в них нептуния и плутония.
 Ученым удалось показать, что первые трансурановые элементы действительно встречаются в природе в исключительно малых концентрациях. Так, отношение плутония к урану составляет 1:1014, а нептуния к урану1:1012. Интересно, что периоды полураспада природных изотопов нептуния и плутония невелики по сравнению со временем существования Земли. Вероятно, эти изотопы постоянно образуются из урана путем захвата последним нейтронов.
В конце 1944 года группа Сиборга заявила об открытии очередных трансурановых элементов — № 95 и № 96. Первый получил имя «америций» (Am) в честь Америки. Кюрием (Cm), в честь Пьера и Марии Кюри, был назван девяносто шестой элемент.
Спустя несколько лет список трансурановых элементов пополнился двумя новыми членами. На сей раз в качестве бомбардирующих частиц выступали не нейтроны, а ядра атомов гелия — альфа-частицы. Эти «снаряды» ускорялись до высоких скоростей в мощном циклотроне. «Мишенями» служили два изотопа трансурановых элементов америция и кюрия — Am241 и Cm242. Вновь полученные элементы № 97 и № 98 были названы «берклием» (Bk) и «калифорнием» (Cf) в честь их «места рождения» — города Беркли и штата Калифорния.
Таким образом, к началу второй половины XX столетия периодическая система Д. И. Менделеева расширила свои рамки на целых шесть новых элементов тяжелее урана.
Очередные трансурановые элементы № 99 и № 100 имели несколько своеобразную историю получения.
В ноябре 1952 года США проводили испытания водородной бомбы на одном из атоллов Тихого океана. Исследовали продукты распада вследствие термоядерного взрыва. Отбирали пробы атмосферных осадков на соседних атоллах. На бумажных фильтрах были собраны частицы, содержащиеся в облаке взрыва.
Первые анализы показали, что в исследуемых материалах содержатся тяжелые изотопы плутония и других трансурановых элементов, вплоть до калифорния.
Ученые насторожились: быть может, в продуктах взрыва есть и следующие трансурановые элементы?
На атоллах вблизи места взрыва отобрали несколько десятков килограммов коралловых отложений. В секретных информациях этот материал носил условное название «Paydrit», что означает «дорогостоящая грязь».
И материал оправдал свое название. В нем действительно обнаружили новые трансурановые элементы с порядковыми номерами 99 и 100.
Несколько позже эти элементы были получены в лаборатории. Процесс их синтеза тоже несколько необычен. «Мишенью» служил уран. Бомбардирующими «снарядами» — ионы азота и кислорода, которые разгонялись до больших энергий на ускорителях. Столь тяжелые «снаряды» также могут применяться в синтезе новых элементов.
Элементы были названы соответственно «эйнштейнием» и «фермием».
В результате тщательных и тончайших экспериментов был синтезирован элемент № 101. Ученые дали ему имя «менделеевий» (Md) в честь великого русского химика Дмитрия Ивановича Менделеева, создателя периодической системы.
Только семнадцать атомов менделеевия удалось получить в результате этих опытов!
Недавно появились сообщения о синтезе сто второго элемента. Окончательно он получил название «нобелий».
— Есть ли предел синтеза новых элементов? — спросил Олег.
— И не так уж он далек! — ответил Илья. — Существует процесс, который называется спонтанным, или самопроизвольным делением ядра. Этот процесс впервые обнаружили в 1940 году советские ученые Флеров и Петржак у ядер урана. При спонтанном делении ядро самопроизвольно раскалывается на две части. Когда были получены трансурановые элементы, выяснилось, что для многих их изотопов характерно спонтанное деление. И чем выше заряд ядра, тем больше вероятность процесса, тем короче период его полураспада: ведь самопроизвольное деление в конечном итоге — один из видов радиоактивного распада. Ученые подсчитали, что для элементов с зарядом ядра 108–110 эта величина составит миллионную долю секунды. Они будут гибнуть, едва лишь появившись на свет.
…Кончался очередной день нашего «зимовья». Клонило ко сну. Я закрывал глаза, и тотчас приглушенней становились голоса ребят.
Обрывки мыслей проносились в голове. И мне становилось радостно за друзей, за тех, с кем пришлось отшагать по свету многие сотни верст, за тех, кто не терялся перед трудностями, а побеждал их. Разве наши необычные в такой обстановке разговоры, в удаленной избушке, где-то за тридевять земель от залитой светом Москвы, не говорили о том, что у нас еще очень молодые души и больше всего на свете мы любим мечтать? И мне захотелось сочинить стихи, хотя ни разу в жизни ничего путного не вышло из-под моего пера. Наташа словно прочла мои мысли.
— Давайте споем что-нибудь тихо-тихо, — услышал я ее голос. Алеша кашлянул в углу.
— Подождите минутку. Вот мы говорили, что надо поставить памятник тем, кто победил атом. Какой памятник? Простой монумент, глыбу мрамора? Мне думается, надо что-нибудь величественное. Вот, например, памятник Ферми. Вы послушайте, я написал кое-что.
Оплывшая свечка еле светила дрожащим огоньком. Бегали по стенам серые тени, царапали стекло маленькие сухие снежинки. Алешка читал стихи:
Ученым удалось показать, что первые трансурановые элементы действительно встречаются в природе в исключительно малых концентрациях. Так, отношение плутония к урану составляет 1:1014, а нептуния к урану1:1012. Интересно, что периоды полураспада природных изотопов нептуния и плутония невелики по сравнению со временем существования Земли. Вероятно, эти изотопы постоянно образуются из урана путем захвата последним нейтронов.
В конце 1944 года группа Сиборга заявила об открытии очередных трансурановых элементов — № 95 и № 96. Первый получил имя «америций» (Am) в честь Америки. Кюрием (Cm), в честь Пьера и Марии Кюри, был назван девяносто шестой элемент.
Спустя несколько лет список трансурановых элементов пополнился двумя новыми членами. На сей раз в качестве бомбардирующих частиц выступали не нейтроны, а ядра атомов гелия — альфа-частицы. Эти «снаряды» ускорялись до высоких скоростей в мощном циклотроне. «Мишенями» служили два изотопа трансурановых элементов америция и кюрия — Am241 и Cm242. Вновь полученные элементы № 97 и № 98 были названы «берклием» (Bk) и «калифорнием» (Cf) в честь их «места рождения» — города Беркли и штата Калифорния.
Таким образом, к началу второй половины XX столетия периодическая система Д. И. Менделеева расширила свои рамки на целых шесть новых элементов тяжелее урана.
Очередные трансурановые элементы № 99 и № 100 имели несколько своеобразную историю получения.
В ноябре 1952 года США проводили испытания водородной бомбы на одном из атоллов Тихого океана. Исследовали продукты распада вследствие термоядерного взрыва. Отбирали пробы атмосферных осадков на соседних атоллах. На бумажных фильтрах были собраны частицы, содержащиеся в облаке взрыва.
Первые анализы показали, что в исследуемых материалах содержатся тяжелые изотопы плутония и других трансурановых элементов, вплоть до калифорния.
Ученые насторожились: быть может, в продуктах взрыва есть и следующие трансурановые элементы?
На атоллах вблизи места взрыва отобрали несколько десятков килограммов коралловых отложений. В секретных информациях этот материал носил условное название «Paydrit», что означает «дорогостоящая грязь».
И материал оправдал свое название. В нем действительно обнаружили новые трансурановые элементы с порядковыми номерами 99 и 100.
Несколько позже эти элементы были получены в лаборатории. Процесс их синтеза тоже несколько необычен. «Мишенью» служил уран. Бомбардирующими «снарядами» — ионы азота и кислорода, которые разгонялись до больших энергий на ускорителях. Столь тяжелые «снаряды» также могут применяться в синтезе новых элементов.
Элементы были названы соответственно «эйнштейнием» и «фермием».
В результате тщательных и тончайших экспериментов был синтезирован элемент № 101. Ученые дали ему имя «менделеевий» (Md) в честь великого русского химика Дмитрия Ивановича Менделеева, создателя периодической системы.
Только семнадцать атомов менделеевия удалось получить в результате этих опытов!
Недавно появились сообщения о синтезе сто второго элемента. Окончательно он получил название «нобелий».
— Есть ли предел синтеза новых элементов? — спросил Олег.
— И не так уж он далек! — ответил Илья. — Существует процесс, который называется спонтанным, или самопроизвольным делением ядра. Этот процесс впервые обнаружили в 1940 году советские ученые Флеров и Петржак у ядер урана. При спонтанном делении ядро самопроизвольно раскалывается на две части. Когда были получены трансурановые элементы, выяснилось, что для многих их изотопов характерно спонтанное деление. И чем выше заряд ядра, тем больше вероятность процесса, тем короче период его полураспада: ведь самопроизвольное деление в конечном итоге — один из видов радиоактивного распада. Ученые подсчитали, что для элементов с зарядом ядра 108–110 эта величина составит миллионную долю секунды. Они будут гибнуть, едва лишь появившись на свет.
…Кончался очередной день нашего «зимовья». Клонило ко сну. Я закрывал глаза, и тотчас приглушенней становились голоса ребят.
Обрывки мыслей проносились в голове. И мне становилось радостно за друзей, за тех, с кем пришлось отшагать по свету многие сотни верст, за тех, кто не терялся перед трудностями, а побеждал их. Разве наши необычные в такой обстановке разговоры, в удаленной избушке, где-то за тридевять земель от залитой светом Москвы, не говорили о том, что у нас еще очень молодые души и больше всего на свете мы любим мечтать? И мне захотелось сочинить стихи, хотя ни разу в жизни ничего путного не вышло из-под моего пера. Наташа словно прочла мои мысли.
— Давайте споем что-нибудь тихо-тихо, — услышал я ее голос. Алеша кашлянул в углу.
— Подождите минутку. Вот мы говорили, что надо поставить памятник тем, кто победил атом. Какой памятник? Простой монумент, глыбу мрамора? Мне думается, надо что-нибудь величественное. Вот, например, памятник Ферми. Вы послушайте, я написал кое-что.
Оплывшая свечка еле светила дрожащим огоньком. Бегали по стенам серые тени, царапали стекло маленькие сухие снежинки. Алешка читал стихи:
Маршрут третий

С утра заготовляем дрова, валим в снег неказистые сухие лиственницы и волочим их по склону к избушке. Здесь Олег с Алешей разделывают стволы на поленья.
Изотопы, кажется, прочно обосновались в избушке, потому что даже Алеша спросил, едва проснувшись, о чем мы с Ильей будем сегодня «докладывать». Олег вполне серьезно заявил:
— Вернусь в Москву, пороюсь в книгах. Как часто мы не обращаем внимания на множество любопытных вещей!
Олег был человек основательный: если начинал дело, то доводил его до конца. Илья даже сострил:
— На будущий год в роли рассказчика придется тебе выступать…
В печку до отказа заложены свежие сухие дрова. Мы заготовили их столько, что хватит еще на несколько дней. А уйдем завтра, останутся другим. Старинный таежный обычай: уходя из избушки, заготовь топливо для других.
И немногочисленная, но любознательная аудитория снова ждет, когда мы продолжим знакомить ее с изотопами.
Илья изложил свою программу:
— Хватит всяких теорий! Нажмем на практику. Одним словом, изотопы в жизни. В науке, в промышленности, в сельском хозяйстве.
Кстати, друзья мои, пока вы знаете только два искусственных радиоактивных изотопа: стронций 90 и прометий 147, те, что применяются в атомных батарейках. Все остальные, о которых шла речь, — это изотопы природные. Я не говорю, конечно, о новых элементах, они ведь тоже получены искусственно. Теперь мы с Анатолием будем рассказывать главным образом о радиоизотопах искусственных. Кто из нас начнет? Ты, Толя?
Изотопы в руках химиков
— Что ж. Пусть изотопы и химия. Так вот, представьте себе, — я задумался, с чего бы начать. — Ну хотя бы… Возьмите обычную поваренную соль, — я вытащил щепоть из мешочка с солью. — Вы видите, какая она белая и чистая. Высший сорт! Ты, кажется, покупала ее, Майка? Но посетите соляные промыслы, и вы убедитесь, какой она имеет неприглядный вид: мокрые серые куски. Пройдет много операций очистки, прежде чем соль станет белой. Вы думаете, что в моей горсти чистая NaCl? Химик берет щепотку соли, производит анализ и обнаруживает в ней громадное, на его взгляд, количество примесей магния, кальция, калия, железа, брома, йода, серы и так далее. Правда, вам покажется, что химик преувеличивает: подумаешь, какие-то десятые доли процента посторонних веществ! Однако именно эти десятые доли нередко оказывают влияние на ход различных процессов. Поэтому химики предпочитают иметь дело с возможно более чистыми веществами. Разработано много чувствительнейших аналитических методов, которые позволяют установить присутствие в нужном материале тысячных и даже десятитысячных долей примесей. Но иногда и такой точности бывает недостаточно. Новая техника требует от промышленности сверхчистых материалов. Особенно необходима чистота материала для полупроводниковой техники. Ничтожнейшие загрязнения могут сделать полупроводник непригодным для употребления. Так, для германиевых полупроводников достаточно одной миллионной доли процента примесей, чтобы металл пришлось забраковать. Классические методы аналитической химии фактически не дают возможности определять столь малые следы посторонних материалов. Новая техника вызвала к жизни особые методы анализа. Одним из них является радиоактивационный анализ. Уже по названию можно догадаться, что и здесь не обошлось без участия радиоактивных изотопов. Вот вкратце принцип метода. Исследуемый образец облучают элементарными частицами. Чаще всего используют медленные нейтроны, но можно применять также дейтроны, протоны, альфа-частицы и гамма-лучи. В результате ядерных реакций образуются радиоактивные изотопы элементов-примесей или изотопы соседних с ними элементов. Как известно, каждый радиоактивный изотоп обладает двумя характерными лишь для него величинами: периодом полураспада и энергией излучения. Измеряя их величины, можно установить, какие именно элементы примеси и в каком количестве есть в исследуемом материале. Радиоактивационный анализ позволяет определить 57 элементов периодической системы при содержании их в количествах менее одной миллионной доли процента, 10–6 процента. Вот один из примеров радиоактивационного анализа. Допустим, нужно исследовать образец металлического висмута, который находит применение в технике полупроводников. Предположим, что в исследуемом металле содержатся ничтожнейшие примеси меди, сурьмы и мышьяка. Сначала приготовим специальные эталоны сравнения. Весьма малые количества меди, сурьмы и мышьяка введем в растворы солей известной концентрации и упарим эти растворы досуха. Сравнивая впоследствии активности нашего образца с активностями эталона, мы сможем сделать вывод о количестве примесей в металлическом висмуте. Затем образец и эталоны облучим в ядерном реакторе. Благодаря ядерным реакциям образуются радиоактивные изотопы мышьяка (As76, период полураспада 26 часов), меди (Cu64, период полураспада 13 часов) и сурьмы (Sb122, период полураспада 3 дня). Полученные образцы и эталоны подвергают особой химической обработке. В результате достигается разделение и очистка определяемых элементов-примесей. Теперь задача состоит в том, чтобы измерить активности выделенных радиоизотопов и сравнить с активностью эталонов. Оказывается, что в образце металлического висмута содержалось 2·10–7 процентов меди, 1,3·10–6 процентов сурьмы и около 10–7 процентов мышьяка. Радиоактивационный анализ позволяет контролировать содержание примесей в тех материалах, которые используются в конструкциях ядерных реакторов. Например, очень важно бывает установить, есть ли примеси редкоземельных элементов в висмуте, свинце, графите. В этом случае процесс упрощается, потому что многие редкоземельные элементы обладают весьма большой способностью поглощать нейтроны. Так, редкоземельные элементы европий и гольмий можно определить в количестве 10–11 грамма на 1 грамм материала. Своеобразным рекордом радиоактивационного анализа является определение примеси теллура в количестве 10–20 грамма (!). Радиоактивационный анализ — это, если хотите, один из самых ярких примеров использования радиоизотопов в химии. Есть и множество других. В химии стал незаменимым метод меченых атомов. В чем его суть? Если к какому-нибудь химическому элементу добавить буквально следы его радиоактивного изотопа, то нетрудно проследить поведение этого элемента, например, установить, в какие реакции он вступает. Достаточно лишь время от времени отбирать пробы, в которых содержится соединение интересующего нас элемента, и с помощью счетного устройства следить за содержанием радиоактивного изотопа. Долгое время считалось, что висмут образует соединение с водородом, так называемый гидрид, причем он при нормальных условиях существует в газообразном состоянии. Обычные аналитические методы оказывались недостаточно чувствительными для доказательства. Поступили следующим образом. На магниевую фольгу нанесли ничтожное количество тория С, который является изотопом висмута и, следовательно, обладает одинаковыми с ним химическими свойствами. Фольгу растворили в соляной кислоте; как известно, при этом процессе выделяется водород. Ученые рассуждали так: если торий С образует гидрид, то в водороде можно будет наблюдать активность. Действительно, с помощью счетчика удалось доказать, что в газообразной фазе находится изотоп висмута. Таким путем ученые получили сведения о способах получения гидрида висмута и его стабильности. — Прошу слова в порядке ведения собрания! — Илья взлохматил шевелюру. — Прости, Толя, что вмешиваюсь в недоступную моему хилому интеллекту область неорганической химии. Знаете, гидриды, то есть соединения водорода с металлами, — это очень сложная часть неорганики. Только сейчас в ней кое-что начинает проясняться. А несколько десятилетий назад она была такой же неизученной, как, например… ну, скажем, как Кольский полуостров для туристов начала пятидесятых годов… — Шел бы ты, Илья, с такой «популяризацией» куда-нибудь подальше! — набросился на него Сережа. — За кого ты нас считаешь? — Он хочет показать, что все знает, — затараторила Майка. — И кокетничает при этом. — Илья, конечно, прав: гидриды — запутанная и сложная область, — сказал я. — Многие из них имеют очень необычную формулу. Например, гидрид церия — CeH2,75. Здесь мы сталкиваемся с понятием дробной валентности. А состав некоторых гидридов вообще нельзя выразить формулой. Не поймешь: то ли химическое соединение, то ли просто раствор водорода в металле. Но мы отвлеклись от основной темы. Как известно, абсолютно нерастворимых солей в природе не существует. Есть соли очень малорастворимые, считающиеся в обиходе нерастворимыми. Примером такого вещества является самый обычный мел CaCO3. С помощью радиоизотопа Ca45 можно с большой точностью определить растворимость мела в воде. Для этого определяют активность одного миллиграмма CaCO3, содержащего Ca45. Затем порошок мела взбалтывают с водой в течение определенного времени. Таким путем получают насыщенный при данной температуре раствор CaCO3 в воде. Раствор отделяют от нерастворившегося мела, отбирают некоторое количество его (несколько миллилитров) и упаривают. Активность сухого остатка определяют с помощью счетчика. Если мы разделим теперь эту величину на активность одного миллиграмма CaCO3, то отсюда найдем количество мела в сухом остатке. Далее просто рассчитать содержание мела в 100 граммах раствора. Очень часто какое-либо химическое соединение получают путем так называемых обменных реакций. Если дан раствор ляписа — AgNO3, осадить из него серебро в виде хлорида можно, добавив соляной кислоты:
AgNO3 + HCl→HNO3 + AgCl.Иногда в подобных процессах важно знать: весь ли осаждаемый металл выпадает в осадок. Тут опять на помощь приходят радиоактивные изотопы. Так, изотоп олова Sn113 позволил доказать, что при действии красной кровяной соли K3[Fe(CN)6] на растворы солей олова все олово выпадает в осадок. После удаления осадка в растворе не было обнаружено радиоактивности. Многие химические реакции представляют собой сложные явления. Если определение конечных продуктов реакции часто не трудно, то механизм реакций удается точно выяснить далеко не всегда. Например, процессы коррозии — ржавления металлов. Ученые и инженеры давно заняты разработкой эффективных методов борьбы с этим страшным бичом металлических конструкций и изделий. Коррозия начинается с того, что металл покрывается пленкой окиси. Дальше процесс окисления может идти двумя путями: или кислород проникает через пленку к не окисленным еще слоям металла, или, наоборот, атомы металла выходят через пленку наружу. Какой из этих двух процессов происходит в действительности, позволил выяснить радиоизотоп меди Cu64. Медную пластинку покрыли тонким слоем меди, которая содержит радиоизотоп Cu64, и окислили при высокой температуре до CuO. Ученые рассуждали так: если окисление происходит путем проникновения атомов меди наружу через окисную пленку, то наружный слой окиси меди должен быть нерадиоактивным. В противном случае Cu64 останется на поверхности. Опыт показал, что наружный слой нерадиоактивен. Мы найдем немало примеров и в органической химии. Вот процесс получения синтетического топлива (смеси углеводородов) из воды и окиси углерода. В странах, бедных нефтью, производство синтетического топлива имеет первостепенное значение. Схема процесса очень проста: над нагретыми железными стружками пропускают смесь окиси углерода и водорода. Предположили, что железо восстанавливает окись углерода до свободного углерода, который образует с железом карбид. На второй стадии реакции углерод карбида соединяется с водородом, давая углеводороды. Но, быть может, железо не принимает участия в реакции, а только ускоряет ее? Ответ был найден благодаря С14. «Меченую» окись углерода С14O пропустили над железом. Оказалось, что на поверхности металла действительно образуется радиоактивный карбид. Однако в углеводородах активности почти не наблюдалось. Следовательно, заключили ученые, происходит прямое взаимодействие окиси углерода и водорода на поверхности железа, которое играет роль катализатора. Карбид — лишь побочный продукт. Или еще более жизненный пример. Два известных в обиходе вещества — уксусная кислота CH3СООН и этиловый спирт С2Н5OH. Требуется выяснить, где — в молекуле спирта или в молекуле кислоты — углерод сильнее связан с кислородом. Формулируя вопрос по-другому, говорим: нужно разобраться в механизме следующей реакции:
CH3COOC2Н5 + HOH→CH3СООН + С2Н5OH.На языке химии эта реакция носит название реакции омыления, или гидролиза, также хорошо известного уксусно-этилового эфира. Куда переходит кислород из молекулы воды: в кислоту или в спирт? Если в спирт, то, значит, именно с ним кислород связан прочнее. Для этого нужно «пометить» кислород воды! К сожалению, радиоактивный изотоп кислорода О15 не подходит: у него слишком мал период полураспада (около 2 минут), и, прежде чем исследование будет проведено до конца, он распадется практически весь. На сей раз выручает «тяжелый» кислород, О18. Им-то и «метят» воду. Изучение продуктов гидролиза эфира показывает, что О18 концентрируется в спирте. Можно взять, наконец, полимеры. Среди них выделяется своими качествами полистирол. В изучении процесса полимеризации стирола большую роль сыграли радиоизотопы. Дело в том, что многие реакции полимеризации для своего успешного протекания нуждаются в специальных «возбудителях» — своеобразных катализаторах. Стирол хорошо полимеризуется в присутствии персульфата аммония. Если к персульфату добавить радиоактивную серу S32, то удается определить длину цепи молекулы полимера. На основе же этих данных легче подобрать наилучшие условия для осуществления процесса. — Как видите, примеров немало! — продолжал я. — Со временем одним из основных методов исследования в химии станет применение радиоактивных изотопов. Я рассказал об их использовании в качестве меченых атомов. Однако есть и другая область, где используется действие излучений радиоактивных изотопов на вещества, на протекание различных химических реакций… Этой областью занимается новая наука. Сейчас я расскажу немного о ней.
Радиационная химия
Лишь очень немногие реакции могут протекать в обычных условиях, то есть при обычной температуре воздуха и атмосферном давлении. В большинстве же случаев дело обстоит по-иному. Мало привести реагирующие вещества в соприкосновение. Нужны и другие условия. Мы можем тщательно растереть в фарфоровой чашечке железный порошок с серой, но никакой реакции не произойдет. Стоит, однако, погреть чашечку на газовой горелке, как мы окажемся свидетелями бурного процесса. Следовательно, высокая температура ускоряет химические реакции. Аналогичным образом действует повышение давления. Наконец, во многих химических процессах применяются так называемые катализаторы. Это различные вещества (чаще всего специально приготовленные металлы, окислы или соли), которые способствуют быстрому течению реакций. Сами же они при этом остаются неизменными. Очень часто химики используют сочетание всех трех факторов. Например, исключительно важная в экономическом отношении реакция синтеза аммиака из азота и водорода требует температуры до 550° и давления до 1000 атмосфер. Катализатором в процессе служит смесь железа с его окислом и некоторыми другими добавками. Иногда бывает так, что никакие давления, температуры и катализаторы не могут заставить реакцию идти в темноте. В то же время на свету эта реакция происходит даже при обычных условиях. Такие реакции называются фотохимическими. Простейший пример — выделение серебра из эмульсии фотографической пластинки. Физика объясняет, что свет возбуждает атомы элементов. Возбужденные атомы весьма активны и легче взаимодействуют между собой. Световые лучи, расскажет далее физика, суть электромагнитные колебания, обладающие определенной частотой и длиной волны. Наибольшее химическое действие оказывают фиолетовые и ультрафиолетовые лучи с малой длиной волн. Чем меньше длина волны, тем «жестче» лучи, тем больше у них энергии. Тем сильнее их химическое действие. Но есть лучи более коротких длин, чем у лучей солнечного спектра. Это рентгеновские лучи. Это радиоактивные излучения. Что радиоактивные излучения могут вызывать химические превращения, было известно давно. Об этом знал еще Беккерель. Поставив все три типа радиоактивных излучений в один ряд, мы допустили некоторую вольность. Электромагнитными колебаниями являются гамма-лучи; альфа- и бета-лучи — это поток заряженных частиц, но они обладают столь же сильным химическим действием. Изучение действия радиоактивных излучений на вещество позволило в последнее десятилетие сформироваться новой науке, развитие которой приведет к величайшим достижениям. Это — радиационная химия. Чаще всего она имеет дело с гамма-излучением, поскольку проникающая способность альфа- и бета-лучей невелика. А для радиационно-химических процессов необходимо, чтобы реакция протекала по всей массе вещества. В настоящее время сконструированы специальные радиационно-химические установки различной мощности, в которых используются главным образом радиоактивные кобальт Со60 и цезий Cs137. Как известно, азотная кислота — одно из основных веществ современной химической промышленности. Удобрения, лаки, краски, важные полупродукты, искусственные ткани — все это «дело рук» азотной кислоты. Хотя процессы получения окислов азота (из которых дальше готовят азотную кислоту) разработаны давно, но они требуют значительных затрат и очень сложного и дорогого оборудования. Совсем недавно радиационно-химические исследования показали, что с помощью гамма-излучения из атмосферного азота можно получить его окислы в обычных условиях. Более того, облучение водных растворов щелочей, насыщенных азотом, показало, что азот в этих условиях может быть окислен непосредственно до азотной кислоты. Пока это первые шаги. Выходы реакций еще очень малы, а затраты велики. И говорить о производственных масштабах рано. Но то, что недоступно сейчас, станет вполне осуществимым и приемлемым через несколько лет. Значительно более ощутимы успехи радиационной химии в органической химии. Прежде всего радиационный крекинг. Крекингом называется процесс расщепления нефти — обогащения ее простыми, легкими углеводородами, играющими главную роль в составе бензиновых фракций. Получение так называемых ненасыщенных углеводородов — сырья для многих органических продуктов — также задача крекинга. Нужно пояснить, что такое насыщенные и ненасыщенные углеводороды. Углерод в подавляющем большинстве своих соединений четырехвалентен. Так, с водородом он образует газ метан CH4 — самый легкий из насыщенных углеводородов, к которым принадлежат также этан С2Н6, пропан С3Н8 и так далее. Углерод с углеродом соединен только одной связью; затрачивая одну валентность, остальные связи идут на соединение с атомами водорода. Но известно соединение С2Н4 — этилен, представитель ненасыщенных соединений. В нем каждый атом углерода использует две валентности на соединение с двумя атомами водорода, а две другие — с соседним атомом углерода. Следовательно, у углеродов этилена как бы остаются «резервные», ненасыщенные валентности. Обычный крекинг проводят при высокой температуре и в присутствии катализатора. Радиационный крекинг не нуждается в нагреве и применении катализаторов. Сильное гамма-облучение образцов нефти в короткий срок способствует расщеплению тяжелых углеводородов (содержащих длинные цепочки углерода), обогащает бензиновые фракции нефти. Одновременно получается широкий ассортимент ненасыщенных углеводородов. Однако в других условиях облучение может вызвать и обратный процесс: получение сложных углеводородов из простых — из метана и этана (наиболее легких углеводородов) под действием радиации образуются более сложные вещества. Кроме того, при облучении углеводороды окисляются. В результате образуются столь ценные органические продукты, как альдегиды и кетоны, а в отдельных случаях и органические кислоты. А радиационное получение фенола из бензола? Или анилина — основы красителей — из смеси жидкого аммиака и бензола? Или радиационная полимеризация этилена, радиационная вулканизация каучука? Вот что наделало применение гамма-излучения в химии! Но еще одно соображение: вовсе не обязательно конструировать специальные установки. Вы помните, что ядерный реактор оказался прекрасной «фабрикой» изотопов? Сложнейшие и многообразные ядерные реакции, которые протекают в реакторе в процессе деления урана, сопровождаются и интенсивным гамма-излучением. Технически несложно выделить поток гамма-лучей из комплекса излучений и использовать его для различных целей. — Можно мне? — поднял руку Олег, когда я кончил. — Мне пришла на память одна история. Тоже связанная с изотопами. — Скажите, пожалуйста! — перебил Илья. — Однако похоже, зря я считал вас полными профанами! — Нет, все-таки мы профаны, — признался Олег. — Просто мне кое-что неясно, а я хотел бы понять. — А что за история? — Ее я услышал в Баку несколько лет назад. Суть вот в чем. Некий русский эмигрант, бывший капиталист, совершил поездку в Советский Союз в качестве туриста. Он объездил много городов и в том числе Баку, где до революции владел плохоньким нефтяным промыслом. И каково же было его удивление, когда он увидел, что на участке, который в старые времена считался мало перспективным, вовсю добывается нефть. Несколько скважин, на которых он сорок лет назад сам поставил крест, давали отличную, первосортную нефть. — Теперь я не сомневаюсь: Советы все могут! — молвил он. В тоне его сквозила откровенная зависть. Но поскольку он был деловым человеком, то спросил: — Как же вам удалось ввести в строй старые, заброшенные скважины? — Нам помогли радиоактивные изотопы, — ответили ему.
Изотопы в геологическом походе
— Значит, радиоизотопы помогают и геологам в разведке полезных ископаемых? — Алеша протер очки. — Конечно! — подтвердил Илья. — Еще как помогают! Например, в поисках нефти. Можно ли судить о том, есть ли здесь залежи нефти, не углубляясь, так сказать, в землю? Да, можно. Давно известно, что углеводороды, входящие в состав нефтей, а особенно легчайший из них — метан CH4, могут проникать от залежей нефти сквозь толщу пород к поверхности. Если обнаружен метан, то неподалеку обязательно располагается нефтяное месторождение. Необходимо лишь уточнить, нефтяного ли он происхождения. Ведь этот углеводород может образовываться и в почве в результате многих процессов, например гниения растений. Как же распознать происхождение метана? Как, по-твоему, Маечка? Теперь ты должна догадаться. Майка несколько смущена. Неудобно ударить лицом в грязь. Но ее сообразительность на высоте. — С помощью углерода четырнадцать! — выпаливает она. — Правильно! А конкретнее? Майка задумывается. — Если углерод метана радиоактивен, то газ явно не нефтяного происхождения. Ведь нефть образовалась многие миллионы лет тому назад, и ее углерод давно уже потерял радиоактивность! — вмешиваюсь я. — Ты так предполагала? — Именно так! — соглашается Майка. — Я только не сумела это высказать. — Вы делаете определенные успехи, мисс Гуманитарий, — констатирует Илья и продолжает: — На карту нанесены контуры предполагаемого месторождения. Теперь геологи углубляются в земную кору. Наступает время буровых скважин. Проходя через толщу пород, бур встречает на своем пути различные слои — глину и сланцы, известняки и песок, — прежде чем достигнет горизонтов, насыщенных нефтью. Порой попадаются на пути бура и водоносные слои. Как, по-вашему, можно определить, в какой последовательности расположены слои, через которые проходил бур? Разумеется, если время от времени отбирать на поверхность пробы. Но ведь такие исследования трудоемки и отнимают немало времени. Но можно обойтись и без отбора проб. Различные материалы по-разному взаимодействуют с нейтронами: одни из них сильнее отражают нейтроны, другие меньше. Породы, в состав которых входят соединения, содержащие много водорода, лучше рассеивают нейтроны, потому что водород обладает способностью замедлять быстрые нейтроны. В скважину вслед за буром опускают нехитрое приспособление. Оно состоит из нейтронного источника, например, смеси соли радия с металлическим бериллием (альфа-частицы радия выбивают из ядер бериллия нейтроны), счетчика отраженных нейтронов, ионизационной камеры и свинцовой защиты. Нейтроны, испускаемые источником, частично вступают в ядерные реакции с элементами пород, причем образуются радиоактивные изотопы, а частично рассеиваются. Рассеянные нейтроны обнаруживаются счетчиком, а излучения образовавшихся радиоизотопов влияют на величину тока в ионизационной камере. По показаниям этих двух приборов и судят о том, какие слои проходит бур. Поскольку в глине, сланцах, известняке, песке содержится разное количество водорода, то эти породы можно различать друг от друга. Слои, в которых содержится много воды или нефти (а нефть является смесью углеводородов), очень хорошо рассеивают нейтроны и определяются весьма отчетливо.
 Этот метод разведки на нефть получил название нейтронного каротажа.
Он может быть видоизменен. В этом случае регистрируются не нейтроны, а гамма-лучи, испускаемые после захвата нейтронов ядрами химических элементов, входящих в состав породы.
Гамма-лучи, возникающие в результате распада радиоактивных изотопов, несут различную энергию. По ее величине устанавливают, каким именно радиоизотопам принадлежат гамма-лучи. Следовательно, есть интересная возможность: с помощью нейтронного каротажа вести разведку других полезных ископаемых. Так, нейтронные источники уже используют для поисков марганца, кобальта, ртути, вольфрама, бора, кадмия — всех тех элементов, ядра которых хорошо захватывают медленные нейтроны.
— А как же ввели в действие старые, заброшенные скважины? — спросила Майка.
— Очень просто. Произвели каротаж нижележащих слоев и убедились, что богатые нефтеносные слои располагаются глубже уровня, до которого были пробурены прежние скважины.
— Солнце! — перебила вдруг Наташа. — Смотрите, солнышко!
Светлым-светлым стал четырехугольник окна. Не сговариваясь, мы выскочили наружу.
Облака разошлись. На сером фоне появились жизнерадостные островки голубого неба, словно проталины среди осевшего ноздреватого снега в вешнем лесу. Мы зачарованно смотрели на них, будто видели что-то совсем необычное. Режущей глаза белизной сверкал Аламинский перевал, и только соседние, ушедшие в поднебесья пики, молчаливые, как стражи у ворот в неведомую страну, еще прятали свои белые шапки в облаках.
— Ура! — закричал Алеша. — Даешь Аламинский перевал!
— Как здорово! — зазвенел голос Наташи. — Мне уж начинало казаться, что на свете нет ничего, кроме пурги, воя ветра и этой удручающей белесой мглы. Вы только посмотрите, до чего же все красиво!
Деревья утопали в снегу, строгие и неподвижные. Ворчала подо льдом порожистая Алама, и вода ее в полыньях казалась изумрудной.
— Да! — Алеша поправил очки. — В такие минуты нельзя без стихов.
Этот метод разведки на нефть получил название нейтронного каротажа.
Он может быть видоизменен. В этом случае регистрируются не нейтроны, а гамма-лучи, испускаемые после захвата нейтронов ядрами химических элементов, входящих в состав породы.
Гамма-лучи, возникающие в результате распада радиоактивных изотопов, несут различную энергию. По ее величине устанавливают, каким именно радиоизотопам принадлежат гамма-лучи. Следовательно, есть интересная возможность: с помощью нейтронного каротажа вести разведку других полезных ископаемых. Так, нейтронные источники уже используют для поисков марганца, кобальта, ртути, вольфрама, бора, кадмия — всех тех элементов, ядра которых хорошо захватывают медленные нейтроны.
— А как же ввели в действие старые, заброшенные скважины? — спросила Майка.
— Очень просто. Произвели каротаж нижележащих слоев и убедились, что богатые нефтеносные слои располагаются глубже уровня, до которого были пробурены прежние скважины.
— Солнце! — перебила вдруг Наташа. — Смотрите, солнышко!
Светлым-светлым стал четырехугольник окна. Не сговариваясь, мы выскочили наружу.
Облака разошлись. На сером фоне появились жизнерадостные островки голубого неба, словно проталины среди осевшего ноздреватого снега в вешнем лесу. Мы зачарованно смотрели на них, будто видели что-то совсем необычное. Режущей глаза белизной сверкал Аламинский перевал, и только соседние, ушедшие в поднебесья пики, молчаливые, как стражи у ворот в неведомую страну, еще прятали свои белые шапки в облаках.
— Ура! — закричал Алеша. — Даешь Аламинский перевал!
— Как здорово! — зазвенел голос Наташи. — Мне уж начинало казаться, что на свете нет ничего, кроме пурги, воя ветра и этой удручающей белесой мглы. Вы только посмотрите, до чего же все красиво!
Деревья утопали в снегу, строгие и неподвижные. Ворчала подо льдом порожистая Алама, и вода ее в полыньях казалась изумрудной.
— Да! — Алеша поправил очки. — В такие минуты нельзя без стихов.
Изотопы варят сталь
Нам часто приходится слышать и читать, что в разных местах страны задувают новые доменные печи. Ввод в действие домны — это большое событие, событие государственного масштаба. Доменная печь беспрерывно работает в течение пяти-шести, а то и более лет. После этого ее останавливают и производят капитальный ремонт. Во время ремонта прежде всего сменяется вся огнеупорная кладка, или, как говорят металлурги, футеровка доменной печи. Роль футеровки в домне исключительно велика. Ее качеством определяется продолжительность непрерывной работы печи. Особенно важно качество огнеупорной кладки горна и заплечиков — наиболее ответственных частей домны. Здесь клокочут расплавленный чугун и шлаки. Они-то и действуют на огнеупоры, постепенно разъедая их. И когда футеровочный материал оказывается недостаточно хорошим, процесс разъедания идет быстрее. Если не обнаружить вовремя разрушения кладки заплечиков и горна, не остановить печь на ремонт, то не миновать катастрофы. Поэтому нужно следить внимательно и постоянно за процессом разъедания, чтобы успеть предупредить опасность. Многие ученые работали над проблемой контроля за разрушением огнеупоров в ходе работы домны. Известно несколько методов, но все они технически весьма сложны. Сейчас эту проблему можно считать решенной. В этом заслуга радиоактивного изотопа кобальта 60. Он обладает весьма мощным гамма-излучением, настолько мощным, что и полуметровая кирпичная кладка не является препятствием. Лучи свободно проникают через нее. При постройке или капитальном ремонте доменной печи в огнеупорную кладку замуровывают на разных глубинах специальные ампулы, содержащие образцы кобальта 60. Излучение образцов легко обнаружить, если поднести специальные счетчики к определенным, заранее отмеченным участкам на наружной стороне печи. Каждый такой участок соответствует определенной ампуле с образцом.
 Как я уже сказал, расплавленные шлаки постепенно разрушают огнеупоры. Поэтому образцы, расположенные близко к внутренней поверхности кладки, попадают в расплав и растворяются в нем. Таким образом, на отмеченных снаружи участках, соответствующих этим образцам, счетчик не уловит гамма-излучения.
Наблюдая последовательное растворение образцов, можно контролировать процесс разъедания огнеупорной кладки и вовремя остановить печь для ремонта.
Работа доменной печи — это целый сложный комплекс одновременно протекающих процессов. Чтобы получать качественные плавки, нужно учитывать ход каждого из них. Например, для получения чугуна с определенными качествами очень важно знать, как движутся шихтовые материалы и газовые потоки. Изучение этих процессов позволяет увеличивать производительность печи.
И здесь помогают радиоактивные изотопы. Их вводят в руду, кокс и флюсы — во все составляющие элементы шихты, а для исследования движения газов в печи через фурмы вдувают радиоактивный радон.
Другой пример. Это уже из области выплавки стали.
Почему при выплавке стали в электрических печах происходит загрязнение ее кальцием, каков источник этого загрязнения?
Радиоизотоп кальций 45 дает четкий ответ: источником загрязнения может быть шлак или материал футеровки ковша.
Откуда попадает сера при выплавке стали в мартеновских печах?
Ясность вносит радиоактивная сера 35. Оказывается, не только из шихты, как можно было бы полагать. Основной источник загрязнений — сера топливных газов.
Если известны источники загрязнений, мы можем соответствующим образом их устранять. А это гарантирует нам сталь более высокого качества.
Радиоизотопы отлично помогают не только и чугунолитейном и сталеплавильном производствах, они выручают и в получении других металлов.
Например, при выплавке сплава ценнейшего металла вольфрама с железом, так называемого ферровольфрама, часть дорогого вольфрама теряется. Куда теряется, долгое время не могли объяснить достаточно определенно. С помощью радиоактивного вольфрама 185 изучили его распределение между металлом, шлаком и газами.
Оказалось, что основные потери вольфрама происходят в результате уноса его газами.
Одной из предварительных стадий получения многих металлов в свободном состоянии является восстановление их окислов углем. Несмотря на кажущуюся простоту, эти процессы часто бывают капризными. Выход ценного металла получается неполным, то есть металл выделяется в количестве, меньшем, чем это можно рассчитывать по уравнению реакции. Чтобы провести восстановление с наибольшей пользой, нужно тщательно изучить условия реакции.
С помощью радиоуглерода C14 можно определить температуру, при которой начинается восстановление окислов.
Если в нашем распоряжении есть, допустим, трехокись молибдена MoO3, то в результате реакции восстановления ее углем получаются металлический молибден и окись углерода. Нетрудно понять, что она появляется лишь после того, как восстановление началось. Значит, если уголь «пометить» радиоуглеродом, то обнаружение радиоактивности в отходящих газах сигнализирует о начале процесса. Таким путем нашли, что трехокись молибдена вступает в реакцию с углем при 425°, окись меди — при 460°, окись никеля — при 500°.
Эти данные позволили повысить эффективность производственных процессов.
Теперь снова обратимся к сталям. Как известно, современные заводы выплавляют стали самых разнообразных марок. Они различаются по тем элементам, которые входят в их состав. Для каждой марки существуют определенные обозначения.
Но представим себе, что на инструментальном заводе потребовался металл какой-нибудь определенной марки. Как обнаружить нужный материал среди десятков стальных заготовок?
Можно подвергнуть их образцы обычному химическому анализу и, рассчитав количество входящих в сталь элементов, сделать вывод о принадлежности ее к данной марке. Однако этот путь весьма трудоемкий и продолжительный. Даже самому искусному химику-специалисту требуется несколько часов, чтобыпроанализировать один образец.
Радиоактивные изотопы позволяют произвести определение марки за несколько секунд.
Для этого в процессе плавки к ней добавляют небольшое количество радиоактивного изотопа, лучше всего излучающего гамма-лучи. Поскольку различные радиоактивные изотопы обладают разной энергией распада, они могут быть и по величине этой энергии отличны друг от друга.
Затем простым измерением энергии гамма-излучения точно определяется, к какой марке относится наша сталь.
Со временем разовьется новая область науки — радиационная металлургия. Известно, что малые добавки многих редких элементов значительно улучшают качества сталей. Но ведь эти элементы можно не вводить предварительно в чугун, а синтезировать из других искусственно прямо в стали. Для этого достаточно подвергнуть расплавленный металл интенсивному нейтронному облучению.
Илья замолк, и было неясно, кончил ли он или станет продолжать, но на его лице уже появилась ехидная улыбка.
— Хотите вопрос на сообразительность? Можно ли с помощью радиоактивных изотопов определять износ режущего инструмента? Пока обед не готов, думайте!
— Я бы хотела подумать о другом, — робко произнесла Майка. — На сколько дней у нас осталось продуктов? Кажется, физической работы никакой, а едим мы многовато.
— Зато какая умственная работа! Нам — популярно объяснять, вам — понимать! И потом, разве ты забыла, какую кучу дров сегодня заготовили. Хватит на несколько солидных дискуссий, — удовлетворенно подытожил Илья.
— Все это мелочи, — отмахнулся Олег. — Знаешь, Илья, я, кажется, нашел ответ. Нужно ввести в резец какой-нибудь радиоактивный изотоп, а затем время от времени измерять активность стружки.
— А как ввести изотоп?
— По-моему, облучить резец нейтронами. Тогда в нем образуются радиоактивные изотопы, — предположила Наташа.
— Разумно! — восхитился Илья. — Из твоих молодцов, начальник, выйдет толк.
Как я уже сказал, расплавленные шлаки постепенно разрушают огнеупоры. Поэтому образцы, расположенные близко к внутренней поверхности кладки, попадают в расплав и растворяются в нем. Таким образом, на отмеченных снаружи участках, соответствующих этим образцам, счетчик не уловит гамма-излучения.
Наблюдая последовательное растворение образцов, можно контролировать процесс разъедания огнеупорной кладки и вовремя остановить печь для ремонта.
Работа доменной печи — это целый сложный комплекс одновременно протекающих процессов. Чтобы получать качественные плавки, нужно учитывать ход каждого из них. Например, для получения чугуна с определенными качествами очень важно знать, как движутся шихтовые материалы и газовые потоки. Изучение этих процессов позволяет увеличивать производительность печи.
И здесь помогают радиоактивные изотопы. Их вводят в руду, кокс и флюсы — во все составляющие элементы шихты, а для исследования движения газов в печи через фурмы вдувают радиоактивный радон.
Другой пример. Это уже из области выплавки стали.
Почему при выплавке стали в электрических печах происходит загрязнение ее кальцием, каков источник этого загрязнения?
Радиоизотоп кальций 45 дает четкий ответ: источником загрязнения может быть шлак или материал футеровки ковша.
Откуда попадает сера при выплавке стали в мартеновских печах?
Ясность вносит радиоактивная сера 35. Оказывается, не только из шихты, как можно было бы полагать. Основной источник загрязнений — сера топливных газов.
Если известны источники загрязнений, мы можем соответствующим образом их устранять. А это гарантирует нам сталь более высокого качества.
Радиоизотопы отлично помогают не только и чугунолитейном и сталеплавильном производствах, они выручают и в получении других металлов.
Например, при выплавке сплава ценнейшего металла вольфрама с железом, так называемого ферровольфрама, часть дорогого вольфрама теряется. Куда теряется, долгое время не могли объяснить достаточно определенно. С помощью радиоактивного вольфрама 185 изучили его распределение между металлом, шлаком и газами.
Оказалось, что основные потери вольфрама происходят в результате уноса его газами.
Одной из предварительных стадий получения многих металлов в свободном состоянии является восстановление их окислов углем. Несмотря на кажущуюся простоту, эти процессы часто бывают капризными. Выход ценного металла получается неполным, то есть металл выделяется в количестве, меньшем, чем это можно рассчитывать по уравнению реакции. Чтобы провести восстановление с наибольшей пользой, нужно тщательно изучить условия реакции.
С помощью радиоуглерода C14 можно определить температуру, при которой начинается восстановление окислов.
Если в нашем распоряжении есть, допустим, трехокись молибдена MoO3, то в результате реакции восстановления ее углем получаются металлический молибден и окись углерода. Нетрудно понять, что она появляется лишь после того, как восстановление началось. Значит, если уголь «пометить» радиоуглеродом, то обнаружение радиоактивности в отходящих газах сигнализирует о начале процесса. Таким путем нашли, что трехокись молибдена вступает в реакцию с углем при 425°, окись меди — при 460°, окись никеля — при 500°.
Эти данные позволили повысить эффективность производственных процессов.
Теперь снова обратимся к сталям. Как известно, современные заводы выплавляют стали самых разнообразных марок. Они различаются по тем элементам, которые входят в их состав. Для каждой марки существуют определенные обозначения.
Но представим себе, что на инструментальном заводе потребовался металл какой-нибудь определенной марки. Как обнаружить нужный материал среди десятков стальных заготовок?
Можно подвергнуть их образцы обычному химическому анализу и, рассчитав количество входящих в сталь элементов, сделать вывод о принадлежности ее к данной марке. Однако этот путь весьма трудоемкий и продолжительный. Даже самому искусному химику-специалисту требуется несколько часов, чтобыпроанализировать один образец.
Радиоактивные изотопы позволяют произвести определение марки за несколько секунд.
Для этого в процессе плавки к ней добавляют небольшое количество радиоактивного изотопа, лучше всего излучающего гамма-лучи. Поскольку различные радиоактивные изотопы обладают разной энергией распада, они могут быть и по величине этой энергии отличны друг от друга.
Затем простым измерением энергии гамма-излучения точно определяется, к какой марке относится наша сталь.
Со временем разовьется новая область науки — радиационная металлургия. Известно, что малые добавки многих редких элементов значительно улучшают качества сталей. Но ведь эти элементы можно не вводить предварительно в чугун, а синтезировать из других искусственно прямо в стали. Для этого достаточно подвергнуть расплавленный металл интенсивному нейтронному облучению.
Илья замолк, и было неясно, кончил ли он или станет продолжать, но на его лице уже появилась ехидная улыбка.
— Хотите вопрос на сообразительность? Можно ли с помощью радиоактивных изотопов определять износ режущего инструмента? Пока обед не готов, думайте!
— Я бы хотела подумать о другом, — робко произнесла Майка. — На сколько дней у нас осталось продуктов? Кажется, физической работы никакой, а едим мы многовато.
— Зато какая умственная работа! Нам — популярно объяснять, вам — понимать! И потом, разве ты забыла, какую кучу дров сегодня заготовили. Хватит на несколько солидных дискуссий, — удовлетворенно подытожил Илья.
— Все это мелочи, — отмахнулся Олег. — Знаешь, Илья, я, кажется, нашел ответ. Нужно ввести в резец какой-нибудь радиоактивный изотоп, а затем время от времени измерять активность стружки.
— А как ввести изотоп?
— По-моему, облучить резец нейтронами. Тогда в нем образуются радиоактивные изотопы, — предположила Наташа.
— Разумно! — восхитился Илья. — Из твоих молодцов, начальник, выйдет толк.
Изотопы в ОТК
— Могу привести еще один пример, — вмешался я. — Контроль за износом двигателя. Здесь участвует радиоактивное железо Fe59. Перед окончательной сборкой верхнее поршневое кольцо двигателя облучают медленными нейтронами в реакторе. Благодаря ядерной реакции в кольце образуется радиоактивный изотоп железа Fe59. При работе двигателя кольцо постепенно изнашивается, истирается. Частички металла попадают в слой масла на стенках цилиндра и смываются в картер. Пробы масла время от времени отбирают из картера и измеряют их активность, обусловленную присутствием железа 59. Таким путем можно весьма точно определить износ кольца в миллиграммах в час. Этот способ позволяет следить и за износом подшипников. А что вы слышали о гамма-дефектоскопии? Ничего? Тогда продолжаю. Вот пример. С конвейера сходит деталь. По всем своим внешним показателям она удовлетворяет требованиям технического контроля. На ней ставится заводская марка, и деталь получает путевку в жизнь. Деталь становится частью сложной машины. Машина работает четко, безукоризненно — и вдруг авария. На долгое время ценный станок выведен из строя. Расследование показывает, что причина аварии заключается именно в этой детали. В ней были внутренние дефекты, не замеченные ранее. Теперь они дорого обошлись производству. Значит, оценивая готовую деталь, нужно требовать не только ее соответствия стандарту, но и заглянуть внутрь, выяснить, нет ли в ней предательских трещин или раковин. Таким всевидящим глазом могут быть рентгеновские лучи. Метод исследования металлических деталей с помощью рентгеновских лучей, или рентгеноскопия, уже давно применяется в промышленности. Но у этого метода есть существенные недостатки. Он требует громоздких и дорогостоящих аппаратов, высокого напряжения тока. Энергия рентгеновского излучения нередко оказывается недостаточной для просвечивания изделий большой толщины. Кроме того, массивные аппараты часто не дают возможности «просмотреть» ответственные участки котлов, трубопроводов и различных других сложных конструкций. Поэтому сейчас рентгеноскопия вытесняется более удобным методом гамма-дефектоскопии. Как показывает само название, это метод обнаружения внутренних дефектов в различных изделиях с помощью гамма-излучения радиоактивных изотопов. Когда гамма-лучи проходят через вещество, они ослабляются. Величина ослабления (или величина поглощения) зависит от разных причин: от толщины облучаемого материала, от зарядов ядер и процентного содержания элементов, входящих в его состав. В общем поглощение пропорционально удельному весу вещества. Кстати, на этом основано определение удельных весов с помощью радиоактивных изотопов.
 Как же осуществляется гамма-дефектоскопия на практике?
Прежде всего подбирается подходящий источник излучения. Чем толще контролируемые детали, тем большая энергия гамма-излучения требуется. Выбор радиоактивных изотопов с различными энергиями гамма-лучей достаточно велик: кобальт 60, цезий 137, церий 144, европий 155, тулий 170.
Источник излучения, а он портативен, помещается с одной стороны детали; с другой стороны располагается детектор — устройство, которое фиксирует проникающие сквозь материал лучи. Таким устройством может служить ионизационная камера или специальная фотопленка. Если применяется фотопленка, то метод носит название гамма-радиографии.
Когда в детали нет внутренних дефектов, гамма-излучение ослабляется равномерно по всей поверхности. Но стоит на пути гамма-лучей оказаться какому-нибудь дефекту, как величина поглощения резко меняется. Ионизационная камера сигнализирует об этом скачком ионизационного тока. Участки фотопленки, расположенные против дефектов, оказываются более темными, чем соседние.
Свободная от недостатков рентгеноскопического метода, гамма-дефектоскопия нашла широкое применение в самых различных областях — от строительства трубопроводов до археологии.
Она незаменима при контроле качества сварных стыков газопровода высокого давления. В Советском Союзе на всех трассах строящихся газопроводов применяется гамма-дефектоскопия.
Она помогла археологам «прочитать» на бронзовой прокладке ассирийского шлема IX века до нашей эры письмена и символические знаки, которые нельзя было обнаружить никакими другими способами.
Но применение гамма-излучения в промышленности ограничивается не одним лишь отысканием дефектов в деталях и изделиях. Гамма-лучи используются в автоматизации многих производственных процессов.
Взять хотя бы автоматическое измерение толщины.
Как же осуществляется гамма-дефектоскопия на практике?
Прежде всего подбирается подходящий источник излучения. Чем толще контролируемые детали, тем большая энергия гамма-излучения требуется. Выбор радиоактивных изотопов с различными энергиями гамма-лучей достаточно велик: кобальт 60, цезий 137, церий 144, европий 155, тулий 170.
Источник излучения, а он портативен, помещается с одной стороны детали; с другой стороны располагается детектор — устройство, которое фиксирует проникающие сквозь материал лучи. Таким устройством может служить ионизационная камера или специальная фотопленка. Если применяется фотопленка, то метод носит название гамма-радиографии.
Когда в детали нет внутренних дефектов, гамма-излучение ослабляется равномерно по всей поверхности. Но стоит на пути гамма-лучей оказаться какому-нибудь дефекту, как величина поглощения резко меняется. Ионизационная камера сигнализирует об этом скачком ионизационного тока. Участки фотопленки, расположенные против дефектов, оказываются более темными, чем соседние.
Свободная от недостатков рентгеноскопического метода, гамма-дефектоскопия нашла широкое применение в самых различных областях — от строительства трубопроводов до археологии.
Она незаменима при контроле качества сварных стыков газопровода высокого давления. В Советском Союзе на всех трассах строящихся газопроводов применяется гамма-дефектоскопия.
Она помогла археологам «прочитать» на бронзовой прокладке ассирийского шлема IX века до нашей эры письмена и символические знаки, которые нельзя было обнаружить никакими другими способами.
Но применение гамма-излучения в промышленности ограничивается не одним лишь отысканием дефектов в деталях и изделиях. Гамма-лучи используются в автоматизации многих производственных процессов.
Взять хотя бы автоматическое измерение толщины.
Изотопы в автоматах
Степень поглощения гамма-излучения зависит от толщины предмета. Интенсивность исходного гамма-излучения от источника нам известна. Если мы будем знать величину излучения, прошедшего через слой вещества, нетрудно определить и толщину слоя. Для этого строят так называемую эталонную кривую поглощения. Через куски материала известной толщины пропускают гамма-излучение и определяют степень его поглощения. Таким образом находят, что лист железа толщиной, например, 2 миллиметра поглощает столько-то процентов излучения; при толщине 3 миллиметра соответственно больше и так далее. Найденные результаты наносят на график: на горизонтальной оси откладывают толщину материала в миллиметрах, на вертикальной — степень поглощения гамма-излучения. По полученным точкам строят кривую. По ней можно определить неизвестную толщину материала, если найти степень поглощения в нем гамма-лучей. Скажем, такой случай из практики. В обработке металла большую роль играет процесс прокатки. Чтобы изменить толщину обрабатываемого металла, нужно увеличить или уменьшить величину давления на валки прокатного стана. Обычно устанавливают определенную толщину проката. С помощью гамма-излучения этот процесс можно автоматизировать. По одну сторону стального листа помещается источник излучения, по другую — счетчик или ионизационная камера. Если толщина проката вдруг оказывается ниже нормы, степень поглощения уменьшается, ток в ионизационной камере усиливается; это изменение тока передается на специальное устройство, которое уменьшает давление на валки.
 Автоматическая регулировка толщины с помощью радиоактивных изотопов применяется в бумажной промышленности — для измерения толщины бумаги в бумагоделательных машинах. Текстильщики таким способом регулируют толщину тканей. Наконец, в резиновой и химической промышленности толщиномеры обслуживают важные процессы.
В производствах, особенно химических, часто требуется измерять уровень жидкости. Но как определить уровень жидкости в закрытом резервуаре? Эта задача далеко не всегда оказывается простой. Ведь химики имеют на производстве дело с громоздкими и сложными аппаратами, с процессами, для протекания которых требуются строгие условия. Особенно трудно приходится в тех случаях, когда резервуар заполнен легко воспламеняющейся или ядовитой жидкостью.
Помогают решить задачу уровнемеры.
На поверхности жидкости в специальном поплавке помещается гамма-излучатель. В верхней части резервуара располагается счетчик, который регистрирует излучение. Чем выше уровень, тем больший ток будет возникать в регистрирующем устройстве. Этот ток приводит в действие специальный мотор, который через вентиль может регулировать приток и отток жидкости и тем самым удерживать уровень жидкости в определенном положении.
…Илья приоткрыл дверь избушки.
— Ну как там, небо чистое?
— Пока ни облачка!
— Погодите, впереди еще длинная ночь! — скептически заметил Олег. — В горах погода изменчива.
— А мне все-таки верится, что завтра мы возьмем Аламинский перевал, — возразила Наташа. — Должно же нам когда-нибудь повезти.
— Рюкзаки наши много полегчали, — заметил Олег. — Правда, снег слишком глубок. Ничего, народ у нас здоровый.
— Почему туристы так редко болеют в походах? — удивилась Майка. — Кажется, в городе у человека сто недугов, а в путешествии…
— Сейчас ты скажешь: природа лучший лекарь! — перебил ее Илья. — А по-моему, не это главное. Самосознание, сознание того, что в походе болеть нельзя: это плохо и для тебя и для твоих спутников. Вот в чем причина! И ни в коем случае не хандрить, если схватишь простуду.
— Так зачем же ты столь тщательно подбирал в Москве аптечку? — засмеялся Сергей. — Сказал бы прямо: не сметь заболевать, лекарств не будет…
— Почему же? — стала защищать Илью Наташа. — Лекарства — один из центральных пунктов теории Ильи. Тоже самосознание: если я вдруг захвораю, то на этот случай найдется кое-что в аптечке.
Все дружно расхохотались.
— Послушайте, мы опять отвлеклись, — пробасил Олег. — Вернемся к изотопам. Раз уж вспомнили о медицине…
— …то нужно рассказать, какую роль в ней играют радиоактивные изотопы! — закончила за него Наташа.
Илья состроил кислую мину:
— Увольте! У меня скоро отнимется язык!
— Хватит, Илья, ломаться! — отрезала Майка. — Сегодня кончается наше зимовье. Вдохновись тем, что завтра будем по ту сторону перевала.
Автоматическая регулировка толщины с помощью радиоактивных изотопов применяется в бумажной промышленности — для измерения толщины бумаги в бумагоделательных машинах. Текстильщики таким способом регулируют толщину тканей. Наконец, в резиновой и химической промышленности толщиномеры обслуживают важные процессы.
В производствах, особенно химических, часто требуется измерять уровень жидкости. Но как определить уровень жидкости в закрытом резервуаре? Эта задача далеко не всегда оказывается простой. Ведь химики имеют на производстве дело с громоздкими и сложными аппаратами, с процессами, для протекания которых требуются строгие условия. Особенно трудно приходится в тех случаях, когда резервуар заполнен легко воспламеняющейся или ядовитой жидкостью.
Помогают решить задачу уровнемеры.
На поверхности жидкости в специальном поплавке помещается гамма-излучатель. В верхней части резервуара располагается счетчик, который регистрирует излучение. Чем выше уровень, тем больший ток будет возникать в регистрирующем устройстве. Этот ток приводит в действие специальный мотор, который через вентиль может регулировать приток и отток жидкости и тем самым удерживать уровень жидкости в определенном положении.
…Илья приоткрыл дверь избушки.
— Ну как там, небо чистое?
— Пока ни облачка!
— Погодите, впереди еще длинная ночь! — скептически заметил Олег. — В горах погода изменчива.
— А мне все-таки верится, что завтра мы возьмем Аламинский перевал, — возразила Наташа. — Должно же нам когда-нибудь повезти.
— Рюкзаки наши много полегчали, — заметил Олег. — Правда, снег слишком глубок. Ничего, народ у нас здоровый.
— Почему туристы так редко болеют в походах? — удивилась Майка. — Кажется, в городе у человека сто недугов, а в путешествии…
— Сейчас ты скажешь: природа лучший лекарь! — перебил ее Илья. — А по-моему, не это главное. Самосознание, сознание того, что в походе болеть нельзя: это плохо и для тебя и для твоих спутников. Вот в чем причина! И ни в коем случае не хандрить, если схватишь простуду.
— Так зачем же ты столь тщательно подбирал в Москве аптечку? — засмеялся Сергей. — Сказал бы прямо: не сметь заболевать, лекарств не будет…
— Почему же? — стала защищать Илью Наташа. — Лекарства — один из центральных пунктов теории Ильи. Тоже самосознание: если я вдруг захвораю, то на этот случай найдется кое-что в аптечке.
Все дружно расхохотались.
— Послушайте, мы опять отвлеклись, — пробасил Олег. — Вернемся к изотопам. Раз уж вспомнили о медицине…
— …то нужно рассказать, какую роль в ней играют радиоактивные изотопы! — закончила за него Наташа.
Илья состроил кислую мину:
— Увольте! У меня скоро отнимется язык!
— Хватит, Илья, ломаться! — отрезала Майка. — Сегодня кончается наше зимовье. Вдохновись тем, что завтра будем по ту сторону перевала.
Смерть против смерти
— Ладно, — Илья хрустнул пальцами. — Начну с детективной истории. Это произошло в одном заграничном городе. Случай сам по себе банальный: нашли труп человека, отравившегося мышьяком. Это был веселый, жизнерадостный мужчина, в расцвете сил. Мысль о самоубийстве у лиц, знавших его, отпала сама собой. Значит, умышленное отравление? Заподозрили соседа. Тот категорически отрицал предъявленное обвинение, говорил, что в день, когда обнаружили труп, не был дома, но свидетелей в свою защиту представить не мог. Судебно-медицинский эксперт считал, что отравление произошло накануне вечером. Дело запутывалось. — Но причем здесь радиоактивные изотопы? — спросил Алеша. — Постой, не перебивай! — возмутился Олег. — Нужно было определить, когда в организм попал мышьяк. Известно, что мышьяк откладывается в волосах. Известно также, что у здорового человека волосы растут со скоростью 0,5 миллиметра в сутки. Наконец, известно, что рост волос продолжается еще 2–2,5 суток после смерти. Следовательно, время попадания мышьяка в организм можно рассчитать по расстоянию места скопления мышьяка от корня волос. Но как определить это место? Ни химический, ни спектральный анализы не могли бы дать результатов более или менее точных. Тогда возникла оригинальная мысль. Волос облучили нейтронами: к счастью, была возможность — в городе действовал ядерный реактор. В результате стабильные изотопы мышьяка превратились в радиоактивные. Потом облученный волос перемещали вдоль узкого отверстия специально сконструированного счетного приспособления. Таким путем установили, в какой части волоса сконцентрирован мышьяк. Данные неопровержимо доказали, что мышьяк принят в середине дня, а не накануне вечером. Отравление, как выяснилось, было результатом нелепой случайности. Так радиоактивные изотопы мышьяка пришли на помощь судебной медицине. Они позволили раскрыть причину трагической гибели человека. А сумеют ли радиоактивные изотопы бороться со смертью, побеждать смерть, лечить болезни, которые, казалось бы, неизлечимы? Может ли радиоактивное излучение превратиться из врага человеческого организма в его друга? Как опасно для человека излучение, известно каждому. Вспомним трагедию Хиросимы и Нагасаки, искалечившую жизнь сотням тысяч людей; вспомним страшный пепел Бикини, принесший ужасные страдания японским рыбакам, случайно оказавшимся близ района испытаний водородной бомбы. Не так грозен термоядерный взрыв, как его последствия — радиоактивное заражение местности на громадных площадях. И затем — не разгаданная до конца лучевая болезнь, медленная, страшная гибель… — Вот наглядный пример, — сказал я. — Ученые подсчитали, что при взрыве водородной бомбы среднего калибра образуется очень большое количество нейтронов, которое способно превратить в радиоактивный углерод 14 сто килограммов атмосферного азота. Уже одного этого достаточно, чтобы наглядно показать вред ядерных испытаний. — А к каким предосторожностям приходится прибегать тем, кто работает с радиоактивными изотопами, сколько существует различных видов защиты, — продолжал Илья. — Человек выпустил на свободу столь могучую силу, справиться с которой не всегда просто. О том, что лучи радиоактивных веществ могут оказывать на организм человека как вредное, так и полезное действие, ученые знали еще в начале XX века. Несколько дней носил в жилетном кармане пакетик с солью урана Анри Беккерель, и на груди у него образовалась долго не заживавшая язва. Выступая перед Стокгольмской академией наук 6 июня 1905 года, Пьер Кюри говорил о том, что действие радия на раковые клетки дало положительные результаты. Медицинские журналы того времени неоднократно заявляли о благотворном влиянии новых лучей на некоторые злокачественные опухоли: их рост приостанавливался, а то и прекращался вовсе. А в построенном в Париже Институте радия была создана специальная лаборатория биологических исследований и радиотерапии. Так что же, радиоактивное излучение — враг или друг для организма человека? Все зависит от дозы, от количества излучения, поглощенного облучаемым объектом или частью его. Доза измеряется специальными величинами — рентгенами. Различают облучение кратковременное и долговременное. При кратковременном облучении безопасной для человеческого организма считается доза меньше 50 рентген. Абсолютно смертельная доза — 600 рентген. Значит, малые дозы облучения безвредны для человека. Если соблюдать необходимые предосторожности при использовании радиоактивных изотопов в медицине, то они могут творить чудеса. — Нужно разграничивать две вещи, — снова перебил я Илью. — Если радиоактивные изотопы вводятся внутрь человеческого организма, то они должны обладать очень малым периодом полураспада; наоборот, для целей облучения, например опухолей, применяются долгоживущие изотопы. — Один вопрос! — вмешался Олег. — А чем, собственно, опасно излучение для организма? Какой вред оно наносит? — Видишь ли, пока наука отвечает лишь приблизительно. Во-первых, излучение может привести к изменению структур молекул различных органических соединений, участвующих в жизнедеятельности организма. Во-вторых… Как известно, в организме человека очень много воды. Под действием излучения вода может превращаться в водород и перекись водорода — химически очень активные продукты. В итоге наступает тяжелое нарушение обмена веществ. — Ясно! — сказал Олег. — А какие же чудеса могут вершить изотопы в медицине? — Хотя бы лечение рака. Эта проблема уже давно остро волнует человечество. Исследования показали, что здоровые и пораженные ткани отличаются разной чувствительностью к облучению. Кроме того, радиоактивные изотопы особенно хорошо накапливаются и задерживаются в быстрорастущих тканях. Лечение раковых опухолей с помощью радиоактивных изотопов проводилось и раньше. Источниками излучения служили естественные радиоактивные элементы. В основном они были пригодны для облучения наружных опухолей. Иногда применяли так называемые радиевые иглы, которые зашивали на некоторое время во внутреннюю опухоль. Порой радиоактивное вмешательство помогало: больной выздоравливал. Но здесь был один весьма существенный минус. Ведь радий чрезвычайно дорог. Значит, нужно искать вещества более дешевые, но обладающие такой же активностью, как и радий. Таким изотопом является радиоактивный кобальт 60. В настоящее время его применяют наиболее широко. Однако этот изотоп-«прима» считается также одним из самых опасных для организма человека, поскольку обладает большим периодом полураспада (≈5,3 года) и очень жестким гамма-излучением. Обращаться с ним следует очень осторожно. С помощью кобальта 60 лечат злокачественные опухоли. При этом используют два метода: внутритканевый и облучение на расстоянии. Для облучения опухолей на расстоянии применяют специальную установку «ГУТ—Со-400», так называемую «кобальтовую пушку». Название расшифровывают так: «Гамма-установка терапевтическая», «Со-400» означает, что «пушка» заряжена таким количеством кобальта, действие которого эквивалентно 400 граммам радия. Бывают установки с меньшим радиевым эквивалентом (20, 40 граммов); они более удобны для массового употребления. Благодаря «кобальтовой пушке» появилась возможность лечения раковых опухолей, ранее обрекавших человека на смерть, — рака легкого, рака пищевода, саркомы костей. Внутритканевый метод гораздо проще. Он заключается в использовании кобальтовых игл, которые изготовляют из специальной кобальто-никелевой проволоки, облученной нейтронами. Кобальтовые иглы применяют главным образом для лечения наружных опухолей. В одном медицинском журнале описывается случай эффективного излечения рака губы. Вокруг опухоли и под нее ввели двадцать игл на 8 дней. Уже через 5 дней размеры опухоли стали уменьшаться, а через месяц она исчезла.
 В борьбе с раковыми опухолями применяются и другие радиоактивные изотопы. Так, в качестве радиоактивного заряда «пушки» употребляют цезий 137. Используются также изотопы иттрия, стронция и церия. Это продукты деления урана в ядерных реакторах, «осколочные» продукты. После соответствующей обработки «осколков» упомянутые изотопы осаждают на тончайших частицах стеклянной пыли. Пыль высушивают, расплавляют в электрической печи и из расплава приготовляют маленькие бусинки. Этими радиоактивными бусинками обкладывают наружную опухоль или зашивают их в пораженную раком ткань внутренних органов.
Наконец, применяются так называемые коллоидные растворы радиоактивных изотопов золота, фосфора и марганца. Опухоль пропитывается растворами, содержащими эти изотопы, и постепенно разрушается.
Радиотерапия рака — область весьма перспективная. В ней еще очень много неясного, но уже достигнутые успехи воодушевляют.
Самое главное — захватить опухоль в начале развития. Запущенные, разросшиеся опухоли мало поддаются лечению даже могущественными радиоизлучениями…
— Слушайте, приоткройте дверь! — воскликнула Майка. — Накурили — не продохнешь. Хотя бы радиоактивные изотопы помогли в борьбе с курением!
— И здесь все-таки главное — самосознание, — засмеялся Илья. — У меня его-то, например, и не хватает! А между прочим, радиоизотопы весьма отчетливо показали вред курения. Знаете как вырастили небольшое количество табачных листьев в атмосфере углекислого газа, содержащего углерод 14. Изотоп, естественно, усваивался листьями. Из них впоследствии сделали сигареты и дали их выкурить нескольким людям. Так удалось показать, в каких частях организма особенно сильно концентрируется никотин. Словом, для курильщиков результаты неутешительные!
В борьбе с раковыми опухолями применяются и другие радиоактивные изотопы. Так, в качестве радиоактивного заряда «пушки» употребляют цезий 137. Используются также изотопы иттрия, стронция и церия. Это продукты деления урана в ядерных реакторах, «осколочные» продукты. После соответствующей обработки «осколков» упомянутые изотопы осаждают на тончайших частицах стеклянной пыли. Пыль высушивают, расплавляют в электрической печи и из расплава приготовляют маленькие бусинки. Этими радиоактивными бусинками обкладывают наружную опухоль или зашивают их в пораженную раком ткань внутренних органов.
Наконец, применяются так называемые коллоидные растворы радиоактивных изотопов золота, фосфора и марганца. Опухоль пропитывается растворами, содержащими эти изотопы, и постепенно разрушается.
Радиотерапия рака — область весьма перспективная. В ней еще очень много неясного, но уже достигнутые успехи воодушевляют.
Самое главное — захватить опухоль в начале развития. Запущенные, разросшиеся опухоли мало поддаются лечению даже могущественными радиоизлучениями…
— Слушайте, приоткройте дверь! — воскликнула Майка. — Накурили — не продохнешь. Хотя бы радиоактивные изотопы помогли в борьбе с курением!
— И здесь все-таки главное — самосознание, — засмеялся Илья. — У меня его-то, например, и не хватает! А между прочим, радиоизотопы весьма отчетливо показали вред курения. Знаете как вырастили небольшое количество табачных листьев в атмосфере углекислого газа, содержащего углерод 14. Изотоп, естественно, усваивался листьями. Из них впоследствии сделали сигареты и дали их выкурить нескольким людям. Так удалось показать, в каких частях организма особенно сильно концентрируется никотин. Словом, для курильщиков результаты неутешительные!
 — Ты говорил о гамма-лучевой терапии, — перебил я Илью. — Однако есть другая интересная область — нейтронотерапия, когда облучение ведется потоком нейтронов. У нее свои преимущества: нейтроны меньше, чем гамма-лучи, поражают кожу, обладают большей проникающей способностью и сильнее воздействуют биологически.
Вот история, которая недавно привлекла внимание медиков.
В одной из зарубежных клиник умирала молодая женщина. Положение было безнадежным. Огромная опухоль мозга не поддавалась излечению. Нож искуснейшего хирурга, сокрушительный поток гамма-лучей — все оказалось бесполезным.
…Консилиум длился недолго. Врачам оставалось лишь расписаться в своем бессилии в борьбе со смертью. И вдруг один из них предложил:
— А если больной впрыснуть бор и облучить опухоль нейтронами? Ведь в нашем городе есть ядерный реактор.
— Что вы, коллега! — обрушились на него все. — Человека под интенсивный поток нейтронов. Это же верная гибель!
— Да, но терять нечего!
Терять нечего… Игла шприца вводит больной раствор соли бора. Один укол, второй, третий… Почему бора? Дело в том, что опыты на животных показали: бор особенно интенсивно оседает в тканях опухоли и сохраняется в них очень долго.
Блистающее чистотой здание ядерного реактора. Больную помещают в свинцовый ящик, чтобы обезвредить действие гамма-излучения. На место опухоли направляют интенсивный поток нейтронов. Они пронизывают клетки опухоли, сталкиваются с атомами бора. Ядерная реакция B(n, α)Li: бор превращается в литий, и образуются альфа-частицы. Необычная операция продолжается полчаса.
А через неделю лечащий врач пишет в истории болезни: «Состояние больной значительно улучшилось. Аппетит хороший. Больная улыбается. Снова начала разговаривать…»
Так смерть победила смерть.
— Есть еще один могущественный изотоп — радиоактивный фосфор, — опять перехватил инициативу Илья. — С его помощью удается успешно бороться с белокровием.
Белокровие — это опаснейшая болезнь. Злокачественная опухоль костного мозга вызывает катастрофическое размножение лейкоцитов — белых кровяных шариков. Применявшиеся до сих пор средства лечения были неэффективными.
Теперь больному вводят в кровь радиоактивный фосфор. Этот изотоп хорошо накапливается в костной ткани и, испуская бета-частицы, разрушает клетки опухоли. К сожалению, радиоактивный фосфор в большинстве случаев лишь приостанавливает процесс, а не ликвидирует его вовсе.
Но позволительно спросить: разве радиоактивные изотопы можно применять лишь для лечения, только тогда, когда характер заболевания или, например, расположение раковой опухоли установлены?
Конечно, нет. Радиоизотопы — отличные диагносты.
Ученые давно установили, что для нормального функционирования щитовидной железы необходим йод. Введенный в организм йод концентрируется именно в этой железе.
…В онкологический институт доставлен больной, у которого подозревается рак щитовидной железы. Как установить местоположение опухоли? Больному впрыскивают небольшую дозу радиоактивного йода 131, безопасную для здоровья. Изотоп оседает в опухоли железы. С помощью счетного устройства можно определить контуры опухоли.
— Ты говорил о гамма-лучевой терапии, — перебил я Илью. — Однако есть другая интересная область — нейтронотерапия, когда облучение ведется потоком нейтронов. У нее свои преимущества: нейтроны меньше, чем гамма-лучи, поражают кожу, обладают большей проникающей способностью и сильнее воздействуют биологически.
Вот история, которая недавно привлекла внимание медиков.
В одной из зарубежных клиник умирала молодая женщина. Положение было безнадежным. Огромная опухоль мозга не поддавалась излечению. Нож искуснейшего хирурга, сокрушительный поток гамма-лучей — все оказалось бесполезным.
…Консилиум длился недолго. Врачам оставалось лишь расписаться в своем бессилии в борьбе со смертью. И вдруг один из них предложил:
— А если больной впрыснуть бор и облучить опухоль нейтронами? Ведь в нашем городе есть ядерный реактор.
— Что вы, коллега! — обрушились на него все. — Человека под интенсивный поток нейтронов. Это же верная гибель!
— Да, но терять нечего!
Терять нечего… Игла шприца вводит больной раствор соли бора. Один укол, второй, третий… Почему бора? Дело в том, что опыты на животных показали: бор особенно интенсивно оседает в тканях опухоли и сохраняется в них очень долго.
Блистающее чистотой здание ядерного реактора. Больную помещают в свинцовый ящик, чтобы обезвредить действие гамма-излучения. На место опухоли направляют интенсивный поток нейтронов. Они пронизывают клетки опухоли, сталкиваются с атомами бора. Ядерная реакция B(n, α)Li: бор превращается в литий, и образуются альфа-частицы. Необычная операция продолжается полчаса.
А через неделю лечащий врач пишет в истории болезни: «Состояние больной значительно улучшилось. Аппетит хороший. Больная улыбается. Снова начала разговаривать…»
Так смерть победила смерть.
— Есть еще один могущественный изотоп — радиоактивный фосфор, — опять перехватил инициативу Илья. — С его помощью удается успешно бороться с белокровием.
Белокровие — это опаснейшая болезнь. Злокачественная опухоль костного мозга вызывает катастрофическое размножение лейкоцитов — белых кровяных шариков. Применявшиеся до сих пор средства лечения были неэффективными.
Теперь больному вводят в кровь радиоактивный фосфор. Этот изотоп хорошо накапливается в костной ткани и, испуская бета-частицы, разрушает клетки опухоли. К сожалению, радиоактивный фосфор в большинстве случаев лишь приостанавливает процесс, а не ликвидирует его вовсе.
Но позволительно спросить: разве радиоактивные изотопы можно применять лишь для лечения, только тогда, когда характер заболевания или, например, расположение раковой опухоли установлены?
Конечно, нет. Радиоизотопы — отличные диагносты.
Ученые давно установили, что для нормального функционирования щитовидной железы необходим йод. Введенный в организм йод концентрируется именно в этой железе.
…В онкологический институт доставлен больной, у которого подозревается рак щитовидной железы. Как установить местоположение опухоли? Больному впрыскивают небольшую дозу радиоактивного йода 131, безопасную для здоровья. Изотоп оседает в опухоли железы. С помощью счетного устройства можно определить контуры опухоли.
 Аналогичным образом определяются положение и размеры опухолей мозга. Для этого используются специальные красители, содержащие «метку» радиоактивного изотопа. Краситель накапливается в опухоли. Так можно определить ее положение, не прибегая к хирургическому вмешательству.
Такой радиоактивный изотоп, как натрий 24, позволяет исследовать скорость кругооборота крови. Для этого в вену вводится физиологический раствор, содержащий радиоизотоп. Подобные исследования весьма полезны для диагностики заболевания легких и сердечно-сосудистой системы.
Пожалуй, трудно отыскать человека, которому хотя бы раз не пришлось побывать в рентгеновском кабинете. И даже искушенного пациента, по специальности имеющего дело с приборами и машинами, всегда поражали сложность и громоздкость рентгеновской аппаратуры. Кроме того, обязателен источник тока. А если такового нет?
…На столе стоит небольшой ящик. На его передней стенке маленькое плексигласовое окошечко, на задней — выход толстой стальной трубки, от которой тянется приспособление, напоминающее спусковой тросик фотоаппарата.
С помощью этого ящика можно производить такие же снимки, как на рентгеновской установке. Но «просвечивающим элементом» здесь служат гамма-лучи, испускаемые радиоактивным изотопом редкоземельного элемента тулия. Препарат, содержащий этот изотоп, расположен внутри стальной трубки. Стоит нажать спусковой тросик, как препарат перемещается к плексигласовому окошечку. Можно производить снимок. И не нужно никакого источника тока.
Словом, гамма-дефектоскопия применительно к человеку!
Конечно, полученные таким путем «тулиевые» снимки не отличаются столь высоким качеством, как рентгеновские. Кроме того, необходимо большое время экспозиции.
Но ведь это начало. Применение тулиевых установок сулит много полезного для медицинской рентгенодиагностики, или, точнее, гамма-диагностики.
Ни тока высокого напряжения, ни высококвалифицированного персонала, ни специального помещения — ничего этого не требует маленький аппарат с радиоактивным тулием.
А весит он всего-навсего… три килограмма. Да и то в основном за счет защитного кожуха.
— Можно ли сказать, что со временем радиоактивные изотопы сумеют излечивать все болезни? — спросил Алеша. — Мне почему-то кажется, что сумеют.
— Опять ты в своем амплуа? — не отказал себе в удовольствии заметить Илья. — Между прочим, некоторые считали, что радиоактивные вещества — панацея от всех зол, пока не узнали, какой они могут принести вред. Некий аптекарь, чтобы излечиться от желудочного заболевания, проглотил ампулку с солью радия. Вскоре на его могиле плакала безутешная вдова! Видишь ли, Алеша, дело состоит в разумном сочетании самых разнообразных методов, в том числе и радиотерапии… Одна она, конечно, не сможет лечить все болезни!..
Майка посмотрела на часы:
— Уже семь. Будем ложиться спать?
— Похоже на то, — ответил Илья. — Тем более, что повестка дня в основном исчерпана.
— Нет, еще осталось кое-что! — заметил я. — Не думаю, что надолго займу ваше внимание. Вот представь себе, Наташа, такую картину: ты — завхоз туристской группы. Проблема еды в походе — сама знаешь! Кстати, потом объявишь, что у нас осталось из съестного… Допустим, через несколько лет мы снова пойдем в поход и вместо консервов ты будешь предлагать на ужин великолепные бифштексы, ростбифы, отбивные или свежую докторскую колбасу, которую так обожает Илья. Устраивает тебя такая перспектива?
— Ну, разумеется! Во всяком случае, не будете жаловаться на однообразие меню… Ты хочешь рассказать о каких-нибудь миниатюрных холодильниках?
— Нет, зачем. Я имею в виду радиационную стерилизацию продуктов питания. Чем вызвана их порча? Деятельностью вредных микробов, червей и насекомых. Излучение губит их. Сама же радиационная стерилизация осуществляется просто. Берут, например, бифштекс, помещают в герметическую упаковку и облучают гамма-лучами или потоком электронов. Организмы, вызывающие порчу и гниение, погибают. Это помогает значительно удлинить срок хранения продуктов.
— Однако есть здесь свое «но», — не удержался Илья. — Для стерилизации нужны большие дозы облучения, при действии которых из веществ продукта возникают новые химические соединения. Они могут придать ему неприятные вкус и запах. Как устранить эти явления, не снижая эффективности облучения над таким вопросом и работают сейчас ученые.
Аналогичным образом определяются положение и размеры опухолей мозга. Для этого используются специальные красители, содержащие «метку» радиоактивного изотопа. Краситель накапливается в опухоли. Так можно определить ее положение, не прибегая к хирургическому вмешательству.
Такой радиоактивный изотоп, как натрий 24, позволяет исследовать скорость кругооборота крови. Для этого в вену вводится физиологический раствор, содержащий радиоизотоп. Подобные исследования весьма полезны для диагностики заболевания легких и сердечно-сосудистой системы.
Пожалуй, трудно отыскать человека, которому хотя бы раз не пришлось побывать в рентгеновском кабинете. И даже искушенного пациента, по специальности имеющего дело с приборами и машинами, всегда поражали сложность и громоздкость рентгеновской аппаратуры. Кроме того, обязателен источник тока. А если такового нет?
…На столе стоит небольшой ящик. На его передней стенке маленькое плексигласовое окошечко, на задней — выход толстой стальной трубки, от которой тянется приспособление, напоминающее спусковой тросик фотоаппарата.
С помощью этого ящика можно производить такие же снимки, как на рентгеновской установке. Но «просвечивающим элементом» здесь служат гамма-лучи, испускаемые радиоактивным изотопом редкоземельного элемента тулия. Препарат, содержащий этот изотоп, расположен внутри стальной трубки. Стоит нажать спусковой тросик, как препарат перемещается к плексигласовому окошечку. Можно производить снимок. И не нужно никакого источника тока.
Словом, гамма-дефектоскопия применительно к человеку!
Конечно, полученные таким путем «тулиевые» снимки не отличаются столь высоким качеством, как рентгеновские. Кроме того, необходимо большое время экспозиции.
Но ведь это начало. Применение тулиевых установок сулит много полезного для медицинской рентгенодиагностики, или, точнее, гамма-диагностики.
Ни тока высокого напряжения, ни высококвалифицированного персонала, ни специального помещения — ничего этого не требует маленький аппарат с радиоактивным тулием.
А весит он всего-навсего… три килограмма. Да и то в основном за счет защитного кожуха.
— Можно ли сказать, что со временем радиоактивные изотопы сумеют излечивать все болезни? — спросил Алеша. — Мне почему-то кажется, что сумеют.
— Опять ты в своем амплуа? — не отказал себе в удовольствии заметить Илья. — Между прочим, некоторые считали, что радиоактивные вещества — панацея от всех зол, пока не узнали, какой они могут принести вред. Некий аптекарь, чтобы излечиться от желудочного заболевания, проглотил ампулку с солью радия. Вскоре на его могиле плакала безутешная вдова! Видишь ли, Алеша, дело состоит в разумном сочетании самых разнообразных методов, в том числе и радиотерапии… Одна она, конечно, не сможет лечить все болезни!..
Майка посмотрела на часы:
— Уже семь. Будем ложиться спать?
— Похоже на то, — ответил Илья. — Тем более, что повестка дня в основном исчерпана.
— Нет, еще осталось кое-что! — заметил я. — Не думаю, что надолго займу ваше внимание. Вот представь себе, Наташа, такую картину: ты — завхоз туристской группы. Проблема еды в походе — сама знаешь! Кстати, потом объявишь, что у нас осталось из съестного… Допустим, через несколько лет мы снова пойдем в поход и вместо консервов ты будешь предлагать на ужин великолепные бифштексы, ростбифы, отбивные или свежую докторскую колбасу, которую так обожает Илья. Устраивает тебя такая перспектива?
— Ну, разумеется! Во всяком случае, не будете жаловаться на однообразие меню… Ты хочешь рассказать о каких-нибудь миниатюрных холодильниках?
— Нет, зачем. Я имею в виду радиационную стерилизацию продуктов питания. Чем вызвана их порча? Деятельностью вредных микробов, червей и насекомых. Излучение губит их. Сама же радиационная стерилизация осуществляется просто. Берут, например, бифштекс, помещают в герметическую упаковку и облучают гамма-лучами или потоком электронов. Организмы, вызывающие порчу и гниение, погибают. Это помогает значительно удлинить срок хранения продуктов.
— Однако есть здесь свое «но», — не удержался Илья. — Для стерилизации нужны большие дозы облучения, при действии которых из веществ продукта возникают новые химические соединения. Они могут придать ему неприятные вкус и запах. Как устранить эти явления, не снижая эффективности облучения над таким вопросом и работают сейчас ученые.
Радиоизотопы в сельском хозяйстве
— Дай уж мне закончить! — я посмотрел на своего напарника с укоризной. — Последняя лекция. Применение радиоизотопов в сельском хозяйстве. Здесь нужно различать два направления: радиоизотопы как меченые атомы для различных исследований и влияние излучений на рост и развитие растений. Известно, какую громадную роль в повышении урожайности самых разнообразных сельскохозяйственных культур играют удобрения. Однако изучить механизм действия удобрений, выяснить влияние отдельных химических элементов на рост и развитие растений — нелегкая задача. Удобрения содержат столь необходимые для жизни растений элементы, как фосфор, азот, калий и другие. Если ввести в удобрение незначительное количество какого-нибудь радиоактивного изотопа, например радиофосфора, то мы получим простой способ проследить, как усваивается фосфор растением. И сможем расшифровать, наконец, механизм перехода фосфора из удобрения в растение. Для этого стоит лишь высушить растение и внимательно исследовать его с помощью счетчиков заряженных частиц. Взяв растения на разных стадиях развития и исследовав на содержание радиофосфора различные их части, можно прийти к интересным выводам. Прежде всего, зная общее содержание фосфора в растении и его активность, можно найти количество фосфора, усвоенное из удобрения. Установили интересный факт: раньше чем растение начинает усваивать фосфор, он подвергается в почве многочисленным превращениям. Следовательно, растение получает фосфор не прямо из удобрения, а после ряда превращений из почвы. Радиоактивный фосфор помог узнать, что зерновые культуры потребляют фосфор в основном на ранних стадиях развития. Прослеживая дальше распределение фосфора в растениях, ученые выяснили, что элемент в значительных количествах накапливается в дозревающих зернах злаков. Ранее иногда казалось удивительным, почему при возделывании различных культур фосфорные удобрения не только не оказывают благотворного действия, но в иных случаях даже снижают урожайность. Радиоактивные изотопы помогли найти объяснение. Многие растения отличаются избирательностью по отношению к фосфорным удобрениям. Это значит, что усвоение фосфора у них зависит от вида фосфорного соединения. Иными словами, такие растения способны усваивать фосфор только из определенных удобрений. — Дополняю! — опять не дал мне договорить Илья. — С помощью меченых атомов удалось установить, как лучше внести удобрение. Например, суперфосфат — важнейшее фосфорное удобрение — усваивается лучше в виде маленьких гранул, чем больших, — так открыли возможность значительной экономии ценного удобрения. — С помощью изотопов можно исследовать использование растениями азотных удобрений, — мне уже надоело одергивать Илью. — Правда, радиоактивные изотопы азота для этого непригодны, так как они имеют очень небольшие периоды полураспада, неудобные для проведения экспериментов. Выручает стабильный изотоп азот 15. Он позволил ответить на два практически важных вопроса. За счет чего растение удовлетворяет потребность в азоте? Откуда берет его в большем количестве: из удобрения или из воздуха, или же использует азот почвы? Азот 15 помогает установить, что у бобовых растений поглощение азота воздуха уменьшается с увеличением количества азотного удобрения. А когда выгоднее вносить в почву азотные удобрения? Изотоп азот 15 отвечает: под овес нужно вносить возможно раньше, так как при этом азот усваивается с наибольшей полнотой. Как показали исследования последних десятилетий, для правильного развития растений нужны не только фосфор, азот и калий — основные элементы питания. Не менее важную, а в отдельных случаях просто необходимую роль играют микроэлементы. Что мы называем микроэлементами? Это элементы, которые поступают в организм в весьма малых, едва уловимых количествах. К ним относятся многие химические элементы. Пока трудно говорить, какие из них являются важнейшими, ведь широкое изучение действия микроэлементов только начинается. Кроме того, растения отличаются определенной избирательностью по отношению к тем или иным микроэлементам. Можно назвать только наиболее изученные. Это медь, цинк, марганец, молибден, кобальт, бор. Они содержатся в почве в очень малых количествах — до сотых и тысячных долей процента. Но если их нет, заболевает растение. С другой стороны, добавка в почву небольших количеств микроэлементов может значительно повысить урожай. Бор резко поднимает урожайность клевера и различных овощных культур. Зерновые культуры дают на торфяных почвах прекрасный урожай, если в почву введено немного меди. Марганец оказывает влияние на рост клубней сахарной свеклы. Молибден и кобальт способствуют лучшему произрастанию кормовых культур и трав. Это качественная сторона влияния микроэлементов. Она более или менее проясняется. Иное дело знание механизма влияния микроэлементов. Здесь пока много непонятного. Изучение же с помощью обычного химического анализа наталкивается на большие трудности хотя бы потому, что микроэлемент попадает в растения в ничтожных количествах. Вот тут-то и могут сказать свое слово радиоактивные изотопы. Так, кобальт 60 позволил изучить механизм поступления кобальта в кормовые травы. Марганец 54 рассказал о своей роли в урожайности и устойчивости злаков и позволил разработать практические рекомендации.
 У растений, и особенно культурных, много врагов. Это не только резкие колебания температуры, заморозки и засухи, болезни и сорняки. Громадный урон урожаю нередко наносят всевозможные вредители и прежде всего насекомые. Подсчитано, что потери от вредителей на земле очень велики. Если эти потери ликвидировать, дополнительно можно прокормить 200 миллионов человек.
С вредителями ведут успешную борьбу, применяя различные яды и химические препараты. Однако чтобы достичь полного успеха, весьма важно знать образ жизни насекомых.
Эта на первый взгляд очень трудная задача может оказаться довольно простой.
Насекомых нужно «пометить».
«Радиоактивные» насекомые не сумеют скрыть своего присутствия.
Используя обычные счетчики заряженных частиц, можно, например, точно определить скорость распространения вредных насекомых.
В одном из подмосковных колхозов провели опыт с зерновой совкой — опасным вредителем хлебов. Выяснилось, что бабочки этого насекомого способны перемещаться на расстояние до 5 километров в сутки.
У растений, и особенно культурных, много врагов. Это не только резкие колебания температуры, заморозки и засухи, болезни и сорняки. Громадный урон урожаю нередко наносят всевозможные вредители и прежде всего насекомые. Подсчитано, что потери от вредителей на земле очень велики. Если эти потери ликвидировать, дополнительно можно прокормить 200 миллионов человек.
С вредителями ведут успешную борьбу, применяя различные яды и химические препараты. Однако чтобы достичь полного успеха, весьма важно знать образ жизни насекомых.
Эта на первый взгляд очень трудная задача может оказаться довольно простой.
Насекомых нужно «пометить».
«Радиоактивные» насекомые не сумеют скрыть своего присутствия.
Используя обычные счетчики заряженных частиц, можно, например, точно определить скорость распространения вредных насекомых.
В одном из подмосковных колхозов провели опыт с зерновой совкой — опасным вредителем хлебов. Выяснилось, что бабочки этого насекомого способны перемещаться на расстояние до 5 километров в сутки.
 Между прочим, методом «меченых» насекомых можно изучать распространение мух, переносчиков инфекции, и комаров. Полученные результаты помогают лучше бороться с паразитами.
— Что касается борьбы с сорняками химическими методами, то и в этой области радиоизотопы привели к интереснейшим результатам, — снова перебил меня Илья. — Оказалось, что широколистные растения-сорняки поглощают разбрызганные ядохимикаты полностью за два часа. В то же время трава и узколистные растения поглощают небольшую их часть. Это позволяет селективно использовать химические яды для борьбы с сорняками.
— Наконец, применение радиоактивных изотопов получило широкое распространение и в животноводстве, — сказал я. — Продуктивность сельскохозяйственных животных непосредственно зависит от качества и количества пищи и того, как она усваивается. Иными словами, от интенсивности обмена веществ в организме.
Как известно, корма состоят из белков, жиров, углеводов и минеральных солей.
Если составные элементы пищи «пометить» радиоактивными изотопами, можно проследить за скоростью их всасывания из пищеварительного тракта, за путями превращения в организме.
В качестве «меток» используются различные изотопы. Так, «меченые» белки получают из растений, выращенных на азотистых удобрениях, содержащих азот 15. Углеводы извлекают из растений, у которых фотосинтез проходил в атмосфере, содержащей углерод 14.
Минеральные соли «метят» радиоизотопами кальция, железа, фосфора, серы и других элементов.
Наконец, можно получить также «меченые» витамины, которые в ничтожных количествах содержатся в пище, и изучить механизм их действия.
Исследования с радиоактивными изотопами позволяют дать ответ на многие вопросы, связанные с обменом веществ в организме животного. А это, в свою очередь, способствует разработке практических мер для значительного увеличения продуктивности животноводства.
Радиоизотопы помогают также выяснить роль микроэлементов для жизнедеятельности животных, бороться с различными заболеваниями.
— Ученые нашли, — вмешался опять Илья, — что облучение семян перед посевом гамма-лучами действует весьма благотворно.
Оказалось, что такие семена приобретают повышенную всхожесть. Внезапные заморозки становятся не столь опасными для молодых зеленых проростков. И, наконец, налицо определенное повышение урожайности.
Или другой пример. Как влияет облучение семян перед посевом на урожайность? Провели опыты с семенами редиса и моркови, подействовав на них малыми дозами гамма-лучей.
Прорастание семян значительно ускорилось, урожайность редиса выросла на 11 процентов, а содержание каротина в моркови возросло на 25 процентов!
…Печка гудела вовсю. Алеша задул свечу. Стало тихо.
И, засыпая, я слышал шепот Майки:
— Все-таки очень здорово, что ребята рассказывали о радиоактивных изотопах. Я узнала так много интересного. Может, и прав Илья: гуманитарий должен хоть немного разбираться в точных науках…
Эти слова адресовались Алеше, но мне было очень радостно услышать их. Эх, взять бы еще завтра Аламинский перевал!
…Погода в горах изменчива. Она нередко разрушает планы и надежды. К сожалению, это случилось и с нами. Утром снова откуда-то набежали тучи, и хотя снег не падал, но белая пелена закутала перевал.
Приходилось возвращаться назад. Перед выходом еще раз взглянули мы на неказистую избушку, столько дней служившую нам уютным домом.
— Жаль! — с грустью произнес Илья. — Прогорело наше путешествие. Так ничего и не достигли. Не узнали ничего нового. Лучше бы уж выбрали другой маршрут.
— А я так не думаю, — ответил ему звонкий голос Наташи. — И нисколько не раскаиваюсь. Ведь мы же совершили путешествие…
— Какое это путешествие! — уныло буркнул Илья. — Пять дней до избушки, да пять дней отсиживания… Не смеши!
— Как ты не понимаешь! Я говорю о другом путешествии. Мы прошли большой маршрут, не выходя из этой избушки. Настоящее путешествие в страну радиоактивных изотопов!
— А если сокращенно — в страну РАИ! — Олег рывком вскинул рюкзак.
— Страна РАИ… — задумчиво повторил он. — Пусть…
Илья улыбнулся: он не умел долго хандрить.
— В таком случае я хочу надеяться, что мы с Толей оказались сносными проводниками… Как ты думаешь, начальник?
Между прочим, методом «меченых» насекомых можно изучать распространение мух, переносчиков инфекции, и комаров. Полученные результаты помогают лучше бороться с паразитами.
— Что касается борьбы с сорняками химическими методами, то и в этой области радиоизотопы привели к интереснейшим результатам, — снова перебил меня Илья. — Оказалось, что широколистные растения-сорняки поглощают разбрызганные ядохимикаты полностью за два часа. В то же время трава и узколистные растения поглощают небольшую их часть. Это позволяет селективно использовать химические яды для борьбы с сорняками.
— Наконец, применение радиоактивных изотопов получило широкое распространение и в животноводстве, — сказал я. — Продуктивность сельскохозяйственных животных непосредственно зависит от качества и количества пищи и того, как она усваивается. Иными словами, от интенсивности обмена веществ в организме.
Как известно, корма состоят из белков, жиров, углеводов и минеральных солей.
Если составные элементы пищи «пометить» радиоактивными изотопами, можно проследить за скоростью их всасывания из пищеварительного тракта, за путями превращения в организме.
В качестве «меток» используются различные изотопы. Так, «меченые» белки получают из растений, выращенных на азотистых удобрениях, содержащих азот 15. Углеводы извлекают из растений, у которых фотосинтез проходил в атмосфере, содержащей углерод 14.
Минеральные соли «метят» радиоизотопами кальция, железа, фосфора, серы и других элементов.
Наконец, можно получить также «меченые» витамины, которые в ничтожных количествах содержатся в пище, и изучить механизм их действия.
Исследования с радиоактивными изотопами позволяют дать ответ на многие вопросы, связанные с обменом веществ в организме животного. А это, в свою очередь, способствует разработке практических мер для значительного увеличения продуктивности животноводства.
Радиоизотопы помогают также выяснить роль микроэлементов для жизнедеятельности животных, бороться с различными заболеваниями.
— Ученые нашли, — вмешался опять Илья, — что облучение семян перед посевом гамма-лучами действует весьма благотворно.
Оказалось, что такие семена приобретают повышенную всхожесть. Внезапные заморозки становятся не столь опасными для молодых зеленых проростков. И, наконец, налицо определенное повышение урожайности.
Или другой пример. Как влияет облучение семян перед посевом на урожайность? Провели опыты с семенами редиса и моркови, подействовав на них малыми дозами гамма-лучей.
Прорастание семян значительно ускорилось, урожайность редиса выросла на 11 процентов, а содержание каротина в моркови возросло на 25 процентов!
…Печка гудела вовсю. Алеша задул свечу. Стало тихо.
И, засыпая, я слышал шепот Майки:
— Все-таки очень здорово, что ребята рассказывали о радиоактивных изотопах. Я узнала так много интересного. Может, и прав Илья: гуманитарий должен хоть немного разбираться в точных науках…
Эти слова адресовались Алеше, но мне было очень радостно услышать их. Эх, взять бы еще завтра Аламинский перевал!
…Погода в горах изменчива. Она нередко разрушает планы и надежды. К сожалению, это случилось и с нами. Утром снова откуда-то набежали тучи, и хотя снег не падал, но белая пелена закутала перевал.
Приходилось возвращаться назад. Перед выходом еще раз взглянули мы на неказистую избушку, столько дней служившую нам уютным домом.
— Жаль! — с грустью произнес Илья. — Прогорело наше путешествие. Так ничего и не достигли. Не узнали ничего нового. Лучше бы уж выбрали другой маршрут.
— А я так не думаю, — ответил ему звонкий голос Наташи. — И нисколько не раскаиваюсь. Ведь мы же совершили путешествие…
— Какое это путешествие! — уныло буркнул Илья. — Пять дней до избушки, да пять дней отсиживания… Не смеши!
— Как ты не понимаешь! Я говорю о другом путешествии. Мы прошли большой маршрут, не выходя из этой избушки. Настоящее путешествие в страну радиоактивных изотопов!
— А если сокращенно — в страну РАИ! — Олег рывком вскинул рюкзак.
— Страна РАИ… — задумчиво повторил он. — Пусть…
Илья улыбнулся: он не умел долго хандрить.
— В таком случае я хочу надеяться, что мы с Толей оказались сносными проводниками… Как ты думаешь, начальник?
Содержание
Маршрут первый … 3 Маршрут второй … 23 Маршрут третий … 62

Последние комментарии
4 часов 41 минут назад
4 часов 42 минут назад
10 часов 1 минута назад
13 часов 43 минут назад
14 часов 3 минут назад
14 часов 58 минут назад